Profylactisch antibiotica bij preterm pre-labour rupture of membranes (PPROM)
Uitgangsvraag
Welke plaats heeft direct geven van profylactisch antibiotica bij preterm prelabour rupture of membranes (zonder klinische tekenen van infectie) vergeleken met behandeling met antibiotica bij tekenen van infectie?
Clinical question
What is the effect of giving prophylactic antibiotics immediately after preterm prelabour rupture of membranes (PPROM) (without clinical signs of an infection) compared to treatment with antibiotics in case of symptoms of infection?
Aanbeveling
Overweeg profylactisch antibiotica bij prematuur gebroken vliezen < 37 weken, aangezien er enig positief effect lijkt te zijn op enkele perinatale uitkomsten (met name lager risico op perinatale infectie en echoscopisch cerebrale afwijkingen), maar waarbij het voordeel op de lange termijn onzeker is.
Counsel de zwangere over de mogelijke voor- en nadelen voor moeder en neonaat op korte en lange termijn bij toediening van antibiotica.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het effect van antibiotica op neonatale morbiditeit is onduidelijk. Bilaterale PVL, IVH graad III/IV en neonatale insulten zijn niet onderzocht. Neonatale encefalopathie kwam onder beide groepen met in totaal 60 neonaten niet voor. Perinatale mortaliteit wordt waarschijnlijk niet gereduceerd door antibioticagebruik onder moeders met PPROM. Het bewijs is van redelijke kwaliteit. Cerebrale parese leek onder de ORACLE-1 trial met 3298 kinderen niet vaker voor te komen bij twee soorten antibiotica (Kenyon 2008 I). De ORACLE-2 trial onder 3196 kinderen liet wel een verhoogd risico zien bij het gebruik van antibiotica op cerebrale parese bij vrouwen met een spontane vroeggeboorte (Kenyon 2008 II). De studiepopulatie kwam echter niet overeen met de populatie waarin de werkgroep geïnteresseerd was en het bewijs is van (zeer) lage kwaliteit.
Andere belangrijke uitkomsten lieten zien dat antibiotica waarschijnlijk wel het aantal perinatale infecties kan verlagen (RR 0.67 (95% CI 0.52 tot 0.85). Dit kan zeker een voordeel zijn voor zowel moeder als kind op de korte termijn. Hierdoor kan de opnameduur wellicht korter zijn indien het kind niet (vroeg) prematuur geboren wordt. Bij een premature geboorte zal vermoedelijk toch standaard antibiotica worden gegeven aan het kind (preventief).
Daarnaast blijkt het risico op echoscopisch cerebrale afwijkingen lager te zijn na profylactische toediening van antibiotica. Het is echter onzeker of deze uitkomst ook invloed heeft op de lange termijn ontwikkeling, maar op de korte termijn lijkt dit toediening van antibiotica wel een duidelijk voordeel te geven.
Ook kan antibiotica de geboorte vanaf het moment van PPROM diagnose verlengen, waardoor minder baby’s binnen 48 uur en binnen 7 dagen na PPROM werden geboren. Het bewijs is voor beide uitkomsten van redelijke kwaliteit. Het aantal geboortes onder 37 weken werd echter niet gereduceerd. De verlenging van de termijn tussen breken van de vliezen en geboorte lijkt echter niet klinisch relevant, omdat dit alleen belangrijk zou zijn als dit ook zou leiden tot een reductie van neonatale mortaliteit of neonatale morbiditeit. Hoogstens is een verlenging van 48 uur zinvol om in die tijd de corticosteroïden voor de foetale longrijping in te kunnen laten werken.
Hoewel er geen statistisch significante afname lijkt te zijn van BPD, lijkt de noodzaak tot toediening van zuurstof en surfactant wel lager te zijn in de groep waarbij de moeders werden behandeld met profylactische antibiotica (respectievelijk RR 0.88 (0.81,0.96) en RR 0.83(0.72,0.96)).
Ook lijkt antibiotica het risico op chorioamnionitis te verlagen, maar dit bewijs is van lage kwaliteit.
Naast perinatale mortaliteit resulteert antibioticagebruik waarschijnlijk niet in een reductie van NICU opnames en minder keizersneden. Het bewijs is van redelijke kwaliteit. De Apgar score, allergie, anafylaxie, sepsis, endometritis, en post partum bloedverlies zijn niet onderzocht. Maternale mortaliteit gerapporteerd in drie studies met 763 deelnemers niet voor.
Het positieve effect van antibiotica op het verlengen van de zwangerschapsduur lijkt niet relevant, aangezien dit alleen belangrijk zou zijn als de neonatale uitkomst er ook beter door zou worden. Dit lijkt niet het geval. Hoogstens is de verlenging van de zwangerschapsduur met 48 uur nog zinvol bij een zwangerschapsduur < 34 weken, om de corticosteroïden voor de foetale longrijping in te laten werken. Mogelijk is er om deze reden een trend te zien naar iets minder frequent voorkomen van BPD bij de neonaat bij antibiotica toediening.
Het zou nog mogelijk kunnen zijn dat het effect van de antibiotica groter (en gunstiger) is in een subgroep met lagere zwangerschapsduur ten tijde van het breken van de vliezen (zoals PPROM < 32 tot 34 weken), waarin het risico op neonatale morbiditeit (zoals BPD, infectie, et cetera) groter is. Deze subgroep is echter niet onderzocht in de Oracle studie, derhalve kan er geen uitspraak gedaan worden over een mogelijk effect in deze groep.
Wel is er nog onduidelijkheid over eventuele lange termijn effecten van antibiotica toediening op het kind (zoals bijvoorbeeld een effect op het microbioom).
Daarbij is er ook nog het (algemene) probleem van het ontwikkelen van resistentie van bacteriën tegen antibiotica. Dit kan zeker een negatief effect zijn van standaard (profylactisch) toediening van antibiotica in geval van PPROM.
Een grote studie naar de lange termijn effecten (op 7-jarige leeftijd) van profylactische toediening van antibiotica bij PPROM (Kenyon, 2008 II) liet geen voordeel zien van de antibiotica.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Als het toedienen van antibiotica een bewezen gunstig effect heeft op de neonaat met betere uitkomsten, dan zal een overgrote meerderheid van de zwangere vrouwen wel positief tegenover de medicatie staan en deze accepteren. Zwangere vrouwen zullen uiteraard ook graag willen weten of er negatieve effecten te verwachten zijn. En zolang dit niet uit te sluiten is, zal er ook enige terughoudendheid zijn (uiteraard vooral afhankelijk van het positieve effect van de medicatie).
Het is te verwachten dat zowel de interventie (preventieve toediening van antibiotica aan de zwangere) als het niet toepassen van de interventie geen effect zullen hebben op de moeder-kind binding en op de kans van slagen van de borstvoeding.
Kosten (middelenbeslag)
Als er positieve effecten zouden zijn op de neonatale gezondheid, vooral op NICU opname (aantal opnames en duur van opname) dan zou het toedienen van profylactische antibiotica kosteneffectief kunnen zijn. De medicatie op zich is niet duur (44 euro voor een 10-daagse kuur erytromycine). Echter gezien het beperkte effect van deze medicatie, is het meest waarschijnlijk dat deze therapie niet kosteneffectief zal zijn.
Aanvaardbaarheid, haalbaarheid en implementatie
Het is wenselijk om zowel de aanbeveling, als ook de resultaten en conclusies van de studie(s), te bespreken binnen de vakgroepen om op basis hiervan een lokale afspraak te maken hoe om te gaan met het beleid bij prematuur gebroken vliezen. In elk geval is het wenselijk om een protocol te hebben over deze situatie (PPROM) en hierin vast te leggen wat de lokale afspraken zijn wat betreft diagnostiek en beleid.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Het voordeel van profylactische toediening van antibiotica lijkt gering te zijn. Op de meest belangrijke neonatale uitkomsten (zoals mortaliteit en ernstige morbiditeit) wordt geen positief effect gezien. Er zijn desondanks wel enkele uitkomstmaten die positief lijken te worden beïnvloed door toediening van antibiotica. Dit zijn met name de kans op perinatale infectie en echoscopische afwijkingen van het cerebrum.
Op de lange termijn lijkt er geen voordeel te zijn van profylactische antibiotica toediening.
Het counselen van de zwangere vrouw over de potentiële voordelen op de korte termijn en eventuele nadelen van de antibiotica (met name de onzekerheid over dat nadelen op de lange termijn niet kunnen worden uitgesloten en resistentie ontwikkeling) en om de voorkeur van de zwangere vrouw mee te nemen in de besluitvorming, blijft dan ook in dit geval relevant.
Onderstaande tabel kan ondersteunen bij de counseling over antibiotica profylaxe bij PPROM:
|
Voordelen |
Nadelen |
|
Er lijkt iets minder risico te zijn op afwijkende bevinden bij echoscopie van de hersenen van de baby (19% minder kans) bij toediening van antibiotica |
Er wordt geen gunstig effect gezien op enkele belangrijke uitkomsten zoals overlijden van de baby of ernstige ziekte (zoals longschade)
|
|
Tevens lijkt er iets minder risico te zijn op een infectie bij de baby (33% minder kans) bij toediening van antibiotica |
Bij toediening van antibiotica is er een kans op resistentie (dit betekent dat bacteriën in de toekomst minder gevoelig kunnen zijn voor deze antibiotica) |
|
|
Er is een zeer klein risico op een allergische reactie bij de zwangere (niet duidelijk hoe groot dit risico is, maar wordt niet vaak gemeld) |
|
|
Er kunnen bijwerkingen zijn van de antibiotica |
|
|
Mogelijk kunnen antibiotica de darmflora (de goede bacteriën in de darm) bij het kindje nadelig beïnvloeden. Het is op dit moment niet duidelijk of dit gevolgen voor de gezondheid in het latere leven kan hebben |
Onderbouwing
Achtergrond
Het is algemeen bekend dat PPROM een groot risico geeft op perinatale complicaties. In het geval van intra-uteriene en/of neonatale infectie (bij (subklinische) chorioamnionitis) neemt het risico op nadelige maternale en perinatale uitkomsten verder toe. Het is daarom van groot belang om een strategie te zoeken die deze risico’s reduceert.
Het beleid in Nederland wisselt; lokaal (per ziekenhuis) is afgesproken of er wel of niet standaard antibiotica worden toegediend bij PPROM. Er is onduidelijkheid over het gunstige effect, als ook over eventuele nadelige bijeffecten. Mogelijk zijn deze effecten ook nog afhankelijk van de zwangerschapsduur ten tijde van PPROM. De NVOG richtlijn Dreigende vroeggeboorte uit 2012 ziet geen rol voor profylactische toediening van antibiotica bij PPROM.
In de NICE guideline (2015) wordt geadviseerd om zwangeren met PPROM wel profylactisch te behandelen met antibiotica (erytromycine)(NICE, 2015).
Conclusies / Summary of Findings
Critical outcome measures
Neonatal outcomes
(1) Neonatal morbidity
|
No GRADE / Very low GRADE |
The effect of antibiotic prophylaxis versus placebo in women with PPROM on neonatal morbidity is unclear.
Bilateral PVL, IVH gr III/IV and neonatal insult were not reported. The effect of antibiotic prophylaxis on neonatal encephalopathy is unclear, because no events occurred in one trial among 60 babies.
Sources: (Kenyon, 2013) |
(1.a) Major cerebral abnormality on ultrasound before discharge
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a slight reduction of major cerebral abnormality on ultrasound before discharge compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(2) Perinatal mortality
|
High GRADE |
Antibiotic prophylaxis for women with PPROM does not reduce or increase perinatal mortality compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(3) Long term effects on the child
(3.1) Cerebral Palsy, as reported by parents of children at age 7 years
|
Low GRADE |
Antibiotic prophylaxis for women with PPROM may not reduce or increase cerebral palsy compared to placebo or no prophylaxis.
Sources: (Kenyon, 2008) |
(3) BPD
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a slight reduction of BPD compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
Important outcome measures
Neonatal outcomes
(4) Perinatal infections
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a decrease of the rate of neonatal infections compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(5) Apgar score < 7 after 5 minutes
|
- GRADE |
Apgar score < 7 after 5 minutes was not reported.
Sources: (Kenyon, 2013) |
(6) Neonatal Intensive Care Unit admission
|
Moderate GRADE |
Antibiotic prophylaxis in women with PPROM probably does not reduce NICU admission compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(7) Prolonged latency/pregnancy duration until birth
(7.1) Birth within 48 hours of randomisation
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a reduction of babies born within 48 hours of randomization compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(7.2) Birth within 7 days of randomisation
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a reduction of babies born within 7 days of randomization compared to placebo or no prophylaxis.
Source: (Kenyon, 2013) |
(7.3) Birth before 37 weeks of gestation
|
High GRADE |
Antibiotic prophylaxis for women with PPROM does not result in a reduction of babies born < 37 weeks of gestation compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
Maternal outcomes
(8, 9, 10) Allergy, anaphylaxis and sepsis
|
- GRADE |
Maternal allergy, anaphylaxis and sepsis were not reported.
Sources: (Kenyon, 2013) |
(11) Chorioamnionitis
|
Low GRADE |
The evidence suggests that antibiotic prophylaxis given to women with PPROM reduces the number of women diagnosed with infection of the womb compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(12) Endometritis
|
- GRADE |
Endometritis was not reported.
Sources: (Kenyon, 2013) |
(13) Delivery mode
|
High GRADE |
Antibiotic prophylaxis given to women with PPROM does not reduce or increase the number of women that deliver with a caesarean section compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(14) Maternal death
|
Very low GRADE |
The evidence is very uncertain about the effect of antibiotic prophylaxis for women with PPROM on maternal mortality compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(15) Postpartum haemorrhage
|
- GRADE |
Postpartum haemorrhage was not reported.
Sources: (Kenyon, 2013) |
Samenvatting literatuur
Description of study
The SR by Kenyon (2013) investigated the effect of immediate and long-term effects of administering antibiotics to women with PPROM < 37 weeks. The review included 14 RCTs comparing antibiotics with placebo, and 6 non-placebo controlled RCTs, which contributed data to the outcome perinatal death alone. In two included RCTs a comparison was made between various lengths of antibiotics prophylaxis. This summary is limited to the 20 trials comparing antibiotics with placebo or no treatment, in which 6740 women and their babies were included. Women were recruited between 20 and 37 weeks of gestation. Ten trials tested broad spectrum antibiotics, five tested macrolide antibiotics (erythromycin) and one tested clindamycin and gentamicin. The duration of treatment varied between two doses and 10 days, or until delivery. Both intravenous and oral antibiotics or a combination was prescribed. The primary outcomes were maternal death, serious maternal morbidity (composite of septicemia, need for intensive care, organ failure, need for hysterectomy), perinatal death and perinatal morbidity (defined as neonatal infection including pneumonia, enterocolitis, oxygen treatment until more than 36 weeks post conceptual age and major cerebral abnormality on ultrasound prior to discharge).
Results
Critical outcome measures
N.B. For the Critical outcome measures information was also extracted from the original RCTs.
(1) neonatal morbidity
Defined by the working group as a composite of (1.1) bilateral periventricular leukomalacia (PVL), (1.2) intraventricular haemorrhage (IVH) gr III/IV, (1.3) neonatal insult, (1.4) neonatal encephalopathy. None of the included studies reported this composite outcome. However, the outcome (1.a) Major cerebral abnormality on ultrasound before discharge was reported in 12 included RCTs. The pooled RR (95% CI) was 0.81 (0.68; 0.98) (Figure 1.1 12 trials, 6289 babies).
Figure 1.1 Outcome (1.a) Major cerebral abnormality on ultrasound before discharge; comparison any antibiotic versus placebo
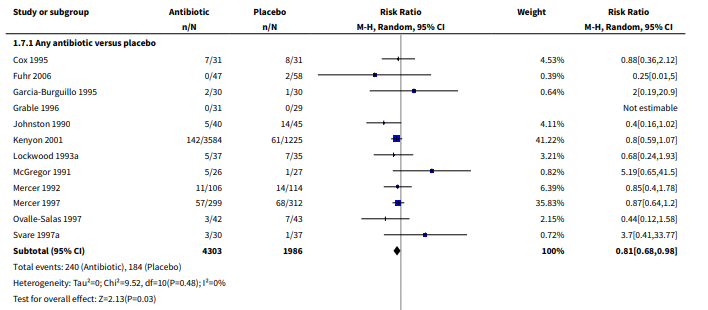
Source: Kenyon (2013): Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(1.1) bilateral PVL
This outcome was not reported.
(1.2) IVH gr III/IV
This outcome was not reported.
(1.3) Neonatal insult
This outcome was not reported.
(1.4) Neonatal encephalopathy
This outcome was only reported by Garcia-Burguillo (1995) reporting 0/30 events in de antibiotic group and 0/30 in the placebo group. The risk ratio could therefore not be estimated.
(2) Perinatal mortality
Perinatal death or death before discharge was reported in 12 individual trials with data for 6301 babies. Perinatal death was comparable between the antibiotics (any type and dose) and placebo arms (Figure 1.2, 12 trials, 6301 babies, RR 0.93, 95% CI 0.76 to 1.14).
Figure 1.2 Outcome (2) Perinatal mortality: antibiotics versus placebo in women after PPROM
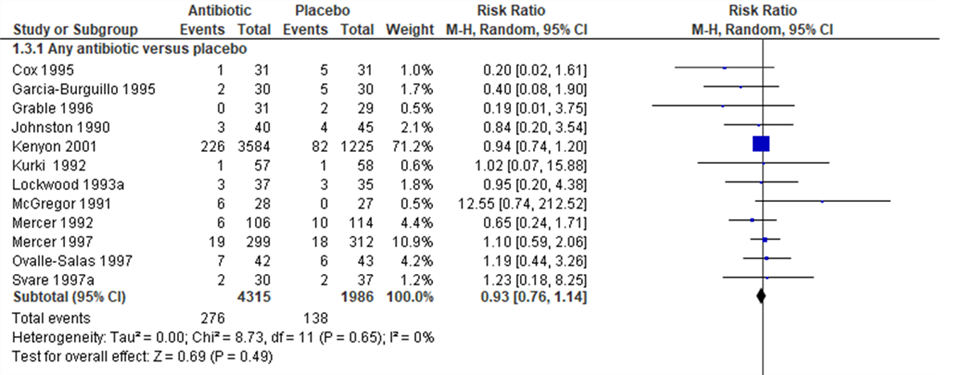
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(3) Long term effects in the child
Long term effects in the child were defined by the working group as (3.1) cerebral palsy (CP) and (3.2) bronchopulmonary dysplasia (BPD). The only long term child outcome reported by Kenyon (2013) was Serious childhood disability at 7 years, reported by Kenyon (2008) (n=3171) in a follow-up study of the trial included in the Cochrane SR (Kenyon, 2013) as Kenyon (2001). The reported RR (95% CI) was 1.01 (0.91; 1.12) (Kenyon, 2013).
(3.1) CP
The outcome CP, as reported by parents of children at age 7 years was only reported by Kenyon (2008). The OR (95% CI) was 1.18 (0.77; 1.81) and 0.81 (0.53; 1.24) for erythromycin and co-amoxiclav, respectively.
(3.2) Bronchopulmonary dysplasia (BPD)
This outcome was not reported. However, Kenyon, 2013 did report the outcomes (3.2.1) Oxygen treatment > 36 weeks’ gestational age and (3.2.2) Neonatal oxygenation > 28 days. The first outcome was reported in one of the included studies (Kenyon, 2001), including 4809 babies. The RR (95% CI) was 0.91 (0.70;1.17). Neonatal oxygenation was reported in 3 trials (n=5487). The RR (95% CI) was 0.79 (0.61; 1.03).
Figure 1.3 Outcome (3.2.2) Neonatal oxygenation > 28 days: antibiotics versus placebo in women after PPROM
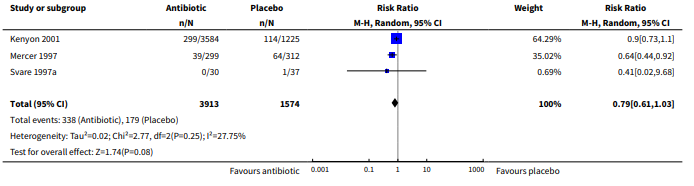
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
Important outcome measures
Neonatal outcomes
(4) Perinatal infections
Kenyon (2013) reported ‘neonatal infections including pneumonia’. A total of 12 trials, with 1680 babies, were included. The authors reported a significant reduction in children with a neonatal infection whose mothers had received antibiotics (Figure 1.4, 12 trials, 1680 children, RR 0.67, 95%CI 0.52 to 0.85). Heterogeneity was low (I2 = 0%).
Figure 2.4 Outcome (4) Perinatal infections: antibiotics versus placebo in women after PPROM
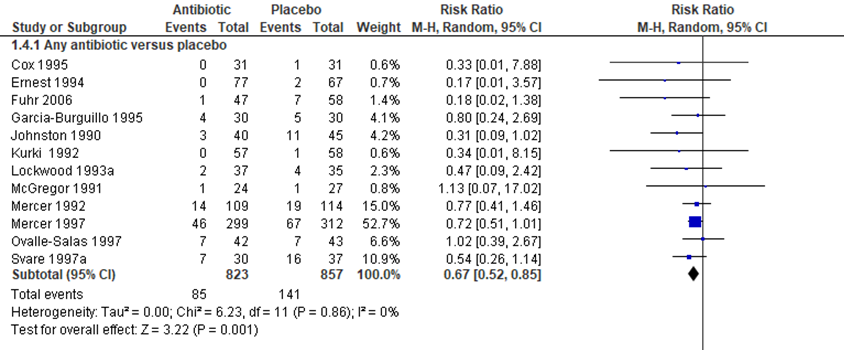
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(5) Apgar score < 7 after 5 minutes
This outcome was not reported.
(6) Neonatal Intensive Care Unit (NICU) admission
4 trials, including 5023 children, reported on NICU admission. NICU admission was comparable between children whose mothers had or had not received antibiotics (Figure 1.5, 4 trials, 5023 children, RR 0.98, 95% CI 0.84 to 1.13). The heterogeneity among studies was high (I2 = 78%).
Figure 1.5 Outcome (6) NICU admission: antibiotics versus placebo in women after PPROM
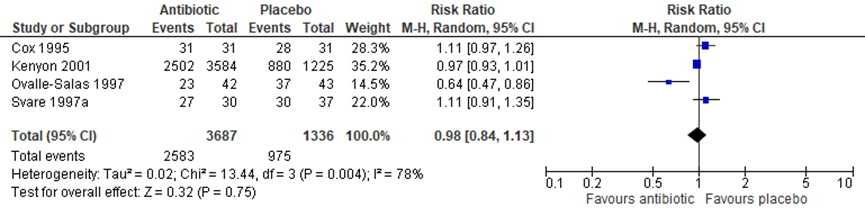
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(7) Prolonged latency/pregnancy duration until birth
The number of days from PPROM to birth was not compared, but the review did report on (7.1) ‘birth within 48 hours of randomisation’ and (7.2) ‘birth within 7 days of randomisation’ and (7.3) ‘birth before 37 weeks’ of gestation’.
(7.1) Birth within 48 hours of randomisation,
In 7 trials, with 5927 children, data were reported on birth within 48 hours of randomisation. A significant difference was found between children born within 48 hours favouring children whose mothers had received antibiotics (Figure 1.6, 7 trials, 5927 children, RR 0.71, 95% CI 0.58 to 0.87).
Figure 1.6 Outcome (7.1) birth within 48 hours of randomisation: antibiotics versus placebo in women after PPROM
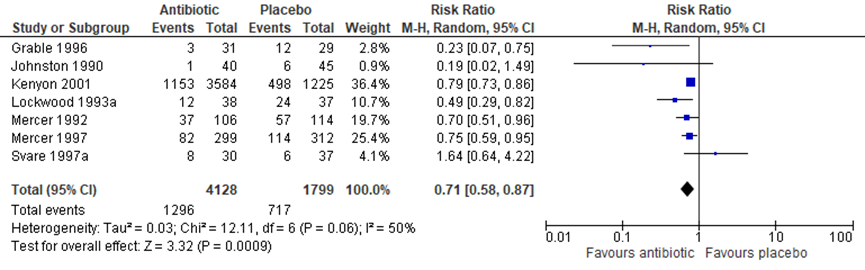
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(7.2) Birth within 7 days of randomisation
There were 7 trials (of which 6 also reported birth within 48 hours after randomisation), 5965 children, reporting on birth within 7 days (Figure 1.7, 7 trials, 5965 children, RR 0.79, 95% CI 0.71 to 0.89).
Figure 1.7 Outcome (7.2) birth within 7 days of randomisation: antibiotics versus placebo in women after PPROM
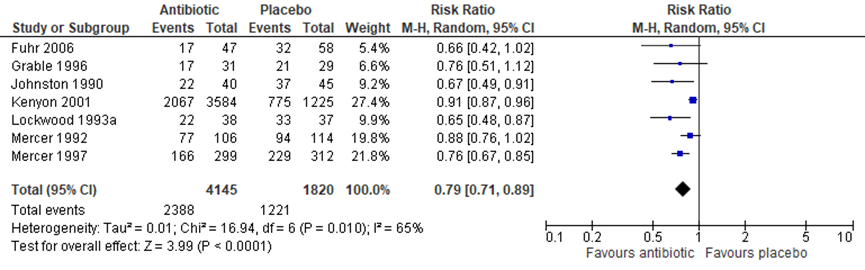
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(7.3) Birth < 37 weeks of gestation
Trials, including 4931 children were found that reported birth < 37 weeks of gestation. The number of babies born before 37 weeks of gestation was comparable among groups (antibiotics versus placebo) (Figure 1.8, 3 trials, 4931 children, RR 1.00, 95%CI 0.98 to 1.03, I2=0%)
Figure 1.8 Outcome (7.3) birth < 37 weeks’ of gestation: antibiotics versus placebo in women after PPROM
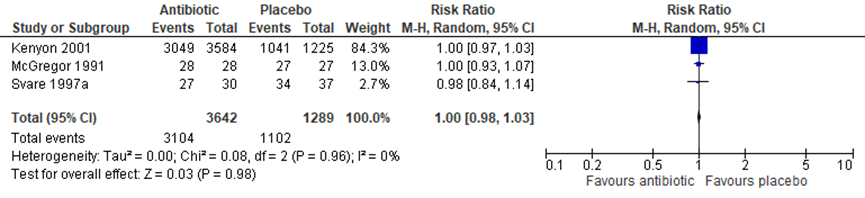
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
Maternal outcomes
(8) Allergy
This outcome was not reported.
(9) Anaphylaxis
This outcome was not reported.
(10) Sepsis
This outcome was not reported.
(11) Chorioamnionitis (clinical and histological)
Chorioamnionitis was defined as ‘infection of the womb’. According to the study descriptions it was defined by most studies as ‘having clinical signs of chorioamnionitis’. Eleven trials, 1559 women, reported on chorioamnionitis. A statistically significant reduction in chorioamnionitis was seen with the use of antibiotics (Figure 1.9, 11 trials, 1559 women, RR 0.66, 95%CI 0.46 to 0.96, I2=45%).
Figure 1.9 Outcome (11) Chorioamnionitis: antibiotics versus placebo in women after PPROM
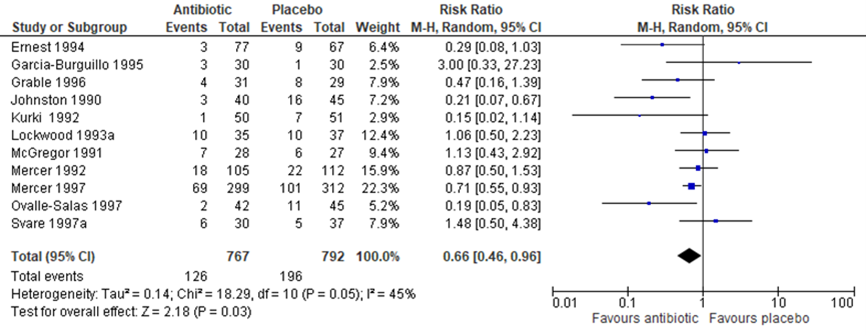
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(12) Endometritis
This outcome was not reported.
(13) Delivery mode (spontaneous vaginal, instrumental or caesarean section)
The 11 studies (6317 women) only reported on the outcome ‘caesarean section’. The rate of caesarean section was comparable among groups (antibiotics versus placebo) (Figure 1.10, 11 trials, 6317 women, RR 0.96, 95% CI 0.88 to 1.05, I2=0%).
Figure 1.10 Outcome (13) Delivery mode: antibiotics versus placebo in women after PPROM
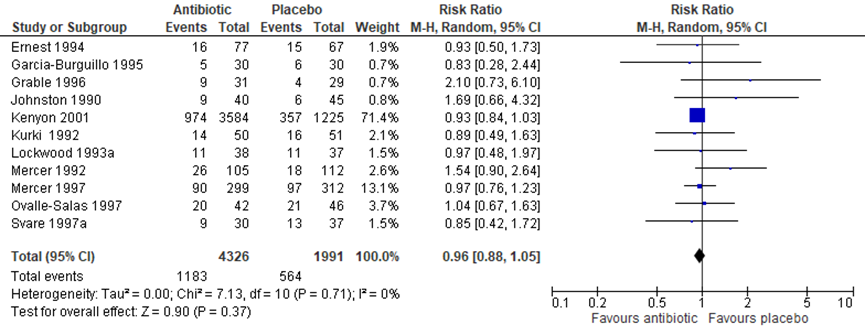
Source: Kenyon (2013); Z: p-value of the pooled effect, df; degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
(14) Maternal mortality
The outcome ‘maternal death’ did not occur in both groups in 3 trials including 763 women in total.
(15) Postpartum haemorrhage
This outcome was not reported.
Level of evidence of the literature
The level of evidence regarding the outcome measure (1) neonatal morbidity, consisting of 1.1 bilateral PVL, 1.2 IVH gr III/IV, 1.3 neonatal insult and 1.4 neonatal encephalopathy, could not be assessed because outcomes 1.1, 1.2 and 1.3 were not reported by Kenyon (2013) and there were no events for outcome 1.4. For the outcome (1.a) Major cerebral abnormality on ultrasound before discharge the level of evidence started high and was downgraded with one level to a moderate GRADE because of imprecision, as the 95% CI overlapped with the minimal clinically important difference (MCID).
The level of evidence regarding the outcome measure (2) perinatal mortality started high and was not downgraded .
The level of evidence regarding the outcome measure (3) long term effects in the child, consisted of (3.1) cerebral palsy (CP) and (3.2) bronchopulmonary dysplasia (BPD). The level of evidence for outcome (3.1) cerebral palsy started high and was downgraded with two levels to a low GRADE because of imprecision (the lower and upper limits of clinical relevance RR<0.8 and RR> 1.25 were exceeded by the 95% CI), and because of possible attrition bias. The level of evidence for outcome (3.2) BPD started high and was downgraded with one level to a moderate GRADE because of imprecision, as the 95% CI overlapped with the MCID.
The level of evidence regarding the outcome measure (4) perinatal infections started high and was downgraded by one level to a moderate GRADE because of imprecision (the lower limit of clinical relevance RR< 0.8 was exceeded).
Outcome (5) 5 minutes’ Apgar score < 7 was not reported.
The level of evidence regarding the outcome measure (6) Neonatal Intensive Care Unit (NICU) admission started high and was downgraded by one level to a moderate GRADE because of inconsistency.
The level of evidence regarding the outcome measure (7) Prolonged latency/pregnancy duration until birth is divided in (7.1) birth within 48 hours of randomisation, (7.2) birth within 7 days of randomisation and (7.3) birth before 37 weeks of gestation. The level of evidence for outcome (7.1) birth within 48 hours of randomisation started high and was downgraded with one level to a moderate GRADE because of imprecision (the lower limit of clinical relevance RR< 0.8 was exceeded). The results of one small study deviated from the other studies, but because of the limited size of this study, it was decided not to downgrade for inconsistency. The level of evidence for outcome (7.2) birth within 7 days of randomisation started high and was downgraded with one level to a moderate GRADE as well because of imprecision (the lower limit of clinical relevance RR<0.8 was exceeded). The level of evidence for outcome (7.3) birth before 37 weeks of gestation started high and was not downgraded.
Outcome (8) Allergy was not reported.
Outcome (9) Anaphylaxis was not reported.
Outcome (10) Maternal sepsis was not reported.
The level of evidence regarding the outcome measure (11) chorioamnionitis started high and was downgraded by 2 levels to a low GRADE because of inconsistency, possibly due to an unclear definition of chorioamnionitis among studies (e.g. clinical signs or histological result) and because of imprecision (the lower limit of clinical relevance of RR<0.8 was exceeded).
Outcome (12) Endometritis was not reported.
The level of evidence regarding the outcome measure (13) delivery mode (caesarean section) started high and was not downgraded.
The level of evidence regarding the outcome measure (14) maternal mortality started high and was downgraded to a very low GRADE because no maternal deaths occurred in any of the three studies that reported maternal death as an outcome.
Outcome (15) Postpartum haemorrhage was not reported.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the beneficial/non beneficial effects of antibiotic prophylaxis compared to placebo or no treatment in pregnant women with preterm prelabour rupture of membranes (PPROM) between 20 and 37 weeks on neonatal and maternal outcomes?
P: Pregnant woman with PPROM between 20 and 37 weeks gestational age (without signs of a clinical infection).
I: Antibiotics prophylaxis (any regime).
C: No antibiotics/placebo.
O: Neonatal morbidity: respiratory distress syndrome, bronchopulmonary dysplasia (BPD), periventricular leukomalacia (PVL), IVH gr III/IV, neurologic problems (neonatal insult, cerebral palsy (CP), neonatal encephalopathy), perinatal mortality, long-term outcomes, perinatal infections, Apgar score < 7 after 5 minutes, Neonatal Intensive Care Unit (NICU) admission, prolonged latency/pregnancy duration until birth, maternal allergy, anaphylaxis, maternal sepsis, chorioamnionitis (clinical and histological), endometritis, delivery mode (spontaneous vaginal, instrumental or caesarean section), maternal mortality, postpartum haemorrhage.
Relevant outcome measures
The guideline development group considered the neonatal outcomes: (1) neonatal morbidity (respiratory distress syndrome (RDS), (1.1) bilateral periventricular leukomalacia (PVL), (1.2) IVH gr III/IV, (1.3) neonatal insult, (1.4) neonatal encephalopathy), (2) perinatal mortality, (3) long term outcomes (composite of (3.1) cerebral palsy (CP) and (3.2) bronchopulmonary dysplasia (BPD)) as critical outcome measures for decision making; and (4) perinatal infections, (5) Apgar score < 7 after 5 minutes, (6) Neonatal Intensive Care Unit (NICU) admission, and (7) prolonged latency/pregnancy duration until birth as important outcomes. The maternal outcomes: (8) allergy, (9) anaphylaxis, (10), sepsis, (11) chorioamnionitis (clinical and histological), (12) endometritis, (13) delivery mode (spontaneous vaginal, instrumental or caesarean section), (14) maternal mortality, (15) postpartum haemorrhage were all considered as important outcomes for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
For the outcome measures perinatal and maternal mortality any clinical difference was considered as a clinically important difference between groups. For delivery mode and postpartum haemorrhage 10% clinical difference was considered clinically important. For all other outcome measures, the GRADE default - RR< 0.80 or RR>1.25 for dichotomous outcomes and 0.5 standard deviation for continuous outcomes - was taken as a minimal clinically important effect.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched using relevant search terms until July 28th, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 602 hits. Studies were selected based on the following criteria: (design) RCTs, (P) women with PPROM, (I) antibiotics (any type/dose), (C) placebo or no treatment. 36 studies were initially selected based on title and abstract screening. After reading the full text, one Cochrane systematic review from 2013 was included, which included 22 trials. No studies published after the systematic review were found that could be included.
Results
One systematic review (SR) by Kenyon (2013), including 22 trials, was included in the analysis of the literature. Only one of the included RCTs reported long term outcomes at age 7 years; since not all of the critical outcomes were reported in the SR, the relevant information was extracted from the original RCT (Kenyon, 2008). Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias table.
Referenties
- Kenyon S, Pike K, Jones DR, Brocklehurst P, Marlow N, Salt A, Taylor DJ. Childhood outcomes after prescription of antibiotics to pregnant women with preterm rupture of the membranes: 7-year follow-up of the ORACLE I trial. Lancet. 2008 Oct 11;372(9646):1310-8.
- Kenyon S, Pike K, Jones DR, Brocklehurst P, Marlow N, Salt A, Taylor DJ. Childhood outcomes after prescription of antibiotics to pregnant women with spontaneous preterm labour: 7-year follow-up of the ORACLE II trial. Lancet. 2008 Oct 11;372(9646):1319-27.
- Kenyon S, Boulvain M, Neilson J. Antibiotics for preterm rupture of membranes. Cochrane Database of Systematic Reviews 2013, Issue 12.
- Kim, H., Sitarik, A. R., Woodcroft, K., Johnson, C. C., & Zoratti, E. (2019). Birth mode, breastfeeding, pet exposure, and antibiotic use: associations with the gut microbiome and sensitization in children. Current allergy and asthma reports, 19(4), 1-9.
- Marlow N, Bower H, Jones D, Brocklehurst P, Kenyon S, Pike K, Taylor D, Salt A. The ORACLE Children Study: educational outcomes at 11?years of age following antenatal prescription of erythromycin or co-amoxiclav. Arch Dis Child Fetal Neonatal Ed. 2017 Mar;102(2):F131-F135.
- NICE guideline (NG25): Preterm labour and birth. 20 November 2015 Last updated: 02 August 2019. https://www.nice.org.uk/guidance/ng25.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
*Kenyon (2001) consists of the ORACLE 1 and ORACLE 2 trials. The ORACLE trials have a follow up at age 7 which were included in the systematic review.
**Cerebral palsy was not reported as a separate outcome of the Kenyon systematic review, but was found in the individual ORACLE follow up trials (Kenyon, 2008a). Because of the importance of the outcome and the large size of the ORACLE-1 trial, the working group decided to add the study results separately to the results of the systematic review.
Table of quality assessment
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/unclear |
Comprehensive and systematic literature search?
Yes/no/unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?
Yes/no/unclear |
Potential conflicts of interest reported?
Yes/no/unclear |
|
Kenyon, 2013 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
Yes |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Khan, 2000 |
FT not available |
|
Segel, 2003 |
Dosage study not predefined |
|
Hutzal, 2008 |
More recent systematic review available |
|
Cousens, 2010 |
More recent systematic review available |
|
Ballinas, 2011 |
Erythromycin versus clindamycin not predefined |
|
Kwak, 2013 |
Erythromycin + clarithromycin versus cefazolin alone not predefined |
|
Kahramanoglu, 2016 |
Dosage study not predefined |
|
Marlow, 2017 |
Educational outcome at age 11 not predefined |
|
Siegel |
β-lactam versus macrolide not predefined |
|
Wolf |
Ampicillin + roxithromycin versus cefuroxime + roxithromycin not predefined |
|
Chatzakis |
Network meta-analysis used for UV2 |
Literature search strategy
Algemene informatie
|
Richtlijn: Geboortezorg TOP50 – cluster 6 |
|
|
Uitgangsvraag: 1. Welke plaats heeft direct geven van antibiotica bij preterm pre-labour rupture of membranes (PPROM) (zonder klinische tekenen van infectie) 2. Welk AB heeft de voorkeur bij PPROM? |
|
|
Database(s): Embase, Medline |
Datum: 28-7-2020 |
|
Periode: 2000 – juli 2020 |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen:
|
|
Zoekopbrengst
|
|
Embase |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
83 |
66 |
87 |
|
RCT |
161 |
109 |
207 |
|
Observationele studies |
216 |
207 |
308 |
|
Totaal |
460 |
382 |
602 |
Critical outcome measures
Neonatal outcomes
(1) Neonatal morbidity
|
No GRADE / Very low GRADE |
The effect of antibiotic prophylaxis versus placebo in women with PPROM on neonatal morbidity is unclear.
Bilateral PVL, IVH gr III/IV and neonatal insult were not reported. The effect of antibiotic prophylaxis on neonatal encephalopathy is unclear, because no events occurred in one trial among 60 babies.
Sources: (Kenyon, 2013) |
(1.a) Major cerebral abnormality on ultrasound before discharge
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a slight reduction of major cerebral abnormality on ultrasound before discharge compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(2) Perinatal mortality
|
High GRADE |
Antibiotic prophylaxis for women with PPROM does not reduce or increase perinatal mortality compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(3) Long term effects on the child
(3.1) Cerebral Palsy, as reported by parents of children at age 7 years
|
Low GRADE |
Antibiotic prophylaxis for women with PPROM may not reduce or increase cerebral palsy compared to placebo or no prophylaxis.
Sources: (Kenyon, 2008) |
(3) BPD
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a slight reduction of BPD compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
Important outcome measures
Neonatal outcomes
(4) Perinatal infections
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a decrease of the rate of neonatal infections compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(5) Apgar score < 7 after 5 minutes
|
- GRADE |
Apgar score < 7 after 5 minutes was not reported.
Sources: (Kenyon, 2013) |
(6) Neonatal Intensive Care Unit admission
|
Moderate GRADE |
Antibiotic prophylaxis in women with PPROM probably does not reduce NICU admission compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(7) Prolonged latency/pregnancy duration until birth
(7.1) Birth within 48 hours of randomisation
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a reduction of babies born within 48 hours of randomization compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(7.2) Birth within 7 days of randomisation
|
Moderate GRADE |
Antibiotic prophylaxis for women with PPROM probably results in a reduction of babies born within 7 days of randomization compared to placebo or no prophylaxis.
Source: (Kenyon, 2013) |
(7.3) Birth before 37 weeks of gestation
|
High GRADE |
Antibiotic prophylaxis for women with PPROM does not result in a reduction of babies born < 37 weeks of gestation compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
Maternal outcomes
(8, 9, 10) Allergy, anaphylaxis and sepsis
|
- GRADE |
Maternal allergy, anaphylaxis and sepsis were not reported.
Sources: (Kenyon, 2013) |
(11) Chorioamnionitis
|
Low GRADE |
The evidence suggests that antibiotic prophylaxis given to women with PPROM reduces the number of women diagnosed with infection of the womb compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(12) Endometritis
|
- GRADE |
Endometritis was not reported.
Sources: (Kenyon, 2013) |
(13) Delivery mode
|
High GRADE |
Antibiotic prophylaxis given to women with PPROM does not reduce or increase the number of women that deliver with a caesarean section compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(14) Maternal death
|
Very low GRADE |
The evidence is very uncertain about the effect of antibiotic prophylaxis for women with PPROM on maternal mortality compared to placebo or no prophylaxis.
Sources: (Kenyon, 2013) |
(15) Postpartum haemorrhage
|
- GRADE |
Postpartum haemorrhage was not reported.
Sources: (Kenyon, 2013) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-03-2023
Beoordeeld op geldigheid : 12-05-2023
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Antibiotica profylaxe bij PPROM |
NVOG |
2022 |
2027 |
5 jaar |
NVOG |
Nieuwe evidence |
Algemene gegevens
De ontwikkeling van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangere vrouwen.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVOG (voorzitter)
- Dr. J.L. (Jantien) van der Heyden, gynaecoloog, werkzaam in het Bernhoven ziekenhuis te Uden, NVOG
- Dr. M.M. (Martina) Porath, gynaecoloog-perinatoloog, werkzaam in het Maxima Medisch Centrum te Veldhoven, NVOG
- Dr. S.M.T.A. (Simone) Goossens, gynaecoloog-perinatoloog, werkzaam in het Maxima Medisch Centrum te Veldhoven, NVOG
- Dr. I.H. (Ingeborg) Linskens, gynaecoloog-perinatoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVOG
- Dr. F. (Fatima) Hammiche, gynaecoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVOG
- Prof. dr. C.A.J. (Catherijne) Knibbe, ziekenhuisapotheker-klinisch farmacoloog, werkzaam in het St Antonius ziekenhuis Nieuwegein & Utrecht, en hoogleraar, werkzaam bij LACDR, Universiteit Leiden, NVKFB
- Dr. R.C. (Rebecca) Painter, gynaecoloog, associate professor, werkzaam in het Amsterdam UMC te Amsterdam, NVOG
- Drs. E.C.J. (Evelyn) Verheijen, gynaecoloog, werkzaam in het Annaziekenhuis te Geldrop, NVOG
- J. (Jolein) Vernooij, klinisch verloskundige, physician assistant in opleiding, werkzaam in het OLVG locatie Oost te Amsterdam, KNOV
- J. (José) Hollander-Boer, verloskundige, werkzaam bij Academie Verloskunde Amsterdam Groningen, KNOV, clusterwerkgroep
- J. (Jacobien) Wagemaker, projectleider, werkzaam in het Maasstadziekenhuis te Rotterdam, Care4Neo
- I. (Ilse) van Ee, patiëntenvertegenwoordiger, werkzaam bij de Patiëntenfederatie te Utrecht, PFN
- Dr. M.C. (Martine) Bouw-Schaapveld, kinderarts-neonatoloog, werkzaam in het Deventer ziekenhuis te Deventer, NVK
- Dr. M. (Mireille) van Westreenen, arts-microbioloog, werkzaam in het Erasmus MC te Rotterdam, NVMM
- Dr. M.L. (Mark) van Zuylen, anesthesioloog, werkzaam in het Amsterdam UMC te Amsterdam, NVA
- Drs. I.C.M. (Ingrid) Beenakkers, anesthesioloog, werkzaam in het UMC Utrecht te Utrecht, NVA
- Dr. S.V. (Steven) Koenen, gynaecoloog, werkzaam in het ETZ, locatie Elisabeth Ziekenhuis te Tilburg, NVOG, lid stuurgroep
- Dr. J.J. (Hans) Duvekot, gynaecoloog, werkzaam in het Erasmus MC te Rotterdam, NVOG, lid stuurgroep
Meelezers
- Leden van de Otterlo-werkgroep (2021)
Met ondersteuning van
- Drs. Y. (Yvonne) Labeur, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. L. (Laura) Viester, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J.H. (Hanneke) van der Lee, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Bax* |
Gynaecoloog-perinatoloog Amsterdam UMC |
Gastvrouw Hospice Xenia Leiden (onbetaald) Lid NIPT consortium Voorzitter WG Otterlo NVOG Lid commissie kwaliteitsdocumenten NVOG Lid pijlerbestuur FMG NVOG Penningmeester WG Infectieziekten NVOG Lid werkgroep voorlichting en deskundigheidsbevordering prenatale screening RIVM Lid werkgroep implementatie scholing prenatale screening RIVM |
Geen |
Geen actie |
|
Beenakkers |
Anesthesioloog UMCU/WKZ |
Geen |
Geen |
Geen actie |
|
Bouw-Schaapveld |
Kinderarts-neonatoloog, Deventer ziekenhuis |
Geen |
Geen |
Geen actie |
|
Duvekot |
Gynaecoloog-perinatoloog, Erasmus MC |
Directeur medisch advies en expertisebureau Duvekot, Ridderkerk, ZZP |
Geen |
Geen actie |
|
Galjaard |
Gynaecoloog-perinatoloog, Erasmus MC |
Geen |
Geen |
Geen actie |
|
Goossens |
Gynaecoloog-perinatoloog, Maxima MC Veldhoven |
Geen |
Geen |
Geen actie |
|
Hammiche |
Gynaecoloog, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Hollander-Boer |
Docent verloskunde Academie Verloskunde Amsterdam Groningen Verloskundige -> oproepcontract Verloskundige stadspraktijk Groningen (zelden) |
Geen |
Geen |
Geen actie |
|
Knibbe |
Ziekenhuisapotheker-klinisch farmacoloog, Sint Antonius ziekenhuis Nieuwegein & Utecht Hoogleraar individualized Drug Treamtment, LACDR, Universiteit Leiden |
Lid Centrale Commissie Mensgebonden Onderzoek, Den Haag (vacatiegelden) Gastaanstelling onderzoeker, Erasmus MC, Sophia Kinderziekenhuis, afdeling NICU (onbetaald) |
Geen |
Geen actie |
|
Koenen |
Gynaecoloog-perinatoloog, ETZ, locatie Elisabeth Ziekenhuis |
Incidenteel juridische expertise (betaald) |
Geen |
Geen actie |
|
Linskens |
Gynaecoloog-perinatoloog, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Painter |
Gynaecoloog, aandachtsgebied maternale ziekte, associate professor, Amsterdam UMC |
Voorzitter Special Interest Group NVOG ‘Zwangerschap en diabetes en obesitas’ (onbetaald) Lid Gezondheidsraad commissie ‘Voeding en zwangerschap’ (vacatiegelden naar werkgever) Lid richtlijncommissie ‘Chirurgische behandeling van obesitas’ (NVvH) (onbetaald) Lid namens NVOG bij RIVM commissie ‘Hielprikscreening’ (onbetaald) Voorzitter organiserend comité Congres ICGH 2019 (onbetaald) Clustercoördinator regio Noord-Holland NVOG Consortium 2.0 (onbetaald) Lid wetenschapscommissie Pijler obstetrie NVOG (onbetaald) Lid Koepel Wetenschap namens Pijler obstetrie Wetenschappelijk adviseur bij patiëntenvereniging 2EHG (hyperemesis gravidarum) |
Geen |
Geen actie |
|
Porath |
Gynaecoloog-perinatoloog, Maxima Medisch Centrum |
lid NVOG werkgroep Otterlo (onbetaald) lid richtlijnwerkgroep extreme vroeggeboorte |
Geen |
Geen actie |
|
van der Heyden |
Gynaecoloog, Bernhoven ziekenhuis |
Geen |
Geen |
Geen actie |
|
van Ee |
Adviseur patiëntenbelang, Patiëntenfederatie |
Vrijwilliger Psoriasispatiënten Nederland, Coördinator patiëntenparticipatie en onderzoek en redactie lid centrale redactie (onbetaald) |
Geen |
Geen actie |
|
van Westreenen |
Arts-microbioloog, Erasmus MC |
Geen |
Geen |
Geen actie |
|
van Zuylen |
Anesthesioloog in opleiding, Amsterdam UMC |
Geen |
Geen |
Geen actie |
|
Verheijen |
Gynaecoloog Maasziekenhuis Pantein Boxmeer |
Geen |
Geen |
Geen actie |
|
Vernooij |
Klinisch verloskundige, physician assistant in opleiding, OLVG locatie Oost |
Geen |
Geen |
Geen actie |
|
Wagemaker |
Projectleider PATH Maasstadziekenhuis, ZZP adviseur, trainer, onderzoeker Family Centered en Single Room Care |
Vrijwilliger Care4Neo (soms vacatiegelden) VrijwilligerV&VN kinderverpleegkunde (soms vacatiegelden) |
Geen |
Geen actie |
|
Labeur |
Junior adviseur, Kennisinstituut FMS |
Geen |
Geen |
Geen actie |
|
Viester |
Adviseur, Kennisinstituut FMS |
Geen |
Geen |
Geen actie |
|
van der Lee |
Senior adviseur, Kennisinstituut FMS |
Onderzoeker, AmsterdamUMC |
Geen |
Geen actie |
*Voorzitter werkgroep
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vertegenwoordigers van de Patiëntenfederatie Nederland en Care4Neo af te vaardigen in de clusterwerkgroep. De conceptrichtlijn werd tevens ter commentaar voorgelegd aan de betrokken patiëntenverenigingen.
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens is er een knelpunteninventarisatie gedaan in november 2018 middels een Invitational conference.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie https://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodules worden aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren worden de conceptrichtlijnmodules aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodules worden aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., ... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11).
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., ... & Morelli, A. (2018). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. Gaceta sanitaria, 32(2), 166-e1.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A., ... & Katikireddi, S. V. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4-13.
Richtlijnen, A., & Kwaliteit, R. (2012). Medisch specialistische richtlijnen 2.0. Utrecht: Orde van Medisch Specialisten.
http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P., ... & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Schünemann, H., Brożek, J., Guyatt, G., & Oxman, A. (2013). GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from guidelinedevelopment. org/handbook. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. Bmj, 336(7653), 1106-1110.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Fetal Membranes, Premature Rupture/ or pprom.ti,ab,kf. or 'preterm prom'.ti,ab,kf. or 'preterm premature rupture of'.ti,ab,kf. or ((preterm or midtrimester or 'second trimester' or 'mid trimester') adj3 ('rupture of membrane*' or 'rupture of the membrane*' or 'amnion rupture' or 'membrane* rupture*' or 'rupture* membrane*')).ti,ab,kf. (8807) 2 exp Anti-Bacterial Agents/ or exp Antibiotic Prophylaxis/ or antibiotic*.ti,ab,kf. (884237) 3 exp Penicillins/ or 'penicill*'.ti,ab,kf. or exp Amoxicillin/ or exp Amoxicillin-Potassium Clavulanate Combination/ or amoxicillin*.ti,ab,kf. or exp Azithromycin/ or exp Erythromycin/ or azithromycin*.ti,ab,kf. or erythromycin*.ti,ab,kf. or exp Clavulanic Acid/ or clavulanic.ti,ab,kf. or clavulanate.ti,ab,kf. (165111) 4 1 and (2 or 3) (1246) 5 limit 4 to (english language and yr="2000 -Current") (662) 6 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (456826) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (2007340) 8 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) (3482359) 9 5 and 6 (66) 10 (5 and 7) not 9 (109) 11 (5 and 8) not (9 or 10) (207) 12 9 or 10 or 11 (382) |

