Magnesiumsulfaat onder de 30 weken
Uitgangsvraag
Wat is de waarde van magnesiumsulfaat bij een zwangere met een dreigende vroeggeboorte onder de 30 weken?
Aanbeveling
Behandel vrouwen met een dreigende vroeggeboorte vóór 32 weken met magnesiumsulfaat ter neuroprotectie. De dosering is 4 gram oplaaddosis, gevolgd door een onderhoudsdosering van 1 gram per uur.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De vorige richtlijn Magnesiumsulfaat bij dreigende vroeggeboorte dateert uit 2012.
In de huidige literatuuranalyse werd opnieuw onderzocht wat de waarde is van magnesiumsulfaat voor neuroprotectie bij een zwangere met een dreigende vroeggeboorte. Vervolgens werd gekeken wat de waarde van magnesiumsulfaat was onder de 30 weken en boven de 30 weken.
Er werd één systematische review gevonden (Wolf 2020) en twee RCT’s (Crowther, 2023; Sheeba, 2022). Daarnaast onderzochten twee studies de lange termijn effecten (op school leeftijd) van magnesiumsulfaat (Chollat, 2014; Doyle, 2014). Aangezien de meta-analyse van Wolf uit 2020 recenter was dan de IPD van Crowther uit 2017, is deze het meest gebruikt bij de analyse van de literatuur. De IPD van Crowther wordt echter wel gebruikt bij de overwegingen. Ook hebben we besloten om de recent gepubliceerde Cochrane van Shepherd uit mei 2024 mee te nemen in de overwegingen.( Shepherd, 2024), aangezien de publicatie van deze Cochrane net buiten de zoekdatum van deze richtlijn (25/03/2024) viel. De studies die gebruikt zijn bij het schrijven van deze richtlijn komen overeen met die uit de Cochrane analyse. De kwaliteit van de Cochrane werd als hoog beoordeeld.
Een van de problemen bij het schrijven van deze richtlijn was, dat de onderzochte studies verschillende zwangerschapsduren en doseringen gebruikten voor inclusie waardoor veel studies vaak net geen statistisch significant verschil in reductie van cerebrale parese haalden, terwijl dit klinisch wel relevant was.
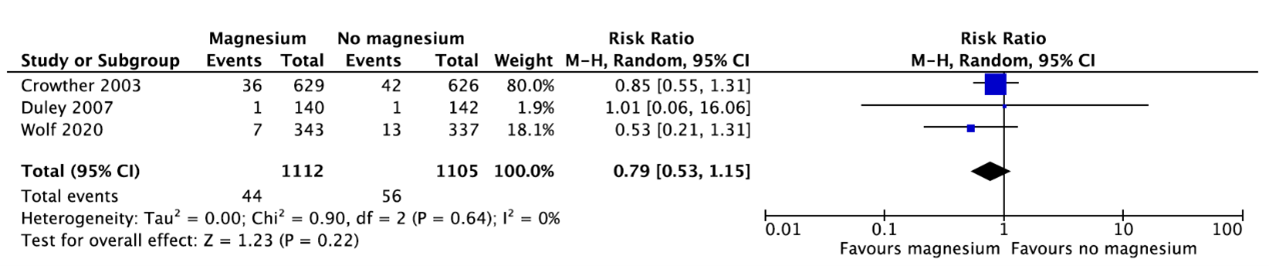
Drie studies rapporteerde de waarde van magnesiumsulfaat bij zwangeren met een dreigende vroeggeboorte onder de 30 weken (Crowther, 2003; Duley, 2007; Wolf, 2020). De bewijskracht voor de cruciale uitkomstmaten ‘neonatale sterfte’ en ‘cerebrale parese’ is laag vanwege grote spreiding in de richting van het effect. Magnesium sulfaat lijkt te resulteren in een vermindering van cerebrale parese (RR 0.79, CI 0,53-1,15). Voor de cruciale uitkomstmaten ‘neurologische ontwikkelingsstoornissen’ en ‘cerebrale parese op school leeftijd’ was de bewijskracht zeer laag. Er werd geen bewijs gevonden voor de cruciale uitkomstmaten ‘maternale sterfte’, en ‘hartstilstand’.
Effect op cerebrale parese en neurologische ontwikkelingsstoornissen
Op basis van bovengenoemde studies kan worden verondersteld dat het geven van magnesiumsulfaat leidt tot een afname van cerebrale parese (CP), waarbij het effect onder de 30 weken het grootst is. Verschillende studies gebruikten verschillende zwangerschapsduren voor inclusie; hierdoor haalden een aantal studies geen statistisch significant verschil in reductie van CP, terwijl dit effect klinisch wel relevant was.
Onder de 30 weken zwangerschapsduur is het effect van magnesiumsulfaat op reductie van CP klinisch en statistisch significant. (Wolf 2000, Crowther 2017).
Dit wordt ook bevestigd door de IPD van Crowther uit 2017, waarbij in de groep vrouwen met een zwangerschapsduur onder de 28 weken het effect op reductie van CP het grootst is (RR 0.69 (CI 0.52-0.93) en ook statistisch significant. In de groep patiënten van 28-31 weken was de reductie in CP vergelijkbaar, maar ging het confidence interval al over de 1 (RR 0.69, CI 0,45-1.05). Deasalniettemin blijft het behandel effect tot 32 weken wel klinisch significant. Dit wordt ook bevestigd door de recente Cochrane uit 2024 (E.S. Shepherd et al), waarin wel een significante reductie van CP wordt gezien in de met magnesium behandelde groep tot 32 weken.
Ook de meta-analyse van Wolf uit 2020 liet een klinisch significant effect zien op reductie van CP met een NNT van 32 onder de 28 weken. Onder de 32 weken is het NNT 52. Het gunstige effect van magnesiumsulfaat lijkt dus al wat uit te doven na 30 weken, waarschijnlijk doordat de incidentie van CP met toenemende zwangerschapsduur lager wordt. De Magenta-trial van Crowther uit 2023 (die specifiek onderzocht wat het effect was tussen 30 en 34 weken), liet echter geen klinisch of statistisch significant verschil meer zien in reductie van CP. Behalve dat de incidentie van CP lager is na 30 weken, is er mogelijk ook een ander onderliggend mechanisme in het ontstaan van CP in de extreem premature groep kinderen onder de 30 weken in vergelijking met latere zwangerschapsduren. De Magenta-trial liet nog wel een geringe reductie zien in de incidentie van neurologische ontwikkelingsstoornissen.
In de internationale literatuur is er weinig consensus wat betreft de optimale zwangerschapsduur voor het geven van magnesiumsulfaat. Engeland en Canada adviseren
behandeling tot 34 weken, de WHO adviseert behandeling tot 32 weken. Australië adviseert behandeling onder de 30 weken. Op basis van de voor deze richtlijn verzamelde literatuur, aangevuld met de IPD van Crowther en de recent gepubliceerde Cochrane adviseert de werkgroep het gebruik van Magnesiumsulfaat onder de 32 weken zwangerschapsduur.
Maternale bijwerkingen
In geen van de studies kwam maternale sterfte of een hartstilstand voor. Er was vrijwel geen significant efect op ademhalingsdepressie (0,7% in de magnesiumgroep, versus 0,5% in de placebo groep). Wel was er een significant effect op hypotensie (6,1% in de magnesiumgroep versus 2,7% in de placebogroep, (RR=2.26, 95%CI 1.31 to 3.88). Dit leidde niet tot meer complicaties.
Dosering
Verschillende studies hebben verschillende doseringen magnesiumsulfaat gebuikt, variërend van een oplaaddosis van 4 tot 6 gram, met wel of geen onderhoudsdosering van 1 of 2 gram.
De IPD van Crowther (2017) liet geen duidelijk voordeel zien van een hogere dosering op verbetering van de uitkomst. Ook was er geen duidelijke effect van het interval tussen het starten van de behandeling tot aan de geboorte op de primaire uitkomstmaat. De meeste auteurs adviseren dan ook om de laagst effectieve behandeling te gebruiken, om de maternale risico’s van overdosering zo klein mogelijk te houden. Voor Nederland is dat een oplaaddosis van 4 gram, met een onderhoudsdosering van 1 gram per uur (vergelijkbaar met de behandeling van preeclampsie). Ook wanneer de vroeggeboorte binnen enkele uren wordt verwacht kan het dus nog zinvol zijn om magnesiumsulfaat te starten.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
De patiëntenvereniging Care4Neo is het eens met de adviezen zoals hier beschreven in de richtlijn. Aangezien het toedienen van magnesiumsulfaat kan leiden tot bijwerkingen bij de moeder, en aangezien toediening boven 32 weken nauwelijks nog een klinisch relevant effect laat zien op de incidentie van CP, zijn zij van mening dat magnesiumsulfaat alleen onder de 30 weken dient te worden toegediend.
Kosten (middelenbeslag)
Kosten van magnesiumsulfaat zijn laag. 1 ampul van 10 ml magnesiumsulfaat (100 mg/ml) kost 3,54 euro (Pharmacotherapeutisch Kompas).
Aanvaardbaarheid, haalbaarheid en implementatie
Magnesiumsulfaat voor neuroprotectie is 12 jaar geleden al ingevoerd toen de toenmalige richtlijn werd gepubliceerd. De behandeling is goed geïmplementeerd in de derdelijnscentra. De huidige update van de richtlijn laat geen aanpassing van het beleid zien. De werkgroep verwacht daarom geen problemen bij het uitkomen van deze richtlijn. De huidige update van de richtlijn adviseert om magnesiumsulfaat nu te gaan geven tot 32 weken zwangerschapsduur in plaats van 30 weken. Aangezien de behandeling beperkt blijft tot de derdelijns centra verwacht de werkgroep geen grote problemen bij het implementeren van deze richtlijn.
Rationale van de aanbeveling
De vorige richtlijn Magnesiumsulfaat bij dreigende vroeggeboorte dateert uit 2012. Sindsdien zijn er een aantal nieuwe studies verschenen waaronder die van Wolf uit 2020 en Crowther uit 2017 en 2023. De tot nu toe gepubliceerde studies hebben verschillende zwangerschapsduren voor inclusie gebruikt en verschillende doseringen magnesiumsulfaat (zie tabel). De werkgroep is van mening dat er voldoende aanwijzingen zijn dat de huidige dosering magnesiumsulfaat ( 4gram oplaaddosis, gevolgd door 1 gram per uur i.v.) voldoet, en dat er bij deze dosering weinig kans is op ernstige bijwerkingen zoals maternale ademdepressie of hypotensie en een gunstig profiel qua foetale toxiciteit.
In deze PICO hebben we eerst gekeken naar het effect van magnesiumsulfaat op de incidentie van cerebrale parese, perinatale sterfte en neurologische ontwikkelingsstoornissen in de hele groep van 24-34 weken. Hieruit kwam voor cerebrale parese zowel een statistisch als ook een klinisch relevant verschil, waarbij er een duidelijk beschermend effect van magnesiumsulfaat was bij behandeling onder de 32 weken op het ontwikkelen van cerebrale parese. Effecten op perinatale sterfte en neurologische ontwikkelingsstoornissen zijn statistisch niet significant, maar mogelijk klinisch nog wel relevant.
Vervolgens hebben we de groep onderverdeeld in < 30 weken en > 30 weken.
Aangezien de incidentie van cerebrale parese hoger is onder de 30 weken, verwacht je in deze groep het grootste behandeleffect (zie met name de systematic review van Wof).
Je ziet in deze groep dan ook duidelijk een gunstig klinisch relevant effect van magnesiumsulfaat op de incidentie van cerebrale parese. Op basis van recente literatuur (Shepherd et al, Cochrane 2024) waarin ook een significante reductie van cerebrale parese wordt beschreven in de groep tot 32 weken, hebben we voldoende aanwijzingen om de behandeling met magnesiumsulfaat ook te adviseren na 30 weken.
Onderbouwing
Achtergrond
In 2012, magnesium sulphate given to pregnant women at risk for preterm delivery, was implemented in Dutch hospitals for neuroprotection in premature infants. Based on a meta-analysis (Conde-Aguledo, 2009), it was shown that adequate treatment with magnesium sulphate in threatened preterm birth led to a substantial reduction in cerebral palsy, with this effect being greatest in the extremely premature group of children <30 weeks. The advised dosage was a bolus of 4 gram, followed by a maintenance dosage of 1 gram per hour. Implementation of magnesium sulphate, in addition to the administration of corticosteroids for fetal lung maturation and antibiotics for GBS carriers, leads to a significant decrease in (severe) perinatal morbidity. The aim of this new guideline is to provide an update of recent literature, which will also specifically look at gestational age at administration and dosage of magnesium sulphate. In addition to short-term outcomes, also long-term outcomes will be assessed.
Conclusies / Summary of Findings
Maternal outcomes
|
No GRADE |
No evidence was found regarding the effect of magnesium sulphate on maternal mortality, cardiac arrest, respiratory depression, hypotension when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks. |
Neonatal outcomes
|
Low GRADE |
The evidence suggests that magnesium sulphate reduces infant mortality when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks.
Source: Crowther, 2003 |
Neurodevelopmental impairment
|
Very low GRADE |
The evidence is very uncertain about the effect of magnesium sulphate on neurodevelopmental impairment at school-age when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks.
Source: Doyle, 2014 |
|
Low GRADE |
The evidence suggests that magnesium sulphate results in a reduction in cerebral palsy when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks.
Source: Crowther, 2003; Duley, 2007; Wolf, 2020 |
|
Very low GRADE |
The evidence is very uncertain about the effect of magnesium sulphate on cerebral palsy at school-age when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks.
Source: Doyle, 2014 |
|
No GRADE |
No evidence was found regarding the effect of magnesium sulphate on composite outcome of neonatal morbidity and mortality and periventricular leukomalacia when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks. |
|
Moderate GRADE |
Magnesium sulphate likely results in little to no difference in intraventricular hemorrhage when compared with no magnesium sulphate in pregnant women with threatened premature birth <30 weeks.
Source: Crowther, 2003 |
Samenvatting literatuur
Description of studies
Chollat (2014) is a follow-up study of the randomized controlled trial of Marret (2006) to assess long-term deleterious effects of magnesium sulphate and to determine developmental and psychomotor outcomes at school-age. Women with a gestational age <33 weeks were included. More information about the in- and exclusion criteria can be found in Marret (2006). In total, 266 women (352 fetuses) were randomized to magnesium sulphate (4 grams) and 278 women (336 fetuses) were randomized to placebo. At 2 years follow-up, five infants were lost to follow-up in both the magnesium sulphate and placebo group. Besides, 34 infants died before 2 years in the magnesium sulphate group while 38 infants died in the placebo group. At school-age follow-up, 218 children whose mother received magnesium sulphate (4 grams; no maintenance infusion) and 213 children whose mother received placebo were included. Groups were comparable at baseline, except for age and birth weight. Children whose mother received magnesium sulphate were more often male and had a lower birth weight. The outcome of interest was neurodevelopmental impairment and cerebral palsy at school-age.
Crowther (2023) performed a randomized controlled trial to assess the effect of magnesium sulphate on mortality and cerebral palsy at 2 years. Women were included if they were at risk of preterm birth between 30 and 34 weeks of gestation with a singleton or twin pregnancy, gave written consent, the birth was planned or definitely expected within 24 hours, and there were no contraindications (such as respiratory depression, hypotension, absent patellar reflexes, kidney failure, or myasthenia gravis) to the use of prenatal magnesium sulphate. An exclusion criteria was administration of magnesium sulphate for the treatment of preeclampsia. In total, 729 women (858 infants) received magnesium sulphate (4 grams; no maintenance infusion) and 704 women (821 infants) received placebo. Groups were comparable at baseline. Outcomes of interest were maternal and infant mortality, neurodevelopmental impairment and cerebral palsy, intraventricular hemorrhage, periventricular leukomalacia, respiratory depression, and cardiac arrest.
Doyle (2014) is a follow-up study of the randomized controlled trial of Crowther (2003) to determine the association between magnesium sulphate and neurological, cognitive, academic, and behavioral outcomes at school age. Women with gestational age less than 30 weeks for whom birth was planned or expected within 24 hours were included. More information about the in- and exclusion criteria can be found in Crowther (2003). In total, 443 children whose mother received magnesium sulphate (4 grams followed by 2 grams per hour as maintenance dose) and 424 children whose mother did not receive magnesium sulphate were requested for an evaluation at 6 to 11 years of age. Groups were comparable at baseline. The outcome of interest was neurodevelopmental impairment and cerebral palsy.
Sheeba (2022) performed a randomized controlled trial to determine the effect of magnesium sulphate on neurodevelopmental outcomes in preterm infants. Women with a gestational age between 24 and 34 weeks and if birth was expected within 24 hours were included. Exclusion criteria were maternal hypotension, renal insufficiency, hepatic insufficiency, and cardiac rhythm or electrolyte insufficiency. Besides, infants with severe malformations such as neural tube defects and chromosomal abnormalities like trisomies that would interfere with assessment of tone and developmental milestones were excluded. In total, 40 women received 4 grams magnesium sulphate bolus initially followed by an infusion of 1 gram/hour for 24 hours or until birth and 43 women received a placebo infusion of normal saline. Groups were comparable at baseline. The outcome of interest was infant mortality and neurodevelopmental impairment.
Wolf (2020) performed a systematic review to determine the neuroprotective effect of magnesium sulphate for women at imminent risk for preterm delivery. MEDLINE, Embase, the Cochrane Central Register of Controlled Trials, and ClinicalTrials.gov were searched on 8 October 2019 and reference lists were checked. Randomized controlled trials comparing intravenous magnesium sulphate with placebo at the time of imminent preterm delivery and reporting about neonatal mortality and neurological impairment outcomes (≥12 month follow up) were included. In total, six studies were included (Crowther, 2003; Duley, 2007; Marret, 2006; Mittendorf, 2002; Rouse, 2008; Wolf 2020 (see characteristics and dosage of magnesium sulphate in table 1). Outcomes of interest were infant mortality, cerebral palsy, and intraventricular hemorrhage.
Table 1. Characteristics of included studies.
|
Study |
Gestation (inclusion criteria) |
Intervention |
Comparator |
Outcomes |
||
|
|
Characteristics |
Intervention |
Characteristics |
Control |
|
|
|
Chollat, 2014 (follow-up of Marret 2006) |
<33 weeks |
Group 1 (n= 266) Gestational age (mean±SD): 29.9 ± 2.0 weeks
|
4 gram MgSO4 (no maintenance infusion) |
Group 2 (n= 278) Gestational age (mean±SD): 30.1 ± 1.9 weeks |
Placebo |
CP at school-age |
|
Crowther, 2003 |
<30 weeks |
Group 1 (n= 629) Gestational age (mean±SD):
|
4 gram MgSO4 followed by 2 grams per hour as maintenance dose
|
Group 2 (n= 626) Gestational age (mean±SD):
|
Placebo |
Infant mortality, CP, IVH |
|
Crowther, 2023 |
30 to 34 weeks |
Group 1 (n= 729) Gestational age 30 to <32 weeks: 323 (44.3%) |
4 gram MgSO4 (no maintenance infusion) |
Group 2 (n= 704) Gestational age (mean±SD): 30 to <32 weeks: 308 (43.8%) 32 to <34 weeks: 396 (56.2%) |
Placebo |
Maternal and infant mortality, CP, IVH, PVL, respiratory depression, cardiac arrest, hypotension, composite outcome of neonatal morbidity and mortality |
|
Duley, 2007 |
<37 weeks |
Group 1 (n= 798) Gestational age (mean±SD): |
4 gram MgSO4 followed by 1 gram per hour intravenously or 5 grams intramuscularly every 4 hours
|
Group 2 (n= 795) Gestational age (mean±SD): |
Placebo |
Infant mortality, CP |
|
Doyle, 2014 (follow-up Crowther 2003) |
<30 weeks |
Group 1 (n= 443) Gestational age at birth (mean±SD): 27.3 ± 2.2 weeks |
4 gram MgSO4 followed by 2 grams per hour as maintenance dose |
Group 2 (n= 424) Gestational age at birth (mean±SD): 27.4 ± 2.0 weeks
|
Placebo |
CP at school-age
|
|
Marret, 2006 |
<33 weeks |
Group 1 (n= 352) Gestational age (mean±SD):
|
4 gram MgSO4 (no maintenance infusion) |
Group 2 (n= 336) Gestational age (mean±SD):
|
Placebo
|
Infant mortality, CP, IVH |
|
Mittendorf, 2002 |
25 to 33 weeks |
Group 1 (n= 85) Gestational age (mean±SD):
|
4 gram MgSO4 followed by 0 or 2 to 3 grams per hour as maintenance dose |
Group 2 (n= 80) Gestational age (mean±SD):
|
Placebo
|
Infant mortality, CP, IVH |
|
Rouse, 2008 |
24 to 31 weeks |
Group 1 (n= 1188) Gestational age (mean±SD):
|
6 gram MgSO4 followed by 2 grams per hour as maintenance dose
|
Group 1 (n= 1256) Gestational age (mean±SD):
|
Placebo |
Infant mortality, CP, IVH |
|
Sheeba, 2022 |
24 to 34 weeks |
Group 1 (n= 45) Gestational age >32 weeks: 27 (67.5%) |
4 gram MgSO4 followed by 1 gram per hour for 24 hours or until birth
|
Group 2 (n= 45) Gestational age >32 weeks: 26 (32.5%) £32 weeks: 17 (29.5%) |
Placebo |
Infant mortality |
|
Wolf, 2020 |
24 to 31 weeks |
Group 1 (n= 343) Gestational age (mean±SD):
|
5 gram MgSO4 followed by 1 gram per hour as maintenance dose
|
Group 1 (n= 337) Gestational age (mean±SD):
|
Placebo |
Infant mortality, CP, IVH |
Abbreviations: CP=cerebral palsy; IVH=intraventricular hemorrhage; MgSO4=magnesium sulphate; NR=not reported; PVL=periventricular leukomalacia
PICO 2: <30 weeks
Results
Maternal outcomes
1. Maternal mortality
Not reported.
2. Cardiovascular arrest
Not reported.
3. Respiratory depression
Not reported.
4. Hypotension
Not reported.
Neonatal outcomes
1 Infant mortality
Wolf (2020) included one study that reported infant mortality at a gestational age <30 weeks (Crowther, 2003). Infant mortality was defined as total mortality until final follow-up. In total, 78 of the 629 infants (12.4%) whose mother received magnesium sulphate died as compared to 96 of the 626 infants (15.3%) whose mother did not receive magnesium sulphate (RR=0.81, 95%CI 0.61 to 1.07).
2. Neurodevelopmental impairment
Doyle (2014) reported the long-term outcomes of Crowther (2003): neurosensory disability at school-age (6 to 11 years of age). In total, 83 of the 257 infants (32.3%) whose mother received magnesium sulphate had mild, moderate or severe neurosensory disability as compared to 83 of the 254 infants (32.7%) whose mother did not receive magnesium sulphate (RR=0.99, 95%CI 0.77 to 1.27).
2.1. Cerebral palsy (CP) (any)
Wolf (2020) included three studies that reported any CP at a gestational age <30 weeks (Crowther, 2003; Duley, 2007; Wolf, 2020) (figure 2.1). In total, 44 of the 1112 infants (4.0%) whose mother received magnesium sulphate had CP as compared to 56 of the 1105 infants (5.1%) whose mother did not receive magnesium sulphate (RR=0.79, 95%CI 0.53 to 1.15).
Figure 2.1. Cerebral palsy for gestational age <30 weeks.
2.2. Cerebral palsy at school-age
Doyle (2014) reported the long-term outcomes of Crowther (2003): CP at school-age (6 to 11 years of age). Twenty-three of the 295 children (7.8%) whose mother received magnesium sulphate had CP at school-age as compared to 21 of the 314 children (6.7%) whose mother did not receive magnesium sulphate (RR=1.17, 95%CI 0.66 to 1.40).
3. Composite outcome of neonatal morbidity and mortality
Not reported.
4. Periventricular leukomalacia (PVL)
Not reported.
5. Intraventricular hemorrhage (IVH)
Wolf (2020) included one study that reported IVH at a gestational age <30 weeks (Crowther, 2003). In total, 165 of the 629 infants (26.2%) whose mother received magnesium sulphate had IVH as compared to 148 of the 626 infants (23.6%) whose mother did not receive magnesium sulphate (RR=1.11, 95%CI 0.92 to 1.34).
Level of evidence of the literature
According to GRADE, the level of evidence of randomized controlled trials start at high.
Maternal outcomes
The level of evidence regarding the outcome measures maternal mortality, cardiovascular arrest, respiratory depression and hypotension could not be assessed with GRADE as these outcome measures were not studied in the included studies.
Neonatal outcomes
The level of evidence regarding the outcome measure infant mortality was downgraded by two levels to low because the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure neurodevelopmental impairment at school-age was downgraded by three levels to very low because of missing data (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure cerebral palsy was downgraded by two levels to low because the 95% confidence interval crossed both lines of no (clinically relevant) effect (-2, imprecision).
The level of evidence regarding the outcome measure cerebral palsy at school-age was downgraded by three levels to very low because of missing data (-1, risk of bias) and the 95% confidence interval crossed both lines of no (clinically relevant) effect
(-2, imprecision).
The level of evidence regarding the outcome measure composite outcome of neonatal morbidity and mortality could not be assessed with GRADE as this outcome measure was not studied in the included studies.
The level of evidence regarding the outcome measure periventricular hemorrhage could not be assessed with GRADE as this outcome measure was not studied in the included studies.
The level of evidence regarding the outcome measure intraventricular hemorrhage was downgraded by one level to moderate because the 95% confidence interval crossed the line of no (clinically relevant) effect (-1, imprecision).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of giving magnesium sulphate to pregnant women with threatened preterm birth between 24 and 34 weeks compared to no magnesium sulphate on the morbidity and mortality of mother and child?
| P: |
pregnant women with threatened premature birth between 24 and 34 weeks with the aim of neuroprotection |
| P2: | < 30 weeks |
| I: | magnesium sulphate |
| C: | no magnesium sulphate |
| O: |
= maternal: respiratory depression, maternal mortality, cardiovascular arrest, hypotension = neonatal: infant mortality, composite outcome of neonatal morbidity and mortality (respiratory distress syndrome, bronchopulmonary dysplasia, retinopathy of prematurity, periventricular leukomalacia, intraventricular hemorrhage, necrotizing enterocolitis, proven neonatal sepsis, neonatal death), PVL (periventricular leukomalacia), IVH (intraventricular hemorrhage), neurodevelopmental impairment (cerebral palsy, Bayley score) |
Relevant outcome measures
The guideline development group considered maternal mortality, cardiovascular arrest, infant mortality, neurodevelopmental impairment as critical outcome measures for decision making; and maternal respiratory depression and hypotension, composite outcome of neonatal morbidity and mortality, periventricular leukomalacia and intraventricular hemorrhage as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- Neurodevelopmental impairment: cerebral palsy, Bayley score
For the other outcomes, the working group did not define the outcome measures a priori but used the definitions used in the studies.
The working group defined a 1% difference for neonatal death (RR < 0.99 or > 1.01) and 10% difference for neurodevelopmental impairment (RR < 0.9 or > 1.10) as minimal clinically (patient) important difference. For the other outcomes, a 25% difference for dichotomous outcomes (RR < 0.8 or > 1.25) and 0.5 SD for continuous outcomes was taken as minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2008 until the 4th of August, 2023. The search was updated on the 25th of March, 2024 resulting in 41 additional hits. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 523 hits.
Studies were selected based on the following criteria:
- Systematic review (searched in at least two databases, and detailed search strategy, risk of bias assessment and results of individual studies available), randomized controlled trial, or observational studies comparing magnesium sulphate with no magnesium sulphate;
- The study population had to meet the criteria as defined in the PICO; and
- Full-text English language publication;
Fifty-two studies were initially selected based on title and abstract screening. After reading the full text, 47 studies were excluded (see the table with reasons for exclusion under the tab Methods), and five studies were included.
Results
Five studies were included in the analysis of the literature. Important study characteristics and results are summarized in table 1 and the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables. A subgroup analysis was performed based on gestational age: <30 weeks and >30 weeks of gestation.
Referenties
- Chollat C, Enser M, Houivet E, Provost D, Bénichou J, Marpeau L, Marret S. School-age outcomes following a randomized controlled trial of magnesium sulfate for neuroprotection of preterm infants. J Pediatr. 2014 Aug;165(2):398-400.e3. doi: 10.1016/j.jpeds.2014.04.007. Epub 2014 May 14. PMID: 24837863.
- Crowther CA, Hiller JE, Doyle LW, Haslam RR; Australasian Collaborative Trial of Magnesium Sulphate (ACTOMg SO4) Collaborative Group. Effect of magnesium sulfate given for neuroprotection before preterm birth: a randomized controlled trial. JAMA. 2003 Nov 26;290(20):2669-76. doi: 10.1001/jama.290.20.2669. PMID: 14645308.
- Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, Marret S, Doyle LW; AMICABLE Group. Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis. PLoS Med. 2017 Oct 4;14(10):e1002398. doi: 10.1371/journal.pmed.1002398. PMID: 28976987; PMCID: PMC5627896.
- Crowther CA, Ashwood P, Middleton PF, McPhee A, Tran T, Harding JE; MAGENTA Study Group. Prenatal Intravenous Magnesium at 30-34 Weeks' Gestation and Neurodevelopmental Outcomes in Offspring: The MAGENTA Randomized Clinical Trial. JAMA. 2023 Aug 15;330(7):603-614. doi: 10.1001/jama.2023.12357. PMID: 37581672; PMCID: PMC10427942.
- Doyle LW, Anderson PJ, Haslam R, Lee KJ, Crowther C; Australasian Collaborative Trial of Magnesium Sulphate (ACTOMgSO4) Study Group. School-age outcomes of very preterm infants after antenatal treatment with magnesium sulfate vs placebo. JAMA. 2014 Sep 17;312(11):1105-13. doi: 10.1001/jama.2014.11189. PMID: 25226476.
- Marret S, Marpeau L, Zupan-Simunek V, Eurin D, Lévêque C, Hellot MF, Bénichou J; PREMAG trial group. Magnesium sulphate given before very-preterm birth to protect infant brain: the randomised controlled PREMAG trial*. BJOG. 2007 Mar;114(3):310-8. doi: 10.1111/j.1471-0528.2006.01162.x. Epub 2006 Dec 4. PMID: 17169012.
- Mittendorf R, Pryde PG, Lee KS. Association between use of antenatal magnesium sulfate in preterm labor and adverse health outcomes in infants. Am J Obstet Gynecol. 2003 Aug;189(2):613. doi: 10.1067/s0002-9378(03)00475-7. PMID: 14524362.
- Rouse DJ, Hirtz DG, Thom E, Varner MW, Spong CY, Mercer BM, Iams JD, Wapner RJ, Sorokin Y, Alexander JM, Harper M, Thorp JM Jr, Ramin SM, Malone FD, Carpenter M, Miodovnik M, Moawad A, O'Sullivan MJ, Peaceman AM, Hankins GD, Langer O, Caritis SN, Roberts JM; Eunice Kennedy Shriver NICHD Maternal-Fetal Medicine Units Network. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. N Engl J Med. 2008 Aug 28;359(9):895-905. doi: 10.1056/NEJMoa0801187. PMID: 18753646; PMCID: PMC2803083.
- Shepherd ES, Goldsmith S, Doyle LW, Middleton P, Marret S, Rouse DJ, Pryde P, Wolf HT, Crowther CA. Magnesium sulphate for women at risk of preterm birth for neuroprotection of the fetus. Cochrane Database Syst Rev. 2024 May 10;5(5):CD004661. doi: 10.1002/14651858.CD004661.pub4. PMID: 38726883; PMCID: PMC11082932.
- Wolf HT, Brok J, Henriksen TB, Greisen G, Salvig JD, Pryds O, Hedegaard M, Weber T, Hegaard HK, Pinborg A, Huusom LD; MASP research group. Antenatal magnesium sulphate for the prevention of cerebral palsy in infants born preterm: a double-blind, randomised, placebo-controlled, multi-centre trial. BJOG. 2020 Sep;127(10):1217-1225. doi: 10.1111/1471-0528.16239. Epub 2020 Apr 29. PMID: 32237024.
- Wolf HT, Huusom LD, Henriksen TB, Hegaard HK, Brok J, Pinborg A. Magnesium sulphate for fetal neuroprotection at imminent risk for preterm delivery: a systematic review with meta-analysis and trial sequential analysis. BJOG. 2020 Sep;127(10):1180-1188. doi: 10.1111/1471-0528.16238. Epub 2020 May 17. PMID: 32237069.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question:
What are the (un)favorable effects of giving magnesium sulphate to pregnant women with threatened preterm birth between 24 and 34 weeks compared to no magnesium sulphate on the morbidity and mortality of mother and child?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Wolf, 2020
[individual study characteristics deduced from Wolf, 2020]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to October/2019
A: Mittendorf, 2002 B: Crowther, 2003 C: Marret, 2006 D: Rouse, 2008 E: Wolf, 2020 F: Duley, 2007
Study design: RCT
Setting and Country: A: USA B: Australia C: France D: USA E: Denmark F: 33 countries
Source of funding and conflicts of interest: Not reported for individual studies
|
Inclusion criteria SR: - Peer-reviewed publications comparing intravenous MgSO4 treatment with placebo at the time of imminent preterm delivery. - Trials were included if they reported neonatal mortality and infant and child neurological impairment outcomes (≥12- month follow up).
Exclusion criteria SR: Not reported
6 studies included
Important patient characteristics at baseline:
N, gestational age A: n=149. Gestational age: 25-33 weeks B: n=1062. Gestational age: <30 weeks C: n=573. Gestational age: <33 weeks D: n=2,241. Gestational age: 24 to 31 weeks E: n=560. Gestational age: 24 to 31 weeks F: n=10,141. Gestational age: no limitations (<37 weeks)
Groups probably comparable at baseline |
Magnesium sulphate
A: bolus dose 4 grams, maintenance dose 0 or 2-3 grams/hour B: bolus dose 4 grams, maintenance dose 2 grams/hour C: bolus dose 4 grams, maintenance dose 0 gram/hour D: bolus dose 6 grams, maintenance dose 2 grams/hour E: bolus dose 5 grams, maintenance dose 1 gram/hour F: bolus dose 4 grams, maintenance dose 1 gram/hour
|
A: placebo B: placebo C: placebo D: placebo E: placebo F: placebo |
End-point of follow-up: A: 18 months B: 24 months C: 24 months D: 24 months E: 24 months F: 18 months
For how many participants were no complete outcome data available? Not reported
|
Cerebral palsy (any) Effect measure: RR [95% CI]: A: 0.94 [0.20 to 4.53] B: 0.85 [0.55 to 1.31] C: 0.70 [0.41 to 1.19] D: 0.59 [0.40 to 0.85] E: 0.62 [0.31 to 1.26] F: 0.40 [0.08 to 2.05]
Pooled effect (random effects model): 0.68 [95% CI 0.54 to 0.86] favoring magnesium Heterogeneity (I2): 0%
Mortality (total until final follow-up) Effect measure: RR [95% CI]: A: 8.47 [1.10 to 65.36] B: 0.81 [0.61 to 1.07] C: 0.87 [0.55 to 1.38] D: 1.18 [0.89 to 1.55] E: 0.90 [0.52 to 1.57] F: 1.11 [0.93 to 1.31]
Pooled effect (random effects model): 1.01 [95% CI 0.83 to 1.23] Heterogeneity (I2): 46%
Intraventricular hemorrhage (any) Effect measure: RR [95% CI]: A: 1.11 [0.53 to 2.34] B: 1.11 [0.92 to 1.34] C: 0.83 [0.62 to 1.09] D: 0.91 [0.78 to 1.08] E: 0.79 [0.56 to 1.11]
Pooled effect (random effects model): 0.94 [95% CI 0.83 to 1.07] favoring magnesium Heterogeneity (I2): 19%
|
Risk of bias (high, some concerns or low): Tool used by authors: Cochrane Collaboration risk of bias tool for randomised controlled trials
A: Low B: Low C: High D: Low E: Low F: Some concerns
Brief description of author’s conclusion This systematic review with meta-analysis and TSA shows conclusively that MgSO4, when given to women at imminent risk for preterm delivery, decreases the offspring’s CP risk.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question - Search is of low quality: no field codes, truncation, proximity parameters and keywords used - Conflicts of interest and source of funding not reported.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses: Subgroup analyses were performed on plurality, gestational age at randomisation, intention of the treatment and dosage of MgSO4
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) Heterogeneity was assessed by I2, with I2 >50% considered to indicate important heterogeneity. No important heterogeneity was present.
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Research question:
What are the (un)favorable effects of giving magnesium sulphate to pregnant women with threatened preterm birth between 24 and 34 weeks compared to no magnesium sulphate on the morbidity and mortality of mother and child?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Chollat, 2014 |
Type of study: Follow-up of RCT (Marret 2006)
Setting and country France
Funding and conflicts of interest: Funded by European Regional Development Fund and the Upper-Normandy region. The authors declare no conflicts of interest.
|
Inclusion criteria: Women with gestational age <33 weeks (more details reported in Marret 2006)
Exclusion criteria: Reported in Marret 2006
N total at baseline: Intervention: 266 women (352 children) Control: 278 women (336 children)
Important prognostic factors2 Gestational age I: 29.9 weeks (SD=2.0) C: 30.1 weeks (SD=1.9)
Birth weight I: 1397 grams (SD=24) C: 1476 grams (SD=25)
Male sex I: 117 (53.7%) C: 82 (38.5%)
Groups were comparable at baseline except for sex and birth weight
|
Magnesium sulphate: 4 grams |
Placebo |
Length of follow-up: 2 years & school-age (7 to 14 years)
Loss-to-follow-up: Intervention: 134 (38.1%) Reasons: deaths, have not been found or declined to participate
Control: 123 (36.6%) Reasons: deaths, have not been found or declined to participate
Incomplete outcome data: For outcome CP: No data available for 2 infants in placebo group |
CP at school-age (mild to moderate or severe) I: 30/218 (13.8%) C: 33/211 (15.6%)
Overall deficits (CP, cognitive deficit/learning disability and psychiatric disorder) I: 166/218 (76.1%) C: 173/211 (82.0%)
|
Author’s conclusion Motor dysfunction/death, qualitative behavioral disorders, cognitive difficulties, school grade repetition, and education services were decreased in the children exposed to MgSO4, although the differences were not significant
Limitations: - Small number of participants - High lost to follow-up - Based on questionnaires |
|
Crowther, 2023 |
Type of study: RCT
Setting and country: 24 Australian and New Zealand hospitals between January 2012 and April 2018.
Funding and conflicts of interest: This trial was funded by grant 1022968 from the National Health and Medical Research Council in Australia and grants PG5716 and PG01817 from the Cerebral Palsy Alliance Research Foundation Australia. No conflicts of interest were reported.
|
Inclusion criteria: - Women at risk of preterm birth between 30 and 34 weeks of gestation - Written consent - Birth was planned or definitely expected within 24 hours - No contraindications (such as respiratory depression, hypotension, absent patellar reflexes, kidney failure, or myasthenia gravis) to the use of prenatal magnesium sulphate.
Exclusion criteria: - If magnesium sulphate therapy was considered essential for the treatment of preeclampsia
N total at baseline: Intervention: 729 women (858 infants) Control: 704 women (821 infants)
Important prognostic factors2 Age I: 30.5 ± 6.2 C: 30.6 ± 6.9
Gestational age 30-<32 I: 323 (44.3%) C: 308 (43.8%)
32-<34 I: 406 (55.7%) C: 396 (56.3%)
Groups were comparable at baseline
|
Magnesium sulphate: 4 grams |
Placebo (an isotonic sodium chloride solution) |
Length of follow-up 2 years
Loss-to-follow-up: Intervention: 33 (3.8%) Reasons: deaths, unable to contact or lost to follow-up
Control: 32 (3.9%) Reasons: deaths, unable to contact or lost to follow-up
Incomplete outcome data: Not reported |
Any death (death of live-born infant before hospital discharge or death after discharge and <2 years) I: 12/837 (1.4%) C: 7/796 (0.9%)
Cerebral palsy (at 2 years corrected age) I: 11/679 (1.6%) C: 11/667 (1.7%)
Developmental delay I: 132/624 (21%) C: 149/622 (24%)
IVH (any) I: 56/854 (6.6%) C: 55/818 (6.7%)
Cystic periventricular leukomalacia I: 2/854 (0.4%) C: 6/818 (0.7%)
Respiratory depression I: 5/690 (0.7%) C: 3/667 (0.5%)
Maternal mortality No cases
Cardiac arrest No cases |
Author’s conclusion Administration of intravenous magnesium sulphate prior to preterm birth at 30 to 34 weeks’ gestation did not improve child survival free of cerebral palsy at 2 years, although the study had limited power to detect small between-group differences.
Remarks: - Limited power - Incomplete outcome data for primary outcome - Unknown efficacy and safety in lower-resource settings |
|
Doyle, 2014 |
Type of study: Follow-up of RCT (Crowther 2003)
Setting and country: 16 centers in Australia and New Zealand
Funding and conflicts of interest: Funded by a project grant from the National Health and Medical Research Council Australia and the Victorian Government’s Operational Infrastructure Support Program. No conflicts of interest.
|
Inclusion criteria: Women with a gestational age <30 weeks for whom birth was planned or expected within 24 hours
Exclusion criteria Reported in Crowther 2003
N total at baseline: Intervention: 443 Control: 424
Important prognostic factors2 Gestational age at birth (mean± SD) I: 27.3 ± 2.2 C: 27.4 ± 2.0
Groups were comparable at baseline. |
Magnesium sulphate: 4 gram loading dose; 1 g/h maintenance, for up to a maximum of 24 hours |
Normal saline placebo |
Length of follow-up Follow-up at 6 to 11 years of age
Loss-to-follow-up: Intervention: 109 (24.6%) Reasons: lost to follow-up or refused
Control: 89 (21.0%) Reasons: lost to follow-up or refused
Incomplete outcome data: Not reported, but analysis using multiple imputation to handle missing data
|
Cerebral palsy (up to follow-up at 6 to 11 years) I: 23/295 (8%) C: 21/314 (7%)
Neurosensory disability I: 83/257 (32.3%) C: 83/254 (32.7%) |
Author’s conclusion Magnesium sulphate given to pregnant women at imminent risk of birth before 30 weeks’ gestation was not associated with neurological, cognitive, behavioral, growth, or functional outcomes in their children at school age, although a mortality advantage cannot be excluded.
Limitations High rate lost to follow-up
|
|
Sheeba, 2022 |
Type of study: Hospital-based, prospective interventional study open label, randomised controlled trial
Setting and country: Department of Neonatology at Jubilee Mission Medical College in Central Kerala, India
Funding and conflicts of interest: Source of funding not reported. No conflicts of interest.
|
Inclusion criteria: Women with a gestational age between 24 and 34 weeks and if birth was expected within 24 hours
Exclusion criteria: - Maternal hypotension - Renal insufficiency - Electrolyte insufficiency - Infants with severe malformations such as neural tube defects and chromosomal abnormalities like trisomies that would interfere with assessment of tone and developmental milestones
N total at baseline: Intervention: 45 Control: 45
Important prognostic factors2: Gestational age (weeks) >32 weeks I: 27 (67.5%) C: 26 (60.5%)
Gestational age (weeks) £32 weeks I: 13 (32.5%) C: 17 (29.5%)
Groups comparable at baseline
|
4 grams magnesium sulphate bolus initially followed by an infusion of 1 gram/hour for 24 hours or until birth
|
Placebo infusion of normal saline
|
Length of follow-up: Up to six months
Loss-to-follow-up: Intervention: 5 (11.1%) Reasons: not reported
Control: 2 (4.4%) Reasons: not reported
Incomplete outcome data: Not reported
|
Neonatal death I: 1 (2.5%) C: 4 (9.3%)
Developmental delay (assessed with Trivandrum Development Screening Chart) I: 23/43 (53.5%) C: 3/40 (7.5%)
|
Author’s conclusion Although the percentage of neonatal deaths in the magnesium sulphate group were less, it was not statistically significant. Amiel-Tison angle abnormalities were significantly less in the group which received magnesium sulphate. Neurodevelopmental outcome as assessed by TDSC was also significantly less in the group which received magnesium sulphate. This suggests that antenatal magnesium sulphate protects preterm babies from cerebral palsy and neurodevelopmental disabilities. A larger study with a longer follow-up is suggested to confirm these finding.
Limitations - Small sample size - Open label study |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question:
What are the (un)favorable effects of giving magnesium sulphate to pregnant women with threatened preterm birth between 24 and 34 weeks compared to no magnesium sulphate on the morbidity and mortality of mother and child?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Chollat, 2014 (follow-up of Marret 2006) |
Definitely yes;
Reason: Randomization numbers were generated by computer. |
Definitely yes;
Reason: Participating centers were unaware of treatment allocation.
|
Probably no;
Reason: Patients were blinded, but no blinding of medical staff |
Probably no;
Reason: Drop-out rate was high |
Probably yes;
Reason: All relevant outcomes were reported. |
Probably yes;
|
Some concerns |
|
Crowther, 2023 |
Definitely yes;
Reason: Randomized by central telephone randomization service. Randomization schedule used balanced, variable block sizes.
|
Definitely yes;
Reason: Randomization was performed by an investigator not involved in clinical care. |
Definitely yes;
Reason: Participants, staff, investigators, and assessors were blinded.
|
Probably yes;
Reason: Loss to follow-up was infrequent and similar for both groups. |
Probably yes;
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
LOW |
|
Doyle, 2014 (follow-up of Crowther, 2003) |
Definitely yes;
Reason: Randomization numbers were generated by computer with variable block sizes of 4, 6, or 8 and managed by nonclinical staff.
|
Definitely yes;
Reason: Masked treatment pack. |
Definitely yes;
Reason: Participants and medical staff were blinded. |
Probably no;
Reason: Drop-out rate was high.
|
Probably yes;
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
Some concerns |
|
Sheeba, 2022 |
No information;
Reason: Participants were randomized but method of randomization was not reported. |
Definitely yes;
Reason: Sealed envelopes were used.
|
Definitely no;
Reason: open-label. Intervention not concealed from patients.
|
Probably yes;
Reason: Loss to follow-up was infrequent.
|
Probably yes;
Reason: All relevant outcomes were reported. |
Probably yes;
Reason: No other problems noted. |
Some concerns |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Bachnas MA, Akbar MIA, Dachlan EG, Dekker G. The role of magnesium sulfate (MgSO4) in fetal neuroprotection. J Matern Fetal Neonatal Med. 2021 Mar;34(6):966-978. doi: 10.1080/14767058.2019.1619688. Epub 2019 May 27. PMID: 31092073. |
Wrong study design: narrative review |
|
Bain E, Middleton P, Crowther CA. Different magnesium sulphate regimens for neuroprotection of the fetus for women at risk of preterm birth. Cochrane Database Syst Rev. 2012 Feb 15;(2):CD009302. doi: 10.1002/14651858.CD009302.pub2. PMID: 22336863. |
Other study aim: different regimens |
|
Binder C, Schmid P, Abele H, Graf J. Does Antenatal MgSO 4 Administration to the Mother in the Event of Imminent Premature Birth Reduce the Occurrence of Infantile Cerebral Palsy in the Child? - An Umbrella Review. Geburtshilfe Frauenheilkd. 2023 May 4;83(5):602-611. doi: 10.1055/a-2049-2976. PMID: 37169015; PMCID: PMC10165730. |
Wrong study design: review of systematic reviews |
|
Binder C, Schmid P, Abele H, Graf J. Does Antenatal MgSO 4 Administration to the Mother in the Event of Imminent Premature Birth Reduce the Occurrence of Infantile Cerebral Palsy in the Child? - An Umbrella Review. Geburtshilfe Frauenheilkd. 2023 May 4;83(5):602-611. doi: 10.1055/a-2049-2976. PMID: 37169015; PMCID: PMC10165730. |
Duplicate; wrong study design: review of systematic reviews |
|
Cahill AG, Stout MJ, Caughey AB. Intrapartum magnesium for prevention of cerebral palsy: continuing controversy? Curr Opin Obstet Gynecol. 2010 Apr;22(2):122-7. doi: 10.1097/GCO.0b013e3283372312. PMID: 20179596. |
Wrong study design: narrative review |
|
Conde-Agudelo A, Romero R. Antenatal magnesium sulfate for the prevention of cerebral palsy in preterm infants less than 34 weeks' gestation: a systematic review and metaanalysis. Am J Obstet Gynecol. 2009 Jun;200(6):595-609. doi: 10.1016/j.ajog.2009.04.005. PMID: 19482113; PMCID: PMC3459676. |
More recent systematic review with almost same studies included |
|
Crowther CA, Brown J, McKinlay CJ, Middleton P. Magnesium sulphate for preventing preterm birth in threatened preterm labour. Cochrane Database Syst Rev. 2014 Aug 15;2014(8):CD001060. doi: 10.1002/14651858.CD001060.pub2. PMID: 25126773; PMCID: PMC10838393. |
Other study aim: magnesium to prevent prematurity |
|
Crowther CA, Middleton PF, Voysey M, Askie L, Duley L, Pryde PG, Marret S, Doyle LW; AMICABLE Group. Assessing the neuroprotective benefits for babies of antenatal magnesium sulphate: An individual participant data meta-analysis. PLoS Med. 2017 Oct 4;14(10):e1002398. doi: 10.1371/journal.pmed.1002398. PMID: 28976987; PMCID: PMC5627896. |
Better systematic review available |
|
Crowther CA, Middleton PF, Wilkinson D, Ashwood P, Haslam R; MAGENTA Study Group. Magnesium sulphate at 30 to 34 weeks' gestational age: neuroprotection trial (MAGENTA)--study protocol. BMC Pregnancy Childbirth. 2013 Apr 9;13:91. doi: 10.1186/1471-2393-13-91. PMID: 23570677; PMCID: PMC3636106. |
Wrong study design: protocol |
|
Dehaene I, Van Steenstraeten T, De Coen K, De Buyser S, Decruyenaere J, Smets K, Roelens K. Neonatal magnesium levels are safe after maternal MgSO4 administration: a comparison between unexposed preterm neonates and neonates exposed for fetal neuroprotection or maternal eclampsia prevention-a cohort study. Eur J Pediatr. 2022 Aug;181(8):2971-2980. doi: 10.1007/s00431-022-04507-7. Epub 2022 May 21. Erratum in: Eur J Pediatr. 2023 Mar;182(3):1433. doi: 10.1007/s00431-022-04774-4. PMID: 35595861. |
Study design: retrospective study |
|
De Jesus LC, Sood BG, Shankaran S, Kendrick D, Das A, Bell EF, Stoll BJ, Laptook AR, Walsh MC, Carlo WA, Sanchez PJ, Van Meurs KP, Bara R, Hale EC, Newman NS, Ball MB, Higgins RD; Eunice Kennedy Shriver National Institute of Health and Human Development Neonatal Research Network. Antenatal magnesium sulfate exposure and acute cardiorespiratory events in preterm infants. Am J Obstet Gynecol. 2015 Jan;212(1):94.e1-7. doi: 10.1016/j.ajog.2014.07.023. Epub 2014 Jul 18. PMID: 25046806; PMCID: PMC4275326. |
Study design: retrospective study |
|
Drassinower D, Friedman AM, Levin H, Običan SG, Gyamfi-Bannerman C. Does magnesium exposure affect neonatal resuscitation? Am J Obstet Gynecol. 2015 Sep;213(3):424.e1-5. doi: 10.1016/j.ajog.2015.05.052. Epub 2015 May 27. PMID: 26026919. |
Wrong outcomes |
|
Edwards JM, Edwards LE, Swamy GK, Grotegut CA. Magnesium sulfate for neuroprotection in the setting of chorioamnionitis. J Matern Fetal Neonatal Med. 2018 May;31(9):1156-1160. doi: 10.1080/14767058.2017.1311312. Epub 2017 Apr 11. PMID: 28395549. |
Wrong study design: secondary analysis analyzed as cohort study |
|
Edwards HB, Redaniel MT, Sillero-Rejon C, Pithara-McKeown C, Margelyte R, Stone T, Peters TJ, Hollingworth W, McLeod H, Craggs P, Hill EM, Redwood S, Treloar E, Donovan JL, Opmeer BC, Luyt K. Quality improvement interventions to increase the uptake of magnesium sulphate in preterm deliveries for the prevention of cerebral palsy (PReCePT study): a cluster randomised controlled trial. BJOG. 2024 Feb;131(3):256-266. doi: 10.1111/1471-0528.17651. Epub 2023 Sep 10. PMID: 37691262. |
Wrong outcome: magnesium sulphate uptake |
|
Fernández Monteagudo B, Villar Castro S, Carrascosa García P, Zeballos Sarrato S, Sánchez Luna M. Neuroprotective effect of magnesium sulfate in premature infants. Analysis after establishing an antenatal administration protocol in a tertiary care hospital. An Pediatr (Engl Ed). 2023 Oct;99(4):224-231. doi: 10.1016/j.anpede.2023.07.007. Epub 2023 Sep 21. PMID: 37741767. |
Study design: retrospective study |
|
Garg BD. Antenatal magnesium sulfate is beneficial or harmful in very preterm and extremely preterm neonates: a new insight. J Matern Fetal Neonatal Med. 2019 Jun;32(12):2084-2090. doi: 10.1080/14767058.2018.1424823. Epub 2018 Jan 17. PMID: 29301419. |
Wrong study design: narrative review |
|
Gupta A, Mishra S. Magnesium Sulfate for Fetal Neuroprotection in Women at Risk of Preterm Birth: Analysis of its Effect on Cerebral Palsy. Journal of South Asian Federation of Obstetrics and Gynaecology. 2021; 13(3), 90-93. |
Very low study quality; also women with gestational age >34 weeks |
|
Hirtz DG, Weiner SJ, Bulas D, DiPietro M, Seibert J, Rouse DJ, Mercer BM, Varner MW, Reddy UM, Iams JD, Wapner RJ, Sorokin Y, Thorp JM Jr, Ramin SM, Malone FD, Carpenter MW, O'Sullivan MJ, Peaceman AM, Hankins GD, Dudley D, Caritis SN; Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Antenatal Magnesium and Cerebral Palsy in Preterm Infants. J Pediatr. 2015 Oct;167(4):834-839.e3. doi: 10.1016/j.jpeds.2015.06.067. Epub 2015 Aug 5. PMID: 26254839; PMCID: PMC4587284. |
Secondary analysis of Rouse 2008, but reported same outcomes (not able to pool results) |
|
Hurrion EM, Badawi N, Boyd RN, Morgan C, Gibbons K, Hennig S, Koorts P, Chauhan M, Bowling F, Flenady V, Kumar S, Dawson PA. SuPreme Study: a protocol to study the neuroprotective potential of sulfate among very/extremely preterm infants. BMJ Open. 2023 Jul 14;13(7):e076130. doi: 10.1136/bmjopen-2023-076130. PMID: 37451710; PMCID: PMC10351292. |
Wrong study design: protocol |
|
Kamyar M, Clark EA, Yoder BA, Varner MW, Manuck TA. Antenatal Magnesium Sulfate, Necrotizing Enterocolitis, and Death among Neonates < 28 Weeks Gestation. AJP Rep. 2016 Mar;6(1):e148-54. doi: 10.1055/s-0036-1581059. PMID: 27054046; PMCID: PMC4816636. |
Wrong comparison: NICU death or stage II/III NEC versus survived NICU, no stage II/III NEC |
|
Kamyar M, Manuck TA, Stoddard GJ, Varner MW, Clark E. Magnesium sulfate, chorioamnionitis, and neurodevelopment after preterm birth. BJOG. 2016 Jun;123(7):1161-6. doi: 10.1111/1471-0528.13460. Epub 2015 Jun 3. PMID: 26036660. |
Same population and subgroup analysis as Edwards 2017 (that matched PICO better) |
|
Kobayashi A, Ito M, Ota E, Namba F. School-Age Outcomes of Antenatal Magnesium Sulphate in Preterm Infants. Children (Basel). 2023 Jul 31;10(8):1324. doi: 10.3390/children10081324. PMID: 37628323; PMCID: PMC10453514. |
Similar to systematic review of Wolf 2020, but Wolf 2020 had more outcomes of interest |
|
Kumar N, Kumar P, Kumar S, Tulsiyan P. Antenatal Low Dose Magnesium Sulphate for Foetal Neuroprotection in Preterm Birth Versus Control: A Comparative Prospective Cohort Study in Tertiary Care Centre in India. The Journal of Obstetrics and Gynecology of India. 2023 Dec 2:1-7. |
Study design: retrospective study |
|
Marret S, Marpeau L, Follet-Bouhamed C, Cambonie G, Astruc D, Delaporte B, Bruel H, Guillois B, Pinquier D, Zupan-Simunek V, Bénichou J; le groupe PREMAG. Effet du sulfate de magnésium sur la mortalité et la morbidité neurologique chez le prématuré de moins de 33 semaines, avec recul à deux ans: résultats de l'essai prospectif multicentrique contre placebo PREMAG [Effect of magnesium sulphate on mortality and neurologic morbidity of the very-preterm newborn (of less than 33 weeks) with two-year neurological outcome: results of the prospective PREMAG trial]. Gynecol Obstet Fertil. 2008 Mar;36(3):278-88. French. doi: 10.1016/j.gyobfe.2008.01.012. Epub 2008 Mar 11. PMID: 18337147. |
Article in French |
|
McLeod RM, Rosenkrantz TS, Fitch RH. Antenatal Magnesium Sulfate Benefits Female Preterm Infants but Results in Poor Male Outcomes. Pharmaceuticals (Basel). 2024 Feb 7;17(2):218. doi: 10.3390/ph17020218. PMID: 38399433; PMCID: PMC10892166. |
Study design: retrospective study |
|
Muhammed HO, Murad SJ. Effect of Prenatal Infusion of Magnesium Sulphate on Neurological Complication in Preterm Infant. International Journal of Pharmaceutical Research. 2019; 11(3). |
Very low study quality |
|
Nisha K, Jha R. Fetomaternal Outcome in Patients with Early Preterm Labour Following Administration of Magnesium Sulphate-A Hospital Based Observational Study. International Journal of Pharmaceutical and Clinical Research. 2024; 16(1): 950-956. |
Study design: retrospective study |
|
Nguyen TM, Crowther CA, Wilkinson D, Bain E. Magnesium sulphate for women at term for neuroprotection of the fetus. Cochrane Database Syst Rev. 2013 Feb 28;(2):CD009395. doi: 10.1002/14651858.CD009395.pub2. PMID: 23450601. |
Wrong population: at term |
|
Numoto S, Kakita H, Takeshita S, Ueda H, Kondo T, Kurahashi H, Wakatsuki A, Yamada Y, Okumura A. Effects of maternal magnesium sulfate treatment on newborns. Pediatrics International. 2022 Jan;64(1):e14747. |
Study design: retrospective study |
|
Okito O, Aromolaran A, Massa-Buck B, Abdelatif D, Aly H, Mohamed MA. Antenatal magnesium sulfate and the need for mechanical ventilation in the first three days of life. Pediatr Neonatol. 2023 Nov;64(6):644-650. doi: 10.1016/j.pedneo.2022.10.008. Epub 2023 May 11. PMID: 37280122. |
Wrong comparison: intubated anytime during the first three days of life were compared to those who were not intubated |
|
Parashi S, Bordbar A, Mahmoodi Y, Jafari MR. The survey of magnesium sulfate in prevention of intraventricular hemorrhage in premature infants: a randomized clinical trial. Shiraz E-Medical Journal. 2017; 18(11). |
Very low study quality |
|
Pergialiotis V, Bellos I, Constantinou T, Voskos A, Papapanagiotou A, Loutradis D, Daskalakis G. Magnesium sulfate and risk of postpartum uterine atony and hemorrhage: A meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2021 Jan;256:158-164. doi: 10.1016/j.ejogrb.2020.11.005. Epub 2020 Nov 10. PMID: 33246200. |
Wrong outcomes |
|
Poppe T, Thompson B, Boardman JP, Bastin ME, Alsweiler J, Deib G, Harding JE, Crowther CA; MagNUM Study Group. Effect of antenatal magnesium sulphate on MRI biomarkers of white matter development at term equivalent age: The magnum study. EBioMedicine. 2020 Sep;59:102957. doi: 10.1016/j.ebiom.2020.102957. Epub 2020 Aug 25. Retraction in: EBioMedicine. 2022 Apr;78:103966. doi: 10.1016/j.ebiom.2022.103966. Retracted and republished in: EBioMedicine. 2022 Apr;78:103923. doi: 10.1016/j.ebiom.2022.103923. PMID: 32858399; PMCID: PMC7452670. |
Article retracted and republished in 2022 |
|
Poppe T, Thompson B, Boardman JP, Bastin ME, Alsweiler J, Deib G, Harding JE, Crowther CA; MagNUM Study Group. Effect of antenatal magnesium sulphate on MRI biomarkers of white matter development at term equivalent age: The MagNUM Study. EBioMedicine. 2022 Apr;78:103923. doi: 10.1016/j.ebiom.2022.103923. Epub 2022 Mar 21. PMID: 35331677; PMCID: PMC9043972. |
Study design: cohort study |
|
Prasath A, Aronoff N, Chandrasekharan P, Diggikar S. Antenatal Magnesium Sulfate and adverse gastrointestinal outcomes in Preterm infants-a systematic review and meta-analysis. J Perinatol. 2023 Sep;43(9):1087-1100. doi: 10.1038/s41372-023-01710-8. Epub 2023 Jun 30. PMID: 37391507. |
Wrong outcomes |
|
Prasath A, Aronoff N, Chandrasekharan P, Diggikar S. Antenatal Magnesium Sulfate and adverse gastrointestinal outcomes in Preterm infants-a systematic review and meta-analysis. J Perinatol. 2023 Sep;43(9):1087-1100. doi: 10.1038/s41372-023-01710-8. Epub 2023 Jun 30. PMID: 37391507. |
Duplicate; Wrong outcomes |
|
Rouse DJ, Hirtz DG, Thom E, Varner MW, Spong CY, Mercer BM, Iams JD, Wapner RJ, Sorokin Y, Alexander JM, Harper M, Thorp JM Jr, Ramin SM, Malone FD, Carpenter M, Miodovnik M, Moawad A, O'Sullivan MJ, Peaceman AM, Hankins GD, Langer O, Caritis SN, Roberts JM; Eunice Kennedy Shriver NICHD Maternal-Fetal Medicine Units Network. A randomized, controlled trial of magnesium sulfate for the prevention of cerebral palsy. N Engl J Med. 2008 Aug 28;359(9):895-905. doi: 10.1056/NEJMoa0801187. PMID: 18753646; PMCID: PMC2803083. |
Included in systematic review of Wolf 2020 |
|
Rouse DJ. Magnesium sulfate for the prevention of cerebral palsy. American journal of obstetrics and gynecology. 2009 Jun 1;200(6):610-2. |
Better systematic review available |
|
Shepherd E, Salam RA, Manhas D, Synnes A, Middleton P, Makrides M, Crowther CA. Antenatal magnesium sulphate and adverse neonatal outcomes: A systematic review and meta-analysis. PLoS Med. 2019 Dec 6;16(12):e1002988. doi: 10.1371/journal.pmed.1002988. PMID: 31809499; PMCID: PMC6897495. |
More recent systematic review with almost same studies included |
|
Shepherd E, Salam RA, Middleton P, Makrides M, McIntyre S, Badawi N, Crowther CA. Antenatal and intrapartum interventions for preventing cerebral palsy: an overview of Cochrane systematic reviews. Cochrane Database Syst Rev. 2017 Aug 8;8(8):CD012077. doi: 10.1002/14651858.CD012077.pub2. PMID: 28786098; PMCID: PMC6483544. |
Wrong study design: review of Cochrane reviews |
|
Stockley EL, Ting JY, Kingdom JC, McDonald SD, Barrett JF, Synnes AR, Monterrosa L, Shah PS; Canadian Neonatal Network; Canadian Neonatal Follow-up Network; Canadian Preterm Birth Network Investigators. Intrapartum magnesium sulfate is associated with neuroprotection in growth-restricted fetuses. Am J Obstet Gynecol. 2018 Dec;219(6):606.e1-606.e8. doi: 10.1016/j.ajog.2018.09.010. Epub 2018 Sep 18. PMID: 30240651. |
Study design: retrospective study |
|
Sung SI, Ahn SY, Choi SJ, Oh SY, Roh CR, Yang M, Chang YS, Park WS. Increased risk of meconium-related ileus in extremely premature infants exposed to antenatal magnesium sulfate. Neonatology. 2022 Jan 11;119(1):68-76. |
Wrong comparison: before, during, and after the adoption of the routine MgSO4 protocol (associated with meconium-related ileus risk) |
|
Turitz AL, Too GT, Gyamfi-Bannerman C. Proximity of magnesium exposure to delivery and neonatal outcomes. Am J Obstet Gynecol. 2016 Oct;215(4):508.e1-6. doi: 10.1016/j.ajog.2016.05.004. Epub 2016 May 10. PMID: 27177525. |
Other study aim: association of time from last exposure to magnesium with cerebral palsy |
|
Vilchez G, Dai J, Kumar K, Mundy D, Kontopoulos E, Sokol RJ. Racial/ethnic disparities in magnesium sulfate neuroprotection: a subgroup analysis of a multicenter randomized controlled trial. J Matern Fetal Neonatal Med. 2018 Sep;31(17):2304-2311. doi: 10.1080/14767058.2017.1342795. Epub 2017 Oct 4. PMID: 28612671. |
Other study aim: effect of race/ethnicity in maternal/infant outcomes after MgSO4 neuroprotection |
|
Weisz DE, Shivananda S, Asztalos E, Yee W, Synnes A, Lee SK, Shah PS; Canadian Neonatal Network. Intrapartum magnesium sulfate and need for intensive delivery room resuscitation. Arch Dis Child Fetal Neonatal Ed. 2015 Jan;100(1):F59-65. doi: 10.1136/archdischild-2013-305884. Epub 2014 Sep 17. PMID: 25232002. |
Study design: retrospective study |
|
Wolf HT, Brok J, Henriksen TB, Greisen G, Salvig JD, Pryds O, Hedegaard M, Weber T, Hegaard HK, Pinborg A, Huusom LD; MASP research group. Antenatal magnesium sulphate for the prevention of cerebral palsy in infants born preterm: a double-blind, randomised, placebo-controlled, multi-centre trial. BJOG. 2020 Sep;127(10):1217-1225. doi: 10.1111/1471-0528.16239. Epub 2020 Apr 29. PMID: 32237024. |
Included in systematic review of Wolf 2020 |
|
Zeng X, Xue Y, Tian Q, Sun R, An R. Effects and Safety of Magnesium Sulfate on Neuroprotection: A Meta-analysis Based on PRISMA Guidelines. Medicine (Baltimore). 2016 Jan;95(1):e2451. doi: 10.1097/MD.0000000000002451. PMID: 26735551; PMCID: PMC4706271. |
More recent systematic review with almost same studies included |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-08-2025
Beoordeeld op geldigheid : 03-06-2025
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) heeft een formele verklaring van geen bezwaar gegeven.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangeren waarbij sprake is van een dreigende vroeggeboorte.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, NVOG (voorzitter)
- Dr. J.B. (Jan) Derks, gynaecoloog-perinatoloog, NVOG
- Dr. A. (Ayten) Elvan-Taşpınar, gynaecoloog-perinatoloog, NVOG
- Dr. H.M. (Marieke) Knol, gynaecoloog-perinatoloog, NVOG
- Dr. M.A. (Marjon) de Boer, gynaecoloog-perinatoloog, NVOG
- Dr. D.N.M. (Dimitri) Papatsonis, gynaecoloog, NVOG
- Dr. D.E. (Lia) Wijnberger, gynaecoloog, NVOG
- Dr. P.H. (Dijk), kinderarts-neonatoloog, NVK
- Drs. L. (Leanne) Erkelens-de Vetten, kinderarts-neonataloog, NVK
- Drs. C. (Christel) Rolf, klinisch verloskundige, KNOV (tot maart 2023)
- Drs. C. (Cedric) van Uytrecht, klinisch verloskundige, KNOV (tot 15 augustus 2023)
- Drs. D. (Daphne) de Jong, eerstelijns verloskundige, KNOV (vanaf september 2023)
- Drs. M.A.M. (Machteld) van der Noll, verloskundige, KNOV
- Dr. I.F. (Igna) Kwint-Reijnders, patiëntenvertegenwoordiging Care4Neo
Klankbordgroep
- Drs. H.I. (Herma) Davelaar – van Zanten, V&VN Voortplanting, Obstetrie & Gynaecologie (tot mei 2024)
- Dhr. M. (Maikel) Hustinx, bestuurslid afdeling Vrouw & Kind V&VN (vanaf mei 2024)
Met ondersteuning van
- Drs. D.A.M. (Danique) Middelhuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. T. (Tessa) Geltink, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (tot april 2023)
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep |
||||
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter) |
Gynaecoloog-perinatoloog AmsterdamUMC |
Allen onbetaald: Adviesraad MADAM project Lid Raad kwaliteit FMS Organisatie en docent basiscursus prenatale counseling Amsterdam UMC Audit voorzitter in regio Amsterdam Lid Dagelijks bestuur koepel kwaliteit |
ZonMW subsidie voor onderzoek naar NIPT |
Geen restricties |
|
Knol |
Perinataloog Isala Kliniek Zwolle |
Lid werkgroep Otterlo NVOG Lid wetenschapscommissie NVOG Lokale hoofdonderzoeker consortiumstudie apostel 8 |
Geen |
Geen restricties |
|
Elvan-Taspinar |
Perinatoloog UMCG |
Instructeur MOET onbetaald |
Geen |
Geen restricties |
|
Van Uytrecht |
Physician Assistant- Obstetrie |
Training acute verloskunde te Medsim. Verloskundige/ Physician Assistant te Maxima Medisch Centrum te Veldhoven |
Geen |
Geen restricties |
|
Rolf |
Physician Assistant Obstetrie; functie van afdelingsarts op de high care verloskunde( OHC), Máxima MC. Betaalde functie |
Klinisch verloskundige, Máxima MC, betaalde functie |
Geen |
Geen restricties |
|
Papatsonis |
Gynaecoloog Amphia Ziekenhuis Breda |
Geen |
Geen |
Geen restricties |
|
Kwint-Reijnders |
Patientvertegenwoordiger namens Care4Neo, experienced expert |
Gynaecoloog i.o. VAGO afgevaardigde in het pijlerbestuur NVOG werkgroep foetomaternale geneeskunde |
In mijn werkzaamheden als gynaecoloog in opleiding werk ik zelf met dreigende vroeggeboorte casuïstiek en met collega's die uitvoering geven aan deze richtlijn. Daarnaast heb ik zitting als VAGO-afgevaardigde in het pijlerbestuur van de NVOG werkgroep foetomaternale geneeskunde, waarin ook onderwerpen geadresseerd worden die gerelateerd zijn aan dreigende vroeggeboorte. |
Geen restricties |
|
Derks |
Gynaecoloog, afdeling verloskunde, WKZ, UMCU.
|
Betrokken bij de richtlijn preventie vroeggeboorte, onderdeel van de Otterlo, deze commissie schrijft de verloskunde richtlijnen voor de NVOG |
Ik ben binnen mijn kliniek betrokken bij de behandeling van patienten met vroeggeboorte (in de anamnese). Gezien mijn expertise op dit gebied zie ik veel patienten met vroeggeboorte |
Geen retricties |
|
De Vetten |
Kinderarts-neonatoloog, Martini ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Wijnberger |
Gynaecoloog en perinatoloog Rijnstate Ziekenhuis Arnhem |
Lid werkgroep Otterlo (richtlijnontwikkeling) onbetaald Opleider, onbetaald |
Geen |
Geen restricties |
|
Van der Noll |
Klinisch verloskundige - Master Physician Assistant (inactief) Docent Verloskunde Ba-VKV Rotterdam (actief) |
Geen |
Geen |
Geen restricties |
|
De Boer |
Gynaecoloog |
Geen |
Geen |
Geen restricties |
|
Dijk |
Kinderarts-neonatoloog UMC Groningen |
Lidmaatschap Neonatologie Netwerk Nederland Lid LNR werkgroep Perined/NVK Lid werkgroep Nedederlands Kinderformularium NKFK Lid consortium PedMed-Nl Lid werkgroep revisie RL Hyperbilirubinemie Adviesraad N3 Adviesraad Zwangerschap en Geboorte Consortium Noord Nederland Lid werkgroep Kinderformularium Lid Pedmed Lid sectie Neonatologie Lid werkgroep SPIN |
Geen |
Geen restricties |
|
De Jong |
Eerstelijns verloskundige De Geboortezaak Nieuwegein Klinisch epidemioloog |
Klinisch epidemioloog Lid werkgroep HPP in de 1e lijn Lid werkgroep Handreiking indicaties vitaliteitsecho |
Geen |
Geen restricties |
|
Klankbordgroep |
||||
|
Achternaam klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Davelaar-Van Zanten |
Adviseur kwaliteit en veiligheid (betaalde functie/reguliere baan) Spaarne Gasthuis |
Geen |
Geen |
Geen restricties |
|
Maikel Hustinx |
Verpleegkundig Specialist, Albert Schweitzer Ziekenhuis, 36u p.w. |
Algemeen bestuurslid V&VN afdeling Vrouw en Kind, vrijwillig. Vice-voorzitter Vereniging Verpleegkundig Specialisten Albert Schweitzer Ziekenhuis, vrijwillig Lid landelijke tafel College Perinatale Zorg, Utrecht, vrijwillig |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en Care4Neo voor de schriftelijke knelpuntenanalyse en afvaardiging namens Care4Neo in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen zie per module ook “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Care4Neo en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Magnesiumsulfaat |
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangeren waarbij sprake is van dreigende vroeggeboorte. Tevens zijn er knelpunten aangedragen door Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Koninklijke Nederlandse Organisatie van Verloskundigen en Care4Neo via een schriftelijke knelpuntenanalyse. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy
|
Richtlijn: Dreigende vroeggeboorte |
|
|
Uitgangsvraag: Wat is de waarde van magnesiumsulfaat bij een zwangere vrouw met een dreigende vroeggeboorte? |
|
|
Database(s): Medline (OVID), Embase |
Datum: 25-03-2024 |
|
Periode: > 2008 |
Talen: geen beperking |
|
Literatuurspecialist: Laura Boerboom |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
→ Voor deze vraag is gezocht op de elementen dreigende vroeggeboorte (in het blauw) en magnesiumsulfaat (in het groen).
à Er waren 4 sleutelartikelen en deze zitten allemaal in de resultaten.
à Resultaten staan in Rayyan.
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase (via embase.com) en Medline (via OVID) is op 25-03-2024 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studies over wat de waarde is van magnesiumsulfaat bij een zwangere vrouw met een dreigende vroeggeboorte. De literatuurzoekactie leverde 523 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SR’s |
101 |
86 |
117 |
|
RCT’s |
185 |
119 |
228 |
|
Observationele designs |
155 |
94 |
178 |
|
|
441 |
299 |
523 |
Zoekstrategie
|
Database |
Zoektermen |
||||||||||||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Obstetric Labor, Premature/ or ((labo*r or deliver* or parturition* or birth*) adj3 (premature or preterm or 'pre term' or early or prior)).ti,ab,kf. (84903) 2 exp Magnesium Sulfate/ or 'magnesium sulfate'.ti,ab,kf. or 'magnesium sulphate'.ti,ab,kf. (8417) 3 (1 and 2) not (comment/ or editorial/ or letter/) (904) 4 limit 3 to yr="2008-Current" (507) 5 meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. (734525) 6 exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. (2704768) 7 Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) (5650235) 8 4 and 5 (86) SR’s 9 (4 and 6) not 8 (119) RCT’s 10 (4 and 7) not 8 not 9 (94) Observationele studies 11 8 or 9 or 10 (299) |