Diagnostiek en preventie bij dreigende vroeggeboorte
Uitgangsvraag
1 Wat is de prevalentie van GBS-dragerschap bij dreigende vroeggeboorte?
2 Wat is de voorspellende waarde van maternale positieve GBS-kweken bij dreigende vroeggeboorte voor de neonatale uitkomst?
3 Wat is de effectiviteit van behandeling met antibiotica van GBS-gekoloniseerde vrouwen bij dreigende vroeggeboorte op neonatale morbiditeit?
a. bij gebroken vliezen
b. bij staande vliezen
Aanbeveling
Bij dreigende vroeggeboorte wordt geadviseerd diagnostiek naar GBS-dragerschap uit te voeren.
De werkgroep adviseert zwangeren met een dreigende vroeggeboorte en GBS-dragerschap alleen profylactisch te behandelen met penicilline (en geen breedspectrumantibiotica) indien zij evident in partu zijn. Preventieve toediening van antibiotica voor langer dan 24 uur wordt afgeraden.
De werkgroep is van mening dat preventieve antibiotica bij dreigende vroeggeboorte in principe alleen geïndiceerd zijn bij vrouwen met tekenen van intra-uteriene infectie of bij GBS-dragerschap.
Overwegingen
-
-
- Er is beperkt onderzoek gedaan naar de benodigde diagnostiek en behandeling rond GBS-dragerschap/infectie specifiek bij vrouwen met een dreigende vroeggeboorte. De beschikbare literatuur beperkt zich voornamelijk tot de aterme periode, en aangezien neonatale GBS-infectie en de GBS-ziekte als gevolg hiervan zich mogelijk anders gedragen bij prematuren (meer vroege GBS, hogere mortaliteit, mogelijk andere serotypen, etc.) is op basis van deze literatuur moeilijk een uitspraak te doen over de vraag wanneer screening en eventuele profylaxe geïndiceerd zijn. Het number needed to treat van antibiotica bij GBS en vroeggeboorte is dus onbekend.
De CDC adviseren screening bij alle zwangeren met een dreigende vroeggeboorte (mits in de voorafgaande 4 weken niet verricht), en intrapartum antibioticaprofylaxe (IAP), hoewel dit niet goed wetenschappelijk onderbouwd is (CDC 2002).
- Er is geen enkele aanwijzing dat antibiotica durante partu alleen wegens een positieve GBS-kweek enige verbetering van de langetermijnuitkomst geeft bij preterme kinderen. Wel is aannemelijk dat de kolonisatiekans afneemt door IAP. Er wordt daarom vanuitgegaan dat de kans op early onset sepsis (EOS) ook afneemt en de negatieve effecten daarvan. Onduidelijk is wat de winst is van GBS-preventie als door resistentievorming de kans op en de ernst van gramnegatieve sepsis toeneemt. In de gerandomiseerde antibiotica bij PPROM-studie van Mercer was geen enkel gunstig kortetermijneffect van antibiotica bij GBS-positieve vrouwen aantoonbaar, echter wel bij GBS-negatieve vrouwen. Vooral de negatieve uitkomst van de ORACLE II op lange termijn (2 x grotere kans op cerebrale parese) maant tot voorzichtigheid. Er is geen enkele evidence dat IAP bij preterme kinderen effectief is voor reductie van morbiditeit; integendeel, eerder het tegenovergestelde (Stoll 2000, Mercer 1997 en Kenyon 2001).
- Het grootschalig toedienen van IAP kan resulteren in ongewenste bijwerkingen, zoals overgevoeligheid of resistentie voor andere micro-organismen en het verstoren van de darmflora van zowel moeder als pasgeborene, evenals de vaginale flora. Hoewel IAP geassocieerd is met een afname in GBS infecties, zijn er ook meldingen van clusters van toegenomen gramnegatieve infecties onder neonaten als gevolg van de toename van profylactische behandeling (Joseph 1998, Stoll 2002, Terrone 1999). Bovendien wordt een incidentie van penicilline allergie bij de obstetrische populatie gemeld van 0,7 tot 10% (Erffmeyer 1981 deel 1 en 2, Surtees 1991). Om IAP te minimaliseren en toch optimale preventie van perinatale GBS-infectie bij preterme neonaten te bereiken, zou het voordelig zijn om alle zwangeren vroeg in de zwangerschap te screenen, maar deze resultaten zijn slechts voor 6 weken voorspellend en zullen dan dus later in de zwangerschap herhaald moeten worden. De incidentie van ‘early onset’-GBS-ziekte bij vroeggeboorte is laag.
- Bijkomend probleem van grootschalige antibioticaprofylaxe is dat preterme baring nogal eens geprotraheerd verloopt en dat daardoor veel vaker een expositie van meer dan 24 uur zal optreden en daardoor de kans op resistentievorming.
- Van belang is overigens om bij vermoeden van intra-uteriene infectie (koorts moeder, tachycardie moeder en of kind, suboptimaal CTG) wel te behandelen met antibiotica.
- De werkgroep is van mening dat voor het formuleren van de aanbevelingen ook rekening dient te worden gehouden met de internationale richtlijnen. Zoals eerder genoemd adviseren de CDC IAP bij alle vrouwen die preterm bevallen, hoewel dit wetenschappelijk niet goed te onderbouwen is. Gezien de mogelijke negatieve effecten tracht de werkgroep een aanbeveling te doen waarbij de IAP gerichter gegeven wordt, door bij GBS-draagsters penicilline (en geen breedspectrumantibiotica) te geven alleen indien zij evident in partu is. Daarbij wordt geaccepteerd dat dan een deel van de kinderen te snel geboren worden. Echter, de werkgroep vermijdt toediening langer dan 24 uur. Bij vrouwen met onbekend of geen dragerschap van GBS en geen andere risicofactoren dan vroeggeboorte kan IAP achterwege blijven.
- Prematuren ( < 35 weken ) met een moeder met bekend GBS-dragerschap en geen of niet adequate IAP, zullen postpartum, ook indien er geen klinische symptomen van GBS-ziekte zijn, na inzetten van diagnostiek, direct behandeld worden als patiënten met neonatale sepsis (NVOG/ NVK richtlijn 2009, ‘Preventie van neonatale groep-B-streptokokkenziekte (GBS-ziekte)’).
Diagnostiek
- Uit praktisch oogpunt dient te worden meegenomen dat het voor de kinderartsen over het algemeen informatief is om bij preterm geboren kinderen de kweekuitslagen beschikbaar te hebben. Indien premature partus zich zo snel aandient dat kweekuitslagen nog niet beschikbaar kunnen zijn, dienen deze kweken ingezet te worden. De maternale kolonisatiestatus kan informatief zijn in het latere neonatale beloop.
- Huidige ontwikkelingen zijn gaande naar een GBS-sneltest als alternatief voor de kweek, maar deze zijn tot op heden nog niet geschikt gebleken. De PCR-methode werd besproken en is onvoldoende gevalideerd. Bovendien is deze vooralsnog niet geschikt om buiten het laboratorium te worden ingezet vanwege de eisen die gesteld worden aan de apparatuur, reagentia, kwaliteitscontroles en contaminatie risico en de complexiteit van de te verrichten handelingen. In theorie kunnen de resultaten snel verkregen worden, maar het is niet reëel om uit te gaan van minder dan 1 uur. Alleen al het transport van de materialen, controleren, valideren en verwerken van de uitslagen kost meer tijd. Bovendien zal de test niet 24 uur per dag, 7 dagen in de week ingezet kunnen worden. Een dagdeel is wel haalbaar (om 8 uur brengen; eind van de ochtend een resultaat). Opgemerkt dient te worden dat PCR de kweek ook niet overbodig zou maken. Bij een positieve kweek bij een patiënte met penicillineallergie zal resistentiebepaling gewenst zijn (waarvan de resultaten bij de bevalling bekend moeten zijn). Bij een negatieve PCR zal een kweek waarschijnlijk weinig aanvullende waarde hebben.
- Bekend is dat met de huidige transportmedia (Amies) de condities waaronder dit transport plaatsvindt de voorspellende waarde van de kweekuitslag kunnen beïnvloeden. Er is een ontwikkeling gaande waarbij een transportmedium gecombineerd met een ophopingsmedium met kleurindicator sneller dan de standaardkweek GBS kan aantonen (omslag duidt op GBS). Bij een hoge ‘bacterial load’ is deze omslag al na een paar uur incubatie zichtbaar. In principe wordt de omslag na 18-24 uur afgelezen. Door verbeterde transportcondities, gecombineerd met directe incubatie van de kweek wordt de kans op fout-negatieve kweekresultaten kleiner. Daardoor zullen zowel commensale als invasieve GBS-infecties meer worden gedetecteerd. Resultaten van vergelijkend onderzoek met deze methode zijn nog niet bekend.
- De ontwikkeling van een PCR waarbij onderscheid kan worden gemaakt tussen invasieve GBS-stammen en commensale GBS-stammen zal nog langere tijd nodig hebben (van Elzakker 2009).
- Bij vergelijking van de resultaten in de literatuur moet meegenomen worden dat een praktijk van spoelen met chloorhexidine de resultaten van de kweek negatief zal beïnvloeden.
-
Onderbouwing
Achtergrond
Neonatale sepsis als gevolg van een infectie met groep B-streptokokken (GBS) kan leiden tot ernstige neonatale morbiditeit en mortaliteit. In 2008 werd door de NVOG en de NVK een richtlijn opgesteld over preventie van neonatale GBS (NVOG/NVK 2008). De genoemde richtlijn bespreekt het beleid rond GBS-diagnostiek en behandeling/profylaxe bij alle zwangeren met een verhoogd risico, terwijl wij ons in dit hoofdstuk specifiek richten op GBS en vroeggeboorte.
De mortaliteit van vroege GBS-sepsis bedraagt 5% en van late GBS-sepsis 7%. Prematuriteit is in 30% van de gevallen een risicofactor bij de vroege vorm van neonatale GBS-sepsis en heeft een belangrijk aandeel in de neonatale morbiditeit en mortaliteit. In 55% van de sterfte bij vroege GBS-sepsis betreft het een prematuur geborene (Trijbels 2002). In de dagelijkse praktijk bestaat nogal eens onduidelijkheid over de betekenis van positieve kweken op GBS en het verdere beleid dat gevoerd dient te worden bij vrouwen met een dreigende vroeggeboorte.
Vragen die in dit hoofdstuk behandeld zullen worden, gaan over de prevalentie van GBS-positieve kweken bij vrouwen met een dreigende vroeggeboorte, de voorspellende waarde van positieve GBS-kweken voor de neonatale uitkomst, en over de effectiviteit van antibioticaprofylaxe/behandeling in geval van GBS-positieve kweken bij zwangeren met een dreigende vroeggeboorte met staande vliezen en met gebroken vliezen.
Voor de uitwerking van deze vragen is gebruikgemaakt van de bestaande richtlijn ‘Preventie van neonatale groep-B-streptokokkenziekte’ van de NVK en NVOG uit 2008, en van de wereldwijd veelgebruikte richtlijn van de Centers for Disease Control and Prevention (CDC) uit de Verenigde Staten (Schrag 2002). Deze richtlijn is in 2010 herzien in een samenwerkingsverband van de the AmericanCollege of Obstetricians and Gynecologists (ACOG), the American Academy of Pediatrics (AAP), the American College of Nurse Midwives (ACNM) and the American Academy of Family Physicians (AAFP) (CDC richtlijn 2010).
Conclusies / Summary of Findings
|
Niveau 2 |
De prevalentie van positieve GBS-kweken bij de populatie zwangeren met een dreigende vroeggeboorte is niet uit de literatuur op te maken. De prevalentie van positieve GBS-kweken bij de populatie aterme zwangeren in Nederland bedraagt 21%.
Bewijskrachtniveau A2 (Valkenburg 2006) |
|
Niveau 2 |
De voorspellende waarde van GBS-dragerschap ten tijde van de premature partus op neonatale sepsis is niet uit de literatuur op te maken. Circa 2/3 van de GBS-draagsters is intermitterend gekoloniseerd. De waarde van een eenmalige kweek van oudere datum is dus beperkt.
Bewijskrachtniveau A2 (Hansen 2004) |
|
Niveau 4 |
Het is onduidelijk of chemoprofylaxe bij GBS-draagsters met dreigende vroeggeboorte de kans op neonatale infectieuze morbiditeit reduceert. Resistentievorming en verhoogde pathogeniteit van andere bacteriën kunnen het mogelijke effect op GBS-sepsis te niet doen.
Bewijskrachtniveau C/D(Ohlsson 2009) C/D(Ohlsson 2009) |
Samenvatting literatuur
1 Wat is de prevalentie van GBS-dragerschap bij dreigende vroeggeboorte?
GBS komen wereldwijd voor. Het is niet uit de literatuur op te maken wat de prevalentie is van positieve GBS-kweken specifiek bij vrouwen met een dreigende vroeggeboorte.
Gegevens over de aterme periode zijn wel bekend. Tussen juli 2000 en december 2002 werd prospectief onderzoek gedaan naar de prevalentie van GBS in Nederland bij vrouwen met een amenorroeduur van 35 tot 37 weken (Valkenburg 2006). Van de 1702 geïncludeerde vrouwen bleek bij 21% (n = 356) sprake van GBS-dragerschap. Er werd geen relatie gevonden tussen kolonisatie en leeftijd, pariteit of het aantal miskramen. Wanneer gekeken werd naar etniciteit en het risico op GBS-kolonisatie, bleek dat vrouwen uit Europa en Latijns Amerika een kolonisatieprevalentie hadden van 21%, vergeleken met 29% bij Afrikaanse vrouwen en 13% bij Aziatische vrouwen. In totaal werd bij 173 van de 365 GBS-positieve vrouwen en bij 588 van de 1337 GBS-negatieve vrouwen opnieuw een kweek afgenomen bij de bevalling. Van de 173 vrouwen waren er 37 (21%) na circa 4 weken geen draagster meer, terwijl 38 van de 588 vrouwen (7%) bij wie de eerste kweek negatief was circa 4 weken later wel draagsters waren.
In een Deense studie met 2 jaar follow-up bleek ruim 50% van de vrouwen minstens een maal met GBS gekoloniseerd, van wie ongeveer een derde permanent en de overigen intermitterend (Hansen 2004).Voor Nederland zijn deze gegevens niet bekend. Het is onbekend of het percentage GBS-dragerschap bij dreigende vroeggeboorte hoger is. Waarschijnlijk is de incidentie vergelijkbaar, aangezien GBS-dragerschap geen risicofactor vormt voor vroeggeboorte(Garland 2000, Kubota 1998).
Bepalen van GBS-dragerschap
De voorspellende waarde van antenatale kweken voor GBS-kolonisatie bij de baring is afhankelijk van de afnametechniek, het kweekmedium (Rosa-Fraile 2005) en het moment van afname (Richtlijn GBS NVK/NVOG). De darm is vrijwel zeker het reservoir van GBS bij de mens. Van hieruit kan verspreiding optreden naar de blaas en de geslachtsorganen. Het vaststellen van GBS-kolonisatie geschiedt het best door met een en dezelfde wattenstok eerst materiaal af te nemen van de introitus vaginae en daarna uit het rectum. De cervix uteri is minder vaak gekoloniseerd. Een selectieve kweek is de gouden standaard: niet-selectieve media verminderen de detectie met de helft of meer. Evenals in de aterme periode zal een kleine proportie vrouwen niet gekoloniseerd zijn bij de screening, maar zal de GBS-kolonisatie oplopen tussen het moment van kweken en het begin van de bevalling.
Een belangrijk nadeel van kweken is dat het 24-48 uur duurt voordat een uitslag kan worden verkregen. Dit beperkt het gebruik ervan tijdens de baring. Er zijn op dit moment geen goede GBS-sneltests voorhanden. Een recente studie (Daniels 2009)naar sneltests voor kweken onderzocht de nauwkeurigheid, aanvaardbaarheid en de kosteneffectiviteit van polymerasekettingreactie (PCR) en optical immunoassay (OIA) als sneltests voor maternale kolonisatie met GBS durante partu, en vond dat screening door gebruik van een sneltest niet kosteneffectief was, op basis van de huidige sensitiviteit, specificiteit en kosten. De meest kosteneffectieve strategie was het routinematig ‘behandelen’ met intraveneuze antibioticaprofylaxe bij alle vrouwen, zonder screening, maar dit wordt niet aanvaardbaar geacht. In deze studie was geen van de sneltests voldoende nauwkeurig om aan te bevelen voor routinematig gebruik in de klinische praktijk.
2 Wat is de voorspellende waarde van maternale positieve GBS-kweken bij dreigende vroeggeboorte voor neonatale uitkomst?
Kolonisatiekans: De kolonisatiekans bij prematuren van wie de moeder GBS-draagster is, is onbekend. In de aterme periode zal naar schatting gemiddeld 50% van alle kinderen van wie de moeder GBS-draagster is, tijdens de geboorte gekoloniseerd raken.
Infectiekans: Bij ongeveer 1% van de gekoloniseerde aterm geborenen ontwikkelt zich een GBS-infectie. Bij 5% van hen worden neurologische restverschijnselen gevonden, met name na meningitis, die in circa 10% van deze gevallen optreedt. De mortaliteit van een ernstige GBS-infectie is 5%. Bij prematuren is de infectiekans mogelijk hoger dan bij aterm geboren kinderen (Stoll 2002).
Preterm geboren kinderen hebben een verhoogd risico op het ontwikkelen van vroege GBS-infecties vergeleken met aterm geboren kinderen, en dit risico is het hoogst bij lagere amenorroeduur (fig. 1)(Adair 2003, Oddie 2002, Schuchat 1990). De incidentie van vroege sepsis bij prematuren is 1,5-2%. Bij prematuren met een geboortegewicht onder de 1500 g zijn GBS in 11,8% van de gevallen de verwekker (Stoll 2005).
In de VS werd een dalende trend gezien van vroege sepsis bij kinderen < 1500 g van 2% (1991-1993) naar 1,5% (1998-2000) na invoeren van antibioticaprofylaxe bij GBS-dragerschap. Het percentage waarbij GBS de verwekker waren, nam af van 30 naar 10%, maar Escherichia coli als verwekker nam toe van 15 naar 40%, terwijl de ‘case fatality rate’ steeg van 26 naar 37% (Stoll 2002).
Fig 1 Incidentie van vroege infectie met groep B-streptokokken, gevonden op gebruikelijke bacteriële surveillancelocaties, gestratificeerd naar etniciteit en termijn, 2000-2007 (bron: CDC. Trends in perinatal groep B streptoccocal disease - US, 2000-2006. MMWR Morb Mortal Wkly Rep 2009;58:109-12)
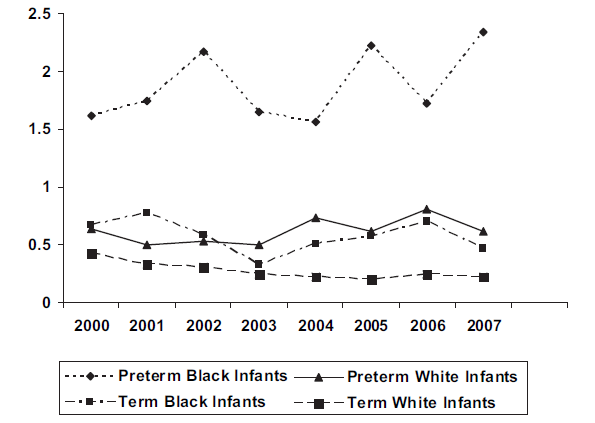
Net als bij vroege GBS-ziekte is prematuriteit een belangrijke risicofactor gebleken voor GBS-ziekte die na 7 dagen optreedt. Aangenomen wordt dat bij late GBS-infectie de contaminatie niet via het baringskanaal van de moeder verloopt.
Er is een aantal factoren waarvan bekend is dat ze, bij aanwezigheid van GBS in het baringskanaal, het risico op een neonatale vroege infectie aanzienlijk vergroten. Hiertoe worden gerekend: vroeggeboorte (< 37 weken), langdurig gebroken vliezen (> 18 uur), maternale koorts tijdens de baring (> 38ºC, rectaal), ernstige maternale GBS-kolonisatie in de huidige zwangerschap, zoals bacteriurie of urineweginfectie door GBS, en een eerder kind met GBS-ziekte (Schrag 2002, Oddie 2002). Uit de multivariate analyse in de studie van Schrag et al worden bovendien etniciteit (zwarte populatie) en maternale leeftijd onder de 20 jaar als risicofactor genoemd.
Uit Nederlandse gegevens (NSCK, 1997-1998) blijkt dat de twee eerstgenoemde risicofactoren (vroeggeboorte en langdurig gebroken vliezen) het vaakst voorkomen (Trijbels 2002).
3 Wat is de effectiviteit van behandeling met antibiotica van GBS-gekoloniseerde vrouwen bij dreigende vroeggeboorte?
a. bij gebroken vliezen
b. bij staande vliezen
De vergelijkende studies naar GBS en antibiotica hebben alle betrekking op aterm geboren kinderen waardoor het niet mogelijk is een wetenschappelijk onderbouwde uitspraak te doen over het effect ervan bij vroeggeboorte. Vroege neonatale sepsis is relatief zeldzaam bij preterme kinderen en GBS zijn hierbij minder vaak de verwekker dan a term (zie bijv. Stoll 2002; zie eerdere tekst over incidentie).
De ORACLE-studies (Kenyon 2001 ORACLE-I, Kenyon 2001 ORACLE-II) onderzochten het effect van antibiotica bij vrouwen met een dreigende vroeggeboorte en respectievelijk gebroken en staande vliezen. In deze studie werd echter geen informatie verstrekt over de GBS-status van de zwangeren.
Een studie van Mercer et al uit 1997 onderzocht de effectiviteit van antibiotische behandeling van vrouwen met PPROM bij wie afwachtend beleid gevoerd werd (Mercer 1997). De primaire uitkomstmaat was een ‘composite outcome’ van foetale mortaliteit, sterfte op kinderleeftijd, respiratory distress, ernstige intraventriculaire bloeding, graad 2 of 3 necrotiserende enterocolitis of sepsis binnen 72 uur na de geboorte. In de totale populatie hadden vrouwen die behandeld werden met antibiotica minder vaak de primaire uitkomst (44,1 vs 52,9%; p = 0,04), respiratory distress (40,5 vs 48,7%; p = 0,04), en necrotiserende enterocolitis (2,3 vs 5,8%; p = 0,03). Opvallend was dat bij secundaire analyse bleek dat bij GBS-positieve vrouwen geen enkel verschil aantoonbaar was voor de onderzochte uitkomstmaten tussen wel of niet behandelen met antibiotica. Ook werd in deze groep geen verschil in zwangerschapsduur vastgesteld (Mercer 1997).
In Nederland wordt tot op heden geadviseerd om ten minste 4 uur vóór de geboorte bij voorkeur te starten met 2 miljoen IE penicilline G intraveneus of als alternatief 2 g amoxicilline/ampicilline intraveneus te geven, waarna elke 4 uur respectievelijk 1 miljoen E of 1 g wordt toegediend tot aan de geboorte. Internationaal wordt het schema van de Centers for Disease Control and Prevention (CDC) gevolgd, waarbij penicilline G hoger wordt gedoseerd: er wordt gestart met 5 miljoen IE, waarna elke 4 uur 2,5 miljoen IE wordt gegeven (CDC-richtlijn 2002 en 2010). De beschermingsgraad wordt in het algemeen als adequaat beschouwd bij een interval van 4 uur tussen de gift van antibiotica en de geboorte. Ook bij kortere intervallen is een reductie in contaminatiekolonisatie waargenomen. De kans op neonatale GBS-kolonisatie blijkt afhankelijk te zijn van de tijdsduur tussen toediening en geboorte: 30% na 1-2 uur, 3% na 2-4 uur en 1% na meer dan 4 uur (de Cueto 1998).
Penicilline G verdient de voorkeur vanwege het smalle spectrum met minder kans op selectie van resistente bacteriën. Bij overgevoeligheid voor penicilline kan clindamycine (900 mg intraveneus elke 8 uur tot de geboorte) of erytromycine (500 mg intraveneus elke 6 uur tot de geboorte) worden gegeven. Recente gegevens wijzen op een toenemende prevalentie van GBS-resistentievorming tegen clindamycine en erytromycine (Simoes 2004). In Nederland was in 2007 de resistentie van GBS tegen clindamycine en erytromicine respectievelijk 7 en 8% (Muller 2008).Het is derhalve ook van belang om te blijven kweken om de resistentieontwikkeling te monitoren. Hoewel clindamycine wereldwijd als alternatief gebruikt wordt, zijn er in een recente studie aanwijzingen dat de geadviseerde dosering van 900 mg iv elke 8 uur inadequaat is (Muller 2008). Er zijn geen studies waarbij het concentratie-tijdverloop van erytromycine bij de moeder en de foetus tegelijkertijd onderzocht zijn , maar niet tegen sepsis). Door middel van allergietests, die in de zwangerschap veilig uitgevoerd kunnen worden, kan het gebruik van deze tweedekeuzemiddelen beperkt worden (GBS-richtlijn NVOG/NVK 2008).
Referenties
- Adair CE, Kowalsky L, Quon H, Ma D, Stoffman J, McGeer A, et al. Risk factors for early-onset group B streptococcal disease in neonates: a population-based case-control study. CMAJ 2003 Aug 5;169(3):198-203.
- CDC. From the Centers for Disease Control. Revision of guidelines for the prevention of perinatal group B streptococcal disease. JAMA 2002 Mar 6;287(9):1106-7.
- CDC guidelines (Centers for Disease Control and Prevention). Prevention of Perinatal Group B Streptococcal Disease. Morbidity and Mortality Weekly Report; November 19, 2010 / Vol. 59 / No. RR-10. http://www.cdc.gov/mmwr/pdf/rr/rr5910.pdf.
- de Cueto M, Sanchez MJ, Sampedro A, Miranda JA, Herruzo AJ, Rosa-Fraile M. Timing of intrapartum ampicillin and prevention of vertical transmission of group B streptococcus. Obstet Gynecol 1998 Jan;91(1):112-4.
- Daniels J, Gray J, Pattison H, Roberts T, Edwards E, Milner P, et al. Rapid testing for group B streptococcus during labour: a test accuracy study with evaluation of acceptability and cost-effectiveness. Health Technol Assess 2009 Sep;13(42):1-iv.
- Elzakker E van, Yahiaoui R, Visser C, Oostvogel P, Muller A, Ho YR, et al. Epidemiology of and prenatal molecular distinction between invasive and colonizing group B streptococci in The Netherlands and Taiwan. Eur J Clin Microbiol Infect Dis 2009 Aug;28(8):921-8.
- Erffmeyer JE. Adverse reactions to penicillin. Part II. Ann Allergy 1981 Oct;47(4):294-300.
- Erffmeyer JE. Adverse reactions to penicillin. Part I. Ann Allergy 1981 Oct;47(4):288-93.
- Garland SM, Kelly N, Ugoni AM. Is antenatal group B streptococcal carriage a predictor of adverse obstetric outcome? Infect Dis Obstet Gynecol. 2000;8(3-4):138-42.
- Hansen SM, Uldbjerg N, Kilian M, Sørensen UB. Dynamics of Streptococcus agalactiae colonization in women during and after pregnancy and in their infants. J Clin Microbiol. 2004 Jan;42(1):83-9.
- Joseph TA, Pyati SP, Jacobs N. Neonatal early-onset Escherichia coli disease. The effect of intrapartum ampicillin. Arch Pediatr Adolesc Med 1998 Jan;152(1):35-40.
- Kenyon SL, Taylor DJ, Tarnow-Mordi W. Broad-spectrum antibiotics for spontaneous preterm labour: the ORACLE II randomised trial. ORACLE Collaborative Group. Lancet 2001 Mar 31;357(9261):989-94.
- Kenyon SL, Taylor DJ, Tarnow-Mordi W. Broad-spectrum antibiotics for preterm, prelabour rupture of fetal membranes: the ORACLE I randomised trial. ORACLE Collaborative Group. Lancet 2001 Mar 31;357(9261):979-88.
- Kenyon S, Pike K, Jones DR, Brocklehurst P, Marlow N, Salt A, et al. Childhood outcomes after prescription of antibiotics to pregnant women with preterm rupture of the membranes: 7-year follow-up of the ORACLE I trial. Lancet 2008 Oct 11;372(9646):1310-8.
- Kenyon S, Pike K, Jones DR, Brocklehurst P, Marlow N, Salt A, et al. Childhood outcomes after prescription of antibiotics to pregnant women with spontaneous preterm labour: 7-year follow-up of the ORACLE II trial. Lancet 2008 Oct 11;372(9646):1319-27.
- Kubota T. Relationship between maternal group B streptococcal colonization and pregnancy outcome.Obstet Gynecol. 1998 Dec;92(6):926-30.
- Mercer BM, Miodovnik M, Thurnau GR, Goldenberg RL, Das AF, Ramsey RD, et al. Antibiotic therapy for reduction of infant morbidity after preterm premature rupture of the membranes. A randomized controlled trial. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. JAMA 1997 Sep 24;278(12):989-95.
- Muller AE, Valkenburg-van den Berg AW, Kreft D, Oostvogel PM, Sprij AJ, van BA. Low rate of carriage of macrolide-resistant group B streptococci in pregnant women in The Netherlands. Eur J Obstet Gynecol Reprod Biol 2008 Mar;137(1):17-20.
- Muller AE, Mouton JW, Oostvogel PM, Dorr PJ, Voskuyl RA, DeJongh J, et al. Pharmacokinetics of clindamycin in pregnant women in the peripartum period. Antimicrob Agents Chemother 2010 May;54(5):2175-81.
- Nederlandse Vereniging voor Obstetrie en Gynaecologie, Nederlandse Vereniging voor Kindergeneeskunde. Preventie van neonatale groep-B-streptokokkenziekte (GBS). www nvog nl 2008 [cited 2010 Jul 22];Available from: URL: http://nvog-documenten.nl/index.php?pagina=/richtlijn/pagina.php&fSelectTG_62=75&fSelectedSub=62&fSelectedParent=75
- Oddie S, Embleton ND. Risk factors for early onset neonatal group B streptococcal sepsis: case-control study. BMJ 2002 Aug 10;325(7359):308.
- Rosa-Fraile M, Camacho-Munoz E, Rodriguez-Granger J, Liebana-Martos C. Specimen storage in transport medium and detection of group B streptococci by culture. J Clin Microbiol 2005 Feb;43(2):928-30.
- Schuchat A, Oxtoby M, Cochi S, Sikes RK, Hightower A, Plikaytis B, et al. Population-based risk factors for neonatal group B streptococcal disease: results of a cohort study in metropolitan Atlanta. J Infect Dis 1990 Sep;162(3):672-7.
- Schrag S, Gorwitz R, Fultz-Butts K, Schuchat A. Prevention of perinatal group B streptococcal disease. Revised guidelines from CDC. MMWR Recomm Rep 2002 Aug 16;51(RR-11):1-22.
- Simoes JA, Aroutcheva AA, Heimler I, Faro S. Antibiotic resistance patterns of group B streptococcal clinical isolates. Infect Dis Obstet Gynecol 2004;12(1):1-8.
- Stoll BJ, Hansen NI, Higgins RD, Fanaroff AA, Duara S, Goldberg R, Laptook A, Walsh M, Oh W, Hale E; National Institute of Child Health and Human Development. Very low birth weight preterm infants with early onset neonatal sepsis: the predominance of gram-negative infections continues in the National Institute of Child Health and Human Development Neonatal Research Network, 2002-2003. Pediatr Infect Dis J. 2005 Jul;24(7):635-9.
- Stoll BJ, Hansen N, Fanaroff AA, Wright LL, Carlo WA, Ehrenkranz RA, et al. Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med 2002 Jul 25;347(4):240-7.
- Surtees SJ, Stockton MG, Gietzen TW. Allergy to penicillin: fable or fact? BMJ 1991 May 4;302(6784):1051-2.
- Terrone DA, Rinehart BK, Einstein MH, Britt LB, Martin JN, Jr., Perry KG. Neonatal sepsis and death caused by resistant Escherichia coli: possible consequences of extended maternal ampicillin administration. Am J Obstet Gynecol 1999 Jun;180(6 Pt 1):1345-8.
- Towers CV, Carr MH, Padilla G, Asrat T. Potential consequences of widespread antepartal use of ampicillin. Am J Obstet Gynecol 1998 Oct;179(4):879-83.
- Trends in perinatal group B streptococcal disease - United States, 2000-2006. MMWR Morb Mortal Wkly Rep 2009 Feb 13;58(5):109-12.
- Trijbels-Smeulders M, Gerards LJ, PC M, de JP, van Lingen RA, Adriaanse AH, et al. Epidemiology of neonatal group B streptococcal disease in The Netherlands 1997-98. Paediatr Perinat Epidemiol 2002 Oct;16(4):334-41.
- Valkenburg-van den Berg AW, Sprij AJ, Oostvogel PM, Mutsaers JA, Renes WB, Rosendaal FR, et al. Prevalence of colonisation with group B Streptococci in pregnant women of a multi-ethnic population in The Netherlands. Eur J Obstet Gynecol Reprod Biol 2006 Feb 1;124(2):178-83.
- Verani JR, Schrag SJ. Group B streptococcal disease in infants: progress in prevention and continued challenges. Clin Perinatol 2010 Jun;37(2):375-92.
Evidence tabellen
|
Referentie |
Type studie |
In- en exclusie Criteria (studie/ patiënten) |
Kenmerken (studie/ patiënten) |
Interventie (I) |
Controle (C)
|
Uitkomst maten en follow-up duur |
Resultaten |
Opmerkingen |
Bewijsniveau |
|
Haas 2009 |
Systematische review, meta-analyse
N= 58 studies |
verschillende groepen tocolytica worden met elkaar vergeleken of met placebo of geen behandeling. Studies over vrouwen met een dreigende vroeggeboorte tussen 28 en 32 weken werden geïncludeerd. De studies werden individueel bekeken en de onderzochte cohorten bij elkaar genomen, waarna deze werden vergeleken met een ‘random effects model’ om bias van heterogeniteit zo veel mogelijk te beperken. Hierna werd gestratificeerd voor gebroken of staande vliezen en voor eenling- of meerlingzwangerschappen, waarna alleen de resultaten voor staande vliezen en eenlingzwangerschappen werden geanalyseerd voor de meta-analyse.
Geen taalbarrière. Abstracts alleen werden niet geaccepteerd wegens onvoldoende info. |
- |
Tocolytica (bètamimetica, calciumantagonisten, magnesiumsulfaat, oxytocinereceptor-antagon-isten, prostaglandinesynthe-taseremmers en stikstofmonoxide-donoren)
Er werd geen onderscheid gemaakt in behandelingsschema en duur van de behandeling (kortdurende behandeling of onderhouds-behandeling). |
Andere tocolytica, geen behandeling of placebo |
Uitgestelde geboorte met 48 uur, 7 dagen, en tot 37 weken. Het aantal vrouwen met ongunstige bijwerkingen van dusdanige ernst dat de behandeling onderbroken moet worden.
Als de auteurs aangaven dat antenatale corticosteroiden werden gegeven dan werd de aanwezigheid van RDS en neonatale sterfte gemeten als uitkomstmaat. .
Voor de neonatale uitkomst werden alleen studies geïncludeerd waarvan zeker was dat ook corticosteroïden antenataal toegediend waren. |
Alle tocolytica waren beter dan placebo in het uitstellen van de partus voor minimal 48 uur (53% voor placebo vergeleken met 75–93% voor tocolyse) en 7 dagen (39% voor placebo vs 61–78% voor tocolyse)
Er werd geen significant verschil gevonden voor de ander uitkomstmaten
Het beslismodel toonde dat prostaglandine remmers de beste combinatie toonden van acceptatie en bevalling.
|
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):+
Intention-to-treat analyse:+
Financiering: geen conflict
Overig: 2 onafhankelijke reviewers
Meta-analyse uitgevoerd volgens QUORUM
Beoordeling van de studies aan de hand van cochrane criteria |
A1 |
|
King 2005
Calciumkanaalblokkers voor tocolyse |
Cochrane systematische review, meta-analyse
N=1029 vrouwen (12 studies) |
Alle studies over het gebruik van calciumantagonisten voor tocolyse bij vrouwen met een zwangerschapsduur tussen 20 en 36 weken en een dreigende vroeggeboorte.
|
- |
Calciumantagonisten voor tocolyse |
Andere tocolytica
(vergelijkingen met placebo of geen behandeling bleek niet mogelijk, geen studies geïdentificeerd) |
Verlenging van de zwangerschapsduur. Geboorte<37 wk, geboorte<34 wk, geboorte<7 dagen, geboorte<48 uur
Tevens neonatale uitkomstmaten, zie artikel. |
Vergeleken met andere tocolytica (voornamelijk betamimetica) reduceerde calciumblokkers het risico op geboorte binnen 7 dagen na start behandeling: RR 0,76; 95% BI 0,60-0,97
En<34 weken: RR 0,83; 95% BI 0,69- 0,99
Bovendien was bij calcium-blokkers minder kans dat overgestapt moest worden op een andere behandeling wegens bijwerkingen (RR 0,14; 95% BI 0,05-0,36), minder vaak neonatele RDS (RR 0,63; 95% BI 0,46- 0,88), NEC (RR 0,21; 95%-BI 0,05-0,96), IVH (RR 0.,9; 95%-BI 0,36- 0,98) en neonatale icterus (RR 0,73; 95%-BI 0,57-0,93). |
Beoordeling m.b.v. de cochrane criteria
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):+
Intention-to-treat analyse:+
Financiering: geen conflict
Overig: 2 onafhankelijke reviewers
|
A1 |
|
Amin 2009 |
Systematische review van 15 retrospectieve cohort studies en 6 case-controle onzerdoeken (tot 2005).
N=21 studies |
Inclusie: Studies waarin indomethacine als tocolyticum geëvalueerd werden. Publicatie in Engels, meer dan dertig bevallingen, zwangerschapsduur<37 weken,. In ieder geval meer dan 2 observationele studies per uitkomstmaat. Per uitkomstmaat worden specifieke criteria benoemd waaraan voldaan moet zijn.
Exclusie: case-reports, case-series, meerdere publicaties van dezelfde auteur. |
- |
Indomethacine alleen of in combinatie met een ander tocolyticum |
Geen, of een ander tocolyticum. |
IVH, IVH graad III en IV, PVL, NEC, BPD, persisterende ductus botalli, RDS, mortaliteit |
Antenatale indomethacine hing samen met een verhoogd risico op PVL (OR 2,0; 95%-BI 1,3-3,1). Recente blootstelling aan antenatale indomethacine was geassocieerd met NEC (OR 2,2; 95%-BI 1,1-4,2). Antenatale indomethacine was niet geassocieerd met IVH, open ductus Botalli, RDS, BPD en mortaliteit. |
Publicatie bias werd onderzocht.
Sensitiviteits analyse uitgevoerd om het effect van antenatale CCS en van eerdere behandeling met indomethacine te onderzoeken. |
A2 |
|
Berkman 2003 |
Systematische review.
N=24 studies |
Inclusie: studies (RCT’s, cohort studies, case-series) over het effect van tocolyse bij dreigende vroeggeboorte, gepubliceerd in Engels, Duits of Frans.
Exclusie: meerlingen, PPROM, iatrogene vroeggeboorte, |
|
Betamimetica, calciumkanaal-blokkers, magnesiumsulfaat, NSAID’s of ethanol. |
Een ander tocolyticum of geen controle. |
Foetale, neonatale en matarnale uitkomsten (niet duidelijk gespecificeerd). |
Studies die kwalitatief redelijk goed waren toonden verschillende uitkomsten met een matige trend richting verlenging van de zwangerschapsduur. Er was onvoldoende data om een verband te onderzoeken met neonatale morbiditeit en mortaliteit.
Ethanol was minder effectief dan betamimetica. Betamimetica hadden significant meer bijwerkingen dan de andere tocolytica. |
Selectiecriteria duidelijk gerapporteerd in tabellen.
De meeste geïncludeerde studies rapporteren bepaalde kwaliteits criteria matig.
|
A1 |
|
Sanchez-Ramos 1999 |
Systematische review van RCT’s
N=1590 vrouwen (12 studies)
Doel: effectiviteit en veiligheid van onderhouds behandeling met nifedipine |
Inclusie: gepubliceerde RCT’sdie medicatie versus placebo of geen therapie vergelijken om de zwangerschapsduur te verlengen bij patienten met acute episodes van voortijdige weeën die reeds een eerste tocolytische therapie gehad hebben. |
|
Onderhoudstherapie met nifedipine |
- |
Frequentie van terugkerende voortijdige contracties/ dreigende vroeggeboorte, incidentie van vroeggeboorte, interval tot aan de eerste recidief van vroegtijdige contracties, zwangerschapsduur, gewonnen dagen vanaf randomizatie tot bevalling, 5-minuten Apgar scores <7, aantal opnames op NICU, en perinatale mortaliteit.
|
Vergeleken met geen behandeling heeft ondehouds therapie met nifedipine een gepoolde OR van 0,95 (95%-BI 0,77-1,17) voor het voorkomen van vroeggeboorte, en de OR voor herhaalde preterme contracties was 0,81 (95%-BI 0,64-1,03). Onderhouds therapie met Tocolyse was niet geassocieerd toegenomen risico op neonatal RDS, perinatale sterfte of verschil in geboortegewicht. Hoewel er geen verschil werd gevonden in gemiddelde AD bij de bevalling, hadden vrouwen die onderhoudstherapie kregen een langere latentie tijd. |
Zie tabel 1 voor kwaliteit van geïncludeerde studies.
Randomisatie: +
Toewijzing verborgen:+
Blindering: +/- voor zover mogelijk
Interventie- en controlegroep vergelijkbaar:+/-
Follow-up voldoende (≥80%):niet gerapporteerd
Intention-to-treat analyse: niet gerapporteerd
Financiering: niet gerapporteerd
Overig: 2 onafhankelijke reviewers, artikelen geanonimiseerd voor beoordeling
|
A1 |
|
De Heus 2009 |
Prospectieve cohort studie (open label)
N=1920 (28 ziekenhuizen)
Doel: evalueren van de incidentie van ernstige maternale complicaties na behandeling van verschillende tocolytische medicatie bij de behandeling van dreigende vroeggeboorte |
Inclusie: opeenvolgende zwangeren die volgens de het lokale protocol van de deelnemende centra in aanmerking komen voor tocolyse, in de periode tussen januari 2006 en juni 2007.
Exclusie: vrouwen die al behandeld waren met tocolytica (bijv. voor uitwendige versie of bij foetale nood).
Een panel beoordeelde de ongunstige uitkomsten en of deze aan de medicatie gerelateerd waren (bijwerkingen) en de ernst hiervan. |
Setting: 28 ziekenhuizen in Nederland en Belgie |
Een enkele behandeling met tocolyse, opeenvolgende behandelingen of gecombineerde behandelingen.
Onderzochte tocolytica: Nifedipine, betamimetica, atosiban, prostaglandine synthetase remmers |
De drie eerder genoemde groepen worden vergeleken. |
Ongunstige zwangerschaps uitkomsten/ bijwerkingen
Ernstige ongunstige bijwerkingen werden gedefinieerd volgens de richtlijn van de Council for International Organizations of Medical Sciences.
Ernstige bijwerkingen waren: ernstige hypotensie (DBD <100 mm Hg en >20% daling vergeleken met de uitgangsmeting), ernstige dyspnoe, long oedeem, myocard infarct, anafylactische shock, opname op de IC of maternale sterfte.
Milde bijwerkingen: Bijwerking die leidde tot staken van de medicatie (bijvoorbeeld wegens tachycardie, misselijkheid, duizeligheid, hoofdpijn) maar die niet voldeden aan de criteria voor ernstige bijwerkingen. |
Een onafhankelijk panel onderzocht de gerapporteerde bijwerkingen zonder kennis van het type tocolyticum. Van de 1920 ontvingen 1327 vrouwen een enkele behandeling met tocolyse (69,1%), 282 Opeenvolgende kuren (14,7%), en 311 gecombineerde kuren (16,2%). Bijwerkingen werden gecategoriseerd als ernstig of mild in 14 gevallen. De totale incidentie van ernstige bijwerkingen was 0,7%. Vergeleken met atosiban is het RR op een ernstige bijwerking na een enkele behandeling met betamimetica was 22,0 (95%-BI 3,6- 138,0) en voor een enkele behandeling met calciumantagonist was 12 (1,9-69). Meerder medicamenten voor Tocolyse leidde tot 5 ernstige bijwerkingen (1,6%). Meerlingen, PPROM en comorbiditeit waren geen onafhankelijke risicofactoren voor ernstige bijwerkingen. |
Randomisatie: nvt
Toewijzing verborgen: nvt
Blindering: +
Financiering: geen conflict
|
A1 |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-02-2012
Uiterlijk in 2014 bepaalt het bestuur van de Nederlandse Vereniging voor Obstetrie en Gynaecologie of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Obstetrie en Gynaecologie is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante nieuwe ontwikkelingen.
Algemene gegevens
De richtlijnontwikkeling werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Met ondersteuning van de Orde van Medisch Specialisten.
Aanleiding voor het maken van de richtlijn
Spontane vroeggeboorte is een omvangrijke complicatie binnen de obstetrie. Het is niet alleen de belangrijkste oorzaak van perinatale sterfte in Nederland, maar ook van complicaties op de lange termijn van het kind.
Multidisciplinaire zorgverlening
In de tweede lijn wordt de zorg voor moeder en kind van de gynaecoloog en de kinderarts aangevuld door onder andere de arts-medisch microbioloog en de internist. De zorg voor moeder en kind is bij spontane vroeggeboorte veelal gedetailleerd uitgewerkt in monodisciplinaire richtlijnen gemaakt door de afzonderlijke beroepsgroepen. Een voorbeeld van een dergelijk document is de NVOG-richtlijn dreigende vroeggeboorte. Ook de neonatologie kent binnen de NVK monodisciplinaire richtlijnen zoals die over actieve levensbeëindiging bij pasgeborenen, reanimatie, hyperbilirubinemie, therapie neonatale convulsies en beslissingen rond het levenseinde in de neonatologie. Zowel de artsen-microbiologen als de internisten hebben geen specifieke richtlijnen op het gebied van zwangerschap en vroeggeboorte.
Bij monodisciplinaire richtlijnen vindt vaak pas laat in het ontwikkelproces (of in het geheel niet) wederzijdse toetsing plaats van de inhoud van de richtlijn. De afgelopen jaren blijkt dat dergelijke toetsing in een laat stadium niet optimaal is. Vaak is een richtlijn al gevormd door keuzes die vroegtijdig in het proces van richtlijnontwikkeling gemaakt zijn en blijkt het moeilijk om in een laat stadium in dat proces in te breken. Implicaties voor de samenwerking kunnen door deze aanpak niet goed verwerkt worden in de richtlijn. Dit terwijl de zorg rond veel onderwerpen inherent multidisciplinair is, zoals weeënremming, behandeling van infectie en het geven van corticosteroïden aan de moeder bij dreigende vroeggeboorte. Om het zorgproces van zwangere vrouwen met een door vroeggeboorte gecompliceerde zwangerschap te optimaliseren is een multidisciplinaire aanpak, met als doel een uniform beleid van belang.
Probleemomschrijving en afbakening
Omdat dreigende vroeggeboorte een van de meest omvangrijke complicatie is in de obstetrie, achtte de NVOG het noodzakelijk hierover multidisciplinaire afspraken te maken voor de dagelijkse praktijkvoering. Gezien de omvang van de problematiek rondom dreigende vroeggeboorte werd door de werkgroep besloten de richtlijn af te bakenen tot de belangrijkste knelpunten op dit gebied, en de mogelijkheid te bieden om deze later als bouwstenen te integreren in nog te ontwikkelen richtlijnen door de eigen vereniging(en). Het nu volgende document bevat derhalve de systematische uitwerking en bediscussiëring van de belangrijkste multidisciplinaire knelpunten rondom dreigende vroeggeboorte.
Delen van deze richtlijn komen overeen met de gelijktijdig ontwikkelde richtlijn Hypertensieve aandoeningen tijdens de zwangerschap (www.nvog.nl). Er is voor gekozen deze opverlap te laten bestaan om de zelfstandige leesbaarheid van de documenten te bevorderen.
Definities
Vroeggeboorte:geboorte voor 37 weken amenorroeduur
- Late prematuriteit: 34 tot 36 weken
- Matige prematuriteit: 32 tot 34 weken
- Vroege prematuriteit: 28 tot 32 weken
- Extreme prematuriteit: 24 tot 28 weken
- (Termijnbepaling volgens regels van de werkgroep ultrageluid NVOG)
Juridische betekenis van richtlijnen
Richtlijnen bevatten geen wettelijke voorschriften, maar aanbevelingen die zoveel mogelijk op bewijs gebaseerd zijn. Zorgverleners kunnen aan de aanbevelingen voldoen in het streven kwalitatief goede of ‘optimale’ zorg te verlenen. Omdat deze aanbevelingen gebaseerd zijn op ‘algemeen bewijs voor optimale zorg’ en de inzichten van de werkgroep hierover, kunnen zorgverleners op basis van hun professionele autonomie zo nodig in individuele gevallen afwijken van de richtlijn. Afwijken van richtlijnen is, als de situatie van de patiënt dat vereist, zelfs noodzakelijk. Wanneer van deze richtlijn wordt afgeweken, is het verstandig om dit beargumenteerd en gedocumenteerd, waar relevant in overleg met de patiënt, te doen.
Doel en doelgroep
Een richtlijn is een document met aanbevelingen ter ondersteuning van de dagelijkse praktijkvoering. In de conclusies wordt aangegeven wat de wetenschappelijke stand van zaken is. De aanbevelingen zijn gericht op het expliciteren van optimaal medisch handelen en zijn gebaseerd op de resultaten van wetenschappelijk onderzoek en overwegingen van de werkgroep.
Aan richtlijnen worden steeds meer eisen gesteld; ze moeten wetenschappelijk onderbouwd, transparant en bruikbaar zijn in de praktijk. Er is bij voorkeur inbreng door patiënten (patiëntenperspectief). Daarnaast is het belangrijk dat de beroepsgroepen die in de praktijk met de richtlijn werken, betrokken zijn bij de ontwikkeling en de richtlijn ook breed dragen (autoriseren).
Deze richtlijn beoogt een leidraad te geven voor de dagelijkse praktijk van de zorg van zwangere vrouwen met een dreigende vroeggeboorte.
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die aan de ontwikkeling van de richtlijn hebben bijgedragen. Deze staan vermeld bij de samenstelling van de werkgroep. Tot de beroepsgroepen die geen zitting hadden in de werkgroep maar wel beoogd gebruikers zijn van deze richtlijn behoren o.a. klinisch verloskundigen.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2009 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die met de diagnostiek en behandeling van vroeggeboorte te maken hebben (zie hiervoor de samenstelling van de werkgroep). Aangezien dezelfde werkgroep betrokken was bij de uitwerking van de multidisciplinaire aanbevelingen voor de richtlijn ‘Hypertensieve aandoeningen in de zwangerschap’, was bij dit project ook vertegenwoordiging van de interne geneeskunde aanwezig.
De werkgroepleden zijn door de wetenschappelijke verenigingen gemandateerd voor deelname aan deze werkgroep.
Samenstelling van de werkgroep
Prof. dr. B.W. Mol, gynaecoloog, Academisch Medisch Centrum, Amsterdam (voorzitter)
Dr. F.A.B.A. Schuerman, kinderarts, Flevoziekenhuis, Almere
Dr. R.A. van Lingen, kinderarts, Isala-Klinieken, Zwolle
Dr. A.H.L.C. van Kaam, kinderarts, Academisch Medisch Centrum, Amsterdam
Dr. P.H. Dijk, kinderarts, Universitair Medisch Centrum Groningen, Groningen
Mw. dr. L.M. Kortbeek, medisch microbioloog, RIVM, Bilthoven
Dr. B.J.H. van den Born, internist, Academisch Medisch Centrum, Amsterdam
Dr. G.D. Mantel, gynaecoloog, Isala-Klinieken, Zwolle
Dr. J.J.H.M. Erwich, gynaecoloog, Universitair Medisch Centrum Groningen, Groningen
Dr. H. Wolf, gynaecoloog, Academisch Medisch Centrum, Amsterdam
Ir. T.A. van Barneveld, klinisch epidemioloog, Orde van Medisch Specialisten, Utrecht
Mw. drs. M.M. Wiegerinck, arts-onderzoeker en richtlijnondersteuner, Nederlandse Vereniging voor Obstetrie en Gynaecologie, Utrecht
Belangenverklaringen
Geen van de werkgroepleden hebben belangen aan te geven. De originele belangenverklaringen zijn op te vragen bij het secretariaat van de NVOG. De inhoud van de conclusies en aanbevelingen uit deze (concept)richtlijn werd onafhankelijk opgesteld van en niet beoordeeld door de financier van deze richtlijn, de Stichting Kwaliteitsgelden Medisch Specialisten.
Belangenverklaringsformulier
Verklaring omtrent mogelijke belangenverstrengeling en embargo met betrekking tot de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’ op initiatief van ‘NVOG’
Utrecht, …. … 2010
Betreft: Richtlijn hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte
Geachte heer, mevrouw,
In verband met uw deelname aan de ontwikkeling van de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’ vragen wij u bijgevoegde verklaring in te vullen.
Mogelijke belangenverstrengeling:
Mogelijke belangenverstrengeling valt niet steeds valt te vermijden, maar de Orde van Medisch Specialisten en NVOG vindt het wel van belang dat hierover openheid bestaat. U wordt daarom gevraagd op bijgaand formulier te vermelden of u in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhield met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’.
Hetgeen u in uw verklaring vermeldt zal bij het secretariaat van de NVOG opvraagbaar zijn.
Embargo
Gedurende de richtlijnontwikkeling rust een embargo op de teksten van de conceptrichtlijn.
Dit betekent dat het zonder schriftelijke toestemming van de opdrachtgever niet is toegestaan om passages uit de conceptrichtlijn, of de gehele conceptrichtlijn inclusief bijlagen zoals evidence-tabellen te verstrekken aan derden.
Ondergetekende verklaart zich door ondertekening akkoord met het bovenstaande.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––– (naam)
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––(handtekening)
Formulier belangenverklaring
Heeft u naar uw mening in de afgelopen vijf jaar en/of gedurende de looptijd van het project belangen die mogelijk kunnen interfereren met de besluitvorming in de werkgroep ten aanzien van de interpretatie van het wetenschappelijk bewijs en het opstellen van aanbevelingen?
Ja / Neen
Zo ja, wilt u aangeven uit welke activiteiten deze belangen voortvloeien en welke organisaties/bedrijven het betreft? Voorbeelden van activiteiten kunnen gevonden worden in consultatie/advisering, (na)scholing / cursus en ondersteuning van wetenschappelijk onderzoek.
1. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
2. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
3. –––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Bij meer dan deze drie vermeldingen graag een extra blad bijvoegen.
Ondergetekende verklaart bovenstaande informatie naar waarheid te hebben ingevuld en mutaties t.a.v. bovenstaande te vermelden aan de voorzitter en secretaris van de werkgroep:
Betreft: richtlijn ‘hypertensieve ziekten in de zwangerschap en dreigende vroeggeboorte’
Naam: ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Afgevaardigde namens: ––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––(handtekening)
Inbreng patiëntenperspectief
Voor de ontwikkeling van een kwalitatief goede richtlijn is de input van patiënten nodig. Een behandeling moet immers voldoen aan de wensen en eisen van patiënten en zorgverleners. Patiënten kunnen zorgverleners die een richtlijn ontwikkelen helpen om te begrijpen hoe het is om met een ziekte of aandoening te leven of om er mee geconfronteerd te worden. Op deze manier kan bij het ontwikkelen van een richtlijn beter rekening gehouden worden met de betekenis van verschillende vormen van diagnostiek, behandeling en zorg voor patiënten. Het in kaart brengen van de behoeften, wensen en ervaringen van patiënten met de behandeling biedt tevens de gelegenheid om de knelpunten in kaart te brengen. Wat zou er volgens patiënten beter kunnen? Een patiënt doorloopt het hele zorgtraject, een behandelaar ziet vaak slechts het stukje behandeling waarin hij zich heeft gespecialiseerd. Het is dus heel zinvol om voor verbetering van de kwaliteit van de behandeling ook knelpunten vanuit patiëntenperspectief in kaart te brengen. Bij deze richtlijn is er in de beginfase van de richtlijnontwikkeling een knelpuntenanalyse door middel van een groepsinterview met een patiëntengroep (focusgroep) van vrouwen met een doorgemaakte dreigende vroeggeboorte gedaan. Een verslag van de focusgroep bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn geadresseerd in de richtlijn. Niet alle genoemde knelpunten waren direct van toepassing op deze richtlijn, derhalve wordt verwezen naar het focusgroep verslag voor het totale overzicht (zie aanverwant). De hier voorliggende conceptrichtlijn is voor commentaar voorgelegd aan deelnemers van het focusgroep gesprek.
Verslag patiëntenfocusgroep 'dreigende vroeggeboorte'
In dit document worden de aandachtspunten die volgen uit het focusgroepgesprek van 26 april 2010 uitgelicht.
Doel van het focusgroep gesprek
Vanuit het patiëntenperspectief inzichtelijk maken hoe de zorg aan vrouwen met een (dreigende) vroeggeboorte, patiënt gerichter kan.
Deelneemsters aan het focusgroep gesprek
In samenwerking met de Vereniging voor Ouders van Couveusekinderen en de stichting HELLP, werden deelnemers benaderd en geselecteerd. Alleen patiënten bij wie de bevalling minder dan 5 jaar geleden had plaatsgevonden, werden geïncludeerd. Er namen in totaal 7 vrouwen deel, van wie er 2 een spontane vroeggeboorte hadden en 5 een geïnduceerde vroeggeboorte wegens een hypertensieve aandoening. Ten tijde van het gesprek was één van de deelnemers (opnieuw) zwanger.
De gespreksstructuur
Het gesprek werd gestructureerd door chronologisch het zorgproces door te spreken: de begeleiding in de vroege zwangerschap, het moment waarop duidelijk werd dat het kind te vroeg geboren zou worden, de begeleiding tot aan de partus, de partus zelf, het kraambed, en de nazorg. De belangrijkste aandachtspunten worden in dit verslag uitgelicht, gegroepeerd naar bovenstaande zorgmomenten.
Algemene punten, voor verbetering van het multidisciplinaire zorgproces
Informatievoorziening in de vroege zwangerschap (voor optreden van klachten)
- Aan geen van de deelnemers was, voordat complicaties van de zwangerschap optraden, informatie verstrekt over symptomen (zoals van hypertensie) waarop de zwangeren bedacht zouden moeten zijn.
- Deelnemers zijn het erover eens dat er wel behoefte is aan informatie vooraf, maar goed getimed, zonder dat er angst ontstaat, en met mededeling van de belangrijkste klachten die je in je zwangerschap tegen kan komen.
- De meeste deelnemers zijn op de hoogte van de blocnotejes die sinds enkele maanden door de stichting HELLP (in samenwerking met KNOV en NVOG) worden verstrekt, en waarop alarmsymptomen van hypertensieve aandoeningen vermeld staan. Deze worden als een positieve ontwikkeling gezien.
- Er wordt aangegeven dat zorgverleners zich wel goed moeten realiseren dat veel vrouwen eventuele klachten niet durven aan te geven (‘Ik stel me aan’), of aan kunnen geven omdat ze niet weten wat belangrijke klachten zijn, waardoor het extra van belang is om goed door te vragen. Het is erg belangrijk dat er een goede vertrouwensband is, en voldoende gelegenheid om alles te durven zeggen.
- Niet alleen de zwangeren, maar ook de verloskundigen moeten uiteraard de klachten zoals aangegeven door de vrouwen goed kunnen herkennen.
De begeleiding van de zwangerschap nadat de eerste complicaties opgetreden zijn
- De wens is dat je als patiënt zoveel mogelijk door één persoon gevolgd wordt. Het is belangrijk voor de continuïteit van zorg en voor de vertrouwensband.
- Ook het goed informeren van de partner wordt als zeer belangrijk benoemd. Dat is wisselend gegaan, bij de een beter dan bij de ander. De zwangere is niet altijd even helder van geest door alles wat er gebeurt, en de partner kan dan nog informatie voor patiënte onthouden en herhalen. Ook was er een positieve ervaring van het bijhouden van een dagboek en het maken van foto’s voor de latere verwerking.
- Eenduidige informatie van de verschillende zorgverleners (o.a. verpleegkundigen), om onrust en onzekerheid bij de patiënt te voorkomen. Daarbij ook rekening houdend met de situatie van de vrouw (begrijpt ze wat er verteld wordt?).
- Informatievoorziening over de prognose van het kind werd bij vrijwel alle deelnemers verstrekt door de neonatoloog. Dit werd als erg prettig ervaren. De ene deelnemer had behoefte aan duidelijke rechttoe rechtaan informatie, terwijl andere deelnemers liever een wat genuanceerder gesprek hadden. Er dient dus ook rekening te worden gehouden met het type patiënt. De deelnemers geven aan dat zij voor het gesprek met de neonatoloog nauwelijks informatie over de prognose van het kind hadden gekregen van de gynaecoloog, maar dat zij deze informatie ook niet gemist hebben.
- ‘Het is de arts die je maakt of breekt, zo is het. En je moet maar net die klik hebben. Dat maakt heel veel uit.’
Partus
- Het is essentieel dat je partner erbij kan zijn.
- Duidelijkheid over wanneer de inleiding gaat starten (‘als ze zeggen dat je die dag ingeleid wordt, dat ze dat dan ook doen’). En als de bevalling begint, zet dan ook door.
- Het werd door deelnemers erg gewaardeerd dat de verpleging/artsen zorgde dat er een fototoestel was bij de partus, aangezien zij deze in alle haast vergeten waren (acute situatie). Het is zo belangrijk voor ouders, en dus fijn dat er meegedacht wordt.
Na de bevalling/kraamperiode
- Het wordt als erg belangrijk benoemd dat de partner bij de opvang van het kind mag zijn, en ook bij het installeren op de NICU. Hierdoor kan de partner ook de vrouw inlichten over alles wat er gebeurd en gedaan is. Dat geeft veel rust.
- Er is behoefte aan direct, zo spoedig mogelijk na de bevalling of keizersnee, een gesprek over hoe het is gegaan.
- Er wordt aangegeven dat patiënten het belangrijk vinden dat er nagedacht wordt over op welke kamer, met wat voor patiënten zij worden geplaatst als zij terugkeren naar de afdeling (‘niet naast een blakende baby’). Bij voorkeur in overleg met patiënt (omgekeerd wil bijvoorbeeld ook niet iedereen op een kamer alleen).
- Er zou goede mogelijkheid moeten zijn om je kind op de couveuse afdeling te bezoeken, en dat er niet hoeft te worden gewacht op de partner ’s middags.
- Er is wisselende ervaring met het videosysteem waarmee moeders vanaf de kraamafdeling hun kind op de NICU kunnen zien op scherm. Op zich wordt het als heel prettig ervaren dat je je kind ook vanaf de afdeling kan zien, maar in sommige gevallen kan het ook juist voor onrust zorgen (bijvoorbeeld door de ervaring dat er af en toe een doek over de camera werd gehangen, zonder dat duidelijk was waarom en wat er gebeurde).
- Het gaat uiteindelijk om de menselijke maat. Kijk niet alleen naar de medische problemen maar ook naar de angst en de zorg eromheen. Want die vrouw is in een roes. Het zou fijn zijn als er een vertrouwenspersoon was, dat zou in principe iedereen kunnen zijn (‘Hoe voel je je, trek je het nog wel’). Als voorbeeld wordt ook gegeven dat het al veel zou schelen als de arts bij de informatievoorziening een stoel zou pakken (zij die daar goede ervaring mee hebben beamen dat).
- Deelnemers verwachten van professionals dat zij rekening houden met belangrijke pijlers voor ouders en hen daarbij betrekken, zoals het eerste badje en eerste flesje. Dat is voor alle ouders belangrijk, maar in ieder geval voor ouders die een heftige situatie rondom de geboorte hebben meegemaakt extra emotioneel.
- Probeer, als een kind van de NICU overgeplaatst moet worden naar een ander ziekenhuis, de ouders op deze overplaatsing voor te bereiden en als zorgverlener bewust te zijn wat dit voor impact op ouders kan hebben.
Nazorg
- De meeste deelnemers hebben ervaren dat er nauwelijks nazorg is. Bij de nacontrole zou meer aandacht moeten zijn voor het bespreken van de gebeurtenissen en hoe het nu gaat, en niet alleen de bloeddruk meten en de wond bekijken. Zo’n nagesprek zou standaard aangeboden moeten worden. Ook voorlichting over wat voor effect zo een ervaring op je kan hebben is belangrijk, zowel geestelijk als lichamelijk met eventueel aanbieden van extra hulpverlening.
- De overgang van ziekenhuis naar huis wordt als groot ervaren. De patiënten bij wie het ontslag in overleg had plaatsgevonden, vonden dit erg prettig. Het ontslaggesprek is ook erg belangrijk.
- Kraamzorg: wanneer kinderen na langdurige opnamen naar huis mogen, wordt er meestal geen kraamzorg meer vergoed, terwijl hier vaak wel veel behoefte aan is.
- Een van de deelnemers heeft in onderzoeksverband wel een nazorgtraject doorlopen, en zij heeft dit als zeer prettig ervaren. Het ging dan vooral om ‘Hoe gaat het? Niet medisch, maar hoe gaat het met jou?’ en ‘Als je je over een jaar niet goed voelt en alles komt weer naar boven, dan is dat normaal, dat hoort erbij’. Ook een andere deelnemer had een duidelijk nazorgtraject als routinezorg met psychologische begeleiding en maatschappelijk werk, en beoordeelde dit zeer positief. Er werd begeleiding geboden aan het hele gezin. Er wordt geconcludeerd dat dit eigenlijk in ieder ziekenhuis routine zou moeten zijn.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is geprobeerd rekening te houden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Aangezien de gemaakte aanbevelingen niet in een op zichzelf staande richtlijn zullen worden aangeboden, maar geïntegreerd in de nog te ontwikkelen richtlijn ‘Vroeggeboorte’, zal implementatie van deze aanbevelingen afhangen van de implementatie van de nog te maken richtlijnen. Wel zal een samenvatting van het in dit project gemaakte document worden gepubliceerd in het Nederlands Tijdschrift voor Geneeskunde of het Nederlands Tijdschrift voor Obstetrie en Gynaecologie. Bovendien zal het document te downloaden zijn via de website van de Vereniging van Obstetrie en Gynaecologie (www.nvog.nl).
De bestaande NVOG indicatoren op het gebied van zorg tijdens de zwangerschap blijven van kracht en zijn niet verder aangevuld (zie website www.nvog.nl).
Werkwijze
De werkgroep werkte gedurende 1 jaar aan de totstandkoming van de conceptrichtlijn. De richtlijnondersteuner en werkgroepleden zochten systematisch literatuur en beoordeelden de kwaliteit en inhoud ervan. Zij gingen hierbij uit va bestaande richtlijnen. Vervolgens schreven de richtlijnondersteuner en werkgroepleden een paragraaf of hoofdstuk voor de conceptrichtlijn, waarin de beoordeelde literatuur werd verwerkt. Tijdens vergaderingen lichtten zij hun teksten toe, dachten mee en discussieerden over andere hoofdstukken. De conceptteksten werden aan de betrokken verenigingen aangeboden voor commentaar. De uiteindelijke aangepaste teksten vormen samen de hier voorliggende richtlijn.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

