Uitkomsten van premature geboorte
Uitgangsvraag
Wat zijn de mogelijke (korte en lange termijn) uitkomsten van premature geboorte?
Aanbeveling
Informeer ouders in geval van dreigende vroeggeboorte over de kans op sterfte en ernstige handicaps passende bij de gegeven zwangerschapstermijn., In overleg met ouders kunnen percentages besproken worden met inachtname van de mate van onzekerheid daarvan.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Vaak gebruikte prevalentiecijfers ten aanzien van mortaliteit en lange termijnuitkomsten zijn afkomstig uit gedateerde onderzoeken met historische cohorten (EpiBel, EpiCure, EpiPage). Met als doel om de counseling van ouders bij dreigende vroeggeboorte te ondersteunen, werd een literatuursearch gedaan naar systematische reviews, cohortstudies en RCT’s gepubliceerd in de afgelopen tien jaar met als onderwerp sterfte, overleving zonder handicaps en ontwikkelingsproblematiek bij 2 jaar na vroeggeboorte.
Mortaliteit
Er werden geen systematische reviews gevonden over mortaliteit na vroeggeboorte gepubliceerd in de afgelopen tien jaar. Beschikbare cohort studies tonen verschillende mortaliteitscijfers, deels afhankelijk van het land en de tijdsperiode van waaruit de studie stamt.
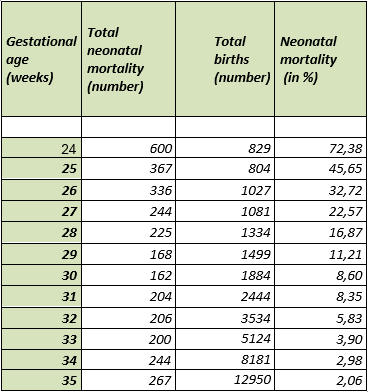
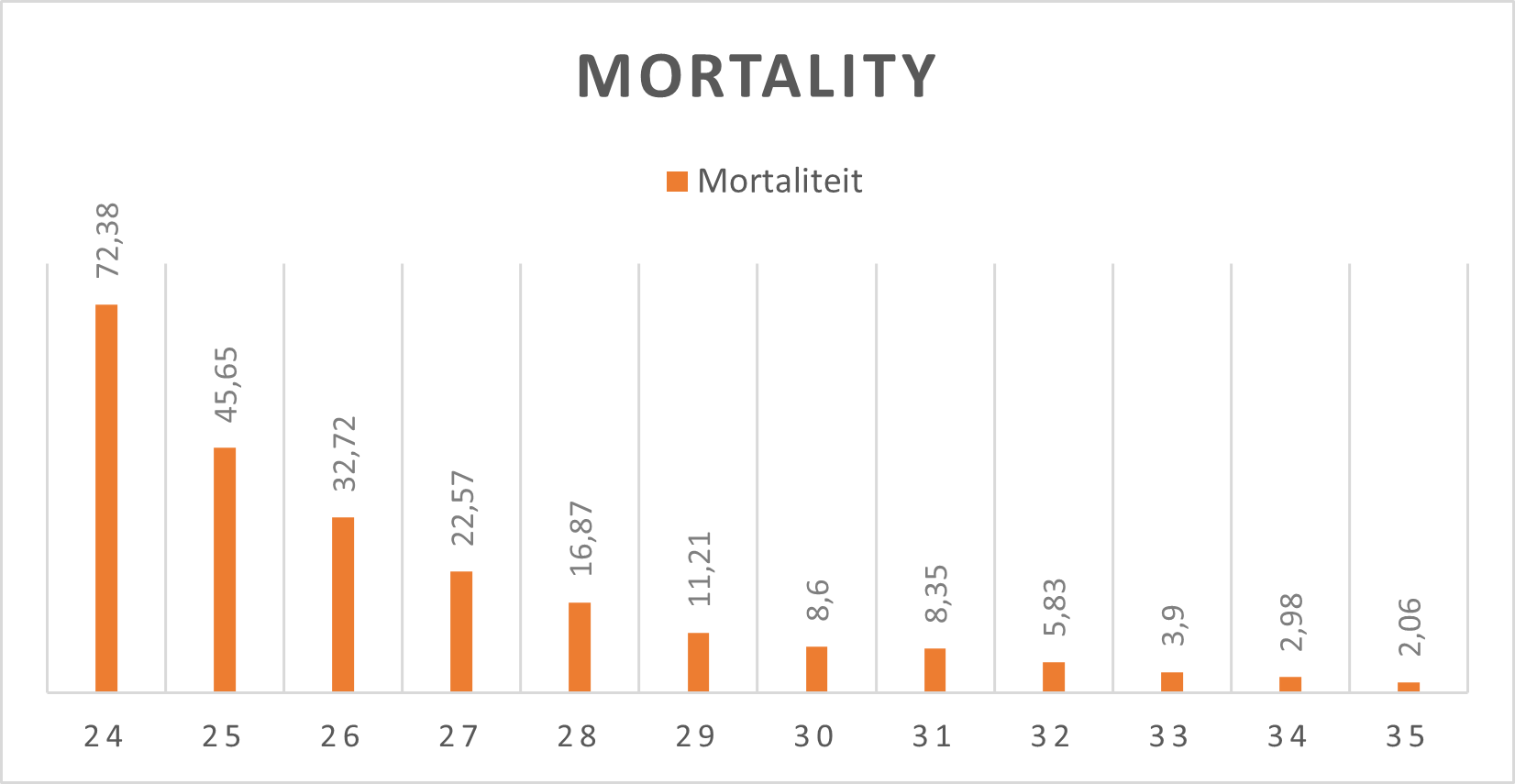
Tabel 1 en Figuur 1 tonen de meest recente (2016-2021) mortaliteitscijfers vanuit de Nederlandse landelijke PRN database, uitgesplitst naar week zwangerschapsduur.
De landelijke Nederlandse cohort studie (Ravelli 2020) rapporteerde redelijke vergelijkbare overlevingscijfers van prematuren vanuit het jaar 2015 in verschillende gestatieduur groepen: 66% bij 24-27.6 weken, 88% bij 28-31.6 weken en 98% bij 32-36.6 weken.
De Nederlandse cohort studie (van Beek 2021) rapporteerde overlevingscijfers van extreme prematuren geboren in 2016-2018: 53.7% bij 24 weken, 75.1% bij 25 weken en 81.8% bij 26 weken gestatieduur.
Tabel 1. Mortaliteit naar zwangerschapsduur (bron: PRN 2016-2021)*
*De PRN database bevat mogelijk casus waarbij tussen 24-26 weken gestatieduur geen actief beleid is gevoerd.
Figure 1. Mortaliteit naar zwangerschapsduur (bron: PRN 2016-2021)*
*De PRN database bevat mogelijk casus waarbij tussen 24-26 weken gestatieduur geen actief beleid is gevoerd.
De grote cohort studie EPIPAGE-2 uit Frankrijk (Ancel, 2015), toont overleving bij premature geboorte (<34 weken gestatieduur) vanuit het jaar 2011. Overlevingspercentages per week gestatieduur betreffen 31% bij 24 weken, 59% bij 25 weken, 75% bij 26 weken, 82% bij 27 weken, 90% bij 28 weken, 95-97% bij 29-31 weken en 98-99% bij 32-34 weken.
Stoll et al. beschrijft de resultaten van een prospectieve registratie van 34.636 extreme prematuren (<28 weken gestatieduur), geboren in 26 centra in de Verenigde Staten tussen 1993 en 2012. Data vanuit de tijdsperiode 2008 – 2012 (n=8877) tonen een overleving per week gestatieduur van 62% bij 24 weken, 77% bij 25 weken, 85% bij 26 weken, 90% bij 27 weken en 95% bij 28 weken.
Neurocognitieve ontwikkeling bij 2 jaar
Premature geboorte is geassocieerd met een lagere neurocognitieve ontwikkeling ten opzichte van op tijd geboren kinderen. Deze ongelijkheid in intelligentie wordt beschreven in de reviews van Allotey et al. (2017), Twilhaar et al. (2018), en Winter et al. (2023). In deze meta-analyses worden studies meegenomen uit verschillende landen, onder andere de Verenigde Staten, Groot-Brittanie, Canada, Australie en Noorwegen, in de jaren na introductie van antenatale steroiden en surfactant. Verschillende testen van de ontwikkeling worden gebruikt, meestal the Bayleys (BSID I-IV), Wechsler, Kaufman en McCarthy testen welke consistent aanwijzingen laten zien voor lagere scores in ontwikkeling en specifieker in intelligentie bij kinderen tussen de 2 en 5 jaar oud, na premature geboorte.
De review van Allotey et al. (2017) liet zien dat premature kinderen lagere cognitieve scores hadden voor de totale intelligentie (FSIQ; gestandaardiseerd gemiddeld verschil (SMD): 0,70; 95% betrouwbaarheidsinterval (BI): 0,73 tot 0,66), performale intelligentie (PIQ; SMD: 0,67; 95% BI: 0,73 tot 0,60) en verbale intelligentie (VIQ; SMD: 0,53; 95% BI: 0,60 tot 0,47). De zwangerschapsduur bij geboorte verklaarde 38–48% van de waargenomen IQ-variatie. Allotey et al. groepeerden hun studies ook op basis van de mate van prematuriteit. Ze vonden een duidelijk verband tussen het IQ-verschil en het aantal weken te vroeg geboren: <28 weken = 11,7 punten (17 studies); 28-34 weken = 11,0 punten (34 studies); en 34-37 weken = 3,6 punten (5 studies) ten opzichte van op tijd geboren kinderen.
De review van Twilhaar et al. (2018) omvatte 71 studies met in totaal 7752 extreem premature (EP) of zeer premature (VP) kinderen en 5155 controlepersonen. De mediane zwangerschapsduur was 28,5 weken (interkwartielafstand [IQR]: 2,4 weken) en de gemiddelde leeftijd bij beoordeling varieerde van 5,0 tot 20,1 jaar. Premature kinderen hadden een 0,86-standaarddeviatie (SD) lagere IQ-score in vergelijking met de controlepersonen (95% betrouwbaarheidsinterval [BI]: -0,94 tot -0,78; P < 0,001).
Een terugwaartse multiple meta-regressieanalyse, uitgevoerd op studies met complete gegevens voor de genoemde covariabelen (k = 24), toonde aan dat de heterogeniteit in effectgrootte tussen studies significant werd verklaard door de zwangerschapsduur (95% BI: 0,04 tot 0,17; P = 0,002) en bronchopulmonale dysplasie (BPD) (95% BI: -0,01 tot -0,001; P = 0,02). BPD verklaarde 65% van de variatie in intelligentie tussen de studies, waarbij elke procent toename in BPD-prevalentie geassocieerd was met een afname van 0,01-SD in IQ (0,15 IQ-punten; P < 0,001).
Wanneer neurocognitieve ontwikkeling wordt uitgedrukt als het risico op een matige tot ernstige ontwikkelingsstoornis wordt vanuit het Epipage-2 cohort (Ancel, 2015) een vergelijkbare associatie gevonden tussen de mate van vroeggeboorte en de grootte van dit risico. Van de kinderen geboren bij 24-26 weken zwangerschapsduur heeft 28% een matig tot ernstige ontwikkelingsstoornis, ten opzichte van 19% bij 27-31 weken en 12% bij 32-34 weken. Ongeveer de helft van de kinderen geboren na 24-26 weken (52%; 95% BI: 46,4% tot 57,3%) ontving minstens één ontwikkelingsinterventie, terwijl dit percentage afnam tot 26% (95% BI: 21,8% tot 29,4%) bij kinderen geboren na 32-34 weken. Gedragsproblemen werden door ouders het vaakst gerapporteerd als een punt van zorg. Het risico op een ontwikkelingsstoornis werd tevens vergroot bij families van lagere sociaaleconomische klasse.
Zoals beschreven zijn de meeste cohort studies naar ontwikkeling bij prematuren gericht op vroege tot extreem vroege prematuriteit. De laatste jaren komt er meer aandacht voor de effecten van matige tot late prematuriteit. Zo beschrijft de prospectieve longitudinale cohort studie uit Australië van Cheong (2017) bij 198 matig tot laat prematuur (MLPT) geboren kinderen (MLPT) en 183 op tijd geboren controles geëvalueerd op een gecorrigeerde leeftijd van 2 jaar. Er werd getest hoe ze presteerden op een gecorrigeerde leeftijd van 2 jaar in vergelijking met 183 op tijd geboren controles. In vergelijking met de controlegroep hadden MLPT-kinderen op 2-jarige leeftijd een slechtere cognitieve, taal- en motorische ontwikkeling. De aangepaste gemiddelde verschillen in samengestelde scores waren −5,3 (95% betrouwbaarheidsinterval [BI]: −8,2 tot −2,4) voor cognitieve ontwikkeling, −11,4 (95% BI: −15,3 tot −7,5) voor taalontwikkeling, en −7,3 (95% BI: −10,6 tot −3,9) voor motorische ontwikkeling. De kans op ontwikkelingsachterstanden was hoger in de MLPT-groep in vergelijking met de controles, met aangepaste oddsratio’s van 1,8 (95% BI: 1,1–3,0) voor cognitieve achterstand, 3,1 (95% BI: 1,8–5,2) voor taalachterstand, en 2,4 (95% BI: 1,3–4,5) voor motorische achterstand. Hoewel de risico’s op een werkelijke ontwikkelingsachterstand laag zijn (odds ratio’s 2-3%) is het van belang ook deze bevindingen met ouders te delen.
Neurocognitieve-ontwikkelingsuitkomsten op 2-jarige leeftijd
Een verhalend overzichtsartikel met cohortstudie (Winter 2023) presenteerde de volgende resultaten. Het overzichtsartikel omvatte slechts een beperkt aantal studies over premature kinderen die als zuigeling of peuter werden getest. Zeven studies vergeleken het cognitieve vermogen van voldragen kinderen met dat van premature kinderen met behulp van de Bayley-I (Bode et al., 2009; Censullo, 1994; Munck et al., 2010; Sajaniemi et al., 1998), de Bayley-II (Gray et al., 2006) en de Bayley-III (Anderson, 2010; Toome et al., 2012). Het totale aantal deelnemers (n) bedroeg 2088, waarvan 1041 prematuur en 1047 voldragen kinderen, verdeeld over de zeven studies die betrekking hadden op tweejarigen. Voldragen peuters scoorden 8 tot 21 standaardscorepunten hoger op cognitieve tests dan peuters die prematuur geboren waren, met een mediane score van 12 punten verschil. De bevindingen van de studies over kinderen die prematuur geboren waren, zijn samengevat in Tabel 2.
Table 2. Cognitieve scores gehaald door voldragen versus prematuur geboren kinderen getest op de leeftijden 1,5 to 4 jaar in studies opgenomen in overzichtsartikel (Winter 2023)
|
Auteur |
Effect grootte (95% CI) |
IQ gemiddeld verschil |
Totaal N |
Prematuur N |
Voldragen N |
Classificatie |
Leeftijd bij testen |
Schaal |
|
Anderson 2010 |
0,85 (0,65 tot 1,05) |
12,75 |
413 |
211 |
202 |
Groot |
2 years |
Bayley-III |
|
Baron 2012 |
Zeer vroeg geboren 0,35 (0,12 tot 0,58), extreem vroeg geboren 0,88 (0,54 to 1,21) |
5,25 Zeer vroeg geboren 13,20 Extreem vroeg geboren |
396 |
196 Zeer vroeg geboren 0,52 Extreem vroeg geboren |
121 |
Klein Groot |
3 jaars, 3 jaar 11 maanden |
DAS-II CGA |
|
Bode 2009 |
Cohort 1 0,98 (0,69 to 1,26) Cohort 2 0,42 (0,20 to 0,63) |
14,70 Cohort 1, 6,30 Cohort 2 |
542 |
106 Cohort 1, 167 Cohort 2 |
269 |
Groot Klein |
2 jaar |
Bayley-I |
|
Breeman 2015 |
0,97 (0,78 tot 1,16) |
14,55 |
458 |
230 |
228 |
Groot |
4 years |
Columbia Mental Maturity Scale |
|
Caravale 2005 |
0,96 (0,42 to 1,49) |
14,40 |
60 |
30 |
30 |
Groot |
3 jaar, 4 jaar
|
Stanford Binet |
|
Censullo 1994 |
0,87 (0,43 tot 1,31) |
13,05 |
87 |
40 |
47 |
Groot |
2 jaar |
Bayley-1 |
|
Gray 2006 |
0,61 (0,33 tot 0,89) |
9,15 |
204 |
100 |
104 |
Medium |
2 jaar |
Bayley-II |
|
Munck 2010 |
0,59 (0,39 to 0,80) |
8,85 |
374 |
182 |
192 |
Groot |
2 jaar gecorrideerd |
Bayley-1 |
|
Sajaniemi 1998 |
1,31 (0,97 tot 1,65) |
19,65 |
160 |
80 |
80 |
Groot |
1 jaar 8 maanden tot 2 jaar 4 maanden |
Bayley-I |
|
Toome 2012 |
Zeer vroeg geboren 0,56 (0,32 tot 0,79) Extreem vroeg geboren 1,11 (0,59 to 1,62) |
8,40 Zeer vroeg geboren 16,65 Extreem vroeg geboren |
308 |
17 Extreem vroeg geboren 138 Zeer vroeg geboren |
153 |
Medium Groot |
2 years corr age |
Bayley-III |
|
Woodward 2009 |
Zeer vroeg geboren 0,67 (0,34 tot 0,98) Extreem vroeg geboren 0,74 (0,37 tot 1,10) |
10,05 Zeer vroeg geboren 11,10 Extreem vroeg geboren |
212 |
62 Zeer vroeg geboren 43 Extreem vroeg geboren |
107 |
Medium Groot |
4 years corr age |
WPPSI-R |
De cohortstudie onderzocht de langetermijn uitkomsten bij 66 extreem premature en 70 matig premature kinderen. De extreem premature kinderen scoorden significant lager dan de matig premature kinderen op vier subtests, waarbij de effectgroottes klein waren voor de subtests expressieve communicatie (p2=0,03p^2 = 0,03p2=0,03), cognitie (p2=0,04p^2 = 0,04p2=0,04), en fijne motoriek (p2=0,05p^2 = 0,05p2=0,05), en middelgroot voor de subtest grove motoriek (p2=0,06p^2 = 0,06p2=0,06). Er was geen statistisch significant verschil (p<0,05p < 0,05p<0,05) tussen de extreem en matig premature kinderen op de subtest receptieve communicatie.
De extreem premature kinderen scoorden significant lager dan de voldragen kinderen op alle vijf subtests. De effectgroottes waren middelgroot voor expressieve communicatie (p2=0,08p^2 = 0,08p2=0,08) en receptieve communicatie (p2=0,11p^2 = 0,11p2=0,11), en groot voor cognitie (p2=0,17p^2 = 0,17p2=0,17), grove motoriek (p2=0,20p^2 = 0,20p2=0,20) en fijne motoriek (p2=0,22p^2 = 0,22p2=0,22).
Wanneer de matig premature kinderen als referentiegroep werden gebruikt, scoorden zij statistisch significant lager dan de voldragen controles op vier subtests: receptieve communicatie, cognitie, en grove motoriek (alle met kleine effectgroottes, p2=0,04p^2 = 0,04p2=0,04), en fijne motoriek, met een middelgrote effectgrootte (p2=0,07p^2 = 0,07p2=0,07). Er was geen statistisch significant verschil (p<0,05p < 0,05p<0,05) tussen de matig premature en voldragen kinderen op de subtest expressieve communicatie.
Zie Tabel 3 voor de gemiddelde scores per prematuriteitsstatus.
Table 3. Subtest standaardscores per groep (Winter 2023)
|
|
Extreem vroeg geboren (n=66) (<32 weken) |
Zeer vroeg geboren (n=70) (32-36 weken) |
Voldragen Controles (n=133) (≥37 weken) |
Gecombinered prematuur (n=136) (<37 weken) |
Gecombineerd Prematuur 2-17 Maanden-Oud (n=63) |
Gecombineerd Prematuur 18-42 Maanden-Oud) (n=73) |
|
|
M (SD) |
M (SD) |
M (SD) |
M (SD) |
M (SD) |
M (SD) |
|
Cognitief |
83,6 (21,1) |
93,4 (18,1) |
102,1 (15,0) |
88,7 (20,1) |
80,7 (18,5) |
95,5 (19,0) |
|
Receptieve Communicatie |
87,7 (17,7) |
94,4 (18,6) |
102,2 (15,7) |
91,1 (18,4) |
86,4 (14,7) |
95,1 (20,3) |
|
Expressieve Communicatie |
88,4 (16,7) |
96,1 (17,8) |
100,7 (16,1) |
92,4 (17,6) |
91,1 (17,4) |
93,5 (17,9) |
|
Fijne Motoriek |
81,9 (16,8) |
90,8 (14,5) |
100,6 (13,4) |
86,5 (16,2) |
82,9 (16,6) |
89,6 (15,4) |
|
Grove Motoriek |
81,9 (15,8) |
92,4 (16,1) |
100,0 (14,0) |
87,3 (16,8) |
85,3 (18,0) |
89,0 (15,6) |
Opmerking: De subschaalscores van de Bayley-4 hebben een gemiddelde (M) van 10 en een standaarddeviatie (SD) van 3. Voor een betere interpretatie hebben we de subschaalscores omgezet naar standaardscores met een gemiddelde van 100 en een standaarddeviatie van 15. Deze statistische transformaties komen overeen met de conversietabel in de technische handleiding van de Bayley-4 (Bayley en Aylward, 2019). (Winter et al., 2023)
Waarden en voorkeuren van ouders
Bij een verwachte vroeggeboorte behoort informatie over de prognose van het kind aan de ouders verstrekt te worden. De belangrijkste risico’s om te bespreken is de kans op sterfte en kans op overleving met ernstige handicap. Bij het gebruik van deze termen is het van belang dat het voor de ouders duidelijk is wat onder ernstige of lichte handicap wordt verstaan en welke verschillende domeinen van ontwikkeling er bestaan (motoriek, cognitie, visus, gehoor, gedrag, psychosociaal functioneren).
Bovenstaand literatuuroverzicht en tabellen zijn bedoeld om houvast te bieden tijdens het counselingsgesprek. De meeste ouders willen geen percentages of risico-berekening horen tijdens een dergelijk gesprek maar hebben meer aan een globale uitleg over de risico’s bij vroeggeboorte bij een gegeven zwangerschapstermijn. Het is aan de professional om samen met ouders te exploreren in hoeveel detail er dus wordt ingegaan op het mortaliteitsrisico en risico op ernstige handicap (zie ook Submodule 2 en 3).
Kosten (middelenbeslag)
Bij de counseling van ouders zijn geen grote kosten te verwachten.
Aanvaardbaarheid, haalbaarheid en implementatie
Hier zijn geen haalbaarheid of implementatieproblemen te verwachten.
Onderbouwing
Achtergrond
Bij een verwachte vroeggeboorte behoort de meest relevante informatie over de prognose van het kind aan de ouders verstrekt te worden. Het gaat dan om de kans op sterfte, overleving zonder handicap en overleving met lichte tot ernstige handicap. Daarnaast kunnen korte (tot lange) termijn complicaties optreden welke invloed hebben op de kans op sterfte of het ontstaan van handicaps. Onder deze complicaties vallen RDS, BPD, IVH, PVL, ROP, NEC, neonatale sepsis.
De domeinen van ontwikkeling waarin zich een handicap kan voordoen, zijn: motoriek (bijvoorbeeld cerebrale parese (CP)), gehoor, visus, cognitie, gedrag en psychosociaal functioneren. In de talrijke nationale en internationale publicaties betreffende uitkomst na vroeggeboorte worden veel verschillende testen gebruikt om de verschillende domeinen van ontwikkeling te kwantificeren. Nog weinig onderzoek is gericht op (ouder en) patientgerichte uitkomsten. De Bayley Scales of Infant and Toddler Development (BSID; Bayley 2006; San Antonio) is op dit moment de beste en meest algemeen aanvaarde ontwikkelingstest voor jonge kinderen (van 4-5 jaar). De BSID wordt op grote schaal gebruikt in de follow-up van te vroeg geborenen voor de kwantificatie van motorische (Psychomotor Development Index; PDI) en mentale (Mental Development Index; MDI) ontwikkeling.
Het is belangrijk dat met ouders wordt besproken wat wordt bedoeld met milde en ernstige handicaps, omdat deze termen niet eenduidig zijn gedefinieerd in de literatuur. Daarnaast is het goed te beseffen dat standaard uitkomstmaten niet per definitie bepalend zijn voor kwaliteit van leven. Veel studies gebruiken de classificaties van de EpiCure-studiegroep (Marlow 2005). In deze studie wordt gesproken van ernstige handicaps als het kind naar alle waarschijnlijkheid in hoge mate afhankelijk wordt van zorg van anderen, bij ernstige cerebrale parese, een IQ van meer dan 3 SD onder het gemiddelde, doofheid en blindheid. Milde handicaps worden door Marlow gedefinieerd als minder ernstige motorische afwijkingen, visusproblemen (geen blindheid) en gehoorverlies waarvoor hulpmiddel noodzakelijk is en een IQ van meer dan 2 SD onder het gemiddelde. Combinaties van handicaps uit verschillende domeinen kunnen ernstige gevolgen hebben voor het functioneren op latere leeftijd.
Samenvatting literatuur
Description of studies
Mortality
No systematic reviews on mortality after preterm birth were published in the past ten years. Four cohort studies were used. Also, data from the Dutch National registry (Perined) were used.
A nationwide cohort study on mortality rates, was performed in the Netherlands (Ravelli, 2020) among 996,423 singleton births in 2010–2015 with a gestational age between 24.0 and 42.6 weeks. Trend tests, univariate and multivariable logistic regression analyses were used. Separate analyses for gestational age subgroups and line of care were done.
A national cohort study on mortality rates in extremely preterm infants, was performed in the Netherlands (van Beek, 2011) among all 3312 stillborn and live born infants with a gestational age between 240/7 and 266/7 weeks born between January 2011 and December 2017.
The EPIPAGE-2 study is a national, prospective, population-based cohort study conducted in all maternity and neonatal units in France in 2011, reporting on survival to discharge and survival without adverse outcomes. A total of 2205 births (stillbirths and live births) and terminations of pregnancy at 22 through 26 weeks’ gestation, 3257 at 27 through 31 weeks, and 1234 at 32 through 34 weeks were studied.
Stoll et al, describes the prospective registry of 34,636 infants 22–28 weeks’ gestational age (GA) and 401–1500 gram birthweight born at 26 Network centers in the United States of America, 1993–2012. Outcome measures are maternal/neonatal care, major morbidities, and survival.
Neurodevelopmental outcome at 2 years
The publication of Twilhaar (2018) was a meta-analysis of cohort studies reporting intelligence scores of extremely preterm (EP) or very preterm (VP) children (<32 weeks of gestation) and full-term controls at age 5 years or older, born in the antenatal corticosteroids and surfactant era. PubMed, WebofScience, and PsycINFO (last search March 2,2017) were searched without language restriction using cominations of the following search terms: prematur*, preterm, low birth weight, elbw, vlbw, intelligence, intellect*, IQ, cognit*, mental,abilit*,perform*,function*,disabilit*,impair*,disorder*, and retard*. A total of 268 studies met selection criteria, of which 71 covered unique cohorts. Standardized mean differences in intelligence per study were pooled using random-effects meta-analysis. Primary outcome was intelligence. Covariates included gestational age, birth weight, birth year, age at assessment, sex, race/ethnicity, socioeconomic status, small for gestational age, intraventricular hemorrhage, periventricular leukomalacia, bronchopulmonary dysplasia (BPD), necrotizing enterocolitis, sepsis, and postnatal corticosteroid use.
The review (Allotey, 2017) searched for observational studies that reported neuro-developmental outcomes from 2 years of age in children born preterm compared with a term-born cohort. Pubmed and Embase were searched from January 1980 to December 2016 using search terms ‘preterm’, ‘premature’ or ‘near term’. From 3830 identified citations, 74 observational studies (64.061 children) were included. Individual estimates of standardised mean differences (SMD) and odds ratios (OR) with 95% confidence intervals were pooled, using a random effects model. Studies either reported general intelligence such as IQ or used standardised intelligence tests such as the Wechsler Intelligence Scale for Children, Stanford Binet intelligence test, Kaufman Assessment Battery for Children and McCarthy Scales of Children’s Abilities were used to assess cognitive function.
One comprehensive meta-analysis combined with a cohort study (Winter 2023) of 66 children that were born extremely premature, 70 moderately premature amd 133 fullterm born children was found. It looked at long-term outcomes in extremely premature and moderately premature born children. This study analyzed Bayley-4 data for 66 extremely premature infants (<32 weeks), 70 moderately premature infants (32–36 weeks), and 133 full-term infants, ages 2 to 42 months (median 20 months, SD 12.0).
A prospective longitudinal cohort study (Cheong 2017) at a single tertiary hospital in Australia included 198 moderate to late preterm infants (32-36 weeks’ gestation) and 183 healthy full-term controls (≥37 weeks’ gestation) recruited at birth, during 2009 – 2012. Main outcomes were cerebral palsy, blindness, and deafness assessed by a pediatrician; cognitive, language, and motor development assessed using the Bayley Scales of Infant Development–Third Edition. Developmental delay was defined as less than −1 SD relative to the mean in controls in any domain of the scales.
The population based cohort study Epipage-2 (Ancel, 2015) consisted of 4441 preterm children, born at 24 – 34 weeks of gestation in 2011 in France. For longterm follow-up at 5,5 years old, 3083 children were assessed. Severe/moderate neurodevelopmental disabilities were defined as severe/moderate cerebral palsy, or unilateral/bilateral blindness or deafness, or full scale intelligence quotient less than -2SD (Wechsler Preschool and Primary Scale of Intelligence, 4th edition).
Results
Mortality
The perinatal mortality rate after preterm birth in the Netherlands (Ravelli 2020) decreased significantly from 6.1 in 2010 to 5.6 per 1000 in 2015 to 4.6 per 1000 in 2015. Survival from the year 2015 was reported in different groups according to gestational age: 66% for 24-27.6 weeks of gestational age, 88% for 28-31.6 weeks and 98% for 32-36.6 weeks.
Mortality rates following extreme preterm birth were reported from the EPI-DAF cohort (van Beek 2021): 53.7% for 24 weeks of gestational age 75.1% for 25 weeks and 81.8% for 26 weeks.
The Epipage-2 cohort (Ancel, 2015) showed percentages of survival to discharge: 31.2% of those born at 24 weeks, 59.1% at 25 weeks, and 75.3% at 26 weeks. Survival rates were 93.6% at 27 – 31 weeks and 98.9% at 32 – 34 weeks.
Data on survival in the extreme preterm cohort from the USA (Stoll, 2015) was reported for the era 2008 – 2012 (n=8877). Survival rates reported by week of gestational age were 62% at 24 weeks, 77% at 25 weeks, 85% at 26 weeks, 90% at 27 weeks and 95% at 28 weeks of gestational age.
The team has drawn up a table with mortality data plotted per week of gestational age (Table 1). This table can provide parents with additional information. It was decided to use recent data from the Dutch national perinatal database, given the fact that there is a great variation in international, often dated studies and their outcomes, see Table 1.
Level of evidence of the literature
These results could not be graded.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the incidence of adverse events for preterm born children (<37 weken)?
Relevant outcome measures
The guideline development group considered perinatal death, survival without severe handicap and neurodevelopmental outcome at 2 years of age as critical outcome measures for counseling.
Search and select (Methods)
An exploratory search was done in the databases Cochrane Library and Pubmed with search terms ‘preterm labour’ and ‘predictive model’ from 2014 until the 10th of July, 2024. This search resulted in an enormous amount of hits so an additional manual search was performed by two neonatologists. In total, eight studies were selected.
Studies were selected based on the following criteria:
- Systematic reviews.
- Outcome measures mortality, survival without servere handicap, neurodevelopmental outcome (BSID).
- The study population consisted of premature born children between 24 and 37 weeks of gestational age.
- Full-text English language publication.
Results
The eight studies included two systematic reviews, five cohort studies and one comprehensive meta-analysis combined with a cohort study.
Referenties
- Allotey J, Zamora J, Cheong-See F, Kalidindi M, Arroyo-Manzano D, Asztalos E, van der Post J, Mol BW, Moore D, Birtles D, Khan KS, Thangaratinam S. Cognitive, motor, behavioural and academic performances of children born preterm: a meta-analysis and systematic review involving 64 061 children. BJOG. 2018 Jan;125(1):16-25. doi: 10.1111/1471-0528.14832. Epub 2017 Oct 11. PMID: 29024294.
- Ancel PY, Goffinet F; EPIPAGE-2 Writing Group; et al. Survival and morbidity of preterm children born at 22 through 34 weeks' gestation in France in 2011: results of the EPIPAGE-2 cohort study. JAMA Pediatr. 2015 Mar;169(3):230-8. doi: 10.1001/jamapediatrics.2014.3351. Erratum in: JAMA Pediatr. 2015 Apr;169(4):323. doi: 10.1001/jamapediatrics.2015.0528. Alberge, Catherine [Corrected to Alberge, Corine]. PMID: 25621457.
- Cheong JL, Doyle LW, Burnett AC, Lee KJ, Walsh JM, Potter CR, Treyvaud K, Thompson DK, Olsen JE, Anderson PJ, Spittle AJ. Association Between Moderate and Late Preterm Birth and Neurodevelopment and Social-Emotional Development at Age 2 Years. JAMA Pediatr. 2017 Apr 3;171(4):e164805. doi: 10.1001/jamapediatrics.2016.4805. Epub 2017 Apr 3. PMID: 28152144.
- Marlow N, Wolke D, Bracewell MA, Samara M; EPICure Study Group. Neurologic and developmental disability at six years of age after extremely preterm birth. N Engl J Med. 2005 Jan 6;352(1):9-19. doi: 10.1056/NEJMoa041367. PMID: 15635108. Ravelli ACJ, Eskes M, van der Post JAM, Abu-Hanna A, de Groot CJM. Decreasing trend in preterm birth and perinatal mortality, do disparities also decline? BMC Public Health. 2020 May 26;20(1):783. doi: 10.1186/s12889-020-08925-w. PMID: 32456627; PMCID: PMC7249399.
- Ravelli ACJ, Eskes M, van der Post JAM, Abu-Hanna A, de Groot CJM. Decreasing trend in preterm birth and perinatal mortality, do disparities also decline? BMC Public Health. 2020 May 26;20(1):783. doi: 10.1186/s12889-020-08925-w. PMID: 32456627; PMCID: PMC7249399.
- Stoll BJ, Hansen NI, Bell EF, Walsh MC, Carlo WA, Shankaran S, etv al. Trends in Care Practices, Morbidity, and Mortality of Extremely Preterm Neonates, 1993-2012. JAMA. 2015 Sep 8;314(10):1039-51. doi: 10.1001/jama.2015.10244. PMID: 26348753; PMCID: PMC4787615.
- Twilhaar ES, Wade RM, de Kieviet JF, van Goudoever JB, van Elburg RM, Oosterlaan J. Cognitive Outcomes of Children Born Extremely or Very Preterm Since the 1990s and Associated Risk Factors: A Meta-analysis and Meta-regression. JAMA Pediatr. 2018 Apr 1;172(4):361-367. doi: 10.1001/jamapediatrics.2017.5323. PMID: 29459939; PMCID: PMC5875339.
- van Beek PE, Groenendaal F, Broeders L, Dijk PH, Dijkman KP, van den Dungen FAM, van Heijst AFJ, van Hillegersberg JL, Kornelisse RF, Onland W, Schuerman FABA, van Westering-Kroon E, Witlox RSG, Andriessen P. Survival and causes of death in extremely preterm infants in the Netherlands. Arch Dis Child Fetal Neonatal Ed. 2021;106(3):251-257.
- Winter EL, Caemmerer JM, Trudel SM, deLeyer-Tiarks J, Bray MA, Dale BA, Kaufman AS. Does the Degree of Prematurity Relate to the Bayley-4 Scores Earned by Matched Samples of Infants and Toddlers across the Cognitive, Language, and Motor Domains? J Intell. 2023 Nov 8;11(11):213. doi: 10.3390/jintelligence11110213. PMID: 37998712; PMCID: PMC10671985.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-08-2025
Beoordeeld op geldigheid : 03-06-2025
De Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV) heeft een formele verklaring van geen bezwaar gegeven.
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2022 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor zwangeren waarbij sprake is van een dreigende vroeggeboorte.
Werkgroep
- Dr. C.J. (Caroline) Bax, gynaecoloog-perinatoloog, NVOG (voorzitter)
- Dr. J.B. (Jan) Derks, gynaecoloog-perinatoloog, NVOG
- Dr. A. (Ayten) Elvan-Taşpınar, gynaecoloog-perinatoloog, NVOG
- Dr. H.M. (Marieke) Knol, gynaecoloog-perinatoloog, NVOG
- Dr. M.A. (Marjon) de Boer, gynaecoloog-perinatoloog, NVOG
- Dr. D.N.M. (Dimitri) Papatsonis, gynaecoloog, NVOG
- Dr. D.E. (Lia) Wijnberger, gynaecoloog, NVOG
- Dr. P.H. (Dijk), kinderarts-neonatoloog, NVK
- Drs. L. (Leanne) Erkelens-de Vetten, kinderarts-neonataloog, NVK
- Drs. C. (Christel) Rolf, klinisch verloskundige, KNOV (tot maart 2023)
- Drs. C. (Cedric) van Uytrecht, klinisch verloskundige, KNOV (tot 15 augustus 2023)
- Drs. D. (Daphne) de Jong, eerstelijns verloskundige, KNOV (vanaf september 2023)
- Drs. M.A.M. (Machteld) van der Noll, verloskundige, KNOV
- Dr. I.F. (Igna) Kwint-Reijnders, patiëntenvertegenwoordiging Care4Neo
Klankbordgroep
- Drs. H.I. (Herma) Davelaar – van Zanten, V&VN Voortplanting, Obstetrie & Gynaecologie (tot mei 2024)
- Dhr. M. (Maikel) Hustinx, bestuurslid afdeling Vrouw & Kind V&VN (vanaf mei 2024)
Met ondersteuning van
- Drs. D.A.M. (Danique) Middelhuis, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. T. (Tessa) Geltink, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (tot april 2023)
- Dr. M.L. (Marja) Molag, adviseur, Kennisinstituut van de Federatie Medsich Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep |
||||
|
Achternaam werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bax (voorzitter) |
Gynaecoloog-perinatoloog AmsterdamUMC |
Allen onbetaald: Adviesraad MADAM project Lid Raad kwaliteit FMS Organisatie en docent basiscursus prenatale counseling Amsterdam UMC Audit voorzitter in regio Amsterdam Lid Dagelijks bestuur koepel kwaliteit |
ZonMW subsidie voor onderzoek naar NIPT |
Geen restricties |
|
Knol |
Perinataloog Isala Kliniek Zwolle |
Lid werkgroep Otterlo NVOG Lid wetenschapscommissie NVOG Lokale hoofdonderzoeker consortiumstudie apostel 8 |
Geen |
Geen restricties |
|
Elvan-Taspinar |
Perinatoloog UMCG |
Instructeur MOET onbetaald |
Geen |
Geen restricties |
|
Van Uytrecht |
Physician Assistant- Obstetrie |
Training acute verloskunde te Medsim. Verloskundige/ Physician Assistant te Maxima Medisch Centrum te Veldhoven |
Geen |
Geen restricties |
|
Rolf |
Physician Assistant Obstetrie; functie van afdelingsarts op de high care verloskunde( OHC), Máxima MC. Betaalde functie |
Klinisch verloskundige, Máxima MC, betaalde functie |
Geen |
Geen restricties |
|
Papatsonis |
Gynaecoloog Amphia Ziekenhuis Breda |
Geen |
Geen |
Geen restricties |
|
Kwint-Reijnders |
Patientvertegenwoordiger namens Care4Neo, experienced expert |
Gynaecoloog i.o. VAGO afgevaardigde in het pijlerbestuur NVOG werkgroep foetomaternale geneeskunde |
In mijn werkzaamheden als gynaecoloog in opleiding werk ik zelf met dreigende vroeggeboorte casuïstiek en met collega's die uitvoering geven aan deze richtlijn. Daarnaast heb ik zitting als VAGO-afgevaardigde in het pijlerbestuur van de NVOG werkgroep foetomaternale geneeskunde, waarin ook onderwerpen geadresseerd worden die gerelateerd zijn aan dreigende vroeggeboorte. |
Geen restricties |
|
Derks |
Gynaecoloog, afdeling verloskunde, WKZ, UMCU.
|
Betrokken bij de richtlijn preventie vroeggeboorte, onderdeel van de Otterlo, deze commissie schrijft de verloskunde richtlijnen voor de NVOG |
Ik ben binnen mijn kliniek betrokken bij de behandeling van patienten met vroeggeboorte (in de anamnese). Gezien mijn expertise op dit gebied zie ik veel patienten met vroeggeboorte |
Geen retricties |
|
De Vetten |
Kinderarts-neonatoloog, Martini ziekenhuis Groningen |
Geen |
Geen |
Geen restricties |
|
Wijnberger |
Gynaecoloog en perinatoloog Rijnstate Ziekenhuis Arnhem |
Lid werkgroep Otterlo (richtlijnontwikkeling) onbetaald Opleider, onbetaald |
Geen |
Geen restricties |
|
Van der Noll |
Klinisch verloskundige - Master Physician Assistant (inactief) Docent Verloskunde Ba-VKV Rotterdam (actief) |
Geen |
Geen |
Geen restricties |
|
De Boer |
Gynaecoloog |
Geen |
Geen |
Geen restricties |
|
Dijk |
Kinderarts-neonatoloog UMC Groningen |
Lidmaatschap Neonatologie Netwerk Nederland Lid LNR werkgroep Perined/NVK Lid werkgroep Nedederlands Kinderformularium NKFK Lid consortium PedMed-Nl Lid werkgroep revisie RL Hyperbilirubinemie Adviesraad N3 Adviesraad Zwangerschap en Geboorte Consortium Noord Nederland Lid werkgroep Kinderformularium Lid Pedmed Lid sectie Neonatologie Lid werkgroep SPIN |
Geen |
Geen restricties |
|
De Jong |
Eerstelijns verloskundige De Geboortezaak Nieuwegein Klinisch epidemioloog |
Klinisch epidemioloog Lid werkgroep HPP in de 1e lijn Lid werkgroep Handreiking indicaties vitaliteitsecho |
Geen |
Geen restricties |
|
Klankbordgroep |
||||
|
Achternaam klankbordgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Davelaar-Van Zanten |
Adviseur kwaliteit en veiligheid (betaalde functie/reguliere baan) Spaarne Gasthuis |
Geen |
Geen |
Geen restricties |
|
Maikel Hustinx |
Verpleegkundig Specialist, Albert Schweitzer Ziekenhuis, 36u p.w. |
Algemeen bestuurslid V&VN afdeling Vrouw en Kind, vrijwillig. Vice-voorzitter Vereniging Verpleegkundig Specialisten Albert Schweitzer Ziekenhuis, vrijwillig Lid landelijke tafel College Perinatale Zorg, Utrecht, vrijwillig |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en Care4Neo voor de schriftelijke knelpuntenanalyse en afvaardiging namens Care4Neo in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen zie per module ook “Waarden en voorkeuren van patiënten”). De conceptrichtlijn is tevens voor commentaar voorgelegd aan Patiëntenfederatie Nederland en Care4Neo en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Counseling
|
Geen financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat [het overgrote deel (±90%) van de zorgaanbieders en zorgverleners al aan de norm voldoet OF het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft]. Er worden daarom geen financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor zwangeren waarbij sprake is van dreigende vroeggeboorte. Tevens zijn er knelpunten aangedragen door Inspectie Gezondheidszorg en Jeugd, Nederlandse Vereniging voor Obstetrie en Gynaecologie, de Koninklijke Nederlandse Organisatie van Verloskundigen en Care4Neo via een schriftelijke knelpuntenanalyse. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.