Indicatiestelling repositie bij distale radiusfracturen
Uitgangsvraag
Wat is de indicatiestelling voor repositie van een gedisloceerde distale radiusfractuur op de spoedeisende hulp (SEH)?
Deze uitgangsvraag omvat de volgende deelvragen:
- Wat is de indicatie voor repositie van een gedisloceerde distale radiusfractuur met een reeds gestelde operatie-indicatie?
- Wat is de indicatie voor repositie van een gedisloceerde distale radiusfractuur waarbij er op grond van de primaire stand zoals gepresenteerd op de SEH er (nog) geen operatie-indicatie bestaat?
Aanbeveling
Repositie van gDRF bij een reeds gestelde operatie-indicatie
Overweeg een gedisloceerde distale radiusfractuur niet te reponeren bij primaire presentatie in het ziekenhuis als er een duidelijke operatie-indicatie is én dit is geaccordeerd zowel door de behandelaar als de patiënt of diens wettelijk vertegenwoordiger middels een informed consent.
Reponeer een gedisloceerde distale radiusfractuur waar al een operatie-indicatie is gesteld bij voorkeur wél eenmalig bij:
- een bedreigde huid;
- neurovasculaire bedreiging.
Repositie van gDRF waarbij er op grond van de primaire stand zoals gepresenteerd op de SEH er (nog) geen operatie-indicatie bestaat
Reponeer een gedisloceerde radiusfractuur die niet voldoet aan de criteria van acceptabele stand én waarbij er op grond van de primaire stand (nog) geen operatie-indicatie bestaat.
Schat in of de stand acceptabel is aan de hand van de volgende criteria:
- < 10 graden dorsale kanteling;
- < 20 graden volaire kanteling;
- < 2 millimeter step-off intra-articulair;
- < 3 millimeter radiale verkorting;
- > 15 graden radiale inclinatie;
- afwezige translatie en intacte radiocarpale alignement in de laterale opname
- afwezige significante translatie in de PA opname.
Reponeer bij voorkeur eenmalig.
Overleg met een ter zake kundig specialist bij twijfel over de stand na repositie.
Reponeer niet opnieuw als op termijn na initiele repositie een secundaire dislocatie optreedt.
Repositie van gDRF als onderdeel van in opzet niet-operatieve behandeling
Overweeg samen met de patiënt of diens wettelijke vertegenwoordiger een gedisloceerde distale radiusfractuur niet te reponeren als geen/weinig voordeel van een repositie te verwachten is, bijvoorbeeld bij patiënten met:
- onvermogen om de aangedane hand en pols in het dagelijks leven in te zetten door beperkingen of ernstige inactiviteit;
- gevorderde dementie;
- hoge leeftijd.
Overwegingen
Op basis van de beschikbare literatuur (twee studies met een gradering ‘zeer laag’), kan er geen antwoord worden gegeven op de vraag of er meerwaarde is van een gesloten repositie van een gedisloceerde distale radius fractuur, bij een reeds gestelde operatie-indicatie (groep 1). Daarom is aanbeveling gebaseerd op consensus binnen de werkgroep.
Tevens kan er op basis van de beschikbare literatuur (1 studie met een zeer lage gradering) geen antwoord worden gegeven op de vraag of er meerwaarde is van een gesloten repositie van een gedisloceerde distale radius fractuur als er voor een primair niet-operatieve behandeling wordt gekozen (groep 2). Er is wel indirect bewijs beschikbaar, waarbij radiologische stand ná repositie is gecorreleerd aan functionele outcomes (Mulders, 2018).
Wanneer reponeren
Bij de behandeling van de distale radiusfractuur zijn een aantal factoren bepalend voor de keuze van de behandeling. Naast het type, de stand en de mate van comminutie van de fractuur, zijn ook factoren als de botkwaliteit en de algehele conditie van de patiënt van belang.
Gesloten repositie en gipsimmobilisatie zijn in de huidige praktijk een belangrijk onderdeel van de behandeling van deze fracturen. De initiële stand van de fractuur op het röntgenonderzoek is daarbij leidend. Op basis van deze stand wordt een keuze gemaakt tussen acceptabele stand van de distale radiusfractuur of niet-acceptabele stand. Een niet-acceptabele stand wordt daarbij gedefinieerd als een stand waarbij de radiologische parameters niet binnen een gedefinieerde normale range vallen. Internationaal worden hiervoor meestal de criteria uit de richtlijnen van de AAOS (American Academy of Orthopedic Surgeons, Lichtman, 2011) aangehouden. Als de radiologische parameters binnen deze gedefinieerde range vallen, wordt over het algemeen een niet-operatieve behandeling geadviseerd. De werkgroep definieert op basis van de beschikbare literatuur en expert opinion de volgende criteria voor een acceptabele stand:
Acceptabele stand:
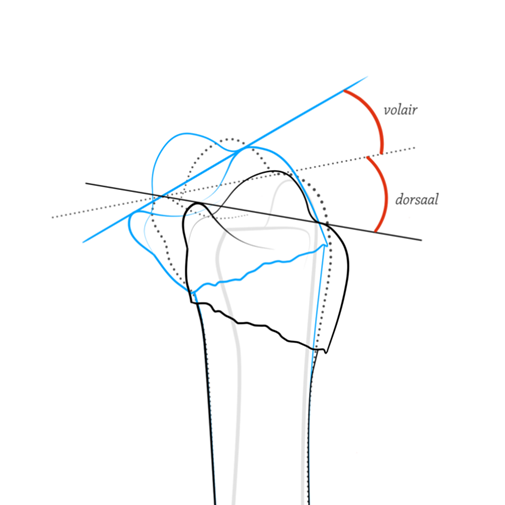
- < 10° dorsale kanteling (tilt) (figuur 1).
- < 20° volaire kanteling (tilt) (figuur 1).
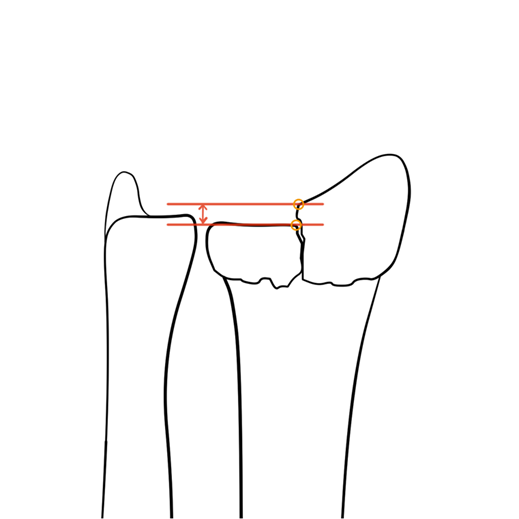
- < 2mm step-off intra-articulair (figuur 2).
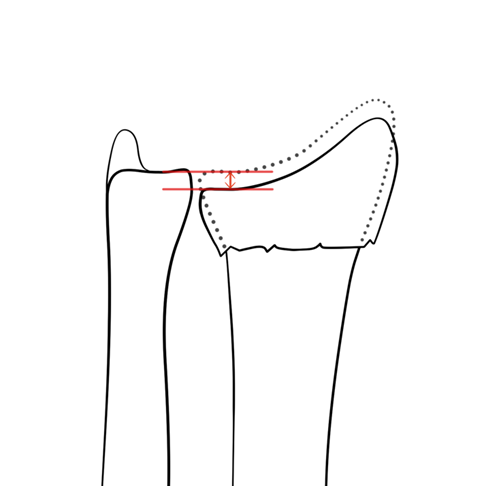
- < 3mm radiale verkorting ten opzichte van de ulna (syn: ulnaire variantie) (figuur 3).
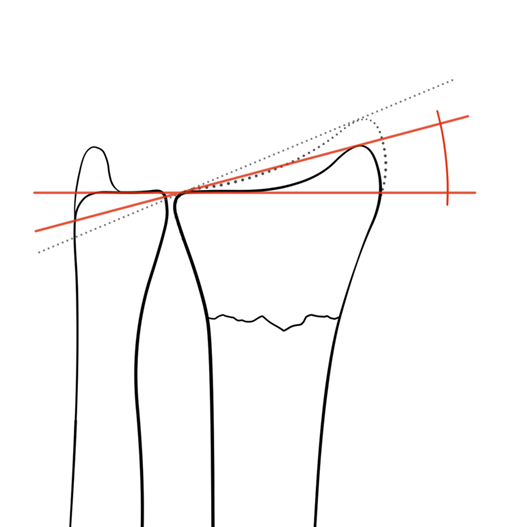
- > 15° radiale inclinatie (figuur 4).
- Afwezige translatie en intacte radiocarpale alignement in de laterale opname (figuur 5).
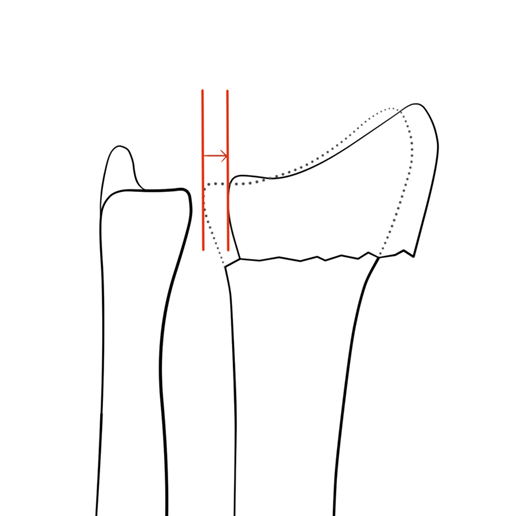
- Afwezige significante translatie in de PA opname (figuur 6).
In de figuren staat weergegeven hoe deze parameters bepaald worden aan de hand van de standaard AP en laterale röntgenfoto van de pols (NB het betreft hier een vereenvoudigde 2D weergave van de werkelijkheid).
Figuur 1 Volaire en dorsale kanteling
Figuur 2 Intra-articulaire step-off
Figuur 3 Radiale verkorting/positieve ulnaire variantie
Figuur 4 Radiale inclinatie
Figuur 5 Volaire en dorsale translatie
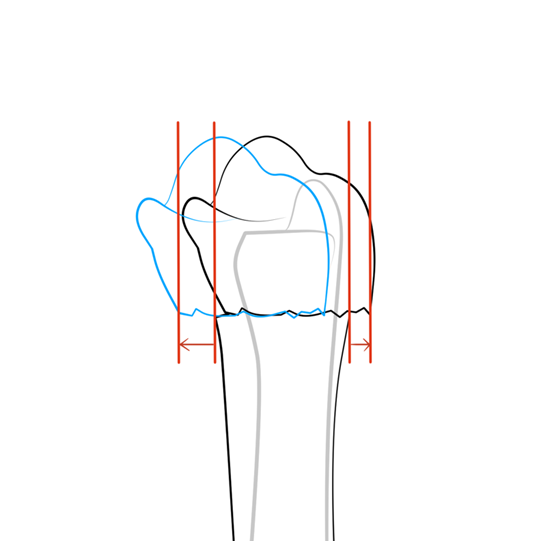
Figuur 6 Radiale translatie
Bovenstaande criteria zijn iets minder liberaal dan de criteria die in de vorige Nederlandse richtlijn werden aangehouden (NVvH; Brink, 2010). In de vorige richtlijn werd gesproken over een acceptabele stand, al dan niet na repositie, indien er sprake was van minder dan 15 graden dorsale kanteling, minder dan 20 graden volaire kanteling en minder dan 5 mm verkorting van de radius ten opzichte van de ulna. Niet-operatieve behandeling werd in die gevallen in de regel geadviseerd.
Op basis van recentere literatuur lijken strengere criteria voor een acceptabele stand zoals nu geformuleerd gerechtvaardigd. Een meta-analyse (Mulders, 2018) laat zien dat er wel degelijk correlatie bestaat tussen een acceptabele stand (al dan niet na repositie) en een slechtere patient reported outcome op termijn. Dat geldt met name voor de populatie jonger dan 65 jaar. Dorsale kanteling en radiale verkorting (i.e. afgenomen ulnar variance) zijn geassocieerd met slechtere patient reported outcomes (DASH scores) (Kvernmo, 2015).
Zoals gezegd zijn in onze search geen studies gevonden waarbij fracturen met een niet-acceptabele stand zonder repositie behandeld zijn. Echter gezien de associatie tussen fracturen die niet-acceptabel staan na repositie én slechtere patiënt reported outcomes is de werkgroep van mening dat een gesloten repositie in principe gerechtvaardigd is.
Op basis van de literatuur is het onduidelijk of repositie van een gedisloceerde distale radiusfractuur noodzakelijk is in die gevallen waar primair voor een operatieve behandeling wordt gekozen. Er zijn geen factoren bekend die het succes van wel of niet reponeren in deze gevallen op langere termijn voorspellen. De werkgroep is van mening dat indien de neurovasculaire status van de hand/pols niet bedreigd is en er op korte termijn (binnen twee weken) een operatieve correctie van de stand van de distale radius fractuur wordt uitgevoerd, een gesloten repositie achterwege kan blijven en alleen een gips ter immobilisatie (en pijnstilling) voldoende is.
Zowel gereponeerde als primair niet-gereponeerde fracturen kunnen secundair dislokeren als gekozen is voor een niet-operatieve behandeling. Na initiële repositie is het percentage fracturen dat alsnog in een niet-acceptabele stand (conform bovenstaande criteria) gaat staan binnen 2 weken helaas vrij hoog (44% (MacKenny, 2006), 41% (Bartl, 2014) en 10 tot 89% (Walenkamp, 2015)). Deze secundaire dislocatie na een initiële goede repositie lijkt met name geassocieerd te zijn met het vrouwelijk geslacht, leeftijd > 60 jaar en de aanwezigheid van dorsale comminutie (Walenkamp, 2015). De eerder beschreven correlatie tussen toegenomen dorsale kanteling, radiaire verkorting en de patient reported outcomes (DASH-scores) (Kvernmo, 2015), dient in dat kader te worden meegenomen in de afweging of verdere niet-operatieve behandeling gerechtvaardigd is na secundaire dislocatie, vastgesteld 1 tot 2 weken na de primaire repositie. De werkgroep raadt hernieuwde gesloten repositie na deze periode af. Indien de stand na de secundaire dislocatie als onacceptabel wordt gezien, dient alsnog een operatieve behandeling te worden overwogen.
In sommige gevallen is de noodzaak om een acceptabele stand (conform bovenstaande criteria) te bereiken veel minder groot. Uit een meta-analyse is gebleken dat het bereiken van een acceptabele stand bij patiënten > 65 jaar, geen voorspeller is voor goede patiënt related outcomes (Mulders, 2018). Daarnaast is de werkgroep van mening dat het bereiken van een acceptabele stand waarschijnlijk geen meerwaarde heeft voor patiënten met een sterk verminderde Activity of Daily Living (ADL), een korte levensverwachting of bij onvermogen om de aangedane hand en pols in het dagelijks leven te gebruiken door motorische beperkingen, invaliditeit of ernstige inactiviteit. In deze gevallen dient te behandelaar het achterwege laten van gesloten repositie te overwegen, al dan niet na overleg met een ervaren collega.
Complicaties
Vaak wordt aangenomen dat reponeren de kans op neurovasculaire beschadiging of huidbedreiging van hand en/of pols doet verminderen. De schaarse literatuur over het optreden van dit type complicatie is echter niet conclusief (Teunis, 2015; Fan 2017). Het is onduidelijk of het niet of juist wél reponeren bijdraagt aan het reduceren van het risico op deze complicaties.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Een patiënt zal in het algemeen kiezen voor de behandeling met de meeste kans op snel, veilig en zo volledig mogelijk herstel. De keuze ligt daarbij bij de patiënt die door de behandelaar goed geïnformeerd is.
Distale radiusfracturen waarbij de operatie-indicatie al gesteld is (groep 1)
Bij een gDRF waarbij er een indicatie tot een operatieve correctie wordt gesteld, is een informed consent noodzakelijk om de voor- en nadelen te bespreken van de operatie én het wel of niet pre-operatief reponeren bij primaire presentatie in het ziekenhuis. Als nu blijkt dat een repositie in dit geval geen bewezen betere uitkomsten oplevert, dan zal de patiënt naar verwachting liever geen onnodige pijn willen hebben van een hematoomblok en repositie en kiezen voor alleen een gipsimmobilisatie in afwachting tot de operatie.
Distale radiusfracturen waarbij operatie-indicatie nog niet duidelijk is (groep 2)
Als een gDRF geen acceptabele stand vertoont, is de werkgroep van mening dat reponeren, met als doel het verkrijgen van een acceptabele stand, voordelen kan hebben indien er redenen zijn om te kiezen voor een niet-operatieve behandeling. Een acceptabele stand leidt op termijn tot minder pijn en betere polsfunctie, vooral bij patiënten < 65 jaar (Grewal, 2007).
Van repositie kan, in overleg met de patiënt of diens vertegenwoordiger, worden afgezien bij hoge co-morbiditeit, hoge leeftijd of sterk verminderde functie of gebruik van de pols.
Kosten (middelenbeslag)
Het is onduidelijk of niet reponeren kostenverhogend of kostenverlagend werkt.
Aanvaardbaarheid, haalbaarheid en implementatie
Aanbeveling 1: overweeg niet te reponeren als er al een operatie-indicatie bestaat (groep 1).
Het niet preoperatief reponeren van een distale radiusfractuur bij primaire presentatie in het ziekenhuis - als dit is geaccordeerd door zowel de behandelaar als de patiënt of diens wettelijk vertegenwoordiger middels een informed consent - zal leiden tot een reductie van het aantal patiënten dat (preoperatief) een repositie ondergaat.
De werkgroep verwacht een brede acceptatie van deze aanbeveling omdat het leidt tot een meer patiëntvriendelijke behandeling, zonder extra pijn van de repositie en de potentieel pijnlijke verdovingsinjectie. Daarnaast leidt het ook mogelijk tot een snellere doorstroming/behandeling op de SEH. De implementatie hiervan zal een aanpassing van de lokale/landelijke protocollen vereisen en het streven naar acceptatie door de individuele behandelaar.
Aanbeveling 2: Reponeer een gedisloceerde radiusfractuur die niet voldoet aan de criteria van acceptabele stand/reponeer in principe eenmalig/overweeg niet te reponeren bij bepaalde patiëntkarakteristieken (groep 2)
Deze aanbeveling is in opzet in overeenstemming met de huidige praktijk in vele klinieken en vergt als zodanig geen grote veranderingen van de huidige praktijk en is daarom volgens de werkgroep aanvaardbaar en haalbaar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Repositie van gDRF bij een reeds gestelde operatie-indicatie
In sommige gevallen is het initieel duidelijk dat een distale radiusfractuur een operatieve correctie behoeft. Uit de literatuur is onvoldoende evidence voor of tegen het pre-operatief reponeren van distale radiusfracturen bij primaire presentatie in het ziekenhuis, waarbij al een operatie-indicatie bestaat (Teunis, 2015; Fan, 2017).
Repositie van gDRF waarbij er op grond van de primaire stand zoals gepresenteerd op de SEH er (nog) geen operatie-indicatie bestaat
Er is zeer beperkte literatuur beschikbaar over de uitgangsvraag wat de indicatie is voor repositie van een gDRF zonder reeds gestelde operatie-indicatie. Vergelijkende studies van fracturen die niet-acceptabel staan en toch niet-gereponeerd zijn, zijn niet gevonden. Daarom zijn de aanbevelingen gebaseerd op een meta-analyse (Mulders, 2018) waarbij slechtere patiënt reported outcomes gevonden zijn bij fracturen met een niet-acceptabele stand.
De werkgroep is van mening dat de voordelen van repositie van een gedisloceerde distale radiusfractuur opwegen tegen de nadelen. Dat wordt ook in andere internationale richtlijnen aangeraden (Lichtman, 2011).
Onderbouwing
Achtergrond
De “gouden standaard” voor de behandeling van een gedisloceerde distale radiusfractuur (gDRF) bestaat van oudsher uit gesloten repositie en gipsimmobilisatie. Er is een groeiende tendens om gDRF primair operatief te behandelen, mede door introductie van (anatomische) hoekstabiele implantaten.
Er is mogelijk een groep patiënten waarbij de repositie achterwege gelaten kan worden, omdat a priori al een operatie-indicatie bestaat op basis van het type fractuur. Het is de vraag of het achterwege laten van gesloten repositie, in afwachting tot de operatie, voor bovenstaande fracturen nadelig is voor de patiënt.
Daarnaast bestaat er een groep patiënten met een gDRF met een niet-acceptabele stand (zie paragraaf ‘wanneer reponeren’) waarbij een gesloten repositie tot een acceptabele stand leidt en daarmee de mogelijkheid van een niet-operatieve behandeling biedt.
Het is de vraag of het huidige beleid van standaard repositie bij deze groep gerechtvaardigd is.
Tot slot is er een patiëntengroep met weliswaar een gDRF, maar met een dusdanige co-morbiditeit dat een operatieve correctie niet gewenst is. Ook hier is de vraag in hoeverre een gesloten repositie zinvol is.
Conclusies / Summary of Findings
Preoperative reduction (group 1)
|
Very low GRADE |
We are uncertain whether closed reduction of a distal radius fracture, prior to planned open reduction and internal fixation (ORIF), results in less pain, compared to no closed reduction prior to planned ORIF, for the treatment of distal radial fractures in adults.
Sources: (Fan, 2017) |
|
Very low GRADE |
We are uncertain whether closed reduction of a distal radius fracture, prior to planned ORIF, results in more complications, in comparison with no closed reduction prior to planned ORIF, for the treatment of distal radial fractures in adults.
Sources: (Fan, 2017; Teunis, 2015) |
|
Very low GRADE |
We are uncertain whether closed reduction of a distal radius fracture, prior to planned ORIF, results in better functional outcomes, in comparison with no closed reduction prior to planned ORIF, for the treatment of distal radial fractures in adults.
Sources: (Fan, 2017) |
Reduction in patients with intention for non-operative treatment (group 2)
|
Very low GRADE |
We are uncertain whether closed reduction of a distal radius fracture results in better functional outcomes in comparison with no closed reduction, for the non-operative treatment of distal radial fractures in adults.
Sources: (Neidenbach, 2010) |
|
- GRADE |
We found no studies that compared closed reduction to no closed reduction for the outcomes secondary surgeries, complications, and pain for the non-operative treatment of distal radius fractures in adults. |
Samenvatting literatuur
Description of studies
A total of three observational studies were included in this literature summary.
Preoperative reduction (group 1)
Fan (2017) retrospectively compared preoperative casting with or without closed reduction in adults with an acute CT-proven DRF. In all 128 patients, the same surgical team performed open reduction and internal fixation (ORIF) with volar locking palmar plates (Deputy company. Closed reduction with casting before surgery was performed in 70 (55%) patients (mean age 46.1 years), plaster or brace immobilization alone before operation in 58 (45%) patients (mean age 43.3 years). Fractures were classified using the AO/Orthopedic Trauma Association (AO/OTA) system, both groups had comparable fracture characteristics and varied between type 23 A-2 and type 23 C-3 fractures. All the patients underwent supervised physiotherapy. The cast was removed at week 2 postoperatively. Patients were encouraged to recover their forearm rotation and finger motion with physiotherapy guidance. The length of follow-up was 12 months. The study was conducted in a University Hospital in China.
Teunis (2015) retrospectively compared preoperative casting with or without closed reduction in adults with a DRF. 1511 patients with a mean age of 54 years underwent open reduction and internal fixation, of this group 102 (7%) did not have reduction before surgery. Sixty-four surgeons treated the cohort. Fracture type was identified by CPT code (extra-articular, intra-articular with 2 or more than 2 articular fragments). The CPT fracture type was not different between the groups. The length of follow-up was 12 months. The study was conducted in three affiliated urban hospitals in a single city in the United States.
Reduction in patients with non-operative treatment (group 2)
Neidenbach (2010) retrospectively compared cast immobilization with or without closed reduction in adults with a moderately to severely displaced DRF. Radiological parameters used to characterize fracture displacement included radial length, ulnar variance, volar tilt angle, radial angle, articular step-off and fracture gap. Fractures were classified according to the AO system as type AO 23-A/B/C (except AO 23A-1). Of the 109 patients with moderate to severe displacement 26 were excluded because they had primary surgery. Of the remaining 83 conservatively treated patients, 62 (75%) (mean age of 61.7 years) received closed reduction plus casting and the other 21 (25%) received casting alone (mean age of 61.5 years). The fracture characteristics were different in both groups: volar tilt was -3° in the no reduction group versus 21° in the reduction group.
Patients without reduction received a dorsal splint that was replaced by a full cast after 1 week. Patients with reduction received a dorsal splint. If the fracture remained in its reduced position, it was changed to a lightweight full cast after the second week. In the case that a fracture lost its reduction, and the position was unacceptable, yet fixation with Kirschner wires (K-wires) or ORIF was performed, if possible, on the same day. The duration of immobilization was approximately 5 to 6 weeks. In both groups, the patient’s physiotherapy needs were assessed two weeks after the removal of the splint. The length of follow-up was 12 months. The study was conducted in a hospital in the United Kingdom.
Results
Preoperative reduction (group 1)
Secondary surgery
Teunis (2015) reported secondary surgery for 84 (6%) patients in the preoperative reduction group and 4 (3.9%) patients in the group without preoperative reduction (RR 1.28; 95% CI 0.57 to 4.06). Teunis (2015) also performed a multivariable analysis for this outcome measure, this resulted in an adjusted odds ratio of 0.71 (95% CI 0.25 to 2) of unreduced compared to reduced fractures. Both analyses showed no significant differences in secondary surgery. The following factors were added to the multivariable regression model: unreduced fractures, age, male gender, fracture type, first presentation at outside emergency department, days between first presentation and surgery, treatment with volar locking plate and concomitant carpal tunnel release.
Level of evidence of the literature
The included studies are all retrospective observational studies, the level of evidence starts at GRADE low. The level of evidence regarding the outcome measure secondary surgery was downgraded to very low because of a small number of included patients with wide confidence intervals (imprecision).
Pain
Fan (2017) reported a mean VAS-score of 2.3 (SD 1.6) in the reduction group and 1.9 (SD 0.8) in the group without reduction at 3 months and respectively 1.1 (SD 1.4) and 0.9 (SD 1.2) after 1 year. No clinically relevant differences were found.
Level of evidence of the literature
The included studies are all retrospective observational studies, the level of evidence starts at GRADE low. The level of evidence regarding the outcome measure pain was downgraded to very low because of bias due to inadequate adjustment for all important prognostic factors (risk of bias) and the small number of included patients (imprecision).
Complications
Fan (2017) and Teunis (2017) both report on adverse events.
Fan (2017) reported complications in 6 patients, in each group (preoperative reduction versus no reduction) 3 complications were described. In the closed reduction group, 1 patient (1.5%) suffered from delayed wound healing which resolved after 4 weeks of treatment; 1 patient (1.5%) had a superficial infection which was cured after 10-day oral antibiotic treatment; and 1 patient (1.5%) had a screw found penetrating into the dorsal radius cortex which caused extensor tenosynovitis but resolved after the longer screw was removed at 6 months. Complications were also reported in the group with casting only. One patient (1.7%) suffered from superficial wound dehiscence which was healed after 3.5-week treatment; 1 patient (1.7%) was diagnosed to have median nerve neuropathy which recovered after 5-month neurotropic drug treatment; 1 patient (1.7%) developed flexor tenosynovitis which was cured following the removal of the implant after 5 months.
Teunis (2015) reported relevant complications in 253 patients overall (table 1).
Table 1 Complications of operated reduced and unreduced distal radius fractures. Source: Teunis (2015)
|
Complication |
Reduction (n=1409) |
No reduction (n=102) |
|
Infection |
0.71% (10) |
0.98% (1) |
|
Hematoma |
0.14% (2) |
0% |
|
Incision and drainage related to infection and/or hematoma |
0.43% (6) |
0% |
|
Stiffness |
1.8% (26) |
2.9% (3) |
|
Neuropathology - For which carpal tunnel release |
11% (159) |
12% (12) |
|
1.5% (21) |
0.98% (1) |
|
|
Malunion |
0.57% (8) |
0 |
|
Loss of alignment |
0.50% (7) |
0 |
|
Tendon rupture |
0.14% (2) |
0.98% (1) |
Teunis (2015) performed a multivariable analysis for the outcome measure adverse events. The factors added to the multivariable regression model were: unreduced fractures, age, male sex, fracture type, first presentation at outside emergency department, days between first presentation and surgery, treatment with volar locking plate and concomitant carpal tunnel release.
Adverse events were described as the complications reported in table 1 and also included the variables time to carpal tunnel release, plate removal, time to removal, time to rupture. This resulted in an adjusted odds ratio of 1.1 (95% CI 0.56 to 2.3) of unreduced compared to reduced fractures. No clinically relevant differences were found.
Level of evidence of the literature
The included studies are all observational studies, the level of evidence starts at GRADE low. The level of evidence regarding the outcome measure complications to very low because of bias due to inadequate adjustment for all important prognostic factors (risk of bias) and a small number of included patients with wide confidence intervals (imprecision).
Preoperative reduction (group 1)
Functional outcomes
DASH
Fan (2017) reported outcomes on the Disabilities of the Arm, Shoulder, and Hand (DASH) questionnaire. The DASH questionnaire comprises 30 items and focuses on two components, disability and symptoms of the upper extremity. It is scored from zero (good status) to 100 (poor status).
Fan (2017) reported a mean DASH score of 15.6 (SD 10.5) in the reduction group and 14.5 (SD 8.9) in the group without reduction at 3 months and respectively 9.5 (SD 9.6) and 8.9 (SD 11.6) after 1 year. The difference was 0.6 (95% CI -3.14 to 4.34). No clinically relevant differences were found.
Level of evidence of the literature
The included studies are all observational studies, the level of evidence starts at GRADE low. The level of evidence regarding the outcome measure functional outcomes was downgraded to very low because of bias due to inadequate adjustment for all important prognostic factors (risk of bias) and the small number of included patients (imprecision).
Reduction in patients with non-operative treatment (group 2)
Functional outcomes
DASH
Neidenbach (2010) reported the adjusted mean difference in the DASH score between treatment groups was 5.05 (95% CI: -4.75 to 14.85) after 1 year. No clinically relevant differences were found.
The following factors were added to the multivariable regression model: body mass index, work status before the accident, occurrence of a concurrent general disease, dominant hand fracture, ulna involvement and the radiological parameters RL and PTA.
Level of evidence of the literature
The included study is an observational study, the level of evidence starts at GRADE low. The level of evidence regarding the outcome measure functional outcomes was downgraded to very low because of a small number of included patients with wide confidence intervals (imprecision).
Secondary surgery
Neidenbach (2010) did not report outcome measure (secondary) surgery.
Pain
Neidenbach (2010) did not report outcome measure pain.
Complications
Neidenbach (2010) did not report outcome measure complications.
Level of evidence of the literature
As Neidenbach (2010) only reported on functional outcomes and not on secondary surgery, pain and complications, it was not possible to assess the level of evidence for this outcome measures.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectiveness of reduction in the emergency department compared to no reduction in the treatment of a distal radius fracture?
- already needing surgery (group 1);
- considered for non-operative management (group 2)?
P: patients with a distal radius fracture;
I: reduction in the emergency department;
C: no reduction;
O: (secondary) surgery, pain, complications (such as carpal tunnel syndrome, soft tissue, swelling), functional outcomes.
Relevant outcome measures
The guideline development group considered (secondary) surgery as a critical outcome measure for decision making; and complications and functional outcomes as important outcome measures for decision making.
The working group defined functional outcomes measured as follows: functional outcomes: PROMS, MHOQ, PRWE and (Quick) DASH. Other outcome measures were not defined a priori, the definitions in the studies were used.
The working group defined a difference of 25% for dichotomous outcomes, 10.8 points on the DASH and 11.5 points on the PRWE score (Walenkamp, 2015), 10% for continuous outcomes, 20mm or 2 points for VAS scales and 20 degrees for extension, flexion, pronation and supination (range of motion) as a minimal clinically important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 2000 until December 23, 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 278 hits, including systematic reviews (SRs), randomized controlled trials (RCTs) and observational studies. Studies were selected based on the following criteria RCTs or observational studies comparing reduction at the emergency department with no reduction in the treatment of patients (adults) with a distal radius fracture (DRF) and a follow up of 1 year. Studies were initially selected based on title and abstract screening by three independent members of the working group. Full texts of 7 papers were evaluated for inclusion. After reading the full text, 4 studies were excluded (see the table with reasons for exclusion under the tab Methods) and 3 studies were included.
Results
Three studies were included in the analysis of the literature. One study of displaced DRF in patients considered for non-operative management compared reduction plus casting to casting alone (Neidenbach, 2010). Two studies in patients planned for surgery compared preoperative reduction and casting, to preoperative casting alone (Fan, 2017; Teunis, 2015). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bartl C, Stengel D, Bruckner T, et al. The treatment of displaced intra-articular distal radius fractures in elderly patients. Dtsch Arztebl Int 2014;111:779–87. doi:10.3238/arztebl.2014.0779.
- Brink P, et al. Richtlijn distale radius fracturen: diagnostiek en behandeling. Ned Ver van Heelkd 2010.
- Fan J, Yuan F, Li SZ, Tang Q, Xian CJ. Is the preoperative closed reduction irreplaceable for distal radius fracture surgical treatment?-A retrospective clinical study. Int J Clin Exp Med, 2017;10(1), 1309-1314.
- Grewal R, MacDermid JC. The Risk of Adverse Outcomes in Extra-Articular Distal Radius Fractures Is Increased With Malalignment in Patients of All Ages but Mitigated in Older Patients. J Hand Surg Am 2007;32:962–70. doi:10.1016/j.jhsa.2007.05.009.
- Kvernmo. Treatment of distal radius fractures in adults - Norwegian Orthopaedic Association Guideline. 2015. ISBN 4748071311.
- Lichtman DM, Bindra RR, Boyer MI, et al. American Academy of Orthopaedic Surgeons clinical practice guideline on: the treatment of distal radius fractures. J Bone Joint Surg Am 2011;93:775–8. doi:10.2106/JBJS.938ebo.
- Mackenney PJ, McQueen MM, Elton R. Prediction of instability in distal radial fractures. J Bone Jt Surg - Ser A 2006;88:1944–51. doi:10.2106/JBJS.D.02520.
- Mulders MAM, Detering R, Rikli DA, et al. Association Between Radiological and Patient-Reported Outcome in Adults With a Displaced Distal Radius Fracture: A Systematic Review and Meta-Analysis. J Hand Surg Am 2018;43:710-719.e5. doi:10.1016/j.jhsa.2018.05.003.
- Neidenbach P, Audigé L, Wilhelmi-Mock M, Hanson B, De Boer P. The efficacy of closed reduction in displaced distal radius fractures. Injury. 2010 Jun;41(6):592-8. doi: 10.1016/j.injury.2009.10.055. Epub 2009 Dec 2. PubMed PMID: 19959165.
- Teunis T, Mulder F, Nota SP, Milne LW, Dyer GS, Ring D. No Difference in Adverse Events Between Surgically Treated Reduced and Unreduced Distal Radius Fractures. J Orthop Trauma. 2015 Nov;29(11):521-5. doi: 10.1097/BOT.0000000000000379. PubMed PMID: 26489056.
- Walenkamp MMJ, Aydin S, Mulders MAM, et al. Predictors of unstable distal radius fractures: a systematic review and meta-analysis. J Hand Surg (European Vol 2016;41:501–15. doi:10.1177/1753193415604795.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|||||||||||||||||||||||||||||
|
Fan, 2017 |
Type of study: Retrospective cohort study
Setting and country: Patients with a distal radius fracture treated in a University Hospital in China
Funding and conflicts of interest: No conflicts of interest, funding is not reported |
Inclusion criteria: Adults with an acute CT-proven fresh distal radius fracture.
Exclusion criteria: Patients with multiple injuries such as skin wound, shin bumps, nerve and vascular injuries
N total at baseline: Intervention: 70 Control: 58
Important prognostic factors2: Mean age: I: 46.1 C: 43.3
Sex: I: 66% M C: 66% M
Groups comparable at baseline? Yes also both groups had comparable fracture characteristics and varied between type 23 A-2 and type 23 C-3 fractures
|
Describe intervention (treatment/procedure/test):
Closed reduction with casting before surgery
|
Describe control (treatment/procedure/test):
Preoperative casting without closed reduction |
Length of follow-up: 12 months
Loss-to-follow-up: No loss-to-follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Pain, mean (SD) VAS-score 3 months follow-up I: 2.3 (1.6) C: 1.9 (0.8)
1 year follow-up I: 1.1 (1.4) C: 0.9 (1.2)
Complications 6 patients, in each group (preoperative reduction versus no reduction) 3 complications were described. In the closed reduction group, 1 patient (1.5%) suffered from delayed wound healing which resolved after 4 weeks of treatment; 1 patient (1.5%) had a superficial infection which was cured after 10-day oral antibiotic treatment; and 1 patient (1.5%) had a screw found penetrating into the dorsal radius cortex which caused extensor tenosynovitis but resolved after the longer screw was removed at 6 months. Complications were also reported in the group with casting only. One patient (1.7%) suffered from superficial wound dehiscence which was healed after 3.5-week treatment; 1 patient (1.7%) was diagnosed to have median nerve neuropathy which recovered after 5-month neurotropic drug treatment; 1 patient (1.7%) developed flexor tenosynovitis which was cured following the removal of the implant after 5 months
Functional outcomes DASH, mean (SD) 3 months I: 15.6 (10.5) C: 14.5 (8.9)
1 year I: 9.5 (9.6) C: 8.9 (11.6) The difference was 0.6 (95% CI -3.14 to 4.34).
|
|
|||||||||||||||||||||||||||||
|
Teunis, 2015 |
Type of study: Retrospective cohort study
Setting and country: Patients with a distal radius fracture treated in three affiliated urban hospitals in a single city in the United States
Funding and conflicts of interest: One of the authors (D.R.) certifies that he, or a member of his immediate family, has or may receive payments or benefits during the study period from Wright Medical (USD less than 10,000) (Memphis, TN); Skeletal Dynamics (USD less than 10,000) (Miami, FL); Biomet (USD less than 10,000) (Warsaw, IN); AO North America (USD less than 10,000) (Paoli, PA); and AO International (USD less than 10,000) (Dubendorf, Switzerland).
The remaining authors report no conflict of interest. |
Inclusion criteria: All adult (18 years or older) patients who underwent open reduction and internal fixation of their distal radius fracture
Exclusion criteria: Pathological (n = 1), open (n = 134), patients with skin tenting (n = 4), neuropathy (n = 57), or compartment syndrome (n = 3) were excluded. One patient who attempted reduction himself before visiting the Emergency Department was excluded and 1 patient with a second fracture at the same location within 1 year.
N total at baseline: Intervention: 1409 Control: 102
Important prognostic factors2: age ± SD: I: 54 (16) C: 54 (17)
Sex: I: 32% M C: 20% M
Groups comparable at baseline? The CPT fracture type was not different between the groups. Less female patients in the intervention group and groups differed on first presentation at outside emergency department (I: 43%, C: 86%)
|
Describe intervention (treatment/procedure/test):
Preoperative casting with closed reduction
|
Describe control (treatment/procedure/test):
Preoperative casting without closed reduction |
Length of follow-up: 12 months
Loss-to-follow-up: No loss-to-follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Secondary surgery I: 84 (6%) C: 4 (3.9%) RR 1.28; 95% CI 0.57 to 4.06
Adjusted odds ratio: 0.71 (95% CI 0.25 to 2) unreduced compared to reduced fractures
Complications
Adjusted odds ratio: 1.1 (95% CI 0.56 to 2.3) unreduced compared to reduced fractures |
|
|||||||||||||||||||||||||||||
|
Neidenbach, 2010 |
Type of study: Retrospective cohort study
Setting and country: Patients with a distal radius fracture treated in a hospital in the United Kingdom
Funding and conflicts of interest: The authors were not supported by any specific grant funding for this work. |
Inclusion criteria: Adults with a moderate to severe distal radius fracture with non-operative treatment.
Exclusion criteria:
N total at baseline: Intervention: 62 Control: 21
Important prognostic factors2: age ± SD: I: 61.7 (15.3) C: 61.5 (13.5)
Sex: I: 8% M C: 10% M
Groups comparable at baseline? - Fracture characteristics were different in both groups: volar tilt was -3° in the no reduction group versus 21° in the reduction group. - Patients receiving CR had a lower mean PTA of -20.6 degrees than those treated without CR (PTA = -2.7 degrees). - The dominant hand was fractured in 11 (52%) cases treated without CR and in 25 (40%) cases treated with CR - The ulna was involved in eight cases (38%) of the fractures treated without CR and in 37 (60%) fractures treated with CR. |
Describe intervention (treatment/procedure/test):
Cast immobilization with closed reduction
|
Describe control (treatment/procedure/test):
Cast immobilization without closed reduction
|
Length of follow-up: 12 months
Loss-to-follow-up: The follow-up rate in the group treated without CR was 86% after 6 months and 1 year. In the CR group, 92% and 79% of patients were examined at 6 months and 1 year, respectively.
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Functional outcomes DASH, adjusted mean difference 5.05 (95% CI: -4.75 to 14.85) |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors [(potential) confounders]
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?
(unlikely/likely/unclear) |
|
Fan, 2017 |
Unlikely |
Unlikely |
Likely, the study has ‘soft’ outcome measures. It is unclear if blinding was performed. |
Likely, no multivariate statistical analysis was performed. |
|
Teunis, 2015 |
Unlikely |
Unlikely |
Likely, investigators not involved with the treatment of the patients extracted all measures, blinded to patient’s reduction status, however it is unclear if patients and doctors were blinded.
|
Unlikely, to account for potential differences in baseline characteristics, we created 2 multilevel multivariable logistic regression models to measure the association between reduction status and (1) overall complications and (2) subsequent procedures. However, the complications formed one group, namely ‘adverse events’. The authors used this variable in multivariate model. This was not the case for the relevant individual complications. Not all the adverse events were relevant for this module. |
|
Neidenbach, 2010 |
Unlikely |
Unlikely |
Likely, the study has ‘soft’ outcome measures. It is unclear if blinding was performed. |
Unlikely, Statistical analyses were performed with Stata Version 10 (StataCorp LP, College Station, TX, USA). The distributions of patient demographics and baseline injury data were compared between study groups to identify any differences that might confound outcome comparisons. This assessment was done by clinical judgement and without statistical testing. Potential confounding factors were added to multivariable regression models, as described below. When two continuous factors were strongly correlated (e.g., radiological measurements), only one was selected for statistical adjustment in the multivariable models. |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Foldhazy, 2007 |
Geen vergelijking tussen wel reponeren versus niet reponeren (maar jong versus oud) |
|
Paksima, 2004 |
Betreft een review met een bredere PICO. Studies uit eigen uitgevoerde literatuursearch worden gebruikt voor het beantwoorden van deze uitgangsvraag |
|
Lalone, 2014 |
Geen vergelijking tussen wel reponeren versus niet reponeren (deze studie includeerde alleen patiënten met een gereponeerde radiusfractuur) |
|
DeGeorge, 2019 |
Geen vergelijking tussen wel reponeren versus niet reponeren (maar opereren versus niet opereren, binnen deze groepen werd niet reponeren versus niet reponeren geanalyseerd) |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 18-08-2021
Beoordeeld op geldigheid : 02-08-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
De richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Orthopaedische Vereniging
- Nederlandse Vereniging voor Plastische Chirurgie
- Nederlandse Vereniging voor Radiologie
- Nederlandse Vereniging van Spoedeisende Hulp Artsen
- Nederlandse Vereniging van Revalidatieartsen
- Koninklijk Nederlands Genootschap voor Fysiotherapie
- Nederlandse Vereniging voor Handtherapie
- Osteoporose Vereniging
Doel en doelgroep
Doel
Deze multidisciplinaire richtlijn bevat aanbevelingen ter ondersteuning van de dagelijkse praktijk voor hulpverleners die zich bezighouden met diagnostiek en behandeling van patiënten met een distale radius fractuur. De aanbevelingen zijn opgesteld op basis van de huidige wetenschappelijke inzichten. De knelpunten die behandelaars ervaren in de dagelijkse zorgpraktijk bij patiënten met een distale radius fractuur dienen als uitgangspunt bij de ontwikkeling van deze richtlijn.
Ter bevordering van de implementatie wordt geadviseerd om deze richtlijn aanknopingspunt te laten zijn voor lokale behandelprotocollen voor patiënten met een distale radius fractuur. Daarnaast kan de richtlijn gebruikt worden bij het geven van voorlichting aan patiënten met een distale radius fractuur.
Doelgroep
Deze richtlijn is bedoeld voor alle zorgverleners die betrokken zijn bij de zorg voor volwassen patiënten met een intra- of extra-articulaire distale radiusfractuur.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met een distale radius fractuur.
Werkgroep
- Dr. P.F.W. Hannemann, chirurg, werkzaam in het Maastricht UMC te Maastricht, (voorzitter), NVvH
- Dr. N.W.L. Schep, chirurg, werkzaam in het Maasstad Ziekenhuis te Rotterdam, NVvH
- Dr. D.I. Vos, chirurg, werkzaam in het Amphia ziekenhuis te Breda, NVvH
- Dr. R.L.M. Deijkers, orthopaedisch chirurg, werkzaam in het HagaZiekenhuis te Den Haag, NOV
- Dr. J.W. Colaris, orthopaedisch chirurg, werkzaam in het Erasmus UMC te Rotterdam, NOV
- Drs. J. van Loon, plastisch chirurg, werkzaam bij Blooming plastisch chirurgie te Haarlem, NVPC
- Drs. S. Bollen, radioloog, werkzaam in Het Groene Hart Ziekenhuis te Gouda,NVvR
- Drs. G.J.P. Smits, SEH-arts, werkzaam in het Catharina Ziekenhuis te Eindhoven, NVSHA
- Drs. K.S. van Wonderen, AIOS SEH, werkzaam in het St. Antonius ziekenhuis te Nieuwegein, NVSHA
- Dr. G. Zemack, revalidatiearts, werkzaam bij Libra revalidatie audiologie te Eindhoven, NVR
- Dr. F.J.B. Lötters, fysiotherapeut en docent fysiotherapie, werkzaam bij het Hand & Pols Centrum te Dordrecht en Hogeschool Leiden, KNGF, NVvHandtherapie
- H.J.G. van den Broek, voorzitter Osteoporose Vereniging te Haarlem.
Met ondersteuning van
- Drs. T. Geltink, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hannemann |
Traumachirurg/hand- en polschirurg (FESSH) Maastricht Universitair Medisch Centrum Maastricht |
Plaatsvervangend opleider heelkunde regio VIII (onbetaald); Course director CASH 3 cursus hand- en polschirurgie (onbetaald); Faculty lid AO (betaald); Faculty lid IBRA (betaald); Course director IBRA hand and wrist courses (betaald); Fellowship director IBRA upper limb training center MUMC Maastricht (betaald); Ontwikkeling course modules upper extremity IBRA (betaald); Faculty lid Esser Master class (onbetaald); ATLS instructor (betaald) Opleider HAIO’s (onbetaald) |
Begunstigde ZonMW subsidie aangaande onderzoek naar correctie osteotomie van de distale radius
Begunstigde Inscite subsidie (extern gefinancierd) voor onderzoek naar artrose van het polsgewricht |
Geen actie. De onderwerpen van de gesubsidieerde studies vallen buiten de afbakening van de richtlijn. |
|
Bollen |
Radioloog Groene Hart Ziekenhuis Gouda |
Geen |
Geen |
Geen actie. |
|
Deijkers |
Orthopedisch Chirurg HagaZiekenhuis Den Haag. |
Voorzitter Hand en Pols Werkgroep van de NOV (onbetaald); Organisator A&A Hand and Wrist Course Utrecht (onbetaald); Instructeur Dutch Wrist Arthroscopy Course (DWAC) (onbetaald); Voorzitter Commissie Certificering Subspecialisatie Handchirurgie van de Nederlandse Vereniging voor Handchirurgie (onbetaald) |
Geen |
Geen actie. |
|
van de Broek |
Voorzitter Osteoporose Vereniging (onbezoldigd)
|
Bestuurslid Energiek Heusden (energie coöperatie,(onbetaald); DGA eigen holding BV (pensioenrechten, betaald) |
Geen |
Geen actie. |
|
Van Loon |
Plastisch chirurg RKZ Beverwijk |
CFO Beverwijk Skin and Scar Company, Haarlem (betaald) |
Geen |
Geen actie. |
|
Colaris |
Orthopedisch chirurg - traumatoloog /hand- en polschirurg (FESSH) |
NOV bestuurslid (onkostenvergoeding); Bestuurslid Orthopedische Traumatologie Portefeuillehouder CCOC (onbetaald); Bestuurslid werkgroep hand-pols NOV (onbetaald); Bestuurslid werkgroep AI NOV (onbetaald); Bestuurslid Zuid West Overleg Traumatologie (onbetaald); Bestuurslid en co-founder BIG hand event (onbetaald); Faculty AO (betaald); Faculty OTC (betaald); Faculty Dutch wrist course (onbetaald); Faculty Esser Master Class (onbetaald) |
ZonMw subsidie voor uitwerking CAST-studie waarbij gereponeerde distale radiusfracturen ofwel in circulair gips ofwel in een gipsspalk worden geïmmobiliseerd. |
Geen actie. |
|
Zemack |
Revalidatiearts, Libra Revalidatie & Audiologie, Eindhoven, Tilburg en Weert. |
Voorzitter van de geaccrediteerde Werkgroep Trauma Revalidatie (WTR) van de VRA (Nederlandse Vereniging van Revalidatieartsen) (onbetaald) |
Geen |
Geen actie. |
|
Smits |
SEH-arts KNMG, Catharinaziekenhuis Eindhoven. |
PhD candidate, TU/e (onbetaald); Docent spoedzorg, Schola Medica Utrecht (betaald) |
Geen |
Geen actie. |
|
Lötters |
Hand-/fysiotherapeut, Bewegingswetenschapper bij Hand en Pols Revalidatie Nederland, locaties Den Haag en Dordrecht |
Docent bij de opleiding fysiotherapie bij de Hogeschool Leiden. |
Geen |
Geen actie. |
|
Schep |
Traumachirurg/hand- en polschirurg (FESSH), Maasstad Ziekenhuis Rotterdam, tevens werkzaam in het Spijkenisse Medisch Centrum |
Bestuurslid Ned. Ver. Handchirurgie (onbetaald); Bestuurslid Big Hand Event (onbetaald); Instructeur Dutch Wrist Ascopie course (onbetaald); Consultant Synthes, Arthrex: betrokken bij cursussen (betaald); Chairman diverse AO cursussen (onkosten vergoeding); Instructeur IBRA course (onkosten vergoeding); Instructeur CASH cursus handfracturen (onkosten vergoeding); Editor boek Leidraad chirurgie co- assistent revenuen; Consultant KLS Martin (betaald) |
Echtgenote heeft een medisch congres bureau. Geen relatie met deze richtlijn; Begunstigde diverse Zonmw subsidies voor onderzoek naar handfracturen, geen relatie met deze richtlijn; Meerdere publicaties aangaande de distale radius die ook in deze richtlijn aan bod komen.
|
Geen actie. |
|
Vos |
Traumachirurg Amphia Ziekenhuis Breda |
Lid klachten-commissie, Jeroen Bosch ziekenhuis den Bosch, (betaald); Lid kwaliteitsvisitatie commissie NVvH (onkostenvergoeding); ATLS instructor (betaald); AO faculty (betaald); consultant Operace Johnson & Johnson (betaald) |
Geen |
Geen trekker of meelezer bij uitgangsvragen over platen. |
|
Van Wonderen |
AIOS SEH bij st. Antoniusziekenhuis te Nieuwegein/Utrecht |
geen |
Geen |
Geen actie. |
Inbreng patiëntenperspectief
Voor de totstandkoming van deze richtlijn is aandacht besteed aan het patiëntenperspectief door uitnodigen van Patiëntenfederatie Nederland en patiëntenvereniging Osteoporose Vereniging voor de invitational conference en door middel van het aanstellen van een afgevaardigde van patiëntenvereniging Osteoporose Vereniging als lid van de werkgroep. Aanvullend zijn er door de Patiëntenfederatie Nederland patiëntervaringen verzameld door een vragenlijst uit te sturen onder het Zorgpanel van de Patiëntenfederatie. Het verslag hiervan (zie de bijlagen) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Osteoporose Vereniging en de Patiëntenfederatie en de daarbij aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met een distale radius fractuur. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodules (Nederlandse Vereniging voor Heelkunde, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de Beroepsvereniging Verzorgenden Verpleegkundigen (V&VN), de Nederlandse Vereniging van Revalidatieartsen (VRA), het Koninklijk Nederlands Genootschap voor Fysiotherapie (KNGF), de Nederlandse Vereniging voor Handtherapie (NVHT) en de Nederlandse Vereniging voor Heelkunde (NVvH) via een schriftelijke invitational conference. Daarnaast is er een enquête uitgezet onder het Zorgpanel van de Patiëntenfederatie. Het rapport hiervan is opgenomen in de bijlagen.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvragen behorende bij de uitgangsvragen inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt gerelateerd) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder ‘Onderbouwing’. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module 'Organisatie van zorg'.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2000-dec. 2019 Engels |
1 Radius Fractures/ (8941) 2 (((distal adj3 (radius or radial)) or wrist or colles or smith*) adj3 fracture*).ti,ab,kf. (6985) 3 1 or 2 (11975) 4 limit 3 to (english language and yr="2000 -Current") (6386) 5 ((closed adj3 (reduction or manipulation)) or reposition*).ti,ab,kf. (22598) 6 4 and 5 (470) 7 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy*).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*)).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (346910) 8 6 and 7 (17) 9 (exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) (1157966) 10 6 and 9 (73) 11 10 not 8 (66) 12 ((exp cohort studies/ or multicenter study.pt. or (cohort or "Follow up" or followup or observational or prospective* or longitudinal* or retrospective* or consecutive* or multicent* or "multi-cent*").ti,ab,kf.) and ((group* or subgroup*).ti,ab,kf. or (versus or versus or compar*).ab,kf.)) or (versus or versus or compar*).ti. or controlled clinical trial/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or Case-Control Studies/ or Comparative Study/ or historically controlled study/ or ((case adj1 (matched or control*)) or ((control or controlled) adj1 (clinical or trial or study or active)) or (control* adj1 (arm* or cohort* or sham or matched or historic or healthy or normal or (usual adj2 care) or "standard care")) or placebo* or ((two or three) adj1 arm*) or ((single or double or triple or assessor) adj1 (blind* or masked)) or (matched adj1 pair*) or propensity or nonrandom* or non-random* or quasi-experimental).ti,ab,kf. (4283019) 13 6 and 12 (208) 14 8 or 11 (83) 15 13 not 14 (140) > 139 uniek |
278 |
|
Embase (Elsevier)
|
(((('distal radius fracture'/exp/mj OR ((distal NEAR/3 (radius OR radial) NEAR/3 fracture*):ti,ab) OR (((wrist OR colles OR smith*) NEAR/3 fracture*):ti,ab)) NOT 'conference abstract':it AND (english)/lim AND ((embase)/lim OR (pubmed-not-medline)/lim) AND (2000-2020)/py) AND ('fracture reduction'/exp/mj OR (((closed NEAR/3 (reduction OR manipulation)):ti,ab) OR reposition*:ti,ab))) AND (('meta analysis'/exp OR 'meta analysis (topic)'/exp OR 'systematic review (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review):ti) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/de OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract':it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it))) OR (('randomized controlled trial'/exp OR 'randomized controlled trial (topic)'/exp OR random*:ti,ab OR rct*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab)) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract':it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it)) (66) > 14 uniek AND (('cohort analysis'/de OR 'major clinical study'/de OR 'clinical study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR cohort:ti,ab OR 'follow up':ti,ab OR followup:ti,ab OR observational:ti,ab OR prospective*:ti,ab OR longitudinal*:ti,ab OR retrospective*:ti,ab OR consecutive*:ti,ab OR 'cross sectional':ti,ab OR crosssectional:ti,ab OR multicent*:ti,ab OR 'multi-cent*':ti,ab) AND (group*:ti,ab OR subgroup*:ti,ab OR versus:ab OR versus:ab OR compar*:ab) OR versus:ti OR versus:ti OR compar*:ti OR 'clinical trial'/de OR 'adaptive clinical trial'/exp OR 'controlled clinical trial'/de OR 'multicenter study'/exp OR 'phase 2 clinical trial'/exp OR 'phase 3 clinical trial'/exp OR 'phase 4 clinical trial'/exp OR 'case control study'/de OR 'comparative study'/exp OR ((case NEAR/1 (matched OR control*)):ti,ab) OR (((control OR controlled) NEAR/1 (clinical OR trial OR study OR active)):ti,ab) OR ((control* NEAR/1 (arm* OR cohort* OR sham OR matched OR historic OR healthy OR normal OR usual OR 'standard care')):ti,ab) OR placebo*:ti,ab OR (((two OR three) NEAR/1 arm*):ti,ab) OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab) OR ((matched NEAR/1 pair*):ti,ab) OR propensity:ti,ab OR nonrandom*:ti,ab OR 'non random*':ti,ab OR 'quasi experimental':ti,ab) (125) > 42 uniek |
|
