Macroliden bij ernstig astma
Uitgangsvraag
Wat is de effectiviteit van macroliden als aanvullende behandeling bij ernstig astma?
Aanbeveling
Wees terughoudend met het langdurig gebruik van macroliden bij de behandeling van ernstig astma, gezien de beperkte effectiviteit en het ongunstige bijwerkingenprofiel.
Overweeg in niet-eosinofiele astmapatiënten met frequente astma-aanvallen om een proefbehandeling te geven met macroliden gedurende een periode van 6 maanden. De voorkeur gaat uit naar azitromycine (3x per week 500 mg).
Verricht voor de start van macrolidenbehandeling een ECG in verband met het risico op QT-verlenging.
Controleer zowel tijdens als na de behandeling het gehoor en de vestibulaire functie, bij de combinatie met andere ototoxische geneesmiddelen.
Wees alert op gehoorverlies, leverenzymstoornissen en verlengde QT-tijd na het starten met behandeling met macroliden.
Overwegingen
Verschillende studies hebben gekeken naar de effecten van macroliden op relevante uitkomstmaten bij ernstig astma. Er is geen klinisch relevant effect op astmacontrole en/of kwaliteit van leven aangetoond, noch op relevante corticosteroïdereductie. Met betrekking tot astma-aanvallen zijn twee recentere RCTs van goede kwaliteit conflicterend: Gibson (2017) vond een reductie in de gehele groep, waar Bruselle (2013) alleen een reductie in de subgroep met niet-eosinofiel astma vond. Bij een urgent gebrek aan therapieën voor ernstig non-eosinofiel astma is een proefbehandeling in deze groep, gericht op reduceren van astma-aanvallen te rechtvaardigen bij patiënten met recidiverende astma-aanvallen. Om dit te kunnen evalueren is 8 weken, zoals genoemd in de vorige versie van de richtlijn, te kort en beveelt de werkgroep een evaluatie na 6 maanden aan. Hoewel azitromycine ook voor een reductie van luchtweginfectes kan zorgen, is dit niet het enige werkingsmechanisme, aangezien ook patiënten zonder kolonisatie en/of luchtweginfecties gunstige uitkomsten lieten zien. Gegevens over lange termijnbehandeling ontbreken.
Voor de start met een macrolidebehandeling dient minstens een ECG gedaan te worden. Tevens dient voorzichtigheid geboden te worden bij combinatie met andere ototoxische geneesmiddelen (vooral aminoglycosiden); controleer bij toepassing van een dergelijke combinatie zowel tijdens als na de behandeling het gehoor en de vestibulaire functie. De patiënt dient ingelicht te worden over bijwerkingen (maag-darmklachten, gehoorverlies, QT-tijd verlenging en mogelijke antibiotica resistentie).
Voor de meeste patiënten met ernstig eosinofiel astma en recidiverende astma-aanvallen zal behandeling met biologicals de voorkeur hebben boven azitromycine behandeling, vanwege de robuustere data op effectiviteit en (langere termijn) veiligheid.
Onderbouwing
Achtergrond
Van macroliden zijn naast de antibiotische werking ook anti-inflammatoire en antivirale eigenschappen bekend. Macroliden worden ingezet bij ernstig astma. Het is niet duidelijk wat daarvoor de evidence is en welke subgroepen (eosinofiel of niet-eosinofiel) het meest profiteren. De kosten zijn niet het probleem, maar wel de potentiele bijwerkingen die patiënten kunnen ondervinden, alsmede het induceren van antibiotica resistentie.
Conclusies / Summary of Findings
Astmacontrole
|
Redelijk GRADE |
Macroliden hebben waarschijnlijk een klein, maar niet klinisch relevant effect op astmacontrole bij patiënten met ernstig astma.
Bronnen: (Brusselle, 2013; Hahn, 2012; Gibson, 2017; Simpson, 2008) |
Kwaliteit van leven
|
Redelijk GRADE |
Macroliden hebben waarschijnlijk een klein, maar niet klinisch relevant effect op kwaliteit van leven bij patiënten met ernstig astma.
Bronnen: (Brusselle, 2013; Hahn, 2012; Gibson, 2017; Simpson, 2008) |
Astma-aanval frequentie
|
Laag GRADE |
Macroliden hebben mogelijk een klein positief effect op de astma-aanval frequentie bij patiënten met ernstig astma.
Bronnen: (Brusselle, 2013; Hahn, 2012; Gibson, 2017) |
Corticosteroïdreductie
|
- GRADE |
Er is onvoldoende onderzoek bij volwassenen met ernstig astma om de effecten van macroliden op corticosteroïdreductie te kunnen beoordelen. |
Longfunctie
|
Redelijk GRADE |
Macroliden hebben nauwelijks effect op longfunctie bij patiënten met ernstig astma.
Bronnen: (Brusselle, 2013; Gibson, 2017; Simpson, 2008) |
Bijwerkingen
|
Redelijk GRADE |
Diarree lijkt vaker voor te komen na azitromycinebehandeling dan na placebo. Er lijken ook meer resistente micro-organismen aanwezig te zijn na azitromycinebehandeling dan in de placebogroep.
Bronnen: (Brusselle, 2013; Hahn, 2012; Gibson, 2017) |
Samenvatting literatuur
Beschrijving studies
Er werden vier RCTs geïncludeerd.
In de RCT van Gibson (2017) werden patiënten geïncludeerd met astma, dat in deze studie gedefinieerd was als een compatibele voorgeschiedenis en gedocumenteerd bewijs van variabele luchtwegobstructie van een bronchodilator respons (en symptomatisch bij de start van de studie met een bijbehorende astmacontrolescore van ≥0,75 ondanks behandeling met onderhoudsdoses inhalatiecorticosteroïden en langwerkende bronchodilatoren. Er werden 213 patiënten (gemiddelde leeftijd 60, range (50 tot 68)) gerandomiseerd in de azithromycinegroep (500 mg, driemaal per week gedurende 48 weken) en 207 patiënten (gemiddelde leeftijd 61, range (51 tot 69)) in de placebogroep. Gerapporteerde uitkomsten waren de astmacontrolescore ACQ, kwaliteit van leven AQLQ, astma-aanval frequentie, FEV1 en bijwerkingen.
In de RCT van Brusselle (2013) werden patiënten (mediane leeftijd 53) van 18 tot 75 jaar geïncludeerd met een diagnose van persisterend astma, behandeling met stap 4 of 5 volgens het Global Initiative voor Astma en bijpassende klinische kenmerken. Bovendien gebruikten de patiënten hoge doses inhalatiecorticosteroïden (> 1000 mg fluticason of equivalent) en hoge doses geïnhaleerde beta-2-agonisten gedurende minstens 6 maanden voorafgaand aan screening en hadden ze minstens twee onafhankelijke ernstige astma-aanvallen die systemische corticosteroïden vereisten en/of LRTI die antibiotica vereisten in de voorgaande 12 maanden. In deze studie was ook sprake van een pre-studie gedefinieerde uitkomst in niet-eosinofiel astma. Er werden 55 patiënten (gerandomiseerd in de azithromycinegroep (250 mg, één per dag gedurende vijf dagen en daarna driemaal per week gedurende 26 weken) en 54 in de placebogroep. Gerapporteerde uitkomsten waren de astmacontrolescore ACQ, kwaliteit van leven AQLQ, astma-aanval frequentie en FEV1.
In de RCT van Hahn (2012) werden patiënten van 18 jaar en ouder geïncludeerd met door een arts gediagnosticeerde astma gedurende meer dan 6 maanden. Ook hadden deze patiënten objectief bewijs van een reversibele luchtwegobstructie. Er werden 38 patiënten (gemiddelde leeftijd 45,7±15,5) gerandomiseerd naar azitromycine (600 mg, eenmaal daags gedurende drie dagen en daarna één tablet van 600 mg per week gedurende elf weken) en 37 patiënten (gemiddelde leeftijd 47,4±14,2) kregen placebo. Gerapporteerde uitkomsten waren de astmacontrolescore ACQ, kwaliteit van leven AQLQ, astma-aanval frequentie en bijwerkingen.
In de RCT van Simpson (2008) werden patiënten geïncludeerd met symptomatische refractoire astma conform de Global Initiative voor Astma richtlijnen. Daarbij werd luchtweg hyperreactiviteit aangetoond met gecombineerde hypertone zoutoplossing. In totaal 23 patiënten (gemiddeld 60 jaar bereik (27 tot 80)) werden gerandomiseerd naar claritromycine (500mg tweemaal daags) en 23 patiënten (gemiddeld 55 jaar bereik (27 tot 77)) kregen placebo gedurende acht weken. Gerapporteerde uitkomsten waren de astmacontrolescore ACQ, kwaliteit van leven AQLQ en FEV1 verlies.
Resultaten
Astmacontrole (ACQ)
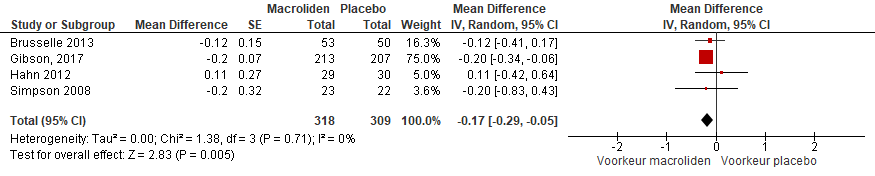
Er werden vier RCTs gevonden met in totaal 299 patiënten die astmacontrole, gebaseerd op de Astma Control Questionnaire (ACQ), rapporteerden (Brusselle, 2013; Gibson, 2017; Hahn, 2012; Simpson, 2008). De vier studies vonden een klein significant verschil in astmacontrole van -0,17 (95% BI -0,29; -0,05) (zie figuur 1), in het voordeel van macroliden.
Figuur 1 Gemiddelde verschil in astmacontrole tussen macroliden- en placebogebruik bij patiënten met ernstig astma.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat astmacontrole is met 1 niveau verlaagd vanwege imprecisie (laag patiëntenaantal en niet behalen van grens klinische relevantie).
Kwaliteit van leven (AQLQ)
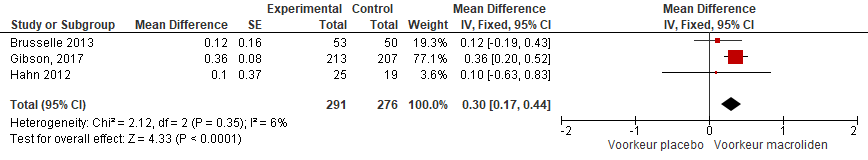
Er werden vier RCTs gevonden die kwaliteit van leven, gebaseerd op de Astma Quality of Life Questionnaire (AQLQ) rapporteerden (Brusselle, 2013; Hahn, 2012; Gibson, 2017; Simpson, 2008). De studie van Simpson (2008) kon niet meegenomen worden in de meta-analyse, omdat deze alleen mediaan en de interquartile range rapporteerde. Meta-analyse van de overige drie studies vond een klein significant verschil in kwaliteit van leven 0,30 (95%BI 0,17; 0,44), zie figuur 2.
Figuur 2 Gemiddelde verschil in kwaliteit van leven tussen macrolide en placebogebruik bij patiënten met ernstig astma.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is met 1 niveau verlaagd vanwege imprecisie (laag patiëntenaantal en niet behalen van grens klinische relevantie).
Astma-aanval frequentie
Er werden drie RCTs gevonden die de astma-aanval frequentie rapporteerden (Brusselle, 2013; Hahn, 2012; Gibson, 2017).
De studie van Hahn (2012) gaf aan dat 51% van de patiënten één of meer astma-aanvallen van astma doormaakte en dat er geen significante verschillen waren tussen de studiegroepen. Het aantal astma-aanvallen per groep werd niet gerapporteerd.
Bruselle (2013) liet op basis van een Poisson regressie zien dat de ernstige astma-aanval rate 0,52 (95%BI 0,36 tot 0,75) was voor placebo en 0,55 (95%BI 0,38 tot 0,78) voor azithromycine. Daarnaast werden de volgende subgroep resultaten gepresenteerd. De ernstige astma-aanval rate voor niet-eosinofiele ernstige astma was 0,62 (95%BI 0,39 tot 0,99) voor placebo en 0,26 (95%BI 0,12 tot 0,54) in de azithromycinegroep, met een bijbehorende rate ratio van 0,42 (95%BI 0,17 tot 1,00, p=0,05). Voor eosinofiele ernstige astma was dit 0,50 (95% BI 0,28 tot 0,88) in de placebogroep en 0,96 (95%BI 0,66 tot 1,41) in de azithromycinegroep, met een bijbehorende rate ratio van 1,93 (95%BI 0,98 tot 3,81).
De studie van Gibson 2017 liet zien dat er 1,86 astma-aanvallen per persoonsjaar waren voor placebo (95%BI 1,54 tot 2,18) en 1,07 (95%BI 0,85 tot1,29) voor azithromycine, een significante reductie door azithromycine. Deze studie presenteerde de volgende subgroepanalyse. Bij niet-eosinofiele astma werd gezien dat patiënten behandeld met placebo (N=104) 1,74 astma-aanvallen per persoonsjaar hadden, vergeleken met azithromycine (N=120) die 1,15 astma-aanvallen per persoonsjaar hadden (incidentie rate ratio 0,66 (95% BI 0,47 tot 0,93; p=0,019). Bij patiënten met eosinofiel astma behandeld met placebo (n=103) werden 1,98 astma-aanvallen gezien per persoonsjaar terwijl de patiënten behandeld met azithromycine (n=93) 0,96 astma-aanvallen per persoonsjaar lieten zien (incidentie rate ratio 0,52 (95% BI 0,29 tot 0,94); p=0,030).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat astma-aanval frequentie is met 1 niveau verlaagd gezien de verschillen in resultaten tussen de studies (inconsistentie) en met een niveau vanwege imprecisie.
Corticosteroïdreductie
Deze uitkomstmaat werd niet gerapporteerd in de geselecteerde studies.
Longfunctie FEV1
Er werden drie RCTs gevonden die longfunctie rapporteerden (Brusselle, 2013; Gibson, 2017; Simpson, 2008). Brusselle (2013) vond geen significante verschillen in prebronchodilatator FEV1 (%) na 10 weken (MD -0,28 (−4,11 tot 3,54)), en na 26 weken (0,88 (−3,44 tot 5,19)) tussen de azitromycine- en de placebogroep. Ook waren er geen verschillen in postbronchodilatator FEV1 (%) na 10 weken (−0,26 (−3,45 tot 2,92)), en na 26 weken 1,95 (−2,42 tot 6,33)).
Ook Gibson (2017) vond geen significant verschil in prebronchodilatator FEV1 na de interventieduur tussen de azitromycine- en de placebogroep (MD (L) -0,06 (-0,12 tot 0,001)). Simpson (2008) vond geen verschil in FEV1 % voorspelde waarde na de interventie tussen de claritromycine- (74,6 % ±17,1) en de placebogroep (69% ±21).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat longfunctie is met 1 niveau verlaagd gezien imprecisie.
Bijwerkingen
In de studie van Gibson (2017) traden 8 cardiale voorvallen op bij 6 personen (3%) in de azitromycinegroep en 7 cardiale voorvallen bij 5 personen (2%) in de placebogroep. QTc verlenging werd gezien bij 5 (5%) patiënten in de azitromycinegroep en bij 2 (3%) patiënten in de placebogroep. In de studie van Hahn (2012) werd één patiënt in de placebogroep opgenomen met acuut coronair syndroom.
Frequenter optreden van diarree in de azitromycinegroep in vergelijking met de placebogroep werd gerapporteerd door zowel Hahn (2012) (12 (42%) patiënten in de azitromycinegroep versus 5 (15%) in de placebogroep) als Gibson (2017) (72 (34%) in de azitromycinegroep versus 39 (19%) in de placebogroep).
Gibson (2017) vond dat gehoorverlies in vergelijkbare mate optrad in de azitromycinegroep (6 (6%)) en de placebogroep 7 (9%). Ook Hahn (2012) vond vergelijkbare aantallen: 2 gevallen na behandeling met azitromycine versus 1 geval na placebo.
Brusselle (2013) vond dat 11 (48%) patiënten in de azitromycinegroep en 9 (39%) patiënten in de placebogroep gekoloniseerd waren met erythromycine resistente streptokokken op basis van orofaryngeale uitstrijkjes bij 46 patiënten. Gibson (2017) bekeek potentieel pathogene micro-organismes in het sputum zowel voor als na de behandeling. Na de behandeling hadden met azitromycine behandelde patiënten vaker een azitromycine-resistent micro-organisme: 19 (49%) voor azitromycine versus 12 (29%) in de placebogroep.
Bewijskracht van de literatuur
De bewijskracht voor bijwerkingen is met 1 niveau verlaagd aangezien deze op heterogene wijze werden gerapporteerd in de verschillende studies.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P (patients): patiënten (≥ 18 jaar) met ernstig astma die optimaal behandeld worden;
I (intervention): macroliden;
C (comparison): placebo, usual care;
O (outcomes): astmacontrole (ACQ), kwaliteit van leven (AQLQ en SGRQ), astma-aanval frequentie, aantal ziekenhuisbezoeken, ziekenhuisopnames en verzuim van school of werk, corticosteroïdereductie, verbetering longfunctie FEV), (fysiologisch FEV1-verlies), bijwerkingen.
Relevante uitkomstmaten
De werkgroep achtte verbetering van astmacontrole en verbetering van kwaliteit van leven voor de besluitvorming cruciale uitkomstmaten; en astma-aanval frequentie, steroïdereductie, verbetering longfunctie en voorkomen van meer dan fysiologisch FEV1-verlies voor de besluitvorming belangrijke uitkomstmaten.
Verbetering van astmacontrole
De werkgroep definieerde ≥ 0,5 punt verbetering op Asthma Control Questionnaire (ACQ) als een klinisch (patiënt) relevant verschil.
Verbetering van kwaliteit van leven
De werkgroep definieerde ≥ 0,5 punt verbetering op Asthma Quality of Life Questionnaire (AQLQ) en ≥ 4 punt verbetering op de SGRQ als een klinisch (patiënt) relevant verschil.
Astma-aanval frequentie
De werkgroep definieerde ≥ 30% afname van aantal astma-aanvallen als een klinisch (patiënt) relevant verschil.
Corticosteroïdreductie
De werkgroep definieerde ≥ 2,5 mg/dag dosisafname prednison of equivalent van een ander steroïd als een klinisch (patiënt) relevant verschil.
Verbetering longfunctie
De werkgroep definieerde een toename FEV1 ≥ 10% van voorspelde waarde als een klinisch (patiënt) relevant verschil.
Voorkomen van meer dan fysiologisch FEV1-verlies
De werkgroep definieerde Δ FEV1 ≥ 50 ml per jaar als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Pubmed en Medline is op 8 juni 2018 met relevante zoektermen gezocht naar RCTs over macrolidengebruik bij patiënten met ernstig astma. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 131 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: relevantie, mate van ernst van astma en leeftijd van de patiënt, doelgroep rokers. Op basis van titel en abstract werden in eerste instantie 14 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 11 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en drie studies definitief geselecteerd. Daarnaast werd één studie uit de vorige richtlijn ook meegenomen in de literatuuranalyse.
Vier onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- 1 - Brusselle GG, VanderStichele C, Jordens P, Deman R, Slabbynck H, Ringoet V, et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): A multicentre randomised double-blind placebo-controlled trial. Thorax 2013 ;68(4): 322-32.
- 2 - Gibson PG, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, et al. Effect of azithromycin on asthma exacerbations and quality of life in adults with persistent uncontrolled asthma (AMAZES): a randomised, double-blind, placebo-controlled trial. Lancet 2017; 390(10095): 659-668.
- 3 - Hahn DL, Grasmick M, Hetzel S, Yale S. Azithromycin for bronchial asthma in adults: An effectiveness trial. J.Am.Board Fam.Med. 2012; 25(4): 442-459.
- 4 - Nelson HS, Hamilos DL, Corsello PR, Levesque NV, Buchmeier AD, Bucher BL. A double-blind study of troleandomycin and methylprednisolone in asthmatic subjects who require daily corticosteroids. Am Rev Respir Dis. 1993; 147(2): 398-404.
- 5 - Simpson JL, Powell H, Boyle MJ, Scott RJ, Gibson PG. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am J Respir Crit Care Med. 2008; 177(2): 148-55. PubMed PMID: 17947611.
Evidence tabellen
Research question: What is the added value of macrolide therapy as an add-on treatment for severe asthma?
Table Evidence table for systematic reviews - macrolides
Table - Risk of bias for intervention studies (randomized controlled trials) - Macrolides
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Brusselle, 2013 |
patients were randomly assigned in a 1 : 1 ratio to receive add-on treatment with azithromycin or placebo using a central web-based randomisation tool. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Gibson, 2017 |
Patients were centrally allocated (1:1) to azithromycin or identical-looking placebo using concealed random allocation from a computer-generated random numbers table with permuted blocks of 4 or 6 and stratification for centre and past smoking |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
|
Hahn, 2012 |
An independent statistician prepared the randomization codes used for subject assignment to the azithromycin or placebo study arms. Each study site received coded study medication bottles (1:1 allocation) in blocks of 6 and was instructed to distribute them (numbered 1 to 6) in numerical ascending order to eligible consenting study subjects. |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unclear |
unlikely |
|
Simpson, 2008 |
Randomiazation was undertaken by a blinded staff member who took no part in the study using a computer-generated random numbers table using permuted blocks of four |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Arfa, 2016 |
Arfa, 2016 |
|
Cameron, 2013 |
Astma bij rokers |
|
Good, 2012 |
Verhalende review |
|
Hernando-Sastre, 2010 |
Review, verouderd |
|
Johnston, 2016 |
betreft medicatie na exacerbatie, en slechts 10 dagen follow-up |
|
Kew, 2015 |
Review met bredere doelgroep dan ernstig astma |
|
Liu, 2015 |
Artikel in Chinees |
|
Nelson, 1993 |
Relevantie zeer laag (uit vorige versie richtlijn) |
|
Price, 2018 |
Is aankondiging van Gibson, 2017 |
|
Reiter, 2013 |
Review met bredere doelgroep dan ernstig astma |
|
Solidoro, 2013 |
Geen RCT maar soort review over met name Brusselle 2013 |
|
Tong, 2015 |
Review met bredere doelgroep dan ernstig astma |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de NVALT of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVALT richtlijn Diagnostiek en behandeling van ernstig astma uit 2013. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2019 |
Uiterlijk jaar voor herziening |
|
Definities |
Opgenomen in Algemene inleiding |
2024 |
|
Diagnostiek van ernstig astma |
Minimale (tekstuele) aanpassingen |
2024 |
|
Behandelprincipes |
Herbevestigd |
2024 |
|
Antifungale therapie |
Minimale aanpassingen |
2024 |
|
Bariatrische chirurgie |
Nieuw ontwikkeld |
2024 |
|
Anti-IgE (omalizumab) |
Herzien in bredere module Biologicals |
2024 |
|
Bronchiale thermoplastiek |
Gereviseerd |
2024 |
|
Fysiotherapie |
Nieuw ontwikkeld |
2024 |
|
Hooggebergtebehandeling |
Wordt in Q2 2020 herzien in module Longrevalidatie en hooggebergtebehandeling |
2024 |
|
Leukotrieën |
Minimale aanpassingen |
2024 |
|
Longrevalidatie (inspanningstraining, educatie/zelfmanagement, ademhalingsoefeningen/yoga) |
Wordt opgenomen in module Longrevalidatie en hooggebergtebehandeling |
2024 |
|
Steroïdsparende behandeling |
Module wordt teruggetrokken. |
|
|
Systemische corticosteroïden |
Vervangen door nieuwe module |
2024 |
|
Theofylline |
Herbevestigd |
2024 |
|
Tiotropium Bromide |
Minimale aanpassingen |
2024 |
|
Optimaliseren en monitoren van zorg |
Gereviseerd |
2024 |
|
Organisatie van zorg |
Gereviseerd |
2024 |
|
Kwaliteitssystemen |
Opgenomen in Verantwoording en Implementatieplan |
2024 |
Algemene gegevens
De richtlijn is goedgekeurd door:
- Vereniging Nederland Davos
- Longfonds
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van diagnostiek en behandeling van volwassen patiënten (leeftijd ≥ 18 jaar) met ernstig astma. Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met ernstig astma wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ernstig astma en astma.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstig astma te maken hebben.
Werkgroep
- Dr. E.J.M. Weersink, longarts, Amsterdam Universitaire medisch centrum, locatie AMC, NVALT
- Dr. G.J. Braunstahl, longarts, Franciscus Gasthuis en Vlietland, Rotterdam, NVALT
- Dr. A. ten Brinke, longarts, Medisch Centrum, Leeuwarden, NVALT
- Dr. H.P.A.A. van Veen, Longarts, Medisch Spectrum Twente, Enschede, NVALT
- Drs. L.H. Conemans, longarts, Maastricht UMC+, Maastricht, NVALT
- Dr. A. Aardenburg-van Huisstede, longarts in opleiding, Franciscus Gasthuis en Vlietland, Rotterdam, NVALT
- Dr. S.W. Zielhuis, Ziekenhuisapotheker, Medisch Centrum Leeuwarden, NVZA
- W. van Litsenburg, Verpleegkundig specialist, Catharina Ziekenhuis, Eindhoven, V&VN
- Dr. H.J. Hulzebos, Medisch fysioloog en fysiotherapeut, UMC Utrecht, Utrecht, KNGF
- M.A.P. Poulissen-Erinkveld, projectleider, Longfonds/ VND
- L.A.M. Frankemölle, Ervaringsdeskundige, Longfonds
- E.M. van der Roest, Senior kernmedeweker pre-analyse poli Wilhelmina Kinderziekenhuis, Ervaringsdeskundige, VND
Met ondersteuning van
- Dr. ir. N.L. van der Zwaluw, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J.G. Wirix, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- I. van Dusseldorp, literatuurspecialist, Kenniscentrum Medisch Centrum Leeuwarden
- S. Wouters, projectsecretaresse, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Dr. E.J.M. Weersink |
Longarts afdeling longziekten Academisch Universitair Medisch Centrum, Amsterdam. |
Geen |
In 2017 voor meerdere farmaceutische bedrijven een betaald adviseurschap (GSK, Novartis, TEVA, Chiesi, Boehringer). In 2018 nog wel adviseurschap niet meer tegen betaling.
|
Adviseurschappen zijn bij de start van de richtlijn gestaakt. Gekeken is naar een vice-voorzitter. Bij relevante onderwerpen zal de vice-voorzitter de vergadering leiden. |
|
Dr. G.J. Braunstahl |
Longarts, Franciscus Gasthuis full-time |
'- Nul-aanstelling Erasmus MC/promotiebegeleiding 4 uur/week (onbetaald) - Redactieraad Nederlands tijdschrift Allergie en Astma 2 uur/maand (onbetaald) - Secretaris Netherlands Respiratory Society (NRS) 4 uur/maand (onbetaald) - Vergoedingen voor advieswerk, richtlijncommissies, ontwikkeling studieprogramma's, presentaties e.d.: (incidenteel) betaald |
- Geen persoonlijke financiele belangen van structurele aard. - De stichting van onze onderzoeksafdeling heeft in het verleden unrestricted grants gekregen van Stichting astmabestrijding, stichting Coolsingel, stichting 't Trekpaert, stichting Bevordering Onderziek Fransciscus, GSK, Teva, Chiesi, Novartis, AstraZeneca, ALK Abello. |
Betaalde adviesfuncties zijn per 1-1-2018 neergelegd. Vergoedingen zijn overkoepelend aan de richtlijn. Geen directe acties nodig. |
|
Dr. A. ten Brinke |
Longarts, vrijgevestigd werkzaam in medisch centrum Leeuwarden |
Geen |
- Unrestricted research grants GSK, TEVA Research advisory boards GSK, Novartis, AstraZeneca, Boehringer Ingelheim, Chiesi, Sanofi. Honoraria lectures GSK, Novartis, Teva, Boehringer Ingelheim. - Actief in expertisecentrum ernstig astma in MCL |
Voor onderwerpen aangaande medicatie kan Ten Brinke, wanneer het zou komen tot stemming, niet mee mogen stemmen. Gezien haar expertise kan ze wel deelnemen aan de discussie over deze onderwerpen. |
|
H.P.A.A. van Veen |
Longarts Medisch spectrum Twente Enschede |
Adviesraden deelname: AstraZeneca, Teva, Novartis, Sanofi (alles betaald) |
Deelname aan wetenschappelijk onderzoek met AstraZeneca |
Geen trekker of meelezer bij modules aangaande medicatie. |
|
L.H. Conemans |
longarts Maastricht UMC |
Geen |
Geen |
Geen actie |
|
Dr. A. Aardenburg- van Huisstede |
Longarts in opleiding Franciscus Gasthuis Rotterdam |
Geen |
Promototieonderzoek verricht op deelgebied van richtlijn (relatie obesitas en astma) |
Expertise wordt juist ingezet op de module Bariatrie en astma. Geen directe actie. Bij onderwerpen waar mogelijke belangen van de voorzitter spelen, zal werkgroeplid optreden als onafhankelijk voorzitter. |
|
Dr. H.J. Hulzebos |
Medisch Fysioloog en (sport)fysiotherapeut in het Universitair Medisch Centrum Utrecht |
Secretaris VHVL (Vereniging Hart, Vaat en Longfysiotherapie) (onbetaald) |
Geen |
Geen actie |
|
W. van Litsenburg |
Verpleegkundig Specialist Astma en COPD Catharina ziekenhuis Eindhoven afdeling Longgeneeskunde 36 uur
Walter van Litsenburg Zorg, ZZP er thuiszorg 24 uur |
-HAN/VDO, opleiding voor praktijkondersteuners Astma/COPD module (betaald) -Workshops en gastlessen voor IMIS (inhalatietechniek), Fontys, UVT (betaald) -Kernteamlid van PICASSO een stichting die wetenschappelijk onderzoek ondersteunt. Sterke link met Boehringer Ingelheim (betaald) |
Geen |
Geen actie |
|
M.A.P. Poulissen-Erinkveld |
Projectleider Longfonds + Vereniging Nederland-Davos |
|
Geen |
Geen actie |
|
L.A.M. Frankemölle |
Ervarings-deskundige; Lid van de Longfonds ErvaringsDeskundigen groep |
- Task Force Group guidelines severe asthma op internationaal niveau. - Diverse werkgroepen zowel internationaal als nationaal, niet gerelateerd aan richtlijnen ernstig astma (onbetaald, reis- en verblijfskosten-vergoedingen). - Vrijwilligster voor het Longfonds en van daaruit ook voor ELF/ERS. - Lid van de werkgroep herziening NHG-standaard astma. |
Geen |
Geen actie |
|
E. van Golen-van der Roest |
Ervaring-sdeskundige; Pre-analyse medewerker UMC Utrecht 25 u/pw |
'- Redactielid, vrijwilliger VND (onbetaald) - bibliotheek, redactielid, vrijwilliger VONK (onbetaald) - Ledenadministratie Sleutelclub hamerik (onbetaald) |
Geen |
Geen actie |
|
Dr. S.W. Zielhuis |
Ziekenhuis-apotheker Medisch Centrum Leeuwarden |
Geen
|
In de afgelopen jaren aanwezig geweest bij eenmalige adviesraden voor ziekenhuisapothekers van een aantal bedrijven waaronder Sanofi, Novartis en Astra Zeneca. De bedrijven hebben producten binnen het indicatiegebied van deze richtlijn. Bij alle bovengenoemde firma's is geen sprake (geweest) van een dienstverband. Tot 2007 werkzaam geweest bij Teva Nederland, maar nu 11 jaar later op geen enkele wijze meer betrokken bij deze firma. |
Geen acties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenverenigingen Longfonds en Vereniging Nederland Davos in de werkgroep en door deelname van de patiëntenvereniging aan de invitational conference. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVALT Richtlijn Diagnostiek en behandeling van ernstig astma, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden (zie pagina 6 voor de uitkomstmaten en de bijbehorende klinisch relevante verbetering).
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de conclusies uit de systematische literatuuranalyse samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. In samenwerkingen met de commissie kwaliteitsvisitatie NVALT wordt er een indicatorenset ontwikkeld die gebruikt kan worden tijdens de kwaliteitsvisitaties en die de astma- en ernstig astma zorg omvat. Er zijn derhalve geen specifieke indicatoren ontwikkeld behorende bij de voorliggende richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist
