Longrevalidatie en hooggebergtebehandeling bij moeilijk behandelbaar en ernstig astma
Uitgangsvraag
- Bij welke patiënten kan longrevalidatie ingezet worden als behandeling van moeilijk behandelbaar en ernstig astma?
- Bij welke patiënten kan hooggebergtebehandeling in combinatie met longrevalidatie ingezet worden als aanvullende behandeling van moeilijk behandelbaar en ernstig astma?
Aanbeveling
Longrevalidatie is geïndiceerd bij patiënten met een moeilijk behandelbaar of ernstig astma, waarbij meerdere (>2) ‘treatable traits’ bijdragen aan een persisterend slechte astmacontrole * en/of herhaalde exacerbaties**.
GINA > 2; ‘uncontrolled asthma’
** ≥2 / jaar en/of 1 of meer ziekenhuis opnames/jaar
Stel de indicatie voor poliklinische longrevalidatie in een multidisciplinair overleg. Bij verwijzing voor klinische longrevalidatie al dan niet met hooggebergtebehandeling wordt de indicatie gesteld in overleg met een centrum voor klinische longrevalidatie (zoals één van de 6 longrevalidatiecentra (Kenniscentra Complex Chronische Longaandoeningen (KCCL’s) en het Nederlands Astmacentrum Davos (NAD)).
Voorwaarden voor longrevalidatie zijn:
- De behandelperiode wordt bepaald door het gepersonaliseerde longrevalidatie programma van de patiënt; meestal zal dit daarmee op 8 weken of langer uitkomen;
- Het programma bestaat uit ten minste een gestructureerd fysiek trainingsprogramma wat rekening houdt met de pulmonale beperkingen van de patiënt én een leefstijlcomponent;
- Bij klinische longrevalidatie: na ontslag volgt er een periode van gepersonaliseerde nazorg in de eerste of tweede lijn en/of via eHealth.
Beoordeel, in geval van een verwijzing voor klinische longrevalidatie, op individuele basis, samen met de patiënt, wat de optimale locatie is. Neem hierbij onder andere mee:
- inflammatoir profiel;
- afstand (iemand uit systeem halen);
- niveau van functioneren van de patiënt (ziektelast);
- ervaren effecten van de patiënt met longrevalidatie in combinatie met hooggebergtebehandeling.
Formuleer samen met de patiënt concrete behandeldoelen, bij voorkeur volgens het SMART principe. Gebruik hierbij ter evaluatie bij voorkeur een PROM-instrument.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Hoewel longrevalidatie en hooggebergtebehandeling al vele jaren bestaan, is het de werkgroep na consultatie van de literatuur duidelijk geworden dat het opzetten en uitvoeren van een dubbelblind gerandomiseerd onderzoek op dit gebied vrijwel onmogelijk is. Dit tonen onder andere de REFRAST studie (De Nijs, 2020) en de studies van Majd (2020) en Türk (2020) aan: de REFRAST studie was initieel opgezet als een gerandomiseerde studie, maar randomisatie bleek in de praktijk niet haalbaar. De patiëntengroep heeft een te hoge ziektelast om randomisatie toe te passen (ethisch niet verantwoord). De haalbaarheidsstudie van Majd (2020) laat tevens zien dat de inclusie van deelnemers lastig is: 238 patiënten waren geschikt, maar slechts 61 patiënten (26%) deden daadwerkelijk mee. Bovendien was er in deze studie sprake van een hoge drop-out. Ook voor de studie van Türk (2020) stemde maar een klein deel van de gescreende patiënten in met deelname aan de studie (31%).
Bovendien wordt een longrevalidatieprogramma voor astmapatiënten volledig afgestemd op de ‘treatable traits’ en de behandeldoelen van de individuele patiënt (Agusti, 2016). Daarmee is een longrevalidatieprogramma per definitie flexibel en gepersonaliseerd voor iedere patiënt. Dit heeft echter als consequentie dat het doen van onderzoek naar ‘longrevalidatie’ (immers longrevalidatie sec is dus geen éénduidige/constante interventie) als behandelmodaliteit daarmee intrinsiek onmogelijk gemaakt wordt. Tot slot is blindering in dergelijke onderzoeken een probleem door zeer hoge ziektelast en daarmee het ontnemen van gepaste zorg bij blindering (ethisch niet verantwoord). Overigens is dit geen unicum in de geneeskunde. Andere onderzoekers hebben al eerder gewezen op de beperkingen van de GRADE methodiek bij de evaluatie van dergelijke geneeskundige interventies (Heymans, 2013; Raad voor Volksgezondheid en Samenleving, 2017).
Het is de verwachting van de werkgroep dat er in de toekomst geen nieuwe grote gerandomiseerde studies zullen kunnen komen waarin het effect van longrevalidatie ten opzichte van standaardzorg onderzocht gaat worden. Dat betekent dat we, om te kunnen komen tot onderbouwde aanbevelingen met betrekking tot deze interventies voor patiënten met een moeilijk behandelbaar of ernstig astma ons zullen moeten richten op de expertise in het veld, de ervaringen van de patiënten zelf en het best mogelijke aanwezige bewijs,.
Daarom volgt hieronder in het kort een samenvatting van de resultaten van de meest recente studies die zijn opgenomen in de literatuursamenvatting aangevuld met de overige studies die we in de literatuur hebben gevonden met betrekking tot longrevalidatie en met betrekking tot hooggebergtebehandeling in combinatie met longrevalidatie. Daarbij willen we benadrukken dat we niet beogen hiermee volledig te zijn, maar zo wel een vollediger beeld kunnen schetsen over wat er bekend is over de effectiviteit van deze behandelingen.
Longrevalidatie
Twee RCT’s waren opgenomen in de literatuuranalyse naar longrevalidatie. Türk (2020) vond klinisch relevante, maar niet significant verschillen op astmacontrole en exacerbatiefrequentie na longrevalidatie ten opzichte van standaardzorg in patiënten met obesitas met suboptimale astmacontrole. Daarnaast was er na 12 maanden een effect te zien op astmacontrole, VO2max en inspanningscapaciteit in het voordeel van longrevalidatie. De haalbaarheidsstudie van Majd (2020) was niet gepowered om de effectiviteit van longrevalidatie ten opzichte van standaardzorg aan te tonen, en toont (niet-significante) trends die wezen op een verbetering van astmacontrole en inspanningscapaciteit in de longrevalidatiegroep. Daarnaast laten aanvullende observationele studies (Tabel 3) en de pre-post data van de RCT’s (Tabel 1 Literatuursamenvatting) zien dat na 12 weken longrevalidatie een verbetering te bereiken is op verschillende uitkomstmaten. Dit wordt ook bevestigd in een recente review van Zampogna (2020). Langere termijneffecten zijn echter weinig onderzocht. In de richtlijnmodule Fysiotherapie zijn wetenschappelijke studies beschreven naar het effect van een fysiek trainingsprogramma. Deze laten zien dat er een mogelijk positief effect is van fysieke training onder begeleiding van een fysiotherapeut op de kwaliteit van leven en inspanningscapaciteit.
Tabel 3. Overige onderzoeken naar longrevalidatie
|
Studie |
Studie-opzet |
Patiënten |
Resultaten (pre-postmetingen) |
Conclusies studie |
|
Schultz, 2021 |
RCT naar effect 3-weeks longrevalidatieprogramma versus standaardzorg |
412 patiënten met ongecontroleerd astma |
ACT verbeterde significant meer in de interventiegroep na 2 en 5 maanden dan in de controlegroep. Pre-post analyses lieten verbetering zien op astmacontrole, longfunctie en kwaliteit van leven. |
Sterk effect van longrevalidatie op verschillende uitkomstmaten. Effecten hielden tot 12 maanden aan. |
|
Miyamoto, 2014 |
Prospectieve pre-poststudie, 12 weken (2 weken inpatient, 10 weeks outpatient).
Patiënten volgden een longrehabilitatieprogramma met fysieke training, in combinatie met dieetinstructies en patiënteducatie. |
Slachtoffers van luchtvervuiling-gerelateerde longaandoeningen, waarvan 18 astmapatiënten |
Na de therapie waren verschillende uitkomstmaten verbeterd (MMRC grade, VC% voorspeld) QF en ISWD). |
Longrevalidatie kan een effectieve methode zijn om longcapaciteit en dyspnea te verbeteren. |
|
Sahin, 2019 |
Observationele studie naar longrevalidatie, 8 weken |
Gedeeltelijk gecontroleerd astma of ongecontroleerd astma |
Astmacontrole, longfunctie en kwaliteit van leven verbeterden in beide groepen. |
Verbetering in astmacontrole is groter in patiënten met ongecontroleerd astma vergeleken met gecontroleerd astma. |
|
Salandi, 2020 |
Observationele studie, pre-post data en vergelijking met controlegroep. |
150 patiënten met astma die een revalidatieprogramma volgde, en een controlegroep (n=78) met astmapatiënten die standaardzorg kreeg. Groepen verschilden op baseline. |
ACT verbeterde in de longrevalidatiegroep en niet in de controlegroep. Het effect was verschillend tussen de groepen. |
Longrevalidatie heeft mogelijk positieve effecten op astma-uitkomsten en zorgbehoeften. |
Hooggebergtebehandeling in combinatie met longrevalidatie
Eén studie was opgenomen in de literatuursamenvatting naar hooggebergtebehandeling (De Nijs, 2020). Deze studie liet een positief effect zien van hooggebergtebehandeling en longrevalidatie op astmacontrole, kwaliteit van leven en OCS-gebruik (cruciale uitkomstmaten voor patiënten) ten opzichte van longrevalidatie op zeeniveau. De positieve effecten hielden aan na 12 maanden. De RCT van Saxer, met een te korte studieduur (3 weken) niet geïncludeerd in de literatuuranalyse, liet ook verbeteringen zien van longrevalidatie in zowel de hooggebergte- als zeeniveaugroep, maar een deel van het effect verdween na 3 maanden. Cohortstudies laten veelal positieve effecten lieten zien na de behandeling op hoogte (zie Tabel 4) en dit komt ook terug in een recent ‘position statement’ van de European Academy of Allergy and Clinical Immunology over de effecten van hooggebergtebehandeling (submitted). Omdat het hier echter om observationele pre-postdata gaat en er daarom mogelijk een risico op confounding en bias bestaat, moeten de conclusies met enige voorzichtigheid gewogen worden.
Tabel 4. Overige onderzoeken naar hooggebergtebehandeling met longrevalidatie
|
Studie |
Studie-opzet |
Patiënten |
Resultaten |
Conclusies studie |
|
Saxer, 2019 |
Gerandomiseerde studie, 3 weken hooggebergte-behandeling of laaggebergte- behandeling (intramuraal revalidatieprogramma). Follow-up 3 maanden |
Patiënten met onvoldoende gecontroleerde astma (ACQ>0,75), n=50 |
Geen verschil tussen de groepen na 3 weken of 3 maanden. ACQ, AQLQ en FEV1, % voorspelde waarde verbeterden significatien na zowel hoog- als laaggebergtebehandeling. Effect op de ACQ verdween na 3 maanden na hooggebergtebehandeling, effect op kwaliteit van leven bleef behouden bij beide groepen. |
Revalidatieprogramma op hoogte en op zeeniveau verbetert astmacontrole op zowel hoogte als zeeniveau.
|
|
Boon-piyathad, 2020 |
Observationele, pre-post studie, 3 weken, |
Volwassen patiënten met astma, n=26, 9 gezonde controles |
Astmacontrole en longfunctie verbeterden t.o.v. baseline. Ook de type 2 immuunrespons verminderde. |
Positieve effecten van hooggebergte op longfunctie en demping van T2 immuunrespons |
|
Vinnikov, 2016 |
Systematisch review, includeerde 21 studies (ook niet-Engelstalige), waarvan merendeel bij kinderen of op zeer grote hoogte (>400m). Observationele pre-poststudies. |
Licht, matig en ernstig astma |
Gestratificeerde analyse liet zien dat bij volwassenen de FEV1 verbeterde na hooggebergtebehandeling met een standardized mean difference (SDM) van 0.75, 95% CI 0.63–0.88 (ten opzichte van baseline) (n=536). |
Behandeling > 4 weken was geassocieerd met een iets groter effect dan kortere behandeling (alle studies geïncludeerd, ook kinderen): SMD 0.63 (95% CI 0.50–0.77) versus 0.42 (95% CI 0.28–0.55). |
Waarden en voorkeuren van patiënten
Ernstig astma heeft een grote invloed op het dagelijks leven van de patiënt (Nunes, 2017). Wanneer er na het inzetten van verschillende behandelopties nog steeds niet de gewenste effecten bereikt worden, kan dit voor de patiënt tot een uitzichtloze situatie, een lage/minimale participatie in de maatschappij en een sociaal isolement leiden (Chung, 2015; Hyland, 2015). De astmapatiënten voor wie dit geldt, hebben vaak invaliderende symptomen van hun ziekte met sterke beperkingen in het dagelijks functioneren en staan vaak al jaren buiten het arbeidsproces (Sullivan, 2011). Vrijwel allen worden behandeld in een astma kennis- of behandelcentrum welke de beschikking heeft over alle actuele medicatie en behandelmogelijkheden. Voor deze patiënten is een integrale aanpak van hun astma middels een (klinisch) longrevalidatieprogramma vaak een essentiële aanvullende behandeling om nog enige kwaliteit van leven, zelfredzaamheid en sociale re-integratie terug te kunnen winnen alsmede de exacerbatiefrequentie te kunnen doen mitigeren.
Een longrevalidatieprogramma vraagt om inzet en medewerking van de patiënt; het intensieve programma moet passen binnen zijn/haar persoonlijke situatie, zoals werk, studie of gezin. Uiteraard is het van groot belang, zo niet een conditio sine qua non, dat een patiënt gemotiveerd is om ook na het programma met de behandeldoelen aan de slag te blijven gaan.
Uit focusgroepgesprekken met patiënten met ernstig astma, die gehouden werden in het kader van de ontwikkeling van de CaReQol (Care Related Quality of Life) Astma, kwamen de ervaren effecten van longrevalidatie ter sprake. Deelnemers van de focusgroepen spraken over effecten van de longrevalidatie in verschillende domeinen zoals een betere conditie en minder last van prikkels zoals luchtvervuiling. Dit zorgde voor meer energie om overdag activiteiten te kunnen ondernemen. Andere effecten hadden te maken met meer kennis over hun astma en het beter kunnen omgaan (zoals de eigen grenzen beter kennen) met hun ziekte. Tot slot spraken deelnemers over het afbouwen of beter ingesteld zijn op medicijnen, wat voor minder bijwerkingen zorgt. Deze patiëntervaringen kunnen teruggevonden worden via:
https://www.nivel.nl/sites/default/files/bestanden/ontwikkeling_CaReQol_Astma.pdf
Verhalen van mensen met ernstig astma en hun ervaringen met klinische longrevalidatie (en in het bijzonder hooggebergtebehandeling) zijn te vinden op de website van de Vereniging Nederland-Davos (https://nederland-davos.nl/beeld-verhaal/).
Het door de Vereniging Nederland-Davos (VND) gepubliceerde Witboek (2018) geeft inzicht in wat ernstig astma betekent voor deze patiëntengroep. Dit laat zien dat cijfers alleen nooit genoeg kunnen zijn om de volledige waarde van een behandeling inhoud te geven.
In 2014 heeft de VND een enquête gehouden onder patiënten met een ernstig astma die een opname hebben doorgemaakt in het Nederlands Astmacentrum Davos (NAD) (‘enquête Verzeker je van lucht’). Dit om de ervaren effecten van mensen met ernstig astma in kaart te brengen. Uit de enquête (ingevuld door 287 mensen) kwam naar voren dat een groot deel (71,7%) de medicatie heeft afgebouwd na opname in het NAD. 86,8% gaf aan dat het gebruik van prednisolon is verminderd. De geënquêteerden gaven aan dat er een duidelijk positief verschil merkbaar was in de belemmeringen van dagelijkse activiteiten voor en na de klinische longrevalidatie in het NAD (zie https://nederland-davos.nl/kennis/astmacentrum-davos/ voor de genoemde referenties).
Kosten (middelenbeslag)
De kosten voor longrevalidatie in Nederland en in combinatie met hooggebergtebehandeling zijn momenteel gelijk gesteld. Het effect van de behandeling op zorgkosten is niet meegenomen in onze literatuursamenvatting. Uit persoonlijke ervaringen van de werkgroepleden en uit observationele studies met een follow-up periode (zie hierboven) blijkt de zorgconsumptie in de jaren na een revalidatiebehandeling lager te zijn (minder heropnames, minder exacerbaties) (Nunes, 2017; Salandi, 2020). Naast de afname in directe kosten voor onder andere medicatie, exacerbatie- en ziekenhuisbehandeling, zal longrevalidatie mogelijk kunnen bijdragen aan een afname van het (overmatig) OCS gebruik met dientengevolge een afname van de daarbij behorende kosten voor de behandeling van de complicaties door OCS-gebruik en een afname van de kosten voor het mogelijk niet doelmatig inzetten van biologicals. Tevens is er ook een gunstig effect te verwachten op indirecte kosten, zoals arbeids- of schoolverzuim.
Indicatiestelling en invulling longrevalidatieprogramma
Wanneer behandeling in de huidige setting of in het eigen zorgnetwerk niet toereikend is gebleken, wordt de indicatie voor longrevalidatie bij voorkeur vastgesteld in een multidisciplinair overleg. Hiervoor komen in aanmerking patiënten met moeilijk behandelbare / ernstige astmapatiënten met persisterende klachten en functioneringsbeperkingen bij wie alle ogenschijnlijk optimale (standaard poliklinische) interventies onvoldoende effectief gebleken zijn. Bij de patiënt is er dan sprake van een persisterend hoge ziektelast (Global Initiative for Asthma (GINA) > 2; ‘uncontrolled asthma’) en / of een hoge zorgconsumptie (> 1 exacerbatie / jaar of 1 of meer ziekenhuisopnames / jaar). Tevens dient het vermoeden te bestaan dat er nog ‘treatable traits’ op meerdere (>2) niveaus bestaan (zie ook indicatiestelling behandeling astma in KCCL).
Een geïntegreerd multidisciplinair longrevalidatieprogramma kan zowel poliklinisch als klinisch (zoals deze bijvoorbeeld in de zes expertisecentra (vijf Kenniscentra voor Chronische Complexe Longaandoeningen en het Nederlands Astmacentrum Davos) wordt aangeboden) plaatsvinden (één en ander afhankelijk van de individuele omstandigheden van de patiënt). Wanneer een poliklinische revalidatie niet toereikend is, kan het noodzakelijk zijn dat de patiënt verwezen wordt voor klinische longrevalidatie. Dit kan bijvoorbeeld het geval zijn als de patiënt in een systeem verkeert dat een belemmerende factor blijkt te zijn bij de behandeling van het moeilijk behandelbaar of ernstig astma, en/of poliklinische behandeling onmogelijk blijkt door ernstige functioneringsbeperkingen van de patiënt
Een longrevalidatieprogramma wordt gecoördineerd door een longarts en dient tenminste te bestaan uit een gestructureerd fysiek trainingsprogramma dat rekening houdt met de pulmonale beperkingen van de patiënt, een gestructureerde begeleiding bij lifestyle aanpassingen door bijvoorbeeld een psycholoog en eventueel een diëtist. Zonder gedragsinterventies bestaat er een grote kans op een terugval naar oude gewoontes en daarmee een terugval naar het oude niveau van functioneren. Op indicatie kan de behandeling worden uitgebreid met andere ondersteunende specialismen zoals logopedie, maatschappelijk werk en/of ergotherapie. Tevens wordt er in het programma aandacht besteed aan educatie en zelfmanagement. Er kan ook op indicatie worden ingezet op arbeidsreïntegratie of studiehervatting. Om de belastbaarheid van de patiënt goed te kunnen inschatten, is betrokkenheid van een bedrijfsarts in de nazorg, in voorkomende gevallen gewenst.
De duur van een revalidatieprogramma wordt bepaald door het gepersonaliseerde longrevalidatieprogramma dat afgestemd is op de ‘treatable traits’ en de behandeldoelen van de patiënt. Daarmee zal het vaak een duur hebben van 8 weken of langer (Spruit, 2014). In het programma wordt toegewerkt naar zelfstandigheid en zelfredzaamheid van de patiënt waarbij het incorporeren van gedragsveranderingen in het dagelijks leven van groot belang is. De patiënt moet na afronding van het revalidatietraject terug kunnen vallen op nazorg om de behaalde resultaten ook in de toekomst te kunnen behouden. Met de patiënt wordt hiervoor een behandelplan opgesteld, met specifieke aandacht voor met name die domeinen waar de problemen of ‘treatable traits’ aan het begin van de behandeling van de patiënt zaten. De geïndividualiseerde nazorg kan plaatsvinden in de 1e of 2e lijn en/of via eHealth (Beerthuizen, 2020). Zie hiervoor ook de module Fysiotherapie.
Zoals in de inleiding al vermeld werd, is de rationale achter hooggebergtebehandeling in combinatie met longrevalidatie voor patiënten met een moeilijk behandelbaar / ernstig astma gelegen in de pleiotrope effecten die een verblijf op hoogte hebben op astmapatiënten. Samen met de patiënt die in aanmerking komt voor klinische longrevalidatie, dient een beoordeling plaats te vinden over wat de meest optimale locatie voor de longrevalidatie is: in Nederland op zeeniveau, of op hoogte. Bij deze beoordeling dient onder andere rekening gehouden te worden met het inflammatoir profiel van de patiënt en zijn/haar psychosociale omstandigheden. Patiënten met een persisterende luchtweginflammatie en/of verhoogde gevoeligheid voor omgevingsfactoren zoals allergene expositie en/of luchtvervuiling zouden met name baat kunnen hebben bij hooggebergtebehandeling. Ook ervaringen van de patiënt zelf over het effect van hoogte op zijn/haar astmaklachten kunnen hierbij worden meegenomen, evenals de mogelijke invloed van het systeem/ de omgeving van de patiënt. Daarbij kan het wenselijk zijn om de patiënt gedurende de gehele revalidatie op fysieke afstand van zijn systeem te zetten om een zo optimaal mogelijk resultaat van de revalidatie te kunnen bewerkstelligen.
Bij een longrevalidatietraject worden individuele behandeldoelen gesteld. Deze dienen zo SMART mogelijk geformuleerd te worden. De behandeldoelen hebben onder andere betrekking op het verbeteren van de algehele conditie, grenzen leren kennen, beter inzicht verkrijgen in de ziekte, leren om te gaan met de ziekte en deze vaardigheden leren toe te passen in het dagelijks leven. Een prioritering is dus op voorhand niet te maken: voor de één is een verbetering van nachtelijke klachten het doel, voor de ander minder lichamelijke beperkingen en weer een ander minder exacerbaties of minder medicatiegebruik. Behandeling en ondersteuning op maat is essentieel voor het beoogde resultaat. Multidisciplinaire (klinische) longrevalidatie biedt dit.
Om samen met de patiënt concrete behandeldoelen op te stellen is door het Nivel instituut in samenwerking met de Vereniging Nederland-Davos en Longfonds een PROM-vragenlijst opgesteld voor gebruik in de longrevalidatie. In het kader van samen beslissen is het aan te bevelen om gebruik te maken van deze instrumenten. Zie https://www.nivel.nl/nl/tool-careqol-vragenlijsten-astma voor de PROM vragenlijsten.
Aanvaardbaarheid, haalbaarheid en implementatie
Naar de mening van de werkgroep zouden, gezien bovenstaande overwegingen, alle centra die voldoen aan de ingangs- en afbakeningscriteria voor longrevalidatie, moeten worden gecontracteerd door zorgverzekeraars om de vergoeding van de behandeling te garanderen. Hooggebergtebehandeling is sinds de duiding van het Zorginstituut aangemerkt als klinische longrevalidatie, zonder een op zichzelf staande behandelcode. Op basis van het beschikbare bewijs en de jarenlange praktijkervaringen van de beroepsgroep én de patiënten, ziet de werkgroep zonder meer een duidelijke meerwaarde van hooggebergtebehandeling in combinatie met longrevalidatie bij geselecteerde patiënten. De werkgroep is daarom van oordeel dat ook hooggebergtebehandeling als optie voor longrevalidatie voor goed geïndiceerde patiënten met een moeilijk behandelbaar / ernstig astma beschikbaar moet blijven.
Tot slot is er een aantal punten te benoemen dat de implementatie van de aanbevelingen kan bemoeilijken:
- Het bespreken van patiënten met een moeilijk behandelbaar of ernstig astma in MDO’s wordt nog niet overal toegepast.
- Het nazorgtraject en re-integratietraject behoeft aandacht omdat dit nu nog niet overal optimaal geregeld is.
- De vergoeding voor fysiotherapie in de nazorg om het geleerde te behouden, eventueel uit te bouwen en blijvend te implementeren in het dagelijks leven van de patiënt, is nog niet geïmplementeerd in het basispakket van de meeste ziektekostenverzekeraars.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Overwegende dat:
- longrevalidatie al dan niet in combinatie met hooggebergtebehandeling voor een selecte groep patiënten met een moeilijk behandelbaar / ernstig astma met een persisterend hoge ziektelast en/of zorgconsumptie een behandelingsmodaliteit is die in de ogen van zowel behandelaren als patiënten (ervaringsdeskundigen) niet gemist kan worden;
- er onvoldoende onderzoek beschikbaar is om een betrouwbare uitspraak te kunnen doen over de eventuele (in)effectiviteit van longrevalidatie dan wel hooggebergtebehandeling in combinatie met longrevalidatie.
- Gezien de aard en omvang van de interventie is het in de toekomst waarschijnlijk ook onuitvoerbaar om een nieuwe RCT studie op te kunnen zetten;
- dat er overige (quasi-experimentele, observationele) studies zijn waarin de effecten van longrevalidatie en hooggebergtebehandeling in combinatie met longrevalidatie beschreven worden; over het algemeen wijzen deze allen in dezelfde (positieve) richting;
- de positieve ervaringen vanuit de beroepsgroep sinds 60 jaar;
- de positieve ervaren effecten vanuit de patiënten met een moeilijk behandelbaar / ernstig astma,
is de werkgroep van oordeel dat longrevalidatie een belangrijke effectieve behandeloptie is voor een selecte groep astmapatiënten met een moeilijk behandelbaar / ernstig astma, mits er duidelijke aanwijzingen zijn voor meerdere (>2) ‘treatable traits’. Daarom dient naar de mening van de werkgroep de indicatie voor longrevalidatie gesteld te worden in een MDO ernstig astma (minimale samenstelling: zie module Organisatie van zorg) waarin de, in de lokale behandelsituatie van de patiënt, on- of moeilijk behandelbare ‘traits’ worden vastgesteld. Daarbij dient uiteraard tevens een analyse van het astma van de patiënt plaats te vinden conform figuur 1.1 uit deze richtlijn waarbij de volgende vragen beantwoord dienen te worden:
- Is de diagnose correct?
- Is de ACQ > 1,5 en / of > 2 exacerbaties per jaar?
- Is er sprake van een adequate inhalatietechniek?
- Is de compliance adequaat?
- Gebruikt de patiënt nog medicatie die (relatief) gecontra-indiceerd is bij astma?
- Zijn er nog niet of onvoldoende behandelde triggerfactoren aanwezig?
- Zijn er nog niet of onvoldoende co-morbide aandoeningen aanwezig?
Indien patiënten ondanks deze analyse en ondanks een ogenschijnlijk optimale aanpak van alle ‘treatable traits’ een persisterend onacceptabel hoge ziektelast (GINA > 2; ‘uncontrolled asthma’) en/of exacerbatie frequentie (> 1 / jaar en/of 1 of meer ziekenhuis opnames/jaar) én meer dan 2 ‘treatable traits’ blijven houden, is een longrevalidatiebehandeling eventueel in combinatie met hooggebergtebehandeling geïndiceerd. Bij de plaatsbepaling (revalidatie in Nederland of in combinatie met hooggebergtebehandeling) dient met name het inflammatoir profiel, eerdere ervaren effecten van longrevalidatie in combinatie met hooggebergtebehandeling en de psychosociale context van de patiënt te worden meegewogen. Deze weging geschiedt samen en in overleg met de patiënt.
Onderbouwing
Achtergrond
Longrevalidatie wordt volgens de ERS/ATS als volgt gedefinieerd: “Pulmonary rehabilitation is a comprehensive intervention based on a thorough patient assessment followed by patient-tailored therapies, which include, but are not limited to, exercise training, education, and behavior change, designed to improve the physical and psychological condition of people with chronic respiratory disease and to promote the long-term adherence of health-enhancing behaviors’’ (Spruit, 2013).
Daarmee is longrevalidatie een uitgebreide interventie die gebaseerd is op een grondig onderzoek van de patiënt, gevolgd door een op de behoeften van de individuele patiënt afgestemde therapie. De therapie bestaat uit verschillende onderdelen, en kan naast fysieke training onder andere educatie, zelfmanagement, gedragsverandering, ergotherapie en dieetinterventies bevatten (Spruit, 2013; Holland, 2021; Osadnik, 2019). De therapie is daarbij niet alleen gericht op de ziekte an sich, maar ook op het lichamelijk en psychosociaal functioneren van de patiënt met als doel dat de mogelijkheden van de patiënt tot het verrichten van activiteiten en participatie aan de samenleving toe zullen gaan nemen (zie figuur 1). Aan de patiënt worden handvatten gegeven om het geleerde zelfstandig toe te kunnen blijven passen na afronding van het revalidatietraject, zodat de kwaliteit van leven, het functioneren van patiënten met chronische longziekten in het dagelijks leven en hun participatie aan de samenleving ook op langere termijn blijvend positief beïnvloed zullen blijven worden. In deze programma’s is er ook aandacht voor de omgeving van de patiënt. Het kan namelijk voorkomen dat de omgeving, of het systeem waarin de patiënt verkeert, negatief bijdraagt aan de behandeling van de patiënt.
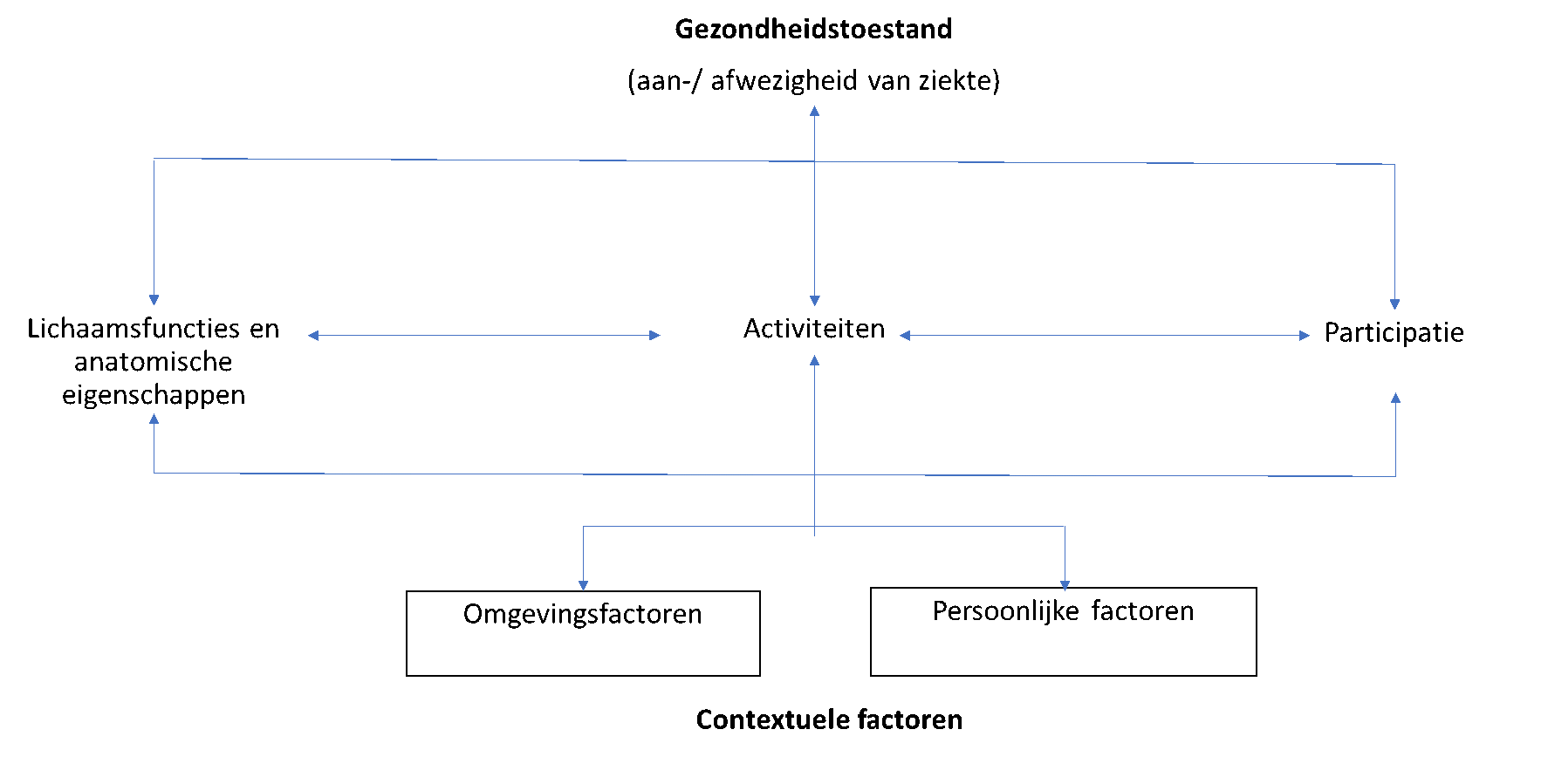
Figuur 1. Model van het menselijk functioneren (Naar: International Classification of Functioning Disability and Health. WHO FIC Collaborating Centre in the Netherlands, RIVM, Bilthoven, 2002)
Bij chronic obstructive pulmonary disease (COPD) zijn gunstige effecten beschreven van longrevalidatie op een aantal uitkomstparameters, zoals inspanningsvermogen, dyspneu en ziekte-specifieke kwaliteit van leven (Osadnik, 2019). Voor astma kan longrevalidatie ook worden ingezet. Het is primair bedoeld voor patiënten met een moeilijk behandelbaar of ernstig astma, ondanks instelling op Global Initiative for Asthma (GINA) klasse 4 medicatie of hoger, waarbij meerdere “treatable traits” bijdragen aan de slechte astmacontrole en/of herhaalde exacerbaties blijven bestaan (zie ook de module Optimaliseren en monitoren van (ernstig) astmazorg) (Agusti, 2016). Longrevalidatie kan poliklinisch of klinisch plaatsvinden. Klinisch zal dit meestal in een gespecialiseerde (long)revalidatiekliniek zijn, zoals één van de Kenniscentra voor Complexe Chronische Longaandoeningen (KCCL) of het Nederlands Astma centrum Davos (NAD). Bij klinische longrevalidatie wordt een patiënt opgenomen ineen revalidatiekliniek en daarmee uit zijn eigen omgeving gehaald. Dit laatste kan van belang zijn vooral wanneer de omgeving (fysiek, psychosociaal, dan wel anderszins) een belangrijke oorzakelijk dan wel onderhoudende (mede-)factor blijkt te zijn van het moeilijk behandelbaar / ernstig astma.
Bij hooggebergtebehandeling wordt een longrevalidatieprogramma aangeboden op hoogte (> 1500 m boven zeeniveau; Vinnikov, 2016). Het wordt al meer dan honderd jaar toegepast als therapeutische modaliteit bij astma. De rationale achter hooggebergte in combinatie met longrevalidatie voor patiënten met een moeilijk behandelbaar / ernstig astma is gelegen in de pleiotrope effecten die een verblijf op hoogte heeft op astmapatiënten. Meerdere onderzoekers hebben aangetoond dat een verblijf op hoogte, met haar verlaagde barometrische druk, verlaagde luchtdensiteit, relatief lage temperatuur en luchtvochtigheid, verhoogde UV blootstelling én verminderde expositie aan allergenen (huisstofmijt, pollen, schimmels) en luchtverontreiniging, verschillende positieve fysiologische (lagere luchtwegweerstand waardoor een betere uitademing en verminderde dynamische hyperinflatie) en immunomodulatoire effecten hebben bij astmapatiënten (o.a. Rijssenbeek-Nouwens, 2011; Karagiannidis, 2006; Huss-Marp, 2007; Spieksma, 1971; EAACI statement, submitted). Hierdoor zouden patiënten op hogere intensiteit kunnen trainen dan op zeeniveau waardoor de conditie sneller en meer kan verbeteren. Immers, een snellere vermindering van de bronchiale inflammatie kan de fysieke training eerder worden ingezet. Dit wordt niet alleen bij het (al dan niet allergische) T2 fenotype astma gezien, maar ook bij het (niet allergische) non T2 fenotype (De Nijs, 2020; Rijssenbeek-Nouwens, 2012; Grootendorst, 2001; Boonpiyathad, 2020).
In deze module wordt de huidige stand van zaken met betrekking tot de effectiviteit van longrevalidatie als therapeutische interventie bij de behandeling van moeilijk behandelbaar en ernstig astma in kaart gebracht. Ten tweede wordt een update gegeven over de huidige stand van zaken met betrekking tot de effectiviteit van de combinatie van hooggebergtebehandeling en longrevalidatie bij de behandeling van moeilijk behandelbaar en ernstig astma.
Conclusies / Summary of Findings
Longrevalidatie
Verbetering van astmacontrole
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van longrevalidatie op astmacontrole in patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma.
Bronnen: (Majd, 2020; Türk, 2020) |
Verbetering van kwaliteit van leven
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van longrevalidatie op kwaliteit van leven in patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma.
Bronnen: (Majd, 2020; Türk, 2020) |
Exacerbatiefrequentie
|
- GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van longrevalidatie op exacerbatiefrequentie in patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma.
Bronnen: (Türk, 2020) |
Corticosteroïdreductie
|
- GRADE |
Er werd geen vergelijkend onderzoek gevonden dat de effecten van een longrevalidatieprogramma op cortidosteroïdreductie bij volwassenen met moeilijk behandelbaar, matig-ernstig en ernstig astma onderzocht. |
Verbetering longfunctie
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van longrevalidatie op longfunctie in patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma.
Bronnen: (Türk, 2020; Majd, 2020) |
Verbetering inspanningscapaciteit
|
Zeer laag |
Er zijn onvoldoende vergelijkende onderzoeken om op grond van de GRADE methodiek een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van longrevalidatie op inspanningscapaciteit in patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma.
Bronnen: (Türk, 2020; Majd, 2020) |
Hooggebergtebehandeling
Verbetering van astmacontrole
|
Zeer laag GRADE |
Er zijn onvoldoende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie op astmacontrole in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma.
Bronnen: (De Nijs, 2020; Rijssenbeek, 2012/Fieten, 2019) |
Verbetering van kwaliteit van leven
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie, ten opzichte van longrevalidatie op zeeniveau, op de verbetering van kwaliteit van leven in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma.
Bronnen: (De Nijs, 2020) |
Exacerbatiefrequentie
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie, ten opzichte van longrevalidatie op zeeniveau, op de exacerbatiefrequentie in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma.
Bronnen: (De Nijs, 2020) |
Corticosteroïdreductie
|
zeer GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie, ten opzichte van longrevalidatie op zeeniveau, op de corticosteroïdreductie in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma.
Bronnen: (De Nijs, 2020) |
Verbetering longfunctie
|
Zeer laag GRADE |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie, ten opzichte van longrevalidatie op zeeniveau, op longfunctie in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma.
Bronnen: (De Nijs, 2020) |
Verbetering inspanningscapaciteit
|
- |
Er zijn onvoldoende vergelijkende onderzoeken om een uitspraak te kunnen doen over de effectiviteit dan wel de ineffectiviteit van hooggebergtebehandeling in combinatie met longrevalidatie, ten opzichte van longrevalidatie op zeeniveau, op inspanningscapaciteit in patiënten met moeilijk behandelbaar, matig-ernstig of ernstig astma. |
Hooggebergtebehandeling versus standaardzorg
|
- |
Er werd geen vergelijkend onderzoek gevonden dat de effecten van hooggebergtebehandeling in combinatie met longrevalidatie ten opzichte van standaardzorg bij volwassenen met moeilijk behandelbaar, matig-ernstig en ernstig astma onderzocht. |
Samenvatting literatuur
Longrevalidatie
Beschrijving studies
Majd (2020) voerde een studie uit om de haalbaarheid van een gerandomiseerde gecontroleerde studie naar de effecten van longrevalidatie op grotere schaal te onderzoeken. Dit betrof niet primair een studie naar de effectiviteit van longrevalidatie. In totaal werden 61 patiënten met ernstig astma (volgens de British Thoracic Society: hoge dosis inhalatiecorticosteroïden (> 1000 mg beclomethason equivalent) plus een tweede controller en/of systemische corticosteroïden) geïncludeerd. Longrevalidatie bestond uit 12 weken fysieke training (2x per week gesuperviseerde aerobe training en krachttraining én 1x per week niet-gesuperviseerde training), een educatieprogramma (1x per week een interactieve sessie met verschillende thema’s), plus 1x per week een individuele sessie met een gezondheidspsycholoog). De controlegroep ontving standaard zorg, welke niet verder gespecificeerd is. Metingen werden gedaan door een geblindeerde onderzoeker bij de start, na 12 weken, en na 9 maanden na baseline. Er vielen veel deelnemers uit: post-interventie waren er nog 21/34 deelnemers in de interventiegroep (drop-out rate 38%) en 9/17 van de controlegroep (drop-out rate 47%). Na 9 maanden was de drop-out in de interventiegroep 53% en in de controlegroep 59%.
Türk (2020) onderzocht het effect van een intensief longrevalidatieprogramma in obese (BMI ≥ 30 kg/m2) patiënten met suboptimale astmacontrole (ACQ ≥ 0.75) ondanks optimale inhalatietherapie (inhalatiecorticosteroïden en een langwerkend β2-agonist). Deelnemers werden gerandomiseerd naar één van de volgende groepen: 1) longrevalidatieprogramma; 2) longrevalidatieprogramma + online zelfmanagement ondersteuningsprogramma (‘Patientcoach’); 3) gebruikelijke zorg met adviezen om gewicht te verliezen en te bewegen. Het longrevalidatieprogramma omvatte intensieve intervaltraining, voedingsinterventie en psychologische groepsessies. De interventies duurden 3 maanden, en patiënten werden tot 12 maanden gevolgd. In totaal deden 34 patiënten mee aan de studie. Het merendeel van de patiënten (77%) had type 2 gemedieerd astma en 74% had ongecontroleerd astma. Patiënten en onderzoekers waren niet geblindeerd.
Resultaten
De resultaten staan vermeld in Tabel 1.
Verbetering van astmacontrole
In de studie van Majd (2020) was het gemiddelde verschil tussen de groepen na 12 weken -0,4 (95%BI -0,9 tot 0,1), een niet-klinisch relevante trend naar verbetering van astmacontrole in de revalidatiegroep ten opzichte van de controlegroep. Na 9 maanden werd geen verschil gevonden tussen de longrevalidatiegroep (n=17) en de controlegroep (n=6). Echter, vanwege de drop-out rate is het lastig deze resultaten te interpreteren.
Türk (2020) zag na 3 maanden geen verschil tussen de controlegroep en de longrevalidatie (p=0,13), evenals tussen de longrevalidatiegroep + zelfmanagement en de longrevalidatiegroep (p=0,62). Na 12 maanden follow-up bleek de longrevalidatiegroep een klinisch relevant betere astmacontrole te hebben dan de controlegroep (gemiddelde verschil=-1,06, 95%BI -1,84 tot -0,27). De longrevalidatiegroep + zelfmanagement verschilde niet van de longrevalidatiegroep (gemiddelde verschil=-0,34, 95%BI -0,95 tot 0,27).
Verbetering van kwaliteit van leven
In de studie van Majd (2020) verschilde de baseline AQLQ-score tussen de twee groepen. Het verschil tussen de groepen na 12 weken was met -0,2 (95%BI -2,7 tot 2,3) niet klinisch relevant. Na 9 maanden werd er geen verschil gevonden ten opzichte van baseline in de longrevalidatie- als in de controlegroep.
Na 3 maanden zag Türk (2020) geen verbetering in kwaliteit van leven (gemeten met de AQLQ) tussen de groepen. Na 12 maanden werd geen verschil gevonden tussen de controlegroep en de longrevalidatiegroep (gemiddelde verschil=0,28, 95%BI -0,65 tot 1,22) of tussen de longrevalidatiegroep en de longrevalidatiegroep + zelfmanagement (gemiddelde verschil=0,32, 95%BI -0,64 tot 1,29).
Exacerbatiefrequentie
Türk (2020) vond een klinisch relevant (≥30%), maar niet-significant verschil in aantal patiënten met een astma-exacerbatie gedurende 3 maanden (longrevalidatie: 16,7%, controlegroep 55,6%, p=0,16). Gedurende 12 maanden werden meer exacerbaties gezien in de controlegroep vergeleken met de longrevalidatiegroep (RR 2,31, 95%BI 1,12 tot 4,77).
Corticosteroïdreductie
De uitkomstmaat Reductie in steroïdgebruik is niet gerapporteerd als uitkomstmaat in deze studies.
Verbetering longfunctie
Türk (2020) vond na 3 maanden geen verschil in FEV1% voorspelde waarde tussen de drie groepen. Ook na 12 maanden werd geen verschil gevonden tussen de controlegroep en de longrevalidatiegroep (gemiddelde verschil=0,24, 95%BI -5,40, 5,87) of tussen de longrevalidatiegroep en de longrevalidatiegroep + zelfmanagement (gemiddelde verschil=3,37, 95%BI -4,41 tot 11,14).
Verbetering inspanningscapaciteit
Majd (2020) gebruikte de shuttle walking test en de VO2max om inspanningscapaciteit te meten. Het verschil tussen beide groepen op de shuttle walking test was klinisch relevant maar het betrouwbaarheidsinterval overlapte met deze grens (74m 95%BI 25 tot 124). Na 9 maanden werd geen verschil meer gevonden tussen de groepen. De VO2max verschilde niet tussen de groepen.
Türk (2020) vond zowel op de VO2max en de 6MWD na 3 maanden relevante verschillen tussen de longrevalidatiegroep en de controlegroep, in het voordeel van de longrevalidatiegroep. Na 12 maanden follow-up had de longrevalidatiegroep een betere VO2max (%) dan de controlegroep (gemiddelde verschil = 12,0 (95%BI 2,0 tot 22,1)), en een betere waarde in 6MWD (gemiddelde verschil 58,0 m (95%BI 16,9 tot 99,1)).
Er werden geen statistisch significante verschillen waargenomen in veranderingen in de inspanningscapaciteit (VO2max en 6MWD) tussen longrevalidatiegroep en de longrevalidatiegroep + zelfmanagement na 3 maanden en na 12 maanden behandeling.
Tabel 1. Resultaten longrevalidatie
|
Uitkomst-maat |
Baseline |
Post-interventie (12 weken) / verschil binnen de groep |
Follow-up (9 of 12 maanden)/ / verschil binnen de groep |
Verschil tussen de groepen post-interventie |
|
Astmacontrole (ACQ) (KRV: ≥0,5 afname |
||||
|
Majd, 2020 |
I: 2,1 ± 0,8 C: 1,5 ± 0,9 |
12 wk: I: 1,9 ± 0,8* C: 1,9 ± 1,0 |
9mnd: I: 2,0 ± 0,7 C: 2,0 ± 0,7 |
Na 12 weken: -0,4 (95%BI-0,9 tot 0,1) Na 9 mnd: geen verschil tussen de groepen. |
|
Turk, 2020 |
I: 2.17 [1.46-2.50] C: 2.09 [1.50-2.68] |
Verschil: I: -0,67 [-1,42, 0,00] C: -0,25 [-0,66, 0,63]
|
Verschil: I: -0,59 [-1,62, 0,22] C: 0,91 [-0,49, 2,50]
|
Na 12 weken: Geen verschil tussen de groepen (p=0,113) Na 12 maanden: -1,06 (95%BI -1,74 tot -0,27)# |
|
Kwaliteit van leven (AQLQ) (KRV: ≥0,5 toename) |
||||
|
Majd, 2020 (cumulatief van subschalen |
I: 19,0 ± 4,5 C: 22,2 ± 3,0 |
I: 19,7± 4,0 C: 21,7 ±2,6 |
alleen subschalen vermeld |
Na 12 weken: -0,2 (-2,7 tot 2,3) Na 9 mnd: geen verschil tussen de groepen. |
|
Turk, 2020 |
I: 4,8 [4,3-5,4] C: 4,5 [3,5-5,0] |
I: 0,20 [-0,33, 0,84] C: 0,12 [-0,26, 0,62]
|
Verschil: I: 0,59 [-0,62, 1,37] C: -0.14 [-0,62, 1.37]
|
Na 12 weken: Geen verschil tussen de groepen (p=0,758) Na 12 maanden: 0,28 (95%BI -0,65 tot 1,22) |
|
Exacerbatiefrequentie (KRV: ≥30%) |
||||
|
Turk, 2020 |
|
12 wk: I: 16,7% C: 55,6% |
- |
Na 12 weken: Geen verschil tussen de groepen (p=0,16) Na 12 maanden: RR=2,3 (95%BI 1,12, 4,78) |
|
Longfunctie (FEV1 (%)) (KRV: ≥10%) |
||||
|
Turk, 2020 |
I: 86.9 [9.4] C: 82.4 [16.2]
|
Verschil: I: 1.0 ± 6.2 C: -0.22 ± 7.5
|
Verschil I: 4.50 ± 10.49 C: 1.43 ±6.32 |
Na 12 weken: Geen verschil tussen de groepen (p=0,351) Na 12 maanden: 0,24 (95%BI -5,40, 5,87) |
|
Inspanningscapaciteit (KRV 6-minuten looptest: 47,5m; shuttle walking test 30m) |
||||
|
Majd, 2020 (SWT) |
I: 418 ± 172 C: 443 ± 121 |
12 wk: I: 450 ± 199 C: 403 ± 104) |
9mnd: I: 412 ± 245 C: 421 ± 76 |
Na 12 weken: 74 m (95%BI 25 tot 124)# Na 9 mnd: geen verschil tussen de groepen. |
|
Turk, 2020 (6MWD, m) |
I: 578 [76] C: 587 [73] |
Verschil: I: 52 ± 40* C: -14 ± 51
|
Verschil: I: -40,38 ± 53.99 C: 40,29 ± 53,52 |
Na 12 weken: Verschil tussen de groepen (p=0,029) Na 12 maanden: 58 (95%BI 17 tot 99)# |
|
Inspanningscapaciteit (VO2 max, mL·kg−1·min−1; KRV: 3,5 ml/O2/min/kg) |
||||
|
Majd, 2020 |
I: 22,5 ± 6,2 C: 22,9 ± 3,9 |
12 wk: I: 23,2 ± 7,6 C: 22,3 ± 2,4 |
9mnd: I: 24,1 ± 10,4 C: 20,3 ± 3,3 |
Na 12 weken: 1,4 (95%BI -1,1 tot 3,8) Na 9 mnd: geen verschil tussen de groepen. |
|
Turk, 2020 |
I: 51.1 [17.7] C: 56.5 [11.3] |
Verschil: I: 13.2± 9.2* C: -0.1 ± 10.5
|
Verschil: I: 11,7 ± 15,65 C: 1,33 ± 14,07 |
Na 12 weken: Geen verschil tussen de groepen (p=0,08) Na 12 maanden: 12,0 (95%BI 2,0 tot 22,1) |
Data zijn gepresenteerd als gemiddeld ±SD, als mediaan [interkwartiel range IQR]. * significant verschillend t.o.v. de baseline. # significant verschillend ten opzichte van controlegroep
ACQ: Asthma Control Questionnaire; AQLQ: Asthma Quality of Life Questionnaire; KRV: klinisch relevant verschil; SWT: shuttle walking test; 6MWD, 6-minuten looptest-afstand
Bewijskracht van de literatuur
- De bewijskracht voor de uitkomstmaat verbetering van astmacontrole is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie) en inconsistentie in de resultaten.
- De bewijskracht voor de uitkomstmaat verbetering van kwaliteit van leven is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), en imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie).
- De bewijskracht voor de uitkomstmaat exacerbaties is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), en imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie).
- De bewijskracht voor de uitkomstmaat verbetering van longfunctie is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), en imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie).
- De bewijskracht voor de uitkomstmaat verbetering van inspanningscapaciteit (VO2Max) is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie) en inconsistentie (na follow-up periode).
- De bewijskracht voor de uitkomstmaat verbetering van inspanningscapaciteit (6MWD of ISW) is met 3 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias), imprecisie (weinig deelnemers en het betrouwbaarheidsinterval overschrijdt de grens van klinische relevantie) en inconsistentie (na follow-up periode).
Hooggebergtebehandeling
Beschrijving studie
In de Refrast studie van De Nijs (2020) werden de behandeleffecten van 12 weken hooggebergtebehandeling op 1560 meter in Davos (Zwitserland) vergeleken met 12 weken behandeling op zeeniveau (in Nederland). In deze studie werden volwassen patiënten met ernstig (refractair) astma, die door hun longarts verwezen waren voor longrevalidatie, ingedeeld tot het krijgen van hooggebergtebehandeling op 1560 meter (n=93) of behandeling op zeeniveau (n=45). De opzet was een gerandomiseerde studie en als dit niet haalbaar bleek, werd de studie met een observationele design voortgezet. De randomisatie bleek niet haalbaar doordat het niet mogelijk was door voorkeuren voor locatie van de patiënten en/of de verwijzend longartsen, en door het selectief toekennen van machtigingsaanvragen door ziektekostenverzekeraar. De interventiegroepen waren grotendeels vergelijkbaar, maar in de hooggebergtegroep was de gemiddelde leeftijd lager (44± SD14 versus 51± SD14), was er een lager percentage ex-rokers (14% versus 53%), en was het percentage atopisch astma (72% versus 53%), het gebruik van biologicals (22% versus 7%) en de dosis inhalatiecorticosteroïden (1600 µg/dag (IQR 1200 tot 3200) versus 1200 µg/dag (IQR 800 tot 2400) hoger dan in de zeeniveaugroep. Ook had de hooggebergtegroep een lagere score op de AQLQ en een hogere ACQ-score, indicerend dat de hooggebergtegroep meer last had van een ernstig astma. Er was geen verschil in uitval gedurende de studie. De behandeling bestond uit intensief trainingsprogramma, en astma-educatie inclusief zelfmanagement en psychologische ondersteuning. De studiepopulatie bestond uit patiënten (18 tot 75 jaar) met ernstig astma bij wie ondanks hoog medicatiegebruik geen controle van het astma was bereikt.
Er werd gekeken naar de uitkomstmaten kwaliteit van leven (gemeten met de AQLQ), astmacontrole (gemeten met de ACQ), exacerbatiefrequentie en corticosteroïdgebruik. De uitkomstmaten werden direct na de behandeling (na 3 maanden) en na een jaar gemeten (aantal deelnemers die de behandeling voltooiden in de hooggebergtegroep n=79 en de zeeniveaugroep n=38).
Rijssenbeek (2012) voerde een prospectieve cohortstudie uit met 137 patiënten met ernstig astma, die voor hooggebergtebehandeling waren doorverwezen. Alle patiënten gebruikten hoge doses inhalatiecorticosteroïden of orale corticosteroïden gecombineerd met LABA voor meer dan een jaar. Ook waren alle patiënten symptomatisch en hadden tenminste 1 ernstige exacerbatie gedurende het afgelopen jaar. Patiënten verbleven 12 weken in Davos voor een multidisciplinaire behandeling, die individueel was afgestemd. In de analyses werden de groepen wel/geen huisstofmijtallergie, en wel/niet allergisch met elkaar vergeleken. Als uitkomstmaten werden de ACQ, AQLQ, 6MWD en FEV1 gemeten. Fieten (2019) publiceerde de langetermijn resultaten (na 12 maanden) van de gehele groep. Van de oorspronkelijke groep voltooiden 101 patiënten de 12-maands meting.
Resultaten
Verbetering van astmacontrole
De Nijs (2020) vond na zowel 12 weken (-0,87, SE 0,20, 95%BI -1,27 tot -0,48) als na 12 maanden (-0,69, SE 0,26, 95%BI -1,38 tot -0,18) een klinisch relevant (≥ 0,5 punt) en significant verschil (gecorrigeerd voor leeftijd, atopie, roken, BMI en geslacht) in ACQ-score tussen behandeling op hoogte en zeeniveau, waarbij hoogtebehandeling zorgde voor een grotere verbetering in astmacontrole (De Nijs, 2020).
Rijssenbeek-Nouwens (2012) zag een klinisch relevante verbetering op de ACQ na 12 weken hooggebergtebehandeling ten opzichte van baseline (mediaan op baseline: 3,0, IQR 1,37; mediaan na 12 weken: 1,0, IQR 1,5). Na 12 maanden was er nog steeds een klinisch relevant (mediaan verschil van 0,7 punten ten opzichte van baseline) zichtbaar, maar deze was niet meer significant (Fieten, 2019).
Verbetering van kwaliteit van leven
Zowel na 12 weken (0,92 (SE 0,18, 95%BI 0,57 tot 1,27), als na 12 maanden (0,82, SE 0,23, 95%BI 0,57 tot 1,27), was het verschil in AQLQ-score (gecorrigeerd voor leeftijd, atopie, roken, BMI en geslacht) tussen behandeling op hoogte en zeeniveau klinisch relevant (≥ 0,5 punt) en significant, in het voordeel van hooggebergtebehandeling (De Nijs, 2020).
Rijssenbeek (2012) zag een klinisch relevante verbetering op de AQLQ na 12 weken hooggebergtebehandeling ten opzichte van baseline (mediaan op baseline: 4,0, IQR 1,22; mediaan na 12 weken: 6,0, IQR 1,1). Ook na 12 maanden was dit effect nog zichtbaar, met een mediaan verschil ten opzichte van 1,0 (Fieten, 2019).
Exacerbatiefrequentie
In de studie van De Nijs (2020) traden er tijdens de longrevalidatie op hoogte significant en klinisch relevant (≥ 30%) minder exacerbaties van astma op dan op zeeniveau: 20% van de patiënten op hoogte had een exacerbatie, tegenover 60% van de patiënten op zeeniveau. Tijdens de follow-up werden exacerbaties gebaseerd op zelf-rapportage en gedefinieerd als het aantal orale corticosteroïdkuren die in de voorgaande 3 maanden voorgeschreven werden en het aantal astma-gerelateerde ziekenhuisopnames. Na correctie van mogelijke confounders werd er geen significant verschil gevonden tussen de hooggebergte en zeeniveaugroep (geen data vermeld). De auteurs hebben een ordinal multivariate model gebruikt voor het berekenen van de coëfficiënt (-1,45, 95%BI -2,14 tot -0,76). In de resultaten wordt dit getal beschreven als een odds ratio, terwijl statistisch gezien een odds ratio niet negatief kan zijn. Hier lijkt echter sprake van een β-coëfficiënt en kan het dus geïnterpreteerd worden als gemiddeld verschil.
In de studie van Rijssenbeek (2012) hadden patiënten in het jaar voorafgaand aan hun hooggebergtebehandeling (mediaan) 3 exacerbaties (IQR 4). Het jaar na de hooggebergtebehandeling was dit met 34% afgenomen tot een mediaan van 2 (IQR 3) exacerbaties per patiënt per jaar (Fieten, 2019).
Corticosteroïdreductie
In de studie van De Nijs (2020) verschilde de dosis van inhalatiecorticosteroïden niet tussen de interventies direct na het longrevalidatieprogramma (gemiddeld verschil = 13,14, 96%BI -488 tot 514). In de OCS-afhankelijke subgroep (n=65) is een ongecorrigeerd verschil te zien van -5,3 (SE 1,73, 95%BI -8,69 tot -1,91) direct na de behandeling en een verschil van -1,67 (SE 0,57, 95%BI -2,79 tot -0,55) na de follow-up.
Rijssenbeek (2012) vond geen klinisch relevante verbetering op orale corticosteroïdengebruik na 12 weken hooggebergtebehandeling ten opzichte van baseline. De mediaan bleef 1600 µg/dag. Ook na 12 maanden was er geen verschil te zin in orale onderhoudscorticosteroïden (Fieten, 2019).
Verbetering longfunctie (FEV1%)
De Nijs (2020) vond een niet klinisch relevante verbetering in longfunctie tussen behandeling op hoogte en zeeniveau (gecorrigeerd voor confounders: 3,35 (SE 1,35, 95%BI -1,3 tot 4,0), p= 0,014), in het voordeel van hooggebergtebehandeling na 12 weken. 12 maanden na revalidatie was het verschil tussen de groepen afgenomen tot een gemiddeld verschil van 1,46% (SE 2,40, 95%BI -3,24, 6,16).
Rijssenbeek (2012) zag een significante, niet-klinisch relevante verbetering (6,1% in de allergische en 5,8% in de niet-allergische groep) in longfunctie na 12 weken hooggebergtebehandeling ten opzichte van baseline. Na 12 maanden werd deze uitkomstmaat niet gemeten.
Verbetering inspanningscapaciteit
De Nijs (2020) vond een nagenoeg klinisch relevant (≥ 47,5m), maar geen statistisch verschil in verbetering van de inspanningscapaciteit (ISWT) tussen behandeling op hoogte en op zeeniveau na 12 weken of 12 maanden (gecorrigeerd voor mogelijke confounders na 12 weken: 46,0 meter, 95%BI 25,3 tot 117,3; en na 12 maanden verschil 42,0, SE 49,6).
Rijssenbeek (2012) zag een klinisch relevante verbetering op de 6MDW (125m in de allergische en 147m in de niet-allergische groep) na 12 weken hooggebergtebehandeling ten opzichte van baseline. Na 12 maanden werd deze uitkomstmaat niet gemeten.
Tabel 2 Hooggebergtebehandeling
|
Uitkomstmaat |
Baseline |
Verschil post-interventie (12 wk)-baseline binnen de groepen |
Verschil follow-up (12 mnd)-baseline binnen de groepen |
Verschil tussen de groepen post-interventie |
|
Astmacontrole (ACQ) (KRV: ≥0,5 afname) |
||||
|
De Nijs, 2020 |
H: 3,1±0,9 Z: 2,4±0,9
|
H: -1,91 (SE 0,12)* Z: -0,60 (SE 0,11)* |
H: -0,91 (SE 0,14)* Z: 0,08 (SE 0,17) |
12 weken: -0,87 (95%BI -1,27, -0,48) 12 maanden -0,69 (95%BI -1,38, -0,18) |
|
Rijssenbeek-Nouwens, 2012, Fieten, 2019 |
Mediaan: 3,0 (IQR 1,37) |
Mediaan op 12 wk: 1,0 (IQR 1,5) |
Mediaan na 12 mnd: 2,3 (IQR 2,0) |
n.v.t. |
|
Kwaliteit van leven (AQLQ) (KRV: ≥0,5 toename) |
||||
|
De Nijs, 2020 |
H: 3,9±0,9 Z: 4,5±0,9
|
H: 1,96 (SE 0,11)* Z: 0,82 (SE 0,10)* |
H: 1,02 (SE 0,12)* Z: 0,05 (SE 0,16) |
12 weken: 0,92 (95%BI 0,57 tot 1,27) 12 maanden: 0,82 (95%Bi 0,57 tot 1,27) |
|
Rijssenbeek-Nouwens, 2012, Fieten, 2019 |
Mediaan: 4,0 ( IQR 1,22) |
Mediaan op 12 wk: 6,0 (IQR 1,1)* |
Mediaan op 12 mnd: 5,0 (IQR 1,6)* |
n.v.t. |
|
Exacerbatiefrequentie (KRV: ≥ 30% afname van aantal exacerbaties) |
||||
|
De Nijs, 2020 |
|
Z: 60% H: 20% |
- |
12 wk: -1.45 (95%BI -2,14 tot -0,76) |
|
Rijssenbeek-Nouwens, 2012, Fieten, 2019 |
Mediaan: 3 (IQR: 4) |
- |
Mediaan 12 mnd: 2 (IQR 3), 34% afname |
n.v.t |
|
Orale corticosteroïden (mg) (KRV: ≥ 2,5 mg/dag dosisafname prednison of equivalent) |
||||
|
De Nijs, 2020 (subgroep met OCS-onafhankelijk astma, n=60) |
H: 17,9±15,7 Z: 13,9± 8,4
|
H: -12,58 (SE 1,75)* Z: -3,92 (1,63)* |
H: -10,80 (SE 1,89)* Z: -1,25 (SE 1,75) |
(ongecorrigeerde verschillen) 12 wk: -5.29 (95%BI -8,69 tot -1,91) 12 mnd: -0.67 (95%BI -2,79 tot -0,55) |
|
Rijssenbeek-Nouwens, 2012, Fieten, 2019 |
Mediaan: 10 (IQR 10) |
- |
Mediaan 12 mnd: 10 (IQR 10) |
n.v.t |
|
Longfunctie (FEV1 (%)) (KRV: ≥10%) |
||||
|
De Nijs, 2020 |
H: 86±21 Z: 81±26
|
H: 4,0 (SE 0,7)* Z: 0,49 (SE 0,84) |
H: 3,2 (SE 1,1)* Z: 1,0 (SE 2,1) |
12 weken: 3,35 (95%BI -1,3 tot 4,0) 12 maanden: 1,46 (95%BI -3,24, 6,16) |
|
Rijssenbeek-Nouwens, 2012, |
Allergisch: 86.9±22.0 Niet-allergisch: 88.6±26.1 |
12 wk: Allergisch: 93.0±20.7* Niet-allergisch: 94.4±23.5* |
- |
n.v.t |
|
Inspanningscapaciteit (KRV 6-minuten looptest: 47,5m; shuttle walking test 30m) |
||||
|
De Nijs, 2020 (SWT) |
H: 418±224 Z: 492±305 |
H: 157m (SE 20,0* Z: 57,6 meter (SE 16)* |
H: 136 meter (SE 24.5) Z: 42,4 (SE 35,6) |
12 weken: 46,0 m (95%BI 25,3 tot 117,3) 12 maanden: 42,0 (SE 49,6) |
|
Rijssenbeek-Nouwens (6MWD) |
Allergisch: 514±182 Niet-allergisch: 397±164 |
12 wk: Allergisch: 639±220* Niet-allergisch: 544±174* |
- |
n.v.t. |
Data zijn gepresenteerd als gemiddelde±SD of (95%BI).
*significant verschillend ten opzichte van baseline.
ACQ: Asthma Control Questionnaire; AQLQ: Asthma Quality of Life Questionnaire; KRV: klinisch relevant verschil; SWT: shuttle walking test.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten astmacontrole, kwaliteit van leven, exacerbaties, corticosteroïdgebruik en longfunctie in de vergelijking longrevalidatie op hoogte of op zeeniveau start op Laag gezien het observationele design van de geïncludeerde studie. Er is met 1 niveau afgewaardeerd gezien beperkingen in de onderzoeksopzet. Er was sprake van een vorm van selectiebias: ‘confounding by indication’ bias. Het is erg lastig hier volledig voor te corrigeren. De multivariate analyse corrigeerde alleen voor karakteristieke die statistisch significant verschilden tussen de interventie- en controlegroep, terwijl astma-gerelateerde karakteristieken niet zijn meegenomen in de multivariate analyses. Daarnaast was er een vrij hoge drop-out rate (17% in beide groepen in de studie van De Nijs). Omdat er geen exacte redenen zijn gegeven, is niet bekend of de uitval te maken kan hebben met de interventie. Voor inspanningscapaciteit en corticosteroïdgebruik is er mogelijk sprake van publicatiebias; de 6MWT was beschreven als secundaire uitkomstmaat in het Nederlands Trial Register, maar is niet beschreven in de publicatie.
De studie van Rijssenbeek-Nouwens (2012) betrof een éénarmige studie. Omdat er geen controlegroep is, is het onduidelijk of de gevonden effecten te wijden zijn aan de interventie zelf, of aan het natuurlijk beloop van de ziekte. Er werden geen multivariate analyses uitgevoerd, er was een hoge drop-out rate van 25% en er was mogelijk selectieve rapportage van uitkomstmaten. Omdat het geen vergelijkend onderzoek is, is deze niet meegenomen bij de conclusies.
Gezien de grootte van het effect op astmacontrole en kwaliteit van leven is er nader bekeken of er opgewaardeerd kon worden. Omdat het effect echter op basis is van één observationeel vergelijkende studie en één pre-post studie, is het risico op vertekening van de resultaten te groot om zeker te zijn dat het waargenomen effect ook daadwerkelijk het ware effect is. We komen daarom uit op een volgens GRADE ‘zeer lage’ bewijskracht.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende twee zoekvragen/PICO’s:
P: volwassen patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma die ondanks maximale medicamenteuze behandeling hun astma onvoldoende onder controle hebben;
I: longrevalidatie, bestaande uit minimaal drie disciplines waaronder een gestructureerd trainingsprogramma;
C: Standaardzorg (zorg die de patiënt al ontvangt om de astma te behandelen);
O: astmacontrole (ACQ), kwaliteit van leven (AQLQ en SGRQ), exacerbatiefrequentie, steroïdreductie, verbetering longfunctie (FEV1), inspanningscapaciteit (6-minuten looptest (6MWT), maximale zuurstofopnamevermogen (VO2 max)).
P: volwassen patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma die ondanks maximale medicamenteuze behandeling hun astma onvoldoende onder controle hebben;
I: longrevalidatie op hoogte (hooggebergtebehandeling, > 1500 m boven zeeniveau), bestaande uit minimaal drie disciplines waaronder een gestructureerd trainingsprogramma;
C: 1. Standaardzorg (zorg die de patiënt al ontvangt om de astma te behandelen);
2. longrevalidatie op zeeniveau;
O: astmacontrole (ACQ), kwaliteit van leven (AQLQ en SGRQ), exacerbatiefrequentie, steroïdreductie, verbetering longfunctie (FEV1), inspanningscapaciteit (6-minuten looptest (6MWT), maximale zuurstofopnamevermogen (VO2 max)).
Relevante uitkomstmaten
De werkgroep achtte verbetering van astmacontrole en verbetering van kwaliteit van leven voor de besluitvorming cruciale uitkomstmaten; en exacerbatiefrequentie, steroïdereductie, verbetering longfunctie en inspanningscapaciteit voor de besluitvorming belangrijke uitkomstmaten.
Verbetering van astmacontrole
De werkgroep definieerde ≥ 0,5 punt verbetering op Asthma Control Questionnaire (ACQ) als een klinisch (patiënt) relevant verschil (Juniper, 2006).
Verbetering van kwaliteit van leven
De werkgroep definieerde ≥ 0,5 punt verbetering op Asthma Quality of Life Questionnaire (AQLQ) en ≥ 4 punt verbetering op de SGRQ als een klinisch (patiënt) relevant verschil (Juniper, 1999).
Exacerbatiefrequentie
De werkgroep definieerde ≥ 30% afname van aantal exacerbaties als een klinisch (patiënt) relevant verschil (Reddel, 2009; Henriksen, 2018).
Corticosteroïdreductie
De werkgroep definieerde ≥ 2,5 mg/dag dosisafname prednison of equivalent van ander steroïd als een klinisch (patiënt) relevant verschil.
Verbetering longfunctie
De werkgroep definieerde een toename FEV1 ≥ 10% van voorspelde waarde als een klinisch (patiënt) relevant verschil.
Verbetering inspanningscapaciteit
De werkgroep definieerde een toename in loopafstand van 30 meter op de 6-minuten looptest (Holland, 2014), een 47,5 meter op de incremental shuttle walking test (Singh, 2008), of toename van 3,5 ml/O2/min/kg (1 MET) op de maximale inspanningstest als een klinisch (patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 22 januari 2020 met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studies die voldoen aan de PICO voor hooggebergtebehandeling. Op 29 januari 2020 is in dezelfde databases gezocht naar studies die voldoen aan de PICO voor longrevalidatie. De werkgroep stelde als aanvullende criteria voor alleen vergelijkend onderzoek mee te nemen, met een minimale interventieduur van 6 weken, en een minimale follow-up duur van 3 maanden. Er is een update van de search naar hooggebergtebehandeling uitgevoerd op 24 februari 2021, en een update van de search naar longrevalidatie op 25 februari 2021. De zoekverantwoording is weergegeven onder het tabblad ‘Verantwoording’. De literatuurzoekactie naar longrevalidatie leverde 694 treffers op, en naar hooggebergtebehandeling leverde 264 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: volwassen patiënten met moeilijk behandelbaar, matig-ernstig en ernstig astma, longrevalidatie bestaande uit tenminste drie disciplines, minimale interventieduur van 6 weken en een minimale follow-up duur van 3 maanden. Op basis van titel en abstract werden in eerste instantie 8 studies voorgeselecteerd voor de PICO naar longrevalidatie op zeeniveau. Na raadpleging van de volledige tekst, werden vervolgens 6 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 2 studies definitief geselecteerd.
Voor de PICO naar hooggebergtebehandeling werden op basis van titel en abstract in eerste instantie 8 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werd in eerste instantie 1 vergelijkend onderzoek geïncludeerd. Vervolgens is besloten om ook twee artikelen over een observationele studie met alleen pre-post metingen mee te nemen omdat er anders belangrijke informatie zou worden gemist. Deze valt sec gezien buiten de PICO. Er zijn 5 studies geëxcludeerd en 3 studie definitief geselecteerd. De referentielijsten van de geïncludeerde studies zijn nagelopen op relevante artikelen; daar kwamen geen andere geschikte studies meer naar voren.
Resultaten
Vier onderzoeken (5 artikelen) zijn opgenomen in de literatuuranalyse: twee studies voor het deel over longrevalidatie, en twee studies (3 artikelen) waarin de effecten van hooggebergtebehandeling in combinatie met longrevalidatie vergeleken werden met de effecten van longrevalidatie op zeenniveau. De studies naar longrevalidatie waren niet te poolen omdat er maar twee studies beschikbaar zijn en omdat de data verschillend zijn gerapporteerd. Er werden geen onderzoeken gevonden die hooggebergtebehandeling vergeleken met standaardzorg. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidentie tabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- 1 - Agusti A, Bel E, Thomas M, et al. Treatable traits: toward precision medicine of chronic airway diseases. European Respiratory Journal Feb 2016, 47 (2) 410-419; DOI: 10.1183/13993003.01359-2015
- 2 - Beerthuizen T.; Rijssenbeek-Nouwens LH; van Koppen SM; et al. Internet-Based Self-Management Support After High-Altitude Climate Treatment for Severe Asthma: Randomized Controlled Trial. J Med Internet Res - Volume 22, Issue 7, pp. e13145 - published 2020-01-01
- 3 - Boonpiyathad T, Capova G, Duchna HW, et al. Impact of high-altitude therapy on type-2 immune responses in asthma patients. Allergy: European Journal of Allergy and Clinical Immunology 2020; 75: 1, pp. 84-94.
- 4 - Chung KF, Wenzel SE, Brozek JL, et al., International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma, Eur. Respir. J. 43 (2) (2014) 343–373.
- 5 - de Nijs SB, Krop EJM, Portengen L, Rijssenbeek-Nouwens LH, et al. (2020). Effectiveness of pulmonary rehabilitation at high-altitude compared to sea-level in adults with severe refractory asthma. Respiratory Medicine, 171, 106123.
- 6 - GINA Full Report 2021 Front Cover ONLY (ginasthma.org) pg 36, geraadpleegd 9 juli 21
- 7 - Grootendorst DC, Dahlen SE, Van Den Bos JW, et al. Benefits of high altitude allergen avoidance in atopic adolescents with moderate to severe asthma, over and above treatment with high dose inhaled steroids, Clin. Exp. Allergy 31 (3) (2001) 400–408.
- 8 - Heymans J, Kleijnen S, Verstijnen I. Passend bewijs bij het bepalen van effectiviteit van interventies. Ned Tijdschr Geneeskd 2013;157:A5479
- 9 - Holland AE, Spruit MA, Troosters T, et al. An official European Respiratory Society/American Thoracic Society technical standard: field walking tests in chronic respiratory disease. Eur Respir J 2014; 44(6): 1428-46.
- 10 - Huss-Marp J, Krämer U, Eberlein B, et al. Reduced exhaled nitric oxide values in children with asthma after inpatient rehabilitation at high altitude. J Allergy Clin Immunol. 2007 Aug;120(2):471-2. doi: 10.1016/j.jaci.2007.03.039
- 11 - Hyland ME, Whalley B, Jones RC, Masoli M. A qualitative study of the impact of severe asthma and its treatment showing that treatment burden is neglected in existing asthma assessment scales, Qual. Life Res. 24 (3) (2015) 631–639.
- 12 - Karagiannidis C, Hense G, Rueckert B, et al. High-altitude climate therapy reduces local airway inflammation and modulates lymphocyte activation. Scand J Immunol 2006;63.
- 13 - Majd, S., Apps, L., Chantrell, S., Hudson, N., Eglington, E., Hargadon, B.,... & Evans, R. A. (2020). A Feasibility Study of a Randomized Controlled Trial of Asthma-Tailored Pulmonary Rehabilitation Compared with Usual Care in Adults with Severe Asthma. The Journal of Allergy and Clinical Immunology: In Practice, 8(10), 3418-3427.
- 14 - Nunes C, Pereira AM, Morais-Almeida M. A Asthma costs and social impact. Asthma Research and Practice (2017) 3:1
- 15 - Osadnik CR, Singh S. Pulmonary rehabilitation for obstructive lung disease. Respirology 2019. DOI: 10.1111/resp.13569]
- 16 - Osadnik CR, McDonald VM, Holland AE. Pulmonary rehabilitation for adults with asthma. Cochrane Database of Systematic Reviews 2019, Issue 11. Art. No.: CD013485. DOI: 10.1002/14651858.CD013485.
- 17 - Raad voor Volksgezondheid en Samenleving. Zonder context geen bewijs. Over de illusie van evidence-based practice. Den Haag, juni 2017
- 18 - Rijssenbeek-Nouwens LH, Fieten KB, Bron AO, et al. High-altitude treatment in atopic and nonatopic patients with severe asthma. Eur Resp Jour 2012; 40: 6, pp. 1374-1380
- 19 - Salandi et al. Impact of pulmonary rehabilitation on patients' health care needs and asthma control: a quasi-experimental study. BMC Pulm Med. 2020 Oct 15;20(1):267. doi: 10.1186/s12890-020-01301-9.
- 20 - Schultz K, Wittmann M, Wagner R, Lehbert N, Schwarzkopf L, Szentes B, Nowak D, Faller H, Schuler M: In-patient pulmonary rehabilitation to improve asthma control—a randomized controlled study (EPRA, Effectiveness of Pulmonary Rehabilitation for Patients with Asthma). Dtsch Arztebl Int 2021; 118: 23–30. DOI: 10.3238/arztebl.m2021.0003
- 21 - Singh, S. J., Jones, P. W., Evans, R. & Morgan, M. D., 2008. Minimum clinically important improvement for the incremental shuttle walk test. Thorax, September, 63(9), pp. 775-777.
- 22 - Spieksma FT, Zuidema P, Leupen MJ. High altitude and housedust mites. Br Med J 1971; 1: 82–84.
- 23 - Spruit MA, Singh SJ, Garvey C, et al. An official American Thoracic Society/European Respiratory Society statement: key concepts and advances in pulmonary rehabilitation. American Journal of Respiratory and Critical Care Medicine 2013;188(8):e13‐64.
- 24 - Spruit MA, Pitta F, Garvey C, et al. Differences in content and organisational aspects of pulmonary rehabilitation programmesEuropean Respiratory Journal 2014 43: 1326-1337; DOI: 10.1183/09031936.00145613
- 25 - Türk, Y., Theel, W., van Huisstede, A., van de Geijn, G. J. M., Birnie, E., Hiemstra, P. S.,... & Braunstahl, G. J. (2020). Short-term and long-term effect of a high-intensity pulmonary rehabilitation programme in obese patients with asthma: a randomised controlled trial. European Respiratory Journal, 56(1).
- 26 - Vereniging Nederland-Davos (VND) Witboek. 2018
- 27 - Vinnikov D, Khafagy A, Blanc PD, et al. High-altitude alpine therapy and lung function in asthma: systematic review and meta-analysis ERJ Open Res 2016; 2: 00097-2015 | DOI: 10.1183/23120541.00097-2015
- 28 - Wise RA, Brown CD. Minimal clinically important differences in the six-minute walk test and the incremental shuttle walking test. COPD: Journal of Chronic Obstructive Pulmonary Disease. Volume 2, 2005 - Issue 1
- 29 - Witboek. https://nederland-davos.nl/over-ons/astmacentrum-davos/witboek-de-mens-achter-de-patient-bij-de-hooggebergtebehandeling-in-het-nad/
Evidence tabellen
Evidence table for the effect of pulmonary rehabilitation programs
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
Majd, 2020 |
Type of study: Feasibility study of RCT
Setting and country: Multicenter, United Kingdom
Funding and conflicts of interest: the study was funded by a Research for Patient Benefit grant of the National Institute for Health Research (NIHR) (grant no. PB-PG-0712-28063). No conflict of interest declared. |
Inclusion criteria: - patients who were under physicians specializing in the care of severe asthma for at least 6 months - symptomatic despite being on step 4 or 5 treatment according to the British Thoracic Society/Scottish Intercollegiate Guideline Network Guidelines (high-dose inhaled corticosteroids (>1000 mg beclomethasone equivalent) plus a second controller and/or systemic corticosteroids).
Exclusion criteria: - diagnosis of smoking-related chronic obstructive pulmonary disease; - presence of fixed airflow obstruction (FEV1/FVC (forced vital capacity) <70%) and a smoking history of 10 pack-years or more; - unable to exercise - history of significant cardiac disease - a severe exacerbation of asthma in the preceding month before entry to the program; - a hospital admission because of an exacerbation of asthma within the last 3 months; and - an admission to intensive care involving intubation within the last year.
N total at baseline: Intervention: 34 Control: 17
Important prognostic factors2: Age ± SD: 54±13
Sex: 38% M
The baseline characteristics of the AT-PR and UC groups were similar except for lung function, which was better in the UC group (FEV1% predicted, 77±13 versus 65±21). |
Intervention:
12 weeks Asthma-tailored pulmonary rehabilitation, including exercise and a multidisciplinary education programme.
|
Control
Usual care
|
Length of follow-up: 9 months
Loss-to-follow-up: before postintervention analysis: Intervention: 13 Reasons: - unable to commit to study visits: 4 - arthritic pain: 1 - serious adverse event: 2
Control: 8 Reasons: - unable to be contacted: 4 - unable to commit to study visits: 1 - family circumstances: 1 - arthritic pain: 1 - serious adverse event: 1
Loss-to-follow-up: before follow-up analysis: Intervention: 5 Reasons: - unable to commit to study visits: 1 - feeling too unwell to continue: 1 - serious adverse event: 2
Control: 2 Reasons: - unable to be contacted: 1 - arthritic pain: 1
|
Outcome measures and effect size (include 95%CI and p-value if available):
ACQ: Mean difference between groups at 12 weeks: -0.4 (95% CI -0.9 to 0.1)
AQLQ: Mean difference between groups at 12 weeks: -0.2 (-2.7 to 2.3)
Shuttle walking test Mean difference between groups at 12 weeks: 74 m (95%BI 25, 124)
VO2max Mean difference between groups at 12 weeks: 1.4 (95%BI -1.1, 3.8) |
|
Turk, 2020 |
Type of study: RCT
Setting and country: single setting, hospital, the Netherlands
Funding and conflicts of interest: |
Inclusion criteria: - 18 and 55 years - with obesity (BMI >30 kg/m2) - and had a suboptimal controlled asthma (ACQ > 0.75), despite optimal inhalation therapy (inhalation corticosteroid and a long-acting B-agonist).
N total at baseline: Intervention 1: 14 Intervention 2: 7 Control: 10
Important prognostic factors2: age ± SD: I1: 41.57 ± 9.73 I2: 41.57 ± 12.54 C: 41.90 ± 8.58
Sex: I1: 71% F I2: 57% F C: 90% F
Groups comparable at baseline
|
Intervention
1) pulmonary rehabilitation only (PR only), 12 weeks 2) pulmonary rehabilitation with online self-management support (PR+SMS), 12 weeks
|
Control
Usual care
|
Length of follow-up: 12 months
Loss-to-follow-up: 3 Intervention 2: 2 Control: 1 Reason: subjects withdrew informed consent
|
Outcome measures and effect size (include 95%CI and p-value if available):
ACQ: After 3 months: PR-group: median decrease: PR+SMS: -0.66 (IQR -1.17, -0.33) Control: 0.25 (IQR -0.66, 0.63) After 3 months difference between PR and control group: p=0.13 Difference PR and PR+SMS: p=0.62
After 12 months difference between PR and control group: (β=-1.06, 95%CI - 1.84, -0.27). Difference between PR and PR+SMS: (β=-0.34, 95%CI -0.95, 0.27).
AQLQ After 3 months there was no difference in AQLQ in the groups and between the groups. After 12 months difference between PR and control group: (β=0.28, 95%CI -0.65, 1.22). Difference between PR and PR+SMS: (β=0.32, 95%CI -0.64, 1.29).
Lung function (FEV1) After 3 months there was no difference in FEV in and between the groups. After 12 months difference between PR and control group: (β=0.24, 95%CI -5.40, 5.87). Difference between PR and PR+SMS: (β=3.37, 95%CI -4.41 - 11.14).
Exercise capacity After 3 months: PR-group: - VO2max increase mean 13,2 (SD 9,2) (p= ≤ 0,005) - 6MWD increase 52 (40) (p≤ 0,005). After 3 months difference between PR and control group: VO2max: p=0,029; and 6MWD: p= 0,080.
After 12 months of follow-up the PR-group had a better VO2max (%) than the control group (β 12,04 (1,99; 22,08), p = 0,022), and a better 6MWD (β 58,0 (16,9; 99,1), p= 0,009).
No statistically significant differences were observed in changes in exercise capacity (VO2max and 6MWD) between PR and the PR + SMS group at 3 months and at 12 months. |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Turk, 2020 |
Research randomization program was used. |
Unlikely |
Likely (no blinding) |
Likely (no blinding) |
Likely (no blinding) |
Unlikely |
Unlikely |
Unlikely |
|
Majd, 2020 |
Internet-based ‘sealed envelope’ randomisation codes (Majd, 2016) |
Unlikely |
Likely (no blinding) |
Likely (no blinding) |
Unlikely (blinded investigator) |
Unlikely |
Likely |
Unclear, no intention to treat analyses |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis
Evidence table for the effect of pulmonary rehabilitation programs on high-altitude
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
|
|
De Nijs, 2020 |
Type of study: Controlled clinical trial
Setting and country: Multicenter, Netherlands and Switserland
Funding and conflicts of interest: This study was supported by grants from the Dutch Asthma Center Davos, Merem Asthma Center Heideheuvel and the Netherland-Davos Society.
Conflicts of interest not reported |
Inclusion criteria: - aged 18–75 years - diagnosis of severe refractory asthma according to the ERS/ATS criteria - use of long-acting bronchodilators and high dose ICS, ≥ 1000 μg fluticasone daily or equivalent) with or without OCS, ≥ 6 months/year - symptomatic and had uncontrolled asthma - non-smokers or ex-smokers for >6 months
Exclusion criteria: - alcohol abuse - severe unstable psychiatric condition requiring treatment, - participation in a clinical trial in the preceding three months, - unstable cardiovascular status, - pregnancy or planning to become pregnant, - suffering from another lung disease that had impact on asthma symptoms - use of long-term oxygen therapy at sea-level
N total at baseline: Intervention: 93 Control: 45
Important prognostic factors2: age ± SD: I: 44 ± 14.1 C: 51 ± 14.2
Sex: I: 76% M C: 62% M
Groups comparable at baseline? NO: Patients in the high-altitude group were younger, were less often an ex-smoker, were more often atopic and had more frequent chronic rhinosinusitis or eczema comorbidity as compared to patients in the sea-level group. At entry the high-altitude group used higher dosages of ICS and demonstrated a lower AQLQ and higher ACQ as compared to the sea-level group. Biologicals were more often used in the high-altitude group and were temporally stopped during HAPR. |
A multidisciplinary pulmonary rehabilitation program (12 weeks) in the high-altitude (1650m) asthma center in Davos, Switzerland.
|
A multidisciplinary pulmonary rehabilitation program (12 weeks) in the tertiary asthma clinic at sea-level in Hilversum, The Netherlands.
|
Length of follow-up: 12 months
Loss-to-follow-up: Intervention: 9 (9.7%) Reasons: not described
Control: 1 (2.2%) Reasons: not described
|
Outcome measures and effect size (include 95%CI and p-value if available):
AQLQ: After 3 months: MD 0,5 higher in HA-group (0,18 to 0,82 higher) After 12 months: MD 0,3 higher in HA-group (0,12 lower to 0,72 higher)
ACQ: After 3 months: MD 0,6 lower in HA-group (0,94 to 0,26 lower) After 12 months: MD 0,2 lower in HA-group (0,64 lower to 0,24 higher)
Steroid reduction: 3 months OCS: MD 3,1 lower in HA-group (6,36 lower to 0,16 higher)
3 months ICS (median (IQR)): HA-group 800 μg/day (IQR: 800-2800), Control group: median 1600 μg/day (IQR: 1200-2500). The difference after 3 months was 13.14 μg/day (SE 206.79).
OCS bursts 12 months: MD 0,0 (-0,48 lower to 0,48 higher)
Exacerbation frequency Fewer asthma exacerbations occurred during treatment at high-altitude compared to sea-level (OR = - 1.45, P < 0.001) although no difference were observed between the groups in the number of OCS bursts or hospitalizations during follow-up.
Improvement lung function Patients receiving HAPR had higher improvement in lung function (%pred FEV1 3.4, p = 0.014) compared to the LAPR group, adjusted for potential baseline confounders. Niet meer na 12 maanden. |
|
|
Rijssenbeek, 2012
Fieten, 2019 |
Type of study: Prospective cohort study
Setting and country: Multicenter, Netherlands and Switserland
Funding and conflicts of interest: Not mentioned
NB: Fieten (2019) reports the follow up data after 12 months for the entire group reported earlier by Rijssenbeek (2012).
|
Inclusion criteria: - >18 years of age - diagnosis of severe, refractory asthma according to ATS criteria - use of high doses of inhaled corticosteroids (>1,260 mg per day of beclomethasone or equivalent) or oral corticosteroids combined with long-acting bronchodilators for >1 yr - symptomatic and had had at least one severe exacerbation during the past year requiring a course of oral corticosteroids, or were receiving chronic oral cortico- steroid therapy - referred for the high-altitude clinic inhalation technique
Exclusion criteria: - current smoking - patients with smoking-related chronic obstructive pulmonary disease (e.g. ex-smokers)
N total at baseline: 137
Patients with (n=68) vs patients without (n=69) house dust mite (HDM) sensitisation
Important prognostic factors: age ± SD: HDM-sen: 41.5 ± 14.5 Non-HDM-sen: 48 ± 15.3
Sex: HDM-sen: 27% M Non-HDM-sen: 37% M
Groups comparable at baseline? No, the HDM-sensitised patients were younger, more often sensitised for any inhaled allergen, and had lower age of asthma onset
Patients with (n=92) vs patients without (n=45) any allergic sensitisation
Important prognostic factors: age ± SD: Sen: 44 ± 15.8 Non-sen: 48 ± 14.2
Sex: Sen: 27% M Non-sen: 22% M
Groups comparable at baseline? NO, sensitised patients were more often sensitised to HDM, and had a lower overall age of asthma onset. |
A multidisciplinary pulmonary rehabilitation program (12 weeks) in the high-altitude (1650m) asthma center in Davos, Switzerland. |
N/a |
Length of follow-up: 12 weeks
Loss-to-follow-up: All 137 completed follow up |
Patients with vs without (n=69) house dust mite (HDM) sensitisation
AQLQ mean ± SD: HDM-sensitised: increased from 4.0 ± 0.9 to 5.6 ± 1.0 (p<0.001) Non-HDM-sensitised: increased from 3.8 ± 0.9 to 5.3 ± 1.1 (p<0.001)
ACQ: mean (SD): HDM-sensitised: decreased from 3.0 ± 1.0 to 1.6 ± 1.2 (p<0.001) Non-HDM-sensitised decreased from 3.3 ± 1.0 to 1.8 ± 1.0 (p<0.001)
ICS ug per day: median (range) HDM-sensitised Baseline: 1600 (200-8000) Follow-up (12 wk): 1600 (0–8000) P=0.533 Non-HDM-sensitised Baseline: 1600 (0–8000) Follow-up (12 wk): 1600 (0–8000) P=0.40
FEV1 %predicted: mean ± SD HDM-sensitised increased from 88.4 ± 20.4 to 94.2 ± 20.1, P=0.001 Non-HDM-sensitised increased from 86.5 ± 26.2 to 92.8 ± 23.1, P=0.004
6MWD m: mean ± SD HDM-sensitised increased from 516 ± 178 to 636 ± 219, p<0.001 Non-HDM-sensitised increased from 430 ± 182 to 575 ± 197, p<0.001
Patients with vs without any allergic sensitisation AQLQ mean ± SD: Sensitised increased from 4.0 ± 1.0 to 5.6 ± 1.0 (p<0.001) Non-sensitised: increased from 3.8 ± 1.0 to 5.3 ± 1.2, p<0.001
ACQ: mean (SD): Sensitised: decreased from 3.1 ± 1.1 to 1.7 ± 1.2, p<0.001 Non-sensitised decreased from 3.3 ± 1.0 to 1.8 ± 1.0, p<0.001
ICS ug per day: median (range) Sensitised Baseline: 1600 (200–8000) Follow-up (12 wk): 1600 (0–8000) P=0.295 Non-sensitised Baseline: 1600 (0–7400) Follow-up (12 wk): 1600 (0–8000) P=0.136
FEV1 %predicted: mean ± SD Sensitised increased from 86.9 ± 22.0 to 93 ± 20.7, p<0.001 Non-sensitised increased from 88.6 ± 26.1 to 94.4 ± 23.5, P=0.019
6MWD m: mean ± SD Sensitised increased from 514 ± 182 to 639 ± 220, p<0.001 Non-sensitised increased from 397 ± 164 to 544 ±174, p<0.001
|
|
|
Fieten (2019): Important prognostic factors: age ± SD: 47 ± 14
Sex: 39% M
Groups comparable at baseline? Fieten (2019): in supplementary: NO, the majority of patients were female, middle‐ aged, had multimorbidities and required chronic oral steroid treatment
|
Length of follow-up: 12 months (meaurements at 3 months, 6 months, 12 months)
Loss-to-follow-up: 41 (29%) Those lost to follow up were significantly younger and had significantly higher ACQ scores at discharge. |
AQLQ median (IQR): Baseline: 4.0 (1.22), discharge 6.0 (1.1), follow‐up by 3 months 5.2 (1.6), 6 months 5.1 (1.4), 12 months 5.0 (1.6)
ACQ: median (IQR): Baseline: 3.0 (1.37), discharge 1.0 (1.5), follow‐up by 3 months 2.0 (2.0), 6 months 2.0 (2.0), 12 months 2.3 (2.0)
Number of exacerbations per patient (pharmacy data): median (IQR) Baseline: 3 (4) Follow up (12 mo): 2 (3) p=0.000
Number of exacerbations per patient (patient reported): median (IQR) Baseline: 5 (6) Follow up (12 mo): 2 (4) P=0.000
Number of hospitalized patients n(%) Baseline: 51 (50.5%) Follow up (12 mo): 28 (32%) P=0.014
Number of hospitalizations per patients: median (IQR) Baseline: 2 (2) Follow up (12 mo): 0.5 (2.2) P=0.010
Need for maintenance oral corticosteroids (pharmacy data): n(%) Baseline: 31 (33%) Follow up (12 mo): 33 (34%) P=1.0
Required dose (mg) of maintenance oral Corticosteroids (pharmacy data): median (IQR) Baseline: 10 (10) Follow up (12 mo): 0.5 (2.2) P=0.684
|
|||||
|
|
|
|
Research question: long rehabilitation on altitude
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear)
|
Bias due to ill-defined or inadequately measured outcome?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
De Nijs, 2020 |
Unlikely |
Unclear; drop-out was equally large between groups, but no clear reasons for drop-out were given |
Likely; patients, caregivers nor investigators were blinded were not blinded (not possible). Several reported items were not reported in the publication |
Unclear/likely; Multivariate analysis controlled for baseline value, corrected for age, atopy, smoking history, BMI and gender, but not for asthma factors. Several deviations from the research protocol took place (observation period: Baseline measurements for sea level intervention for the outcomes AQLQ/ACQ took place 6 weeks later; 30% of the patients received a different questionnaire; The group who trained at sea level did the 6MWT in groups though the high altitude group executed the test individually |
|
Rijssenbeek, 2012, Fieten, 2019 |
Likely, no control group
|
Large drop-out during the intervention (21%) and in the follow-up period of 12 months (29%) |
Likely; patients, caregivers nor investigators were blinded (not possible). |
Likely, only pre-post analyses, no multivariate analysis took place. |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Longrevalidatie |
|
|
Feng, 2021 |
Systematisch review over effect van fysieke training (verkeerde I). De geïncludeerde studies onderzochten geen multidisciplinaire (met ten minste 3 disciplines) longrevalidatie. Geen ernstig astma |
|
Sahin, 2019 |
andere PICO: ze vergelijken ongecontroleerd astma met deel gecontroleerd astma en niet longrevalidatie met geen longrevalidatie |
|
Lingner, 2015 |
Te korte studieperiode (longrevalidatieprogramma duurde 3 weken) |
|
França-Pinto, 2015 |
Verkeerde PICO (alleen fysieke training) + educatie + ademoefeningen |
|
Mendes, 2011 |
Verkeerde PICO (alleen fysieke training) |
|
Orooj, 2020 |
patiënten met ACOS |
|
Korczak, 2010 |
HTA, includeert COPD en bronchiale astma; niet de juiste uitkomstmaten |
|
Feng, 2021 |
Geen ernstig astma, review; Geincludeerde studies onderzochten geen multidisciplinaire (met ten minste 3 disciplinines) longrevalidatie |
|
Coëtmeur, 2020 |
Niet multidisciplinair; fysieke activiteit in ernstig astma (FASE-CPHG study) |
|
Knibb, 2020 |
Verkeerde PICO, review P=young adults(11-25 jaar) met allergische aandoening (oa astma) |
|
Lopez-de-Uralde-Villanueva, 2018 |
Andere PICO, geen multidisciplinaire longrevalidatie |
|
Evaristo, 2020 |
Verkeerde PICO (Aerobici vs breathing) |
|
McDonald, 2020 |
Andere PICO, corss-sectionele studie |
|
Sliwka, 2020 |
Andere PICO (respiratory physiotherapy+muziek, vs respiratory physiotherapyzonder muziek) |
|
Toennessen, 2018 |
Geen ernstig astma, niet multidisciplinair (I=high intensity trainig) |
|
Motaghi Nejad, 2017 |
Geen ernstig astma; verkeerde PICO (I=precede training (gedragsverandering). Geen astmauitkomsten) |
|
Blakemore, 2015 |
Review, geen ernstig astma; geen multidisciplinaire studies geïncludeerd. |
|
Meyer, 2015 |
Geen ernstig astma, niet multidisciplinair |
|
Miyaoto, 2014 |
|
|
Freitas, 2017 |
Andere PICO, niet multidisciplinair |
|
Hooggebergtebehandeling |
|
|
Saxer, 2019 |
Te korte studieduur (slechts 3 weken op hoogte) |
|
Eberlein, 2014 |
Verkeerde P (niet enkel astmapatiënten); geen aparte rapportage |
|
Boonpiyathad, 2020 |
Verkeerde vergelijking (niet hoog versus laag), te korte studieduur (slechts 21 dagen op hoogte), andere uitkomstmaten |
|
Basler, 2020 |
Andere uitkomstmaten (Changes in FeNO, d1 and sx1), zelfde studie als Saxer (2019) |
|
Beerthuizen, 2020 |
Andere PICO (internet-based zelfmanagementprogramma na het volgen van hooggebergtebehandeling) |
|
Massimo, 2014 |
Review; geïncludeerde studies gaan over kinderen, of zijn al meegenomen in ons overzicht. |
|
Jurczak, 2011 |
Bronchiale astma; te korte studieduur |
|
Vinnikov, 2016 |
Geen van de geïncludeerde studies voldoet aan onze criteria |
|
Hashimoto, 2018 |
Andere PICO, verkeerde studiedesign |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-07-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de NVALT of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVALT is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De voorliggende richtlijn betreft een herziening van de NVALT richtlijn Diagnostiek en behandeling van ernstig astma uit 2013. Alle modules zijn beoordeeld op actualiteit. Vervolgens is een prioritering aangebracht welke modules een daadwerkelijke update zouden moeten krijgen. Hieronder staan de modules genoemd met de wijzigingen. Tevens is per module een inschatting gemaakt voor de beoordeling voor herziening.
|
Uitgangsvraag/onderwerpen |
Wijzigingen richtlijn 2019 |
Uiterlijk jaar voor herziening |
|
Definities |
Opgenomen in Algemene inleiding |
2024 |
|
Diagnostiek van ernstig astma |
Minimale (tekstuele) aanpassingen |
2024 |
|
Behandelprincipes |
Herbevestigd |
2024 |
|
Antifungale therapie |
Minimale aanpassingen |
2024 |
|
Bariatrische chirurgie |
Nieuw ontwikkeld |
2024 |
|
Anti-IgE (omalizumab) |
Herzien in bredere module Biologicals |
2024 |
|
Bronchiale thermoplastiek |
Gereviseerd |
2024 |
|
Fysiotherapie |
Nieuw ontwikkeld |
2024 |
|
Hooggebergtebehandeling |
Wordt in Q2 2020 herzien in module Longrevalidatie en hooggebergtebehandeling |
2024 |
|
Leukotrieën |
Minimale aanpassingen |
2024 |
|
Longrevalidatie (inspanningstraining, educatie/zelfmanagement, ademhalingsoefeningen/yoga) |
Wordt opgenomen in module Longrevalidatie en hooggebergtebehandeling |
2024 |
|
Steroïdsparende behandeling |
Module wordt teruggetrokken. |
|
|
Systemische corticosteroïden |
Vervangen door nieuwe module |
2024 |
|
Theofylline |
Herbevestigd |
2024 |
|
Tiotropium Bromide |
Minimale aanpassingen |
2024 |
|
Optimaliseren en monitoren van zorg |
Gereviseerd |
2024 |
|
Organisatie van zorg |
Gereviseerd |
2024 |
|
Kwaliteitssystemen |
Opgenomen in Verantwoording en Implementatieplan |
2024 |
Algemene gegevens
De richtlijn is goedgekeurd door:
- Vereniging Nederland Davos
- Longfonds
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Stichting Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
Deze richtlijn geeft aanbevelingen ten aanzien van diagnostiek en behandeling van volwassen patiënten (leeftijd ≥ 18 jaar) met ernstig astma. Doel van deze herziening is om een richtlijn te verkrijgen waarin de meeste recente medische kennis omtrent de zorg voor patiënten met ernstig astma wordt meegenomen.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met de ernstig astma en astma.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstig astma te maken hebben.
Werkgroep
- Prof. F.W.J.M. Smeenk, longarts, Catharina Ziekenhuis, Eindhoven, NVALT (voorzitter werkgroep)
- Dr. G.J. Braunstahl, longarts, Franciscus Gasthuis en Vlietland, Rotterdam, NVALT
- Dr. A. ten Brinke, longarts, Medisch Centrum Leeuwarden, Leeuwarden, NVALT
- Dr. H.P.A.A. van Veen, longarts, Medisch Spectrum Twente, Enschede, NVALT
- Drs. L.H. Conemans, longarts, Maastricht UMC+, Maastricht, NVALT
- Dr. A. Aardenburg-van Huisstede, longarts, Noordwest Ziekenhuisgroep, Alkmaar, NVALT
- W. van Litsenburg, verpleegkundig specialist, Catharina Ziekenhuis, Eindhoven, V&VN
- Dr. H.J. Hulzebos, medisch fysioloog en fysiotherapeut, UMC Utrecht, Utrecht, KNGF
- M.A.P. Poulissen-Erinkveld, projectleider, Longfonds/ astmaVereniging Nederland en Davos
- L.A.M. Frankemölle, ervaringsdeskundige, Longfonds
- E.M. van der Roest, hoofdanalist polilaboratorium Wilhelmina Kinderziekenhuis, Ervaringsdeskundige, astmaVereniging Nederland en Davos
Met ondersteuning van
- Dr. ir. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. A.J.G. Wirix, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- I. van Dusseldorp, literatuurspecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met evt. belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroep-lid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. F.W.J.M. Smeenk |
- Longarts, Catharina Ziekenhuis Eindhoven - Decaan Catharina-ziekenhuis Eindhoven - Bijzonder hoogleraar MUMC, School SHE, ‘kwaliteitsbevordering medisch specialistische vervolgopleidingen’ |
Voorzitter examencommissie Postinitiële master Kwaliteit en Veiligheid patiëntenzorg (Radboud UMC) (vacatiegelden) Bestuurslid van Wassink0Hesp Fonds (onbezoldigd) |
Afdeling heeft gelden ontvangen i.v.m. lezingen, voordrachten van AstraZeneca, Chiesi en TEVA |
Geen actie |
|
Dr. G.J. Braunstahl |
Longarts, Franciscus Gasthuis full-time |
'- Nul-aanstelling Erasmus MC/promotiebegeleiding 4 uur/week (onbetaald) - Redactieraad Nederlands tijdschrift Allergie en Astma 2 uur/maand (onbetaald) - Secretaris Netherlands Respiratory Society (NRS) 4 uur/maand (onbetaald) - Vergoedingen voor advieswerk, richtlijncommissies, ontwikkeling studieprogramma's, presentaties e.d.: (incidenteel) betaald |
- Geen persoonlijke financiële belangen van structurele aard. - De stichting van onze onderzoeksafdeling heeft in het verleden unrestricted grants gekregen van Stichting astmabestrijding, stichting Coolsingel, stichting 't Trekpaert, stichting Bevordering Onderziek Fransciscus, GSK, Teva, Chiesi, Novartis, AstraZeneca, ALK Abello. |
Betaalde adviesfuncties zijn per 1-1-2018 neergelegd. Vergoedingen zijn overkoepelend aan de richtlijn. Geen directe acties nodig. |
|
Dr. A. ten Brinke |
Longarts, vrijgevestigd werkzaam in medisch centrum Leeuwarden |
Geen |
- Unrestricted research grants GSK, TEVA Research advisory boards GSK, Novartis, AstraZeneca, Boehringer Ingelheim, Chiesi, Sanofi. Honoraria lectures GSK, Novartis, Teva, Boehringer Ingelheim. - Actief in expertisecentrum ernstig astma in MCL |
Voor onderwerpen aangaande medicatie kan Ten Brinke, wanneer het zou komen tot stemming, niet mee mogen stemmen. Gezien haar expertise kan ze wel deelnemen aan de discussie over deze onderwerpen. |
|
H.P.A.A. van Veen |
Longarts Medisch spectrum Twente Enschede |
Adviesraden deelname: AstraZeneca, Teva, Novartis, Sanofi (alles betaald) |
Deelname aan wetenschappelijk onderzoek met AstraZeneca |
Geen trekker of meelezer bij modules aangaande medicatie. |
|
L.H. Conemans |
longarts Maastricht UMC |
Geen |
Geen |
Geen actie |
|
Dr. A. Aardenburg- van Huisstede |
Longarts, Noordwest Ziekenhuisgroep Alkmaar |
Geen |
Promototieonderzoek verricht op deelgebied van richtlijn (relatie obesitas en astma) |
Expertise wordt juist ingezet op de module Bariatrie en astma. Geen directe actie. Bij onderwerpen waar mogelijke belangen van de voorzitter spelen, zal werkgroeplid optreden als onafhankelijk voorzitter. |
|
Dr. H.J. Hulzebos |
Medisch Fysioloog en (sport)fysiotherapeut in het Universitair Medisch Centrum Utrecht |
Secretaris VHVL (Vereniging Hart, Vaat en Longfysiotherapie) (onbetaald) |
Geen |
Geen actie |
|
W. van Litsenburg |
Verpleegkundig Specialist Astma en COPD Catharina ziekenhuis Eindhoven afdeling Longgeneeskunde 36 uur
Walter van Litsenburg Zorg, ZZP er thuiszorg 24 uur |
-HAN/VDO, opleiding voor praktijkondersteuners Astma/COPD module (betaald) -Workshops en gastlessen voor IMIS (inhalatietechniek), Fontys, UVT (betaald) -Kernteamlid van PICASSO een stichting die wetenschappelijk onderzoek ondersteunt. Sterke link met Boehringer Ingelheim (betaald) |
Geen |
Geen actie |
|
M.A.P. Poulissen-Erinkveld |
Projectleider Longfonds + Vereniging Nederland-Davos |
- |
Geen |
Geen actie |
|
L.A.M. Frankemölle |
Ervarings-deskundige; Lid van de Longfonds ErvaringsDeskundigen groep |
- Task Force Group guidelines severe asthma op internationaal niveau. - Diverse werkgroepen zowel internationaal als nationaal, niet gerelateerd aan richtlijnen ernstig astma (onbetaald, reis- en verblijfskosten-vergoedingen). - Vrijwilligster voor het Longfonds en van daaruit ook voor ELF/ERS. - Lid van de werkgroep herziening NHG-standaard astma. |
Geen |
Geen actie |
|
E. van Golen-van der Roest |
Ervaring-sdeskundige; Pre-analyse medewerker UMC Utrecht 25 u/pw |
'- Redactielid, vrijwilliger VND (onbetaald) |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardigden van de patiëntenverenigingen Longfonds en Vereniging Nederland Davos in de werkgroep en door deelname van de patiëntenvereniging aan de invitational conference. Een verslag hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenverenigingen.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt, wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVALT Richtlijn Diagnostiek en behandeling van ernstig astma, 2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door middel van een invitational conference. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence, (3) en de te verwachten impact op de kwaliteit van zorg en patiëntveiligheid.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden (zie pagina 6 voor de uitkomstmaten en de bijbehorende klinisch relevante verbetering).
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De gespecificeerde zoekstrategieën zijn op te vragen bij het Kennisinstituut.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (eindconclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een eindconclusie. In dat geval werden de conclusies uit de systematische literatuuranalyse samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn heeft de werkgroep overwogen om interne kwaliteitsindicatoren te ontwikkelen om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van de Federatie Medisch Specialisten. In samenwerkingen met de commissie kwaliteitsvisitatie NVALT wordt er een indicatorenset ontwikkeld die gebruikt kan worden tijdens de kwaliteitsvisitaties en die de astma- en ernstig astma zorg omvat. Er zijn derhalve geen specifieke indicatoren ontwikkeld behorende bij de voorliggende richtlijn.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialist
