Minimaal invasieve chirurgie
Uitgangsvraag
Welke benadering bij minimaal invasieve chirurgie heeft de voorkeur voor het verwijderen van een bijniertumor?
Aanbeveling
Overweeg retroperitoneoscopische benadering bij de volgende patiënten:
- Met een tumor ≤7 cm en BMI <35
- Na eerdere peritonitis en transperitoneale chirurgie
- Met indicatie om beiderzijds de bijnier te verwijderen
Overweeg de laparoscopische transperitoneale benadering bij de volgende patiënten:
- Bij patiënten met grotere en/of primair maligne tumoren (ACC) in verband met chirurgische werkruimte. Weeg hierbij altijd af of een minimaal invasieve benadering de voorkeur heeft en oncologisch veilig is
- Bij patiënten met een hoge BMI (≥35) of na eerdere retroperitoneale chirurgie
Spoedconversie van retroperitoneoscopische benadering (in buikligging) naar laparoscopische of open benadering is complex, vanwege de tijd die het kost om de positie van de patiënt aan te passen naar zij- of rugligging.
Voorkeur van de patiënt, de voor- en nadelen per operatietechniek en de ervaring van de chirurg met verschillende technieken zijn uiteindelijk doorslaggevend in het preoperatieve gesprek met de patiënt en de keuze voor operatietechniek.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de drie cruciale uitkomstmaten (tijd tot herstel, complicaties en opnameduur) werden resultaten gerapporteerd.
Drie studies rapporteerden tijd tot herstel (Fernández-Cruz, 1996; Mohammadi-Fallah, 2013; Rubinstein, 2005). Twee studies (Mohammadi-Fallah, 2013; Rubinstein, 2005) rapporteerden een klinisch relevant verschil van meer dan één week in het voordeel van de retroperitoneale benadering echter doorkruist het 95% betrouwbaarheidsinterval de grens van klinische besluitvorming waardoor het ware effect mogelijk ook niet klinisch relevant kan zijn. Eén studie rapporteerde geen klinisch relevant verschil tussen beide benaderingen (Fernández-Cruz, 1996). De studies gebruikten verschillende definities voor de uitkomsten en er waren verschillen tussen de studie populaties. Eén studie had alleen patiënten met het syndroom van Cushing geïncludeerd en twee studies hebben patiënten met zowel benigne als maligne bijniertumoren geïncludeerd.
Twee studies (Barczynski, 2014; Kozlowski, 2019) rapporteerden graad III-V complicaties (volgens de Clavien-Dindo classificatie) waarbij twee studies korte termijn complicaties rapporteerden waarbij geen klinisch relevante verschillen zijn gevonden tussen de retroperitoneale benadering en transperitoneale benadering.
Vijf studies rapporteerden opnameduur (Barczynski, 2014; Chai, 2017; Fernández-Cruz, 1996; Mohammadi-Fallah, 2013; Rubinstein, 2005; Kozlowski, 2019). Er was geen klinisch relevant verschil tussen de verschillende behandelingen. Een zeer recent internationaal, retrospectief observationeel onderzoek laat wel een kortere opnameduur zien voor patiënten die een retroperitoneale benadering ondergingen (Van den Heede, 2023).
De bewijskracht van twee (tijd tot herstel en complicaties) van de drie cruciale uitkomstmaten is zeer laag. Er was sprake van risico op bias door het onduidelijk beschrijven van de selectie van participanten, gebrek aan blindering en onduidelijkheid over de rapportage van uitkomsten. Er was sprake van inconsistentie tussen de studies vanwege verschillende studie populaties. Naast de gemiddelde leeftijd die verschilde tussen de studies, hebben de onderzoekers, patiënten geïncludeerd met verschillende bijniertumoren of bijnier adenomen of alleen patiënten met het syndroom van Cushing. Daarnaast zijn er kleine patiëntaantallen gebruikt waarop de resultaten gebaseerd zijn.
Het is lastig om een conclusie te trekken. De gerapporteerde resultaten in twee studies (Mohammadi-Fallah, 2013; Rubinstein, 2005) voor de uitkomstmaat tijd tot herstel lijken een mogelijk klinisch relevant voordeel te geven voor de retroperitoneale benadering maar de bewijskracht is zeer onzeker. Eén studie rapporteerde postoperatieve pijn (Kozlowski, 2019) waarbij er een verschil gevonden was in het voordeel van de retroperitoneale benadering maar dit verschil niet klinisch relevant was. Met betrekking tot de belangrijke uitkomstmaat conversie naar open chirurgie is er een klinisch relevant verschil in het voordeel van de transperitoneale benadering.
Ook de bewijskracht voor deze uitkomstmaten is zeer laag door het risico op bias, heterogeniteit tussen de studies en het kleine patiëntaantal waarop de resultaten gebaseerd zijn.
Er is een aantal overwegingen dat mee kan spelen bij het maken van een keuze tussen de retroperitoneale benadering en transperitoneale behandeling. De retroperitoneale benadering is te overwegen bij patiënten met een tumor ≤7 cm en Body Mass Index (BMI) <35 met oog op het (geringe) voordeel in herstelduur van de patiënt. Tumor grootte van ≤7 cm is ook als inclusiecriterium gehanteerd door Barczynski (2014). In de studie van Barczynski (2014) hadden slecht 15 van de 65 patiënten een BMI >30. De nadelen van buikligging (zoals beademingsvoorwaarden, veneuze return en beperkte chirurgische werkruimte) gaan zwaarder wegen bij hoge BMI en langdurige operatieduur (complexe/grote tumoren). De consensus onder de werkgroepleden is dat dit bij BMI ≥35 een rol speelt.
Overweeg retroperitoneale benadering na eerdere peritonitis of transperitoneale chirurgie vanwege potentiële inwendige verlittekening die via deze route wordt vermeden.
Als beide bijnieren verwijderd moeten worden heeft de posterieure retroperitoneale benadering voordeel voor operatieduur (van Uitert, 2017). Bij verhoogde kans op littekenbreuk, zoals door wondgenezingsstoornis bij diabetes mellitus, is een overweging om retroperitoneaal te opereren waarbij dit nagenoeg niet voorkomt.
Overweeg de transperitoneale benadering bij grotere tumoren en bij primair maligne tumoren zoals een adrenocorticaal carcinoom (ACC) in verband met werkruimte en kans op tumor spill. Houdt daarbij voor ogen dat open chirurgie nog steeds de gouden standaard is bij (grote) ACCs. Ook na eerdere retroperitoneale chirurgie kan de transperitoneale benadering uitkomst bieden in verband met verlittekening van het operatiegebied.
De voorkeur en ervaring van de operateur speelt een rol bij keuze voor chirurgische benadering, waarbij factoren als toenemende centralisatie, volume, leercurve en expertise met (verschillende) technieken doorslaggevend zijn (van Uitert, 2017).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Bespreek de voorkeur van de patiënt met inachtneming van factoren als (mogelijk voordeel in) herstelduur en terugkeer naar werk, kans op littekenbreuk en postoperatieve pijn die volgens de werkgroep minder is na retroperitoneale benadering.
Kosten (middelenbeslag)
Er wordt verwacht dat de retroperitoneale benadering efficiënter is, door een kortere operatieduur en mogelijk kortere hersteltijd, met minder kosten. Hiervoor dient de operateur de leercurve te hebben doorlopen met optimale voorbereiding van het operatieteam op de specifieke aspecten van de techniek. Het gebruik van materialen en apparatuur is vergelijkbaar tussen beide technieken. Echter, dit is niet gebaseerd op wetenschappelijke (kosteneffectiviteit) studies.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep is van mening dat bijnierchirurgie in centra moet plaatsvinden waar voldoende exposure van patiënten bestaat en ervaring met verschillende operatietechnieken beschikbaar is. Training van deze operatietechnieken is van belang voor optimale veiligheid van de patiënt en een korte leercurve van bijnierchirurgen. Het opzetten van een programma waarin gebruik wordt gemaakt van het proctoring principe door een (inter)nationale expert kan de training optimaliseren. Hiervoor zijn voldoende ervaren bijnierchirurgen en operatieteams in Nederland, maar ook in sommige omringende landen beschikbaar.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Er lijkt, op basis van de cruciale uitkomstmaten (tijd tot herstel, complicaties en opnameduur) mogelijk een licht voordeel te zijn voor de retroperitoneale benadering. Met betrekking tot de belangrijke uitkomstmaat conversie naar open chirurgie is er een klinisch relevant verschil in het voordeel van de transperitoneale benadering die kan zijn gerelateerd aan de werkruimte bij deze benadering.
De bewijskracht van twee van de drie cruciale uitkomstmaten is zeer laag door risico op bias en inconsistentie vanwege verschillende patiënten populaties. Ook de bewijskracht voor conversie is zeer laag door het risico op bias, heterogeniteit tussen de studies en het kleine patiëntaantal waarop de resultaten gebaseerd zijn.
Onderbouwing
Achtergrond
In diverse internationale richtlijnen wordt minimaal invasieve chirurgie van bijniertumoren aanbevolen, maar niet nader gespecificeerd (Fassnacht, 2016; Zeiger, 2009; Lenders, 2014; Berruti 2012; Funder 2016). Daarbij wordt onvoldoende onderscheid gemaakt tussen enerzijds benigne en/of hormonaal actieve bijniertumoren en anderzijds het bijnierschorscarcinoom. Sinds 1992 is laparoscopische adrenalectomie geleidelijk de standaard geworden voor benigne en/of functionele bijniertumoren. Daarna is de retroperitoneoscopische adrenalectomie ontwikkeld. Deze operatietechniek gaat potentieel gepaard met minder postoperatieve pijn en een kortere opname- en herstelduur. Daarentegen is bij een retroperitoneoscopische adrenalectomie de chirurgische werkruimte beperkt en zijn anatomische herkenningspunten lastig te identificeren. Vanwege deze nadelen wordt een retroperitoneoscopische adrenalectomie minder uitgevoerd bij patiënten met een bijnierschorscarcinoom. Momenteel kiest de chirurg de minimaal invasieve operatietechniek vaak op basis van persoonlijke voorkeur en niet op basis van patiënt-specifieke afwegingen tussen de voor- en nadelen. Ook in de internationale richtlijnen wordt geen aandacht besteed aan de respectievelijke voor- en nadelen van een laparoscopische en retroperitoneoscopische adrenalectomie, ondanks het feit dat er gerandomiseerd onderzoek naar is gedaan. In deze module zal er gekeken worden naar welke operatietechniek de beste (patiënt gerelateerde) uitkomsten heeft.
Conclusies / Summary of Findings
Time to recovery
|
Very low GRADE |
The evidence is very uncertain about the effect of retroperitoneoscopic adrenalectomy on time to recovery when compared with laparoscopic transperitoneal adrenalectomy in patients with an adrenal tumor.
Source: Arezzo, 2018 |
Complications
|
Very low GRADE |
The evidence is very uncertain about the effect of retroperitoneoscopic adrenalectomy on complications when compared with laparoscopic transperitoneal adrenalectomy in patients with an adrenal tumor.
Source: Arezzo, 2018; Kozlowski, 2019 |
Length of stay
|
Low GRADE |
The evidence suggests that retroperitoneoscopic adrenalectomy results in little to no difference in length of stay when compared with transperitoneal adrenalectomy in patients with an adrenal tumor.
Source: Arezzo, 2018; Kozlowski, 2019 |
Conversion to open surgery
|
Very low GRADE |
The evidence is very uncertain about the effect of retroperitoneoscopic adrenalectomy on conversion to open surgery when compared with laparoscopic transperitoneal adrenalectomy in patients with an adrenal tumor.
Source: Arezzo, 2018 |
Postoperative pain
|
Very low GRADE |
The evidence is very uncertain about the effect of retroperitoneoscopic adrenalectomy on postoperative pain when compared with laparoscopic transperitoneal adrenalectomy in patients with an adrenal tumor.
Source: Kozlowski, 2019 |
Samenvatting literatuur
Description of studies
The systematic review of Arezzo (2018) included five RCT’s (Barczynski, 2014; Chai, 2017; Fernández-Cruz, 1996; Mohammadi-Fallah, 2013; Rubinstein, 2005). All RCT’s compared the retroperitoneoscopic adrenalectomy (RPA) with the laparoscopic (transperitoneal) adrenalectomy (LTPA). The review only included RCT’s with patients who were older than sixteen years and who underwent RPA or LTPA. In total, 244 patients participated in the five trials. The LRPA group consisted of 127 patients and the LTPA group consisted of 117 patients. In four RCT’s only unilateral adrenalectomies were performed (Barczynski, 2014; Chai, 2017; Mohammadi-Fallah, 2013; Rubinstein, 2005). In one RCT both unilateral and bilateral adrenalectomies were performed (Fernández-Cruz, 1996). In total six patients (3%) underwent a bilateral adrenalectomy.
Barczynski (2014) included patients with an adrenal benign tumor up to 7 centimeters in diameter. The study population of Barczynski (2014) consisted of patients with aldosteronoma (21%), glucocorticoid adrenal adenoma (11%), pheochromocytoma (23%) and nonfunctioning tumor (45%). Chai (2017) also included patients with a unilateral benign tumor up to 7 centimeters in diameter. The study population of Chai (2017) consisted of patients with aldosteronoma (43%), Cushing syndrome (21%), pheochromocytoma (18%) and nonfunctioning tumor (18%). The study population of Fernández-Cruz (1996) consisted of patients with Cushing’s syndrome, including Cushing’s disease and Cushing’s adenoma. The study population of Mohammadi-Fallah (2013) consisted of patients with aldosteronoma (12%), pheochromocytoma (17%), Cushing syndrome (29%) and nonfunctional tumor (42%). Mohammadi-Fallah (2013) excluded patients with a clinical suspicion of malignancy, tumors of more than six centimeters and bilateral adrenalectomy. The study population of Rubinstein (2005) consisted of patients with aldosteronoma (35%), adrenal mass (not otherwise specified) (35%), pheochromocytoma (16%), Cushing syndrome (9%), metastasis (3%) and adrenal carcinoma (2%). Rubinstein (2005) excluded patients with a bilateral adrenalectomy.
The mean age of the participants ranged from 42.2 years to 57.7 years in the RPA group and from 39.9 years to 57.0 years in the LTPA group (Arrezo, 2018).
The review of Arezzo reported the outcome times to return to normal activities, length of hospital stay and conversion to open surgery.
Data for the outcome complications were extracted from individual studies.
Kozlowski (2019) performed a single center, randomized clinical trial in Poland, comparing unilateral retroperitoneal adrenalectomy (RPA) using the posterior approach with unilateral laparoscopic transperitoneal adrenalectomy (LTPA) using the lateral approach. The adrenalectomies were performed by one surgeon with ten years of experience in laparoscopic adrenalectomies with both approaches. Patients with adrenal tumors requiring unilateral adrenalectomy and an adrenal tumor up to eight centimeters, were included. Patients with an adrenal tumor of more than eight centimeters, imaging features suggesting primary invasive malignant tumors and patients who refused to undergo randomization, were excluded. In total 77 patients were included. Patients were randomly assigned to a treatment group with no respect to remain equal group sizes. The RPA group consisted of 44 patients and the LTPA group of 33 patients. Mean age in the RPA group was 59.3 years and in the LTPA group 61.2 years. Mean Body Mass Index (BMI) in the RPA group was 29.1 kilogram per square meter (kg/m2) and in the LTPA group 30.1 kg/m2. In the LTPA group 4 patients (12%) and in the RPA group 9 patients (20%) had a pheochromocytoma. Cushing syndrome was diagnosed in 5 patients (15%) in the LTPA group and in 3 patients (7%) in the RPA group. Conn’s disease was diagnosed in 2 patients (6%) in the LTPA group and in 4 patients (9%) in the RPA group. Nonfunctioning tumors were diagnosed in 22 patients (67%) in the LTPA group and in 28 patients (64%) in the RPA group. Median tumor size in the RPA group was 4.1 centimeters and in the LTPA group 4.0 centimeters. There were no significant differences between treatment groups at baseline.
Kozlowski (2019) reported the outcomes postoperative hospital stay, 30-day complications and postoperative pain.
Results
Time to recovery (Critical)
Three studies in the review of Arezzo (2018) reported time to return to normal activities. (Fernández-Cruz, 1996; Mohammadi-Fallah, 2013; Rubinstein, 2005). Time to return to normal activities was reported in days. Because only two studies reported estimated mean differences (Fernández-Cruz, 1996; Mohammadi-Fallah, 2013), the pooled results are not displayed (figure 1).
Fernández-Cruz (1996) reported mean number of days to return to normal activities of 16.1 in the RPA group and 18.8 days in the LTPA group. This is not clinically relevant.
Mohammadi-Fallah (2013) reported mean number of days to return to normal activities of 15.8 days in the RPA group and 31.2 days in the LTPA group. This difference is clinically relevant.
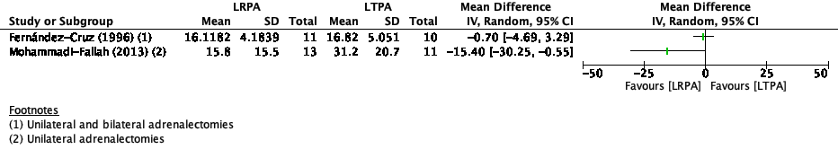
Figure 1. Time to recovery with LRPA versus LTPA
CI: Confidence Interval
Rubinstein (2005) reported average convalescence of 2.3 weeks in the RPA group and 4.7 weeks in the LTPA group. This difference is clinically relevant.
Complications (Critical)
One study from the review of Arezzo (2018) (Barczynski, 2014) and the one additional study (Kozlowski, 2019) reported grade III-V complications according to the Clavien-Dindo classification.
Barczynski (2014) reported short-term postoperative complications. Barczynski (2014) reported zero grade III-V complications in the RPA group and one grade III-V complication (3.1%) in the LTPA group.
Kozlowski (2019) reported 30-day complications. Kozlowski (2019) reported zero grade III-V complications in the RPA group and zero grade III-V complications in the LTPA group.
Length of stay (Critical)
Length of stay was reported in five studies in the review of Arezzo (2018) (Barczynski, 2014; Chai, 2017; Fernández-Cruz, 1996; Mohammadi-Fallah, 2013; Rubinstein, 2005) and the one additional study (Kozlowski, 2019). The pooled mean difference (MD) was -0.40 (95%CI -1.05 to 0.25) favoring retroperitoneal adrenalectomy (figure 2). This difference is not clinically relevant.
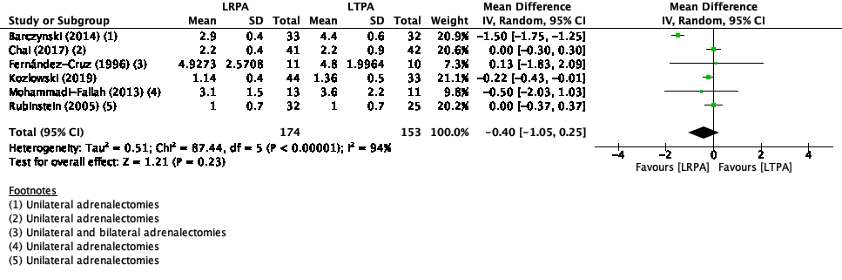
Figure 2. Length of stay with RPA versus LTPA
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
Conversion to open surgery (Important)
Conversion to open surgery was reported in four studies in the review of Arezzo (2018) (Barczynski, 2014; Chai, 2017; Mohammadi-Fallah, 2013; Rubinstein, 2005) (figure 3). In the study of Barczynski (2014), no events of conversion to open surgery occurred, therefore Risk Ratio (RR) was not estimable.
The pooled RR was 1.72 (95%CI 0.31 to 9.62) favoring transperitoneal adrenalectomy. This difference is clinically relevant.
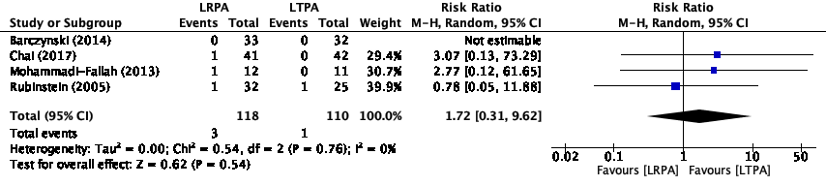
Figure 3. Proportion of conversion to open surgery events with RPA versus LTPA
Z: p-value of pooled effect; df: degrees of freedom, I2: statistical heterogeneity, CI: confidence interval
Postoperative pain (important)
One study reported postoperative pain at day 1 (Kozlowski, 2019) using the Visual Analog Scale (VAS) ranging from 0 for no pain to 10 for maximal pain.
Kozlowski (2019) reported mean VAS score of 3.4 (SD 1) in the LRPA group and 4.2 (SD 1) in the LTPA group. This difference is not clinically relevant.
Level of evidence of the literature
Time to recovery
The level of evidence regarding the outcome measure time to recovery was downgraded by three levels because of study limitations (-1; risk of bias because of unclear risk for selection and performance bias), conflicting results (-1; inconsistency because of methodological heterogeneity) and number of included patients (-1; imprecision because of low sample size). The level of evidence was therefore graded as very low.
Complications
The level of evidence regarding the outcome measure complications was downgraded by three levels because of study limitations (-1; risk of bias because of selection, performance and detection bias) and number of included patients (-2; imprecision because of low sample size, small number of events and the confidence intervals including the possibility of a positive effect, no effect or a negative effect). The level of evidence was therefore graded as very low.
Length of stay
The level of evidence regarding the outcome measure length of stay was downgraded by two levels because of study limitations (-1; risk of bias because of selection, performance and detection bias) and number of included patients (-1; imprecision because of low sample size and the confidence intervals including the possibility of a positive effect or no effect). The level of evidence was therefore graded as low.
Conversion to open surgery
The level of evidence regarding the outcome measure conversion to open surgery was downgraded by three levels because of study limitations (-1; risk of bias because of unclear risk of selection bias), conflicting results (-1; inconsistency because of methodological heterogeneity) and number of included patients (-1; imprecision because of low sample size, small number of events and the confidence intervals including the possibility of a positive effect, no effect or a negative effect). The level of evidence was therefore graded as very low.
Postoperative pain
The level of evidence regarding the outcome measure postoperative pain was downgraded by three levels because of study limitations (-1; risk of bias because of selection bias, selective reporting and lack of blinding) and number of included patients (-2; imprecision because of single study and low sample size). The level of evidence was therefore graded as very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What is the effect of the retroperitoneoscopic adrenalectomy when compared with laparoscopic (transperitoneal) adrenalectomy on time to recovery, complications, length of hospital stay, conversion to open surgery and postoperative pain in patients with an adrenal tumor?
|
P (Patients) |
Patients with an adrenal tumor |
|
I (Intervention) |
Retroperitoneoscopic adrenalectomy |
|
C (Control) |
Laparoscopic (transperitoneal) adrenalectomy |
|
O (Outcomes) |
Time to recovery, complications, length of stay, conversion to open surgery and postoperative pain |
Relevant outcome measures
The guideline development group considered time to recovery, complications and length of stay as a critical outcome measure for decision making, conversion to open surgery and postoperative pain as an important outcome measure for decision making.
The working group defined the outcome measures as follows:
- Time to recovery: Time to recover and return to work and/or exercise
- Complications: Serious complications Grade III to V according to the Clavien-dindo classification of surgical complications (Dindo, 2014)
- Length of stay: Length of hospital stay in number of days
The working group defined the following differences as a minimal clinically (patient) important difference:
- Time to recovery: > 1 week
- Complications: Absolute difference ≥1% for lethal complications, or ≥5% for serious complications
- Difference in length of hospital stay: > 1 day
- Conversion to open surgery: Absolute difference >5% or absolute difference >3% and Hazard Ratio (HR) <0.7
- Postoperative pain: Change of 10 on 100mm Visual Analogue Scale (VAS) (Myles, 2017)
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 07-04-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 219 hits. Studies were selected based on the following criteria:
- The study population had to meet the criteria as defined in the PICO;
- The intervention and comparison had to be as defined in the PICO;
- Outcomes had to be as defined in the PICO;
- Research type: Systematic review or randomized-controlled trial (RCT);
- Articles written in English or Dutch
27 studies were initially selected based on title and abstract screening. After reading the full text, 25 studies were excluded (see the table with reasons for exclusion under the tab Methods), one systematic review and one RCT, were included.
Results
Five RCTs from the systematic review and one RCT published after the search date of the systematic review, were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Arezzo A, Bullano A, Cochetti G, Cirocchi R, Randolph J, Mearini E, Evangelista A, Ciccone G, Bonjer HJ, Morino M. Transperitoneal versus retroperitoneal laparoscopic adrenalectomy for adrenal tumours in adults. Cochrane Database Syst Rev. 2018 Dec 30;12(12):CD011668. doi: 10.1002/14651858.CD011668.pub2. PMID: 30595004; PMCID: PMC6517116.
- Barczyński M, Konturek A, Nowak W. Randomized clinical trial of posterior retroperitoneoscopic adrenalectomy versus lateral transperitoneal laparoscopic adrenalectomy with a 5-year follow-up. Ann Surg. 2014 Nov;260(5):740-7; discussion 747-8. doi: 10.1097/SLA.0000000000000982. PMID: 25243546.
- Berruti A, Baudin E, Gelderblom H, Haak HR, Porpiglia F, Fassnacht M, Pentheroudakis G; ESMO Guidelines Working Group. Adrenal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012 Oct;23 Suppl 7:vii131-8. doi: 10.1093/annonc/mds231. PMID: 22997446.
- Chai YJ, Yu HW, Song RY, Kim SJ, Choi JY, Lee KE. Lateral Transperitoneal Adrenalectomy Versus Posterior Retroperitoneoscopic Adrenalectomy for Benign Adrenal Gland Disease: Randomized Controlled Trial at a Single Tertiary Medical Center. Ann Surg. 2019 May;269(5):842-848. doi: 10.1097/SLA.0000000000002603. PMID: 29189215.
- Fassnacht M, Arlt W, Bancos I, Dralle H, Newell-Price J, Sahdev A, Tabarin A, Terzolo M, Tsagarakis S, Dekkers OM. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2016 Aug;175(2):G1-G34. doi: 10.1530/EJE-16-0467. PMID: 27390021.
- Fernández-Cruz L, Saenz A, Benarroch G, Astudillo E, Taura P, Sabater L. Laparoscopic unilateral and bilateral adrenalectomy for Cushing's syndrome. Transperitoneal and retroperitoneal approaches. Ann Surg. 1996 Dec;224(6):727-34; discussion 734-6. doi: 10.1097/00000658-199612000-00008. PMID: 8968227; PMCID: PMC1235468.
- Funder JW, Carey RM, Mantero F, Murad MH, Reincke M, Shibata H, Stowasser M, Young WF Jr. The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016 May;101(5):1889-916. doi: 10.1210/jc.2015-4061. Epub 2016 Mar 2. PMID: 26934393.
- Kozłowski T, Choromanska B, Wojskowicz P, Astapczyk K, Łukaszewicz J, Rutkowski D, Dadan J, Rydzewska-Rosołowska A, Myśliwiec P. Laparoscopic adrenalectomy: lateral transperitoneal versus posterior retroperitoneal approach - prospective randomized trial. Wideochir Inne Tech Maloinwazyjne. 2019 Apr;14(2):160-169. doi: 10.5114/wiitm.2019.84694. Epub 2019 May 5. PMID: 31118978; PMCID: PMC6528120.
- Lenders JW, Duh QY, Eisenhofer G, Gimenez-Roqueplo AP, Grebe SK, Murad MH, Naruse M, Pacak K, Young WF Jr; Endocrine Society. Pheochromocytoma and paraganglioma: an endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2014 Jun;99(6):1915-42. doi: 10.1210/jc.2014-1498. PMID: 24893135.
- Mohammadi-Fallah MR, Mehdizadeh A, Badalzadeh A, Izadseresht B, Dadkhah N, Barbod A, Babaie M, Hamedanchi S. Comparison of transperitoneal versus retroperitoneal laparoscopic adrenalectomy in a prospective randomized study. J Laparoendosc Adv Surg Tech A. 2013 Apr;23(4):362-6. doi: 10.1089/lap.2012.0301. PMID: 23573882.
- Myles PS, Myles DB, Galagher W, Boyd D, Chew C, MacDonald N, Dennis A. Measuring acute postoperative pain using the visual analog scale: the minimal clinically important difference and patient acceptable symptom state. Br J Anaesth. 2017 Mar 1;118(3):424-429. doi: 10.1093/bja/aew466. PMID: 28186223.
- Rubinstein M, Gill IS, Aron M, Kilciler M, Meraney AM, Finelli A, Moinzadeh A, Ukimura O, Desai MM, Kaouk J, Bravo E. Prospective, randomized comparison of transperitoneal versus retroperitoneal laparoscopic adrenalectomy. J Urol. 2005 Aug;174(2):442-5; discussion 445. doi: 10.1097/01.ju.0000165336.44836.2d. PMID: 16006861.
- Van Den Heede K, Vatansever S, Girgin T, Van Slycke S, Makay Ö; EUROCRINE® Council. Posterior retroperitoneal versus transperitoneal laparoscopic adrenalectomy in adults: results from the EUROCRINE® surgical registry. Langenbecks Arch Surg. 2023 Jun 22;408(1):241. doi: 10.1007/s00423-023-02975-5. PMID: 37349535.
- van Uitert A, d'Ancona FCH, Deinum J, Timmers HJLM, Langenhuijsen JF. Evaluating the learning curve for retroperitoneoscopic adrenalectomy in a high-volume center for laparoscopic adrenal surgery. Surg Endosc. 2017 Jul;31(7):2771-2775. doi: 10.1007/s00464-016-5284-0. Epub 2016 Oct 17. PMID: 27752814; PMCID: PMC5487835.
- Zeiger MA, Thompson GB, Duh QY, Hamrahian AH, Angelos P, Elaraj D, Fishman E, Kharlip J; American Association of Clinical Endocrinologists; American Association of Endocrine Surgeons. The American Association of Clinical Endocrinologists and American Association of Endocrine Surgeons medical guidelines for the management of adrenal incidentalomas. Endocr Pract. 2009 Jul-Aug;15 Suppl 1:1-20. doi: 10.4158/EP.15.S1.1. PMID: 19632967.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What is the effect of the retroperitoneoscopic adrenalectomy when compared to laparoscopic adrenalectomy on time to recovery, complications, duration of hospital stay and conversion in patients with an adrenal tumor?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Arezzo, 2018
Study characteristics and results are extracted from the SR unless stated otherwise |
SR and meta-analysis of RCTs
Literature search up to April 2018
A: Barczynski, 2014 B: Chai, 2017 C: Fernández-Cruz, 1996 D: Mohammadi-Fallah, 2013 E: Rubinstein, 2005
Study design: A: Parallel RCT B: Parallel RCT C: Parallel RCT D: Parallel RCT E: Parallel RCT
Setting and Country: A: Poland B: South Korea C: Spain D: Iran E: USA
Source of funding and conflicts of interest: A: Not declared B: Not reported C: Not declared D: Urmia University of Medical Sciences E: Not declared
|
Inclusion criteria SR: - Randomized Controlled Trials - Data from adults (> 16 years) - Patients who underwent laparoscopic transperitoneal or laparoscopic retroperitoneal adrenalectomy for preoperatively assessed adrenal tumors
Exclusion criteria SR: No exclusion for systematic review were reported.
Main exclusion criteria reported in studies: - History of major abdominal surgery - planned bilateral adrenal surgery - Adrenal tumor larger than six centimeters of seven centimeters in diameter - Age less than 16 years or 18 years
5 studies were included
Important patient characteristics at baseline:
N, mean age in years (SD) A: I: 76, 47.9 C: 72, 46.6 B: I: 63, 46.4 (11.0) C: 67, 48.0 (11.4) C: I: 73, 49.9 (17.8) C: 71. 39.9 (18.4) D: I: 62, 42.2 (median) C: 55, 42.9 (median) E: I: 59, 57.5 (median) C: 48, 57 (median)
Body Mass Index, mean kg/m 2 (SD): A: I: 27.6 C: 27.3 B: I: 23.6 (3.0) C: 24.2 (3.3) C: NR D: I: 27.5 (median) C: 26.7 (median) E: I: 30.4 (median) C: 29.1 (median)
Tumor size, mean in millimeters (SD): A: I: 39 (95%CI 10-70) C: 40 (95%CI 10-65) B: I: 30 (13) C: 29 (14) C: NR D: I: 26 (median) (IQR 20-50) C: 29 (median) (IQR 20-50) E: I: 26 (median) (IQR 17-49) C: 27 (median (IQR 16-42)
Groups are not comparable at baseline |
Describe intervention:
A: Retroperitoneal adrenalectomy B: Retroperitoneal adrenalectomy C: Retroperitoneal adrenalectomy D: Retroperitoneal adrenalectomy E: Retroperitoneal adrenalectomy
|
Describe control:
A: Transperitoneal adrenalectomy B: Transperitoneal adrenalectomy C: Transperitoneal adrenalectomy D: Transperitoneal adrenalectomy E: Transperitoneal adrenalectomy
|
End-point of follow-up:
A: 60 months after surgery B: 31.3 months C: Mean follow-up 9.2 months D: Mean follow-up 9 months E: Mean follow-up 5.9 years
For how many participants were no complete outcome data available? A: N=5 (8%) B: N=0 (0%) C: N=0 (0%) D: N=0 (0%) E: N=0 (0%)
|
Outcome measure-1: Time to recovery Defined as: Time to return to normal activities (in days)
Effect measure: Mean difference [95% CI]: A: Not reported B: Not reported C: -0.70 (-4.69-3.29) D: -15.4 (-30.25- -0.55) E: Not estimable
Pooled effect (random effects model): -1.33 [95% CI -5.43 to 2.76] favoring retroperitoneal adrenalectomy Heterogeneity (I2): 71%
Outcome measure-2: Complicationsa Defined as: Postoperative complications (grade I-V) Effect measure: Risk Ratio [95% CI]: A: 0.58 (0.24-1.41) E: 2.56 (0.25-26.65)
Pooled effect (random effects model): 0.81 [95% CI 0.24 to 2.75] favoring retroperitoneal adrenalectomy Heterogeneity (I2): 26%
Outcome measure-3: Length of hospital stay (in days) Effect measure: Mean difference [95% CI]: A: -1.5 (-1.75- -1.25) B: 0 (-0.3-0.3) C: 0.13 (-3.11.83-2.09) D: -0.50 (-2.03-1.03) E: 0 (-0.37-0.37)
Pooled effect (random effects model): -0.43 [95% CI -1.32 to 0.46] favoring retroperitoneal adrenalectomy Heterogeneity (I2): 95%
Outcome measure-4: Conversion to open surgery Effect measure: Risk ratio [95% CI]: A: Not estimable B: 3.07 (0.13-73.29) C: Not reported D; 2.77 (0.12-61.65) E: 0.78 (0.05-11.88)
Pooled effect (random effects model): 1.72 [95% CI 0.31 to 9.62] favoring transperitoneal adrenalectomy Heterogeneity (I2): 0%
|
Facultative:
Author’s conclusion: The body of evidence on laparoscopic retroperitoneal adrenalectomy compared with laparoscopic transperitoneal adrenalectomy is limited. Very low-quality evidence indicates that for relatively small lesions (less than 6 cm to 7 cm), late morbidity might be reduced following the retroperitoneal approach. While no conclusive differences were observed between intervention and comparator groups in the analysis of operative parameters, the analysis of some post-operative parameters, such as the time to oral fluid of food intake and the time to ambulation, may show an advantage for the laparoscopic retroperitoneal adrenalectomy technique.
Level of evidence: Outcome time to return to normal activities: GRADE very low because of unclear risk of performance and detection bias and because of (serious) imprecision.
Outcome length of hospital stay: GRADE very low because of unclear risk of performance and detection bias and because of (serious) imprecision.
Sensitivity analyses: There were too few trials to carry out these analyses.
Clinical heterogeneity: All studies only performed unilateral adrenalectomies apart from Fernández-Cruz (1996) who performed unilateral and bilateral adrenalectomies. Rubinstein (2005) performed lateral retroperitoneal approach and not the posterior retroperitoneal approach. |
|
Kozlowski, 2019 |
Type of study: Randomized controlled trial
Setting and country: Single center, Poland, between February 2015 and June 2018
Funding and conflicts of interest: The authors declare no conflict of interest |
Inclusion criteria: - Patients with adrenal tumors requiring adrenalectomy - Unilateral adrenalectomy - Adrenal tumor up to 8 centimeters
Exclusion criteria: - Adrenal tumors of more than 8 centimeters - Imaging features suggesting primary invasive malignant tumors - Refusal of the patients to undergo randomization
N total at baseline: Intervention: 44 Control: 33
Important prognostic factors2: Mean age in years (SD): I: 59.3 (10.2) C: 61.2 (8.3)
Sex, male: I: N=21 (48%) C: N=13 (39%)
Mean Body Mass Index in kg/m2 (SD): I: 29.1 (5.2) C: 30.1 (6)
Median tumor size in centimeters (IQR): I: 4.1 (1.5-7.5) C: 4.0 (0.8-7.5)
No significant differences between treatment groups at baseline |
Describe intervention: Unilateral laparoscopic total adrenalectomy using the posterior retroperitoneal approach (PRA) performed by one surgeon with 10 years of experience in laparoscopic adrenalectomies with both approaches.
|
Describe control: Unilateral laparoscopic total adrenalectomy using the lateral transperitoneal approach (LTA) performed by one surgeon with 10 years of experience in laparoscopic adrenalectomies with both approaches.
|
Length of follow-up: I: 28 months (SD 12) C: 28 months (SD 13)
Loss-to-follow-up: Intervention: N=1 (2.3%) Reasons: Not reported
Control: N =0 (0%)
Incomplete outcome data: Intervention: N N=0 (0%)
Control: N=1 (3%) Reasons: Death
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mean postoperative hospital stay in days (SD): C: 1.36 (0.5) MD -0.22 (95%CI -0.43- -0.01)
30-day complications (according to Dindo): I: N=4 (9%) C: N=4 (12%) RR 0.75 (95%CI 0.20-2.78) |
Authors conclusion: The present study comparing LTA and PRA laparoscopic adrenalectomies confirmed the safety, efficacy, and very low morbidity of both techniques. The PRA proved superior to LTA in terms of lower intensity of postoperative pain and shorter hospital stay. This study only performed unilateral laparoscopic adrenalectomy.
|
|
a Results extracted from individual studies |
|||||||
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Arezzo, 2018 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
No |
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What is the effect of the retroperitoneoscopic adrenalectomy when compared to laparoscopic adrenalectomy on time to recovery, complications, duration of hospital stay and conversion in patients with an adrenal tumor?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Kozlowski, 2019 |
No information
Reason: Study stated: ‘To avoid any disturbance of free randomization, we did not use the computer option to balance the number of patients’ |
No information
Reason: No exact information on allocation concealment |
Definitely no
Reason: Patients, health care providers, outcome assessors or data analysts were not blinded |
Probably yes
Reason: Loss to follow-up was infrequent in intervention and control group. Only one patient was lost to follow-up. |
No information
Reason: No trial registry or protocol available |
No information |
HIGH (no information regarding allocation generation and concealment, no blinding and no information regarding selective outcome reporting) |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Gavriilidis P, Camenzuli C, Paspala A, Di Marco AN, Palazzo FF. Posterior Retroperitoneoscopic Versus Laparoscopic Transperitoneal Adrenalectomy: A Systematic Review by an Updated Meta-Analysis. World J Surg. 2021 Jan;45(1):168-179. doi: 10.1007/s00268-020-05759-w. Epub 2020 Aug 27. PMID: 32856097. |
Wrong study design: The systematic review also includes observational studies |
|
Meng C, Du C, Peng L, Li J, Li J, Li Y, Wu J. Comparison of Posterior Retroperitoneoscopic Adrenalectomy Versus Lateral Transperitoneal Laparoscopic Adrenalectomy for Adrenal Tumors: A Systematic Review and Meta-Analysis. Front Oncol. 2021 May 10;11:667985. doi: 10.3389/fonc.2021.667985. PMID: 34041031; PMCID: PMC8142855. |
Wrong study design: The systematic review also includes observational studies |
|
Jiang YL, Qian LJ, Li Z, Wang KE, Zhou XL, Zhou J, Ye CH. Comparison of the retroperitoneal versus Transperitoneal laparoscopic Adrenalectomy perioperative outcomes and safety for Pheochromocytoma: a meta-analysis. BMC Surg. 2020 Jan 13;20(1):12. doi: 10.1186/s12893-020-0676-4. PMID: 31931809; PMCID: PMC6958587. |
Wrong population: Review only included patients with pheochromocytoma |
|
Kwak J, Lee KE. Minimally Invasive Adrenal Surgery. Endocrinol Metab (Seoul). 2020 Dec;35(4):774-783. doi: 10.3803/EnM.2020.404. Epub 2020 Dec 23. PMID: 33397038; PMCID: PMC7803606. |
Wrong design: Narrative review |
|
Li J, Wang Y, Chang X, Han Z. Laparoscopic adrenalectomy (LA) vs open adrenalectomy (OA) for pheochromocytoma (PHEO): A systematic review and meta-analysis. Eur J Surg Oncol. 2020 Jun;46(6):991-998. doi: 10.1016/j.ejso.2020.02.009. Epub 2020 Feb 17. PMID: 32102743. |
Wrong intervention versus control: Laparoscopic versus open adrenalectomy |
|
Portelli, M., Camenzuli, C., Gafa’, A. et al. Retroperitoneal vs. transperitoneal laparoscopic adrenalectomy: a meta-analysis of the literature. Eur Surg 50, 278–284 (2018) |
Systematic review only included three studies: Included review of Arezzo (2018) included five. |
|
Ball MW, Hemal AK, Allaf ME. International Consultation on Urological Diseases and European Association of Urology International Consultation on Minimally Invasive Surgery in Urology: laparoscopic and robotic adrenalectomy. BJU Int. 2017 Jan;119(1):13-21. doi: 10.1111/bju.13592. Epub 2016 Aug 19. PMID: 27431446. |
Wrong intervention versus control: Laparoscopic versus robotic adrenalectomy |
|
Gaujoux S, Mihai R; joint working group of ESES and ENSAT. European Society of Endocrine Surgeons (ESES) and European Network for the Study of Adrenal Tumours (ENSAT) recommendations for the surgical management of adrenocortical carcinoma. Br J Surg. 2017 Mar;104(4):358-376. doi: 10.1002/bjs.10414. PMID: 28199015. |
Wrong design: International guideline |
|
Conzo G, Tartaglia E, Gambardella C, Esposito D, Sciascia V, Mauriello C, Nunziata A, Siciliano G, Izzo G, Cavallo F, Thomas G, Musella M, Santini L. Minimally invasive approach for adrenal lesions: Systematic review of laparoscopic versus retroperitoneoscopic adrenalectomy and assessment of risk factors for complications. Int J Surg. 2016 Apr;28 Suppl 1:S118-23. doi: 10.1016/j.ijsu.2015.12.042. Epub 2015 Dec 18. PMID: 26708860. |
Wrong design: No systematic review |
|
Chai YJ, Kwon H, Yu HW, Kim SJ, Choi JY, Lee KE, Youn YK. Systematic Review of Surgical Approaches for Adrenal Tumors: Lateral Transperitoneal versus Posterior Retroperitoneal and Laparoscopic versus Robotic Adrenalectomy. Int J Endocrinol. 2014;2014:918346. doi: 10.1155/2014/918346. Epub 2014 Dec 17. PMID: 25587275; PMCID: PMC4281398. |
Wrong study design: The systematic review only includes observational studies |
|
Chen W, Li F, Chen D, Zhu Y, He C, Du Y, Tan W. Retroperitoneal versus transperitoneal laparoscopic adrenalectomy in adrenal tumor: a meta-analysis. Surg Laparosc Endosc Percutan Tech. 2013 Apr;23(2):121-7. doi: 10.1097/SLE.0b013e3182827b57. PMID: 23579504. |
Wrong study design: The systematic review only includes observational studies |
|
Nigri G, Rosman AS, Petrucciani N, Fancellu A, Pisano M, Zorcolo L, Ramacciato G, Melis M. Meta-analysis of trials comparing laparoscopic transperitoneal and retroperitoneal adrenalectomy. Surgery. 2013 Jan;153(1):111-9. doi: 10.1016/j.surg.2012.05.042. Epub 2012 Aug 30. PMID: 22939744. |
Wrong study design: The systematic review also includes observational studies |
|
Al-Zahrani HM. Laparoscopic adrenalectomy: An update. Arab J Urol. 2012 Mar;10(1):56-65. doi: 10.1016/j.aju.2011.11.003. Epub 2012 Jan 31. PMID: 26558005; PMCID: PMC4442880. |
Wrong design: Narrative review |
|
Constantinides VA, Christakis I, Touska P, Palazzo FF. Systematic review and meta-analysis of retroperitoneoscopic versus laparoscopic adrenalectomy. Br J Surg. 2012 Dec;99(12):1639-48. doi: 10.1002/bjs.8921. Epub 2012 Sep 28. PMID: 23023976. |
Wrong study design: The systematic review also includes observational studies |
|
Heloury Y, Muthucumaru M, Panabokke G, Cheng W, Kimber C, Leclair MD. Minimally invasive adrenalectomy in children. J Pediatr Surg. 2012 Feb;47(2):415-21. doi: 10.1016/j.jpedsurg.2011.08.003. PMID: 22325405. |
Wrong population: Children |
|
Lal G, Duh QY. Laparoscopic adrenalectomy--indications and technique. Surg Oncol. 2003 Aug;12(2):105-23. doi: 10.1016/s0960-7404(03)00036-7. PMID: 12946482. |
Wrong design: Narrative review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 19-03-2024
Beoordeeld op geldigheid : 07-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen en patiëntvertegenwoordigers (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met bijniertumoren.
Werkgroep
- Prof. dr. M.R. (Menno) Vriens, endocrien oncologisch chirurg, werkzaam in het UMC Utrecht te Utrecht, NVvH (voorzitter)
- Prof. dr. S. (Schelto) Kruijff, endocrien oncologisch chirurg, werkzaam in het UMCG te Groningen, NVvH (voorzitter)
- Prof. dr. R.A. (Richard) Feelders, internist-endocrinoloog, werkzaam in het Erasmus MC te Rotterdam, NIV
- Prof. dr. H.R. (Harm) Haak, internist, werkzaam in het Máxima MC te Eindhoven, NIV
- Drs. J.F. (Julia) Heusdens, anesthesioloog, werkzaam in het UMC Utrecht te Utrecht, NVA
- Prof. dr. R.R. (Ronald) de Krijger, patholoog, werkzaam in het UMC Utrecht/Prinses Máxima Centrum te Utrecht, NVVP
- Drs. J. (Jeroen) Vister, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Dr. M.R. (Max) Dahele, radiotherapeut-oncoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVRO
- Dr. J.F. (Hans) Langenhuijsen, uroloog, werkzaam in het Radboudumc te Nijmegen, NVU
- Dr. B.P.M. (Bernadette) van Nesselrooij, klinisch geneticus, werkzaam in het UMC Utrecht te Utrecht, VKGN
- J.G. (Johan) Beun, manager/coördinator BijnierNET, BijnierNET
- D.D. (Diana) Kwast-Hoekstra, MScN.RN. Verplegingswetenschapper en patientvertegenwoordiger, Bijniervereniging NVACP (tot 31-12-2022)
- Drs. N.T.M. (Nick) van der Meij, verpleegkundig specialist, werkzaam in het UMC Utrecht, te Utrecht, LWEV
Met ondersteuning van
- dr. A. (Anja) van der Hout, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. S. (Sarah) van Duijn, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. M. (Miriam) te Lintel Hekkert, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. I. (Ingeborg) van Dusseldorp, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Vriens (voorzitter) |
Chirurg UMC Utrecht |
Bestuurslid NVvH (tot mei 2021) |
Geen |
Geen restricties |
|
Kruijff (voorzitter) |
Endocrien chirurg UMCG Groningen |
Geen |
Geen |
Geen restricties |
|
Feelders |
- Professor -internist-endocrinoloog Erasmus MC - Adjunct Professor of Medicine New York University U.S.A. |
- Medisch adviseur NVCAP, onbetaald - Bestuurslid Dutch Adrenal Network, onbetaald - Consultant Recordati, betaald |
Geen |
Geen restricties |
|
Beun |
Coordinator van de Stichting BijnierNET, parttime |
Geen |
Geen |
Geen restricties |
|
Langenhuijsen |
Uroloog Radboudumc, Niijmegen |
Bestuurslid Radboudumc Expertisecentrum Bijnierziekten Voorzitter eUROGEN WS 3 Rare genito-urological cancers en Expertise Area coordinator Adrenal tumours |
ZonMw gefinancieerd onderzoek, DoelmatigheidsOnderzoek "Pentixafor PET/CT vs veneuze bijniervenesampling bij subtypering primair hyperaldosteronisme" i..s.m. PentixaPharm GmBH |
Geen restricties |
|
De Krijger |
- Patholoog, UMC Utrecht, 0,2 fte |
- Board member of Perined, Dutch organization supporting perinatal registries (vacatiegeld) - Council Member European Society of Pathology (onbetaald) - International Panel Member of Wilms tumor panel of SIOP Renal Tumor Study Group (onbetaald) - Chair International (European) pediatrie liver tumor panel (PHITT trial) (onbetaald) - Chairmen Dutch/Belgian working group on Pediatrie Pathology (onbetaald) - Associate editor Pediatrie and Developmental Pathology (onbetaald) - Member editorial board Endocrine Pathology (onbetaald) - Member editorial board Virchows Archiv (onbetaald) - Member editorial board Frontiers in Endocrinology (onbetaald) - Editor-in-Chief Cancers, section Pediatrie Oncology (honorarium) - Member editorial board WHO Endocrine and Neuroendocrine Tumors, 5th edition (onbetaald) |
Geen |
Geen restricties |
|
Heusdens |
Anesthesioloog UMC Utrecht
|
Geen |
Geen |
Geen restricties |
|
Haak |
- Internist- endocrinoloog Maxima MC tot 01-09-2023, daarna nul-aanstelling en pensioen - Hoogleraar acute interne geneeskunde MUMC/UM, tot 01-02-2024 |
- Lid algemeen bestuurd BijnierNET - Voorzitter Bijniernetwerk Nederland D.A.N. - Raad van Toezicht Kempenhaeghe, betaald |
Incidenteel grant van HRA
|
Geen restricties |
|
Dahele |
Radiotherapeut/VHD afdeling radiotherapie Amsterdam UMC (locatie VUmc)
|
Geen |
Onderzoek financiering van: Varian Medical Systems (niet gerelateerd aan bijniertumoren) |
Geen restricties |
|
Van Nesselrooij |
Klinisch Genetica, UMC Utrecht (0,8fte)
|
Secretaris van de VKGN (tot 01-01-2023)
|
Geen |
Geen restricties |
|
Kwast (tot 13-12-2022)
|
Bestuurslid Bijniervereniging NVACP te Nijkerk (onbetaald) (tot 13-12-2022) |
Redactielid Bijniervereniging NVACP (onbetaald) (tot 13-12-2022) |
Geen |
Geen restricties |
|
Vister
|
Radioloog, UMCG
|
Geen |
Geen |
Geen restricties |
|
van der Meij
|
Verpleegkundig specialist AGZ, UMC Utrecht, afdeling Endocriene oncologie |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Patiëntenfederatie Nederland, BijnierNET, Bijniervereniging NVACP, Nederlandse Federatie van Kankerpatiënten organisaties (NFK), Nierstichting, Nierpatiëntenvereniging Nederland uit te nodigen voor de invitational conference en afgevaardigden van BijnierNET en Bijniervereniging NVACP in de werkgroep. Het verslag van de invitational conference (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties: Bijniervereniging NVACP, Patiëntenfederatie Nederland, BijnierNET, Nederlandse Federatie van Kankerpatiënten organisaties (NFK), Nierstichting, Nierpatiëntenvereniging Nederland, Nederlandse Hypofyse Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Diagnostiek morbus Conn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling morbus Conn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling Cushing |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling feochromocytoom |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Expertisecentrum ACC |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Biopsie bij ongedefinieerde retroperitoneale massa |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Kenmerken CT-scan incidentaloom |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Autonome cortisol (hyper)secretie (subklinische Cushing) |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling bijniermetastasen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Minimaal invasieve chirurgie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Genetisch testen en chirurgisch beleid |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Pathologieverslag |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Radiologieverslag |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Follow-up |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Aandacht bijnierschorsinsufficiëntie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met bijniertumoren. Tevens zijn er knelpunten aangedragen door de NVvH, NVU, NOV, NVRO, VKGN, Bijniervereniging NVACP, IKNL, NAPA (vakgroep interne geneeskunde), Belangenvereniging Von Hippel-Lindau via een invitational conference. Een verslag hiervan is opgenomen in de bijlage.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Algemene informatie
|
Richtlijn: Diagnostiek en behandeling van bijniertumoren |
|
|
Uitgangsvraag: Welke benadering bij minimaal invasieve chirurgie heeft de voorkeur voor het verwijderen van een bijniertumor? |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 7-4-2022 |
|
Periode: 2000- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de elementen bijniertumoren en adrenalectomie. Alle sleutelartikelen worden gevonden |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 7-4-2022 met relevante zoektermen gezocht naar systematische reviews en RCTs over adrenalectomie van bijniertumoren. De literatuurzoekactie leverde 219 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
144 |
119 |
186 |
|
RCTs |
66 |
81 |
33 |
|
Observationele studies |
|
|
|
|
Overig |
|
|
|
|
Totaal |
|
|
219 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#14 |
#4 AND (#12 OR #13) Sleutelartikelen gevonden |
4 |
|
#13 |
#12 NOT #11 RCT |
66 |
|
#12 |
#8 AND #10 |
82 |
|
#11 |
#8 AND #9 SR |
144 |
|
#10 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1897667 |
|
#9 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
815025 |
|
#8 |
#7 AND [1-1-2000]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3859 |
|
#7 |
#5 AND #6 |
7101 |
|
#6 |
'adrenalectomy'/exp OR adrenalectom*:ti,ab,kw |
34002 |
|
#5 |
'adrenal cortex carcinoma'/exp OR 'adrenal cancer'/exp OR 'suprarenal carcinoma':ti,ab,kw OR (((adren* OR suprarenal) NEAR/4 (cancer* OR neoplasm* OR carcinoma* OR lesion* OR tumor* OR disease*)):ti,ab,kw) OR 'adrenal enucleation':ti,ab,kw OR 'hemiadrenalectomy':ti,ab,kw |
31684 |
|
#4 |
#1 OR #2 OR #3 |
4 |
|
#3 |
prospective, AND randomized AND comparison AND of AND transperitoneal AND versus AND retroperitoneal AND laparoscopic AND adrenalectomy AND rubinstein |
1 |
|
#2 |
lateral AND transperitoneal AND versus AND posterior AND retroperitoneoscopic AND adrenalectomy AND for AND benign AND adrenal AND gland AND disease AND randomized AND controlled AND trial AND at AND a AND single AND tertiary AND medical AND center |
1 |
|
#1 |
randomized AND clinical AND trial AND of AND posterior AND retroperitoneoscopic AND versus AND lateral AND transperitoneal AND laparoscopic AND adrenalectomy AND with AND a AND '5 year' AND 'follow up' |
2 |
Ovid/Medline
|
# |
Searches |
Results |
|
10 |
9 not 8 RCT |
81 |
|
9 |
5 and 7 |
99 |
|
8 |
5 and 6 SR |
119 |
|
7 |
(exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) |
1364804 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
557229 |
|
5 |
4 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
4408 |
|
4 |
limit 3 to yr="2000 -Current" |
4685 |
|
3 |
1 and 2 |
6954 |
|
2 |
Adrenalectomy/ or adrenalectom*.ti,ab,kf. |
26891 |
|
1 |
exp Adrenal Gland Neoplasms/ or suprarenal carcinoma.ti,ab,kf. or ((adren* or suprarenal) adj4 (cancer* or neoplasm* or carcinoma* or tumor* or lesion* or disease*)).ti,ab,kf. |
40769 |
