Autonome cortisol (hyper)secretie (subklinische Cushing)
Uitgangsvraag
Wanneer dient er tot resectie over gegaan te worden bij milde autonome cortisol (hyper)secretie, voorheen subklinische Cushing genoemd?
Aanbeveling
Overweeg een adrenalectomie, te bespreken in een multidisciplinair overleg bij voorkeur in hierop gespecialiseerd centrum, bij een patiënt met autonome cortisol productie op basis van een bijnierincidentaloom, mede in het kader van eventuele andere (cardiovasculaire) risicofactoren (bloeddruk en lipidenspectrum), osteoporose en diabetes. Factoren die bij de individuele patiënt meegenomen moeten worden met betrekking tot de behandelbeslissing zijn:
- Leeftijd
- Geslacht
- Gezondheid
- Comorbiditeiten (hypertensie, osteoporose, diabetes)
- Uitslag dexamethason suppressie test (cortisol >50 nmol/l)
- Voorkeur van de patiënt
Pas adequate secundaire preventie en follow-up toe bij patiënten met autonome cortisol productie van een bijnierincidentaloom op cardiovasculaire risicofactoren, osteoporose en diabetes.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek verricht naar de vergelijking tussen adrenalectomie versus geen adrenalectomie bij patiënten met autonome cortisol (hyper)secretie (subklinische Cushing) en gedetecteerde bijnier laesie. Er zijn twee systematische reviews op basis van observationeel onderzoek en één RCT geïncludeerd die deze vergelijking hebben onderzocht. Voor de cruciale uitkomstmaten werd gevonden dat patiënten die een adrenalectomie hadden ondergaan vaker verbetering van bloeddruk, diabetes en dyslipidemie hadden (niet altijd klinisch relevant). Voor de belangrijke uitkomstmaten osteoporose, myocardinfarct, beroerte en mortaliteit werd geen bewijs gevonden. Voor alle uitkomstmaten was de bewijskracht zeer laag, hier ligt dus een kennislacune. De lage bewijskracht werd met name veroorzaakt door beperkingen in de studies en resultaten van lage precisie. Door de zeer lage bewijskracht zal de keuze voor het wel of niet behandelen met adrenalectomie dus afhangen van andere factoren, zoals bijvoorbeeld comorbiditeiten van de patiënt of de eigen voorkeur van de patient. Bij patiënten bij wie er een hoog (anesthesiologisch) operatierisico is, zal de voorkeur niet uitgaan naar een operatie. Denk hierbij aan comorbiditeiten zoals cardiopulmonale aandoeningen of morbide obesitas. Voor patiënten bij wie het gevonden incidentaloom op basis van verricht onderzoek (beeldvorming, labonderzoek) een verhoogde kans heeft dat het een maligniteit betreft, of middels biochemische activiteit leidt tot klinische klachten, gelden de aanbevelingen gedaan in de overige modulen van deze richtlijn.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het besluit tot al dan niet een adrenalectomie moet in goed overleg met de patiënt genomen worden. De voorkeuren van de patiënt zijn hierin van groot belang. Wat de beste voortgang is na de bevinding van een (goedaardig) bijnierincidentaloom met autonome, subklinische cortisol productie, is niet met bewijs onderbouwd en met zekerheid te zeggen. Het is wel mede afhankelijk van de mate van cortisol overproductie en de duur en aanwezigheid van comorbiditeiten zoals hypertensie, diabetes, lipidemie, eventueel osteoporose, etc. Met name moeilijk behandelbare diabetes en moeilijk behandelbare hypertensie zou een aanvullende reden tot operatie kunnen zijn.
Kosten (middelenbeslag)
Kosteneffectiviteit van een dergelijke adrenalectomie dient afgezet te worden tegen de behaalde QALY’s door de postoperatief mogelijk beter controleerbare diabetes, tensie- en lipidenwaarden. Hierin zal meegenomen moeten worden de kosten die eventueel bespaard worden bij minder medicatiegebruik. De genoemde klachten betreffen een zeer breed spectrum en de ervaren klachten door patiënten lopen vermoedelijk zeer uiteen, daarom is het niet goed mogelijk een homogene studiepopulatie te vinden waarbij dergelijke kosten tussen de interventies adequaat vergeleken kunnen worden. De werkgroep is van mening dat een hogere toename van comorbiditeit op basis van de autonome cortisol overproductie wel sneller de aan de operatie gerelateerde kosten zou kunnen rechtvaardigen. Daarin dient echter te worden meegenomen dat naast de financiele kosten, ook rekening gehouden moet worden met het (eenmalig) verhoogde complicatierisico.
Aanvaardbaarheid, haalbaarheid en implementatie
Verschillende studies tonen aan dat er een verbetering optreedt van de cruciale uitkomstmaten dyslipidemie, hypertensie en diabetes na een verrichte adrenalectomie bij patiënten met subklinische Cushing. De kosten van een operatie wegen zeker op tegen de macro-economische lasten van bovengenoemde uitkomstmaten. Een eventuele toename van chirurgische ingrepen op basis van deze diagnose kan in potentie een langere wachttijd impliceren; we verwachten echter niet dat dit tot grote problemen zal leiden.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Meerdere studies tonen een verbetering van de cruciale uitkomstmaten dyslipidemie, hypertensie en diabetes na verrichte adrenalectomie bij patiënten met subklinische Cushing. Getuige de relatieve lage betrouwbaarheid van deze uitkomstmaten kan de werkgroep echter niet zonder meer een adrenalectomie aanbevelen als best beschikbare therapie. Keuze hierover blijft een gezamenlijke overweging van arts en patient, welke in goed overleg genomen dient te worden en vermoedelijk mede afhankelijk zal zijn van de door patiënt ervaren klachten in het kader van zijn/haar comorbiditeiten. Ten aanzien van osteoporose, myocardinfarct of herseninfarct is geen bewijs aan te dragen voor een verminderd risico of ziektelast na het uitvoeren van een adrenalectomie. De werkgroep kan derhalve geen chirurgie adviseren ter preventie van deze uitkomstmaten.
Onderbouwing
Achtergrond
Autonome cortisol hypersecretie is een endocriene stoornis welke kan worden gevonden bij patiënten met een bijnierincidentaloom. Deze incidentalomen kunnen leiden tot ACTH-onafhankelijk verhoogde cortisol secretie, welke geen klassieke klachten geven maar wel metabole problemen kunnen geven met daarbij een verhoogd risico op cardiovasculaire events en osteoporose. In deze module wordt er een handvat gegeven in het management van het incidentaloom met autonome cortisol (hyper)secretie.
Conclusies / Summary of Findings
Hypertension (critical)
|
Very low GRADE |
The evidence is very uncertain about the effect of adrenalectomy on hypertension when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: Bancos, 2016; Morelli, 2022; Petramala, 2017 |
Blood pressure (critical)
Systolic blood pressure and diastolic blood pressure
|
Very low GRADE |
The evidence is very uncertain about the effect of adrenalectomy on systolic blood pressure when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: Bancos, 2016; Morelli, 2022 |
Diabetes Mellitus (critical)
|
Very low GRADE |
The evidence is very uncertain about the effect of adrenalectomy on Diabetes Mellitus when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: Bancos, 2016; Morelli, 2022; Petramala, 2017 |
Dyslipidemia (critical)
|
Very low GRADE |
The evidence is very uncertain about the effect of adrenalectomy on dyslipidemia when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: Bancos, 2016; Morelli, 2022 |
Osteoporosis (important)
|
No GRADE |
No evidence was found regarding the effect of adrenalectomy on osteoporosis when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: - |
Myocardial infarction (important)
|
No GRADE |
No evidence was found regarding the effect of adrenalectomy on myocardial infarction when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: - |
Cerebrovascular accident (important)
|
No GRADE |
No evidence was found regarding the effect of adrenalectomy on cerebrovascular accident when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: - |
Mortality (important)
|
No GRADE |
No evidence was found regarding the effect of adrenalectomy on mortality when compared with no adrenalectomy in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion.
Source: - |
Samenvatting literatuur
Description of studies
Systematic reviews
The systematic review by Bancos (2016) studied the effect of adrenalectomy on cardiovascular risk factors compared with conservative management in patients with adrenal tumors and subclinical Cushing’s syndrome. Original prospective and retrospective, comparative and non-comparative studies, containing at least five patients who underwent adrenalectomy, which analyzed adults with either non-functioning adrenal tumors or adrenal tumors with subclinical Cushing, and reporting outcomes of interest before and after adrenalectomy, were eligible for inclusion. Nonoriginal studies and case reports were excluded from the systematic review and meta-analysis. Electronic searches were performed in MEDLINE In-Process & Other Non-Indexed Citations, MEDLINE, EMBASE, Cochrane Central Register of Controlled Trial, Cochrane Database of Systematic Reviews, and Scopus on 17 November 2015. Outcome measures of interest were: hypertension, pre-diabetes or diabetes mellitus, obesity, dyslipidemia, systolic blood pressure, diastolic blood pressure, body mass index, weight, fasting glucose concentrations, glycosylated hemoglobin, total cholesterol, triglycerides, high-density lipoprotein cholesterol, and low-density lipoprotein cholesterol. Data of 16 retrospective cohort studies, 9 prospective cohort studies and 1 randomized controlled trial, including a total of 584 patients with subclinical Cushing’s syndrome were included in the systematic review of Bancos (2016).
Of these 26 studies, 10 studies meet our PICO criteria (Azaka, 2011; Chiodini, 2010; Giordano, 2010; Guerrieri, 2010; Iacobone, 2012; Kawate, 2014; Ricciato, 2014; Rossi, 2000; Toniato, 2009; Tsuiki, 2008). Six were retrospective cohort studies, three were prospective cohort studies and one was a randomized controlled trial. These studies were performed in Italy (n=7) and Japan (n=3). Meta-analyses were performed for multiple outcome measures. Subgroup analyses were performed in three subgroups of patients stratified based on dexamethasone suppression test cortisol cutoff, for the outcome measures hypertension and diabetes mellitus type 2. Important limitations of the current review were that definitions of subclinical Cushing’s syndrome were heterogenous, there were significant differences between studies in how and when the outcomes of interest were assessed, definitions of comorbidities and of improvement were inconsistent, it was unclear what exactly conservative management was, and individual variables such as age, gender, and tumor size were not consistently reported.
The systematic review by Khan (2019) investigated the prevalence of cardiometabolic outcomes in nonfunctioning and subclinical cortisol secreting adrenal incidentalomas (AIs), comparing adrenalectomy to conservative treatment. Original retrospective, prospective, or cross-sectional studies, which analyzed patients with nonfunctioning and/or subclinical cortisol secreting adrenal incidentalomas, that reported at least two components of metabolic syndrome (diabetes, impaired glucose tolerance, fasting hyperinsulinemia, dyslipidemia, hypertension, and obesity/central adiposity) and the results of adrenalectomy or conservative management on these outcomes, were eligible for inclusion. Studies without biochemically confirmed subclinical hypercortisolism, studies only reporting preoperative data or insufficient postoperative data, and case series and case reports including fewer than 10 operated patients were excluded. Electronic searches were performed in MEDLINE, Cochrane Controlled Trials Register (1960-2005), and EMBASE (1991-2005) from the date of each database’s inception up to June 2018. Outcome measures were: prevalence of components of metabolic syndrome in subclinical cortisol secreting AIs and nonfunctioning AIs, and cardiometabolic outcomes of conservative management and adrenalectomy (diabetes, impaired glucose tolerance, fasting hyperinsulinemia, dyslipidemia, hypertension, and obesity/central adiposity). Data of 15 cohort studies, 1 randomized controlled trial, and 2 cross-sectional studies, including a total of 1722 patients were included. Of these 18 studies, 5 studies meet our PICO criteria, of which 4 studies are already included through Bancos (2016). Therefore, only 1 study was left to include (Petramala, 2017). This retrospective cohort study was performed in Italy. Khan (2019) did not perform any meta-analyses or subgroup analyses because of heterogeneity between the studies. Important limitations of the current review were the heterogeneity in definitions of subclinical cortisol secreting and in definitions of endpoints and outcomes, variation in follow-up length, variation in medical treatment for cardiovascular risk factors, and the content of conservative management.
RCTs
Morelli (2022) performed a randomized clinical trial to study the metabolic effect of adrenalectomy in patients with adrenal incidentalomas with possible autonomous cortisol secretion. Patients with age between 40 and 75 years, and diagnosis by imaging of unilateral AI larger than 1 cm with radiological features at computed tomography consistent with an adrenocortical adenoma (homogeneous and hypodense, Hounsfield units <10 or with proven radiological dimensional stability) were eligible for trial participation. In total, 62 patients were eligible and were randomized into two groups. The intervention group (n=31) received adrenalectomy intervention, in which the AI was removed. The control group (n=31) received the conservative approach, in which patients with borderline-elevated blood pressure or grade 1 hypertension, prediabetes, or overweight were suggested to follow intensive lifestyle behavior changes, and patients with grade 2-3 hypertension, not fully controlled diabetes, obesity, or dyslipidemia were addressed to cardiologists and/or diabetologists. The duration of the follow-up was 6 months. The study reported the following relevant outcome measures: patients with obesity, body weight change, patients with dyslipidemia, dyslipidemia control, systolic blood pressure, diastolic blood pressure, patients with hypertension, hypertension grade, blood pressure control, patients with diabetes mellitus, patients with impaired glucose tolerance/impaired fasting glucose, diabetes mellitus grade, glycometabolic control, and the association between blood pressure control improvement and surgical or conservative approach (adjusted for possible confounders).
Hypertension (critical)
Three studies reported the outcome measure hypertension (Bancos, 2016; Morelli, 2022; Petramala, 2017). Due to heterogenous presentation of the results, the results were not pooled, but presented separately.
Bancos (2016) reported hypertension improvement in nine studies. In total, 55 of 89 patients with hypertension who underwent adrenalectomy had hypertension improvement, and 0 of 84 patients with hypertension who did not undergo adrenalectomy had hypertension improvement. Pooled data of these nine studies showed a pooled risk ratio of 12.69 (95% CI 4.87 to 33.07), in favour of the patients who underwent adrenalectomy (Figure 1). This difference is considered clinically relevant.
Figure 1. Hypertension improvement
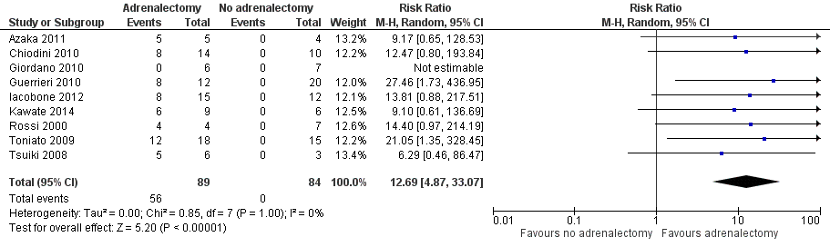
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Petramala (2017) reported patients with hypertension. At baseline, 22 of the 26 patients (85%) who underwent adrenalectomy had hypertension, and 28 of the 44 patients (63.1%) who did not undergo adrenalectomy had hypertension. At follow-up, 15 of the 26 patients (58.82%) who underwent adrenalectomy had hypertension, and 32 of the 44 patients (72.5%) who did not undergo adrenalectomy had hypertension. The risk ratio at follow-up was 0.79 (95% CI 0.54 to 1.15), in favour of the patients who underwent adrenalectomy. This difference is considered clinically relevant.
Morelli (2022) reported the amount of patients with hypertension. In total, 14 of the 25 patients (56%) who underwent adrenalectomy had hypertension, and 22 of the 30 patients (73%) who did not undergo adrenalectomy had hypertension. The risk ratio was 0.76 (95% CI 0.51 to 1.15), in favour of the patients who underwent adrenalectomy. This difference is considered clinically relevant.
Blood pressure (critical)
Two studies reported several blood pressure outcome measures (Bancos, 2016; Morelli, 2022). These outcomes are presented separately, and results were not pooled due to heterogenous presentation of the outcomes.
Systolic blood pressure
Two studies reported the outcome measure systolic blood pressure (Bancos, 2016; Morelli, 2022). As only two studies were included, the results were not pooled.
Bancos (2016) reported systolic blood pressure. The mean difference between the group of patients who underwent adrenalectomy and the group of patients who did not undergo adrenalectomy was -12.546 mmHg (95% CI -18.589 to -6.502), in favour of the patients who underwent adrenalectomy. This difference is considered clinically relevant.
Morelli (2022) reported systolic blood pressure. The patients who underwent adrenalectomy (n=25) had a mean systolic blood pressure of 133.2 mmHg (SD ± 12.8 mmHg). The patients who did not undergo adrenalectomy (n=30) had a mean systolic blood pressure of 142.9 mmHg (SD ± 16.7 mmHg). The mean difference between the groups was -9.70 mmHg (95% CI -17.50 to -1.90), in favour of the patients who underwent adrenalectomy. This difference is not considered clinically relevant.
Diastolic blood pressure
Two studies reported the outcome measure diastolic blood pressure (Bancos, 2016; Morelli, 2022). As only two studies were included, the results were not pooled.
Bancos (2016) reported diastolic blood pressure. The mean difference between the group of patients who underwent adrenalectomy and the group of patients who did not undergo adrenalectomy was -9.298 mmHg (95% CI -15.123 to -3.472), in favour of the patients who underwent adrenalectomy. This difference is not considered clinically relevant.
Morelli (2022) reported diastolic blood pressure. The patients who underwent adrenalectomy (n=25) had a mean diastolic blood pressure of 77.1 mmHg (SD ± 8.9 mmHg). The patients who did not undergo adrenalectomy (n=30) had a mean diastolic blood pressure of 78 mmHg (SD ± 10.7 mmHg). The mean difference between the groups was -0.90 mmHg (95% CI -6.08 to 4.28), in favour of the patients who underwent adrenalectomy. This difference is not considered clinically relevant.
Diabetes Mellitus (critical)
Three studies reported the outcome measure Diabetes Mellitus (Bancos, 2016; Morelli, 2022; Petramala, 2017). Due to study heterogeneity, the results were not pooled.
Bancos (2016) reported Diabetes Mellitus improvement in eight studies. In total, 25 of 53 patients with diabetes who underwent adrenalectomy had Diabetes Mellitus improvement, and 1 of 35 patients with diabetes who did not undergo adrenalectomy had Diabetes Improvement. Pooled data of these eight studies showed a pooled risk ratio of 4.21 (95% CI 1.60 to 11.09), in favour of the patients who underwent adrenalectomy (Figure 2). This difference is considered clinically relevant.
Figure 2. Diabetes Mellitus improvement
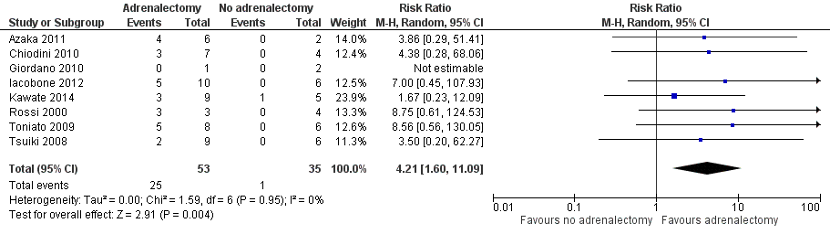
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Petramala (2017) reported Diabetes Mellitus improvement, normalization, or worsening. At baseline, 10 of the 26 patients (38%) who underwent adrenalectomy had diabetes, and 11 of the 44 patients (25%) who did not undergo adrenalectomy had diabetes. The risk ratio at baseline was 1.54 (95% CI 0.76 to 3.12), in favour of the patients who did not undergo adrenalectomy. At follow-up, 6 of the 26 patients (23.5%) who underwent adrenalectomy had diabetes, and 17 of the 44 patients (38.5%) who did not undergo adrenalectomy had diabetes. The risk ratio at follow-up was 0.60 (95% CI 0.27 to 1.32), in favour of the patients who underwent adrenalectomy. This difference is considered clinically relevant.
Morelli (2022) reported the amount of patients with Diabetes Mellitus. In total, 5 of the 25 patients (20%) who underwent adrenalectomy had Diabetes Mellitus, and 6 of the 30 patients (20%) who did not undergo adrenalectomy had Diabetes Mellitus. The risk ratio was 1.00 (95% CI 0.35 to 2.89). This means there was no difference between the groups.
Dyslipidemia (critical)
Two studies reported the outcome measure dyslipidemia (Bancos, 2016; Morelli, 2022).
Bancos (2016) reported dyslipidemia improvement in seven studies. In total, 18 of 80 patients with dyslipidemia who underwent adrenalectomy had dyslipidemia improvement, and 5 of 71 patients with dyslipidemia who did not undergo adrenalectomy had dyslipidemia improvement.
Morelli (2022) reported the amount of patients with dyslipidemia. In total, 15 of the 25 patients (60%) who underwent adrenalectomy had dyslipidemia, and 20 of the 30 patients (66.7%) who did not undergo adrenalectomy had dyslipidemia. The risk ratio was 0.90 (95% CI 0.60 to 1.35), in favour of the patients who underwent adrenalectomy. This difference is not considered clinically relevant.
Morelli (2022) reported dyslipidemia control. In total, 23 of the 25 patients (92%) who underwent adrenalectomy had a stable dyslipidemia level, and 23 of the 30 patients (76.7%) who did not undergo adrenalectomy had a stable dyslipidemia level. In total, 1 of the 25 patients (4%) who underwent adrenalectomy had a worse dyslipidemia level, and 4 of the 30 patients (13.3%) who did not undergo adrenalectomy had a worse dyslipidemia level. In total, 1 of the 25 patients (4%) who underwent adrenalectomy had an improved dyslipidemia level, and 3 of the 30 patients (10%) who did not undergo adrenalectomy had an improved dyslipidemia level (Figure 3). The risk ratio was 0.40 (95% CI 0.04 to 3.61), in favour of the patients who underwent adrenalectomy. This difference is considered clinically relevant. The p-value for dyslipidemia control was 0.31.
Pooled data of these eight studies showed a pooled risk ratio of 2.04 (95% CI 0.80 to 5.25), in favour of the patients who underwent adrenalectomy (Figure 3). This difference is considered clinically relevant.
Figure 3. Dyslipidemia improvement
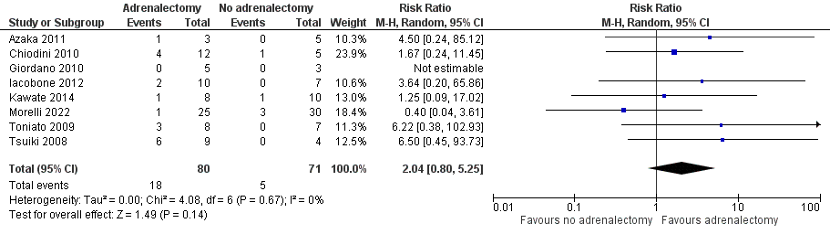
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval.
Osteoporosis (important)
None of the studies reported the outcome measure osteoporosis.
Myocardial infarction (important)
None of the studies reported the outcome measure myocardial infarction.
Cerebrovascular accident (important)
None of the studies reported the outcome measure cerebrovascular accident.
Mortality (important)
None of the studies reported the outcome measure mortality.
Level of evidence of the literature
The level of evidence regarding the outcome measure was based on systematic revies of observational studies and an RCT and therefore starts low.
Hypertension (critical)
The level of evidence was downgraded by 2 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the level for clinical relevance (imprecision, -1). The level of evidence is therefore very low.
Blood pressure (critical)
Systolic blood pressure and diastolic blood pressure
The level of evidence was downgraded by 2 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -1). The level of evidence is therefore very low.
Diabetes Mellitus (critical)
The level of evidence was downgraded by 2 levels because of study limitations (risk of bias, -1), and because of the small amount of included patients (imprecision, -1). The level of evidence is therefore very low.
Dyslipidemia (critical)
The level of evidence was downgraded by 3 levels because of study limitations (risk of bias, -1), and because the confidence interval exceeds the levels for clinical relevance (imprecision, -2). The level of evidence is therefore very low.
Osteoporosis (important)
The level of evidence regarding the outcome measure osteoporosis could not be graded, as the included studies did not report this outcome measure.
Myocardial infarction (important)
The level of evidence regarding the outcome measure myocardial infarction could not be graded, as the included studies did not report this outcome measure.
Cerebrovascular accident (important)
The level of evidence regarding the outcome measure cerebrovascular accident could not be graded, as the included studies did not report this outcome measure.
Mortality (important)
The level of evidence regarding the outcome measure mortality could not be graded, as the included studies did not report this outcome measure.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question: What are the beneficial and harmful effects of surgery compared to watchful waiting in patients with subclinical Cushing’s Syndrome on cardiovascular events, diabetes and osteoporosis?
|
P (Patients) |
Patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion |
|
I (Intervention) |
Adrenalectomy |
|
C (Control) |
No adrenalectomy, follow-up |
|
O (Outcomes) |
Hypertension, blood pressure, diabetes, dyslipidemia, cardiovascular diseases (intermediate outcomes), osteoporosis, myocardial infarction, cerebrovascular accident, mortality |
Relevant outcome measures
The guideline development group considered hypertension, blood pressure, diabetes, and dyslipidemia as critical outcome measures for decision making; and osteoporosis, myocardial infarction, cerebrovascular accident, and mortality as important outcome measures for decision making.
The working group defined the outcome measures as follows:
- hypertension: number of patients with hypertension
- blood pressure: systolic and diastolic blood pressure
- diabetes: number of patients with diabetes
- dyslipidemia: number of patients with dyslipidemia
- osteoporosis: number of patients with osteoporosis
- myocardial infarction: incidence
- cerebrovascular accident: incidence
- mortality: death rate
The guideline development group defined the following differences as a minimal clinically (patient) important difference:
- hypertension: GRADE standard limits of 25% for dichotomous outcome measures (RR <0.80 or RR >1.25)
- blood pressure: 10 mmHg
- diabetes: GRADE standard limits of 25% for dichotomous outcome measures (RR <0.80 or RR >1.25)
- dyslipidemia: GRADE standard limits of 25% for dichotomous outcome measures (RR <0.80 or RR >1.25)
- osteoporosis: GRADE standard limits of 25% for dichotomous outcome measures (RR <0.80 or RR >1.25)
- myocardial infarction: Absolute difference >5% for lethal complications, or >25% for serious complications.
- cerebrovascular accident: Absolute difference >5% for lethal complications, or >25% for serious complications.
- mortality: Absolute difference >5%
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 04-10-2022. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 153 hits. Studies were selected based on the following criteria: systematic reviews or RCT’s comparing adrenalectomy versus no adrenalectomy or follow-up in patients with autonomous cortisol (hyper)secretion (subclinical Cushing) and detected adrenal lesion. In total, eighteen studies were initially selected based on title and abstract screening. After reading the full text, fifteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and three studies were included.
Results
Three studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Bancos I, Alahdab F, Crowley RK, Chortis V, Delivanis DA, Erickson D, Natt N, Terzolo M, Arlt W, Young WF Jr, Murad MH. THERAPY OF ENDOCRINE DISEASE: Improvement of cardiovascular risk factors after adrenalectomy in patients with adrenal tumors and subclinical Cushing's syndrome: a systematic review and meta-analysis. Eur J Endocrinol. 2016 Dec;175(6):R283-R295. doi: 10.1530/EJE-16-0465. Epub 2016 Jul 22. PMID: 27450696.
- Khan U. Nonfunctioning and Subclinical Cortisol Secreting Adrenal Incidentalomas and their Association with Metabolic Syndrome: A Systematic Review. Indian J Endocrinol Metab. 2019 May-Jun;23(3):332-346. doi: 10.4103/ijem.IJEM_52_19. PMID: 31641636; PMCID: PMC6683688.
- Morelli V, Frigerio S, Aresta C, Passeri E, Pugliese F, Copetti M, Barbieri AM, Fustinoni S, Polledri E, Corbetta S, Arosio M, Scillitani A, Chiodini I. Adrenalectomy Improves Blood Pressure and Metabolic Control in Patients With Possible Autonomous Cortisol Secretion: Results of a RCT. Front Endocrinol (Lausanne). 2022 Jun 2;13:898084. doi: 10.3389/fendo.2022.898084. PMID: 35721734; PMCID: PMC9202594.
Evidence tabellen
Evidence tables
Systematic reviews
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Khan, 2019 |
SR of 15 cohort studies, 1 RCT, and 2 cross-sectional studies
Literature search up to June 2018
A: Toniato, 2009 B: Iacobone, 2012 C: Kawate, 2014 D: Petramala, 2017 E: Tsuiki, 2008
Study design: Systematic review
Setting and country: A: Italy B: Italy C: Japan D: Italy E: Japan
Source of funding: Nil.
Conflicts of interest: None declared. |
Inclusion criteria SR: Original retrospective, prospective, or cross-sectional studies, analyzing patients with nonfunctioning and/or subclinical cortisol secreting Adrenal Incidentalomas (AIs), reporting at least two components of metabolic syndrome (diabetes, impaired glucose tolerance, fasting hyperinsulinemia, dyslipidemia, HTN, and obesity/central adiposity), and the results of adrenalectomy and/or conservative management on these outcomes included.
Exclusion criteria SR: Studies without biochemically confirmed subclinical hypercortisolism, studies reporting only preoperative data or insufficient postoperative data, case reports and case series including fewer than 10 operated patients.
5 studies included
Important patient characteristics at baseline:
Study size (n): A: Intervention 23, control 22 B: Intervention 15, control 20 C: Intervention 15, control 12 D: Intervention 26, control 44 E: Intervention 10, control 12
Age (years): A: Intervention 63 ± 4.1, control 64 ± 1.8 B: Intervention median 57 (range 36-78), control median 58 (range 39-75) C: Intervention 55.3 ± 9.4, control 66.3 ± 8.8 D: 61.9 ± 8.4 E: Median 59.7 (range 43-74)
Sex of participants (male): A: Intervention 12, control 10 B: Intervention 12, control 8 C: Intervention 2, control 6 D: 52 E: 6 |
Intervention: Surgery: adrenalectomy.
|
Control: Conservative management.
|
Duration of follow-up:
A: Mean 7.7 years (range 2-17 years) B: Intervention mean 54 ± 34 months, control 56 ± 37 months C: Median 5.3 years D: Mean 12 months (range 9-15 months) E: Intervention 7-19 months (average 13 ± 3.8 months), control 15-69 months (average 27 ± 15.2 months)
For how many participants were no complete outcome data available?
Not reported. |
Hypertension: Defined as: A: Systolic blood pressure >150 and diastolic blood pressure >90 B, C: Systolic blood pressure ≥140, diastolic blood pressure ≥90 or antihypertensive treatment. E: Systolic blood pressure >140 and/or diastolic blood pressure >90
A: Intervention: Improved 7 (38.9%), normalized 5 (27.8%) Control: worsened 5 (22.7%) P=0.046 B: Control: worsened 3/12 (25%) P=0.002 C: Intervention: improved 6 (67%) Control: improved 0 (0%), worsened 4 (67%) D: Baseline: Intervention: 85% Control: 63.1% Follow-up: Intervention: 58.82% Control: 72.5% P<0.05 E: Intervention: improved 5 Control: worsened 1, developed HTN 1
Diabetes mellitus: Defined as: A: Fasting glucose >126 mg/dl or treatment with antidiabetic drugs B: FPG >126 mg/dl or treatment with antidiabetic drugs C: FPG ≥126 mg/dl and/or random glucose ≥200 mg/dl and/or HbA1c ≥6.5% and/or treatment with antidiabetic drugs E: FPG >126 mg/dl or 2h plasma glucose >200 mg/dl
A: Intervention: improved 3 (37.5%), normalized 2 (25%) Control: worsened 2 (9%) P=0.619 B: Control: worsened 3/12 (25%) P=0.032 C: Intervention: improved 3 (60%) Control: improved 1 (20%), worsened 2 (40%) D: Baseline: Intervention: 38% Control: 25% Follow-up: Intervention 23.5% Control: 38.5%
Hypercholesterolemia (data retrieved from Toniato, 2009) A: Intervention: normalized 3 (37.5%) Control: worsened 3 (13.6%) P=0.619
Dyslipidemia Defined as: A: Triglycerides >150 mg/dl, HDL <40 mg/dl in men, HDL <50 mg/dl in women B: Triglycerides ≥150 mg/dl, HDL <40 mg/dl in men, HDL <50 mg/dl in women, patients on anti-dyslipidemic treatment C: Total cholesterol ≥220 mg/dl and/or LDL ≥140 mg/dl and/or HDL <40 mg/dl and/or triglycerides ≥150 mg/dl, treatment with lipid-lowering medication E: Total cholesterol >220 mg/dl
B: Baseline: Intervention: 10 (50%) Control: 7 (46.7%) Follow-up: Control: no change P=0.47 C: Baseline: Intervention: 8 (53%) Control: 10 (83%) Follow-up: Intervention: 1 improvement (13%) Control: 1 improvement (10%)2, 2 worsening (20%) E: Baseline: Intervention: 9 (90%) Control: 6 (50%) Follow-up: Intervention: 6 improvement Control: none worsened, 2 developed P<0.001
Obesity Defined as: A: Overweight: BMI 25-30 kg/m2, obese: BMI >30 kg/m2 B: Overweight: BMI 25-29.9 kg/m2, obese: ≥30 kg/m2 C: Obesity: BMI ≥25 kg/m2 E: Obesity: BMI ≥25 kg/m2
A: Intervention: BMI normalized 3 (50%) B: Control: BMI worsened 3/12 (25%) P=0.19 C: Baseline: Intervention: 5 (33%) Control 5 (42%) D: Baseline: Intervention: 53.8% Control: 33% Follow-up: Intervention: 24.5% Control: 42.7% P<0.05 E: Baseline: Intervention: 3 (30%) Control: 3 (25%) Follow-up: Intervention: 0 improvement Control: none worsened, 2 developed
Metabolic syndrome Defined as: D: Defined by ATP III-NCEP criteria
D: Baseline: Intervention 54% Control 39% Follow-up: Intervention: 23% Control: 45% P<0.05
High triglycerides D: Baseline: Intervention: 34% Control: 34% Follow-up: Intervention: 27% Control: 38%
Impaired glucose metabolism (data retrieved from Tsuiki, 2008): E: Baseline: Intervention: 9 (90%) Control: 6 (50%) Follow-up: Intervention: 2 Control: 1 worsened, 2 developed |
The author concludes that cardiometabolic risk factors should be screened for in patients with subclinical cortisol secreting AIs.
In general, adrenalectomy data indicated improvement in metabolic complications in patients with subclinical cortisol secreting AI. Metabolic complications deteriorated or did not improve in patients who were treated conservatively.
No GRADE performed.
No meta-analysis and sensitivity analysis performed. Age, gender, and size of the AI might influence cardiovascular outcomes, but subgroup analysis was not possible, as the individual studies did not consistently report these variables. |
|
Bancos, 2016
[individual study characteristics deduced from Bancos, 2016]
|
SR and meta-analysis of 6 cohort studies
Literature search up to 17 November 2015
A: Rossi, 2000 B: Guerrieri, 2010 C: Giordano, 2010 D: Chiodini, 2010 E: Azaka, 2011 F: Ricciato, 2014
Study design: 2 prospective cohort studies and 4 retrospective cohort studies
Setting and Country: A: Italy B: Italy C: Italy D: Italy E: Japan F: Italy
Source of funding: No specific grant from any funding agency in the public, commercial or not-for-profit sector was received.
Conflicts of interest: Authors have no conflicts of interest to declare. IB, WA and MT are members of the European Society of Endocrinology and European Network for the Study of Adrenal Tumors Clinical Guideline Panel. |
Inclusion criteria SR:
Exclusion criteria SR: Nonoriginal studies and case reports.
6 studies included
Important patient characteristics at baseline: N patients A: Intervention: n=5, control: n=7 B: Intervention: n=19, control: n=28 C: Intervention: n=6, control: n=10 D: Intervention: n=25, control: n=16 E: Intervention: n=8, control: n=8 F: Intervention: n=16, control: n=17
Definition of subclinical Cushing’s syndrome: A: Overnight dexamethasone: 3 µg/dL (2 mg), UFC >2 SD above normal range, ACTH Low, Average daily cortisol. B: Not defined. C: Overnight dexamethasone: 1.8 µg/dL (1 mg), UFC >100 µg/24h, ACTH <5 pg/mL, Loss of circadian cortisol rhythm. D: Overnight dexamethasone: 3 µg/dL (1 mg), UFC >70 µg/24h, ACTH <10 pg/mL. E: Overnight dexamethasone: 3 µg/dL (1 mg), cortisol cutoff 1 µg/dL, Normal basal cortisol AND one of: low DHEA-S, low ACTH, loss of circadian cortisol rhythm, unilateral uptake on scintigraphy. F: Overnight dexamethasone: 1.8 µg/dL (1 mg), UFC >137 µg/24h, ACTH <10 pg/mL, Midnight serum cortisol >50 µg/mL.
Groups comparable at baseline: not reported. |
Intervention: Adrenalectomy
|
Control: Conservative management
|
End-point of follow-up: Most studies reassessed patients 6 months after surgery, with a mean follow-up of 28 (1-109) months (median or mean follow-up was reported in only 11 studies).
For how many participants were no complete outcome data available? Not reported.
|
Hypertension improvement Defined as: A: Decrease in the dose, number of discontinuation of medications. B: Before and after SBP and DBP means/SD, P values, and magnitude of change reported. C: Not defined. D: Change of HTN grade (European Society Cardology Mean SBP and DBP before and after. E: Decrease in blood pressure <140/90 mmHg leading to decrease of the dose, number or discontinuation of medications. F: Before and after blood pressure measurements, reduction or discontinuation of blood pressure meds.
A: Intervention: 4/4 Control: 0/7 RR 14.400 [95% CI 0.968 to 214.193] B: Intervention: 8/12 Control: 0/20 RR 27.462 [95% CI 1.726 to 436.947] C: Intervention: 0/6 Control: 0/7 RR 1.143 [95% CI 0.026 to 50.397] D: Intervention: 8/14 Control: 0/10 RR 12.467 [95% CI 0.802 to 193.845] E: Intervention: 5/5 Control: 0/4 RR 9.167 [95% CI 0.654 to 128.533]
Diabetes Mellitus improvement Defined as: A: Reduction of oral medications or insulin. B: P values and magnitude of change reported to fasting plasma glucose. C: Not defined. D: Fasting plasma glucose considered changed if move from one category to another according to Adult Treatment Panel III criteria Fasting plasma glucose mean before and after. E: Normoglycemia (glucose <110 mg/dL) on OGTT, HbA1c decreased by >0.3% or discontinuation/decrease of medications. F: Change in glucose level.
A: Intervention: 3/3 Control: 0/4 RR 8.750 [95% CI 0.615 to 124.534] C: Intervention: 0/1 Control: 0/2 RR 1.500 [95% CI 0.046 to 49.070] D: Intervention: 3/7 Control: 0/4 RR 4.375 [95% CI 0.281 to 68.058] E: Intervention: 4/6 Control: 0/2 RR 3.875 [95% CI 0.289 to 51.407]
Dyslipidemia improvement Defined as: A: Not reported. B: P values and magnitude of change reported for HDL. C: Not defined. D: Move from one category to another based on Adult Treatment Panel III criteria LDL means before and after. E: LDL <140 mg/dL, trigs <150 mg/dL; HDL>40 or discontinuation/decrease of medications. F: Before and after mean HDL and TG.
C: Intervention: 0/5 Control: 0/3 RR 0.667 [95% CI 0.016 to 27.240] D: Intervention: 4/12 Control: 1/5 RR 1.667 [95% CI 0.243 to 11.448] E: Intervention: 1/3 Control: 0/5 RR 4.500 [95% CI 0.238 to 85.117]
Obesity improvement Defined as: A: Not reported. B: Before and after mean BMI/SDs, P values, and magnitude of change reported. C: Not defined. D: Improvement = greater than 5% decrease in body weight, body weight before and after mean. E: Weight decrease by ≥3 kg F: Before and after mean BMIs.
D: Intervention: 4/12 Control: 1/8 RR 2.667 [95% CI 0.361 to 19.712] E: Intervention: 2/2 Control: 0/1 RR 3.333 [95% CI 0.287 to 38.752]
Systolic blood pressure: B: MD -10.000 [95% CI -17.250 to -2.750] D: MD -22.800 [95% CI -37.780 to -7.820] F: MD -14.300 [95% CI -36.054 to 7.454]
Diastolic blood pressure: D: MD -14.900 [95% CI -25.082 to -4.718] F: MD -4.800 [95% CI -15.431 to 5.831]
Fasting blood glucose: D: MD -31.600 [95% CI -56.031 to -7.169] F: MD -12.100 [95% CI -37.944 to 13.744] |
Facultative: The authors conclude that a beneficial effect of adrenalectomy compared to conservative management on cardiovascular risk factors in patients with subclinical Cushing’s syndrome is suggested.
No GRADE performed.
Subgroup analyses were performed for dexamethasone suppression test (DST) cortisol cutoff. The three groups were: 1. Cortisol cutoff ≥3 µg/dL, 83 nmol/L 2. Cortisol cutoff <3 µg/dL, 83 nmol/L 3. Studies that did not report DST cortisol cutoff or did not provide how SCS was defined. Subgroup analysis was performed for outcomes hypertension (HTN) and diabetes mellitus type 2 (DM2). Patients in the three subgroups experienced similar rates of HTN and DM2 improvement following adrenalectomy.
Heterogeneity was low for the outcome measures reported.
|
RCT
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Morelli, 2022 |
Data from a randomized clinical trial
Setting and country: Fondazione IRCCS Ca’ Granda, Milan, Italy, IRCCS Istituto Ortopedico Galeazzi, Milan, Italy, and IRCCS “Casa Sollievo della Sofferenza” Hospital, San Giovanni Rotondo, Foggia, Italy.
Source of funding Funded by the Grant RF 2013-02356606 from the Italian Ministry of Health to IC, VM, AS, and SC.
Conflicts of interest: IC received consulting fees from Corcept Therapeutics and HRA Pharma. The remaining authors declare they have no conflicts of interest. |
Inclusion criteria: Age between 40 and 75 years, and diagnosis by imaging of unilateral Adrenal Incidentaloma (AI) larger than 1 cm with radiological features at computed tomography consistent with an adrenocortical adenoma (homogeneous and hypodense, Hounsfield units <10 or with proven radiological dimensional stability).
Exclusion criteria: Hypogonadism, thyrotoxicosis, chronic renal failure and hepatic disease, alcoholism, rheumatologic and hematological disease, and eating disorders, including binge eating disorder, bulimia nervosa, and anorexia nervosa, intake of drugs influencing cortisol and dexamethasone metabolism or cortisol secretion, signs or symptoms specific to hypercortisolism, possible metastatic diseases or radiologic appearance not consistent with an adrenocortical adenoma, biochemical evidence of pheochromocytoma and aldosteronoma, ACTH dependency, and incomplete diagnostic work-up, and patients with AI larger than 5 cm.
N total at baseline: Intervention: 31 Control: 31
Important prognostic factors2: Age ± SD: Intervention: 62.5 ± 10.4 Control: 66.1 ± 9.1
Sex (female): Intervention: 68 Control: 80
Patients with obesity (%): Intervention: 8 (26.7) Control: 8 (32)
Patients with DL (%): Intervention: 15 (60) Control: 21 (70)
SBP (mmHg): Intervention: 139.1 ± 14.0 (100-170) Control: 139.7 ± 15.3 (110-165)
DBP (mmHg): Intervention: 82.2 ± 10.1 (70-100) Control: 77.7 ± 10.2 (60-97)
Patients with HT (%): Intervention: 16 (64) Control: 22 (73)
Patients with diabetes (%): Intervention: 5 (20) Control: 6 (20)
Patients with IGT/IFG (%): Intervention: 7 (28) Control: 9 (30)
Groups were comparable at baseline. |
Intervention: adrenalectomy |
Control: Conservative approach. Patients with borderline-elevated BP or grade 1 hypertension, with prediabetes, or with overweight were suggested to follow intensive lifestyle behaviour changes. Patients with grade 2-3 hypertension, with not fully controlled diabetes, with obesity, or with dyslipidemia were addressed to cardiologists and/or diabetologists. Patients received personalised treatment. |
Length of follow-up: 6 months.
Loss-to-follow-up: Intervention: N=6 (19.4%)
Reasons: consent withdrawal (n=4), cancer occurrence (n=1), death for COVID-19 (n=1)
Control: N=1 (3.2%) Reasons: adrenalectomy for adenoma enlargement (n=1)
Incomplete outcome data: No incomplete outcome data.
|
Patients with obesity: Intervention: 6 (24.0) Control: 7 (23.3) P=1.00
Body weight change (stable/worse/better): Intervention: 19/2/4 (76/8/16) Control: 26/1/3 (86.7/3.3/10) P=0.48
Patients with dyslipidemia: Intervention: 15 (60) Control: 20 (66.7) P=0.41
DL control (stable/worse/better): Intervention: 23/1/1 (92/4/4) Control: 23/4/3 (76.7/13.3/10) P=0.31
SBP (mmHg): Intervention: 133.2 ± 12.8 (105-160) P=0.02
DBP (mmHg): Intervention: 77.1 ± 8.9 (60-90) Control: 78 ± 10.7 (60-100) P=0.74
Patients with HT: Intervention: 14 (56) Control: 22 (73) P=0.14
HT grade: Intervention: 0.6 ± 0.5 (0-2) Control: 1.1 ± 0.8 (0-2) P=0.02
BP control (stable/worse/better): Intervention: 7/1/17 (28/4/68) Control: 18/8/4 (60/26.7/13.4) P=0.001
Patients with DM: Intervention: 5 (20) Control: 6 (20) P=1.00
Patients with IGT/IFG: Intervention: 5 (20) Control: 10 (33.3) P=0.37
DM grade: Intervention: 0.8 ± 1.2 (0-3) Control: 1.1 ± 1.2 (0-4) P=0.34
GL control (stable/worse/better): Intervention: 16/2/7 (64/8/28) Control: 23/6/1 (76.7/20/3.3) P=0.03
Association blood pressure control improvement with surgical or conservative approach: - Surgical approach (yes): OR 3.0 [95% CI 3.8 to 108.3] P<0.001 - Hypertension (yes/no): OR 1.2 [95% CI 0.20 to 6.21] P=0.90 - Diabetes (yes/no): OR 2.34 [95% CI 0.33 to 16.52] P=0.40
|
|
Risk of bias tables
Systematic reviews
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Khan, 2019 |
Yes
Reason: Inclusion criteria and research question are predefined. PICO and research question only match for part of the studies in the SR. |
Yes
Reason: Search period and strategy are described, multiple databases, including Medline, were searched. |
No
Reason: Excluded studies are not referenced. |
Yes
Reason: Study characteristics of included studies are described. |
No
Reason: No multivariate analysis performed. |
Yes
Reason: NIH quality assessment tool for observational cohort and cross-sectional studies was used. |
No
Reason: Clinical heterogeneity exists between studies. Studies are not pooled. |
No
Reason: Publication bias was not assessed. |
No
Reason: Sources of support (nil) were reported for the SR but not for every individual study. |
|
Bancos, 2016 |
Yes
Reason: Inclusion criteria and research question are predefined. PICO and research question only match for part of the studies in the SR. |
Yes
Reason: Search period and strategy are described, multiple databases, including Medline, were searched. |
No
Reason: Excluded studies are not referenced.
|
Yes
Reason: Study characteristics of included studies are described. |
No
Reason: No multivariate analysis performed. |
Yes
Reason: Newcastle-Ottawa tool was used to assess the quality of included observational studies. |
Yes
Reason: Low statistical heterogeneity for pooled data. |
No
Reason: Publication bias was not assessed. |
No
Reason: Sources of support were reported for the SR but not for every individual study. |
RCT
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Morelli, 2022 |
Definitely yes
Reason: Block randomization was used. |
No information
Reason: Not reported. |
No information
Reason: Not reported. |
Definitely no
Reason: Loss-to-follow-up in intervention group was 19.4% and in control group was 3.2%. |
Probably yes
Reason: All outcomes in the methods section are reported in the results. |
Probably no
Reason: Treatments in control group were not standardized, study bias might exist. |
HIGH
Due to lack of information about allocation concealment and blinding, high loss-to-follow-up, and other bias that might exist. |
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Thompson LH, Ranstam J, Almquist M, Nordenström E, Bergenfelz A. Impact of Adrenalectomy on Morbidity in Patients with Non-Functioning Adrenal Cortical Tumours, Mild Hypercortisolism and Cushing's Syndrome as Assessed by National and Quality Registries. World J Surg. 2021 Oct;45(10):3099-3107. doi: 10.1007/s00268-021-06214-0. Epub 2021 Jun 27. PMID: 34180008; PMCID: PMC8408086. |
Does not match with PICO: no comparison with no surgery or follow-up |
|
Sheikh-Ahmad M, Dickstein G, Matter I, Shechner C, Bejar J, Reut M, Sroka G, Laniado M, Saiegh L. Unilateral Adrenalectomy for Primary Bilateral Macronodular Adrenal Hyperplasia: Analysis of 71 Cases. Exp Clin Endocrinol Diabetes. 2020 Dec;128(12):827-834. doi: 10.1055/a-0998-7884. Epub 2019 Oct 21. PMID: 31634962. |
Does not match with PICO: SR on unilateral adrenalectomy for primary bilateral macronodular adrenal hyperplasia |
|
Morelli V, Arosio M, Chiodini I. Cardiovascular mortality in patients with subclinical Cushing. Ann Endocrinol (Paris). 2018 Jun;79(3):149-152. doi: 10.1016/j.ando.2018.03.005. Epub 2018 Mar 30. PMID: 29606280. |
Wrong publication type: communication |
|
Loh HH, Yee A, Loh HS, Sukor N, Kamaruddin NA. The natural progression and outcomes of adrenal incidentaloma: a systematic review and meta-analysis. Minerva Endocrinol. 2017 Mar;42(1):77-87. doi: 10.23736/S0391-1977.16.02394-4. Epub 2015 Dec 23. PMID: 26698544. |
Does not match with PICO: no comparison with surgery |
|
Thomas AZ, Blute ML Sr, Seitz C, Habra MA, Karam JA. Management of the Incidental Adrenal Mass. Eur Urol Focus. 2016 Feb;1(3):223-230. doi: 10.1016/j.euf.2015.12.006. Epub 2016 Feb 3. PMID: 28723391. |
Wrong publication type: communication |
|
Guerin C, Taieb D, Treglia G, Brue T, Lacroix A, Sebag F, Castinetti F. Bilateral adrenalectomy in the 21st century: when to use it for hypercortisolism? Endocr Relat Cancer. 2016 Feb;23(2):R131-42. doi: 10.1530/ERC-15-0541. PMID: 26739832. |
Does not match with PICO: no comparison of surgery with follow-up |
|
Fassnacht M, Arlt W, Bancos I, Dralle H, Newell-Price J, Sahdev A, Tabarin A, Terzolo M, Tsagarakis S, Dekkers OM. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol. 2016 Aug;175(2):G1-G34. doi: 10.1530/EJE-16-0467. PMID: 27390021. |
Wrong publication type: guideline |
|
Iacobone M, Citton M, Scarpa M, Viel G, Boscaro M, Nitti D. Systematic review of surgical treatment of subclinical Cushing's syndrome. Br J Surg. 2015 Mar;102(4):318-30. doi: 10.1002/bjs.9742. Epub 2015 Feb 2. PMID: 25640696. |
Does not add studies to Bancos (2016) |
|
Shen J, Sun M, Zhou B, Yan J. Nonconformity in the clinical practice guidelines for subclinical Cushing's syndrome: which guidelines are trustworthy? Eur J Endocrinol. 2014 Oct;171(4):421-31. doi: 10.1530/EJE-14-0345. Epub 2014 Jul 1. PMID: 24986532. |
Wrong publication type: overview of guidelines |
|
Di Dalmazi G, Berr CM, Fassnacht M, Beuschlein F, Reincke M. Adrenal function after adrenalectomy for subclinical hypercortisolism and Cushing's syndrome: a systematic review of the literature. J Clin Endocrinol Metab. 2014 Aug;99(8):2637-45. doi: 10.1210/jc.2014-1401. Epub 2014 May 30. PMID: 24878052. |
Does not match with PICO: no comparison of surgery with follow-up |
|
Ritzel K, Beuschlein F, Mickisch A, Osswald A, Schneider HJ, Schopohl J, Reincke M. Clinical review: Outcome of bilateral adrenalectomy in Cushing's syndrome: a systematic review. J Clin Endocrinol Metab. 2013 Oct;98(10):3939-48. doi: 10.1210/jc.2013-1470. Epub 2013 Aug 16. PMID: 23956347. |
Does not match with PICO: SR on outcomes of bilateral adrenalectomy in Cushing’s Syndrome |
|
Perysinakis I, Marakaki C, Avlonitis S, Katseli A, Vassilatou E, Papanastasiou L, Piaditis G, Zografos GN. Laparoscopic adrenalectomy in patients with subclinical Cushing syndrome. Surg Endosc. 2013 Jun;27(6):2145-8. doi: 10.1007/s00464-012-2730-5. Epub 2013 Jan 26. PMID: 23355146. |
Does not match with PICO: no comparison with no surgery or follow-up |
|
Chiodini I. Clinical review: Diagnosis and treatment of subclinical hypercortisolism. J Clin Endocrinol Metab. 2011 May;96(5):1223-36. doi: 10.1210/jc.2010-2722. Epub 2011 Mar 2. PMID: 21367932. |
Wrong publication type: narrative review |
|
Toniato A, Merante-Boschin I, Opocher G, Pelizzo MR, Schiavi F, Ballotta E. Surgical versus conservative management for subclinical Cushing syndrome in adrenal incidentalomas: a prospective randomized study. Ann Surg. 2009 Mar;249(3):388-91. doi: 10.1097/SLA.0b013e31819a47d2. PMID: 19247023. |
Included in the review of Khan (2019) |
|
Tabarin A, Bardet S, Bertherat J, Dupas B, Chabre O, Hamoir E, Laurent F, Tenenbaum F, Cazalda M, Lefebvre H, Valli N, Rohmer V; French Society of Endocrinology Consensus. Exploration and management of adrenal incidentalomas. French Society of Endocrinology Consensus. Ann Endocrinol (Paris). 2008 Dec;69(6):487-500. doi: 10.1016/j.ando.2008.09.003. Epub 2008 Nov 20. PMID: 19022420. |
Wrong publication type: consensus document, review |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 07-05-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2021 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen en patiëntvertegenwoordigers (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met bijniertumoren.
Werkgroep
- Prof. dr. M.R. (Menno) Vriens, endocrien oncologisch chirurg, werkzaam in het UMC Utrecht te Utrecht, NVvH (voorzitter)
- Prof. dr. S. (Schelto) Kruijff, endocrien oncologisch chirurg, werkzaam in het UMCG te Groningen, NVvH (voorzitter)
- Prof. dr. R.A. (Richard) Feelders, internist-endocrinoloog, werkzaam in het Erasmus MC te Rotterdam, NIV
- Prof. dr. H.R. (Harm) Haak, internist, werkzaam in het Máxima MC te Eindhoven, NIV
- Drs. J.F. (Julia) Heusdens, anesthesioloog, werkzaam in het UMC Utrecht te Utrecht, NVA
- Prof. dr. R.R. (Ronald) de Krijger, patholoog, werkzaam in het UMC Utrecht/Prinses Máxima Centrum te Utrecht, NVVP
- Drs. J. (Jeroen) Vister, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Dr. M.R. (Max) Dahele, radiotherapeut-oncoloog, werkzaam in het Amsterdam UMC te Amsterdam, NVRO
- Dr. J.F. (Hans) Langenhuijsen, uroloog, werkzaam in het Radboudumc te Nijmegen, NVU
- Dr. B.P.M. (Bernadette) van Nesselrooij, klinisch geneticus, werkzaam in het UMC Utrecht te Utrecht, VKGN
- J.G. (Johan) Beun, manager/coördinator BijnierNET, BijnierNET
- D.D. (Diana) Kwast-Hoekstra, MScN.RN. Verplegingswetenschapper en patientvertegenwoordiger, Bijniervereniging NVACP (tot 31-12-2022)
- Drs. N.T.M. (Nick) van der Meij, verpleegkundig specialist, werkzaam in het UMC Utrecht, te Utrecht, LWEV
Met ondersteuning van
- dr. A. (Anja) van der Hout, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. S. (Sarah) van Duijn, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. M. (Miriam) te Lintel Hekkert, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- drs. I. (Ingeborg) van Dusseldorp, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Vriens (voorzitter) |
Chirurg UMC Utrecht |
Bestuurslid NVvH (tot mei 2021) |
Geen |
Geen restricties |
|
Kruijff (voorzitter) |
Endocrien chirurg UMCG Groningen |
Geen |
Geen |
Geen restricties |
|
Feelders |
- Professor -internist-endocrinoloog Erasmus MC - Adjunct Professor of Medicine New York University U.S.A. |
- Medisch adviseur NVCAP, onbetaald - Bestuurslid Dutch Adrenal Network, onbetaald - Consultant Recordati, betaald |
Geen |
Geen restricties |
|
Beun |
Coordinator van de Stichting BijnierNET, parttime |
Geen |
Geen |
Geen restricties |
|
Langenhuijsen |
Uroloog Radboudumc, Niijmegen |
Bestuurslid Radboudumc Expertisecentrum Bijnierziekten Voorzitter eUROGEN WS 3 Rare genito-urological cancers en Expertise Area coordinator Adrenal tumours |
ZonMw gefinancieerd onderzoek, DoelmatigheidsOnderzoek "Pentixafor PET/CT vs veneuze bijniervenesampling bij subtypering primair hyperaldosteronisme" i..s.m. PentixaPharm GmBH |
Geen restricties |
|
De Krijger |
- Patholoog, UMC Utrecht, 0,2 fte |
- Board member of Perined, Dutch organization supporting perinatal registries (vacatiegeld) - Council Member European Society of Pathology (onbetaald) - International Panel Member of Wilms tumor panel of SIOP Renal Tumor Study Group (onbetaald) - Chair International (European) pediatrie liver tumor panel (PHITT trial) (onbetaald) - Chairmen Dutch/Belgian working group on Pediatrie Pathology (onbetaald) - Associate editor Pediatrie and Developmental Pathology (onbetaald) - Member editorial board Endocrine Pathology (onbetaald) - Member editorial board Virchows Archiv (onbetaald) - Member editorial board Frontiers in Endocrinology (onbetaald) - Editor-in-Chief Cancers, section Pediatrie Oncology (honorarium) - Member editorial board WHO Endocrine and Neuroendocrine Tumors, 5th edition (onbetaald) |
Geen |
Geen restricties |
|
Heusdens |
Anesthesioloog UMC Utrecht
|
Geen |
Geen |
Geen restricties |
|
Haak |
- Internist- endocrinoloog Maxima MC tot 01-09-2023, daarna nul-aanstelling en pensioen - Hoogleraar acute interne geneeskunde MUMC/UM, tot 01-02-2024 |
- Lid algemeen bestuurd BijnierNET - Voorzitter Bijniernetwerk Nederland D.A.N. - Raad van Toezicht Kempenhaeghe, betaald |
Incidenteel grant van HRA
|
Geen restricties |
|
Dahele |
Radiotherapeut/VHD afdeling radiotherapie Amsterdam UMC (locatie VUmc)
|
Geen |
Onderzoek financiering van: Varian Medical Systems (niet gerelateerd aan bijniertumoren) |
Geen restricties |
|
Van Nesselrooij |
Klinisch Genetica, UMC Utrecht (0,8fte)
|
Secretaris van de VKGN (tot 01-01-2023)
|
Geen |
Geen restricties |
|
Kwast (tot 13-12-2022)
|
Bestuurslid Bijniervereniging NVACP te Nijkerk (onbetaald) (tot 13-12-2022) |
Redactielid Bijniervereniging NVACP (onbetaald) (tot 13-12-2022) |
Geen |
Geen restricties |
|
Vister
|
Radioloog, UMCG
|
Geen |
Geen |
Geen restricties |
|
van der Meij
|
Verpleegkundig specialist AGZ, UMC Utrecht, afdeling Endocriene oncologie |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door Patiëntenfederatie Nederland, BijnierNET, Bijniervereniging NVACP, Nederlandse Federatie van Kankerpatiënten organisaties (NFK), Nierstichting, Nierpatiëntenvereniging Nederland uit te nodigen voor de invitational conference en afgevaardigden van BijnierNET en Bijniervereniging NVACP in de werkgroep. Het verslag van de invitational conference (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenorganisaties: Bijniervereniging NVACP, Patiëntenfederatie Nederland, BijnierNET, Nederlandse Federatie van Kankerpatiënten organisaties (NFK), Nierstichting, Nierpatiëntenvereniging Nederland, Nederlandse Hypofyse Stichting en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Wkkgz & Kwalitatieve raming van mogelijke substantiële financiële gevolgen
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Diagnostiek morbus Conn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling morbus Conn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling Cushing |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling feochromocytoom |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Expertisecentrum ACC |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Biopsie bij ongedefinieerde retroperitoneale massa |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Kenmerken CT-scan incidentaloom |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Autonome cortisol (hyper)secretie (subklinische Cushing) |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Behandeling bijniermetastasen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Minimaal invasieve chirurgie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Genetisch testen en chirurgisch beleid |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Pathologieverslag |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Radiologieverslag |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Follow-up |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Module Aandacht bijnierschorsinsufficiëntie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachting geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met bijniertumoren. Tevens zijn er knelpunten aangedragen door de NVvH, NVU, NOV, NVRO, VKGN, Bijniervereniging NVACP, IKNL, NAPA (vakgroep interne geneeskunde), Belangenvereniging Von Hippel-Lindau via een invitational conference. Een verslag hiervan is opgenomen in de bijlage.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
