Diagnostiek van acute Charcot-voet
Uitgangsvraag
D Wat is de optimale methode voor het stellen van de diagnose acute Charcot neuro-osteo-artropathie (ACN) van de voet bij patiënten met diabetes?
Aanbeveling
Initiële diagnose
Overweeg bij iedere patiënt met diabetes mellitus en polyneuropathie die zich presenteert met een rode, gezwollen voet de diagnose acute Charcot neuro-osteo-artropathie (ACN).
Beoordeel bij iedere patiënt bij lichamelijk onderzoek, de aanwezigheid van vormveranderingen van de voet, de aanwezigheid van een voetulcus, pijn, roodheid, temperatuur van de huid, oedeem, arteriële pulsaties en de sensibiliteit; vergelijk hierbij beide voeten.
Verwijs iedere patiënt naar het ziekenhuis voor spoedconsultatie door een multidisciplinair voetenteam indien bij initiële evaluatie de diagnose ACN niet uitgesloten kan worden en adviseer de patiënt dringend de voet zo min mogelijk te belasten.
Verricht onderstaand aanvullend onderzoek als de gevonden afwijkingen niet volledig verklaard kunnen worden door een alternatieve diagnose (zoals voetulcus met infectie, acute jicht aanval, veneuze trombose):
- Laboratoriumonderzoek naar inflammatieparameters (niet of marginaal verhoogd bij ACN).
- Röntgenfoto’s van de voet en enkel (ter vergelijking eventueel beiderzijds): de voet zowel antero-posterieur (AP) (belast), lateraal (belast; dat is inclusief het bovenste spronggewricht ofwel de enkel) als een ¾ opname (onbelast); de enkel AP (onbelast). Bij de laterale voetopname moet de gehele voet in beeld gebracht worden om een eventuele vormafwijking van het lengtegewelf adequaat te kunnen beoordelen
- Een MRI-scan (met contrast) indien op basis van de röntgenfoto’s geen definitieve diagnose gesteld kan worden of als een voetulcus aanwezig is, om te bepalen of er sprake is van een osteomyelitis.
- Verricht een SPECT-scan (single photon emission computed tomography) als een MRI niet mogelijk is.
Immobiliseer de aangedane extremiteit totdat de diagnose ACN onwaarschijnlijk is geworden
Vervolgonderzoek als de diagnose ACN waarschijnlijk is:
- Herhaal de onbelaste en belaste röntgenfoto’s om de progressie en remissie van de aandoening te vervolgen
- Meet op gestandaardiseerde en objectieve wijze bij iedere consultatie de huidtemperatuur.
- Als bij herhaling het temperatuurverschil met de contralaterale voet <2 graden Celsius is en er radiologisch consolidatie van fracturen is opgetreden, is de aandoening waarschijnlijk grotendeels in remissie.
Overwegingen
Hoewel onderzocht in meerdere studies, is de pathogenese van ACN en het onderliggende ziekteproces nog steeds niet opgehelderd. Helaas is er geen gouden standaard voor de diagnose ACN. Andere aandoeningen zoals cellulitis, jicht, distorsie (verstuiking) en diepe veneuze trombose kunnen klinisch dezelfde afwijkingen geven en moeten daarom worden uitgesloten, middels de geëigende diagnostiek. De diagnose ACN moet daarom gesteld worden op basis van de combinatie van klinisch tekenen van (steriele) inflammatie in de voet bij een patiënt met tekenen van sensorische polyneuropathie en radiologisch osteolyse en/of beenmergoedeem. De literatuuranalyse leverde geen andere diagnostische onderzoeken op die in de dagelijkse praktijk kunnen bijdragen aan de diagnose ACN.
Zoals besproken in de module ‘Behandeling diabetische voet’ lijkt het zo vroeg mogelijk stellen van de diagnose ACN van belang om het ontwikkelen van een ernstig gedeformeerde voet te voorkomen. De diagnose is zeer waarschijnlijk bij een patiënt met diabetes mellitus en polyneuropathie die zich presenteert met een warme, gezwollen voet, met tekenen van botresorptie en/of fracturen op een conventionele röntgenfoto, of met beenmergoedeem met oedeem in het aangrenzende weefsel op MRI en waarbij andere verklaringen voor de bevindingen zijn uitgesloten (Rogers, 2011; Milne, 2013). Na de initiële klinische evaluatie is daarom de eerste stap een conventionele röntgenfoto, wordt hierop een of meerdere fissuren/fracturen gezien dan is de diagnose zeer waarschijnlijk. Bij een negatieve foto moet een MRI gemaakt worden omdat deze beginnende afwijkingen kan laten zien, zoals beenmergoedeem, wat op een conventionele röntgenfoto niet zichtbaar is (Rogers, 2011). Als een MRI niet mogelijk is, lijkt een SPECT-scan het beste alternatief, hoewel de specificiteit van deze techniek lager zal zijn omdat deze botscan bij veel verschillende aandoeningen (langdurig) afwijkend kan zijn (Rogers, 2011). Voor de aanvullende diagnostiek is specifieke expertise noodzakelijk. Daarom moet iedere patiënt naar een ziekenhuis verwezen worden voor spoedconsultatie door een multidisciplinair voetenteam, indien bij initiële evaluatie de diagnose ACN niet uitgesloten kan worden. Als de zwelling na een paar dagen bedrust (waarvoor meestal ziekenhuisopname nodig is) afneemt, kan dit – in de ervaring van de richtlijnwerkgroep – de diagnose ACN ondersteunen en bijvoorbeeld de diagnose osteomyelitis onwaarschijnlijker maken. ACN kan optreden bij patiënten met een voetulcus en zal in dat geval onderscheiden moeten worden van een osteomyelitis. Op basis van de bestudeerde literatuur kan misschien ook een normale FDG-PET scan een osteomyelitis minder waarschijnlijk maken, hoewel dit een studie betrof van lage kwaliteit en er in een andere studie bij bijna alle patiënten met ACN, zonder osteomyelitis, een verhoogde FDG opname in de voet werd waargenomen (Basu, 2007; Pickwell, 2011). De plek van FDG-PET scanning in de diagnostiek van ACN is daarom onduidelijk.
Er zijn weinig handvatten die tijdens het beloop van ACN als parameters van ziekteactiviteit gebruikt kunnen worden, naast klinisch onderzoek van de aangedane extremiteit (zowel liggend als met afhangend been, want dan is de hyperemie vaak het meest opvallend), beoordeling van de huidtemperatuur en consolidatie van de fractuur of fracturen middels conventionele röntgenfoto’s. Een temperatuurverschil, gemeten met een infrarood thermometer, van meer dan 2 graden Celsius was in meerdere van de bestudeerde studies een diagnostisch criterium. Deze afkapwaarde wordt ook door experts geadviseerd als maat voor ziekteactiviteit, hoewel de onderbouwing voor dit advies grotendeel lijkt te berusten op expert-opinion (Rogers, 2011; Armstrong, 1997). Ook wordt geadviseerd, op basis van klinische ervaring, na het stellen van de diagnose ACN een belaste röntgenfoto van de aangedane voet te maken en deze tijdens de behandeling te vervolgen. Juist door het maken van belaste opnames kunnen, in de ervaring van de richtlijnwerkgroep, vorm- en standsafwijkingen beter in de loop der tijd vergeleken worden. Of het MRI onderzoek bij de follow-up gebruikt kan worden als maat voor ziekteactiviteit is nog onduidelijk. Een studie van lage kwaliteit suggereerde dat op het moment dat klinisch de tekenen van inflammatie verdwenen zijn, een MRI nog tekenen van beenmergoedeem laat zien (Zampa, 2011). Het is onduidelijk welke consequenties aan deze bevinding gegeven moet worden. Gegeven de lage kwaliteit van de studies en onduidelijkheid van de bevindingen, zijn op basis van de bestudeerde literatuur verschillende parameters van botmetabolisme niet geschikt voor diagnostiek of follow-up.
Tijdens de ontwikkeling van deze richtlijn werd door de National Institute for Health and Care Excellence (NICE) een richtlijn over diabetische voetproblemen uitgebracht (NICE, 2015). Deze NICE richtlijn behandelt ook de diagnostiek en behandeling van ACN en komt tot dezelfde conclusies ten aanzien van de (lage) kwaliteit en inhoud van de literatuur en geeft overeenkomstige adviezen (NICE, 2015).
Onderbouwing
Achtergrond
Een acute Charcot neuro-osteo-artropathie (ACN) van de voet is een zeldzame complicatie van (diabetische) polyneuropathie die gepaard kan gaan met aanzienlijke destructie van het voetskelet. Betrouwbare gegevens over prevalentie en incidentie zijn niet bekend. De richtlijnwerkgroep schat dat de aandoening waarschijnlijk bij 0,1 tot 0,3% van alle patiënten met diabetes mellitus per jaar optreedt. Indien niet tijdig herkend en vervolgens snel behandeld, kan dit leiden tot een ernstig gedeformeerde voet, met aanzienlijk verlies van kwaliteit van leven, recidiverende ulcera en een sterk verhoogde kans op amputatie (Chantelau, 2005; Fabrin, 2000; Raspovic, 2014; Sohn, 2010). De kans is echter groot dat de aandoening gemist wordt doordat de aandoening relatief zeldzaam is en verward kan worden met een distorsie (verstuiking), cellulitis, acute jicht of een veneuze trombose (Wukich, 2011; Chantelau, 2005; Baglionii, 2012). Charcot beschreef de aandoening in 1898 bij patiënten met tabes dorsalis door syfillis, nadien werd de aandoening ook beschreven bij patiënten met andere vormen van zenuwschade zoals diabetische polyneuropathie, alcoholische polyneuropathie en syringomyelie (Hartemann-Heurtier, 2002). Het ziekteproces kan binnen enige weken tot desintegratie en ernstige deformatie van het voetskelet leiden. ACN wordt gekenmerkt door een lokale, steriele inflammatie die gepaard gaat met botresorptie, botdestructie met ontstaan van een of meerdere fracturen en dislocaties waardoor uiteindelijk een gedeformeerde voet ontstaat (Petrova, 2016). Welke mechanismen verantwoordelijk zijn voor het ontstaan van ACN en welke onderliggende processen vervolgens verantwoordelijk zijn voor de lokale inflammatie en botresorptie, is grotendeels onbekend (Petrova, 2016).
De meeste patiënten presenteren zich met een warme en gezwollen voet. In verschillende studies konden 25 tot 50% van de patiënten zich een trauma herinneren en de aandoening kan ook uitgelokt worden door voetchirurgie (Milne, 2013). Door de neuropathie heeft de patiënt relatief weinig klachten. Soms is er matige pijn (Milne, 2013). De activiteit van de aandoening kan in verschillende stadia beschreven worden (de zogenaamde Eichenholtz-classificatie) (Rosenbaum, 2015):
- Stadium 0: Klinisch warmte en zwelling. Röntgenologisch geen afwijkingen, maar op MRI beenmergoedeem en verhoogde activiteit op 3-fase botscan.
- Stadium 1: Klinisch warmte, zwelling erytheem en laxiteit van de ligamenten. Radiologisch osteopenie en fragmentatie met (sub-)luxatie van de gewrichten.
- Stadium 2: Klinisch vermindering van zwelling, roodheid en warmte. Radiologisch sclerosering resorptie van fragmenten en fusie van fracturen.
- Stadium 3: Klinisch verstijving van de voet met stabilisatie van de misvorming. Geen zwelling roodheid of warmte meer. Radiologisch consolidatie van de fracturen.
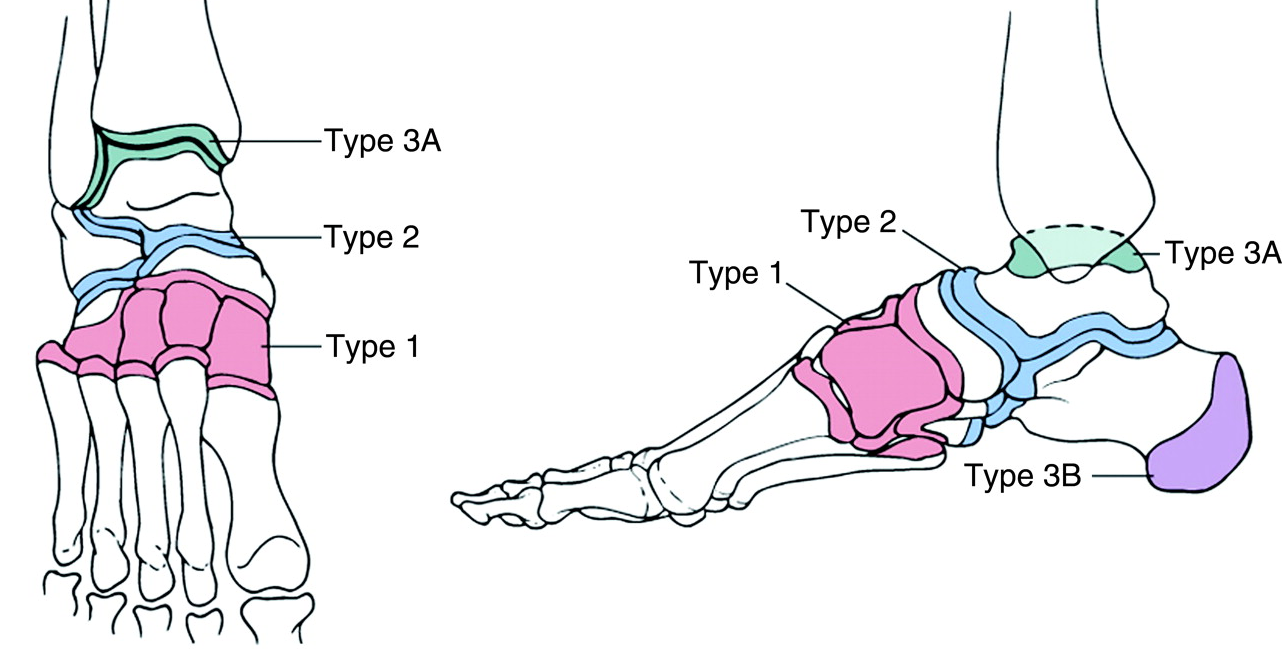
Ook kan de aandoening geclassificeerd worden op basis van de anatomische lokalisatie van de aandoening (figuur 1; Brodsky, 2006). Hierbij geldt dat hoe meer de aandoening proximaal gelokaliseerd is, hoe instabieler de voet en hoe vaker een operatieve behandeling geïndiceerd is.
Figuur 1 Brodsky’s anatomische classificatie van de Charcot voet (Brodsky, 2006) met de meest voorkomende lokalisaties: (A) antero–posterieure en (B) laterale tekeningen met verschillende typen van Charcot voet. Type 1 betreft de tarsometatarsale en naviculocuneiforme gewrichten. Type 2 betreft het subtalaire (=onderste spronggewricht), het talonaviculaire en het calcaneocuboidale gewricht. Type 3A betreft het enkel(=bovenste sprong)gewricht. Type 3B betreft een fractuur van de tuberositas calcanei.
Op basis van de hierboven beschreven publicaties is het beloop van ACN redelijk goed beschreven en wordt benadrukt dat bij iedere patiënt met diabetes mellitus en polyneuropathie, die zich presenteert met een warme en gezwollen voet de diagnose ACN overwogen moet worden. In de dagelijkse praktijk is het stellen van de diagnose ACN soms lastig, waarbij het onduidelijk kan zijn wat de meeste effectieve diagnostische aanpak kan zijn. Dit was de aanleiding voor de richtlijncommissie om te onderzoeken welke diagnostische modaliteiten het beste gebruikt kunnen worden om de diagnose ACN te stellen dan wel uit te sluiten bij een patiënt met diabetes mellitus en polyneuropathie die zich bij zijn behandelaar presenteert met een rode en gezwollen voet en waarvoor niet direct een alternatieve verklaring gevonden kan worden.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Er zijn geen verschillen in algemene patiëntkarakteristieken tussen patiënten met Charcot-voet, patiënten met andere voetaandoeningen of patiënten zonder neuropathie.
Bronnen (Chantelau, 2005; Foltz, 2004; Bem, 2006; Leung, 2009; Christensen, 2010; Christensen, 2011; Wukich, 2011; Chantelau, 2013) |
|
Laag GRADE |
Patiënten met ACN hebben tekenen van polyneuropathie met sensibiliteitsverlies in de voeten.
Bronnen (Chantelau, 2005; Foltz, 2004; Bem, 2006; Leung, 2009; Christensen, 2010; Christensen, 2011; Wukich, 2011; Chantelau, 2013) |
|
Zeer laag GRADE |
Er zijn geen verschillen in sensibiliteit voor vibratie, druk, fijne tast, temperatuur, prik, of propriocepsis tussen patiënten met ACN (en neuropathie) ten opzichte van patiënten met neuropathie zonder ACN in voorgeschiedenis.
Bronnen (Piaggesi, 2002; Christensen, 2011; Chantelau, 2012) |
|
Zeer laag GRADE |
Patiënten met ACN of inactieve Charcot-voet hebben mogelijk een hogere bloedconcentratie carboxy-terminal collagen telopeptide (I-CTP) dan patiënten met neuropathie, diabetes mellitus of gezonde controles.
Bronnen (Jirkovska, 2001; Piaggesi, 2002; Bem, 2006) |
|
Zeer laag GRADE |
Er zijn tegenstrijdige resultaten (wel verschil, geen verschil) over verschillen in de concentratie botspecifiek alkaline fosfatase (b-ALP) en osteocalcine tussen patiënten met ACN, neuropathie, diabetes mellitus of gezonde controles.
Bronnen (Jirkovska, 2001; Piaggesi, 2002; Bem, 2006; Christensen, 2010) |
|
Zeer laag GRADE |
Patiënten met ACN hebben mogelijk een verhoogde bloedstroom naar de aangedane voet in vergelijking met de contralaterale voet en met patiënten met chronische Charcot-voet, neuropathie of zonder neuropathie.
Bronnen (Bem, 2006; Christensen, 2011) |
|
Zeer laag GRADE |
FDG PET-CT heeft mogelijk een hogere negatief voorspellende waarde dan MRI om osteomyelitis in de voet uit te sluiten bij vermoeden op ACN.
Bronnen (Basu, 2007) |
|
Zeer laag GRADE |
Patiënten met een ACN hebben mogelijk een hoger ratio voet : hele lichaam opname van het isotoop dan patiënten met niet-acute Charcot-voet, zoals gemeten met botscintigrafie.
Bronnen (Bem, 2006) |
|
Zeer laag GRADE |
Er lijken geen structurele verschillen in botdichtheid van de wervelkolom tussen patiënten ACN en niet-actieve Charcot-voet, neuropathie, geen neuropathie, of gezonde controles zoals gemeten met Dual Energy X-ray Absorptiometry (DEXA).
Er lijken geen structurele verschillen in botdichtheid van het femur tussen patiënten met ACN en gezonde controles zoals gemeten met Dual Energy X-ray Absorptiometry (DEXA).
Bronnen (Jirkovska, 2001; Piaggesi, 2002; Christensen, 2010) |
|
Zeer laag GRADE |
Patiënten met ACN hebben mogelijk een lagere botdichtheid van de calcaneus zoals gemeten met ultrasonografie dan patiënten met niet-actieve Charcot voet, neuropathie, zonder neuropathie of gezonde controles.
Dit verschil in botdichtheid is mogelijk groter bij patiënten met diabetes type 1 dan bij patiënten met Diabetes type 2.
Bronnen (Jirkovska, 2001; Petrova, 2005; Piaggesi, 2002; Sinacore, 2008) |
|
Zeer laag GRADE |
Genezing op basis van MRI beelden, gedefinieerd als verdwijnen beenmergoedeem, treedt mogelijk later op dan genezing op basis van klinische symptomen.
Bronnen (Zampa, 2011) |
Samenvatting literatuur
Alle studies zijn observationeel, cohortstudies, cross-sectionele studies of case-control studies, prospectief dan wel retrospectief uitgevoerd. Omdat de studies slechts lage kwaliteit en indirecte evidence leveren bij het beantwoorden van de uitgangsvraag, is de individuele studiekwaliteit (risk of bias) niet formeel beoordeeld (voor een nadere toelichting: zie het kopje bewijskracht van de literatuur).
Op één studie na (Formosa, 2013) werden in alle studies daadwerkelijk patiënten met ACN geïncludeerd. Echter, de definitie van ACN verschilde aanzienlijk tussen de studies. Tabel 1 geeft een overzicht van de gehanteerde definities voor ACN in de geïncludeerde literatuur.
Tabel 1 Beschreven diagnostische criteria voor acute Charcot neuro-osteo-artropathie in de geïncludeerde studies.
|
Eerste auteur, jaartal |
Definitie acute Charcot neuro-osteo-artropathie (ACN) |
|
Armstrong, 1997 |
Sanders & Frykberg criteria (1991, 1993) |
|
Basu, 2007 |
Chirurgische en histopathologische bevindingen bij operatief behandelde patiënten; lange termijn follow-up van laboratorium en kliniek (sluiten van een voetulcus bij antibioticagebruik, aanwezigheid van persisterende klachten, klinische, radiografische en laboratoriumuitslagen) bij andere patiënten. |
|
Bem, 2006 |
Niet gerapporteerd |
|
Chantelau, 2005 |
Beginnende ACN: klinische symptomen en botafwijkingen op röntgen (bijvoorbeeld osteoartritis), MRI (bijvoorbeeld beenmergoedeem), CT (bijvoorbeeld verborgen breuklijnen) of scintigrafie (bijvoorbeeld verhoogde isotoopopname). Duidelijke ACN: breuken op röntgen |
|
Chantelau, 2012 |
Chronische inactieve Charcot: Typische skeletafwijkingen op röntgen of MRI, zonder ontstekingsactiviteit (hyperthermie, oedeem, erytheem) |
|
Chantelau, 2013 |
ACN stadium 0: gezwollen, rode en warme voet met diffuse of vlekkerig beenmergoedeem (indicatie voor trabeculaire microbreuken) in twee of meer botten op MRI beelden, met significant zacht weefsel oedeem in het aangrenzende weefsel; in de afwezigheid van corticale breuken (op MRI of röntgen) in patiënten met diabetische neuropathie. ACN stadium 1: gezwollen, rode en warme voet met diffuse of vlekkerig beenmergoedeem met zacht weefsel oedeem in het aangrenzende weefsel, in combinatie met gesloten corticale breuken (op MRI of röntgen) bestaande uit breuklijnen op MRI, eenvoudige metatarsale diafyse breuken en versplinterde breuken (voornamelijk in de tarsale botten en gewrichten) in patiënten met diabetische neuropathie. |
|
Christensen, 2010 |
ACN: Klinische symptomen (warme, gezwollen, rode voet met >2°C verschil tussen de aangedane en niet-aangedane voet, bevestiging door scintigrafie. Chronische Charcot: manifeste voetmisvorming voorafgegaan door ACN, zonder verschil in temperatuur tussen aangedane en niet-aangedane temperatuur. |
|
Christensen, 2011 |
ACN: klinische symptomen (warme, gezwollen, rode voet met >2°C verschil tussen de aangedane en niet-aangedane voet, bevestiging door scintigrafie. Chronische Charcot: manifeste voetmisvorming voorafgegaan door acute Charcot, zonder verschil in temperatuur tussen aangedane en niet-aangedane temperatuur. |
|
Foltz, 2004 |
Radiografisch bewijs van bot- en gewrichtsdestructie, fragmentatie of hermodellering (Cofield, 1983) |
|
Jirkovska, 2001 |
Klinische symptomen: warmte, gezwollen voet, temperatuurverschil aangedane en niet-aangedane voet; diabetische perifere en autonome neuropathie; bevestiging door scintigrafie. |
|
La Fontaine, 2011 |
Klinische symptomen: cutane warmte, erytheem, oedeem, pijn, pulsaties van de dorsalis pedis en/of tibialis posterior; temperatuurverschil van ≥ 2,2°C tussen aangedane en niet-aangedane voet. Radiografische tekenen: verminderde botdichtheid, peri-articulaire fragmentatie, breuken, gewrichtscollaps |
|
Leung, 2009 |
Neuropathie waarbij infectie is uitgesloten; belaste röntgenfoto’s. |
|
Petrova, 2005 |
Klinische symptomen: warme, gezwollen voet; >2°C verschil tussen aangedane en niet-aangedane voet; typische radiologische veranderingen (Sanders & Frykberg, 2001) |
|
Piaggesi, 2002 |
ACN: tenminste drie klinische symptomen: oedeem, erytheem, >2°C verschil tussen aangedane en niet-aangedane voet; afwijkende vorm van de voet; gevoeligheid; abnormale motiliteit; voelbaar knarsen/kraken. Bevestigd door röntgenfoto’s (protocol Cavanagh, 1994) en bij twijfel MRI. |
|
Shagos, 2015 |
Klinische, radiologische en scintigrafische follow-up |
|
Shanmuga, 2007 |
Verhoogde traceropname in tarsale botten, zonder voetulcera. |
|
Sinacore, 2008 |
Bevestiging van duidelijke breuken of luxatie, subluxatie of dislocatie van het gewricht, zonder bewijs van lokale infectie, osteomyelitis of vergaande cellulitis. |
|
Thorning, 2010 |
Niet gerapporteerd |
|
Valabhji, 2012 |
Niet gerapporteerd |
|
Wukich, 2011 |
Inactieve Charcot: klinisch onderzoek, geschiedenis, beschikbare beeldvorming (Rogers, 2009) ACN: Eichenholtz-criteria en radiografisch zichtbare breuken (Eichenholtz, 1966) |
|
Zampa, 2011 |
Tenminste drie klinische symptomen: >2°C verschil tussen aangedane en niet-aangedane voet; oedeem; erytheem; voetmisvorming; gevoeligheid; abnormale motiliteit; voelbaar knarsen/kraken. |
Naast de diagnostische criteria verschilden ook andere patiëntkenmerken tussen studies. Patiënten hadden actieve/acute of inactieve/chronische Charcot-voet; met of zonder botafwijkingen; vermoeden op een diagnose; met of zonder voetulcera; verschillende stadia ACN; unilateraal of bilateraal; en met of zonder osteomyelitis. Niet alleen de definitie van ACN verschilde tussen de studies, maar ook de controlegroepen waren verschillend gedefinieerd. De controlegroepen hadden diabetische neuropathie; neuropathische voetulcera; diabetische osteomyelitis; ongecompliceerde ‘diabetische voet’; chronisch gedeformeerde Charcot-voet; met of zonder botafwijkingen; verschillende stadia ACN; een geamputeerde teen; of verdenking op osteomyelitis/cellulitis. Sommige studies vergeleken meerdere diagnostische methoden, strategieën of karakteristieken bij dezelfde patiënten met ACN, of onderzochten (tevens) het verschil tussen de aangedane en contralaterale voet.
Diagnostische testaccuratesse en betrouwbaarheid – kritieke uitkomstmaten
Zoals eerder aangegeven ontbraken diagnostische studies van hoge kwaliteit. De diagnostische methoden, strategieën of karakteristieken die werden onderzocht zijn zeer divers. Vanwege de grote klinische heterogeniteit die een meta-analyse in de weg staat, kunnen de studies alleen individueel worden beoordeeld. In plaats van een beschrijving van elke studie in de tekst, is gekozen voor een tabel met een overzicht van de belangrijkste karakteristieken en uitkomsten. In tabel 2 staat een overzicht van de karakteristieken die zijn vergeleken en de methoden waarmee deze werden gemeten. De methoden, strategieën of karakteristieken zijn opgedeeld in vier categorieën: patiëntkarakteristieken, sensibiliteit, enzymen en beeldvorming.
Bruikbaarheid en geschiktheid, en kosten - belangrijke uitkomstmaten
Slechts incidenteel wordt in de geïncludeerde studies aandacht besteed aan de bruikbaarheid en geschiktheid, kosten worden nauwelijks belicht. Voor deze aspecten wordt verwezen naar de Overwegingen.
Tabel 2 Diagnostische methoden, strategieën en karakteristieken in vergelijkend onderzoek bij patiënten met ACN in de geselecteerde studies.
|
Diagnostische methode, strategie of karakteristiek |
Meetmethode |
Studies |
Conclusie |
|
PATIËNTKARAKTERISTIEKEN |
|||
|
Algemene patiëntkenmerken |
Dossieronderzoek |
Bem, 2006; Chantelau, 2013; Christensen, 2010; Christensen, 2011; Foltz, 2005; Leung, 2009 |
Geen verschil in leeftijd, geslacht, duur van diabetes, diabetes type, gerapporteerde pijn, A1C, oraal medicatiegebruik, albumine concentratie lengte, gewicht, BMI of mate van perifere somatische neuropathie . Tegenstrijdige resultaten over insulinegebruik. |
|
Ziektegeschiedenis |
Dossieronderzoek |
Foltz, 2005; Leung, 2009 |
Patiënten met een ACN voet hadden vaker een voetulcus en minder vaak van perifeer vaatlijden. Tegenstrijdige resultaten over retinopathie en nefropathie. |
|
Verkeerde eerste diagnose |
Dossieronderzoek |
Chantelau, 2005 |
Patiënten die naar een gespecialiseerd diabetische voetcentrum verwezen zijn nadat botscheurtjes zichtbaar waren hadden vaker een verkeerde eerste diagnose (verrekking, diep-veneuze trombose, vermoeden osteomyelitis, Sudeck’s atrofie, cellulitis en/of reuma) dan patiënten die verwezen zijn voordat botscheurtjes zichtbaar waren. |
|
Tijd van symptomen tot behandeling |
Dossieronderzoek |
Chantelau, 2005; Chantelau, 2013; Wukich, 2011 |
Patiënten die in Eichenholtz-stadium 0 zijn gediagnosticeerd hadden vaker direct een MRI ondergaan in plaats van röntgenfoto’s dan patiënten die in stadium 1 zijn gediagnosticeerd. Geen verschil in tijd van symptomen tot aan behandeling tussen patiënten met diagnose ACN in stadium 0 en stadium 1. Patiënten gediagnosticeerd in stadium 0 die uiteindelijk fracturen kregen, hadden een langere tijd van symptomen tot behandeling. |
|
Tijd van behandeling tot genezing |
Dossieronderzoek |
Chantelau, 2005; Chantelau, 2013 |
Geen verschil in duur van de behandeling tussen stadium 0 en stadium 1 ACN. |
|
Verschil in huidtemperatuur tussen aangedane en contralaterale voet |
Infrarood thermometer |
Armstrong, 1997; Bem, 2006; Sinacore, 2008 |
Er is een temperatuurverschil tussen de aangedane en contralaterale voet bij patiënten met ACN en patiënten met voetulcera, maar niet bij patiënten met asymptomatische perifere sensorische neuropathie of patiënten zonder diabetes of perifere neuropathie. Het temperatuurverschil is groter bij patiënten met actieve dan met niet-actieve Charcot voet. |
|
SENSIBILITEIT |
|||
|
Sensibiliteit van vibratie |
Niet gerapporteerd |
Bem, 2006; |
Geen verschil tussen patiënten met ACN en niet-acute Charcot voet. |
|
|
Stemvork |
Chantelau, 2012; Valabhji, 2012 |
Geen verschil tussen chronische Charcot voet en patiënten met pijnloze neuropathie zonder een verleden van voetulcera of gezonde vrijwilligers zonder diabetes. |
|
|
Neurothesiometer |
Petrova, 2005; |
Geen verschil tussen ACN, contralaterale voet of controles zonder Charcot of voetulcera bij DM type 1; Verminderde sensibiliteit in ACN voet in vergelijking met de contralaterale voet en controles zonder Charcot of voetulcera bij DM type 2 |
|
|
Biothesiometrie |
Christensen, 2011, Piaggesi, 2002 |
Tegenstrijdige bevindingen (geen verschil of juist afgenomen sensibiliteit (vibratiezin)) tussen patiënten met ACN, chronische Charcot, neuropathie, zonder neuropathie, met een geamputeerde eerste teen of gezonde controles. |
|
Druk sensibiliteit |
Gekalibreerde von-Frey hairs /monofilament
|
Chantelau, 2012; Christensen, 2011; |
Tegenstrijdige resultaten. Verhoogde drempel voor druk sensibiliteit bij patiënten met chronische, inactieve Charcot voet in vergelijking met patiënten met pijnloze neuropathie en gezonde controles in studie Chantelau. Geen verschil in sensibiliteit (drukperceptie) tussen patiënten met ACN, chronische Charcot, neuropathie, zonder neuropathie of een geamputeerde eerste teen in studie Christensen. |
|
Fijne tast sensibiliteit |
Watten |
Valabhji, 2012 |
Geen verschil in sensibiliteit (aanrakingszin) tussen de aangedane en contralaterale voet. |
|
Sensibiliteit van koude en hitte |
Thermotest |
Petrova, 2005 |
Geen verschil in sensibiliteit (temperatuurzin) tussen aangedane en contralaterale voet, maar wel met voeten van controle patiënten. |
|
Sensibiliteit van koude |
Koude stemvork |
Valabhji, 2012 |
Geen verschil in sensibiliteit van koude tussen aangedane en contralaterale voet. |
|
Sensibiliteit van prik |
Neurotip prik |
Valabhji, 2012 |
Geen verschil in sensibiliteit van een prik tussen aangedane en contralaterale voet. |
|
Proprioceptie |
Kleine bewegingen |
Valabhji, 2012 |
Geen verschil in sensibiliteit van kleine bewegingen in het gewricht tussen aangedane en contralaterale voet. |
|
BOTMARKERS |
|||
|
Bloedconcentratie carboxy-terminal collagen telopeptide (I-CTP) Botspecifieke alkaline-fosfatase (b-ALP) |
Radioimmunoassay |
Bem, 2006; Jirkovska, 2001; Piagessi, 2002
Bem, 2006; Jirkovska, 2001; Piagessi, 2002 |
De bloedconcentratie carboxy-terminal collagen telopeptide (I-CTP) is hoger bij patiënten met ACN dan bij patiënten met chronische Charcot voet, neuropathie, diabetes of gezonde controles.
Tegenstrijdige resultaten voor het verschil in concentratie tussen patiënten met ACN , chronische Charcot-voet, neuropathie, diabetes of gezonde controles. |
|
Concentratie osteocalcine, type I collageen (S-CTX1) |
Bloedonderzoek met ELISA |
Christensen, 2010 |
Patiënten met ACN voet hadden een hogere concentratie osteocalcine in vergelijking met patiënten zonder neuropathie, maar niet in vergelijking met chronische Charcot, patiënten met neuropathie of met geen geamputeerde teen. Er was geen verschil in de concentratie type I collageen (S-CTX1). |
|
IMAGING |
|||
|
Bloedstroom |
Scintigrafie |
Bem, 2006 |
Patiënten met acute Charcot-voet hadden een significant hogere bloedstroom in de aangedane voet dan patiënten met niet-acute Charcot voet. |
|
|
Venous occlusie plethysmography |
Christensen, 2011 |
Patiënten met ACN of een geamputeerde teen hadden een significant hoger ratio in bloedstroom tussen de aangedane en contralaterale voet dan patiënten met chronische Charcot, neuropathie, of patiënten zonder neuropathie. |
|
Beenmerg signaal afwijkingen |
MRI |
Basu, 2007; Chantelau, 2013; Thorning, 2010; Zampa, 2011 |
De sensitiviteit en specificiteit van MRI bij het diagnosticeren van Charcot-voet (en onderscheid maken met osteomyelitis en weke delen weefsel infectie) waren 76.9% en 75% respectievelijk. Patiënten die eerst een MRI ondergingen hadden een kortere tijd tussen symptomen en behandeling dan patiënten waarbij eerst een röntgenfoto gemaakt werd. Remote areas of signal change in 70 voeten van patiënten met diabetes met verdenking osteomyelitis voorspelden niet de ontwikkeling van een Charcot-voet. De interrater betrouwbaarheid van een fast spin echo inversion recovery sequentie is laag. |
|
|
Dynamic-MRI |
Zampa, 2011 |
Genezing van ACN treedt later op basis van D-MRI dan op basis van klinische symptomen. |
|
Standard uptake value van fluorodeoxyglucose (FDG) |
FDG-PET |
Basu, 2007 |
FDG-PET heeft een hoge negatief voorspellende waarde in het uitsluiten van osteomyelitis bij ACN in vergelijking met MRI: sensitiviteit 100% versus 76.9%, accuratesse 93.8% versus 75,0% |
|
Niet gerapporteerd |
FDG-PET-CT en 3 fasen scintigrafie |
Shagos, 2005 |
Er is een verschil tussen de diagnostisering van ACN, cellulitis of geen afwijking volgens PET-CT of 3 fasen scintigrafie; geen verdere interpretatie van de resultaten mogelijk. |
|
Botkwaliteit |
Scintigrafie |
Bem, 2006; |
Patiënten met ACN hadden een significant hoger ratio voet : hele lichaam opname van het isotoop dan patiënten met niet-acute Charcot voet. |
|
|
Dual Energy X-ray Absorptiometry (DEXA) |
Christensen, 2010; Jirkovska, 2001; Piaggesi, 2002 |
Er is geen verschil tussen de botdichtheid van de wervelkolom gemeten met DEXA tussen patiënten met ACN, niet-actieve Charcot, neuropathie, geen neuropathie, patiënten met een geamputeerde teen of gezonde controles. Er zijn tegenstrijdige bevindingen (lagere botdichtheid of geen verschil in botdichtheid) bij metingen in de femurhals in vergelijking met gezonde controlepatiënten. |
|
|
3 fasen scintigrafie |
Jirkovska, 2001; Shanmuga, 2007 |
De resultaten zijn niet vermeld of onduidelijk. |
|
|
Ultrasonometer/ultrasound |
Jirkovska, 2001; Petrova, 2005; Piaggesi, 2002; Sinacore, 2008 |
Patiënten met Charcot-voet hadden een significant lagere T-score in stijfheid van de calcaneus dan van de contralaterale voet of van patiënten met niet-actieve Charcot, neuropathie, geen neuropathie en gezonde controles. Patiënten met ACN en DM type 1 hebben vaker een lage botdichtheid in de contralaterale voet in vergelijking met gezonde controles dan patiënten met ACN en DM type 2. Patiënten met ACN hebben een lagere botdichtheid dan patiënten met niet-actieve Charcot voet, neuropathie, zonder neuropathie of gezonde controles. |
|
|
Histomicroscopie |
La Fontaine, 2011 |
Patiënten met ACN hadden een lager aantal trabeculae dan gezonde controles, maar niet lager dan patiënten met diabetes. Verdere resultaten zijn alleen kwalitatief beschreven. |
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat diagnostische technieken is met drie niveaus verlaagd vanwege beperkingen in de onderzoeksopzet (hoge risk of bias), inconsistentie (grote variatie in uitkomsten tussen individuele studies) of indirectheid (onduidelijke of afwijkende patiëntenpopulatie), en imprecisie (een gering aantal patiënten, onvoldoende statistische power). Veel studies hadden methodologische beperkingen zoals onduidelijke definities van ACN; onduidelijke definities van de vergelijkende groep; retrospectieve data; het niet blinderen van beoordelaars; het niet testen van diagnostische methoden binnen het gebruikelijke diagnostische pad; het ontbreken van een gouden standaard en onduidelijke omschrijving van de resultaten (methodologische beperkingen).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is een systematische literatuuranalyse verricht naar de volgende zoekvraag: Wat zijn de voor- en nadelen (testaccuratesse met röntgen, MRI en/of nucleaire diagnostiek als gouden standaard, betrouwbaarheid, bruikbaarheid en geschiktheid, kosten) van verschillende methoden (lichamelijk onderzoek, testen) voor de diagnose van een acute Charcot neuro-osteo-artropathie (ACN) van de voet bij volwassen patiënten met diabetes? In een enkele zoekactie is deze zoekvraag naar diagnostische methodes voor Charcot gecombineerd met de zoekvraag naar behandeling van ACN (zie module Behandeling van ACN).
Relevante uitkomstmaten
De werkgroep achtte diagnostische testaccuratesse (sensitiviteit, specificiteit, positieve en negatieve Likelihoods ratio’s) en betrouwbaarheid (reproduceerbaarheid) voor de besluitvorming kritieke uitkomstmaten; en bruikbaarheid en geschiktheid, en kosten voor de besluitvorming belangrijke uitkomstmaten. Met betrekking tot de testaccuratesse is met name een hoge sensitiviteit van belang (een laag percentage fout-negatieven).
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. De uitkomstmaat ‘bruikbaarheid en geschiktheid’ staat voor bruikbaarheid in de dagelijkse praktijk: hanteerbaarheid, tijdsbeslag, begrijpelijkheid voor patiënt en belasting voor de patiënt
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) and Cochrane (via Wiley) is met relevante zoektermen gezocht naar diabetische voet, neuro-osteo-artropathie, Charcot en diagnostiek of therapie vanaf het jaar 1980. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De gecombineerde literatuurzoekactie (diagnostiek en behandeling van ACN) leverde 338 treffers op. In eerste instantie is geselecteerd op systematische reviews naar diagnostiek van ACN en werd een recente systematische review over diagnostiek en behandeling van ACN geïdentificeerd (Milne 2013). Milne (2013) dekt de literatuur tot augustus 2012. Vraagstelling, zoeken en selecteren, en inhoudelijke beschrijving zijn van goede kwaliteit, maar de conclusies zijn niet goed te herleiden naar de onderliggende literatuur. De overall studiekwaliteit is matig (zie risk of bias tabel). Daarom is Milne (2013) wel als basis van de literatuuranalyse gebruikt, maar is de uiteindelijke analyse gebaseerd op de individuele publicaties, aangevuld (geüpdatet) met de eigen zoekactie.
In totaal zijn 354 treffers bekeken op titel en abstract. Studies werden aanvankelijk geselecteerd op grond van de volgende selectiecriteria: 1) inclusie van patiënten met ACN; 2) vergelijkend onderzoek; 3) het testen van diagnostische methoden of strategieën; 4) vergelijking met röntgen, MRI of nucleaire diagnostiek (referentietest); en 5) testkarakteristieken als uitkomstmaat. Geen van de treffers voldeed aan alle criteria. Daarom zijn de inclusiecriteria verbreed, en is geselecteerd op onderzoek naar karakteristieken waarmee eventueel onderscheid gemaakt kan worden tussen patiënten met en zonder ACN. Zodoende zijn alle studies geïncludeerd die karakteristieken vergeleken tussen patiënten met ACN en controle patiënten. Niet voor iedere studie is hierbij specifiek aangegeven of de karakteristiek wel of niet als diagnostisch criterium zou kunnen fungeren. De uiteindelijke selectiecriteria zijn: 1) inclusie van patiënten met ACN; 2) vergelijkend onderzoek; en 3) het testen van diagnostische methoden, strategieën en/of patiëntkarakteristieken. Op basis van titel en abstract werden in eerste instantie 81 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 59 studies geëxcludeerd (zie exclusietabel) en 22 studies definitief geselecteerd.
De literatuuranalyse omvat 22 studies. Omdat geen van deze studies voldoet aan de initiële selectiecriteria, en slechts lage kwaliteit en indirecte evidence leveren bij het beantwoorden van de uitgangsvraag, is de individuele studiekwaliteit (risk of bias) niet formeel beoordeeld (voor een nadere toelichting: zie het kopje bewijskracht van de literatuur) en zijn de belangrijkste studiekarakteristieken en resultaten opgenomen in verkorte evidencetabellen in de richtlijntekst. Omdat er geen eenduidigheid is in het definiëren van ACN, zijn de definities die gehanteerd worden in de geïncludeerde studies opgenomen in een aparte evidence tabel.
Referenties
- Armstrong DG, Lavery LA, Liswood PJ, et al. Infrared dermal thermometry for the high-risk diabetic foot. Phys Ther. 1997;77(2):169-75; discussion 176-7. PubMed PMID: 9037217.
- Baglioni P, Malik M, Okosieme OE. Acute Charcot foot. BMJ. 2012;344:e1397. PMID: 22419788.
- Basu S, Chryssikos T, Houseni M, et al. Potential role of FDG PET in the setting of diabetic neuro-osteoarthropathy: can it differentiate uncomplicated Charcot's neuroarthropathy from osteomyelitis and soft-tissue infection? Nucl Med Commun. 2007;28(6):465-72. PubMed PMID: 17460537.
- Bem R, Jirkovská A, Fejfarová V, et al. Intranasal calcitonin in the treatment of acute Charcot neuroosteoarthropathy: a randomized controlled trial. Diabetes Care. 2006;29(6):1392-4. PubMed PMID: 16732029.
- Bem R, Jirkovská A, Fejfarová V, et al. Intranasal calcitonin in the treatment of acute Charcot neuroosteoarthropathy: a randomized controlled trial. Diabetes Care. 2006;29(6):1392-4. PubMed PMID: 16732029.
- Brodsky JW. The diabetic foot. In: Coughlin MJ, Mann RA and Saltzman CL (eds) Surgery of the foot and ankle. 8th ed. St. Louis, MO: Mosby. 2006;12811368.
- Chantelau E, Wienemann T, Richter A. Pressure pain thresholds at the diabetic Charcot-foot: an exploratory study. J Musculoskelet Neuronal Interact. 2012 Jun;12(2):95-101. Erratum in: J Musculoskelet Neuronal Interact. 2013;13(2):263. PubMed PMID: 22647283.
- Chantelau E. The perils of procrastination: effects of early vs. Delayed detection and treatment of incipient Charcot fracture. Diabet Med. 2005;22(12):1707-12. PubMed PMID: 16401316.
- Chantelau EA, Richter A. The acute diabetic Charcot foot managed on the basis of magnetic resonance imaging--a review of 71 cases. Swiss Med Wkly. 2013;143:w13831. doi: 10.4414/smw.2013.13831. PubMed PMID: 23897135.
- Christensen TM, Bülow J, Simonsen L, et al. Bone mineral density in diabetes mellitus patients with and without a Charcot foot. Clin Physiol Funct Imaging. 2010;30(2):130-4. doi: 10.1111/j.1475-097X.2009.00915.x. Epub 2010 Jan 18. PubMed PMID: 20089075.
- Christensen TM, Simonsen L, Holstein PE, et al. Sympathetic neuropathy in diabetes mellitus patients does not elicit Charcot osteoarthropathy. J Diabetes Complications. 2011;25(5):320-4. doi: 10.1016/j.jdiacomp.2011.06.006. Epub 2011 Aug 2. PubMed PMID: 21813289.
- Fabrin J, Larsen K, Holstein PE. Long-term follow-up in diabetic Charcot feet with spontaneous onset. Diabetes Care. 2000;23(6):796-800. PubMed PMID: 10840999.
- Foltz KD, Fallat LM, Schwartz S. Usefulness of a brief assessment battery for early detection of Charcot foot deformity in patients with diabetes. J Foot Ankle Surg. 2004;43(2):87-92. PubMed PMID: 15057854.
- Formosa C, Gatt A, Chockalingam N. The importance of clinical biomechanical assessment of foot deformity and joint mobility in people living with type-2 diabetes within a primary care setting. Prim Care Diabetes. 2013;7(1):45-50. doi: 10.1016/j.pcd.2012.12.003. Epub 2013 Jan 16. PubMed PMID: 23332418.
- Hartemann-Heurtier A, Van GH, Grimaldi A. The Charcot foot. Lancet. 2002;360:1776-9. PMID: 12480445.
- Idusuyi OB. Surgical management of Charcot neuroarthropathy. Prosthet Orthot Int. 2015;39(1):61-72. doi: 10.1177/0309364614560939. Review. PubMed PMID: 25614502.
- Jirkovská A, Kasalický P, Boucek P, et al. Calcaneal ultrasonometry in patients with Charcot osteoarthropathy and its relationship with densitometry in the lumbar spine and femoral neck and with markers of bone turnover. Diabet Med. 2001;18(6):495-500. PubMed PMID: 11472470.
- La Fontaine J, Shibuya N, Sampson HW, et al. Trabecular quality and cellular characteristics of normal, diabetic, and charcot bone. J Foot Ankle Surg. 2011;50(6):648-53. doi: 10.1053/j.jfas.2011.05.005. Epub 2011 Jun 25. PubMed PMID: 21705241.
- Leung HB, Ho YC, Wong WC. Charcot foot in a Hong Kong Chinese diabetic population. Hong Kong Med J. 2009;15(3):191-5. PubMed PMID: 19494374.
- Milne TE, Rogers JR, Kinnear EM, et al. Developing an evidence-based clinical pathway for the assessment, diagnosis and management of acute Charcot Neuro-Arthropathy: a systematic review. J Foot Ankle Res. 2013;6(1):30. PMID: 23898912.
- NDF (2015). Zorgstandaard Diabetes. Link: http://www.zorgstandaarddiabetes.nl/ [geraadpleegd op 20 januari 2017].
- NICE, National Institute for Health and Care Excellence. Diabetic foot problems: prevention and management (NG19). nice.org.uk/guidance/ng19 (geraadpleegd nov 2015). 2015.
- Petrova NL, Edmonds ME. Acute Charcot neuro-osteoarthropathy. Diabetes Metab Res Rev. 2016;32 Suppl 1:281-6. doi: 10.1002/dmrr.2734. PubMed PMID: 26451965.
- Petrova NL, Foster AV, Edmonds ME. Calcaneal bone mineral density in patients with Charcot neuropathic osteoarthropathy: differences between Type 1 and Type 2 diabetes. Diabet Med. 2005;22(6):756-61. PubMed PMID: 15910628.
- Piaggesi A, Rizzo L, Golia F, et al. Biochemical and ultrasound tests for early diagnosis of active neuro-osteoarthropathy (NOA) of the diabetic foot. Diabetes Res Clin Pract. 2002;58(1):1-9. PubMed PMID: 12161051.
- Pickwell KM, van Kroonenburgh MJ, Weijers RE, et al. F-18 FDG PET/CT scanning in charcot disease: a brief report. Clin Nucl Med. 2011;36:8-10. PMID: 21157199.
- Raspovic KM, Wukich DK. Self-reported quality of life in patients with diabetes: a comparison of patients with and without Charcot neuroarthropathy. Foot Ankle Int. 2014; 35:195-200. PMID: 24351658.
- Rogers LC, Frykberg RG, Armstrong DG, et al. The Charcot foot in diabetes. Diabetes Care. 2011;34:2123-9. PMID: 21868781.
- Rosenbaum AJ, DiPreta JA. Classifications in brief: Eichenholtz classification of Charcot arthropathy. Orthop Relat Res. 2015;473(3):1168-71. PMID: 25413713.
- Shagos GS, Shanmugasundaram P, Varma AK, et al. 18-F flourodeoxy glucose positron emission tomography-computed tomography imaging: A viable alternative to three phase bone scan in evaluating diabetic foot complications? Indian J Nucl Med. 2015;30(2):97-103. doi: 10.4103/0972-3919.152946. PubMed PMID: 25829725.
- Shanmuga SP, Padma S, Kumar H, et al. Role of 99mTc MDP bone and 67Gallium imaging in evaluation of diabetic osteopathy. Foot. 2007;17(2):94-101. doi: 10.1016/j.foot.2006.11.004
- Sinacore DR, Hastings MK, Bohnert KL, et al. Inflammatory osteolysis in diabetic neuropathic (charcot) arthropathies of the foot. Phys Ther. 2008;88(11):1399-407. doi: 10.2522/ptj.20080025. Epub 2008 Sep 18. PubMed PMID: 18801857.
- Sohn MW, Stuck RM, Pinzur M, et al. Lower-extremity amputation risk after charcot arthropathy and diabetic foot ulcer. Diabetes Care. 2010;33(1):98-100. PMID: 19825822.
- Thorning C, Gedroyc WM, Tyler PA, et al. Midfoot and hindfoot bone marrow edema identified by magnetic resonance imaging in feet of subjects with diabetes and neuropathic ulceration is common but of unknown clinical significance. Diabetes Care. 2010;33(7):1602-3. doi: 10.2337/dc10-0037. Epub 2010 Apr 22. PubMed PMID: 20413517.
- Valabhji J, Marshall RC, Lyons S, et al. Asymmetrical attenuation of vibration sensation in unilateral diabetic Charcot foot neuroarthropathy. Diabet Med. 2012;29(9):1191-4. doi: 10.1111/j.1464-5491.2012.03598.x. PubMed PMID: 22276944.
- Wukich DK, Sung W, Wipf SA, et al. The consequences of complacency: managing the effects of unrecognized Charcot feet. Diabet Med. 2011;28:195-8. PMID: 21219429.
- Zampa V, Bargellini I, Rizzo L, et al. Role of dynamic MRI in the follow-up of acute Charcot foot in patients with diabetes mellitus. Skeletal Radiol. 2011;40(8):991-9. doi: 10.1007/s00256-010-1092-0. Epub 2011 Jan 28. PubMed PMID: 21274711.
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur, jaartal |
Reden van exclusie / onderwerp |
|
Systematische review filter |
|
|
Smith, 2007 |
Gaat alleen over interventies |
|
Lowery, 2012 |
Gaat alleen over chirurgische interventies |
|
Sinacore, 1999 |
Geen systematische review |
|
Basu, 2012 |
Geen systematische review |
|
Jeffcoate, 2008 |
Gaat niet over Charcot-voet |
|
RCT filter |
|
|
Lavery, 2015 |
Charcot-voet als exclusiecriterium |
|
Petrova, 2013 |
Geen systematische review |
|
Donegan, 2013 |
Geen systematische review |
|
Bharath, 2013 |
Gaat alleen over interventie met soledronic acid of alendronate |
|
Arts, 2012 |
Gaat alleen over interventie met aangepast schoeisel |
|
Game, 2012 |
Geen vergelijkend onderzoek |
|
Game, 2012 erratum |
Geen vergelijkend onderzoek |
|
Pakarinen, 2011 |
Gaat alleen over interventie |
|
Rathus, 2005 |
Geen systematische review |
|
Chanelau, 1997 |
Gaan alleen over interventie met radiotherapie |
|
Griffith, 1995 |
Geen vergelijkend onderzoek |
|
Andere bronnen of design filter |
|
|
Garcia-Alvarez, 2013 |
Niet gekeken naar Charcot-voet, alleen risicofactoren voor Charcot-voet als uitkomsten |
|
Wukich, 2013 |
Geen vergelijkend onderzoek |
|
Illgner, 2013 |
Geen vergelijkend onderzoek |
|
Wukich, 2013 |
Geen patiënten met Charcot-voet geïncludeerd |
|
Hastings, 2013 |
Alleen beschrijving van de voetafwijkingen bij Charcot-voet en controle |
|
Cullen, 2013 |
Gaat alleen over interventie met ‘midfoot fusion bolt’ |
|
Wiewiorski, 2013 |
Gaat alleen over interventie met ‘solid bolt’ |
|
Cullen, 2013 |
Gaat alleen over interventie met ‘midfoot fusion bolt’ |
|
Rasmussen, 2013 |
Geen patiënten met Charcot-voet geïncludeerd |
|
Shen, 2013 |
Geen systematische review |
|
Kolodziej, 2013 |
Gaat alleen over chirurgische interventie bij cavo-varus voet |
|
Formosa, 2013 |
Geen patiënten met Charcot-voet geïncludeerd. |
|
Moura-Neto, 2012 |
Geen vergelijkend onderzoek |
|
Altindas, 2012 |
Alleen interventie met Boyd’s operatie |
|
Pinzur, 2012 |
Geen systematische review |
|
Evans, 2011 |
Alleen vergelijking tussen verschillende hoogte van de amputatie |
|
Sohn, 2010 |
Alleen vergelijking op risico van amputatie |
|
Poll, 2010 |
Alleen vergelijking Charcot-voet en onaangedane voet met MRI |
|
Georga, 2010 |
Alleen poster abstract |
|
Sella, 2009 |
Geen systematische review |
|
Grant, 2009 |
Alleen tevredenheid na reconstructies van Charcot-voet |
|
Rozzanigo, 2009 |
Alleen diagnostiek van osteomyelitis |
|
Schlossbauer, 2008 |
Alleen beeldvorming met MRI na de diagnose Charcot-voet |
|
Bevan, 2008 |
Alleen risico op infectie na Charcot-voet |
|
Barbaro, 2008 |
Alleen veranderingen in de calciumhuishouding bij perifere neuropathie |
|
Sennevillle, 2006 |
Alleen de bron van infectie bij osteomyelitis bestudeerd |
|
Chantelau, 2006 |
Alleen retrospectief bij Charcot voet naar röntgenfoto’s gekeken, geen vergelijkend onderzoek |
|
Miranda-Palma, 2005 |
Alleen monofilament als diagnostisch instrument bij ulcera |
|
Willrich, 2005 |
Alleen effect van onder andere Charcot-voet op kwaliteit van leven |
|
Pinzur ,2005 |
Alleen relatie tussen BMI en diabetische morbiditeit; onduidelijk abstract |
|
Eckardt, 2004 |
Geen vergelijkend onderzoek; cohortstudie (n=121); x-ray sensitief voor Charcot-voet, maar geen controle |
|
Hopfner, 2004 |
Alleen beeldvorming voor preoperatieve evaluatie |
|
Poirier, 2002 |
Alleen diagnostiek van osteomyelitis |
|
Van der Wall, 2001 |
Alleen osteomyelitis |
|
Simon, 2000 |
Geen vergelijkend onderzoek; behandeling van Charcot-voet, zonder controlegroep |
|
Vesco, 1999 |
Alleen osteomyelitis |
|
Armstrong, 1997 |
Geen vergelijkend onderzoek; alleen cohort met Charcot-voet (n=55), zonder controlegroep |
|
Larcos, 1991 |
Alleen osteomyelitis |
|
Beltran, 1990 |
Alleen osteomyelitis |
Tabel Quality assessment systematic reviews
Table of quality assessment for systematic reviews of diagnostic studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Research question: what is the optimal method to diagnose acute Charcot?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Assessment of scientific quality of included studies?5
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?6
Yes/no/unclear |
Potential risk of publication bias taken into account?7
Yes/no/unclear |
Potential conflicts of interest reported?8
Yes/no/unclear |
|
Milne 2013 |
Yes |
Yes |
Unclear*1 |
Yes*1 |
Unclear*1 |
Unclear*1 |
No |
Unclear*1 |
*1 inclusion and exclusion criteria, and reasons for exclusion specified but not at the level of individual publications; brief descriptions of study characteristics provided; study quality was assessed but not using a validated ROB tool; clinical heterogeneity prevented pooling; authors of the SR report (no) conflicts of interest, but this was not assessed for the studies included in the systematic review; note: description of the results, and the conclusions in the SR are not clearly referenced, thus there is no clear link between conclusions and the study quality (risk of bias) in the underlying publications
- Research question (PICO) and inclusion criteria should be appropriate (in relation to the research question to be answered in the clinical guideline) and predefined
- Search period and strategy should be described; at least Medline searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to the research question (PICO) should be reported
- Quality of individual studies should be assessed using a quality scoring tool or checklist (preferably QUADAS-2; COSMIN checklist for measuring instruments) and taken into account in the evidence synthesis
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, diagnostic tests (strategy) to allow pooling? For pooled data: at least 5 studies available for pooling; assessment of statistical heterogeneity and, more importantly (see Note), assessment of the reasons for heterogeneity (if present)? Note: sensitivity and specificity depend on the situation in which the test is being used and the thresholds that have been set, and sensitivity and specificity are correlated; therefore, the use of heterogeneity statistics (p-values; I2) is problematic, and rather than testing whether heterogeneity is present, heterogeneity should be assessed by eye-balling (degree of overlap of confidence intervals in Forest plot), and the reasons for heterogeneity should be examined.
- There is no clear evidence for publication bias in diagnostic studies, and an ongoing discussion on which statistical method should be used. Tests to identify publication bias are likely to give false-positive results, among available tests, Deeks’ test is most valid. Irrespective of the use of statistical methods, you may score “Yes” if the authors discuss the potential risk of publication bias.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Tabel Evidence table included studies
|
Auteur, jaartal |
Interventie / karakteristiek |
Cases |
Controles |
Diagnostiek van Charcot |
Resultaat Gem (range) |
Conclusie / commentaar |
|
Armstrong, 1997 |
Verschil in huid temperatuur linker- en rechtervoet |
21 DM II patiënten met Charcot voet (Sanders & Frykberg criteria) zonder ulcers, weefsel of botinfectie |
78 DM II patiënten met asymptomatische perifere sensore neuropathie; 44 patiënten met neuropathische voetulcera |
Sanders & Frykberg, 1991 criteria Sanders & Frykberg, 1993 criteria |
Gem. temperatuurverschil (range): Charcot: 32.4°C (28.9°C-35.2°C) aangedaan vs 27.8°C (22.8°C -31.7°C) onaangedaan: 4.6°C (p<0.001)
Ulcera: 31.9°C (25.8°C -34.4°C) aangedaan vs 28.8°C (25.1°C -32.3°C) onaangedaan: 3.1°C (p<0.001)
Sensorische neuropathie: geen verschil |
Er is een verschil in het verschil in huidtemperatuur tussen de aangedane en contralaterale voet bij patiënten met acute Charcot voet en neuropathische voetulcera, maar niet met asymptomatische perifere sensore neuropathie. |
|
Basu, 2007 |
FDG-PET MRI |
17 patiënten (DM type onbekend) met vermoeden op acute Charcot voet |
5 patiënten (DM type onbekend) met diabetische osteomyelitis; 21 patiënten met ongecompliceerde diabetische voet; 20 patiënten zonder DM en met normale ledematen
|
Chirurgische en histopathologische bevindingen voor patiënten die operatief werden behandeld (n=10); Lange-termijn follow-up data op basis van laboratorium en kliniek (bijvoorbeeld sluiten van een ulcer bij antibiotica, aanwezigheid van persisterende klachten, klinische , radiografische en laboratorium resultaten) voor patiënten die niet chirurgisch werden behandeld (n=7). |
SUVmax, gem. (range): Charcot: 1.3 (0.7-2.4) OM: 4.38 (2.9-6.2) DM: 0.5 (0.2-0.8) Norm: 0.42 (0.2-0.7) (p<0.01)
Sensitiviteit: FDG-PET: 100% MRI: 76.9%
Accuratesse: FDG-PET: 93.8% MRI: 75.0% |
FDG-PET heeft een hoge negatieve voorspellende waarde in het uitsluiten van osteomyelitis bij acute Charcot |
|
Bem, 2006 |
Kwantitatieve skeletscintigrafie met een Gamma camera en een intraveneuze injectie van 740 MBq technetium-99m methyleen-difosfaat; Bot afbraak-opbouw parameters
|
21 patiënten (66.7% DMII) met acute Charcot voet (A) |
21 patiënten (66.7% DMII) met niet-acute Charcot voet (N) |
Niet gerapporteerd |
Geen verschil in leeftijd, geslacht, duur van diabetes, DM type, A1C en vibration perception threshold.
1 collageen telopeptide, gem. (SD) µg/l: A: 9.57 (4.16) N: 6.95 (2.32) p<0.05
Bot-specifiek isoenzym van alkaline phosphatase, gem. (SD) µg/l: A: 15.23 (7.90) N: 11.22 (2.66) p<0.05
Verschil in huidtemperatuur aangedane – contralaterale voet, gem. (SD) °C: A: 3.15 (1.22) N: 1.17 (0.46) p<0.001
Blood flow velocity, gem. (SD) m/s: BFV: 11.54 (3.7) N: 9.33 (3.10) p<0.05
Ratio tussen voet opname en hele lichaam opname van het isotoop: A: 5.20 (2.86) N: 3.30 (1.44) P<0.05 |
Bij actieve Charcot voet is een verhoogde concentratie van enzymen voor botafbraak, een groter verschil in temperatuur tussen de aangedane en contralaterale voet en een hoger volume bloedstroom tussen aorta bifurcatie en de aangedane voet in vergelijking met chronische Charcot voet. |
|
Chantelau, 2005 |
Vertraagde versus tijdige verwijzing naar een gespecialiseerd centrum |
11 patiënten met acute Charcot voet (wv 7 DM II) doorgestuurd naar een gespecialiseerde kliniek vóórdat botscheurtjes zichtbaar waren (groep 1). |
13 patiënten met acute Charcot voet (wv 9 DM II) doorgestuurd naar een gespecialiseerde kliniek nadat botscheurtjes zichtbaar waren (groep 2). |
Beginnende Charcot voet: klinische symptomen in combinatie met botafwijkingen op röntgen (bijvoorbeeld osteoartritis), MRI (beenmerg oedeem), CT (verborgen breuklijnen), of bot technetium scan (verhoogde isotoop opname). Duidelijke Charcot voet: breuken op röntgen. |
Verkeerde diagnose Groep 1: 6/11 Groep 2: 13/13 p=0.013).
Verkeerde diagnoses waren verrekking (11), diep-veneuze trombose (3), vermoeden osteomyelitis (4), Sudeck’s atrofie (3), cellulitis (6), en/of reuma (2).
Tijd van symptomen tot gips gem. (range) maanden: Groep 1: 1.0 (0.5-5) Groep 2: 3 (1-12) NS
Tijd van gips tot genezing, gem. (range) maanden: Groep 1: 3 (2-9) Groep 2: 5,5 (2-12) NS |
Meer patiënten met een verlate presentatie hadden een verkeerde diagnose. |
|
Chantelau, 2012 |
Druk(pijn)perceptie |
11 patiënten met chronische inactieve Charcot voet en (een verleden van) neuropathische voetulcera (wv 7 DM II) |
13 controle patiënten met pijnloze neuropathie zonder een verleden van voetulcera (wv 4 DM II); 20 gezonde vrijwilligers (zonder DM) |
Typische skeletafwijkingen op röntgen of MRI, zonder ontstekingsactiviteit (hyperthermie, oedeem, erytheem) bij diabetische neuropathie. |
Geen verschillen in vibration perception threshold, diepe drukpijn gevoelsgrens (>1400 kPa). Cutane drukperceptie gevoelsgrens (>512 mN met von-Frey monofilament) over plantaire teen huidplooi: Charcot: 11 (100%) Neuropathie: 6 (46%) Gezond: 2 (10%) p=0.005 |
De cutane drukperceptie in de teen is verhoogd bij patiënten met Charcot voet in vergelijking met gezonde controles en neuropathie. |
|
Chantelau, 2013 |
MRI |
27 gevallen van acute Charcot voet in Eichenholtz stadium 0 in een onbekend aantal patiënten (in verband met bilaterale Charcot voet). |
44 gevallen van acute Charcot voet in Eichenholtz stadium 1 in een onbekend aantal patiënten (in verband met bilaterale Charcot voet). |
Charcot voet stadium 0: gezwollen, rode en warme voet met diffuse of vlekkerig beenmerg oedeem (indicatie voor trabeculaire microbreuken) in twee of meer botten op MRI beelden, met significante zacht weefsel oedeem in het aangrenzende weefsel; in de afwezigheid van corticale breuken (op MRI of röntgen) in patiënten met diabetische neuropathie. Charcot voet stadium 1: gezwollen, rode en warme voet met diffuse of vlekkerig beenmerg oedeem met zacht weefsel oedeem in het aangrenzende weefsel, in combinatie met gesloten corticale breuken (op MRI of röntgen) bestaande uit breuklijnen op MRI, eenvoudige metatarsale diafyse breuken en versplinterde breuken (voornamelijk in de tarsale botten en gewrichten) in patiënten met diabetische neuropathie. |
Geen verschillen in gerapporteerde pijn, tijd van symptomen tot gips, duur van gipsbehandeling,
Stadium 0: 19 (70%) genezing zonder vervorming Stadium 1: 14 (32%) genezing zonder vervorming. p=0.002
Tijd tot behandeling, gem. (range) maanden MRI eerst: 1 (0.5-2) Röntgen eerst: 2,5 (0,75-5) p<0.02
|
Patiënten die eerst een röntgen ondergingen kregen later behandeling dan patiënten die eerst een MRI ondergingen.
Mogelijke bias omdat onduidelijk is hoe de diagnostische techniek is gekozen.
In totaal zijn 24 patiënten met DM I en 35 patiënten met DM II geïncludeerd, die in totaal 73 gevallen van acute Charcot voet hadden (sommigen hadden bilaterale Charcot voet). |
|
Christensen, 2010 |
Leeftijd; Type diabetes; Duur diabetes; Geslacht; Botdichtheid total body; Botdichtheid AP-spine L2-L4; Botdichtheid calcaneus aangedane en contralaterale voet; Concentratie type I collageen (CTX); Concentratie Osteocalcine (N-MID) |
17 patiënten met acute Charcot voet (wv 12 DM II); 7 patiënten met chronische Charcot voet (wv 6 DM II). |
9 patiënten met diabetes met neuropathie; 11 patiënten met diabetes zonder neuropathie; 5 patiënten met diabetes en een geamputeerde eerste teen. |
Acute Charcot: klinische tekenen (warme, gezwollen rode voet met >2°C temperatuurverschil contralateraal); Bevestiging door scintigrafie;
Chronische Charcot: Manifeste voet misvorming voorafgegaan door acute stage (zoals hierboven), maar zonder temperatuurverschil. |
Geen verschillen in leeftijd, type diabetes, duur van diabetes, geslacht. Geen verschillen in botdichtheid van total body, AP_spine L2-L4, hip total dual, calcaneus aangedane voet, calcaneus contralaterale voet of type I collageen concentratie.
Osteocalcine concentratie (N-MID), gemiddelde ng mL-1 (SD): Acute Charcot: 19.76 (5.75) Chronische Charcot: 16,71 (6,42) Amputatie: 26,58 (33,51) Neuropathie: 13,89 (9,2) Zonder neuropathie: 12,27 (5,06) p=0.02 |
Er was alleen een significant verschil in osteocalcine concentratie tussen de vijf groepen. |
|
Christensen, 2011 |
Leeftijd; Lengte; Gewicht; Duur van diabetes; Mate van perifere somatische neuropathie; Biothesiometrie; Grens van cutane perceptie (monofilament); Symptomen; Variabiliteit in hartslag; Subcutane bloedstroom enkel; Bloedstroom (veneuze plethysmografie) |
17 patiënten met acute Charcot voet (wv 12 DMII); 7 patiënten met chronische Charcot voet (wv 6 DMII). |
9 patiënten met diabetes met neuropathie; 11 patiënten zonder neuropathie; 5 patiënten met een geamputeerde eerste teen |
Acute Charcot: klinische tekenen (warme, gezwollen rode voet met >2°C temperatuurverschil contralateraal); Bevestiging door scintigrafie.
Chronische Charcot: Manifeste voet misvorming voorafgegaan door acute stage (zoals hierboven), maar zonder temperatuurverschil. |
Geen verschillen in leeftijd, lengte, gewicht, duur van diabetes, mate van perifere somatische neuropathie (neuropathy disability score, biothesiometrie, grens van cutane perceptie (CCPT, Semmes-Weinstein monofilament)) (m.u.v. patiënten zonder neuropathie), zelfgerapporteerde symptomen, variabiliteit in hartslag of subcutane bloedstroom in de enkel. Wel een significant hogere bloedstroom tussen de aangedane en contralaterale voet in de Charcot en geamputeerde eerste teen groep; in de andere groepen gelijk.
Acute Charcot: 4.3 (0.9) Chronische Charcot: 0.2 (0.7) Amputatie: 3.0 (0.6) Neuropathie: 0.5 (0.7) Zonder neuropathie: 0.1 (0.1) p<0.05 |
Patiënten met Charcot voet en met een geamputeerde eerste teen hebben een significant hogere bloedstroom in de aangedane voet dan in de contralaterale voet in vergelijking met verschillende controles.
Ratio van 0.1 bij gezonde patiënten is vreemd aangezien de gemiddelde bloedstroom in de aangedane en contralaterale voet vrijwel identiek was; waarschijnlijk moet dit 1.0 zijn. |
|
Foltz, 2005 |
Geschiedenis, verschillende vasculaire en neurologische bevindingen: Perifere hartslag, haargroei, oedeem, voethuid temperatuur, oppervlakkige pijnsensatie, trilgevoeligheid, reflexen, monofilament |
18 patiënten met chronische Charcot voet (wv 15 DM II) |
41 patiënten met diabetes (wv 40 DM II) |
Radiografisch bewijs van bot- en gewrichtsdestructie, fragmentatie of hermodellering (Cofield, 1983)
|
Geen verschillen in geslacht, leeftijd, gewicht, lengte, BMI, duur van diabetes, DM II, of oraal medicatiegebruik.
DM I I: 3 (16,7%) p=0.0450
Insulinegebruik I: 15 (83,3%) p=0.0100
Retinopathie I: 9 (50%) p=0.0200
Nefropathie I: 6 (33,3%) p=0.0030
Geschiedenis ulcer I: 13 (72,2%) p=0.0100 |
Er waren significante verschillen op meerdere karakteristieken tussen Charcot voet en een controlegroep.
Poging om karakteristieken te identificeren om Charcot voet vroegtijdig op te sporen, maar geen duidelijke methode geïdentificeerd.
I= interventie C= controle |
|
Jirkovska, 2001 |
Botkwaliteit: Calcaneal Quantitative Ultrasound (QUS) parameter stijfheid; Botdichtheid (echo); Botdichtheid van de lumbale ruggengraat en de femur (DEXA); Carboxy-terminal telopeptide region of type I collagen (ICTP); Alkaline fosfatase (ALP); Botspecifieke –alkaline fosfatase (b-ALP); Osteocalcine; S-hydroxyproline; U-hydroxyprolin/creatinin |
16 patiënten met acute Charcot voet (wv 4 DMII). |
26 op leeftijd en geslacht gematchte gezonde controles; De gezonde voet van 16 patiënten met acute Charcot voet. |
Klinische tekenen (warme, gezwollen voet, temperatuurverschil aangedane en contralaterale voet); diabetische perifere en autonome neuropathie; bevestiging door scintigrafie.
|
Geen verschil in botdichtheid ruggengraat (gemiddelde T-score), ALP of osteocalcine.
Stijfheid, gemiddelde T-score (SD): Charcot voet: -3,00 (1,39) Contralaterale voet: -2,36 (SD=1,12) Controle: 0,27 (1,25) p<0,001 t.o.v. Charcot voet en contralaterale voet.
Botdichtheid femur, gemiddelde T-score (SD) Charcot: -1,58 (1,24) Controle: -0,76 (0,98) p<0,05
b-ALP, gemiddelde µkat/l (SD) Charcot: 0,72 (0,28) Controle: 0,46 (0,20) p<0,01
ICTP zonder nierfalen, gemiddelde ng/ml (SD) Charcot: 8,49 (4,37) Controle: 3,92 (2,55) p<0,001
ICTP (ng/ml) Charcot:12,96 (SD=10,51) Controle: 3,94 (SD=2,38) p<0,001
S-hydroxyproline zonder nierfalen, gemiddelde µM/l (SD) Charcot: 58,3 (30,3) Controle: 31,5 (14,5) p<0,001
U-hydroxyproline/creatinine zonder nierfalen, gemiddelde µM/mM per 24 uur, SD: Charcot: 15,3 (12,5) Controle: 8,1 (5,9) p<0,01 |
Patiënten met Charcot voet hebben een verminderde botkwaliteit in vergelijking met gezonde controles, te meten met echografie en/of botremodellering markers. |
|
La Fontaine, 2011 |
Botkwaliteit: Histologische botverschillen |
8 patiënten met acute, Charcot voet (wv 8 DM II) |
8 diabetes patiënten zonder Charcot voet (wv 8 DM II); 7 gezonde personen |
Radiografische en klinische tekenen: verminderde botdichtheid, peri-articulaire fragmentatie, breuken, gewrichts collaps op röntgenfoto’s. Cutane warmte, erytheem, zwelling, pijn, palpitaties in de dorsalis pedis en/of posterior tibialis, of een temperatuurverschil van ≥ 2,2°C (≥4°F) met de contralaterale voet. |
Significant verschil in trabeculae number tussen Charcot voet en gezonde personen; verdere verschillen alleen kwalitatief beschreven. |
Patiënten met Chacutearcot voet hebben een verminderde botkwaliteit.
Vergelijking van histologische verschillen van het bot, voornamelijk kwalitatieve resultaten. |
|
Leung, 2008 |
Algemene patiëntkarakteristieken
|
25 patiënten met acute of chronische Charcot voet (DM type onbekend) |
75 op leeftijd en geslacht gematchte patiënten met diabetes die dezelfde Diabetes voet kliniek bezochten. |
Neuropathie waarbij infectie is uitgesloten; belaste röntgenfoto’s. |
Geen verschillen in insuline afhankelijkheid, duur diabetes, albumin concentratie, haemoglobin A1c concentratie, retinopathie of nefropathie.
Perifeer vaatlijden: Charcot: 0% Controle: 18% p=0.002
Neuropathie: Charcot: 100% Controle: 69% p=0.007 |
Beschrijving van algemene patiëntkarakteristieken van een populatie met Charcot voet in vergelijking met controlepatiënten bij dezelfde diabetische voetkliniek in Hong Kong. |
|
Petrova, 2005 |
Botdichtheid Temperatuur perceptie (koud en heet) Vibratie perceptie |
35 patiënten met acute, unilaterale Charcot voet (wv 18 DM II) |
95 patiënten met diabetes (wv 48 DM II) zonder (een verleden van) Charcot voet en voetulceratie |
Presentatie met warme, gezwollen voet; verschil van ≥2°C tussen de aangedane voet en contralaterale voet; en typische radiologische veranderingen (Sanders & Frykberg, 2001). |
Botdichtheid – DM I Charcot: Z-score*: -2.0 (IQR: -2.8;-1.4) Contralaterale voet: Z-score: -1.7 (IQR: -1.9;-1.4) p=0.018 DM I controle: Z-score: -0.2 (IQR: -1.1;0.5) p<0.0001
Botdichtheid – DM II Charcot: Z-score*: -0.2 (IQR: -1.4;0.1) Contralaterale voet: Z-score: 0.15 (IQR: -0.45;0.85) p=0.001 DM II controle: Z-score: 0.3 (IQR: -0.5;0.9) P=0.001
DM I temperatuur: Charcot voet: Heet: 15°C (IQR: 12.8;15) Koud: 15°C (IQR: 12.6;15) Contralaterale voet: Heet: 15°C (IQR: 8.7;15); p = 0.344, Koud: 15°C (IQR: 9.7;15) p = 0.600 Controle: Heet: 7.2°C (IQR: 4.5;15), p = 0.01; Koud: 6°C (IQR: 3.4;11.6), p = 0.001
DM II temperatuur: Charcot voet Heet: 15°C (IQR: 7.8;15), Koud: 12°C (IQR: 7.9;15) Contralaterale voet: Heet: 15°C (IQR: 9.1–15); p = 0.515 Koud: 7.6°C (IQR: 5.6;15); p = 0.115 Controle: Heet: 5.9°C (IQR: 4.5;11.4), p = 0.001; Koud: 3.7°C (IQR: 2.5;7.7), p = 0.001
DM I vibratie: Charcot voet: 30V (IQR: 22;38.5) Contralaterale voet: 29V (IQR: 22;39.5); p=0.235 Controle: 15V (IQR: 10.5;33) p=0,077
DM II vibratie: Charcot: 41V (IQR: 36;50) Contralaterale voet: 10V (IQR: 30;50); p=0.714 Controle: 13.5 (IQR: 7;37,3); p<0.0001 |
In deze studie is een vergelijking gemaakt tussen patiënten met en zonder acute Charcot voet; deze vergelijking is gestratificeerd voor DM I en DM II.
Bij patiënten met DM I was er wel een duidelijk verschil in botdichtheid tussen Charcot voet en de contralaterale voet of controle; bij patiënten met DM II was dit verschil veel kleiner. Mogelijk is botdichtheid alleen bij DM I als diagnostisch criterium te gebruiken.
De controlegroep heeft geen neuropathie, osteomyelitis of een andere diabetische complicatie; hierdoor is onduidelijk in hoeverre deze studie relevante informatie oplevert.
|
|
Piaggesi, 2002 |
Botkwaliteit: Sensibiliteit van trilling; Bloedconcentratie carboxy-terminal collagen telopeptide (ICTP), botspecifieke alkaline fosfatase isoenzyme (B-ALP); osteocalcin (BGP); Urine excretie van deoxypyridinoline (DPD); Botdichtheid (BMD, echo); Quantitative ultrasound index (QUI, echo); Broadband ultrasound attenuation (BUA, echo); Speed of sound (SOS, echo); Botdichtheid van de lumbale ruggengraat en de femur (DEXA) |
A: 15 patiënten met actieve Charcot voet (wv 10 DM II) |
B: 9 patiënten met inactieve Charcot voet (wv 6 DM II); C: 14 patiënten met diabetische neuropathie (wv 10 DM II); D: 13 patiënten zonder neuropathie (wv 9 DM II); E: 15 gezonde personen.
|
Actieve Charcot voet: Tenminste drie van de volgende tekenen: oedeem; erytheem; >2°C temperatuurverschil aangedane en contralaterale voet; afwijkende vorm van de voet; gevoeligheid; abnormale motiliteit; of voelbaar kraken/knarsen. Bevestiging door Röntgenfoto (protocol Cavanagh, 1994) en bij twijfel MRI. |
Trilling: Resultaten alleen in figuur gerapporteerd.
ICTP (µg/L): A: 7.2±2.3 (p<0.01 t.o.v C-E) B: 7.5±3.9 (p<0.01 t.o.v C-E) C: 3.9±1.6 E: 3.8±0.9
B-ALP (µg/L): A: 9.9±3.7 B: 10.4±6.7 C: 10.5±7.5
BGP (µg/L): A: 16.7±8 B: 14.9±5.7 C: 12.7±4.4 E: 20.1±10.6 (p<0.01 t.o.v. C,D)
DPD (ng/mmol): A: 5.1±2.2 B: 4.7±2.1 C: 7.5±4.1 (p<0.01 t.o.v. A,B,D,E) E: 4.1±2.5
BMD (g/cm2) A: 0.3±0.1 (p<0.01 t.o.v. B-E) B: 0.5±0.2
QUI: A: 49.2±19.3 (p<0.01 t.o.v. B-E) B: 88.6±33.4 C:90.7±17.5 E:92.7±17.6
BUA (db/MHz): A: 35.7±16.6 (p<0.01 t.o.v. B-E) B: 70.3±29.1 C: 66.1±15.2 E: 70.1±20.1
SOS (m/s): A: 1475±38 (p<0.01 t.o.v. B-E) B: 1545±53 C: 1551±30 E: ±1557±29
DEXA: geen verschillen |
Mogelijk een rol voor een integrale aanpak voor het diagnosticeren van Charcot voet.
Negatief: Veel vergelijkingen gemaakt in een kleine populatie met 95% betrouwbaarheidsinterval, wat kans op type I fout vergroot.
Positief: Veel verschillende controlegroepen, waardoor het onderscheidend vermogen beter wordt onderzocht. |
|
Shagos, 2015 |
FDG-PET-CT; Drie fasen scintigrafie na methyleen difosfaat intraveneus |
43 patiënten met verdenking chronische en acute Charcot voet (beide DM typen, verhouding onbekend) |
36 patiënten met verdenking osteomyelitis/cellulitis |
Klinische, radiologische en scintigrafische follow-up |
Sensitiviteit en specificiteit alleen berekend voor osteomyelitis; Alleen beelden en de verhouding positief/negatief gegeven voor Charcot: FDG-PET-CT: 22 Charcot, 14 cellulitis, 7 normaal. Scintigrafie: 30 Charcot, 5 cellulitis, 6 normaal. |
Zeer onduidelijke resultatensectie van het artikel, waardoor resultaten onduidelijk. |
|
Shanmuga, 2007 |
Drie fasen scintigrafie met 99m Technetium methyleen difosfaat en 67 Gallium |
37 patiënten met osteomyelitis in combinatie met Charcot voet (n=16) of alleen Charcot voet (n=21). Beide groepen hadden normale röntgenfoto’s. DM type onbekend. |
34 patiënten met osteomyelitis zonder Charcot voet met normale röntgenfoto’s. |
Verhoogde tracer opname in de tarsale botten zonder voetulcera. |
Sensitiviteit en specificiteit alleen berekend voor osteomyelitis. Resultaten voor Charcot voet onduidelijk. |
Onduidelijke resultatensectie; geen sensitiviteit/specificiteit vermeld. |
|
Sinacore, 2008 |
Huidtemperatuur verschil aangedane contralaterale voet; Botdichtheid (echo) Quantitative ultrasound index (QUI, echo); Broadband ultrasound attenuation (BUA, echo); Speed of sound (SOS, echo);
|
32 patiënten (wv 23 DM II), perifere neuropathie en acute/subacute Charcot voet. |
64 patiënten zonder DM, perifere neuropathie of Charcot voet. |
Bevestiging van duidelijke breuken of luxatie van het gewricht of verandering aan het gewricht (subluxatie of dislocatie) consistent met Charchot voet, zonder bewijs van lokale infectie, osteomyelitis of vergaande cellulitis. |
Huidtemperatuur: Charcot: 3,72°C verschil (SD=2.2) Controle: 0°C (SD=0.7) p<0.001
Botdichtheid: Aangedane voet: 384 mg/cm2 (SD=110); Contralaterale voet: 467 mg/cm2 (SD=123). Controle: 545 mg/cm2 (SD=121) P<0.001
QUI: Charcot: 79.7 (SD=19.6) Controle: 98.2 (SD=19.4) P<0.001
BUA (dB/MHz): Charcot: 59.9 (SD=21.8) Controle: 75.4 (SD=16.6) P<0.001
SOS (m/s): Charcot: 1526 (SD=31) Controle: 1544 (SD=135) P<0.001
T-score (SD eenheden): Charcot: -1.38 (SD=1.10) Controle: -0.33 (SD=1.1) P<0.001 |
Patiënten met Charcot voet hebben een verminderde botkwaliteit in vergelijking met gezonde controles. |
|
Thorning, 2010 |
MRI |
1 patiënt met Charcot voet en een neuropathische voetlaesie. DM type onbekend. |
65 patiënten met neuropathische voetlaesies. |
Niet gerapporteerd. |
Patiënt met Charcot voet had geen ‘remote areas of signal change’ of osteomyelitis op de MRI. |
‘Remote areas of signal change’ zijn geen voorspeller voor Charcot voet.
Zeer onduidelijke resultatensectie. |
|
Valabhji, 2012 |
Sensibiliteit van vibratie, prik, aanraking, gewrichtspositie en temperatuur. |
50 patiënten met unilaterale acute of chronische Charcot voet (wv 33 DM II) |
Contralaterale voet van dezelfde patiënten |
Niet gerapporteerd |
Sensibiliteit voor vibratie meer proximaal in de Charcot voet.
Geen verschillen in sensibiliteit voor prik, aanraking, gewrichtspositie of temperatuur. |
Alleen vergelijking tussen Charcot voet en contralaterale voet |
|
Wukich, 2011 |
Vertraging in behandeling (tijd tussen symptomen en correcte diagnose/behandeling) |
A: 7 stadium 0 Charcot voeten van patiënten die uiteindelijk geen actieve Charcot voet kregen. DM type onbekend. |
B: 15 stadium 0 Charcot voeten van patiënten die uiteindelijk actieve Charcot voet kregen. DM type onbekend. |
Inactieve Charcot: klinisch onderzoek, geschiedenis en beschikbare beeldvorming (Rogers, 2009). Actieve Charcot: Eichenholtz criteria en radiografisch zichtbare breuken (Eichenholtz, 1966). |
Weken vertraging in behandeling vanaf start symptomen, gemiddelde (SD): A: 4,1 (0,7) B: 8,7 (6,8) p=0,0262 |
Patiënten waarbij de Charcot in het actieve stadium terecht kwamen hadden een langere tijd tussen eerste symptomen en correcte diagnose/behandeling. |
|
Zampa, 2011 |
Unenhanced MRI; Dynamic MRI na intraveneuze Gadolinium toediening |
Ziekteactiviteit op basis van klinische symptomen bij 40 patiënten met acute Charcot voet (wv 23 DM II) |
Ziekteactiviteit op basis van MRI bij dezelfde 40 patiënten met acute Charcot voet. |
Tenminste drie van de volgende tekenen: Oedeem, erytheem, >2°C temperatuurverschil aangedane en contralaterale voet, voetmisvorming, gevoeligheid, abnormale motiliteit, voelbaar kraken/knarsen. |
Maanden van diagnose tot genezing, gemiddelde (SD): Klinisch: 6,8 (2,3) maanden MRI (geen beenmergoedeem): 8,3 (2,9) maanden p<0.0001
Maanden van diagnose tot genezing (op basis van MRI), gemiddelde (SD): Patiënten met een contrastopname ≤100%: 5,3 (2,7) Patiënten met een contrastopname >100%: 9,1 (2,5) p=0.0003 |
Genezing op basis van klinische symptomen treedt gemiddeld vroeger op dan genezing op basis van MRI (gedefinieerd als geen beenmergoedeem). Contrastopname kan een indicatie geven van de ziekteactiviteit en tijd tot genezing. |
|
°C = Celsius; µg/l = microgram/liter; ALP: alkaline fosfatase; AP-spine = niet gedefinieerd in het artikel; b-ALP = botspecifieke alkaline fosfatase; BGP = osteocalcine; BMD = bone mineral density; BMI = body mass index; BUA: broadband ultrasound attenuation; C = controle; CCPT = cutaneous perception threshold; CI = confidence interval; CTX = collegeen type I concentatie; DEXA: dual energy x-ray absorptiometry; DM = diabetes mellitus; DPD: deoxypyridinoline; FDG-PET-CT = fluorodeoxyglucose positron emissie tomografie computed tomografie; I = interventie; ICTP: carboxy-terminal telopeptide region van type I collagen; IQR: interquartile range; MBq = milliBecquerel; mg = milligram; min = minuut; mL-1 = niet gedefinieerd in het artikel; mN = milliNewton; MRI = magnetic resonancy imaging; N-MID = osteocalcine concentratie; NS=niet significant; OM = osteomyelitis; QUI: quantitative ultrasound index; QUS: quantitative ultrasound; SD = standaard deviatie; SOS: speed of sound; SPECT-CT = single photon emission computed tomografie; SUVmax = maximale standard uptake value. *Z-score: (measurement value – age-matched mean)/age matched population SD. |
||||||
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 14-07-2017
Beoordeeld op geldigheid : 16-12-2021
Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Andere autoriserende partijen:
- Nederlands Huisartsen Genootschap
- WCS Kenniscentrum Wondzorg
- Eerste Associatie van Diabetes Verpleegkundigen
- Nederlandse Vereniging van Podotherapeuten
- ProVoet (Brancheorganisatie voor de Pedicure)
- Nederlandse Vereniging van Diabetes Podotherapeuten
- Wondplatform Nederland
- Diabetesvereniging Nederland
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Patiëntenparticipatie bij deze richtlijn werd mede gefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Doel en doelgroep
Doel
De richtlijn heeft als doelstelling zorgprofessionals handvatten te bieden voor de diagnostiek, preventie en behandeling van deze aandoeningen om ulcera, amputaties en levenslang verlies van mobiliteit en kwaliteit van leven te voorkomen. Een tweede doel is dat zorgprofessionals beter inzicht krijgen in de mogelijkheden en beperkingen van de andere disciplines betrokken bij de zorg voor deze complexe groep patiënten. Tenslotte beschrijft de richtlijn hoe de zorg voor een patiënt met een voetulcus het beste georganiseerd kan worden in Nederland.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de (preventieve) zorg voor patiënten met diabetes mellitus en voetulcera of ACN. Deze beroepsgroepen bestaan onder andere uit huisartsen, praktijkondersteuners, (vaat)chirurgen, orthopedisch chirurgen, internisten, revalidatieartsen, apothekers, podotherapeuten, diabetespodotherapeuten, medisch pedicures, orthopedisch schoentechnici, gipsverbandmeesters, wondverpleegkundigen, wondconsulenten, verpleegkundig specialisten, physician assistants, en diabetes verpleegkundigen.
Samenstelling werkgroep
De richtlijn Diabetische voet is onderdeel van de Netwerkrichtlijn diabetes mellitus ontwikkeld onder overkoepelend voorzitterschap van dr. P.H.L.M. (Nel) Geelhoed, internist-endocrinoloog, Haaglanden Medisch Centrum, Den Haag (Nederlandse Internisten Vereniging).
Voor het ontwikkelen van de richtlijn Diabetische voet is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van relevante specialismen die betrokken zijn bij de zorg voor personen met diabetes mellitus en (een risico op) een diabetische voet (zie hieronder).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Prof. Dr. N.C. (Nicolaas) Schaper, internist-endocrinoloog, Maastricht UMC+ (voorzitter); Nederlandse Internisten Vereniging
- Dr E.J.G. (Edgar) Peters, Internist- Infectieziekten en Acute Geneeskunde, afd. Interne Geneeskunde, VU medisch centrum, Amsterdam; Nederlandse Internisten Vereniging
- M.C.J. (Marion) Knippels, Internist in opleiding (AIOS), Maastricht UMC+; Nederlandse Internisten Vereniging
- J. (Jaap) Kroon, huisarts en kaderarts diabetes, Huisartsenpraktijk Anderegglaan, Nuenen; Nederlands Huisartsen Genootschap
- B.A. (Bela) Pagrach, Diabetes/wondverpleegkundige, Ziekenhuis Amstelland, Amstelveen; WCS Kenniscentrum Wondzorg en Eerste Associatie Van Diabetesverpleegkundigen
- Drs M.A. (Margreet) van Putten, arts, Fontys Hoge Scholen, Eindhoven; Nederlandse Vereniging van Podotherapeuten
- Dr J.G. (Sjef) van Baal, vaatchirurg, ZGT, Almelo; Nederlandse Vereniging voor Heelkunde
- Dr S.A. (Sicco) Bus, bewegingswetenschapper, afd. Revalidatie, AMC, Universiteit van Amsterdam; studiegroep Neurovasculaire Complicaties van Diabetes
- Dr A.P. (Antal) Sanders, revalidatiearts, Leids Universitair Medisch Centrum, Leiden; Nederlandse Vereniging van Revalidatieartsen
- Drs A.E.B. (Arthur) Kleipool, orthopedisch chirurg, OLVG Amsterdam; Nederlandse Orthopaedische Vereniging
- Drs L.A. (Loes) Lemmens, senior beleidsmedewerker, ProVoet; ProVoet (Brancheorganisatie voor de Pedicure)
- P.W.C. (Paul) Buchrnhornen, schoentechnicus, Buchrnhornen Orthopedie BV; op persoonlijke titel
- I. (Ingrid) Ruys, diabetespodotherapeut, Maxima Medisch Centrum, Veldhoven; Nederlandse Vereniging van Diabetes Podotherapeuten en Wondplatform Nederland
- L. (Lian) Stoeldraaijers, diabetespodotherapeut, Podotherapie Valkenswaard, Valkenswaard; Nederlandse Vereniging van Podotherapeuten en Nederlandse Vereniging van Diabetes Podotherapeuten
- Drs D.S.V. (Dayline) Coffie, beleidsadviseur, Diabetesvereniging Nederland
Met ondersteuning van:
- Dr. K.N.J. (Koert) Burger, epidemioloog, senior adviseur Kennisinstituut van Medisch Specialisten
- J. (Joppe) Tra (MSc), adviseur Kennisinstituut van Medisch Specialisten
- C. (Carla) Sloof (MSc), medisch informatiespecialist, St. Antonius Ziekenhuis, Nieuwegein
- L. (Linda) Niesink (MSc), medisch informatiespecialist, Kennisinstituut van Medisch Specialisten
- S.K. (Sanne) Josso, secretaresse, Kennisinstituut van Medisch Specialisten
- N.F. (Natalia) Bullock, secretaresse, Kennisinstituut van Medisch Specialisten
Met dank aan:
- S.A.V. (Suzanne) van Asten, arts, afd. Interne Geneeskunde, VU medisch centrum, Amsterdam
Belangenverklaringen
De “KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Ondernomen actie |
|
Schaper |
hoofd onderafdeling Endocrinologie, interne geneeskunde, Maastricht UMC |
Voorzitter 7e int. Symp on the diabetic foot; Voorzitter international guidance on management of the diabetic foot (International Working Group on the Diabetic Foot) Lid Wetenschappelijke Advies Raad Diabetes Fonds |
geen |
geen |
geen |
geen |
Zie nevenfuncties |
geen |
Geen |
|
Kroon |
Huisarts, Kaderhuisarts Diabetes |
Stafarts Diabetes bij zorggroep PoZoB (betaald. |
geen |
geen |
Lid geweest van Commissie/ Werkgroep: Multidisciplinaire samenwerking rond preventie van Diabetische voetulcera |
geen |
Kaderhuisarts Diabetes, bijzondere belangstelling voor diabetische voet |
nee |
Geen |
|
Van Baal |
Vaatchirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Van Putten |
docent opleiding Podotherapie, Fontys Paramedische Hogeschool Eindhoven |
bestuurslid ProVoet (onkostenvergoeding), bestuurslid NVvP (onkostenvergoeding); bestuursfuncties beëindigd in 2015 |
niet van toepassing |
niet van toepassing |
Zie bestuursfuncties. Het geven van lezingen/cursussen op het gebied van preventie van diabetische voetulcera. |
niet van toepassing |
niet van toepassing |
geen |
Geen |
|
Pagrach |
Diabetesverpleegkundige |
betaald als docent |
Aviescommissie: Lilly |
niet van toepassing |
EADV |
niet van toepassing |
geen |
geen |
Geen |
|
Bus |
Senior onderzoeker |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Lemmens |
senior beleidsmedewerker Provoet |
geen |
geen |
geen |
ruim acht jaar werkzaam in pedicurebranche en wordt duidelijk gezien als vertegenwoordiger van die branche |
geen |
geen |
geen |
Geen |
|
Peters |
internist, aandachtsgebieden infectieziekten en acute geneeskunde VUMC |
Werkgroep: -richtlijn infections desease Soc America: diabetische Voet |
geen |
geen |
geen |
Fond Nuts Ohra: subsidie onderzoek naar chirurgische behandeling neuropathie |
Expertise op gebied diabetische voet en diabetische voet infecties. Geen patent. |
geen |
Geen |
|
Sanders |
Revalidatiearts (65%) |
Lid van Raad van Advies ' Orthopedisch Instrument Makerijken /Orthopedische Schoentechnische Bedrijven van de Stichting Erkenningsregeling voor leveranciers voor Medische Hulpmiddelen (SEMH) (alleen een onkostenvergoeding wordt betaald) |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Kleipool |
meelezer orthopedisch chirurg |
bestuurslid werkgroep Voet en Enkel NOV |
geen |
geen |
bestuurslid werkgroep voet en enkel NOV |
geen |
geen |
geen |
Geen |
|
Buchrnhornen |
orthopedisch schoenmaker |
lid raad van Advies Fontys Hogescholen opleiding podotherapie |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Ruijs |
diabetespodotherapeut Maxima Medisch Centrum te Veldhoven |
vz NVvDP, penningmeester WPN, Bestuurslid ISPO, deelnemer Raad van Advies Fontys Hogescholen, Lid maatschappelijke advies Raad (MAR) Diabetesfonds. Alle genoemde functies zijn onbetaald. |
geen |
geen |
NVvDP en WPN |
geen |
geen |
geen |
Geen |
|
Knippels |
medeauteur als AIOS |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Coffie |
Beleidsadviseur DVN |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Geen |
|
Stoeldraaijers |
diabetespodotherapeut, Podotherapie Valkenswaard |
bestuurslid Ned Ver Diabetes Podotherapeuten (onbetaald), lid werkgroep Kwaliteitsstandaard Complexe Wondzorg (onbetaald), lid commissie Wetenschap & Innovatie Ver Podotherapeuten (onkostenvergoeding) |
geen |
geen |
NVvP en NVvDP |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Het patiëntenperspectief werd ingebracht door een afvaardiging van de patiëntenvereniging in de werkgroep en een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV, 2014). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference (gezamenlijk voor zeven richtlijnen die deel uitmaken van de netwerkrichtlijn diabetes, diabetische voet, diabetische retinopathie, diabetische neuropathie, kinderen, ouderen met comorbiditeit, diabetes en zwangerschap, diabetes en psychiatrie) door: de NIV, Diabetesvereniging Nederland (DVN), Eerste Associatie Van Diabetesverpleegkundigen (EADV), Inspectie voor de Gezondheidszorg, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Menzis, Nefarma, Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlands Huisartsen Genootschap (NHG), Nederlands Oogheelkundig Gezelschap (NOG), Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging van Diëtisten (NVD), Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse Vereniging voor Neurologie (NVN), Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), Nederlandse Vereniging van Diabetes Podotherapeuten (NVvDP), Optometristen Vereniging Nederland (OVN), Provoet (Brancheorganisatie voor de Pedicure), Verpleegkundigen & Verzorgenden Nederland (V&VN), Verenso, WCS Kenniscentrum Wondzorg, Zorgverzekeraars Nederland (ZN), en Zorginstituut Nederland (ZIN). Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of bias (ROB) tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Randvoorwaarden.
Indicatorontwikkeling
Bij de richtlijn zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. Daarnaast werden de volgende verenigingen en organisaties benaderd voor commentaar: Nederlandse Vereniging voor Neurologie, Nefarma (Vereniging innovatieve geneesmiddelen Nederland), Nederlandse Federatie van Universitair Medische Centra, Nederlandse Vereniging voor Klinische Geriatrie, Nierpatiënten Vereniging Nederland, Verpleegkundigen & Verzorgenden Nederland, Verenso, Zorgverzekeraars Nederland, Zorginstituut Nederland, Inspectie voor de Gezondheidszorg, Nederlandse Diabetes Federatie, Stichting LOOP, Stichting Stipezo, Nederlandse Vereniging voor Radiologie, Nederlandse Vereniging voor Hyperbare Geneeskunde, Nefemed, NVOS-Orthobanda, Stichting Ineen. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Zoekverantwoording
|
Database |
|
Totaal |
|
Medline (OVID) 1980 -Augustus 2015 Engels, Nederlands |
(Diabetic Foot/ or ((exp Diabetes Mellitus/ or diabet*.mp.) and (exp Foot ulcer/ or foot.mp. or feet.mp. or pedal.mp. or toe.mp.))) and (exp Arthropathy, Neurogenic/ or neuroarthropath*.mp. or arthropath*.mp. or charcot.mp.) and (exp Diagnosis/ or di.fs. or du.fs. or diagnos*.mp. or exp Therapeutics/ or th.fs. or dt.fs. or rt.fs. or tu.fs. or therap*.mp. or treatment*.mp. or intervention*.mp. or exp Immobilization/ or exp orthopedic fixation devices/ or immobilizat*.mp. or fixat*.mp. or cast*.mp. or splint*.mp. or exp General surgery/ or su.fs. or exp surgical procedures, operative/ or surger*.mp. or surgical*.mp. or operative.mp.) Filters: A) Limit to (yr="1980 -Current" and (dutch or english)) B1) SR: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) B2) RCT: (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) B3) Observationeel: Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. or Cross sectional.tw. or Cross-sectional studies/ |
338 |
|
Embase (Elsevier) 1980 -Augustus 2015 Engels, Nederlands |
'diabetic foot'/exp OR ('diabetes mellitus'/exp OR diabet*.ti,ab. AND ('foot ulcer'/exp OR foot.ti,ab. OR feet.ti,ab. OR pedal.ti,ab. OR toe.ti,ab.)) AND ('neuropathic joint disease'/exp OR arthropath*.ti,ab. OR neuroarthropath*.ti,ab. OR charcot.ti,ab.) AND ('diagnostic procedure'/exp OR 'diagnosis'/lnk OR diagnos*.ti,ab. OR 'therapy'/exp OR 'therapy'/lnk OR 'drug therapy'/lnk OR radiotherapy/lnk OR therap*.ti,ab. OR treatment*.ti,ab. OR intervention*.ti,ab. OR 'orthopedic fixation device'/exp OR immobilizat*.ti,ab. OR fixat*.ti,ab. OR cast*.ti,ab. OR splint*.ti,ab. OR 'surgery'/exp OR 'surgery'/lnk OR surger*.ti,ab. OR surgical*.ti,ab. OR operative.ti,ab.) AND ([dutch]/lim OR [english]/lim) AND [1980-2014]/py Filters: B1) SR: meta analysis'/exp OR 'meta analysis' OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/exp OR 'systematic review' B2) RCT: 'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti NOT 'conference abstract':it B3) Observationeel: 'clinical study'/exp |
|
|
Cochrane library (Wiley) |
diabet* and (foot or feet or pedal or toe) and (neuroarthropath* or arthropath* or charcot):ti,ab,kw |
