Metformine bij insulinetherapie
Uitgangsvraag
Is toevoeging van metformine aan insulinetherapie van meerwaarde bij volwassen patiënten met DM1?
Aanbeveling
Voeg geen metformine toe aan de standaard insulinetherapie bij type 1 diabetes om de metabole controle te verbeteren.
Overweeg in individuele gevallen metformine toe te voegen aan insuline therapie, met name wanneer er ook kenmerken zijn van een metabool syndroom.
Overwegingen
Alleen korte termijn studies (<4mnd) tonen een klinisch relevante reductie in Hba1c van 0,6-0,9% in de metfomine groep. Twee van de drie langere termijn studies, 6-12 maanden (Lund et al., 2008; Walravens et al., 2000) laten eveneens een significante reductie zien van het HbA1c (0,5-0,7%) in de metformine groep na drie maanden follow-up; echter is deze reductie na 6-12 maanden volledig verdwenen. Metformine toevoegen ter verbetering van de lange termijn glycemische controle lijkt dus niet zinvol. Toevoeging van metformine bleek wel de totale dagdosis insuline (TDI) significant te verlagen (6.6 E/dag). Het is sterk de vraag of deze reductie in TDI klinisch relevant is bij iemand die 4x daags insuline spuit. Echter 6.6 E/dag is natuurlijk een gemiddelde, voor een individuele patiënt zou dit meer kunnen zijn.
De studie van Särnblat et al. (2003) bij 26 adolescenten (13 per groep), suggereert dat de insulinegevoeligheid bij de metformine groep is toegenomen na drie maanden behandeling, bepaald met behulp van een hyperinsulinemische euglycemische clamp. Verder laat de studie van Meyer et al. (2002; 62 T1D behandeld met CSII, n=31 per behandelgroep, metformine 1700mg vs. placebo, follow-up 6 maanden) zien dat 23% in de metformine groep vs. 0% in de placebogroep ‘succesvolle responders’ waren (gedefinieerd als een reductie in TDI van >20%, met stabiel of dalend HbA1c en uitblijven van ernstige hypoglycemieën). De dagdosis basale insuline was significant afgenomen in de metformine groep, de prandiale dagdosis daalde niet-significant. Dit pleit ervoor dat metformine ook bij DM1 de hepatische glucose productie kan verminderen. Hoewel dus een verlaging van 6.6 E/dag niet klinisch relevant lijkt, suggereren de 2 bovengenoemde studies, dat het voor een individuele patiënt, degene met bijvoorbeeld hogere nuchtere glucoses en/of hoge basale insuline behoefte, voordeel kan hebben om metformine toe te voegen aan het insuline regime. Dit zouden mensen met DM1 en ook kenmerken van het metabole syndroom (“double diabetes”) kunnen zijn.
Bij de beslissing om metformine toe te voegen aan insulinetherapie kan verder nog gekeken worden naar veiligheid. Ten aanzien van de veiligheid is het aantal hypoglycemieën licht toegenomen na toevoeging van metformine, waarbij dit alleen significant was voor hypoglycemieën met bewusteloosheid tot gevolg (2 vs. 10 gevallen over studieduur van 1 jaar), (Lund et al.,2008). Verder is van metformine bekend dat het een verhoogd risico geeft op lactaat acidose. In geen van de beoordeelde studies wordt hierover iets beschreven. Het risico op lactaat acidose dient meegenomen te worden in de besluitvorming om een patiënt met DM1 met metformine te behandelen bij risicoverhogende omstandigheden, zoals nierfunctiestoornissen, hartfalen of dehydratie.
Omdat lange termijn metformine studies bij patiënten met DM1 ontbreken, kan het effect van metformine op incidentie van cardiovasculaire events en kankerincidentie niet worden beoordeeld.
Onderbouwing
Achtergrond
Metformine is geneesmiddel van eerste keus bij patiënten met DM2, conform Nederlandse (NHG) en buitenlandse richtlijnen (NICE, ADA, IDF). Naast het feit dat metformine goedkoop is en het risico op hypoglycemieën laag, heeft metformine deze eerste keus ook te danken aan gunstige effecten op vermindering van cardiovasculaire incidenten bij DM2, welke behouden blijven tot in ieder geval 10 jaar na het einde van de interventie studie (Holman et al., 2008). Metformine vermindert de glucoseproductie in de lever door remming van de gluconeogenese en glycogenolyse. Daarnaast neemt de perifere gevoeligheid van insuline toe. Metformine lijkt derhalve vooral van meerwaarde bij patiënten met overgewicht en insulineresistentie, en wordt bij DM2 frequent gecombineerd met insulinetherapie. Ook bij mensen met DM1 komt insulineresistentie voor. De vraag is of het toevoegen van metformine aan de standaard insulinebehandeling bij DM1 van meerwaarde is, zoals verbetering van metabole controle, vermindering van totale dagelijkse insulinedosis en verminderen van cardiovasculaire incidenten.
Er is gezocht naar literatuur waarin de effectiviteit van metformine en placebo wordt vergeleken bij patiënten met DM1, op glycemische controle (HbA1c) en totale dagelijkse insulinedosis (TDI), cardiovasculaire morbiditeit en mortaliteit, en bijwerkingen als uitkomstmaat. Er is gezocht vanaf 1-1-2008 op systematische reviews en RCT’s, in de databases Medline, Embase en the Cochrane Library. Uit het totaal van 36 treffers werden op basis van titel en abstract, twee artikelen geselecteerd. Het betreft systematische reviews van studies gepubliceerd tot augustus 2008 (Abdelghaffar & Attia, 2009), en tot oktober 2009 (Vella et al., 2010). De zoekactie leverde geen relevante recentere RCT’s op.
Conclusies / Summary of Findings
|
LAAG |
Metformine behandeling bij patiënten met type 1 diabetes en een matige metabole controle leidt niet tot reductie van HbA1c.
De effectiviteit van metformine op de langere termijn (> 1 jaar) is onbekend.
De effectiviteit van metformine bij patiënten met type 1 diabetes en een goede metabole controle is onbekend.
Vella et al., 2010; Abdelghaffar & Attia, 2009; Walravens et al., 2000; Meyer et al., 2002; Hamilton et al., 2003; Särnblad et al., 2003; Khan et al., 2006; Lund et al., 2008; Jacobsen et al., 2009 |
|
MATIG |
Metformine behandeling van patiënten met type 1 diabetes en een matige metabole controle leidt tot een beperkte reductie in de dagelijkse insulinebehoefte.
De effectiviteit van metformine op TDI is op de langere termijn (> 1 jaar) onbekend
De effectiviteit van metformine op TDI bij patiënten met type 1 diabetes en een goede metabole controle is onbekend.
Vella et al., 2010; Abdelghaffar & Attia, 2009; Walravens et al., 2000; Meyer et al., 2002; Hamilton et al., 2003; Särnblad et al., 2003; Khan et al., 2006; Lund et al., 2008; Jacobsen et al., 2009 |
|
LAAG |
Metformine behandeling bij patiënten met type 1 diabetes en een matige metabole controle leidt tot een licht verhoogde kans op hypoglycemische episodes.
Vella et al., 2010; Abdelghaffar & Attia., 2009; Keen et al., 1987; Meyer et al., 2002; Hamilton et al., 2003; Särnblad et al., 2003; Khan et al., 2006; Lund et al., 2008; Jacobsen et al., 2009 |
|
No Grade |
De effecten van metformine behandeling van patiënten met type 1 diabetes op cardiovasculaire morbiditeit en mortaliteit zijn onbekend.
De langetermijneffecten van metformine op andere belangrijke klinische eindpunten bij patiënten met type 1 diabetes zijn eveneens onbekend.
Vella et al., 2010; Abdelghaffar & Attia, 2009 |
Samenvatting literatuur
De zoekactie leverde twee systematische reviews op (Abdelghaffar & Attia, 2009; Vella et al., 2010). Het Cochrane review (Abdelghaffar & Attia, 2009) richt zich op de effectiviteit van metformine bij adolescenten met DM1, en includeert twee RCT’s (Hamilton et al., 2003; Särnblad et al., 2003). Het tweede en recentere systematische review (Vella et al., 2010) richt zich op alle patiënten met DM1, en includeert naast de twee eerdergenoemde studies nog zeven RCT’s, waarvan zes uitgevoerd bij volwassenen. De inclusiecriteria van Vella et al. (2010) en de belangrijkste karakteristieken van de geselecteerde studies zijn te vinden in de evidence-tabel. In vrijwel alle gevallen gaat het om patiënten met DM1 en een matige metabole controle (HbA1c ≥ 8%). Drie van de negen geïncludeerde RCT’s zijn cross-over studies waarin patiënten in opeenvolgende periodes zowel de interventie als controlebehandeling ondergaan, de overige zes studies hebben een parallel design. De studiegrootte varieert tussen acht en honderd deelnemers, en de studieduur van zeven dagen tot twaalf maanden. Geen van de studies analyseert cardiovasculaire morbiditeit of mortaliteit. In zeven van de negen studies werden HbA1c en de totale dagelijkse insulinedosis, als maten voor de glycemische controle en insulinegevoeligheid, vergeleken tussen metformine- en placebogroep. Het gebruik van metformine (1000 tot 2000 mg per dag) was geassocieerd met een statistisch significante reductie in HbA1c van 0,6-0,9% in vier van de zeven studies, p<0,05 (follow-up 3-4 maanden). In de overige drie studies, met follow-up van 6-12 maanden, was het verschil tussen metformine- en placebogroep statistisch niet significant. Daarnaast was in zes van de zeven studies, de totale insulinedosis gereduceerd in de metforminegroep ten opzichte van de placebogroep met 5,7-10,1 units/dag (p<0,05), in één studie was het verschil niet significant.
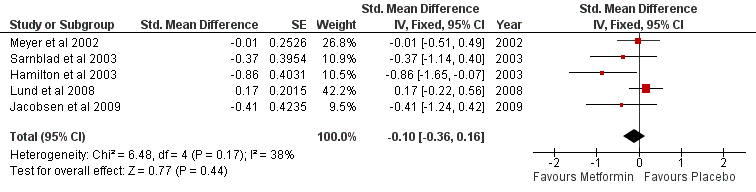
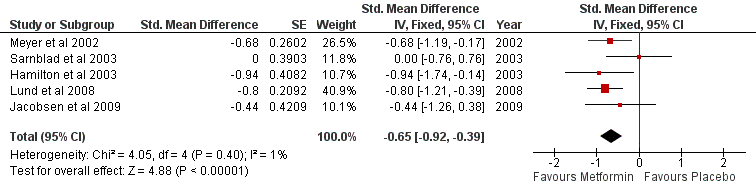
Een meta-analyse werd mogelijk na exclusie van twee studies met een studieduur korter dan één maand (Gin et al., 1985; Keen et al., 1987) en twee studies met onvoldoende details over HbA1c en insuline dosis (Walravens et al., 2000; Khan et al., 2006). In de vijf studies geïncludeerd in de meta-analyse (Meyer et al., 2002; Särnblad et al., 2003; Hamilton et al., 2003; Lund et al., 2008; Jacobsen et al., 2009) varieert de studieduur tussen drie en twaalf maanden. De meta-analyse geeft een statistisch niet significante reductie te zien in Hb1Ac in de metforminegroep ten opzichte van de placebogroep (Figuur 1; gestandaardiseerd verschil van gemiddelden, SMD; SMD= 0,10; 95% BI= [0,36; 0,16]), die overeenkomt met een absolute reductie in HbA1c met 0,11% (p=0,42). De meta-analyse geeft wel een statistisch significante reductie in de totale dagelijkse insulinedosis (TDI) van patiënten in de metforminegroep ten opzichte van de placebogroep (Figuur 2; SMD= 0,65; 95% BI= [0,92; 0.39]). De reductie in insulinebehoefte in de metforminegroep ten opzichte van de placebogroep komt overeen met 6,6 E/dag (p<0,001). Hoewel statisch significant, is het twijfelachtig of een dergelijke beperkte afname in TDI klinisch relevant is. Meyer et al. (1999) noemt bijvoorbeeld een 20% reductie in TDI succesvol. In bovenbeschreven studies is de gemiddelde dagdosis insuline rond de 1E/kg lichaamsgewicht, wat neerkomt op maximaal 10% daling in insulinedosis.
Figuur 1 Vergelijking in effectiviteit tussen metformine en placebo. Effectiviteit is gebaseerd op een vergelijking van HbA1c waardes (standardized mean difference, MSD).
Figuur 2 Vergelijking in effectiviteit tussen metformine en placebo. Effectiviteit is gebaseerd op een vergelijking van de insulinebehoefte, de totale dagelijkse insulinedosis (standardized mean difference, MSD).
 In zeven van de negen RCT’s wordt de incidentie of frequentie van hypoglycemische episodes vergeleken tussen de metformine- en placebogroep. De kans op een hypoglycemische episode lijkt enigszins verhoogd in de metforminegroep, maar bereikt vrijwel nooit statistische significantie (zie evidence-tabel). In de RCT met de grootste omvang en studieduur (Lund et al., 2008), is de frequentie van milde hypoglycemie (per patiënt per maand) 9,0 in de metforminegroep versus 6,4 in de placebogroep (p=0,3; statistisch niet significant). Een ernstige hypoglycemische episode kwam voor bij 31% van de patiënten in de metforminegroep versus 20% in de placebogroep (p=0,2; statistisch niet significant), waarbij bewusteloosheid optrad in 10 versus 2 gevallen (p<0,05). Het aantal patiënten dat gastrointestinale bijwerkingen rapporteert was vergelijkbaar tussen de behandelgroepen (43 versus 39; p=0,3; statistisch niet significant). Cardiovasculaire symptomen waren zeldzaam en de incidentie verschilde niet significant tussen metformin- en placebogroep. Geen van de studies rapporteert lactaat acidose als mogelijke complicatie.
In zeven van de negen RCT’s wordt de incidentie of frequentie van hypoglycemische episodes vergeleken tussen de metformine- en placebogroep. De kans op een hypoglycemische episode lijkt enigszins verhoogd in de metforminegroep, maar bereikt vrijwel nooit statistische significantie (zie evidence-tabel). In de RCT met de grootste omvang en studieduur (Lund et al., 2008), is de frequentie van milde hypoglycemie (per patiënt per maand) 9,0 in de metforminegroep versus 6,4 in de placebogroep (p=0,3; statistisch niet significant). Een ernstige hypoglycemische episode kwam voor bij 31% van de patiënten in de metforminegroep versus 20% in de placebogroep (p=0,2; statistisch niet significant), waarbij bewusteloosheid optrad in 10 versus 2 gevallen (p<0,05). Het aantal patiënten dat gastrointestinale bijwerkingen rapporteert was vergelijkbaar tussen de behandelgroepen (43 versus 39; p=0,3; statistisch niet significant). Cardiovasculaire symptomen waren zeldzaam en de incidentie verschilde niet significant tussen metformin- en placebogroep. Geen van de studies rapporteert lactaat acidose als mogelijke complicatie.
Bij beoordelen van de studies volgens GRADE is de bewijskracht matig voor effecten van metformine behandeling op de totale dagelijkse insulinedosis, er is één punt afgetrokken vanwege ernstige imprecisie (kleine studiegrootte, ook na poolen in de meta-analyse). Bij het bepalen van de bewijskracht voor de effecten van metformin op HbA1c en het optreden van bijwerkingen, is een tweede punt afgetrokken voor imprecisie omdat de betrouwbaarheidsintervallen het nuleffect omvatten. De studiepopulaties bestonden vrijwel geheel uit patiënten met DM1 met een matige metabole controle. Onbekend is de effectiviteit van metformine bij DM1 patienten die een goede metabole controle bezitten. Door de korte duur van de RCT’s kan ook geen uitspraak worden gedaan over de effectiviteit van metformine behandeling op de langere termijn. Tenslotte is door de korte duur en geringe omvang van de RCT’s onbekend of metformine de verhoogde cardiovasculaire morbiditeit en mortaliteit van patiënten met DM1 verlaagt.
Referenties
- Abdelghaffar, S., & Attia, A.M. (2009). Metformin added to insulin therapy for type 1 diabetes mellitus in adolescents. Cochrane Database Syst Rev, 1, CD006691.
- Gin, H., Messerchmitt, C., Brottier, E., & Aubertin, J. (1985). Metformin improved insulin resistance in type I, insulin-dependent, diabetic patients. Metabolism, 34, 923925.
- Hamilton, J., Cummings, E., Zdravkovic, V., Finegood, D., & Daneman, D. (2003). Metformin as an adjunct therapy in adolescents with type 1 diabetes and insulin resistance: a randomized controlled trial. Diabetes Care, 26, 138143.
- Holman, R.R., Paul, S.K., Bethel, M.A., Matthews, D.R., & Neil, H.A. (2008). 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med., 359, 15771589.
- IDF Clinical Guidelines Task Force. (2005). Global guideline for Type 2 diabetes. Brussels: International Diabetes Federation.
- Jacobsen, P.K., Lund, S.S., & Tarnow, L. (2007). Impact of metformin treatment on glycaemic control and cardiovascular risk-factors in patients with poorly controlled type 1 diabetes (T1DM). Diabetologia, 50(1), S107.
- Keen, H., Collins, A.C.G., & Bending, J.J. (1987). Metformin increases response to insulin in type-1 (insulin-dependent) diabetes. Diabetologia, 30, A538.
- Khan, A.S., McLoughney, C.R., & Ahmed, A.B. (2006). The effect of metformin on blood glucose control in overweight patients with type 1 diabetes. Diabet Med., 23, 10791084.
- Lund, S.S., Tarnow, L., Astrup, A.S., Hovind, P., Jacobsen, P.K., Alibegovic, A.C., Parving, I., Pietraszek, L., . (2008). Effect of adjunct metformin treatment in patients with type-1 diabetes and persistent inadequate glycaemic control. A randomized study. PLoS One, 3, e3363.
- Meyer, L., Delbachian, I., Lehert, P., Cugnardey, N., Drouin, P., & Guerci, B. (1999). Continuous subcutaneous insulin infusion in type 1 diabetes: insulin-sparing effect of metformin. Diabetologia, 42(1), A226.
- Nathan, D.M., Buse, J.B., Davidson, M.B., Ferrannini, E., Holman, R.R., Sherwin, R., Zinman, B. & American Diabetes Association; European Association for Study of Diabetes. (2009). Medical management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia, 52, 1730.
- National Collaborating Centre for Chronic Conditions (UK). (2008). Type 2 Diabetes: National Clinical Guideline for Management in Primary and Secondary Care (Update). London: Royal College of Physicians (UK). (NICE Clinical Guidelines, No. 66.). http://www.nice.org.uk
- Särnblad, S., Kroon, M., & Aman, J. (2003). Metformin as additional therapy in adolescents with poorly controlled type 1 diabetes: randomised placebo-controlled trial with aspects on insulin sensitivity. Eur J Endocrinol., 149, 323329.
- Vella, S., Buetow, L., Royle, P., Livingstone, S., Colhoun, H. M., & Petrie, J.R. (2010). The use of metformin in type 1 diabetes: a systematic review of efficacy. Diabetologia, 53, 809-820.
- Walravens, P.A., Chase, P.H., Klingensmith, G.J., Ellison, M., Cornell, C., & Monahan, K. (2000). Low dose metformin in adolescents with type 1 diabetes mellitus: a double blind, controlled study. Diabetes, 49(1), A128.
Evidence tabellen
Evidence table for intervention studies
Research question: Does addition of metformin to the insulin regime improve treatment of patients with type 1 diabetes?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Vella et al, 2010
[individual study characteristics deduced from Vella et al, 2010] |
SR and meta-analysis of 9 RCTs
Literature search up to Oct 2009
Parallel group (C,D,E,F,H,I), or cross-over design (A,B,G)
A: Gin, 1985 B: Keen, 1987 C: Walravens, 2000 D: Meyer, 2002 E: Hamilton, 2003 F: Särnblad, 2003 G: Khan, 2006 H: Lund, 2008 I: Jacobsen, 2009
B/C: abstract only (further data not available)
Source of funding: D: LIPHA France (manufacturer metformin) E: non-commercial F: non-commercial; supported by Merck (provided drug and placebo) H: non-commercial; authors report equity in Novo Nordisk; drugs provided by Hexal A/S I: non-commercial; drugs provided by GEA A/S
|
Inclusion criteria SR: randomisation, informed consent., patients with type 1 diabetes, metformin vs placebo or comparator drug, study duration ≥ 1 week; 9 studies included
Studies typically include patients with poor metabolic control (HbA1c ≥ 8%)
N, mean age A: 10 patients, 41 yrs B: 8 patients, ‘adults’ C: 80 patients, 16 yrs D: 62 patients, 41 yrs E: 30 patients, 16 yrs F: 30 patients, 17 yrs G: 15 patients, 48 yrs H: 100 patients, 46 yrs I: 24 patients, 40 yrs
HbA1c (%) at baseline A: 10.0 B: not stated C: 9.6 D: 7.6 E: 9.4 (I), 8.9 (C) F: 9.3 G: 8.6 H: 9.5 I: 8.9 (I), 9.3 (C)
Mean weight (kg) A: 62 B: 84 C: 68 D: 76 E: 63 (I), 71 (C) F: 68 G: 92 H: 80 I: 90
G/I: only included patients with overweight |
Metformin
Daily metformin dose A: 1,700 mg B: 1,500 mg C: 1,000 mg D: 1,700 mg E: up to 2,000 mg (weight dep.) F: forced titration to 2,000 mg G: forced titration to 2,000 mg H: forced titration to 2,000 mg I: forced titration to 2,000 mg
|
Placebo
|
Endpoint of follow-up:
A: 7 days (!) B: 3 wks (!) C: 6 months D: 6 months E: 3 months F: 3 months G: 4 months H: 12 months I: 6 months
For how many participants were no complete outcome data available?
A: 0 (0%) B: not stated C: not stated D: 3/62 (5%) E: 3/30 (10%) F: 4/30 (13%) G: 0 (0%) H: 8/100 (8%) I: 1/24 (4%)
|
Effect on HbA1c , effect on insulin dose, adverse effects; overall standardized mean difference (meta-analysis); p-value, [95%CI]
Effect on HbA1c I minus C
A: not stated B: not measured C: -0.7% at 3 months (p<0.05); no difference at 6 months D -0.02%; p=NS E: -0.6% (p=0.03) F: -0.9% [–1.6, –0.1]; p<0.05 G: -0.7% (p<0.005) H: +0.13% [–0.19,0.44]; p=NS I: -0.31%; p=NS
Effect on insulin dose I minus C
A: Fixed by design (HEC / Biostator) B: No change (fixed CSII) C: -10% in men at 6 months only D: -6.0 U/day (p=0.004) E: -0.16 U kg–1 day–1 (p=0.01) F: No significant change G: -8 U/day (p<0.05) H: -5.7 U/day [–8.6, –2.9]; p<0.001 I: -8.8 U/day [–14.6, –3.0]; p=0.004
Adverse effects Hypoglycemic events (I vs C)
A: not stated B: 7 vs 0; p=NS C: not stated D: minor 47 vs 45 patient–1 month–1 major 19 vs 8; p=NS E: minor 1.8 vs 0.9 patient–1 week–1 (p=0.03); major 2 vs 1 F: minor not stated; major none G: minor 12 vs 11 patient-1 per 4 weeks (p=NS); major none H: minor 48% of patients vs 49%; major 15% vs 10%; p=NS; leading to unconsciousness 10 vs 2; p<0.05 I: 0.7 vs 0.3 patient–1week–1; p=0.005
no reports of lactic acidosis; rates of gastrointestinal adverse effects only reported in H and I (in largest study [H], rates are similar in both groups)
Meta-analysis Standard. mean difference (SMD) SMD <0 favours I (metformin) SMD >0 favours C (placebo)
Excluded: very short studies (A,B), studies not stating mean and SD (C,G)
Effect on HbA1c D: –0.01 [–0.51, 0.48] E: –0.86 [–1.65, –0.07] F: –0.37 [–1.14, 0.41] H: 0.17 [–0.23, 0.56] I: –0.41 [–1.24, 0.42] Overall: –0.10 [–0.36, 0.15] Heterogeneity: I2=36.9%; p=0.175
translates into an absolute difference of 0.11 units lower %HbA1c in the metformin groups (not statistically significant)
Effect on insulin dose D: –0.68 [–1.19, – 0.17] E: – 0.94 [–1.74, –0.14] F: – 0.00 [– 0.77, 0.76] H: – 0.80 [–1.21, –0.39] I: – 0.44 [–1.27, 0.38] Overall:– 0.65 [–0.92, –0.39] Heterogeneity: I2= 0.0%; p=0.410
translates into an absolute difference in insulin dose requirement of 6.6 U/day lower in the metformin groups (p<0.001)
|
Authors conclude that Metformin reduces insulin-dose requirement in type 1 diabetes but that there is no clear evidence of an improvement in glycemic control; it is unclear whether insulin dose reduction is sustained beyond 1 year and whether there are benefits for cardiovascular and other key clinical outcomes
Metformin was associated with reductions in: (1) insulin-dose requirement (5.7–10.1 U/day in 6 of 7 studies); (2) HbA1c (0.6–0.9% in 4 of 7 studies); (3) weight (1.7–6.0 kg in 3 of 6 studies); and (4) total cholesterol (0.3–0.41 mmol/l in 3 of 7 studies). Metformin was well tolerated, albeit with a trend towards increased hypoglycaemia. Formal estimates of combined effects from 5 trials indicated a significant reduction in insulin dose (6.6 U/day, p<0.001) but no significant reduction in HbA1c (absolute reduction 0.11%, p=0.42)
Note: studies typically include patients with poor metabolic control (HbA1c ≥ 8%)
Level of evidence: GRADE
MODERATE* Metformin vs placebo Effect on insulin dose
LOW** Metformin vs placebo Effect on HbA1c
LOW*** Metformin vs placebo Adverse effects
*Downgraded 1 point because of serious imprecision: small study size (also after pooling)
**Downgraded 2 points because of serious imprecision: small study size, CIs include no effect (also after pooling)
***Downgraded 2 points because of serious imprecision: small study size, CIs include no effect
Sensitivity analyses, excluding small studies (<30 patients) i.e. only including Meyer et al (2002) and Lund et al (2008): (1) overall effect on HbA1c 0.10 [-0.21, 0.41], (2) overall effect on insulin dose -0.75 [-1.07, -0.43]
|
Table of quality assessment – intervention studies
(The criteria used in this checklist are adapted from GRADE)
Research question: Does addition of metformin to the insulin regime improve treatment of patients with type 1 diabetes?
|
Study reference
(first author, year of publication) |
There was adequate concealment of allocation
(yes/no/unclear) |
Participants receiving care were kept ‘blind’ to treatment allocation
(yes/no/unclear) |
Care providers were kept ‘blind’ to treatment allocation
(yes/no/unclear) |
Outcome assessors were kept ‘blind’ to participants’ exposure to the intervention
(yes/no/unclear) |
Use of unvalidated or intermediate outcomes
(yes/no/unclear) |
Selective outcome reporting on basis of the results
(yes/no/unclear) |
Loss to follow-up/incomplete outcome data described and acceptable
(yes/no/unclear) |
Analysis by intention to treat
(yes/no/unclear) |
Other limitations
(yes/no/unclear) |
|
Meyer, 2002 |
Unclear1 |
Yes |
Yes |
Yes |
No |
No |
Yes |
No2 |
No |
|
Hamilton, 2003 |
Yes |
Yes |
Yes |
Yes |
No |
No |
Yes |
No3 |
Yes4,5 |
|
Sarnblad, 2003 |
Unclear1 |
Yes |
Yes |
Yes |
No |
No |
Yes |
No6 |
Yes4,5 |
|
Lund, 2008 |
Yes |
Yes |
Yes |
Yes |
No |
No |
Yes |
No7 |
No |
|
Jacobsen, 2009 |
Unclear1 |
Yes |
Yes |
Yes |
No |
No |
Yes |
No8 |
Yes9 |
1Randomization method not described; 2stated ITT but 3 patients interupted the trial because of drug intolerance; 3three patients dropped out; 4small studies (15-30 patients; cf. Meyer et al, 2002 and Lund et al, 2008, with 62 and 100 patients respectively); 5adolescents (instead of adult patients); 6four patients dropped out; 7eight patients dropped out; 8one patient dropped out; 9Only overweight patients included (bmi >25 kg/m2)
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 20-02-2014
De werkgroep streeft ernaar jaarlijks de aanbevelingen te updaten.
De Nederlandse Internisten Vereniging is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
IN SAMENWERKING MET
Nederlandse Vereniging voor Neurologie
Nederlandse Vereniging voor Anesthesiologie
MET ONDERSTEUNING VAN
Kennisinstituut van Medisch Specialisten
FINANCIERING
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Het doel is één integrale, modulair opgebouwde NIV richtlijn diabetes te ontwikkelen volgens het concept netwerkrichtlijnen. De richtlijn moet een praktisch handvat bieden aan de internist en zijn/haar team. De richtlijn richt zich op alle DM patiënten die verwezen worden naar de internist, i.e. alle patiënten DM type 1 en de patiënten DM type 2 in de tweede lijn (volwassen patiënten).
De primaire doelgroep van deze richtlijn is de internist en degenen in zijn/haar team, die onder eindverantwoordelijkheid van de internist zorg leveren. Daarnaast is het belangrijk dat alle beroepsgroepen die betrokken zijn bij de diabeteszorg in de tweede lijn kennis nemen van deze richtlijn en deze ondersteunen.
Samenstelling werkgroep
Totstandkoming werkgroep
Voor het ontwikkelen van de richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die met DM te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Samenstelling werkgroep
· Dr. B.J. Potter van Loon, internist, Nederlandse Internisten Vereniging (voorzitter);
· Dr. B.E. de Galan, internist, Nederlandse Internisten Vereniging;
· Mw. dr. C.B. Brouwer, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.H.L.M. Geelhoed, internist, Nederlandse Internisten Vereniging;
· Prof. dr. N.C. Schaper, internist, Nederlandse Internisten Vereniging;
· Dr. R.P.L.M. Hoogma, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.J.M. van Gurp, internist, Nederlandse Internisten Vereniging;
· Mw. dr. L.D. Elving, internist, Nederlandse Internisten Vereniging;
· Dr. T.F. Veneman, internist, Nederlandse Internisten Vereniging;
· Mw. dr. H.L. Lutgers, internist, Nederlandse Internisten Vereniging;
· Prof. dr. A.J.M. Loonen, arts/klinisch farmacoloog; Nederlandse Vereniging van Psychiatrie
· Dr. D. Cohen, psychiater; Nederlandse Vereniging van Psychiatrie;
· Dr. G.E.M.G. Storms, internist, Nederlandse Internisten Vereniging;
· Mw. drs. I. Hommel, internist, Nederlandse Internisten Vereniging;
· Dr. T.W. van Haeften, internist, Nederlandse Internisten Vereniging;
· Dr. A.D.M. Stork, internist, Nederlandse Internisten Vereniging;
· Dr. J.L.M. Jongen, neuroloog, Nederlandse Vereniging voor Neurologie;
· Mw. J.M. Ronday, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie;
· Mw. drs. L.J.N. Wind, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.C.J. Knippels, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. M.M.L. Stikkelbroeck, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. S.M. van der Leij, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. L.C.G. de Graaff, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. C. van Noord, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. I.J.A. de Bruin, AIOS, Nederlandse Internisten Vereniging;
· Dr. C.K.A. van den Berge, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.P.A. Hoeks, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. Y.W. van den Berg, AIOS, Nederlandse Internisten Vereniging;
· Dr. E.J.G. Peters, internist, Nederlandse Internisten Vereniging;
Met ondersteuning van:
· Ir. T.A. van Barneveld, hoofd Kennisinstituut van Medisch Specialisten;
· Dr. K.N.J. Burger, epidemioloog, adviseur Kennisinstituut van Medisch Specialisten;
· Mw. Ir. I.W. Loman, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. S.B. Muller-Ploeger, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. M. Wessels, informatiespecialist Kennisinstituut van Medisch Specialisten;
· Mw. V. Beaujean, secretariaat, Kennisinstituut van Medisch Specialisten;
· Mw. S. Jaber, MSc, beleidsadviseur Kwaliteit, Nederlandse Internisten Vereniging
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête via internet. Een verslag van de enquête is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is digitaal verspreid onder alle relevante beroepsgroepen. De richtlijn is te downloaden vanaf de website van de NIV en via de Richtlijnendatabase.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van het Nederlands Huisartsen Genootschap (NHG), de beroepsorganisatie voor Diabeteszorgverleners (EADV), DiabetesVereniging Nederland (DVN), Zorgverzekeraars (ACHMEA en UVIT), farmacie/industrie (Nefarma), Nederlandse Diëtisten Vereniging (NVD) en arts-assistenten in opleiding (JNIV) van de NIV via een Invitational conference. Een verslag hiervan kunt u vinden in de bijlagen.
Methode richtlijnontwikkeling
Deze (concept)richtlijn is opgesteld aan de hand van het Procedureboek NIV richtlijnen die aansluit bij het “Appraisal of Guidelines for Research & Evaluation II” (AGREE II) instrument (www.agreecollaboration.org). Dit instrument is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Adaptatie
De a/b/c/e-level ADA aanbevelingen (2011, USA) worden in principe overgenomen, mits deze:
-
niet in tegenspraak zijn met deze uit de Duitse richtlijn (2010), de NICE richtlijn (update 2010, Engeland), de Sign richtlijn (2010, Schotland) en de Canadese richtlijn (2008);
-
niet in tegenspraak zijn met de resultaten van een literatuur update van de laatste drie jaar; 3) geldig zijn voor de Nederlandse situatie.
Vaststellen van de belangrijkste uitkomstmaten
De richtlijnwerkgroep heeft per uitgangsvraag de wetenschappelijke uitkomstmaten vastgesteld die zij van belang achtte en hebben deze naar mate van belang voor de patiënt geordend. Hierbij was het streven om vooral harde klinische eindpunten te gebruiken. Tevens heeft de werkgroep aangegeven welk verschil zij klinisch relevant vinden.
Strategie voor zoeken naar en selectie van literatuur
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline, Cochrane en, zo nodig, Embase. Daar waar stukken uit de ADA-richtlijn* werden overgenomen werden aanvullende searches gedaan van de afgelopen drie jaar, i.e. van 2008 tot 2011. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCT’s). In afwezigheid van RCT’s werd verder gezocht naar prospectieve vergelijkende onderzoeken en prospectieve niet-vergelijkende onderzoeken (uitzondering: onderwerpen van a/b level-ADA aanbevelingen: uitsluitend RCT’s; zie later). De werkgroepleden selecteerden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. Voor de gebruikte zoekstrategieën zie de bijlagen.
* De ADA-richtlijn wordt elk jaar geüpdate. Onduidelijk is of de richtlijn elk jaar volledig of partieel geüpdate wordt.
Beoordeling van de kwaliteit van studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de tabel ‘Beoordeling kwaliteit studie’ in de bijlagen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE methodiek. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al., 2004). Waarbij de bewoording van de GRADE methode is gebruik zoals hieronder weergegeven.
|
EBRO |
bewoording |
|
Niveau 1 |
Hoog |
|
Niveau 2 |
Matig |
|
Niveau 3 |
Laag |
|
Niveau 4 |
Zeer laag |
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Procedure voor commentaar en autorisatie
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetesvereniging Nederland (DVN), de Beroepsorganisatie voor Diabeteszorgverleners (EADV), het Nederlands Huisartsen genootschap (NHG), Nefarma, de Nederlandse Diabetes Federatie (NDF), de Nederlandse Vereniging van Diëtisten (NVD), en de Nederlandse Vereniging van Klinisch Chemici (NVKC). De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek per module staat in aanverwant 'Kennislacunes'.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

