Optimale insulinebehandeling voor mensen met DM1: insulinepomp zonder gekoppelde sensor (CSII) of MDI?
Uitgangsvraag
Wat is de optimale insulinebehandeling voor mensen met DM1: insulinepomp zonder gekoppelde sensor (CSII) of MDI?
Aanbeveling
De werkgroep is van mening dat op basis van gezamenlijke besluitvorming tussen behandelteam en patiënt besloten dient te worden welke insulinetherapie geschikt is. In het kader van het leren van hoe om te gaan met insulinetherapie, heeft MDI de voorkeur om mee te starten bij kinderen en volwassenen met diabetes mellitus type 1. De gezamenlijke besluitvorming is onder andere afhankelijk van de waarde die patiënten hebben over het type insulinetherapie, behandeldoelen, motivatie en inzet van patiënt.
Aanbeveling 1
Bepaal de keuze voor insulinebehandeling bij mensen met type 1 diabetes in nauwe samenspraak met het diabetesbehandelteam en de patiënt:
- Kies bij start van de behandeling in principe voor MDI
- Bepaal samen met de patiënt en het diabetesbehandelteam de individuele behandeldoelen van de patiënt. Let hierbij bijvoorbeeld op: HbA1c, percentage glucosewaarden binnen streefwaarde (Time in range), frequentie en ernst van hypoglykemieën, en kwaliteit van leven.
- Bepaal samen hoe het behandeldoel zo snel mogelijk kan worden bereikt: Bespreek hierbij de voor- en nadelen van verschillende methoden, en houd rekening met persoonlijke voorkeuren en mogelijkheden van de patiënt.
Gebruik hierbij de Checklist Glucosecontrole en Insulinetherapie.
- Maak afspraken met de patiënt over de eigen verantwoordelijkheden en verplichtingen die verbonden zijn aan de keuzes die gemaakt zijn voor insulinetoediening en glucosecontrole.
- Bespreek regelmatig binnen het diabetesbehandelteam de mate waarin de individuele behandeldoelen worden bereikt. Bespreek regelmatig met de patiënt of alle behandeldoelen naar tevredenheid van patiënt én behandelteam worden bereikt, en waar verbetering nodig is. Stel samen met patiënt vast welk behandeldoel eventueel voorrang krijgt bij de aanpak van de behandeling.
- Evalueer jaarlijks, eventueel aan de hand van een checklist, of onderlinge afspraken worden nagekomen, of behandeldoelen moeten worden bijgesteld, of continuering van de gekozen vorm van behandeling gerechtvaardigd is, en of intensivering van de behandeling gewenst is.
Aanbeveling 2
Kies bij CSII (insuline pomptherapie) de voor het individu meest optimale techniek met de grootst mogelijke succeskans om de behandeldoelen te halen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de gunstige en ongunstige effecten van glucose behandeling met insuline therapie met een insulinepomp (CSII) versus ‘multiple dose injection’ (MDI) bij volwassenen en kinderen met type 1 diabetes mellitus. Analyse van de literatuur leidde tot 2 systematische reviews (Pala, 2019, Dos Santos 2021) met daarnaast nog één RCT (Little 2018) waarin in totaal 25 klinische trials werden geïncludeerd. Als cruciale uitkomstmaten voor de besluitvorming zijn HbA1c, ernstige hypoglykemie, diabetische ketoacidose (DKA), en tijd in- boven en onder de glucose normaalwaarden meegenomen. Daarnaast werd kwaliteit van leven als belangrijke uitkomstmaat onderzocht.
Beperkingen
- Door een gebrek aan onderzoeksgegevens is er geen uitspraak mogelijk over het effect van een behandeling met CSII vergeleken met MDI op de tijd binnen, boven en onder de streefwaarden van bloedglucose.
- Er dient opgemerkt te worden dat de follow-up tijd in 10 van de 25 trials 6 maanden of korter was en dat er 3 trials een follow-up tijd hadden van 24 maanden.
- De trials hebben niet kunnen kijken naar specifieke patiëntengroepen (bv jonge kinderen of oudere volwassenen met veel comorbiditeit).
- In het merendeel van de geïncludeerde trials was de HbA1c baseline waarde laag (rondom 7-7.5%). Subgroep analyses waarbij patiënten met een hoge HbA1c baseline waarde werden gerandomiseerd op CSII of MDI konden niet in de literatuursamenvatting meegenomen worden.
- Harde klinische eindpunten (als cardiovasculaire ziekte en mortaliteit) werden niet tot nauwelijks als uitkomst gerapporteerd omdat de studies daar niet voor gepowered waren en een te korte follow-up hadden om over die eindpunten iets te kunnen zeggen.
- Bovengenoemde beperkingen zijn veelal niet aanwezig in niet-gerandomiseerde (‘real life’) studies, maar zijn niet systematisch onderzocht in bovengenoemde literatuuranalyse omdat de farmacoepidemiologische ‘evidence’ zich klassiek richtte op informatie uit de klinische trial.
Aanvullende argumenten
Op grond van de uitkomsten van onze analyse van de studies is (gemiddeld genomen) het gebruik van CSII gelijkwaardig aan MDI, zowel bij kinderen als volwassenen met type 1 diabetes. Wel vindt de werkgroep dat de uitkomsten HbA1C en hypoglykemieën als gezamenlijk eindpunt moeten worden beschouwd. Het gebruik van CSII leidde tot een significant verschil in HBA1C: daling van -0.28% zonder toename van ernstige hypoglykemieën/ mogelijk zelfs minder vaak ernstige hypoglykemieën (relatief risico 0.91, 95%BI, 0.71-1.18). Deze gecombineerde uitkomst beschouwt de werkgroep als een licht voordeel ten faveure van CSII. Ofschoon het relatief risico op DKA bij CSII verhoogd leek te zijn (bewijskracht laag), dient hier opgemerkt te worden dat de absolute kans op DKA bij CSII klein was (n=16 van in totaal 405 onderzochte kinderen en n=24 van in totaal 549 onderzochte volwassenen over een follow-up tijd van 4-24 maanden). Het is onwaarschijnlijk dat toekomstig gerandomiseerd onderzoek de wetenschappelijke bewijskracht zal verhogen. Wel laat een recent gepubliceerde langlopende observationele studie uit Schotland, en waarbij 4684 mensen met type 1 diabetes werden geïncludeerd, vanaf start van de CSII therapie tussen 2004 en 2019 een meerwaarde van CSII zien (Reid 2021). Ofschoon (per definitie) observationele studies in vergelijking met RCTs een hogere kans hebben op confounding, is de ‘real life experience’ dat bij patiënten met diabetes die met CSII starten er een verbetering van het HbA1c tot 5 jaar na start van CSII van gemiddeld 5.5 mmol/mol optreedt. Tevens werd een daling van ernstige hypoglykemieën gezien en minder diabetische ketoacidose bij CSII. In dezelfde observationele studie, (Reid 2021)] werd een dosis response zichtbaar, waarbij CSII gunstigere effecten had (dan MDI) bij patiënten met een hogere uitgangs HbA1c waarde. Gezien de lange follow-up en grote patiëntengroep konden ook hardere uitkomstmaten beoordeeld worden, waarbij de kans op retinopathie bij CSII gebruik kleiner is dan bij MDI (Reid 2021). Hoewel dit een observatie betreft, benadert deze studie vanwege de lange observatietijd en ongeselecteerde patiëntenpopulatie meer ‘real life’.
Verder dient opgemerkt te worden, dat met gebruik van enkel CSII, de patiënt met diabetes de beoogde streefwaarde van 53 mmol/mol vaak niet haalt (Leelarathna 2020). Sinds kort is er duidelijke vooruitgang in de diabetische technologische mogelijkheden. Er zijn geautomatiseerde insulinetoedieningssystemen (zogenoemde ‘automated hybrid closed-loop insulin delivery systems’) (Boughton, 2021) op de markt.
Dit zijn systemen waarbij een glucosesensor gekoppeld is aan een insulinepomp en via een algoritme de glucosewaarden deels worden gereguleerd. Van hybride closed loop systemen is een verbetering van het HbA1c, de tijd binnen, onder en boven doelbereik beschreven (Pease 2020). De trials van de inmiddels commerciëel beschikbare hybride closed loop systemen tonen een tijd binnen doelbereik van ongeveer 70% aan, doch hebben een korte follow up duur. Deze ontwikkelingen van geautomatiseerde insulinetoedieningssystemen zijn van zeer recente datum en de artikelen die deze nieuwe technologie betreffen zijn niet in de literatuurzoekopdracht meegenomen.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Mensen met type 1diabetes zijn dag en nacht bezig om de glucosewaarden te balanceren, doch behaalt een minderheid hun streefwaarden: een HbA1c kleiner dan 53 mmol/mol (TIR > 70%) . Vele tientallen factoren beïnvloeden deze glucosewaarden. Waar bij een gezond persoon de bètacellen er automatisch voor zorgen dat deze glucosewaarden in balans blijven, zijn mensen met diabetes afhankelijk van het zelf meten van glucosewaarden en het zelf toedienen van insuline. Mensen met diabetes willen optimale glucosewaarden met minimale 'moeite’ en minimale ‘beperking’ in het dagelijks leven.
In de praktijk blijkt dat ieder individu zijn eigen waarden en voorkeuren heeft wat betreft de toedieningsvorm van insuline omdat ‘moeite’ en ‘beperking’ per individu anders worden geïnterpreteerd. De ene persoon zal CSII zien als een beperking doordat deze 24/7 aan het lijf verbonden is, de andere als minder moeite omdat de insulineafgifte makkelijker te optimaliseren is. Een boluscalculator kan voor iemand een beperking om de insulinedosis te berekenen opheffen, terwijl de ander het als moeite zal zien om de calculator in te vullen. In de vergelijking tussen CSII en MDI laat een individu mogelijk geen verbetering zien in klinische uitkomsten, maar kan dit wel een wereld van verschil betekenen in het leven van het individu. Keuzevrijheid, waarbij de persoon met diabetes samen met de voorschrijver het beste middel voor de individuele zorgvraag kiest, is daarom van groot belang.
Conclusie van de werkgroep
Hoewel met een insuline pomp er meer mogelijkheden zijn dan met MDI om de type 1 diabetes beter en preciezer te behandelen blijft het bereiken van een zo goed mogelijk resultaat in afwezigheid van een (semi) closed loop systeem grotendeels afhankelijk van dagelijks menselijk handelen. Switchen van MDI naar CSII kan het HbA1c wat verlagen zonder toename van hypoglykemieën. Het lijkt echter niet logisch om standaard elk kind of volwassene met type 1 diabetes te behandelen met een niet-(semi) closed loop insuline pomp (dus zonder gekoppelde sensor) te zetten. Er kunnen namelijk allerlei factoren zijn waardoor een insulinepomp bij bepaalde patiënten niet een betere behandeling zal zijn dan MDI. De werkgroep is van mening dat de behandelaar samen met de patiënt beslist welke therapie het meest geschikt is. Gezamenlijk beslist de persoon met diabetes, bij jonge kinderen de ouders, samen met het behandelteam welke behandeldoelen er zijn en hoe die het beste kunnen worden behaald.
Behandeldoelen kunnen zijn:
voorkomen van hypoglykemieën,
verlaging HbA1c,
verhogen TIR,
zwangerschapswens,
kwaliteit van leven,
functioneren in de maatschappij.
Daarnaast kan sprake zijn van een sterk persoonlijk gekleurde voorkeur dan wel noodzaak zijn voor de patiënt, mede op basis van jonge leeftijd, eerdere ervaringen, opleidingsniveau, werk- of privésituatie etc.
Kosten (middelenbeslag)
In de analyse zijn geen kosteneffectiviteitsstudies meegenomen. De kosteneffectiviteit is moeilijk te bepalen. Dit komt doordat de vergelijking van de directe kosten (insulinepennen versus van aanschaf van de insulinepomp) en indirecte kosten (meer of minder arbeidsverzuim) afgezet moeten worden tegen een winst op de lange termijn: vermindering van complicaties van de diabetes. De kosteneffectiviteitsstudies in de meta analyse van Pease 2020 zijn van lage bewijskracht. Van de behandelaars wordt gevraagd de inzet van insulinepompen doelmatig voor te schrijven in overeenkomst met de kwaliteitscriteria opgesteld door de NDF.
Aanvaardbaarheid, haalbaarheid en implementatie
Behandeling van patiënten met type 1 diabetes is teamwork. In de dagelijkse praktijk is de patiënt de eigen behandelaar doordat er steeds weer op basis van diverse factoren moet worden beslist wat er aan insulinedosering en/of koolhydraat-inname moet worden gedaan. Het behandelteam dient uiteraard deskundig, betrokken, toegewijd en goed bereikbaar te zijn voor vragen en ondersteuning van de patiënt. Haalbaarheid en implementatie van de richtlijn is dus sterk afhankelijk van de beschikbaarheid van een deskundig diabetesteam. Anno 2021 is het ook essentieel dat patiënt met het team kan overleggen via diverse communicatiemedia, waarbij steeds alle partijen inzage hebben in de gegevens omtrent insulinedoseringen, glucosewaarden etc. In de zorgstandaard diabetes mellitus van de NDF wordt verder ingegaan op de kwaliteitseisen die worden gesteld aan het diabetes-behandelteam (NDF, 2021; link). De keuze van een bepaalde vorm van insulinebehandeling in combinatie met een bepaalde vorm van glucosecontrole wordt individueel bepaald. Niet iedere patiënt is even geschikt voor iedere behandelvorm. De complexiteit van CSII, maar ook het vermogen om te kunnen rekenen met koolhydraten, kunnen beperkende factoren zijn, bijvoorbeeld bij ouderen of mensen met een laag opleidingsniveau. Ook andere factoren zoals taal of cultuur kunnen de communicatie tussen zorgverlener, patiënt en familie bemoeilijken, hetgeen van invloed kan zijn op het maken van een keuze. Mogelijk kan een deel van deze beperkingen worden verminderd door hulpverleners met speciale expertise en/of een migratie-achtergrond.
Onderbouwing
Achtergrond
Type 1 diabetes kan enkel behandeld worden met insuline. Om de kans op complicaties op korte en lange termijn zo klein mogelijk te maken, dient er in het algemeen gestreefd te worden naar normale glucose waarden. Om dit te bewerkstelligen dient bij subcutane insuline toediening zo goed mogelijk de fysiologie nagebootst te worden: Bij multiple dose injections (MDI) wordt eenmaal per dag langwerkende insuline toegediend, en bij inname van koolhydraten een bolus (ultra)kortwerkende insuline/ KW insuline. Bij continue subcutane insuline infusie d.m.v. een insulinepomp (CSII) wordt continu (ultra)kortwerkende insuline toegediend, en wordt bij inname van koolhydraten een bolus (ultra)kortwerkende insuline toegediend.
Hoewel met een insuline pomp er meer mogelijkheden in de insulinetoediening zijn dan met MDI om diabetes type 1 beter en preciezer te behandelen, blijft het resultaat nog grotendeels afhankelijk van menselijk handelen. De vraag is of de insulinepomp bij kinderen en volwassenen met type 1 diabetes ook tot betere resultaten leidt dan MDI. De meerwaarde van een behandeling kan bestaan uit een betere regulatie uitgedrukt in HbA1c, time in range (TIR), ernstige hypoglykemiën, minder ernstige hypoglykemieën, minder tijd in het hypoglyceme gebied (Time Below Range, TBR), en minder hyperglykemieën, (Time Above range TAR). Ook spelen kwaliteit van leven en kosten een rol.
Conclusies / Summary of Findings
HbA1c levels (crucial outcome)
Severe hypoglycemia (crucial outcome)
|
Moderate GRADE |
Use of continuous subcutaneous insulin infusion (CSII) probably results in little to no difference in the incidence of severe hypoglycemia as compared with multiple-daily injections (MDI) in people with type 1 diabetes
Little (2018), Pala (2019), Dos Santos (2021) |
Ketoacidosis in adults (crucial outcome)
|
Low GRADE |
Continuous subcutaneous insulin infusion (CSII) may result in an increase in risk of ketoacidosis as compared with multiple-daily injections (MDI) in adult people with type 1 diabetes
Pala (2019) |
Ketoacidosis in children and young adolescents (crucial outcome)
|
Very Low GRADE |
Continuous subcutaneous insulin infusion (CSII) may result in a slight increase in risk of ketoacidosis as compared with multiple-daily injections (MDI) in children and young people with type 1 diabetes but the evidence is very uncertain
Pala (2019) |
Time within the target range (TIR), time above the target range (TAR), time below the
target range (TBR) of blood glucose (crucial outcome)
|
GRADE |
Due to the lack of data, it is not possible to draw a conclusion about the effect of continuous subcutaneous insulin infusion (CSII) as compared with multiple-daily injections (MDI) on TIR, TAR and TBR in people with type 1 diabetes
Beck (2017), Dos Santos (2021) |
Health related quality of life (important)
|
Low GRADE |
Use continuous subcutaneous insulin infusion (CSII) probably results in little to no difference in the incidence of health-related quality of life as compared with multiple-daily injections (MDI) in people with type 1 diabetes
Tsui (2001), De Vries (2002), Thomas (2007)), Dos Santos (2021) |
Samenvatting literatuur
Population: adults
Pala (2019) performed a systematic review with meta-analysis of randomized controlled trials in adults comparing subcutaneous insulin infusions (CSII) versus multiple-daily injections (MDI) on glycemic outcomes in adults with type 1 diabetes mellitus. The search date ranged from any date up to September 1st, 2018. Randomized trials on CSII have been performed on a range of over 4 decades. During this time, the technology of insulin pumps and infusion sets has improved dramatically, at the same time, there has been a profound evolution in insulin types and therapeutic schemes. In addition Pala (2019) revealed that older studies often showed greater methodological problems than newer ones. It was therefore decided to not include trials in the current systematic review that were published before 2000. In total, 10 randomized clinical trials in adults comparing subcutaneous insulin infusions (CSII) versus multiple-daily injections (MDI) were included by Pala (2019). We found one additional publication (Little, 2018) that was not included in the Pala review but met our search criteria. Of note, this publication describes the same population as the study of Little (2014) (which was included by Pala, 2019), but had longer follow up duration. Little (2018) presented 2 year follow-up results while Little (2014) presented 6 months follow-up results. In order to not count the same study population multiple times, results of Little (2018) were not pooled in the overall analysis, but shown separately.
Trials from the review included non-pregnant adults with type 1 diabetes. The intervention (CSII) was defined by the authors as a CSII device and the comparator (MDI) as multiple daily injections.
Population: children and young adolescents
Dos Santos (2021) performed a systematic review and meta-analysis of randomized controlled trials comparing glycemic outcomes between subcutaneous insulin infusions (CSII) and multiple-daily injections (MDI) in children and adolescents (aged < 20 years) with type 1 diabetes mellitus. The literature search by Dos Santos (2021) was performed from January 2000 to January 2019. We did not identify additional trials in children and adolescents that were published after 1 January 2019
Trials from the review included children and adolescents (aged < 20 years) with type 1 diabetes. The intervention (CSII) was defined by the authors as a CSII device and the comparator (MDI) as multiple daily injections.
Outcomes Adults
The systematic review of Pala (2019) and the randomized trial of Little (2018) reported the following outcomes: HbA1c, severe hypoglycemia, diabetic ketoacidosis. The original trials that were reported in the two aforementioned studies were hand searched for the following outcomes: percentage of time that the glucose level was in the target (TIR), below (TBR) and above the range (TAR) of 70 to 180 mg/dL (3.9 to 10.0 mmol/L), and health-related quality of life. In all trials HbA1c was defined as the primary outcome.
Children and young adolescents
The systematic review of Dos Santos (2021) reported the following outcomes: glycated hemoglobin (HbA1c), severe hypoglycemia, diabetic ketoacidosis, the percentage of time that the glucose level was in the target (TIR), below (TBR) and above the range (TAR) of 70 to 180 mg/dL (3.9 to 10.0 mmol/L), and health-related quality of life. In all trials HbA1c was defined as the primary outcome.
Study characteristics
In the pooled data (of 25 trials in total), 2249 participants were randomized: 1148 participants were randomized to CSII and 1142 were randomized to MDI. Fifteen studies included children and adolescents: 982 participants (61%). The remaining 10 trials included adults only. All studies had an open-label design. The mean age of the participants varied from < 5 to 50 years. The average duration of diabetes type 1 varied from 0 (i.e., new onset) to 29 years. The average follow-up varied from 4 to 24 months. There were three studies (2 adult, 1 children/ adolescents) that had a follow-up of 24 months (Repose Study group, 2017; Little, 2018) and one in children (Skogsberg, 2008). In these three trials a training program was offered to participants before they were randomized in order to ensure optimal treatment adherence. All studies had predefined HbA1c as the primary outcome.
Results
HbA1c levels (critical outcome)
The mean difference in HbA1c levels at time of baseline and at the end of the study were expressed as percentages and were reported in 26 studies. The included studies showed a mean difference of -0.28% (95% CI -0.39 to -0.17), indicating a higher, but clinically irrelevant reduction of HbA1c in the intervention group compared to the control group. Effects were similar for adults and children/adolescents.
Of note: in one study (Little (2018)) 63% of participants were either not using the therapy to which they were randomized, or were lost to follow-up after 2 years of follow-up.
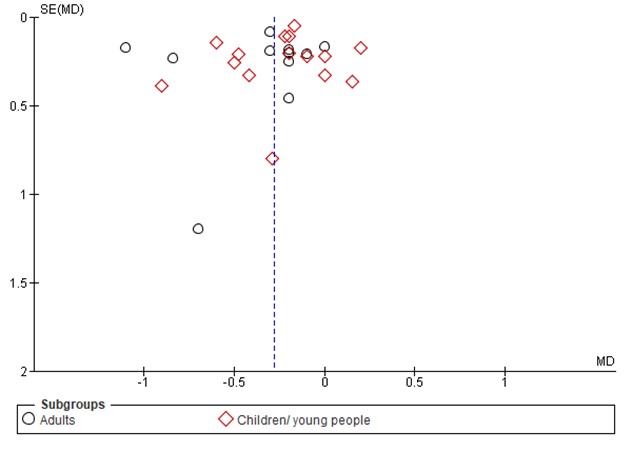
A funnel plot analysis revealed asymmetry in adults which could have generated an overestimation of advantage of CSII with respect to HbA1c in adults. In trials performed in children, no sign of publication bias was revealed through funnel plot analysis.
Figure 1. Forest plot of comparison CSII vs MDI, outcome HbA1c
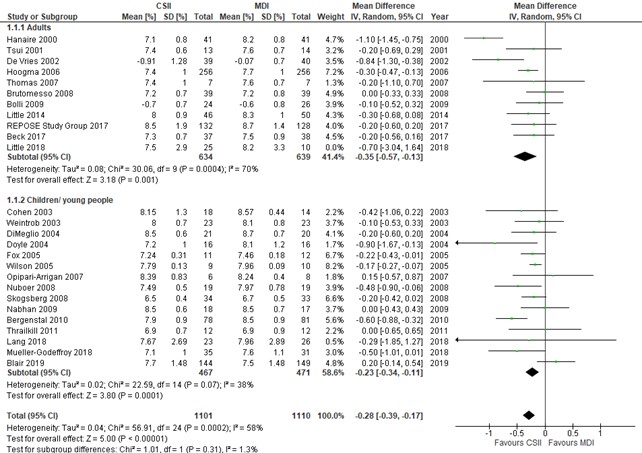
Figure 1B Funnel plot analysis of comparison CSII vs MDI, outcome HbA1c
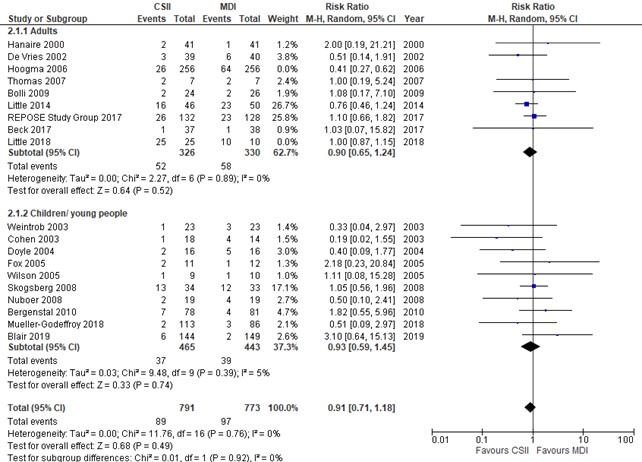
Severe hypoglycemia (critical outcome)
Severe hypoglycemia was defined as: severe hypoglycemia episodes (glucose level < 3.0 mmol/L [54 mg/dL] or an event associated with severe cognitive impairment (including coma and convulsions) that required external assistance. Severe hypoglycemia was reported in 19 studies. The result of Hoogma (2006) was an outlier to this outcome, which led to heterogeneity (I2=79% in adults and an overall pooled I2 of 55%). For that reason, the study of Hoogma (2006) was excluded in a post hoc sensitivity analysis, after which the pooled risk ratio was 0.91; 95% CI, 0.71-1.18 (with I2=0% in adults and children/ young people). Funnel plot analysis revealed no sign of publication bias in adults or children.
Figure 2. Forest plot of comparison CSII vs MDI, outcome severe hypoglycemia
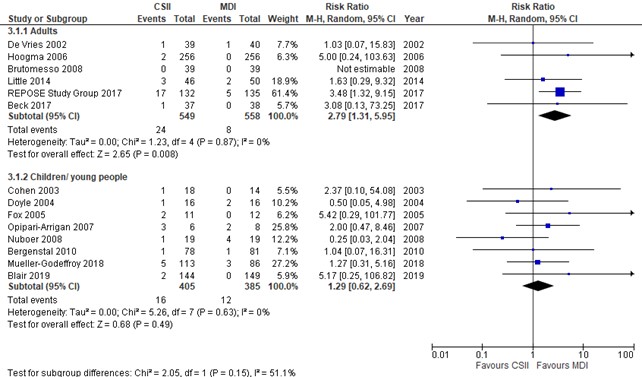
Diabetic ketoacidosis (critical outcome)
Diabetic ketoacidosis was defined as potentially life-threatening condition with high levels of ketones in the body which when building up in the blood make the blood more acidic. Occurrence of DKA was reported in 14 studies. Although the P-value for heterogeneity between adults and children/adolescents was >0.05, we decided not to pool the results of DKA in children and adults as the point estimates for DKA were considered clearly different in adults and children. The pooled risk ratio in adults was 2.79 (95% CI, 1.31-5.95), Indicating that DKA occurred more frequently during CSII treatment. This result was partly driven by the REPOSE Study (2017). In the REPOSE Study (2017) authors noted that ‘most events were caused by infections and 18% by infusion set failure in those using pumps’. Although ketoacidosis was reported through serious adverse event episodes in the REPOSE Study (2017), authors mention that only five episodes occurred in which participants concurrently noted a sick day rule. The severity of at least part of the DKA episodes in the REPOSE study group (2017) seems therefore debatable, which was the reason why this study was excluded in a post hoc sensitivity analysis. After excluding the REPOSE study group (2017) from analysis, the pooled risk ratio in adults was 1.96 (95% CI, 0.58-6.64). The risk ratio of DKA in children and young people aged < 20 years was 1.29 (95% CI, 0.62-2.69). Funnel plot analysis revealed no sign of publication bias in adults and children
Figure 3. Forest plot of CSII vs MDI, outcome diabetic ketoacidosis
Time in target, below and above glycemic range (critical outcome)
The time in target (TIR), below (TBR) and above (TAR) glycemic range was defined as the mean percentage of TIR [percentage of readings in the glycemic range of 3.9–10.0 mmol/L (70–180 mg/dl) per unit of time], TAR and TBR assessed with any continuous glucose monitor system. Three randomized clinical trials (n=1 in adults and n=2 in children and people aged < 20 years only) reported data on the percentage of the TIR, TBR and/or TAR. The results in children and people aged < 20 years are shown in (Figure 4-6). The study in adults (Beck, 2017) reported the TIR as mean time in range as minutes per day, and found that the TIR was 791 min per day (SD 157) in the CSII group and 741 min per day (SD 225) in the MDI group, representing an adjusted mean treatment group difference favoring the CSII group: 83 min (95% CI 17 to 149). Since only few studies reported on these outcomes, it was decided to not pool the results.
Figure 4. Forest plot of CSII vs MDI, outcome time in target (TIR)*

Figure 5. Forest plot of CSII vs MDI, outcome time below target (TAR)

Figure 6. Forest plot of CSII vs MDI, outcome time above target (TBR)

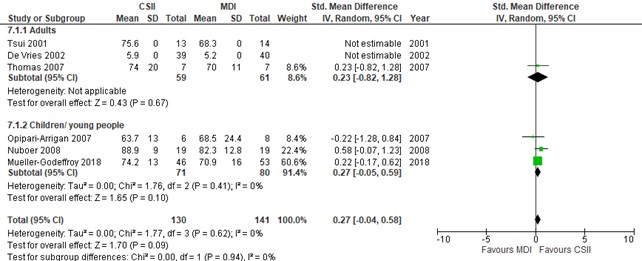
Health-related quality of life (important outcome)
The included studies used different tools to assess Health-related quality of life (HRQoL) (evidence table). Some studies measured HRQoL with validated and age-appropriated diabetes-related quality of life questionnaires, whereas others measured overall quality of life and focused on parental rather than children’s quality of life. When studies assess the same outcome but measure it in a variety of ways (as is the case here), it is necessary to standardize the results of the studies to a uniform scale before they can be combined. This can be done with the standardized mean difference (SMD) (see for instance https://handbook-5-1.cochrane.org/chapter_9/9_2_3_2_the_standardized_mean_difference.htm), and which was done accordingly here. The interpretation of the magnitude of the SMD is given as small, SMD 0.2-0.5; medium, SMD 0.5-0.8; or large, SMD > 0.8. The pooled SMD was 0.27 (95% CI, -0.04 to 0.58), i.e., no difference in effect between CSII vs MDI. Of note, De Vries (2002) and Tsui (2001) (both RCTs that were performed in adults) reported the mean outcome without a standard deviation, so this result could not be pooled with the other results. In addition, HRQoL in REPOSE study group (2017) (an RCT performed in adults) was reported as a mean difference of the difference at 24 months compared to baseline, which findings cannot be plotted as SMD. REPOSE (2017) showed that the mean difference of the differences were similar in CSII and MDI groups (1.2, SD 6.1 in CSII vs 0.5, SD 8.6 in MDI, P=0.72).
Figure 7. Forest plot of CSII vs MDI, outcome health related quality of life
Level of evidence of the literature
The level of evidence (GRADE method) is determined per comparison and outcome measure and is based on results from systematic review of randomized trials and therefore starts at level “high”. Subsequently, the level of evidence was downgraded if there were relevant shortcomings in one of the several GRADE domains: risk of bias, inconsistency, indirectness, imprecision, and publication bias.
The level of evidence regarding the outcome measure HbA1c levels was downgraded by 1 level because of risk of bias (1 level, open label trials with lack of transparency of randomization). Although publication bias was suggested in adults through funnel plot analysis, the GRADE was not further downgraded as it was considered unlikely that publication bias could have influenced the result in terms of clinical relevance.
The level of evidence regarding the outcome measure severe hypoglycemia was downgraded by 1 level because of risk of bias (open label trials with lack of transparency of randomization).
The level of evidence regarding the outcome measure diabetic ketoacidosis in adults was downgraded by 2 levels because of risk of bias (unclear definition of the outcome event) and imprecision (1 level, low number of events [<40])
The level of evidence regarding the outcome measure diabetic ketoacidosis in children and young adolescents (aged < 20 years) was downgraded by 3 levels because of imprecision (2 levels, 95% confidence interval includes the level of clinical relevance) and inconsistency (1 level, some studies suggest benefit, and others no effect or harm)
The level of evidence regarding the outcome measure time in target, below and above glycemic range (critical outcome) was ungraded due to lack of data.
The level of evidence regarding the outcome measure health related quality of life was downgraded by 2 levels because of risk of bias (2 levels due to differences in outcome definition of the studies)
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the (un)favorable effects of continuous subcutaneous insulin infusion (CSII]) vs. intensive insulin therapy with multiple daily injections (MDI) in people with type 1 diabetes mellitus?
PICO
P (Patients) = Children and adults with (incident) type 1 diabetes mellitus.
I (intervention) = Continuous Subcutaneous Insulin Infusion (CSII).
C (Comparison) = Multiple daily injection (MDI).
O (Outcomes) = HbA1c levels, severe hypoglycemia, diabetic ketoacidosis (DKA), time within, above or below the target range of blood glucose, health-related quality of life.
Relevant outcome measures
The guideline development group considered HbA1c levels, severe hypoglycemia, diabetic ketoacidosis (DKA), time within the target range of blood glucose, time above the target range of blood glucose, time below the target range of blood glucose critical outcomes for decision making. Health-related quality of life was considered an important outcome measure.
The working group did not define the outcome measures listed above but used the definitions in the studies.
Previous studies used a threshold of 5 mmol/mol (+/-0.5%) as a clinically important difference in HbA1c. Therefore a difference of of >5 mmol/mol was determined as clinical relevant (Lenters-Westra, 2014, Beck 2019, Vigersky 2019). For TIR each incremental 5% in was considered clinically significant (Lenters-Westra, 2014, Beck 2019, Vigersky 2019). The working group did not define a minimal clinically important difference for other outcome measures. Therefore, default thresholds were used: a 25% difference in relative risk (RR< 0.8 or RR>1.25) for dichotomous outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 15 May 2021. This search strategy can be found in the Methods section. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 820 hits, including 207 systematic reviews and 613 randomized controlled trials (RCTs).
Results
Two systematic reviews of randomized trials (one in adults, i.e., Pala, 2019, and one in children and young people aged < 20 years, i.e., Dos Santos, 2021) and one extra result from a randomized clinical trial in adults that was not included in the systematic review of Pala (2019) were included in the analysis of the literature.
Furukawa (2002) showed that when the relative risk does not substantially vary between subgroups (independent of the underlying absolute risk in subgroups), one can pool such evidence. It was therefore decided that the results in children and adults could be pooled, except when an interaction analysis showed that outcome results (on a relative scale) were not similar in adults and children.
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Beck RW, Bergenstal RM, Cheng P, et al. The Relationships Between Time in Range, Hyperglycemia Metrics, and HbA1c. J Diabetes Sci Technol. 2019;13(4):614-626. doi:10.1177/1932296818822496
- Boughton, C.K., Hovorka, R. New closed-loop insulin systems. Diabetologia. 2021;64:1007-15. https://doi.org/10.1007/s00125-021-05391-w
- Dos Santos TJ, Donado Campos JM, Argente J, Rodríguez-Artalejo F. Effectiveness and equity of continuous subcutaneous insulin infusions in pediatric type 1 diabetes: A systematic review and meta-analysis of the literature. Diabetes Res Clin Pract. 2021 Feb;172:108643. doi: 10.1016/j.diabres.2020.108643. Epub 2020 Dec 31. PMID: 33359572.
- Furukawa TA, Guyatt GH, Griffith LE. Can we individualize the 'number needed to treat'? An empirical study of summary effect measures in meta-analyses. Int J Epidemiol. 2002;31(1):72-76. doi:10.1093/ije/31.1.72
- Leelarathna L, Choudhary P, Wilmot EG, et al. Hybrid closed-loop therapy: Where are we in 2021?. Diabetes Obes Metab. 2021;23(3):655-660. doi:10.1111/dom.14273
- Lenters-Westra E, Schindhelm RK, Bilo HJ, Groenier KH, Slingerland RJ. Differences in interpretation of haemoglobin A1c values among diabetes care professionals. Neth J Med. 2014;72(9):462-466.
- Little SA, Speight J, Leelarathna L, Walkinshaw E, Tan HK, Bowes A, Lubina-Solomon A, Chadwick TJ, Stocken DD, Brennand C, Marshall SM, Wood R, Kerr D, Flanagan D, Heller SR, Evans ML, Shaw JAM. Sustained Reduction in Severe Hypoglycemia in Adults With Type 1 Diabetes Complicated by Impaired Awareness of Hypoglycemia: Two-Year Follow-up in the HypoCOMPaSS Randomized Clinical Trial. Diabetes Care. 2018 Aug;41(8):1600-1607. doi: 10.2337/dc17-2682. Epub 2018 Apr 16. PMID: 29661916.
- Pala L, Dicembrini I, Mannucci E. Continuous subcutaneous insulin infusion vs modern multiple injection regimens in type 1 diabetes: an updated meta-analysis of randomized clinical trials. Acta Diabetol. 2019 Sep;56(9):973-980. doi: 10.1007/s00592-019-01326-5. Epub 2019 Apr 3. PMID: 30945047.
- Reid LJ, Gibb FW, Colhoun H, et al. Continuous subcutaneous insulin infusion therapy is associated with reduced retinopathy progression compared with multiple daily injections of insulin. Diabetologia. 2021;64(8):1725-1736. doi:10.1007/s00125-021-05456-w
- Vigersky RA, McMahon C. The Relationship of Hemoglobin A1C to Time-in-Range in Patients with Diabetes. Diabetes Technol Ther. 2019;21(2):81-85. doi:10.1089/dia.2018.0310
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: What are the (un)favorable effects of continuous subcutaneous insulin infusion (CSII]) vs. intensive insulin therapy with multiple daily injections (MDI) in people with type 1 diabetes mellitus?
|
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
|
Pala 2019 |
SR and meta-analysis of RCTs Literature search up to February 2012 A: Tsui 2001 B: De Vries 2002 C: Thomas 2007 D: Bolli 2009 E: Little 2014 F: REPOSE 2017 G: Beck 2017 H: Hanaire 2000 I: Hoogma 2006 J: Brutomesso 2008
Study design: RCT, open label, parallel, single center (A, C)
RCT, open label, set up as crossover study, but analyzed as parallel, due to high drop-out rate, multi center (B)
RCT, open label, parallel, multi center (D, E, G)
RCT, open label, multicenter, parallel, cluster randomized (F)
RCT, open label, crossover study (H, I, J)
Setting and Country:
University of Florence, Florence, Italy
Source of funding and conflicts of interest: The authors declare that they have no conflict of interest.
|
Inclusion criteria:
Adults with DM1 (A-G).
Exclusion criteria: Pregnancy
7 studies included (all RCTs)
Setting A-J: Outpatients
Important patient characteristics at baseline:
Participants, N A: I 13/ C 14 B: I 39 / C 40 C: I 7 / C 7 D: I 28 / C 30 E: I 46/ C 50 F: I 132 / C 135 G: I 37 / C 38 H: I 41 / C 41 I: I 129/ C 127 J: I 15/ C 24
Mean duration of diabetes, years A: 13 B: 18 C: Not reported D: 19 E: 29 F: 18 G: Unreported (Range 3-57) H: 20 I: 15 J: 16
Sex, men: A: I 8/ C 10 B: I 21/ C 21 C: Not reported D: I 13/ C 14 E: I 19/ C 16 F: I 21/ C 21 G: I 21/ C 19 H: I 21/ C 21 I: I 60/ C 61 J: I 7/ C 12
Mean age, years: A: I 38/ C 35 B:I 36/ C 37 C: Total: 43 D: I 38/ C 42 E: I 50/ C 47 F:I 42/ C 40 G: I 46/ C 45 H: I 45/ C 45 I: I 37/ C 35 J: I 36/ C 40
Mean HbA1c, %: A: I 7.5/ C 8.2 B: I 9.3/ C 9.3 C: Not reported D: I 7.7/ C 7.8 E: I 8.2/ C 8.2 F: I 9.3/ C 9.0 G: I 7.6/ C 7.6 H: 8.4 at randomization I: I 8.3/ C 8.2 J: I 7.4/ C 7.4
BMI, kg/m2 A: I 27/ C 27 B: Unavailable C: Not reported D: I 24/ C 24 E: I 26.3/ C 26.7 F: I 27.4/ C 27.0 G: I 29/ C 27 I: 24.8/ C 24.9 J: I 22.9/ C 24.1
Groups comparable at baseline? Yes
|
Describe intervention:
The intervention treatment was defined as receiving subcutaneous insulin infusions with a CSII device (A-J).
|
Describe control (all):
The control treatment was defined as receiving multidose injections (MDI) (A-J).
|
End-point of follow-up:
A: 9 months B: 4 months C: 6 months D: 6 months E: 6 months F: 24 months G: 7 months H:4 months I: 6 months J: 4 months
For how many participants were no complete outcome data available? (intervention/control) A: I 0 / C 0 B: I 6 / C 18 C: Not reported D: I 4 / C 4 E: 6 in total (in I or in C; not provided in which group) F: I 4 / C 15 G: I 1 / C 3 H: I 0 / C 0 I: I 15/ C 16 J: I 0/ C 3 |
Outcome measure-1 HbA1c levels, % (critical outcome)
Effect measure: mean difference [95% CI]:
Adults
A: Not estimable B: -0.84 [-1.30, -0.38] C: -0.20 [-1.10, 0.70] D: -0.10 [-0.52, 0.32] E: -0.30 [-0.68, 0.08] F: -0.20 [-0.60, 0.20] G: -0.20 [-0.56, 0.16] H: -1.10 [-1.45, -0.75] I: -0.30 [-0.47, -0.13] J: 0.00 [-0.33, 0.33] K: -0.70 [-3.04, 1.64]
Pooled effect adults (random effects model): -0.35 [-0.57, -0.14] indicating a clinically irrelevant reduction of HbA1c in the intervention group compared to the intervention group. Heterogeneity (I2): 67%
Children and young adults < 20 years
L: -0.42 [-1.06, 0.22] M: -0.10 [-0.53, 0.33] N: -0.20 [-0.60, 0.20] O: -0.90 [-1.67, -0.13] P: -0.22 [-0.43, -0.01] Q: -0.17 [-0.27, -0.07] R: 0.15 [-0.57, 0.87] S: -0.48 [-0.90, -0.06] T: -0.20 [-0.42, 0.02] U: 0.00 [-0.43, 0.43] V: -0.60 [-0.88, -0.32] W: 0.00 [-0.65, 0.65] X: -0.29 [-1.85, 1.27] Y: -0.50 [-1.01, 0.01] Z: 0.20 [-0.14, 0.54]
Pooled effect children and adults < 20 years (random effects model): -0.23 [-0.34, -0.11] indicating a clinically irrelevant reduction of HbA1c in the intervention group compared to the intervention group. Heterogeneity (I2): 38%
Pooled effect adults and children (random effects model): -0.28 [-0.39, -0.17]indicating a clinically irrelevant reduction of HbA1c in the intervention group compared to the intervention group. Heterogeneity (I2): 56%
|
Facultative:
Brief description of Pala’s conclusions (based on A-J). ‘CSII seems to produce a small improvement in HbA1c in patients with type 1 diabetes inadequately controlled with MDI.’
Personal remarks on study quality (A-J), conclusions, and other issues (potentially) relevant to the research question
a) All studies were open label trials
b) Follow-up was relatively short (4-24 months) and whether results are applicable after 4-24 months remains unknown.
c) The REPOSE Study group (2017) had the largest sample size and longest follow-up. Their conclusion is: ‘[…] results do not support a policy of providing insulin pumps to adults with poor glycaemic control until the effects of training on participants’ level of engagement in intensive self-management have been determined.
d) Funnel plot analyses were performed and authors report that Publication bias might have influenced the results on HbA1c levels
|
|
Little (2018) |
Study design: RCT, open label, parallel, multi center (K), update of E with 24 months study outcomes
Study design: RCT, open label, parallel, multi center (H)
Setting and Country:
Institute of Cellular Medicine, Newcastle University, Newcastle, U.K. And Newcastle Diabetes Centre, Newcastle upon Tyne Hospitals NHS Foundation Trust, Newcastle, U.K.
University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands, Medisch Spectrum Twente, Department of Pulmonary Medicine, EnschedeNetherlands, University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands, Medisch Spectrum Twente, Department of Pulmonary Medicine, EnschedeNetherlands, University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands,
Source of funding and conflicts of interest: The study was funded by a peer-reviewed grant from Diabetes UK (07/0003556). The research was supported by the National Institute for Health Research Newcastle Biomedical Research Centre. The National Institute for Health Research and the Cambridge National Institute for Health Research Biomedical Research Centre funded data entry and trial support. Various potential confklict of interests were reported by the study authors
|
Inclusion criteria:
Adults with DM1 (K).
Exclusion criteria: Pregnancy
Setting K: Outpatients
Important patient characteristics at baseline:
Participants, N K: I 25 / C 10
Mean duration of diabetes, years K: 29
Sex, men: K: Unclear
Mean age, years: K: Unclear
Mean HbA1c, %: H: Unclear
BMI, kg/m2 H: Unclear
Groups comparable at baseline? Unknown
|
Describe intervention:
The intervention treatment was defined as receiving subcutaneous insulin infusions with a CSII device (K).
|
Describe control (all):
The control treatment was defined as receiving multidose injections (MDI) (K).
|
End-point of follow-up:
K: 24 months
For how many participants were no complete outcome data available? (intervention/control) K: 20 in total (in I or in C; not provided in which group)
|
Outcome measure-2 Severe hypoglycemia (critical outcome)
Effect measure: risk ratio [95% CI]:
Adults B: 0.51 [0.14, 1.91] C: 1.00 [0.19, 5.24] D: 1.08 [0.17, 7.10] E: 0.76 [0.46, 1.24] F: 1.10 [0.66, 1.82] G: 1.03 [0.07, 15.82] H: 2.00 [0.19, 21.21] I: 0.41 [0.27, 0.62] K: 1.00 [0.87, 1.15]
Pooled effect adults (random effects model): 0.80 [0.49, 1.32] no difference Heterogeneity (I2): 79%
Children and young adults < 20 years
L: 0.19 [0.02, 1.55] M: 0.33 [0.04, 2.97] O: 0.40 [0.09, 1.77] P: 2.18 [0.23, 20.84] Q: 1.11 [0.08, 15.28] U: 0.50 [0.10, 2.41] T: 1.05 [0.56, 1.96] V: 1.82 [0.55, 5.96] Y: 0.51 [0.09, 2.97] Z: 3.10 [0.64, 15.13]
Pooled effect children and young adults < 20 years (random effects model): 0.93 [0.59, 1.45] no difference Heterogeneity (I2): 5%
Pooled effect adults and children (random effects model): 0 0.82 [0.60, 1.14] no difference Heterogeneity (I2): 55%
|
Facultative:
Brief description of Little’s conclusions (based on K). ‘In conclusion, brief structured education in addition to informed support in active insulin dose self-adjustment underpinned by targeted self-monitoring of blood glucose leads to sustained falls in severe hypoglycemia rates in those at high risk. These should be provided, regardless of the choice of insulin delivery and glucose monitoring modality.’
Personal remarks on study quality (K), conclusions, and other issues (potentially) relevant to the research question
a) The study was an open label trial
b) Lost to follow-up was substantial
c) Unclear if the lost to follow-up was differential or non-differential
d) Study groups were small numbered
|
|
Dos Santos 2021 |
SR and meta-analysis of RCTs Literature search up to February 2012
L: Cohen 2003 M: Weintrob 2003 N: Di Meglio 2004 O: Doyle 2004 P: Fox 2005 Q: Wilson 2005 R: Opipari 2007 S: Nuboer 2008 T: Skogsberg 2008 U: Nabhan 2009 V: Bergenstal 2010 W: Thrailkill 2011 X: Lang 2018 Y: Mueller- Godeffroy 2018 Z: Blair 2019
Study design: RCT, open label, (L-Z)
Setting and Country:
Department of Preventive Medicine and Public Health, School of Medicine, Universidad Autonoma de Madrid/IdiPAZ, Madrid, Spain
Source of funding and conflicts of interest: This research received no specific grant from any funding agency in the public, commercial or not-for-profit sectors
The authors declare that they have no conflict of interest.
|
Inclusion criteria:
Children and young adults < 20 years with DM1 (I-W).
Exclusion criteria: Studies that compared the use of single-hormonal or dual hormonal closed-loop systems
16 studies included (all RCTs)
Setting I-W: Outpatients
Important patient characteristics at baseline:
Participants, N L: I 18/ C 14 M: I 23/ C 23 N: I 20/ C 20 O: I 16/ C 16 P: I 11/ C 12 Q: I 9/ C 10 R: I 6/ C 8 S: I 19/ C 19 T: I 34/ C 33 U: I 18/ C 17 V: I 87/ C 69 W: I 12/ C 12 X: I 23/ C 26 Y: I 35/ C 31 Z: I 144/ C 199
Duration of diabetes L: Mean 16 years M: > 2 years N: > 1 year O: Not provided P: Mean 1.5 years Q: Mean 1.4 years R: > 1 year S: Mean 5 years T: Not proviuded U: > 1 year V: Not provided W: Newly diagnosed X: Not provided Y: Mean 3.5 years Z: 14 days from diagnosis
Sex, men: L: I 6/ C 10 M: I 10/ C 13 N: I 17/ C 25 O: I 14 / C 18 P: I 13/ C 9 Q: I 7/ C 12 R: Not reported S: Not reported T: Not reported U: Not reported V: I 51/ C 37 W: I 5/ C 6 X: Not reported Y: Not reported Z: I 73/ C 80
Mean age, range, years: L: 14.5-17.9 M: 9.4-13.9 N: <5 O: 13 P: 1-6 Q: 3.6 (SD 1.0) R: 4.4 (SD 0.7) S: 10 T: 7-17 U: 3.7 (SD 0.8) V: 7-18 W: 8-18 X: 5-14 Y: 12 Z: 9.8 median (IQR 5.7-12.3)
Mean HbA1c, %: L: I 8.5/ C 8.5 M: I 8.0/ C 8.3 N: I 8.8/ C 8.8 O: I 8.1/ C 8.2 P: I 7.4/ C 7.6 Q: I 8.0/ C 8.0 R: I 8.3/ C 8.0 S: I 7.7/ C 8.0 T: I 8.2/ C 8.4 U: I 8.9/ C 8.9 V: I 8.3/ C 8.3 W: I 11.2/ C 11.7 X: I 13.6/ C 12.9 Y: I 7.3/ C 7.8 Z: 11.6
BMI, kg/m2 L-Z: not reported
Groups comparable at baseline? Yes
|
Describe intervention:
The intervention treatment was defined as receiving subcutaneous insulin infusions with a CSII device (E-G).
|
Describe control (all):
The control treatment was defined as receiving multidose injections (MDI) (E-G).
|
End-point of follow-up:
I: 12 months J: 8 months K: 6 months L: 4 months M: 6 months N: 12 months O: 6 months P: 14 months Q: 24 months R: 12 months S: 12 months T: 12 months U: 6 months V: 6 months W: 12 months
For how many participants were no complete outcome data available? (intervention/control)
I: I 5/ C 0 J: I 0/ C 0 K: I 1/ C 0 L: I 0/ C 0 M: I 0/ C 0 N: I 0/ C 0 O: I 0/ C 0 P: I 0/ C 0 Q: I 0/ C 0 R: I 0/ C 0 S: I 9/ C 12 T: 5 in total (in I or in C; not provided in which group) U: I 0/ C 0 V: Unreported W: I 0/ C 0
|
Outcome measure-3 Diabetic ketoacidosis (critical outcome ) Effect measure: risk ratio [95% CI]:
Adults B: 1.03 [0.07, 15.83] E: 1.63 [0.29, 9.32] F: 3.48 [1.32, 9.15] G: 3.08 [0.13, 73.25] I: 5.00 [0.24, 103.63] J: Not estimable
Pooled effect adults (random effects model): 2.79 [1.31, 5.95], clinically significant difference favoring comparator Heterogeneity (I2): 0%
Children and young adults < 20 years
L: 2.37 [0.10, 54.08] O: 0.50 [0.05, 4.98] P: 5.42 [0.29, 101.77] R: 2.00 [0.47, 8.46] U: 0.25 [0.03, 2.04] V: 1.04 [0.07, 16.31] Y: 1.27 [0.31, 5.16] Z: 5.17 [0.25, 106.82]
Pooled effect children and young adults < 20 years (random effects model): 1.29 [0.62, 2.69] clinical significant difference favoring comparator treatment Heterogeneity (I2): 0%
Pooled effect adults and children (random effects model): 1.87 [1.11, 3.17] clinical significant difference favoring comparator treatment Heterogeneity (I2): 0%
Outcome measure-4 Time in target (TIR), below (TBR) and above (TAR) glycemic range (critical outcome). Effect measure: mean difference [95% CI]:
Definition: difference of the mean time in the glycemic range (TIR; 3.9–10.0 mmol/L) as minutes per day
Adults G: 83 [17, 49], favoring the intervention treatment
Children and young adults < 20 years
Not applicable
Definition: mean percentage of TIR [percentage of readings in the glycemic range of 3.9–10.0 mmol/L (70–180 mg/dl) per unit of time], TAR and TBR
Adults: not applicable
Children and young adults < 20 years
TIR M: 5.00 [-2.77, 12.77] W: 6.60 [-13.47, 26.67]
Pooled effect children and young adults < 20 years (random effects model): 5.21 [-2.04, 12.46] clinical insignificant difference. Heterogeneity (I2): 0%
TBR M: -2.00 [-6.87, 2.87] W: -0.60 [-12.73, 11.53]
Pooled effect children and young adults < 20 years (random effects model): -1.81 [-6.33, 2.72] clinical insignificant difference. Heterogeneity (I2): 0%
TAR M: -3.00 [-14.95, 8.95] W: -6.00 [-24.51, 12.51]
Pooled effect children and young adults < 20 years (random effects model): -3.88 [-13.92, 6.16] clinical insignificant difference. Heterogeneity (I2): 0%
Children and young adults < 20 years
M: 5.00 [-2.77, 12.77] W: 6.60 [-13.47, 26.67]
Pooled effect children and young adults < 20 years (random effects model): 5.21 [-2.04, 12.46] clinical insignificant difference. Heterogeneity (I2): 0%
Outcome measure-5 Health related quality of life (important outcome). Effect measure: standardized mean difference [95% CI]:
Adults A: Not estimable B: Not estimable C: 0.23 [-0.82, 1.28]
Clinical insignificant difference
R: -0.22 [-1.28, 0.84] U: 0.58 [-0.07, 1.23] Y: 0.22 [-0.17, 0.62]
Pooled effect children and young adults < 20 years (random effects model): 0.27 [-0.05, 0.59] clinical insignificant difference Heterogeneity (I2): 0%
Pooled effect adults and children (random effects model): 0.27 [-0.04, 0.58] clinical insignificant difference Heterogeneity (I2): 0%
|
Facultative:
Brief description of Dos Santos conclusions (based on L-Z). ‘CSII modestly lower HbA1c when compared with MDI. Current literature does not provide adequate data on other glycemic outcomes.’
Personal remarks on study quality (L-Z), conclusions, and other issues (potentially) relevant to the research question
a) All studies were open label trials
b) Follow-up was relatively short (4-24 months) and whether results are applicable after 4-24 months remains unknown.
c) The studies were only sufficienty powered for HbA1c.
|
Table of quality assessment for systematic reviews of RCTs
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Pala (2019) |
Yes |
Yes |
Yes |
Yes |
not applicable |
Yes |
Yes |
Yes, funnel plot analyses were performed. Authors report that Publication bias might have influenced the results on HbA1C levels |
Yes: The authors declare that they have no conflict of interest. |
|
Dos Santos (2021) |
Yes |
Yes |
Yes |
Yes |
not applicable |
Yes |
Yes |
Yes. funnel plot analyses were performed and authors report no evidence of publication bias that might have biased the results |
Yes: the authors declare that they have no known competing financial interests or personal relationships that could have appeared to influence the work reported in their paper |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question:
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated? a
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?b
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?c
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?d
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?e
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?f
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measureg
LOW Some concerns HIGH
|
|
Little, 2018 |
Definitely yes
Using a Web-based system, and stratified by baseline HbA1c and by center, participants were allocated randomly on an equal allocation basis |
Probably yes;
Reason: Allocation sequence was generated by an individual not otherwise involved in participant recruitment. |
Probably no
This was an open label trial where both participants and health care providers knew who was randomized to which treatment. Unclear if data analysts were blinded |
Definitely no
Reason: Of the total amount of participants of n=97, 20 were lost to follow-up and 42 were switched from treatment arm during the study (after which the follow-up was censored). Unclear why patients switched from treatment arm. Also no mention was made in which arm patients went loss to follow-up (only a total number was provided) |
Probably yes
Reason: pre-published protocol available and results were published as was a-priori described. |
Probably no;
Reason: The trial was industry sponsored |
High concerns
Reason: Unblinded study where both participants and health care providers knew who was randomized to which treatment, lost to follow-up and/or switch from treatment arm after which follow-up was censored might have influenced all outcomes, industry sponsoring
|
- Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location). Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules..
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments, but this should not affect the risk of bias judgement. Blinding of those assessing and collecting outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment or data collection (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is usually not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary. Finally, data analysts should be blinded to patient assignment to prevents that knowledge of patient assignment influences data analysis.
- If the percentage of patients lost to follow-up or the percentage of missing outcome data is large, or differs between treatment groups, or the reasons for loss to follow-up or missing outcome data differ between treatment groups, bias is likely unless the proportion of missing outcomes compared with observed event risk is not enough to have an important impact on the intervention effect estimate or appropriate imputation methods have been used.
- Results of all predefined outcome measures should be reported; if the protocol is available (in publication or trial registry), then outcomes in the protocol and published report can be compared; if not, outcomes listed in the methods section of an article can be compared with those whose results are reported.
- Problems may include: a potential source of bias related to the specific study design used (e.g. lead-time bias or survivor bias); trial stopped early due to some data-dependent process (including formal stopping rules); relevant baseline imbalance between intervention groups; claims of fraudulent behavior; deviations from intention-to-treat (ITT) analysis; (the role of the) funding body. Note: The principles of an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
- Overall judgement of risk of bias per study and per outcome measure, including predicted direction of bias (e.g. favors experimental, or favors comparator). Note: the decision to downgrade the certainty of the evidence for a particular outcome measure is taken based on the body of evidence, i.e. considering potential bias and its impact on the certainty of the evidence in all included studies reporting on the outcome.
Table of excluded studies
|
Author |
Reason for exclusion |
|
Yeh (2012) |
more recent SR |
|
Atkin (2013) |
more recent SR |
|
Bolli (2016) |
Abstract only, no full text available |
|
Chubb (2013) |
more recent SR |
|
Culic (2016) |
more recent SR |
|
Dawoud (2015) |
more recent SR |
|
Dawoud (2018) |
more recent SR |
|
Diez-Fernandez (2019) |
more recentSR |
|
Dzygalo (2014) |
more recent SR |
|
Dzygalo (2014) |
more recent SR |
|
Einhorn (2015) |
Abstract only, too few information to know if it fits PICO |
|
Ericsson (2013) |
more recent SR |
|
Freemantle (2013) |
more recent SR |
|
Heller (2016) |
more recent SR |
|
Holmes (2019) |
more recent SR |
|
Liu (2018) |
more recent SR |
|
Mathews (2016) |
more recent SR |
|
Meneghini (2016) |
more recent SR |
|
Monami (2013) |
more recent SR |
|
Philis-Tsimikas (2016) |
more recent SR |
|
Ratner (2013) |
more recent SR |
|
Rodbard (2013) |
more recent SR |
|
Russell-Jones (2015) |
more recent SR |
|
Siegmund (2017) |
more recent SR |
|
Sorli (2013) |
more recent SR |
|
Vora (2014) |
more recent SR |
|
Wang (2012) |
more recent SR |
|
Yfantopoulos (2017) |
more recent SR |
|
Zhang (2018) |
Abstract only, no full text available |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 19-01-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2019 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor personen met diabetes mellitus type 1.
Werkgroep DM1
- Prof. Dr B.E. (Bastiaan) de Galan, internist, hoogleraar interne geneeskunde-diabetologie, Maastricht UMC, NIV (voorzitter);
- Dr. P.S. (Sytze) van Dam, internist niet-praktiserend, OLVG, locatie Oost, Amsterdam; NIV (voorzitter);
- Dr. A.C. (Arianne) van Bon, internist-endocrinoloog, Rijnstate, Arnhem, NIV;
- Dr. T.C.J. (Theo) Sas, kinderarts-endocrinoloog, Erasmus MC, Sophia Kinderziekenhuis, Rotterdam; Diabeter, Rotterdam, NVvK;
- Dr. H (Harold) de Valk, Internist endocrinoloog, UMC Utrecht, NIV;
- P.L.M. (Petra) Bouhuijzen, diabetesverpleegkundige, St. Antonius Ziekenhuis, Utrecht, Nieuwegein; V&VN;
- T.M. (Ties) Obers, beleidsmedewerker Diabetesvereniging Nederland, Leusden; DVN.
Klankbordgroep DM1
- Dr. M. (Manuel) Castro Cabezas, NIV
- Dr. T.M. (Titia) Vriesendorp, NIV
- Dr. S.E. (Sarah) Siegelaar – Luijnenburg, NIV
- Drs. J.M. (Marieke) van Haren-Loezmans, Koninklijke Nederlandse Maatschappij ter bevordering der Pharmacie
- Drs. R.M. (Richard) Posthuma; NVZ
- Drs. A.M. (Aisha) Salarbaks; NVKG
- Sue Holleman; V&VN Diabeteszorg
- Dr. K.A.C. (Kirsten) Berk; NVD-Netwerk Diabetesdiëtist.
- Dr. P.J.H.M (Pauline) Stouthart; NVK
- Dr. M.W.F. (Martin) van Leen; vereniging van en voor specialisten ouderengeneeskunde (Verenso)
- Dr. E.H. (Erik) Serné, Internist-vasculaire geneeskunde/diabetologie, Amsterdam UMC, locatie VUmc, Amsterdam, NIV
Stuurgroep Modulair onderhoud diabetesrichtlijnen
- Dr. P.S. (Sytze) van Dam, internist niet-praktiserend, OLVG, locatie Oost, Amsterdam, NIV (overkoepelend voorzitter);
- Dr. E.H. (Erik) Serné, Internist-vasculaire geneeskunde/diabetologie, Amsterdam UMC, locatie VUmc, Amsterdam, NIV;
- Prof. Dr B.E. (Bastiaan) de Galan, internist, hoogleraar interne geneeskunde-diabetologie, Maastricht UMC+, NIV.
- Dr C. (Carolien) Beukhof, internist, Ikazia Ziekenhuis, Rotterdam
Met ondersteuning van
- Dr. W.M. (Willem) Lijfering, klinisch epidemioloog, senior-adviseur; Kennisinstituut van de Federatie van Medisch Specialisten;
- N.F. (Natalia) Bullock, secretaresse; Kennisinstituut van de Federatie van Medisch Specialisten.
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
de Galan (vz) |
Internist/hoogleraar, MUMC+ Maastricht (0,8 fte), Internist, Radboudumc Nijmegen (0,2 fte) |
Docent/cursusleider DESG cursus voor aios interne geneeskunde en kindergeneeskunde (betaald; naar MUMC) Associate editor Diabetologia (betaald; naar MUMC) Bestuurslid Nederlandse Vereniging voor Endocrinologie (NVE; onbetaald), Voozitter accreditatiecommissie NIV (vacatiegelden), Lid COIG examencommissie NIV (vacatiegelden), Voozitter J. Terpstraprijs commissie NVDO (onbetaald) Organisatie nascholingsreeks Diabetes Overleg (betaald, naar MUMC) Organisatie nascholingsreeks Dutch Diabetes Academy (betaald, naar MUMC) |
Financier: Novo Nordisk. Inh onderzoek: ADREM study (investigator initiated trial naar aanpassing van degludec bij sport bij mensen met type 1 diabetes, unrestricted grant). Rol projectleider (PL): ja Fin: Horizon Europe Framework Programme. Inh ondz: Hypoglycaemia- redefining sollutions for better lives Rol PL:ja Horizon Europe Framework Programme. Inh ondz: MELISSA (mobile artificial intelligence solution for diabetes adaptive care) Rol PL: ja |
Geen |
|
van Dam (co-vz) |
Internist endocrinoloog OLVG Amsterdam (momenteel onbetaald verlof). |
Ondersteuning Amsterdam Diabetes Centrum (vooralsnog onbetaald). |
Actief betrokken bij de ontwikkeling van een diabetescentrum (vooral type 1) in Amsterdam (samenwerking Amsterdam UMC met OLVG). |
Geen |
|
van Bon |
Internist-endocrinoloog Rijnstate ziekenhuis. |
Laag frequent geven van nascholing over diabetes, met name aan POH-ers en diabetes-verpleegkundigen (deels betaald door Sanofi, Novo Nordisk). |
Geen financieel belang. Nauw betrokken bij de ontwikkeling van kunstalvleesklier van het bedrijf lnreda Diabetic (testen prototypes; onbetaald). |
Geen |
|
Sas |
Kinderarts-endocrinoloog (0.55 fte) ErasmusMC - Sophia Rotterdam; kinderarts-endocrinoloog (0.4 fte) Diabeter, Rotterdam. |
Commissie lid sensor richtlijn NDF vanuit NVK - onbetaald Secretaris ESPE Working Group on Turner syndrome - onbetaald Voorzitter werkgroep Groei en Ontwikkeling van NVE - onbetaald |
Financier: Diamyd Medical AB, Stockholm, Sweden. Inhoud onderz: Intralymphatic GAD-alum (Diamyd) - flycaemic control in Type 1 diabetes with HLA DR3-DQ2. PL: nee. Financier: JDRF. Inh onderz: Biomarker studie. Projectleider (PL): nee. Financier: DICA. Inh onderz: Zorgconsumptie bij mensen met DM in NL. PL: deels |
Geen trekker bij uitgangsvragen m.b.t. glucose management. |
|
Bouhuijzen |
Diabetes-verpleegkundige St. Antonius Ziekenhuis |
gastdocent Academie St. Antonius Ziekenhuis (betaald) |
Geen |
Geen |
|
Obers |
Beleidsmedewerker Belangenbehartiging, Diabetes Vereniging Nederland (24 uur/week); freelance adviseur voor Goede Doelen, Groei voor Goed (16 uur/week). |
Lid Cliëntenraad, UMC Utrecht (vrijwilligersvergoeding). |
Boegbeeldfunctie bij patiëntenorganisatie. |
Geen |
|
De Valk |
Internist endocrinoloog UMC Utrecht |
-Voorzitter Zorgstandaard Diabetes technologie NDF -Voorzitter Werkgroep Medische Hulpmiddelen Ronde tafel Diabetes (ZINL & NDF) -Lid Ronde Tafel Diabetes (ZINL & NDF) -Lid Diabeteskamer NIV
Alles onbetaald |
Extern gefinancierd onderzoek:
Randomsed trial dual hormone closed loop, financier Zorginstituut Nederland, projectleider: ja
ONWARDS 4, GLP1-analoga (type 2 diabetes), financier: NovoNordisk, projectleider: nee
ONWARDS6, GLP1-analoga (type 1 diabetes), financier: novo nordisk. Projectleider: nee
Trial Boehringer, nieuw geneesmiddel voor diabetische nefropathie: financier Boehringer, projectleider: nee |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van de patiëntenvereniging (Diabetesvereniging Nederland) in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De richtlijn is tevens voor commentaar voorgelegd aan Diabetesvereniging Nederland. De aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de stuurgroep van het project Modulair onderhoud diabetesrichtlijnen, en de werkgroep DM1, de knelpunten in de zorg van personen met diabetes mellitus type 1. Het project Modulair onderhoud diabetesrichtlijnen is gestart met een brede algemene analyse van de knelpunten in de zorg voor personen met diabetes: een schriftelijke knelpuntanalyse bij NIV, V&VN, DVN en het NHG, aangevuld met een enquête tijdens de Internistendagen (24-26 april 2019, Maastricht) en een inventarisatie van de belangrijkste knelpunten (top-3) bij de genodigden voor de invitational conference. In de invitational conference zijn de uitkomsten van de schriftelijke knelpuntenanalyses besproken en waar nodig aangevuld, en is een eerste prioritering van de meest urgente revisies (bestaande modules) en aanvullingen (nieuwe modules) vastgesteld (zie verslag invitational in de bijlage). De stuurgroep heeft de definitieve prioritering vastgesteld waarna onderwerpen zijn geclusterd en afzonderlijke werkgroepen zijn samengesteld op basis van de benodigde expertise, waaronder een werkgroep DM1. De werkgroep DM1 heeft de knelpunten rondom de zorg voor patiënten met DM1 verder geanalyseerd en concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Indien relevant worden algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas, T., Merglen, A., Heen, A. F., Kristiansen, A., Neumann, I., Brito, J. P., ... & Guyatt, G. H. (2017). UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ open, 7(11):e018593.
Alonso-Coello, P., Schünemann, H. J., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., ... & GRADE Working Group. (2016). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. bmj, 353:i2016.
Alonso-Coello, P., Oxman, A. D., Moberg, J., Brignardello-Petersen, R., Akl, E. A., Davoli, M., ... & GRADE Working Group. (2016). GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. bmj, 353:i2089.
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Zitzelsberger, L. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Cmaj, 182(18), E839-E842.
Hultcrantz, M., Rind, D., Akl, E. A., Treweek, S., Mustafa, R. A., Iorio, A., ... & Guyatt, G. (2017). The GRADE Working Group clarifies the construct of certainty of evidence. Journal of clinical epidemiology, 87, 4-13.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann, I., Santesso, N., Akl, E. A., Rind, D. M., Vandvik, P. O., Alonso-Coello, P., ... & Guyatt, G. H. (2016). A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. Journal of clinical epidemiology, 72, 45-55.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
