Detemir, glargine en protamine Hagedor
Uitgangsvraag
Hebben langwerkende insulineanalogen (detemir, glargine) de voorkeur boven NPH insuline?
Aanbeveling
Stem de insuline behandeling af op de individuele eet- en leefpatronen van de patiënt.
Houd hierbij rekening met de farmacokinetische eigenschappen van de verschillende insulines.
Gebruik gezien de grote intraindividuele variatie in absorptie bij voorkeur langwerkende insuline-analogen in plaats van NPH insuline.
Overwegingen
Bovenstaande meta-analyse laat een grotere reductie zien van Hb1Ac bij het gebruik van langwerkende insulineanalogen dan bij het gebruik van NPH insuline (Sanches et al., 2011). Dit verschil van 0,09% is zeer beperkt, maar statistisch wel significant. De meta-analyses geven geen statistisch significant verschil van het overall risico op hypoglycemie of het risico op een nachtelijke hypoglycemie. De drie andere systematische reviews (Szypowska et al., 2011; Garg et al., 2010; Monami et al., 2009) includeerden ook cross-over studies, studies bij kinderen en adolescenten, en niet-gepubliceerde RCT’s, waarbij er geconcludeerd werd dat er wel een afname in het overall risico op hypoglycemieen, nachtelijke hypoglycemieen en ernstige hypoglycemieen was. Naast de absolute kans op een hypoglycemie is de impact van een ernstige hypoglycemie op de kwaliteit van leven en het risico op slechtere regulatie hierna wegens angst voor hypoglycemieën zeker ook van belang. Een belangrijk nadeel van NPH insuline is de grote intra-individuele variatie in de kinetiek van NPH insuline (26%; Kolenberg et al., 1978; Lepore et al., 2000). Het begin van het glucose verlagend effect van NPH insuline varieert van 1-7 uur en het maximale effect tussen 5 en 19 uur (Roy et al., 1980) waardoor het effect onbetrouwbaar wordt. Er zijn ook nog latere studies die hetzelfde laten zien. Overigens zijn insulineanalogen bij hogere doses ook niet helemaal piekloos. Hierbij kan het veranderen van de tijd van toedienen en/of de frequentie van de injecties de kans op hypoglycemie verlagen (Roach, 2008).
Vooralsnog zijn er onvoldoende aanwijzingen gevonden dat er een associatie is tussen langwerkende insulineanalogen en maligniteiten (Colhoun et al., 2009; Currie et al., 2009; Home & Lagarenne, 2009; Jonasson et al., 2009; Mannucci et al., 2010; Morden et al., 2011; Rosenstock et al., 2009; Ruiter et al., 2012; Suissa et al., 2011).
In conclusie, aangezien het gebruik van langwerkende insulineanalogen een marginale extra reductie van het HbA1c laat zien ten opzichte van NPH insuline en er eveneens geen vermindering van (nachtelijke) hypoglycemieen optreedt bij langwerkende insulineanalogen, is een duidelijk voordeel van de langwerkende insulineanalogen ten opzichte van NPH insuline niet bewezen. Langwerkende insuline wordt echter gegeven als basaal insuline en niet om het glucose te verlagen, een belangrijk effect op het HbA1c wordt dan ook niet verwacht. Omdat in de studies patiënten met zeer uiteenlopende HbA1c’s zijn onderzocht is er geen goede uitspraak te doen of bij scherpe instelling wel verschillen zullen zijn. De kans op hypoglycemieën staat dus meer op de voorgrond. De farmacokinetiek van insulineanalogen is meer fysiologisch en de intraindividuele variatie in absorptie bij NPH insuline zeer groot. Derhalve, kan op patiëntniveau toch een goede reden zijn om voor een langwerkend insulineanaloog te kiezen, zoals nachtelijke hypoglycemieën en het Dawn fenomeen. Omdat bij de insulinebehandeling voor iemand met DM1 maatwerk op de voorgrond staat, is het van belang dat het gehele arsenaal aan insulines beschikbaar is.
Onderbouwing
Conclusies / Summary of Findings
|
MATIG
|
Toepassing van langwerkende insulineanalogen bij patiënten met type 1 diabetes leidt tot een beperkte, maar statistisch significante, verlaging van het HbA1c ten opzichte van NPH insuline.
Sanches et al, 2011; Szypowska et al, 2011; Garg et al, 2010; Monami et al, 2009 |
|
LAAG
|
Toepassing van langwerkende insulineanalogen bij patiënten met type 1 diabetes leidt tot minder nachtelijke hypoglycemieen ten opzichte van NPH insuline.
Er bestaat grote heterogeniteit tussen studies, een afname van nachtelijke hypoglycemieën wordt niet altijd waargenomen
Sanches et al., 2011; Szypowska et al., 2011; Garg et al., 2010; Monami et al., 2009 |
Samenvatting literatuur
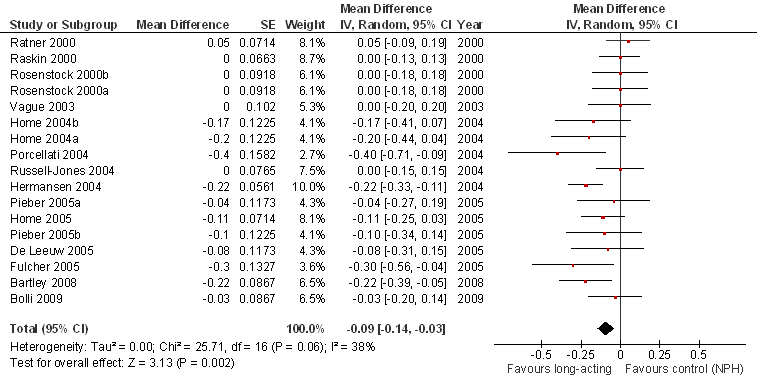
De zoekactie leverde vijf systematische reviews op (Sanches et al., 2011; Szypowska et al., 2011; Garg et al., 2010; Monami et al., 2009; Dejgaard et al., 2009). Het meest recente systematische review (Sanches et al., 2011) is van goede kwaliteit, en includeert 16 RCT’s gepubliceerd tot december 2010. De belangrijkste uitkomstmaten zijn glycemische controle (HbA1c) en bijwerkingen in de vorm van hypoglycemie. De zoekactie leverde geen relevante recentere RCT’s op. De inclusiecriteria van Sanches et al. (2011) en de belangrijkste karakteristieken van de geselecteerde studies, inclusief een beoordeling van de studiekwaliteit (Jadad-score), zijn te vinden in de evidence-tabel. De geïncludeerde RCT’s hebben een parallel design met 124 tot 747 deelnemers en een studieduur variërend van vier weken tot ruim twee jaar. Onder de vijftien studies die HbA1c als maat voor de glycemische controle vergeleken tussen de groep behandeld met detemir of glargine, en de controlegroep behandeld met NPH insuline, was er in vier studies sprake van een statistisch significant grotere reductie in HbA1c in de interventiegroep (0,22-0,40%, p<0,05; follow-up 4-26 maanden). In de overige elf studies was het verschil tussen interventie- en controlegroep statistisch niet significant. Een meta-analyse geeft een grotere reductie te zien in Hb1Ac in de interventiegroep dan in de controlegroep, het verschil is klein maar wel statistisch significant (Figuur 2; gemiddelde verschil, MD; MD=-0,09 [-0,14; -0,03]). Er wordt geen statistisch significant verschil waargenomen tussen glargine en detemir (detemir versus NPH, MD=-0,13 [-0,19, -0,06]; glargine versus NPH, MD=-0,06 [-0,14; 0,02]). Bij vergelijking van de frequentie van hypoglycemische episodes tussen glargine (vijf studies) of detemir (acht studies) en NPH insuline (controlegroep) ontstaat een inconsistent beeld met een grote verschillen tussen de afzonderlijke studies. Meta-analyses geven geen statistisch significant verschil te zien in het overall risico op hypoglycemie, of het risico op nachtelijke hypoglycemie.
Figuur 2 Vergelijking in effectiviteit tussen langwerkende insulineanalogen (glargine of detemir) en NPH insuline (Effectiviteit is gebaseerd op een vergelijking van HbA1c waardes (mean difference, MD)).
De drie eerdere systematische reviews (Szypowska et al., 2011; Garg et al., 2010; Monami et al., 2009) includeren ook cross-over studies, studies bij kinderen en adolescenten, en niet-gepubliceerde RCT’s. Voor wat betreft de effecten op de glycemische controle (HbA1C), komen de conclusies in deze studies overeen met die van Sanches et al. (2011). Meta-analyses geven een geringe extra reductie in HbA1c te zien in de interventiegroep (MD=–0.07 [–0.13; –0.01]; Szypowska et al., 2011; Monami et al., 2009). Het afwijkende inclusiebeleid heeft wel invloed op de geschatte effecten van langwerkende insulineanalogen op het risico van hypoglycemie. De studies rapporteren een afname in het overall risico op hypoglycemie (afname met 2-18%), het risico op nachtelijke hypoglycemie (met 12-31%; p<0,05), en het risico op ernstige hypoglycemie (met 27-33%; p<0,05).
Bij beoordelen van de studies volgens GRADE is de bewijskracht matig voor effecten van behandeling met langwerkende insulineanalogen op HbA1c, er is één punt afgetrokken vanwege ernstige beperkingen in studieopzet (geen verborgen groepstoewijzing en geen blindering van de behandeling in meerderheid van de studies). De bewijskracht voor de effecten op het optreden van hypoglycemie zijn laag vanwege de beperkingen in studieopzet, en vanwege inconsistentie (grote onverklaarde variatie tussen studies).
Referenties
- Brock Jacobson, I., Vind, B. F., Korsholm, L., Flyvbjerg, A., Frystyk, J., Holst, J. J., Beck-Nielsen, H., & Henriksen, J.E. (2011). Counter-regulatory hormone responses to spontaneous hypoglycaemia during treatment with insulin Aspart or human soluble insulin: a double-blinded randomized cross-over study. Acta Physiologica, 202, 337-347.
- Colhoun, H. M., SDRN Epidemiology Group (2009). Use of insulin glargine and cancer incidence in Scotland: a study from the Scottish Diabetes Research Network Epidemiology Group. Diabetologia 52:17661777.
- Currie CJ, Poole CD, Gale EA (2009). The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia 52:17661777.
- Dejgaard, A., Lynggaard, H., Rastam, J., & Krogsgaard, T. M. (2009). No evidence of increased risk of malignancies in patients with diabetes treated with insulin detemir: a meta-analysis. Diabetologia, 52, 2507-2512
- Garg, S., Ampudia-Blasco, F. J., & Pfohl, M. (2010). Rapid-acting insulin analogues in Basal-bolus regimens in type 1 diabetes mellitus. Endocr Pract., 16, 486-505.
- Garg, S., Moser, E., Dain, M. P., & Rodionova, A. (2010). Clinical experience with insulin glargine in type 1 diabetes. Diabetes Technology & Therapeutics, 12, 835-846.
- Home, P.D., & Lagarenne, P. (2009). Combined randomised controlled trial experience of malignancies in studies using insulin glargine. Diabetologia, 52, 24992506.
- Jonasson JM, Ljung R, Talback M, Haglund B, Gudbjornsdottir S, Steineck G. Insulin glargine use and short-term incidence of malignancies-a population-based follow-up study in Sweden. Diabetologia. 2009;52:17451754.
- Kølendorf, K., Aaby, P., Westergaard, S., & Deckert, T. (1978). Absorption, effectiveness and side effects of highly purified porcine NPH-insulin preparations (Leo). Eur J Clin Pharmacol., 14, 117-124.
- Lepore, M., Pampanelli, S., Fanelli, C., Porcellati, F., Bartocci, L., Di Vincenzo, A., Cordoni, C., Costa, E., Brunetti, P., & Bolli, G.B. (2000). Pharmacokinetics and pharmacodynamics of subcutaneous injection of long-acting human insulin analog glargine, NPH insulin, and ultralente human insulin and continuous subcutaneous infusion of insulin lispro. Diabetes, 49, 2142-2148.
- Mannucci E, Monami M, Balzi D, et al. (2010). Doses of insulin and its analogues and cancer occurrence in insulin-treated type 2 diabetic patients. Diabetes Care 33:19972003.
- Monami, M., Marchionni, N., & Mannucci, E. (2009). Long-acting insulin analogues vs. NPH human insulin in type 1 diabetes. A meta-analysis. Diabetes, Obesity & Metabolism, 11, 372-378.
- Morden, N., Liu, S., Smith, J., Mackenzie, T., Skinner, J., & Korc, M. (2011). Further exploration of the relationship between insulin glargine and incident cancera retrospective cohort study of older Medicare patients. Diabetes Care, 34, 19651971.
- Roach, P. (2008). New insulin analogues and routes of delivery: pharmacodynamic and clinical considerations. Clin Pharmacokinet., 47, 595-610.
- Rosenstock, J., Fonseca, V., McGill, J.B., et al. (2009). Similar risk of malignancy with insulin glargine and neutral protamine Hagedorn (NPH) insulin in patients with type 2 diabetes: findings from a 5 year randomised, open-label study. Diabetologia, 52, 19711973.
- Roy, B., Chou, M.C., & Field, J.B. (1980). Time-action characteristics of regular and NPH insulin in insulin-treated diabetics. J Clin Endocrinol Metab., 50, 475-479.
- Ruiter, R., Visser, L.E., van Herk-Sukel, M.P.P., Coebergh, J.W.W., Haak, H.R., Geelhoed-Duijvestijn, P.H., Straus, S.M.J.M., Herings, R.M.C., & Ch. Stricker, B.H. (2012). Risk of cancer in patients on insulin glargine and other insulin analogues in comparison with those on human insulin: results from a large population-based follow-up study. Diabetologia, 55, 5162.
- Rys, P., Pankiewicz, O., Lach, K., Kwaskowski, A., Skrzekowska-Baran. I. & Malecki, M. T. (2011). Efficacy and safety comparison of rapid-acting insulin aspart and regular human insulin in the treatment of type 1 and type 2 diabetes mellitus: a systematic review. Diabetes & Metabolism, 37, 190-200.
- Sanches, A. C. C., Correr, C. J., Venson, R., & Pontarolo, R. (2011). Revisiting the efficacy of long-acting insulin analogues on adults with type 1 diabetes using mixed-treatment comparisons. Diabetes research and clinical practice, 94, 333-339.
- Singh, S. R., Ahmad, F., Lal, A., Yu, C., Bai, Z., & Bpharm, H.B. (2009). Efficacy and safety of insulin analogues for the management of diabetes mellitus: A meta-analysis. CMAJ, 180, 385-397.
- Suissa, S., Azoulay, L., Dell'aniello, S., Evans, M., Vora, J., & Pollak, M. (2011). Long-term effects of insulin glargine on the risk of breast cancer. Diabetologia, 54, 22542262.
- Szypowska, A., Golicki, D., Groele, L., & Pankowska, E. (2011). Long-acting insulin analogue detemir compared with NPH insulin in type 1 diabetes: a systematic review and meta-analysis. Pol Arch Med Wewn, 121, 237-246.
Evidence tabellen
Research question: Does the use of long-acting insulin analogs instead of NPH human insulin improve treatment of patients with type 1 diabetes?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Sanches, 2011
[individual study charac-teristics deduced from Sanches, 2011] |
SR and meta-analysis of 16 RCTs
Literature search up to Dec 2010
A: Home, 2005 B: Porcellati, 2004 C: Raskin, 2000 D: Ratner, 2000 E: Rosenstock, 2000a F: Bolli, 2009 G: Fulcher, 2005 H: Bartley, 2008 I: De Leeuw, 2005 J: Hermansen, 2004 K: Home, 2004a L: Home, 2004b M: Pieber, 2005a N: Pieber, 2005b O: Russell-Jones, 2004 P: Pieber, 2007
Source of funding: 3 studies on glargine and 6 on detemir were sponsored by pharmaceutical industry |
Inclusion criteria SR: RCT, adult patients with established type 1 diabetes, received long-acting insulin analogue (glargine or detemir) or NPH insulin alone or in combination with rapid acting insulin analogues (Lispro or Aspart) for at least 4 weeks
Exclusion: studies with crossover design
N; mean age A: 585; 39.0 yrs B: 124; 35.0 yrs C: 619; 39.2 yrs D: 534; 38.6 yrs E: 344; 37.7 yrs F: 175; 40.5 yrs G: 125; 36.3 yrs H: 495; 35.0 yrs I: 315; 40.5 yrs J: 585; 39.0 yrs K: 585; 39.8 yrs L: 271; 39.6 yrs M: 268; 40.0 yrs N: 261; 40.7 yrs O: 747; 40.3 yrs P: 320; 41.0 yrs
BMI (kg/m2) A: 24.9 B: 23.1 C: 25.6 D: 25.8 E: 24.3 F:23.5 G: 26.6 H: 24.7 I:24.5 J:24.8 K:25.2 L:25.2 M:25.2 N:25.2 O:25.3 P: 25.6
|
Long-acting analogs (LAA)
Glargine dose (U/Kg/Day) A: 0.27 B: 0.66 C: NA D: NA E: NA F: 0.28 G: 0.39
Detemir dose (U/Kg/Day) H: 0.37 I: 0.36 J: 0.44 K: 0.48 L: 0.48 M: 0.35 N: 0.34 O: 0.31
In 2 studies (P; one study not detailed), Glargine was compared to Detemir
dose (U/Kg/Day) P: 0.39 (glargine) vs 0.36 (detemir)
|
NPH
dose (U/Kg/Day) A: 0.28 B: 0.64 C: NA D: NA E: NA F: 0.28 G: 0.39
H: 0.36 I: 0.36 J: 0.38 K: 0.48 L: 0.48 M: 0.32 N: 0.32 O: 0.31
|
Endpoint of follow-up: Treatment duration (weeks) A: 28 B: 54 C: 16 D: 28 E: 4 F: 30 G: 30 H: 108 I: 54 J: 18 K: 16 L: 16 M: 16 N: 16 O: 28 P: 52
For how many participants were no complete outcome data available? Not stated
|
Effect on glycemic control (HbA1c), adverse effects (any hypoglycemia episode, nocturnal hypoglycemia); mean difference, OR [95%CI]
Mean difference HbA1c (1) Glargine minus NPH A: -0.11 [-0.25, 0.03] B: -0.40 [-0.71, -0.09] C: 0.00 [-0.13, 0.13] D: 0.05 [-0.09, 0.19] E: 0.00 [-0.18, 0.18] F: -0.03 [ -0.20, 0.14] G: -0.30 [ -0.56, -0.04] Total: -0.06 [-0.14, 0.02] Heterogeneity: I2=44%
(2a) Detemir once a day H: -0.22 [-0.39, -0.05] O: 0.00 [-0.15, 0.15] Subtotal: -0.11 [-0.32, 0.11] Heterogeneity: I2=71% Note: only 2 studies
(2b) Detemir twice a day I: -0.08 [-0.31, 0.15] J: -0.22 [-0.33, -0.11] K: -0.20 [-0.44, 0.04] L: -0.17 [-0.41, 0.07] M: -0.04 [-0.27, 0.19] N: -0.10 [-0.34, 0.14] Subtotal : -0.14 [-0.22, -0.07] Heterogeneity: I2=0%
Total: -0.13 [-0.19, -0.06] Heterogeneity: I2=13%
(3) Glargine or detemir (minus NPH): (1) and (2) combined Total: -0,09 [-0,14; -0,03] Heterogeneity: I2=38%
(4) Glargine minus detemir P: -0.13 [-0.32, 0.06] Total (95%CI): -0.07 [-0.19, 0.06] Heterogeneity: I2=0% Note: only 2 studies
Adverse effects (hypoglycemia) OR [95%CI] (1) Glargine vs. NPH Hypoglycemia 1.12 [0.69-1.81] Nocturnal 1.93 [0.78-4.79] High heterogeneity (I2>66%)
(2) Detemir vs. NPH: Hypoglycemia 0.88 [0.52-1.51] Nocturnal 0.91 [0.52-1.60] High heterogeneity (I2>83%)
(3) Glargine vs. Detemir: Hypoglycemia 2.05 [0.98-4.29] Nocturnal 1.24 [0.83-1.84] Only 2 studies included |
Authors conclude that there are no significant differences in HbA1c change between glargine or detemir (once daily) and conventional human insulin (NPH insulin). Twice daily regimen of detemir caused a difference in HbA1c that favored detemir (-0.14% [-0.22; -0.07]). No significant differences between glargine and detemir in safety or HbA1c mean change
Note that results for hypoglycemia were inconsistent (high heterogeneity; I2); also note that the definition of hypoglycemia was not consistent across the studies
Quality of RCTs (Jadad score): Max=5 A: 2 B: 4 C: 2 D: 0 E: 5 F: 2 G: 2 H: 2 I: 2 J: 2 K: 2 L: 2 M: 2 N: 2 O: 2 P: 3
Level of evidence: GRADE
Across all studies analysed
MODERATE* LAA vs NPH Effect on HbA1c
LOW** LAA vs NPH Adverse effects (hypoglycemic episodes)
*Downgraded 1 point because of serious study limitations: low Jadad score (lack of blinding and allocation concealment)
**Downgraded 2 points because of serious study limitations (low Jadad score), and imprecision (high heterogeneity; wide confidence intervals)
|
|
Szypowska, 2011
|
SR and meta-analysis of 10 RCTs
Literature search up to Nov 2010
|
Inclusion criteria SR: RCTs ≥ 12 weeks; basal‑bolus therapy; DM type 1 with history ≥1 year
Crossover trials and trials with children or adolescents not excluded
Unpublished trials (Novo Nordisk) were also included
|
Long-acting analogs (LAA)
Detemir |
NPH |
Endpoint of follow-up: Treatment duration 4-24 months
For how many participants were no complete outcome data available? Not stated
|
Effect on glycemic control (HbA1c), adverse effects (any / nocturnal / severe hypoglycemia); weighted mean difference, OR [95%CI]
Mean difference HbA1c Detemir minus NPH Total: –0.073 [–0.135; –0.011] Heterogeneity: I2=0%
Adverse effects(hypoglycemia) RR [95%CI] Detemir vs. NPH: All 0.98 [0.961; 0.996]; I2=26% Nocturn 0.88 [0.82; 0.94]; I2=0 Severe 0.67 [0.55; 0.81]; I2=51
|
Authors conclude that detemir, as compared with NPH, provided a minor benefit in terms of the HbA1c, and reduced the risk of all‑day, nocturnal, and severe hypoglycemic episodes
Note: meta-analysis differs from that in Sanches et al (2011) in that a cross-over study and a study on children/adolescents was included as well as 3 unpublished trials from the Novo Nordisk trial registry
Level of evidence: GRADE (analyzed collectively; see Sanches, 2011)
|
|
Garg, 2010 |
SR of 19 RCTs
9 RCTs comparing glargine with NPH (MDI regimen)
No meta-analysis
Literature search up to Feb 2010
|
Inclusion criteria SR: RCTs ≥ 12 weeks; patients (adult, children, adolescents) using once-daily insulin glargine
Exclusion: pregnant women; studies not providing separate data on T1DM
Crossover trials and trials with children or adolescents not excluded
Very small studieswith ≤50 patients were also included |
Long-acting analogs (LAA)
Glargine |
NPH (MDI) |
Endpoint of follow-up: Treatment duration 3-12 months
For how many participants were no complete outcome data available? Not stated
|
Effect on glycemic control (HbA1c), adverse effects (any / nocturnal / severe hypoglycemia); p-values
No meta-analysis
Effects on HbA1c out of 9 RCTS: 4 showed statistically significantly greater improvements with glargine compared with NPH insulin 4 showed no difference 1 showed slightly increased HbA1c (P=NS)
Adverse effects(hypoglycemia) Out of 9 RCTs: 5 showed significantly reduced risk of symptomatic hypoglycemia 4 showed no difference in risk
|
Authors conclude that glycemic control with glargine is at least comparable to that with NPH, while the risk for hypoglycemia is significantly reduced
Note: SR differs from Sanches et al (2011) in that a cross-over study, a subgroup analysis and a very small study were included, and no meta-analysis was performed |
|
Monami, 2009
|
SR and meta-analysis of 20 RCTs
Literature search up to Apr 2008
|
Inclusion criteria SR: RCTs ≥ 12 weeks; T1DM patients
Exclusion criteria: prandial insulin not comparable in treatment arms
Crossover trials and trials with children or adolescents not excluded
4 unpublished trials were also included
|
Long-acting analogs (LAA)
Detemir Glargine
Prandial insulin: RHI (4 RCTs), short-acting insulin analogues (16 RCTs) |
NPH
Prandial insulin: indentical to treatment arm |
|
Effect on glycemic control (HbA1c), adverse effects (any /severe /nocturnal hypoglycemia); mean difference, OR [95%CI]
Mean difference HbA1c Total: -0.07 [-0.13; -0.01]; different LAA (detemir, glargine) yielded similar results
Adverse effects (hypoglycemia) OR [95%CI]; MH estimates
Any/severe/nocturnal 12 / 15 /13 RCTs
Any 0.82 [0.61; 1.07] Severe 0.73 [0.60; 0.89] Nocturnal 0.69 [0.55; 0.86]
similar point-estimates for glargine and detemir, but OR estimates for severe and nocturnal hypoglycemia not statistically significant for glargine (these RCTs enrolled fewer patients)
|
Authors conclude that long-acting analogues as basal insulin replacement DMT1 patients had a small (beneficial) effect on HbA1c, and also reduced the risk of nocturnal and severe hypoglycaemia (by about 30%)
Note that the overall incidence of hypoglycemia does not appear to be different between LAAs and NPH insulin
Note: meta-analysis differs from that in Sanches et al (2011) in that cross-over studies, studies on children/adolescents were included as well as 3 unpublished trials |
|
Dejgaard, 2009
|
SR and IPD meta-analysis of 21 RCTs (all open-labelled)
Source of funding: Individual patient data (IPD) analysis of Novo Nordisk-sponsored RCTs; authors are employed by Novo Nordisk |
Inclusion criteria SR: Novo Nordisk sponsored RCTs with type 1 or type 2 diabetes (IPD available); insulin detemir versus NPH insulin or insulin glargine; duration > 12 weeks
Exclusion criteria (IPD analysis): children
21 Novo Nordisk studies met the criteria
N= 8,693 (total): detemir (3,983) versus NPH (2,661), and detemir (1,219) versus glargine (830)
Patient characteristics (mean) Mean age 48-52 y Type 1 diab 37-52% Diab duration 13-15 y BMI 27-29 kg/m2 HbA1c 8.1-8.6% Male 54-56%
|
Long-acting analogs (LAA)
Detemir
In 5 out of 21 studies, detemir was compared to glargine (instead of NPH)
|
NPH
|
Endpoint of follow-up: Median exposure
Detemir: 24.0 weeks NPH: 23.9 weeks
In studies comparing detemir to glargine: 51 weeks
For how many participants were no complete outcome data available? Not stated
|
Malignant neoplasm (cancer); OR, adjusted OR [95%CI]
Outcome assessment: suspected treatment-emergent malignant tumours were identified in a blinded manner from databases of adverse events
Malignant neoplasm (cancer) Cases; rate/100 exposure years; OR; adjusted OR (stratified; MH estimate)
Detemir versus NPH Cases: 8 versus 13 Rate: 0.36 versus 0,92 Crude OR: 2.44 [1.01–5.89] Adjusted OR: 2.53 [1.02–6.28] stratified on trial Adjusted OR: 2.35 [0.97–5.70] stratified on DM type
Detemir versus glargine Cases: 8 versus 8 Rate: 0.87 versus 1.27 Crude OR: 1.47 (0.55–3.94) Adjusted OR: 1.32 [0.51–3.43] stratified on trial Adjusted OR: 1.46 [0.55–3.90] stratified on DM type
|
Authors conclude that patients treated with insulin detemir had a lower or similar occurrence of a cancer diagnosis compared with patients treated with NPH insulin or insulin glargine
Note that incidence rate of cancer in this study population is low (probably due to inclusion and exclusion criteria of the RCTs), and length of followup is short: low number of cases; study does not allow definitive conclusions on risk of cancer promotion by insulin analogues
Note: literature was not searched systematically for insulin analogs in relation to cancer risk; e.g. also see Home et al (2009; Diabetologia 52:2499-2506), and Ruiter et al (2012; Diabetologia 55:51-62)
Level of evidence: GRADE
LOW* LAA vs NPH Adverse effects (cancer)
*Downgraded 2 points because of imprecision (low number of cases) and indirectness (low incidence of cancer in study population; short length of followup)
|
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 20-02-2014
De werkgroep streeft ernaar jaarlijks de aanbevelingen te updaten.
De Nederlandse Internisten Vereniging is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
IN SAMENWERKING MET
Nederlandse Vereniging voor Neurologie
Nederlandse Vereniging voor Anesthesiologie
MET ONDERSTEUNING VAN
Kennisinstituut van Medisch Specialisten
FINANCIERING
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Het doel is één integrale, modulair opgebouwde NIV richtlijn diabetes te ontwikkelen volgens het concept netwerkrichtlijnen. De richtlijn moet een praktisch handvat bieden aan de internist en zijn/haar team. De richtlijn richt zich op alle DM patiënten die verwezen worden naar de internist, i.e. alle patiënten DM type 1 en de patiënten DM type 2 in de tweede lijn (volwassen patiënten).
De primaire doelgroep van deze richtlijn is de internist en degenen in zijn/haar team, die onder eindverantwoordelijkheid van de internist zorg leveren. Daarnaast is het belangrijk dat alle beroepsgroepen die betrokken zijn bij de diabeteszorg in de tweede lijn kennis nemen van deze richtlijn en deze ondersteunen.
Samenstelling werkgroep
Totstandkoming werkgroep
Voor het ontwikkelen van de richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die met DM te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Samenstelling werkgroep
· Dr. B.J. Potter van Loon, internist, Nederlandse Internisten Vereniging (voorzitter);
· Dr. B.E. de Galan, internist, Nederlandse Internisten Vereniging;
· Mw. dr. C.B. Brouwer, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.H.L.M. Geelhoed, internist, Nederlandse Internisten Vereniging;
· Prof. dr. N.C. Schaper, internist, Nederlandse Internisten Vereniging;
· Dr. R.P.L.M. Hoogma, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.J.M. van Gurp, internist, Nederlandse Internisten Vereniging;
· Mw. dr. L.D. Elving, internist, Nederlandse Internisten Vereniging;
· Dr. T.F. Veneman, internist, Nederlandse Internisten Vereniging;
· Mw. dr. H.L. Lutgers, internist, Nederlandse Internisten Vereniging;
· Prof. dr. A.J.M. Loonen, arts/klinisch farmacoloog; Nederlandse Vereniging van Psychiatrie
· Dr. D. Cohen, psychiater; Nederlandse Vereniging van Psychiatrie;
· Dr. G.E.M.G. Storms, internist, Nederlandse Internisten Vereniging;
· Mw. drs. I. Hommel, internist, Nederlandse Internisten Vereniging;
· Dr. T.W. van Haeften, internist, Nederlandse Internisten Vereniging;
· Dr. A.D.M. Stork, internist, Nederlandse Internisten Vereniging;
· Dr. J.L.M. Jongen, neuroloog, Nederlandse Vereniging voor Neurologie;
· Mw. J.M. Ronday, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie;
· Mw. drs. L.J.N. Wind, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.C.J. Knippels, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. M.M.L. Stikkelbroeck, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. S.M. van der Leij, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. L.C.G. de Graaff, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. C. van Noord, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. I.J.A. de Bruin, AIOS, Nederlandse Internisten Vereniging;
· Dr. C.K.A. van den Berge, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.P.A. Hoeks, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. Y.W. van den Berg, AIOS, Nederlandse Internisten Vereniging;
· Dr. E.J.G. Peters, internist, Nederlandse Internisten Vereniging;
Met ondersteuning van:
· Ir. T.A. van Barneveld, hoofd Kennisinstituut van Medisch Specialisten;
· Dr. K.N.J. Burger, epidemioloog, adviseur Kennisinstituut van Medisch Specialisten;
· Mw. Ir. I.W. Loman, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. S.B. Muller-Ploeger, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. M. Wessels, informatiespecialist Kennisinstituut van Medisch Specialisten;
· Mw. V. Beaujean, secretariaat, Kennisinstituut van Medisch Specialisten;
· Mw. S. Jaber, MSc, beleidsadviseur Kwaliteit, Nederlandse Internisten Vereniging
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête via internet. Een verslag van de enquête is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is digitaal verspreid onder alle relevante beroepsgroepen. De richtlijn is te downloaden vanaf de website van de NIV en via de Richtlijnendatabase.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van het Nederlands Huisartsen Genootschap (NHG), de beroepsorganisatie voor Diabeteszorgverleners (EADV), DiabetesVereniging Nederland (DVN), Zorgverzekeraars (ACHMEA en UVIT), farmacie/industrie (Nefarma), Nederlandse Diëtisten Vereniging (NVD) en arts-assistenten in opleiding (JNIV) van de NIV via een Invitational conference. Een verslag hiervan kunt u vinden in de bijlagen.
Methode richtlijnontwikkeling
Deze (concept)richtlijn is opgesteld aan de hand van het Procedureboek NIV richtlijnen die aansluit bij het “Appraisal of Guidelines for Research & Evaluation II” (AGREE II) instrument (www.agreecollaboration.org). Dit instrument is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Adaptatie
De a/b/c/e-level ADA aanbevelingen (2011, USA) worden in principe overgenomen, mits deze:
-
niet in tegenspraak zijn met deze uit de Duitse richtlijn (2010), de NICE richtlijn (update 2010, Engeland), de Sign richtlijn (2010, Schotland) en de Canadese richtlijn (2008);
-
niet in tegenspraak zijn met de resultaten van een literatuur update van de laatste drie jaar; 3) geldig zijn voor de Nederlandse situatie.
Vaststellen van de belangrijkste uitkomstmaten
De richtlijnwerkgroep heeft per uitgangsvraag de wetenschappelijke uitkomstmaten vastgesteld die zij van belang achtte en hebben deze naar mate van belang voor de patiënt geordend. Hierbij was het streven om vooral harde klinische eindpunten te gebruiken. Tevens heeft de werkgroep aangegeven welk verschil zij klinisch relevant vinden.
Strategie voor zoeken naar en selectie van literatuur
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline, Cochrane en, zo nodig, Embase. Daar waar stukken uit de ADA-richtlijn* werden overgenomen werden aanvullende searches gedaan van de afgelopen drie jaar, i.e. van 2008 tot 2011. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCT’s). In afwezigheid van RCT’s werd verder gezocht naar prospectieve vergelijkende onderzoeken en prospectieve niet-vergelijkende onderzoeken (uitzondering: onderwerpen van a/b level-ADA aanbevelingen: uitsluitend RCT’s; zie later). De werkgroepleden selecteerden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. Voor de gebruikte zoekstrategieën zie de bijlagen.
* De ADA-richtlijn wordt elk jaar geüpdate. Onduidelijk is of de richtlijn elk jaar volledig of partieel geüpdate wordt.
Beoordeling van de kwaliteit van studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de tabel ‘Beoordeling kwaliteit studie’ in de bijlagen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE methodiek. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al., 2004). Waarbij de bewoording van de GRADE methode is gebruik zoals hieronder weergegeven.
|
EBRO |
bewoording |
|
Niveau 1 |
Hoog |
|
Niveau 2 |
Matig |
|
Niveau 3 |
Laag |
|
Niveau 4 |
Zeer laag |
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Procedure voor commentaar en autorisatie
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetesvereniging Nederland (DVN), de Beroepsorganisatie voor Diabeteszorgverleners (EADV), het Nederlands Huisartsen genootschap (NHG), Nefarma, de Nederlandse Diabetes Federatie (NDF), de Nederlandse Vereniging van Diëtisten (NVD), en de Nederlandse Vereniging van Klinisch Chemici (NVKC). De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek per module staat in aanverwant 'Kennislacunes'.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.

