CSII vs MDI glycaemische regulatie DM
Uitgangsvraag
-
Verbetert CSII bij volwassenen met DM1 en met DM2 de glycaemische regulatie ten opzichte van MDI?
-
Verbetert CSII in combinatie met CGMS, bij volwassenen met DM1 en met DM2, de glycaemische regulatie ten opzichte van MDI in combinatie met SMBG (Self-Monitoring of Blood Glucose)?
Aanbeveling
Overweeg CSII bij patiënten met een ernstige insulineresistentie, individuele omstandigheden (bijvoorbeeld werksituatie), (ernstige) hypoglykemieën, voor en tijdens de zwangerschap en hypo-unawareness. De patiëntvoorkeur weegt zwaar. Terughoudendheid is geboden bij mensen die ouder, adipeus zijn en type 2 diabetes hebben.
Overweeg CSII bij patienten met langbestaande type 2 diabetes, als er sprake is van variabele glucosewaarden en frequente hypoglykemieën als gevolg van insulinegevoeligheid en ernstig betacel falen.
Overweeg CGMS in te zetten bij mensen met diabetes type 1 die al behandeld worden met:
-
CSII en adequate monitoring (smbg > 3 dd) en nog onvoldoende metabole controle hebben bereikt;
-
HbA1c hoger dan 64 mmol/mol.
Overweeg bij diabetes type 2, CGMS alleen bij zwangere vrouwen.
Overwegingen
De indicaties voor CSII zoals deze opgesteld zijn door de NIV (gebaseerd op de ADA richtljin van 2007), zijn:
Hba1c > 64 mmol/mol; grote fluctuaties in glucosewaarden; dawn fenomeen; frequente en ernstige hypoglycemieen; nachtelijke hypoglycemieën; hypoglycemie unawareness; zwangerschap en preconceptie; variabel dagelijks leefpatroon niet te managen met MDI; complicaties; ernstige insuline resistentie. Hieraan kan toegevoegd worden: allergie voor (middel)langwerkende insulines.
CSII lijkt op korte termijn een betere regulatie bij mensen met DM1 ten opzichte van MDI te geven. Dit wordt echter niet in alle studies bevestigd. Literatuur geeft aan dat een hoger uitgangs-HbA1c gepaard gaat met een grotere daling van HbA1c door CSII ten opzichte van MDI (Retnakaran et al., 2004). Indien onderzoek wordt verricht bij patiënten met een redelijke regulatie kan derhalve geen grote daling in het HbA1c worden verwacht. De bestudeerde literatuur toont een significant grotere daling in HbA1c bij CSII in vergelijking tot MDI, in de eerste periode na start van CSII (1-6 maanden), in lange termijn studies bereikt het effect op HbA1c daling geen statistische significantie. De gemiddelde daling in HbA1c is klein, maar deze daling wordt wel als klinisch relevant gezien. Er zijn aanwijzingen dat er een grotere reductie in het aantal ernstige hypoglykemie is bij CSII. Ondanks een verlaging van het HbA1c lijken er mogelijk dus niet meer hypoglykemieën op te treden, terwijl dit normaliter wel verwacht zou worden; er is immers een omgekeerde relatie tussen het HbA1c en aantal hypoglykemieën.
De invloed op microvasculaire complicaties wordt in de beoordeelde studies en reviews niet beschreven. Dit is onder andere toe te schrijven aan de studieduur en de beperkte omvang van de onderzoeksgroepen. Het is echter al langere tijd bekend dat een betere regulatie over het algemeen leidt tot minder microvasculaire complicaties (DCCT, 1993). Juist jonge mensen met DM1 hebben door een betere regulatie veel profijt voor de toekomst. Ook geeft CSII mogelijk meer flexibiliteit qua levensstijl, hetgeen een positief effect op de kwaliteit van leven zou kunnen hebben. Er zijn aanwijzingen dat CSII voor een betere kwaliteit van leven zorgt. Doordat er verschillende meetinstrumenten zijn gebruikt, kon er geen meta-analyse verricht worden.
In verschillende studies wordt beschreven dat de kosten hoger zijn (Bolli et al., 2009; Derosa et al., 2009).Bolli et al. ( 2009) benoemen dat de kosten voor CSII 3.9 keer zo hoog zijn als de kosten voor MDI. De kosten bedragen €778,- voor MDI en €3020,- voor CSII. Derosa et al. (2009) geven aan dat de kosten van MDI €1222,56 per jaar betreffen, voor CSII is dit €4072,46 per jaar. In Nederland zijn de kosten voor CSII €3000,- hoger dan voor MDI (Proefschrift R.P.L.M. Hoogma, 2006).
Mede gezien de meerkosten van CSII en gezien het feit dat er aanwijzingen zijn dat CSII voor een kleine daling van het HbA1c zorgt zonder stijging van het aantal hypoglykemieën, is het van belang om per individu de regulatie en de ernst en het aantal hypoglykemieën te beoordelen om zodoende de afweging voor CSII te kunnen maken. Het is noodzakelijk dat de patiënt gemotiveerd is en dat er lichamelijk en intellectuele bekwaamheid voor het gebruik van CSII is.
Geadviseerd wordt pas te beginnen met CSII als het diabetesteam als geheel een positief advies geeft. Ook jonge patiënten zijn goede kandidaten voor het gebruik van CSII gezien de kans op het ontwikkelen van complicaties wordt verminderd door een goede regulatie en zij vaker een onregelmatig leven hebben.
CSII geeft geen betere regulatie bij mensen met DM2 ten op zichte van MDI. Ook geeft het niet duidelijk minder hypoglykemieën. Er zijn jongere mensen met DM2 ( < 50 jaar) en CSII, die formeel DM2 hebben op basis van afwezigheid van antistoffen tegen GAD, afwezigheid van ketoacidose en een korte behandeling met orale hypoglykemica in het verleden. Voor deze mensen is er geen biologisch plausibele verklaring waarom zij anders zouden reageren op CSII dan mensen met DM1. Het verdient dan ook aanbeveling voor deze mensen de conclusies voor DM1 over te nemen. Deze mensen zijn in de bovengenoemde literatuur niet onderzocht of vielen mogelijk onder DM1.
CGMS is in Nederland een relatief nieuwe bloedglucosemonitoring methode met duidelijke, maar beperkte voordelen boven SMBG. Het prijsverschil is ongeveer € 3500,- op jaarbasis.
Beschikbaarheid van de voorzieningen is beperkt en onderhevig aan strenge eisen.
In Nederland is CGMS alleen geindiceerd bij mensen met DM1 met CSII en HbA1c > 64 mmol/mol en adequate monitoring (bij vooorkeur 4-5 dd, maar zeker > 3x/dag smbg), bij zwangerschap bij DM1 of DM2 en eerst nadat psychologische counseling heeft plaatsgevonden
De werkgroep ziet geen aanleiding momenteel af te wijken van deze drie adviezen, totdat er meer bewijs is verkregen.
Onderbouwing
Achtergrond
Inzetten van moderne, geavanceerde (en vaak prijzige) behandelingsmogelijkheden voor die patiënten, waarbij met de gebruikelijke behandelwijze de doelstelling niet kan worden behaald, vraagt om keuzes. Welke geavanceerde methoden zijn in te zetten voor welke patientencategorie?
Sinds 1980 worden continue subcutane insulinepompen (CSII) gebruikt in de behandeling van DM1 en de laatste jaren ook in de behandeling van DM2, van patiënten die afhankelijk geworden zijn van insuline en waarbij de gewenste glycaemische instelling niet met een intensief insulineschema en frequente zelfcontrole bereikt kan worden. Deze behandeling met een insulinepomp is kostbaarder dan reguliere injectiebehandeling. Om een goede afweging te maken wanneer CSII gebruikt kan en moet worden, is het noodzakelijk de voordelen ervan boven intensieve reguliere insuline injectie behandeling (MDI, meer dan drie injecties per dag in combinatie met frequent meten) in kaart te brengen.
Bij CSII is frequente bloedglucose feedback essentieel om een goede diabetesregulatie te bewerkstelligen. Er zijn CSII systemen die uitgerust zijn met continue glucosemeting (real time CGMS, dit is 288 metingen per etmaal tegen een prijs van ongeveer 12 conventionele meetstrips per dag), de vraag is wanneer deze moderne, maar steeds beter beschikbare techniek in te zetten. Omdat juist bij CSII het aantal metingen belangrijk is, en omdat in de Nederlandse situatie vanaf 2012 CGMS beschikbaar is in een aantal klinieken bij CSII gebruikers, vond de werkgroep het noodzakelijk na te gaan wat de meerwaarde is van specifiek CGMS-gebruikende CSII (CGMS augmented CSII) versus CSII enerzijds en versus MDI (in combinatie met SMBG) anderzijds.
Conclusies / Summary of Findings
Type 1 diabetes mellitus
|
LAAG |
Voor mensen met type 1 diabetes is er op korte termijn (één-zes maanden) een significante daling in het HbA1c bij CSII ten opzichte van MDI.
In lange termijn studies was het verschil in HbA1c daling tussen CSII en MDI kleiner en bereikte geen statistische significantie
Misso et al., 2010 |
|
LAAG |
Voor mensen met type 1 diabetes is er geen verschil tussen CSII en MDI wat betreft hypoglycemieën, maar mogelijk wel wat betreft ernstige hypoglyciemieën (in het voordeel van CSII).
Misso et al., 2010 |
|
LAAG |
Er zijn aanwijzingen dat CSII bij mensen met type 1 diabetes een betere kwaliteit van leven geeft in vergelijking met MDI.
Misso et al., 2010; Bolli et al., 2009 |
Type 2 diabetes mellitus
|
LAAG |
Voor mensen met type 2 diabetes geeft CSII ten opzichte van MDI geen extra daling van het HbA1c.
Fatourechi et al., 2009 |
|
LAAG |
Voor mensen met type 2 diabetes zijn geen aanwijzingen dat er voordeel van CSII ten opzichte van MDI is wat betreft (nachtelijke) hypoglycemieën.
Fatourechi et al., 2009 |
CSII met CGMS
|
MATIG |
Het is aangetoond dat bij mensen met type 1 diabetes CGMS leidt tot zeer geringe HbA1c reductie zonder verschillen in hypoglykemie, optreden van ketoacidose en verandering in kwaliteit van leven.
Langendam et al., 2012 |
|
MATIG |
Het is aangetoond dat bij mensen met type 1 diabetes CGMS augmented CSII leidt tot een forse HbA1c reductie ten opzichte van MDI met SMBG, zonder duidelijke stijging van hypo’s en DKA.
Langendam et al., 2012; Battelino et al., 2012 |
Samenvatting literatuur
Type 1 diabetes mellitus
De zoekactie leverde één Cochranereview op (Misso et al., 2010), die zich richt op de effectiviteit van CSII vergeleken met MDI bij 976 mensen met DM1 en includeert 23 verschillende studies, waarvan zeven studies bij mensen onder de 18 jaar.
Als uitkomstmaat wordt glycemische controle (HbA1c) en hypoglycemieën gebruikt. Ze vonden in een subgroepanalyse een gemiddeld verschil in het HbA1c geschat op -0,3% (95% BI -0,5 tot -0,1) in het voordeel van CSII vergeleken met MDI bij patiënten en DM1, ouder dan 18 jaar. Echter gaf de test voor heterogeniteit een I2 van 62% (overall effect p= 0,001). In een subgroepanalyse is het effect van de studieduur beoordeeld. In de review is er één studie met een follow-up korter dan één maand beoordeeld en hiervan was het verschil in HbA1c 0,2 (95% BI -1,9 tot 2,3; statistisch niet significant). Er waren 12 studies met een duur tussen de één en zes maanden geïncludeerd. Het gemiddeld verschil in HbA1c in deze groep was -0,3 (95 BI -0,5 tot -0,1; I2 van 53%). Zeven studies hadden een duur van meer dan zes maanden en het gemiddeld verschil in HbA1c was -0,2 (95% BI -0,4 tot 0,1; statistisch niet significant; I2 van 57%).. In lange termijn studies bereikte het verschil in HbA1c daarmee geen statistische significantie. Wat betreft de uitkomsten hypoglycemie en ernstige hypoglycemie kon er geen meta-analyse worden uitgevoerd. Er zijn geen aanwijzingen dat er voordeel van CSII of MDI is wat betreft milde hypoglycemieën. Er zijn echter wel aanwijzingen dat CSII voor een grotere reductie van het aantal ernstige hypoglycemieën zorgt. Acht van de vijftien studies met ernstige hypoglycemie als uitkomstmaat rapporteren een reductie in de frequentie van ernstige hypoglycemie met tenminste 50% bij gebruik van CSII. Kwaliteit van leven werd in 15 van de 23 studies beoordeeld. Dit gebeurde echter met verschillende meetinstrumenten waardoor er geen meta-analyse mogelijk was. Over het algemeen werd er een betere kwaliteit van leven gevonden. Bij een studie (Hoogma et al, 2005) werd een discrepantie tussen twee meetinstrumenten gevonden, waarbij DQoL ten faveure van MDI scoorde en bij gebruik van het meetinstrument SF-12 een voordeel voor CSII werd gevonden. Doyle et al. (2004) vonden geen verschil in kwaliteit van leven, Tsui et al. (2001) vonden een voordeel van MDI ten opzichten van CSII. Misso et al. (2010) suggereren dat CSII in het voordeel is ten opzichte van MDI wat betreft de kwaliteit van leven. Bijwerkingen en hyperglykemie werden in de studies niet of niet voldoende beschreven om goed te kunnen beoordelen.
De gerandomiseerde open parallelle multicenter studie van Bolli et al. (2009) richt zich op mensen met DM1 en CSII werd vergeleken met MDI. De inclusieriteria van deze studie en de belangrijkste karakteristieken van de trial zijn te vinden in de evidence-tabel (zie desbetreffende kop). Bolli et al. (2009) behandelde in totaal 50 patiënten gedurende 24 weken. Er waren geen significante verschillen tussen MDI en CSII betreffende HbA1c, dagcurves en hyper/hypo-glycemieën.
Er werd ook gekeken naar kwaliteit van leven, met als meetinstrument DTSQ (Diabetes Treatment Satisfaction Questionnaires). De behandelingssatifactie steeg meer bij de patiënten met CSII dan met MDI. Het tweede beoordeelde item van de DTSQ, het verschil in satisfactie na behandeling, was echter gelijk.
Bij beoordelen van de studies volgens GRADE bij mensen met DM1 is de bewijskracht:
- Laag voor het effect van CSII ten opzichte van MDI op de glycaemische regulatie (HbA1c); er is één punt afgetrokken op basis van heterogeniteit (inconsistentie) en nog één punt op basis van de onderzoeksopzet van de geïncludeerde RCT’s;
- Laag voor het effect van CSII ten opzichte van MDI op hypoglycemieën en ernstige hypoglycemieën; er is één punt afgetrokken op basis van imprecisie en nog één punt op basis van onderzoeksopzet van de geïncludeerde RCT’s;
- Laag voor het effect van CSII ten opzichte van MDI op kwaliteit van leven; er is één punt afgetrokken op basis van imprecisie en nog één punt op basis van onderzoeksopzet van de geïncludeerde RCT’s.
Type 2 diabetes mellitus
De meta-analyse van Fatourechi et al. (2009) richt zich op zowel mensen met DM1 als DM2 en includeert twee studies met mensen met DM2. Deze DM2 patiënten waren gemiddeld 55 en 66 jaar en een gemiddelde BMI van 32 kg/m2. In deze populatie vonden zij ten opzichte van MDI bij CSII geen daling van het HbA1c, in tegendeel, een lichte, niet-significante stijging van 0,23% (BI -0,02 – 0,48%). Wat betreft ernstige hypoglykemieën was er geen significant verschil tussen MDI en CSII (OR: 0,64; 95% BI 0,12-3,28). Ook was er geen significant verschil in het aantal nachtelijke hypoglycemieën (OR: 0,61; BI 0,26-1,47).
Bewijskracht van de literatuur
Bij beoordelen van de studies volgens GRADE bij mensen met DM2 is de bewijskracht:
-
Laag voor het effect van CSII ten opzichte van MDI op de glycaemische regulatie (HbA1c); er is één punt afgetrokken op basis van het geringe aantal patiënten (imprecisie) en één punt op basis van onderzoeksopzet;
-
Laag voor het effect van CSII ten opzichte van MDI op hypoglycemieën en nachtelijke hypoglycemieën; er is één punt afgetrokken op basis van het geringe aantal patiënten (imprecisie) en één punt op basis van onderzoeksopzet.
CSII met CGMS
Een nieuw aspect binnen de glucoseregulatie is continue glucosemeting (CGMS), speciaal in combinatie mét CSII. In een recente Cochrane review (Langendam et al., 2012) werd CGMS met SMBG vergeleken bij mensen met DM1. Na searches werden 1366 titels en abstracts beoordeeld, dit leverde 22 RCT's op waarvan 11 bij volwassenen. Speciale aandacht was er voor een lange follow up, dat wil zeggen zes maanden of langer. Bij het gebruik van CSII in combinatie met CGMS, in vergelijking tot MDI in combinatie met SMBG werd bij mensen met DM1 een daling in HbA1c gezien van 0,2% (BI -0,4 tot -0,1), er waren geen verschillen in ernstige hypoglykamie, DKA (diabetische ketoacidose) en kwaliteit van leven (zie eerder).
Specifiek voor CGMS-ondersteunde CSII was het resultaat een 0,7% lagere HbA1c (BI -0,8 tot -0,5%) ten opzichte van MDI plus SMBG, een niet-significant verhoogd relatief risico op ernstige hypoglykemie (RR: 3,24; BI 0,38 tot 27,8) (zie tabel 2).
Kwaliteit van leven was niet hoger met CGMS dan met SBGM, in geen van de beoordeelde 22 studies waren er verschillen tussen CGMS en SBGM, ook de meta-analyse liet geen verschillen zien.
Tabel 2. Vergelijking tussen CGMS-ondersteunde CSII en MDI met SMBG bij patiënten met DM1. NS (verschil statistisch niet significant); 95%BI (95% betrouwbaarheidsinterval); RR (relatief risico)
|
|
MDI+SMBG |
CSII+CGMS |
|
HbA1c |
-0,1 a -0,2% |
-0,7% t.o.v. SMBG (95%BI=[-0,8; -0,5]) |
|
Majeure hypoglykemie |
29/1000
|
93/1000 (RR= 3,2; (95%BI=[0,4; 27,8]; NS) |
|
DKA |
10/1000 |
25/1000 (RR= 2,5; (95%BI=[0,1; 58,5]; NS) |
|
Kwaliteit van leven (fysiek) |
91 |
92,3. (NS) |
|
Kwaliteit van leven (mentaal) |
77 |
79,4. (NS) |
Tabel 3. Vergelijking tussen CGMS-ondersteunde CSII en MDI met SMBG bij patiënten met DM1: effecten op HbA1c (Forest plot; Langendam et al., 2010).
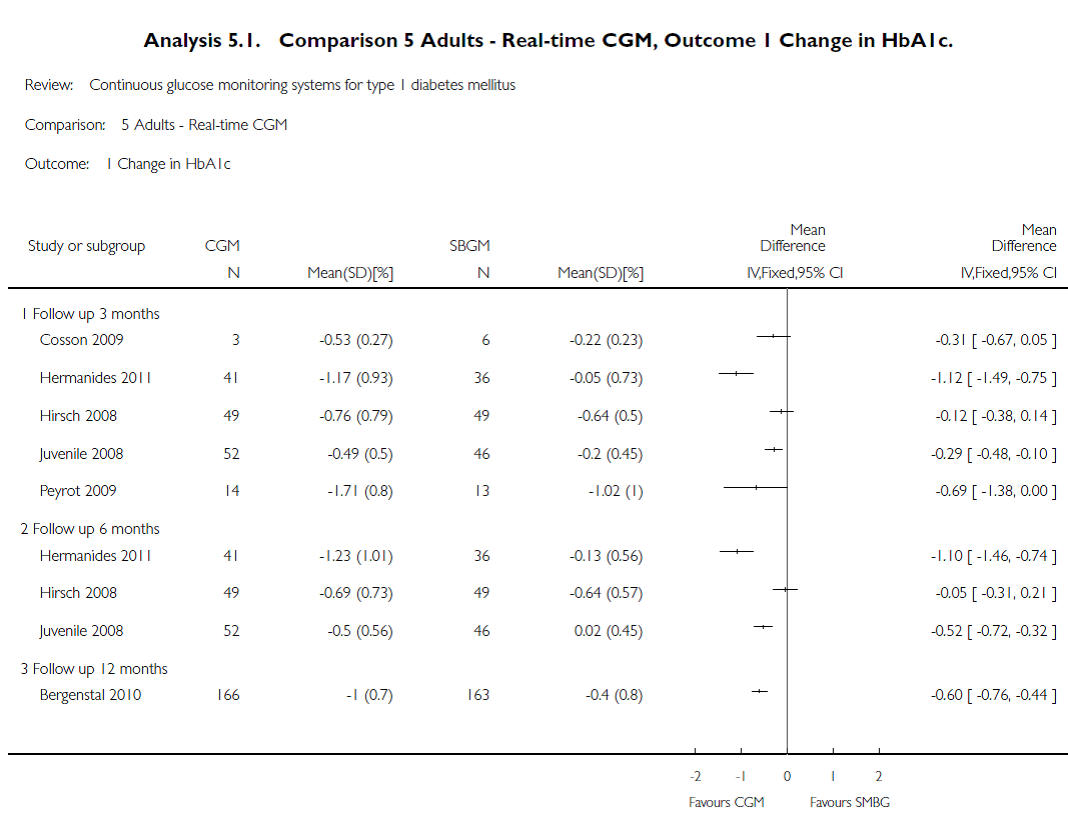
Bij vijf studies werden de bloedglucosewaarden retrospectief uitgelezen.
Er werd geen verschil in uitkomsten gezien tussen retrospectieve studies (n=2) en real time studies (n=9) bij volwassenen; in vier van de vijf retrospectieve studies werd ook een daling van HbA1c gezien bij CGMS ten opzichte van SMBG. De studies bij volwassenen met real time CGMS (n=6) toonden in de subanalyse geen significante veranderingen ten opzichte van SMBG in HbA1c, ernstige hypoglykemie, DKA, kwaliteit van leven en patiëntentevredenheid (geïincludeerde patienten = 467cgms(=cgm) en 444 smbg).
Bij adolescenten (18-25 jaar) waren twee studies verricht; de resultaten hiervan verschilden niet van de totale groep (HbA1c daling, echter gezien kleine aantal studies (NS), geen verschil in ernstige en totaal hypoglykemie).
De resultaten bij kinderen worden voor deze richtlijn buiten beschouwing gelaten.
Na 12 maanden was bij CGMS augmented CSII het HbA1c nog steeds 0,6% lager (BI 0,45 tot 0,75%) dan bij SMBG.
De auteurs concluderen dat er beperkt bewijs is van overigens goede kwaliteit dat CGMS bij mensen met DM1 en CSII het HbA1c doet dalen gedurende langere tijd (> zes maanden) in vergelijking met SMBG (bij MDI).
Voorts geven de auteurs aan dat continu gebruik van CGMS (dat wil zeggen > 60-80% van de tijd) betere resultaten geeft dan intermitterend gebruik (in 1 studie HbA1c daling van -1,06% vs -0,83%) (Hirsch et al., 2008).
Tenslotte suggereren de auteurs dat er in de toekomst ook per protocol analyses uitgevoerd moeten worden vanwege bovengenoemd verschil in effectiviteit bij een zo complexe en kostbare behandeling.
Tabel 4. Vergelijking tussen CGMS-ondersteunde CSII en MDI met SMBG bij patiënten met DM1: effecten op patiënt relevante uitkomsten en bewijskracht (Langendam et al., 2010).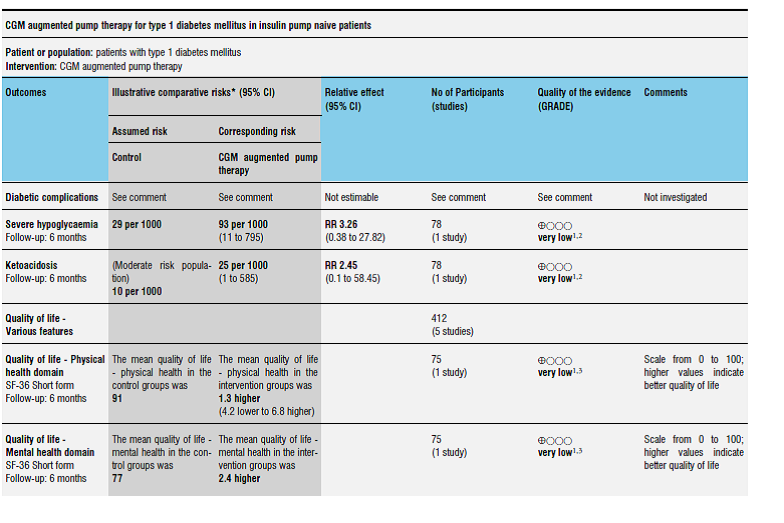
In de gerandomiseerde crossoverstudie van Battelino et al. (2012) werd de werkzaamheid van het toevoegen van CGM aan CSII bekeken bij mensen met DM1.
Kinderen en volwassenen (n= 153) die op de CSII-therapie zaten met een HbA1c tussen de 7,5 en 9,5% werden gerandomiseerd in wel of geen toegevoegde CGM voor zes maanden. Kinderen en volwassenen werden onafhankelijk van elkaar gerandomiseerd. De primaire uitkomstmaat was verschil in HbA1c. Het gemiddelde verschil in HbA1c was -0,43% in het voordeel van de CGM (8,04% [64,34 mmol/mol] vs 8,47% [69.08 mmol/mol]; 95% BI −0.32%, −0.55% [−3.50,
−6.01 mmol/mol]; p<0.001). Tevens werden niet significant meer of minder ernstige hypoglyciemieën gedetecteerd in de groep waar de CGM werd gebruikt (p=0,4).
Bewijskracht van de literatuur
Bij beoordelen van de studies volgens GRADE bij CSII met CGMS is de bewijskracht:
-
Matig voor het effect van CSII met CGMS ten opzichte van MDI op de glycaemische regulatie (HbA1c);
-
Zeer laag voor het effect van CSII met CGMS ten opzichte van MDI op hypoglycemieën;
-
Zeer laag voor het effect van CSII met CGMS ten opzichte van MDI op de kwaliteit van leven;
Zoeken en selecteren
Uitkomstmaten
De werkgroep definieerde de uitkomstmaten als volgt: ’glycaemische controle’ (HbA1c), ’hyperglykemie’, ’hypoglykemie’ en ’kwaliteit van leven’.
Zoeken en methode
In de databases Medline en Cochrane is met relevante zoektermen en binnen de periode 2009-2012 op systematische reviews en RCT’s gezocht naar literatuur waarin de effectiviteit van CSII en MDI wordt vergeleken bij mensen met DM1 en afzonderlijk met DM2. De zoekverantwoording is weergegeven onder desbetreffende kop. De literatuurzoekactie leverde voor DM1 77 treffers op en voor DM2 13 treffers.
Resultaten
Voor de search naar DM1 geldt dat op basis van titel en abstract drie artikelen werden geselecteerd. Het betreft een Cochrane review van studies gepubliceerd tot juli 2009 (Misso et al., 2010). De zoekactie leverde tevens één relevante RCT op (Bolli et al., 2009) en één case control studie (Derosa et al., 2009). Voor de search naar DM2 leverde dat twee geselecteerde artikelen op. Het betreft een systematische review van Fatourechi et al. (2009) en een case control studie van Derosa et al. (2009). De case control studie van Derosa et al. (2009) beschrijft echter de uitkomsten van mensen met DM1 en DM2 samen, om deze reden is deze case control studie toch nog geëxcludeerd.
Voor DM2 kwam alleen de meta-analyse van Fatourechi et al. (2009) in aanmerking, die twee RCT’s samenvatte. Daarnaast is gezocht naar specifiek CGMS-ondersteunde (CGMS-augmented) CSII in vergelijking tot standaardbehandeling met MDI en SMBG; hiervoor werd de in 2012 gepubliceerde Cochrane analyse gebruikt speciaal over dit onderwerp, van de hand van Langendijk et al. (2010).
Voor de studiekarakterisitieken en resultaten van de studies geincludeerd in de Cochrane reviews (Misso et al., 2010; Langendijk et al., 2010) wordt verwezen naar de bewuste reviews. De evidencetabellen van de overige geselecteerde studies zijn opgenomen onder de desbetreffende kop.
Referenties
- ADA, (2007). Standards for medical care in diabetes. Diab Care, 30.
- Battelino, T., Conget, I., Olsen, B., Schütz-Fuhrmann, I., Hommel, E., Hoogma, R., Schierloh, U., Sulli, N., (2012). The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomized controlled trial. Diabetologia, 55, 31553162.
- Bolli, G.B., Kerr, D., Thomas, R., Torlone, E., Sola-Gazagnes, A., Vitacolonna, E., Selam, J.L., & Home, P.D. (2009). Comparison of a multiple daily insulin injection regimen (basal once-daily glargine plus mealtime lispro) and continuous subcutaneous insuline infusion (lispro) in type 1 diabetes. Diabetes care, 32(7), 1170-1176.
- DCCT and EDIC. The Diabetes Control and Complications Trial and Follow-up Study, 1993.
- Derosa, G., Maffioli, P., D'Angelo, A., At Salvadeo, S., Ferrari, I., Fogari, E., Mereu, R., Gravina, A., Palumbo, I., Randazzo, S., & Cicero, A.F.G. (2009). Effects of insulin therapy with continuous subcutaneous insuline infusion (CSII) in diabetic patients: comparison with multi-daily insulin injections therapy. Endocrine Journal, 56(4), 571-578.
- Doyle, E.A., Weinzimer, S.A., Steffen, A.T., Ahern, J.A., Vincent, M., & Tamborlane, W.V. (2004). A randomized, prospective trial comparing the efficacy of continuous subcutaneous insulin infusion with multiple daily injections using insulin glargine. Diabetes Care, 27(7), 15548.
- Fatourechi, M.M., Kudva, Y.C., Murad, M.H., Elamin, M.B., Tabini, C.C., & Montori, V.M. (2009). Hypoglycemia with intensive insulin therapy: a systematic review and meta-analyses of randomized trials of continuous insulin infusion versus multiple daily injections. J Clin Endocrinol Metab., 94(3), 729-740.
- Hirsch, I.B., Abelseth, J., Bode, B.W., Fischer, J.S., Kaufman, F.R., Mastrototaro, J, Parkin CG, Wolpert HA,.... (2008). Sensor-augmented insulin pump therapy: Results of the first randomized treat-to-target study. Diabetes Technology and Therapeutics, 5, 37783.
- Hoogma, R.P.L.M., Hoekstra, J.B., Michels, B.P., & Levi, M. (2006). Comparison between multiple daily insulin injection therapy (MDI) and continuous subcutaneous insulin infusion therapy (CSII), results of the five nations study. Diabetes Research & Clinical Practice, 74(2), S1447.
- Langendam, M., Luif, Y.M., Hooft, L., de Vries, J.H., Mudde, A.H., Scholten, R.P.J.M. (2012). Continuous glucose monitoring systems for type 1 diabetes mellitus. The Cochrane Collaboration, 1, CD008101.
- Misso, M.L., Egberts, K.J., Page, M., OConnor, D., & Shaw, J. (2010). Continuous subcutaneous insulin infusion (CSII) versus multiple insulin injections for type 1 diabetes mellitus. The Cochrane Library, Issue 1.
- Retnakaran, R., Hochman, J., de Vries, J.H., Hanaire-Broutin, H., Heine, R.J., Melki, V., & Zinman, B. . (2004). Continuous subcutaneous insulin infusion versus multiple daily injections: the impact of baseline A1c. Diabetes Care, 27(11), 2590-6.
- Tsui, E., Barnie, A., Ross, S., Parkes, R., & Zinman, B. (2001). Intensive insulin therapy with insulin lispro: a randomized trial of continuous subcutaneous insulin infusion versus multiple daily insulin injection. Diabetes Care, 24(10), 17227.
Evidence tabellen
Research question 1: Does CSII improve the glycemic control compared to MDI in adult patients with type 1 diabetes?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Bolli et al, 2009 |
Type of study: Randomized, parallel-group, open-label, multicenter study.
Setting:
Country: Italy, UK, France
Source of funding: Support from sanofi-aventis |
Inclusion criteria: Patients with type 1 diabetes, previously using MDI regime with NPH insulin.
Exclusion criteria: Prior use of CSII or insulin glargine, unwilling or unable to use CSII or MDI's, had more than two severe hypoglycemic events in the previous 6 months, or had recent ketoacidosis or impaired hepatic/ renal function.
N= 50. 57 pts randomized, 7 protocol violators
Intervention group: N= 24 Mean age ± SD: CSII: 37.6 ± 12.3 Sex: % M / % F CSII: 54/46
Control group: N= 26 Mean age ± SD: MDI: 42.4 ± 9.9 Sex: % M / % F MDI: 54/46
Baseline characteristics were similar. |
CSII with insulin lispro. 1- week run-in period followed by a 24-week treatment period, with clinical visits at 0,2,8,16,24 weeks and 2 weeks follow-up.
CSII, total dose after randomization 34.6 ± 13.0 units/day. 24 weeks: 36.2 ± 11.5 units /day.
|
MDI regime using insulin glargine as basal insulin with insulin lispro at mealtimes. 1- week run-in period followed by a 24-week treatment period, with clinical visits at 0,2,8,16,24 weeks and 2 weeks follow-up.
MDI, total dose after randomization 45.3 ± 15.0 units/day, 24 weeks 42.6 ± 15.5 units/day.
|
Endpoint of follow-up: 24 weeks
For how many participants were no complete outcome data available? 7 drop outs before completion
Reasons for incomplete outcome data described? 7 drop outs before completion: 3 withdrawing consent, 1 due AE, 1 due pregnancy and 2 due to protocol noncompliance.
Significant differences between groups? NR
|
Blood glucose control: Decrease in HbA1c CSII: -0.7 ± 0.7% MDI: -0.6 ± 0.8% difference at endpoint -0.1 (-0.5 to 0.3) No significant change in fasting glucose levels, preprandial blood glucose levels or postprandrial blood glucose levels
Hypoglycemia: CSII: N= 1152 events (82% of the participants), MDI: N= 1022 events (93% of the participants).
No significant difference in overall events, nonsevere events, nocturnal events, symptomatic or asymptomatic patients.
Treatment satisfaction: The DTSQ treatment satisfaction score (± SD) increased from 22.8± 8.1 at baseline to 31.5± 4.9 at 24 weeks in the CSII group and from 24.0 ± 6.3 to 28.8 ± 5.4 in the MDI group (treatment difference: 3.1 [95% CI 0.1– 6.1]; P = 0.042). Differences between treatment groups regarding perception of hyperglycemia and hypoglycemia were not statistically significant. At 24 weeks, change DTSQ values of 13.3± 5.3 (CSII) and 12.9± 4.9 (MDI) were observed (difference: 0.4[-2.4 to 3.3]), with no statistical difference between groups in perception of hyperglycemia and hypoglycemia. Results of the ITT analyses were comparable.
|
Limitation in number of participants and duration
Conclusion: Both regimes achieved similar improvements in HbA1c, self-monitored plasma glucose and hypoglycemia.
Costs: Average costs per treatment during the study was 3.9 times higher for CSII versus MDI.
|
Research question 1: Does CSII improve the glycemic control compared to MDI in adult patients with type 1 diabetes?
|
Study reference
(first author, year of publication) |
There was adequate concealment of allocation
(yes/no/unclear) |
Participants receiving care were kept ‘blind’ to treatment allocation
(yes/no/unclear) |
Care providers were kept ‘blind’ to treatment allocation
(yes/no/unclear) |
Outcome assessors were kept ‘blind’ to participants’ exposure to the intervention
(yes/no/unclear) |
Use of unvalidated or intermediate outcomes
(yes/no/unclear) |
Selective outcome reporting on basis of the results
(yes/no/unclear) |
Loss to follow-up/incomplete outcome data described and acceptable
(yes/no/unclear) |
Analysis by intention to treat
(yes/no/unclear) |
Other limitations
(yes/no/unclear) |
|
Bolli et al, 2009 |
Yes |
no |
No |
Unclear |
no |
No |
yes |
Partially. (ITT vs per-protocol) |
Limitation in number of participants and duration of trial |
Research question 2: Is CSII superior to MDI in T2DM?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Fatourechi, 2009 2 studies with T2DM: Herman,2005 Raskin, 2003 |
Type of study: RCT Herman 2005 52 week Setting: Secondary care, single center Country: USA Source of funding: ADA, NIH |
Inclusion criteria: DM2; > 60 yrs, insulin treatment Exclusion criteria: DM1 N= 107
Intervention group: N= 48
Mean age ± SD: 66 (6) yrs Sex: % M / % F 72/28 Other important characteristics: BMI 32 (6) HbA1c 8,4(1,1)% Control group: N= 50
Mean age ± SD: 66(5) yrs Sex: % M / % F 55/56 Other important characteristics: BMI 32(6); HbA1c 8,1(1,2)% Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test): CSII with insulin lispro
|
Describe control (treatment/procedure/test): MDI with insulin lispro
|
Endpoint of follow-up: HbA1c, treatment satisfaction, QoL For how many participants were no complete outcome data available? 9 Intervention group: N (%): 9 %
Control group: N (%): 7 %
Reasons for incomplete outcome data described? yes Significant differences between groups? no |
Outcome measures and effect size (include 95%CI and p-value if available): HbA1c 8,4->6,7 (CSII) HbA1c 8,1-> 6,5 (MDI) n.s. Hypoglycaemia minor csii 81 % Hypoglycaemia minor con 90% n.s. Hypo severe csii n=3 Hypo severe con n=6 n.s. treatment satisfaction: DQOLCTO 52->81 csii DQOLCTO 50->78 con n.s. |
|
|
|
Type of study: RCT Raskin 2003 Setting: Multicentre 24-week Country: USA Source of funding: NovoNordisk |
Inclusion criteria: DM2; > 35 yrs, > 6 months of insulin treatment, BMI < 43, HbA1c 6-12 % Exclusion criteria: DM1, major hypoglycaemia N= 127
Intervention group: N= 66
Mean age ± SD: 55 (10) yrs Sex: % M / % F 64/36 Other important characteristics: BMI 32 (4) HbA1c 8,2(1,4)% Control group: N= 61
Mean age ± SD: 56(8) yrs Sex: % M / % F 57/43 Other important characteristics: BMI 32(5); HbA1c 8,0(1,1)% Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test): CSII with insulin aspart
|
Describe control (treatment/procedure/test): MDI with insulin aspart and basal NPH
|
Endpoint of follow-up: HbA1c, treatment satisfaction, QoL For how many participants were no complete outcome data available? 12 Intervention group: N (%): 9 %
Control group: N (%): 10 %
Reasons for incomplete outcome data described? yes Significant differences between groups? no |
Outcome measures and effect size (include 95%CI and p-value if available): HbA1c 8,2->7,6 (CSII) HbA1c 8,0-> 7,5 (MDI) n.s. Hypoglycaemia minor csii 54 % Hypoglycaemia minor con 59% n.s. Hypo severe csii n=0 Hypo severe con n=0 n.s. treatment satisfaction: DQOLCTO 59->79 csii DQOLCTO 64->70 con P<0.001 |
|
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 12-03-2014
Beoordeeld op geldigheid : 20-02-2014
De werkgroep streeft ernaar jaarlijks de aanbevelingen te updaten.
De Nederlandse Internisten Vereniging is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
IN SAMENWERKING MET
Nederlandse Vereniging voor Neurologie
Nederlandse Vereniging voor Anesthesiologie
MET ONDERSTEUNING VAN
Kennisinstituut van Medisch Specialisten
FINANCIERING
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Het doel is één integrale, modulair opgebouwde NIV richtlijn diabetes te ontwikkelen volgens het concept netwerkrichtlijnen. De richtlijn moet een praktisch handvat bieden aan de internist en zijn/haar team. De richtlijn richt zich op alle DM patiënten die verwezen worden naar de internist, i.e. alle patiënten DM type 1 en de patiënten DM type 2 in de tweede lijn (volwassen patiënten).
De primaire doelgroep van deze richtlijn is de internist en degenen in zijn/haar team, die onder eindverantwoordelijkheid van de internist zorg leveren. Daarnaast is het belangrijk dat alle beroepsgroepen die betrokken zijn bij de diabeteszorg in de tweede lijn kennis nemen van deze richtlijn en deze ondersteunen.
Samenstelling werkgroep
Totstandkoming werkgroep
Voor het ontwikkelen van de richtlijn is in 2011 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten die met DM te maken hebben (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Samenstelling werkgroep
· Dr. B.J. Potter van Loon, internist, Nederlandse Internisten Vereniging (voorzitter);
· Dr. B.E. de Galan, internist, Nederlandse Internisten Vereniging;
· Mw. dr. C.B. Brouwer, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.H.L.M. Geelhoed, internist, Nederlandse Internisten Vereniging;
· Prof. dr. N.C. Schaper, internist, Nederlandse Internisten Vereniging;
· Dr. R.P.L.M. Hoogma, internist, Nederlandse Internisten Vereniging;
· Mw. dr. P.J.M. van Gurp, internist, Nederlandse Internisten Vereniging;
· Mw. dr. L.D. Elving, internist, Nederlandse Internisten Vereniging;
· Dr. T.F. Veneman, internist, Nederlandse Internisten Vereniging;
· Mw. dr. H.L. Lutgers, internist, Nederlandse Internisten Vereniging;
· Prof. dr. A.J.M. Loonen, arts/klinisch farmacoloog; Nederlandse Vereniging van Psychiatrie
· Dr. D. Cohen, psychiater; Nederlandse Vereniging van Psychiatrie;
· Dr. G.E.M.G. Storms, internist, Nederlandse Internisten Vereniging;
· Mw. drs. I. Hommel, internist, Nederlandse Internisten Vereniging;
· Dr. T.W. van Haeften, internist, Nederlandse Internisten Vereniging;
· Dr. A.D.M. Stork, internist, Nederlandse Internisten Vereniging;
· Dr. J.L.M. Jongen, neuroloog, Nederlandse Vereniging voor Neurologie;
· Mw. J.M. Ronday, anesthesioloog, Nederlandse Vereniging voor Anesthesiologie;
· Mw. drs. L.J.N. Wind, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.C.J. Knippels, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. M.M.L. Stikkelbroeck, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. S.M. van der Leij, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. L.C.G. de Graaff, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. C. van Noord, AIOS, Nederlandse Internisten Vereniging;
· Mw. dr. I.J.A. de Bruin, AIOS, Nederlandse Internisten Vereniging;
· Dr. C.K.A. van den Berge, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. M.P.A. Hoeks, AIOS, Nederlandse Internisten Vereniging;
· Mw. drs. Y.W. van den Berg, AIOS, Nederlandse Internisten Vereniging;
· Dr. E.J.G. Peters, internist, Nederlandse Internisten Vereniging;
Met ondersteuning van:
· Ir. T.A. van Barneveld, hoofd Kennisinstituut van Medisch Specialisten;
· Dr. K.N.J. Burger, epidemioloog, adviseur Kennisinstituut van Medisch Specialisten;
· Mw. Ir. I.W. Loman, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. S.B. Muller-Ploeger, junior adviseur Kennisinstituut van Medisch Specialisten;
· Mw. drs. M. Wessels, informatiespecialist Kennisinstituut van Medisch Specialisten;
· Mw. V. Beaujean, secretariaat, Kennisinstituut van Medisch Specialisten;
· Mw. S. Jaber, MSc, beleidsadviseur Kwaliteit, Nederlandse Internisten Vereniging
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een enquête via internet. Een verslag van de enquête is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Het verslag is op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten (KIMS).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
De richtlijn is digitaal verspreid onder alle relevante beroepsgroepen. De richtlijn is te downloaden vanaf de website van de NIV en via de Richtlijnendatabase.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten.
Werkwijze
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van het Nederlands Huisartsen Genootschap (NHG), de beroepsorganisatie voor Diabeteszorgverleners (EADV), DiabetesVereniging Nederland (DVN), Zorgverzekeraars (ACHMEA en UVIT), farmacie/industrie (Nefarma), Nederlandse Diëtisten Vereniging (NVD) en arts-assistenten in opleiding (JNIV) van de NIV via een Invitational conference. Een verslag hiervan kunt u vinden in de bijlagen.
Methode richtlijnontwikkeling
Deze (concept)richtlijn is opgesteld aan de hand van het Procedureboek NIV richtlijnen die aansluit bij het “Appraisal of Guidelines for Research & Evaluation II” (AGREE II) instrument (www.agreecollaboration.org). Dit instrument is een breed (internationaal) geaccepteerd instrument voor de beoordeling van de kwaliteit van richtlijnen.
Adaptatie
De a/b/c/e-level ADA aanbevelingen (2011, USA) worden in principe overgenomen, mits deze:
-
niet in tegenspraak zijn met deze uit de Duitse richtlijn (2010), de NICE richtlijn (update 2010, Engeland), de Sign richtlijn (2010, Schotland) en de Canadese richtlijn (2008);
-
niet in tegenspraak zijn met de resultaten van een literatuur update van de laatste drie jaar; 3) geldig zijn voor de Nederlandse situatie.
Vaststellen van de belangrijkste uitkomstmaten
De richtlijnwerkgroep heeft per uitgangsvraag de wetenschappelijke uitkomstmaten vastgesteld die zij van belang achtte en hebben deze naar mate van belang voor de patiënt geordend. Hierbij was het streven om vooral harde klinische eindpunten te gebruiken. Tevens heeft de werkgroep aangegeven welk verschil zij klinisch relevant vinden.
Strategie voor zoeken naar en selectie van literatuur
Er werd voor alle afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in de elektronische databases van Medline, Cochrane en, zo nodig, Embase. Daar waar stukken uit de ADA-richtlijn* werden overgenomen werden aanvullende searches gedaan van de afgelopen drie jaar, i.e. van 2008 tot 2011. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar (systematische reviews of meta-analyses van) gerandomiseerde gecontroleerde onderzoeken (RCT’s). In afwezigheid van RCT’s werd verder gezocht naar prospectieve vergelijkende onderzoeken en prospectieve niet-vergelijkende onderzoeken (uitzondering: onderwerpen van a/b level-ADA aanbevelingen: uitsluitend RCT’s; zie later). De werkgroepleden selecteerden artikelen op basis van op voorhand opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. Voor de gebruikte zoekstrategieën zie de bijlagen.
* De ADA-richtlijn wordt elk jaar geüpdate. Onduidelijk is of de richtlijn elk jaar volledig of partieel geüpdate wordt.
Beoordeling van de kwaliteit van studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de tabel ‘Beoordeling kwaliteit studie’ in de bijlagen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE methodiek. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al., 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al., 2004). Waarbij de bewoording van de GRADE methode is gebruik zoals hieronder weergegeven.
|
EBRO |
bewoording |
|
Niveau 1 |
Hoog |
|
Niveau 2 |
Matig |
|
Niveau 3 |
Laag |
|
Niveau 4 |
Zeer laag |
Formuleren van de conclusies
Bij interventievragen verwijst de conclusie niet naar een of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie(s), waarbij het niveau van het meest relevante bewijs is weergegeven.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen.
Procedure voor commentaar en autorisatie
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Diabetesvereniging Nederland (DVN), de Beroepsorganisatie voor Diabeteszorgverleners (EADV), het Nederlands Huisartsen genootschap (NHG), Nefarma, de Nederlandse Diabetes Federatie (NDF), de Nederlandse Vereniging van Diëtisten (NVD), en de Nederlandse Vereniging van Klinisch Chemici (NVKC). De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek per module staat in aanverwant 'Kennislacunes'.

