Termijn van bevallen voor vrouw met diabetes
Uitgangsvraag
Wat is de beste termijn van bevallen voor een zwangere vrouw met diabetes mellitus of diabetes gravidarum (GDM) die glucoseverlagende medicatie (insuline en/of orale antidiabetica) gebruikt en van welke factoren is dit afhankelijk?
Aanbeveling
Adviseer de zwangere vrouw met diabetes type 1 of type 2 zonder complicaties, een inleiding van de bevalling, of een sectio caesarea indien geïndiceerd, bij voorkeur vanaf een zwangerschapsduur van 38 weken, maar niet later dan 39 weken.
Overweeg bij vrouwen met GDM die insuline of andere glucoseregulerende medicatie gebruiken, een inleiding van de bevalling, of een sectio caesarea indien geïndiceerd, bij voorkeur vanaf een zwangerschapsduur van 38 weken, maar niet later dan 39 weken.
Adviseer vrouwen met GDM die alleen een dieet hebben en waarbij het kind zich normaal ontwikkelt een expectatief beleid (zie richtlijn serotiniteit).
Bespreek met de zwangere vrouw met diabetes mellitus of GDM met glucoseregulerende medicatie de voor- en nadelen van het inleiden van de bevalling en van een sectio caesarea.
Overwegingen
Het inleiden van de baring is een interventie die door zwangere vrouwen over het algemeen als ingrijpend wordt ervaren. Alvorens het advies wordt gegeven hiertoe over te gaan is het van belang samen met de zwangere zorgvuldig de voor- en nadelen van een dergelijke interventie af te wegen. Inleiding van de baring lijkt geassocieerd met meer instrumentele bevallingen en keizersnedes (Baud, 2013). Dit laatste geldt in gelijke mate voor inleiding van de baring om electieve redenen als om medische redenen. De indicatie voor een inleiding moet altijd kunnen rechtvaardigen dat bij het niet slagen van de inleiding een sectio caesarea wordt geadviseerd (NVOG, 2006; Baud, 2013).
Op basis van de beschikbare literatuur is er onvoldoende kwalitatief goed bewijs over voor- en nadelen van inleiding van de baring ten opzichte van het afwachten van het spontane begin van de baring bij vrouwen met GDM of vrouwen met type 1 of type 2 diabetes mellitus. Er werd geen significant verschil gevonden tussen inleiden en afwachten in aantal keizersnedes en het vóórkomen van schouderdystocie bij vrouwen met GDM. Deze uitkomsten zijn niet eenduidig in de gebruikte studies. Bovendien zijn de studies heterogeen van opzet en is het niveau van bewijs zeer laag. Het is daarom niet goed mogelijk om op basis van de literatuur duidelijke conclusies te trekken over het beste tijdstip van bevallen, of over de voor- of nadelen van inleiding van de baring.
Wel zijn er uit grote observationele studies aanwijzingen dat bij zwangere vrouwen met type 1 en type 2 diabetes de kans op foetale en perinatale sterfte verhoogd is vanaf de 39e week, in vergelijking met zwangere vrouwen zonder diabetes (NICE guideline, 2015, evidence statement), hoewel het bewijs van lage kwaliteit is. Zie onderstaande tabel en voor absolute risico’s de tabellen 79 en 80. Op basis daarvan vindt de werkgroep het overwegen van een inleiding of een electieve sectio vóór de termijn van 39 weken bij vrouwen met type 1 of type 2 diabetes gerechtvaardigd. De werkgroep is daarbij zelfs van mening dat aan deze vrouwen dit zou moeten worden geadviseerd. Dit laatste is derhalve zo geformuleerd in de aanbeveling.
Tabel: kans op foetale en perinatale sterfte bij vrouwen met diabetes, gerelateerd aan de zwangerschapsduur (NICE tabel 77 en 78).
|
Incidence of stillbirth in the babies of women with type 1 and type 2 diabetes compared with all women in England and Wales (NICE 2015) |
||||||||
|
|
Week 24-27 |
Week 28-31 |
Week 32-34 |
Week 35-36 |
Week 37-38 |
Week >-39 |
|
Quality |
|
Holman 2014 |
0,95 (0,82-1,10) |
0,87 (0,66-1,16) |
1,25 (0,81-1,94) |
0,75 (0,33-1,68) |
1,46 (0,37-5,66) |
7,2 (1,31-39,63) |
|
Very low |
|
|
|
|||||||
|
Incidence of perinatal mortality in the babies of women with type 1 diabetes compared with women who do not have type 1 diabetes |
||||||||
|
|
Week 32-34 |
Week 35-36 |
Week 37 |
Week 38 |
Week 39 |
Week 40 |
Week 41- 45 |
Quality |
|
Eidem 2011 |
1,17 (0,50-2,74) |
0,83 (0,27-2,56) |
1,42 (0,36-5,63) |
1,97 (0,49-7,85) |
4,25 (1,38-13,11) |
3,03 (0,43-21,41) |
12,42 (4,06-37,93) |
Very low |
Vanaf welke zwangerschapsduur deze inleiding of electieve sectio plaats dient te vinden is op basis van de literatuur niet te beantwoorden. De NICE-richtlijn geeft in haar aanbeveling aan vanaf 37/0 weken, waarbij de NICE-werkgroep in haar overwegingen een voorkeur uitspreekt voor zo laat mogelijk binnen de periode 37/0 tot 38/6 weken. De Nederlandse richtlijnwerkgroep heeft ervoor gekozen om in de aanbeveling een voorkeur uit te spreken om de bevalling pas na 38/0 weken in te leiden. Dit laatste wordt ook mede ingegeven door de toegenomen kansen op neonatale morbiditeit, in casu respiratoire insufficiëntie en NICU opname. Respiratoire insufficiëntie wordt vooral gezien na een (te) vroeg uitgevoerde electieve sectio caesarea (Niu, 2014). Desalniettemin kunnen er kunnen zowel maternale als foetale redenen zijn om toch eerder dan 38 weken in te leiden of een sectio caesarea te verrichten.
Over vrouwen met GDM die insuline of andere glucoseverlagende medicatie gebruiken is onvoldoende geschikte literatuur gevonden over het tijdstip van bevallen. Er was slechts één RCT van matige kwaliteit uit 1993 met 200 patiënten beschikbaar (Kjos, 1993). De meeste vrouwen in deze studie hadden GDM gereguleerd met insuline, echter 13 vrouwen hadden diabetes mellitus type 2. Deze trial vergeleek actief inleiden bij 38 weken zwangerschapsduur met een afwachtend beleid tot 42 weken zwangerschapsduur. Deze RCT geeft beperkt houvast voor een beleid van inleiden bij 38 weken. Er was geen significant verschil in sectio caesarea, schouderdystocie of perinatale sterfte tussen de groep die werd ingeleid en de afwachtende groep. Er was een grotere kans op een kind >90e percentiel (10/100 vs 23/100, p=0,02), maar het verschil in macrosomie (geboortegewicht >4500 gr; 0/100 vs 2/100) was niet significant. Voor alle uitkomsten werd de kwaliteit van de evidence als low of very low beoordeeld in de NICE guideline (zie Grade-tabellen 79 en 80).
In een observationele studie van matige kwaliteit (Lurie, 1996) was de groep vrouwen met GDM en medicatie herkenbaar beschreven. In deze studie werd geen significant verschil gevonden in de percentages sectio caesarea en schouderdystocie (zie Grade-tabellen 79 en 80).
In de overige observationele studies werd onvoldoende onderscheid gemaakt tussen vrouwen met GDM die wel of geen medicatie gebruikten. In deze studies gebruikte het merendeel van de zwangeren (meer dan driekwart) geen medicatie. Deze observationele studies verschilden aanzienlijk van opzet (in- en exclusiecriteria; geschat foetaal gewicht voor inleiden of afwachten), waardoor er geen betrouwbare conclusies getrokken kunnen worden over voor of- nadelen van inleiden van de baring bij vrouwen met GDM met of zonder glucoseregulerende medicatie.
De NICE-richtlijn en de beschikbare literatuur maken geen onderscheid tussen vrouwen met diabetes mellitus en vrouwen met GDM met en zonder glucoseregulerende medicatie. Dit kan als kennishiaat worden gezien.
De werkgroep is van mening dat vrouwen met GDM en gebruik van insuline of andere glucoseverlagende medicatie, op dezelfde manier beoordeeld kunnen worden als vrouwen met pre-existente diabetes. Op basis van deze overweging kan ook bij hen een inleiding of sectio caesarea tussen 38+0 en 38+6 week worden overwogen, waarbij de wensen van de zwangere en haar partner een belangrijke meebepalende factor zijn.
De werkgroep is van mening dat vrouwen met GDM die met een dieet een goed gereguleerd glucose stofwisseling hebben en geen macrosoom kind verwachten, een gezonde zwangerschap hebben en op dezelfde manier beoordeeld dienen te worden als vrouwen zonder GDM. Voor hen kan het gebruikelijke beleid ten aanzien van serotiniteit worden gevolgd (NVOG richtlijn Serotiniteit 2007). Als er sprake is van een vermoeden van macrosomie kan dat een reden zijn om eerder een inleiding te overwegen.
Onderbouwing
Achtergrond
Bij vrouwen met diabetes type 1 en 2 zonder complicaties wordt vaak in de a terme periode een inleiding van de baring aangeboden om de kans op onverwachte intra-uteriene vruchtdood te verkleinen. In hoeverre verhoogt echter een vroeg a terme inleiding (37 tot 39 wk) van de baring de kans op een mislukte inleiding of op neonatale problemen? Bij een afwachtend beleid zou juist de kans op macrosomie, schouderdystocie of keizersnede verhoogd zijn. Mogelijk geldt ditzelfde ook voor vrouwen met GDM die insuline of andere glucoseregulerende medicatie gebruiken. Deze richtlijnmodule beoogt om tot een afgewogen advies te komen over het inleiden van de baring bij vrouwen met pre-existente diabetes mellitus type 1 en 2 en GDM die behandeld worden met insuline of andere glucoseverlagende medicatie.
Samenvatting literatuur
6.1.2 Timing of birth
6.1.2.1 Review question: What is the gestational age-specific risk of intrauterine death in pregnancies with type 1, type 2 or gestational diabetes, and the optimal timing of birth?
6.1.2.3 Description of included studies
Six studies were identified for inclusion in this review (Rosenstein, 2012; Holman, 2014; Eidem, 2011; Kjos, 1993; Lurie, 1996; Alberico, 2010). Four studies included women with gestational diabetes (Rosenstein, 2012; Kjos, 1993; Lurie, 1996; Alberico, 2010), one study included women with type 1 diabetes (Eidem, 2011) and the sixth study included women with Type 1 or Type 2 diabetes (Holman, 2014).
One large retrospective study from the USA (Rosenstein, 2012) used record linkage to examine mortality rates in babies of women with gestational diabetes compared with those with no diabetes. Three mortality outcomes were examined in the study and were stratified by gestational age: stillbirth, neonatal death and infant death. A second study (Holman, 2014) examined data on stillbirth incidence collected from four audits of women with pre-existing diabetes conducted in England over two time periods and compared these data to stillbirth incidence in all births in England and Wales collected by the Office of National Statistics.
A third study from Norway (Eidem, 2011) also used record linkage to examine perinatal mortality rates in babies of women with pregestational type 1 diabetes compared with those without type 1 diabetes. There were no corresponding studies that could be included that examined mortality rates with different severities of diabetes (such as those estimated by HbA1c).
Three further studies compared morbidity and mortality outcomes in women with gestational diabetes who underwent elective delivery or expectant management (Kjos, 1993; Lurie, 1996; Alberico, 2010). One was a randomised controlled trial (RCT) from the USA (Kjos, 1993), one a prospective cohort study with historical controls from Israel (Lurie, 1996) and one was a retrospective cohort from Italy (Alberico, 2010).
Most women (93.5%) in the RCT (Kjos, 1993) and all women in the prospective cohort study (Lurie, 1996) had insulin treated gestational diabetes (A2). The retrospective cohort study (Alberico, 2010) included women with insulin treated and non-insulin treated gestational diabetes (A1 and A2) and foetal growth acceleration diagnosed at 38 weeks of gestation.
The elective delivery method was active induction of labour in the 38th or 39th gestational week in three studies (Kjos, 1993; Lurie, 1996; Alberico, 2010). Two studies required evidence of fetal lung maturity before induction was started (Kjos, 1993; Lurie, 1996). Up to three applications of vaginal prostaglandin were used for cervical ripening in women with low Bishop scores before treatment with intravenous oxytocin to induce labour in the RCT (Kjos, 1993). In the prospective cohort study, induction of labour was performed by either intracervical balloon catheter or by prostaglandin gel placement if the cervix was unfavourable or by intravenous oxytocin followed by amniotomy if the cervix was favourable. If fetal weight was estimated to be 4500 g or more, then a caesarean section was performed (Lurie, 1996). In the retrospective cohort study, prostaglandin gel was placed vaginally every six to eight hours until labour started, and if induction did not succeed after 5 attempts, or if fetal distress was suspected, then a caesarean section was performed (Alberico, 2010).
Expectant management of pregnancy awaiting spontaneous onset of labour was followed until gestational week 42 in the RCT (Kjos, 1993) and beyond reassessment at gestational week 40 (Lurie, 1996) or week 40 to 41 (Alberico, 2010) if there were no complications. If spontaneous labour had not occurred by these gestational age limits elective delivery was undertaken. In all three studies induction of labour was undertaken if complications arose or, in one study, if the pregnancy exceeded 42 weeks of gestation or if the estimated fetal weight was 4200 g or more (Kjos, 1993). Caesarean section was performed if the estimated fetal weight was more than 4250 g in the prospective cohort study (Lurie, 1996) and was performed electively if the estimated fetal weight was 4500 g or more in the retrospective cohort study (Alberico, 2010).
Data were available for the following outcomes prioritised by the guideline development group:
- mode of birth (Kjos, 1993; Lurie, 1996; Alberico, 2010);
- stillbirth/neonatal death/ perinatal death/infant death (Rosenstein, 2012; Kjos, 1993; Lurie, 1996; Alberico, 2010);
- admission to NICU (Kjos, 1993; Lurie, 1996; Alberico, 2010);
- macrosomia (Kjos, 1993; Lurie, 1996; Alberico, 2010);
- shoulder dystocia (Kjos, 1993; Lurie, 1996; Alberico, 2010).
No data were available in the six studies for outcomes regarding maternal complications of delivery, maternal satisfaction/experiences or neonatal intensive care unti (NICU) stay or more than 24 hours.
6.1.2.4 Evidence profile
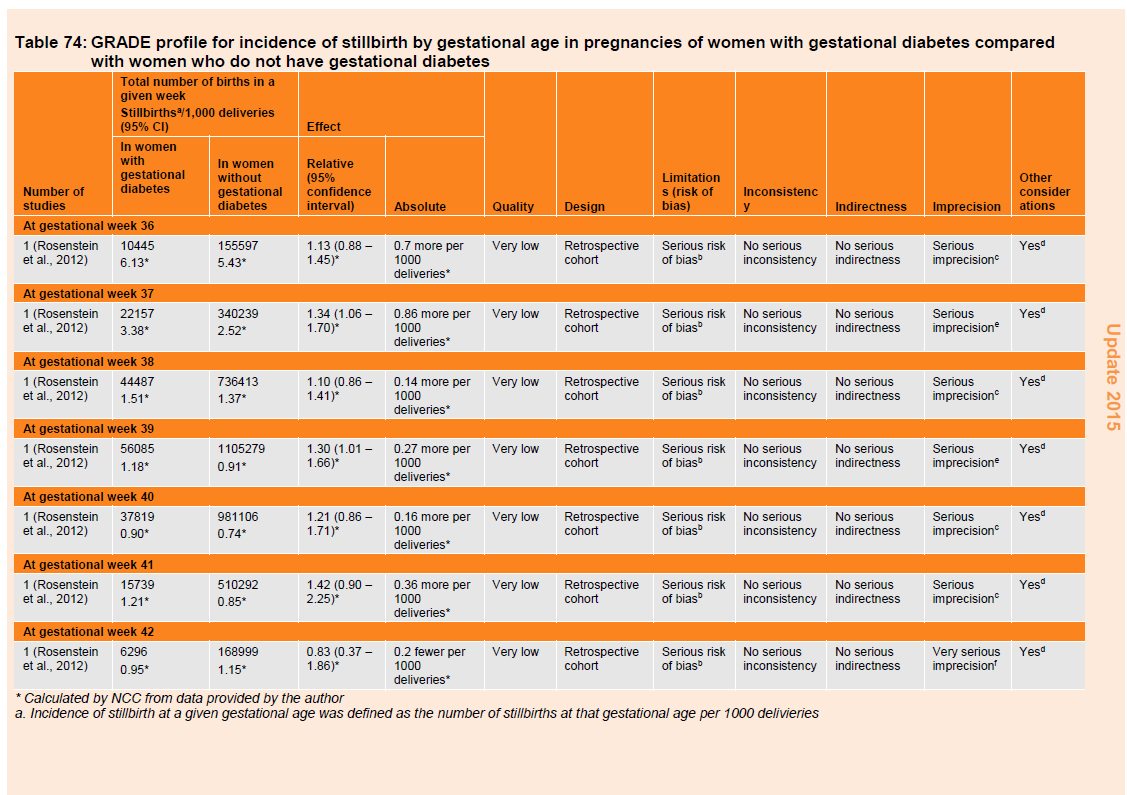
Table 74: GRADE profile for incidence of stillbirth by gestational age in pregnancies of women with gestational diabetes compared with women who do not have gestational diabetes.
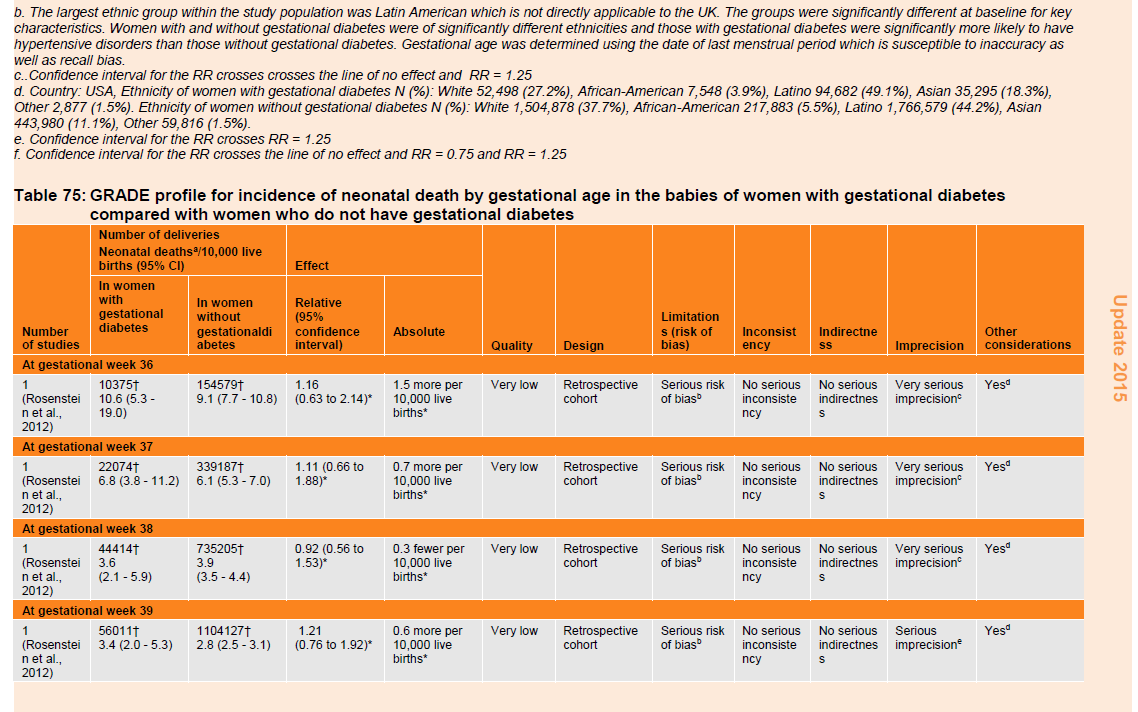
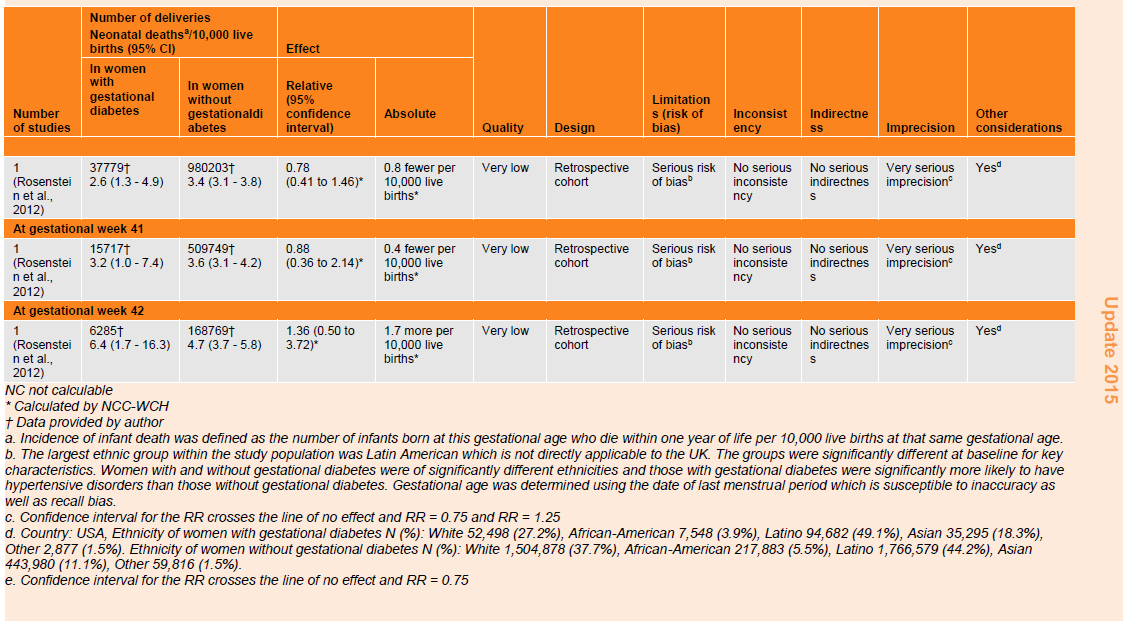
Table 75: GRADE profile for incidence of neonatal death by gestational age in the babies of women with gestational diabetes compared with women who do not have gestational diabetes.
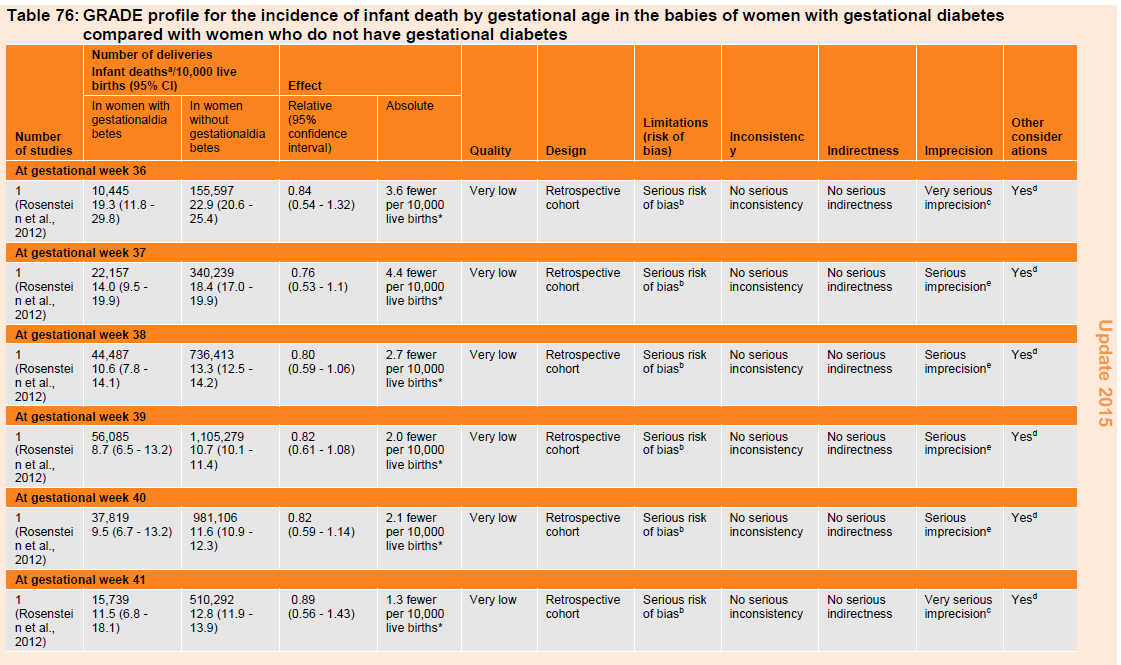
Table 76: GRADE profile for the incidence of infant death by gestational age in the babies of women with gestational diabetes compared with women who do not have gestational diabetes.
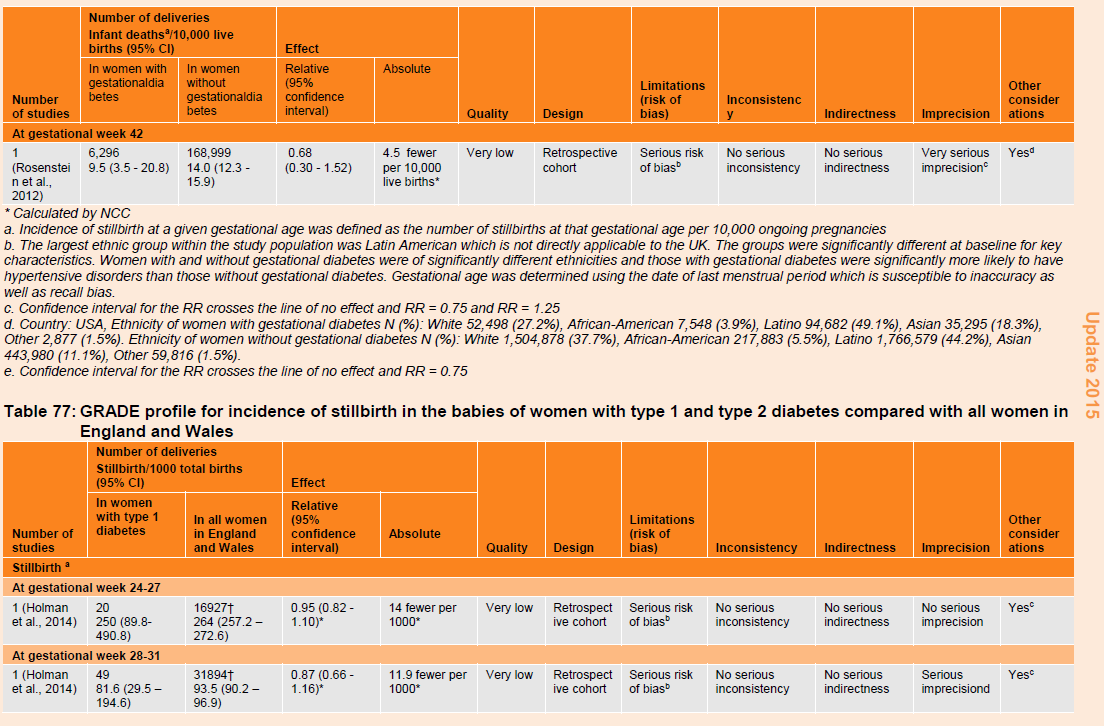
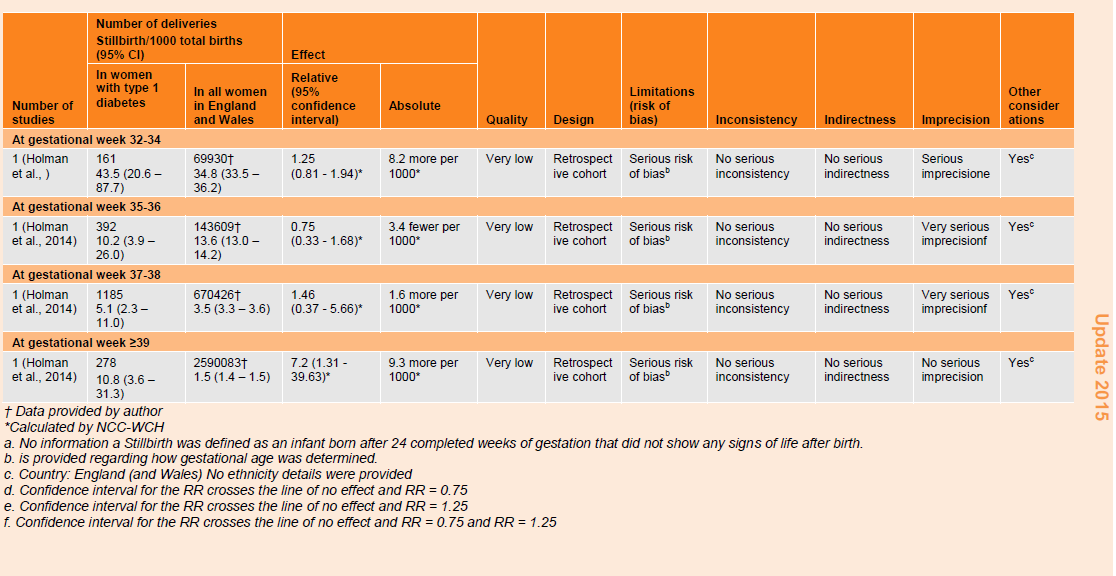
Table 77: GRADE profile for incidence of stillbirth in the babies of women with type 1 and type 2 diabetes compared with all women in England and Wales.
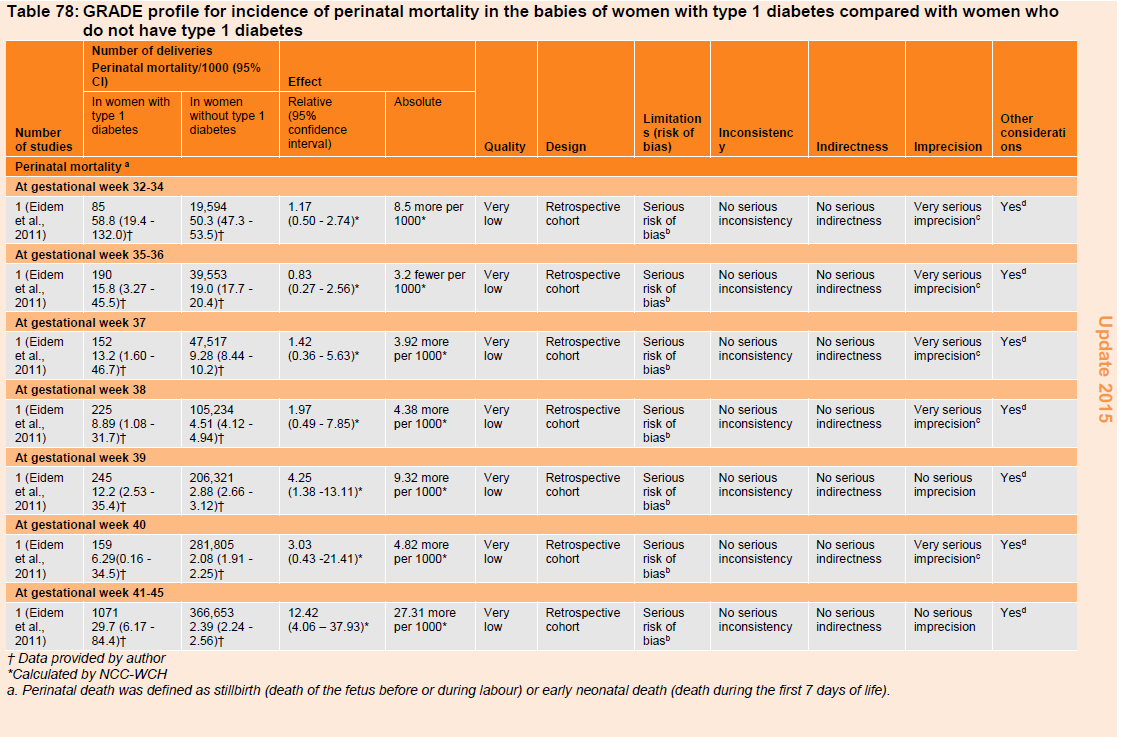
Table 78: GRADE profile for incidence of perinatal mortality in the babies of women with type 1 diabetes compared with women who do not have type 1 diabetes.
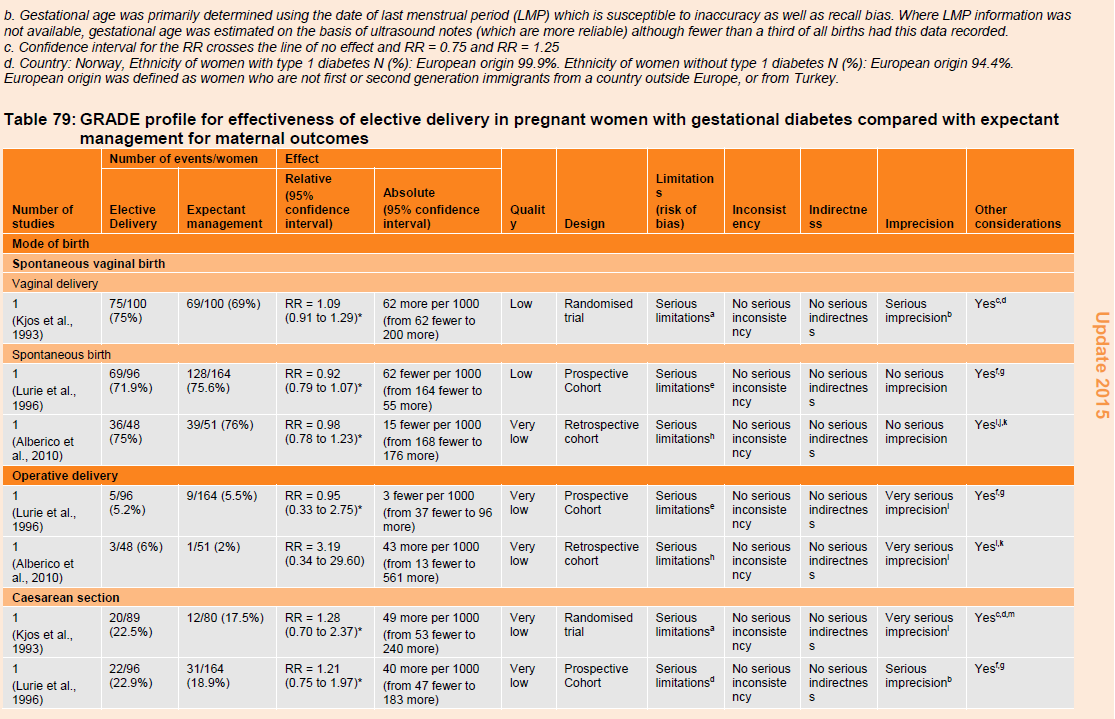
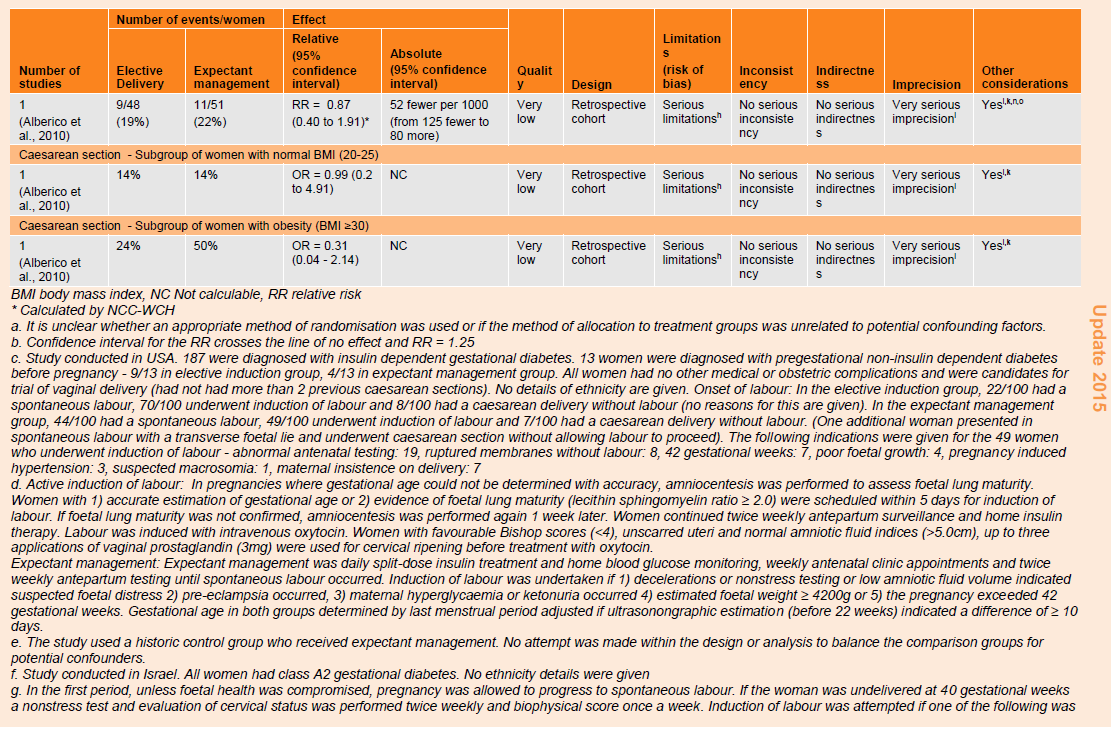
Table 79: GRADE profile for effectiveness of elective delivery in pregnant women with gestational diabetes compared with expectant management for maternal outcomes.
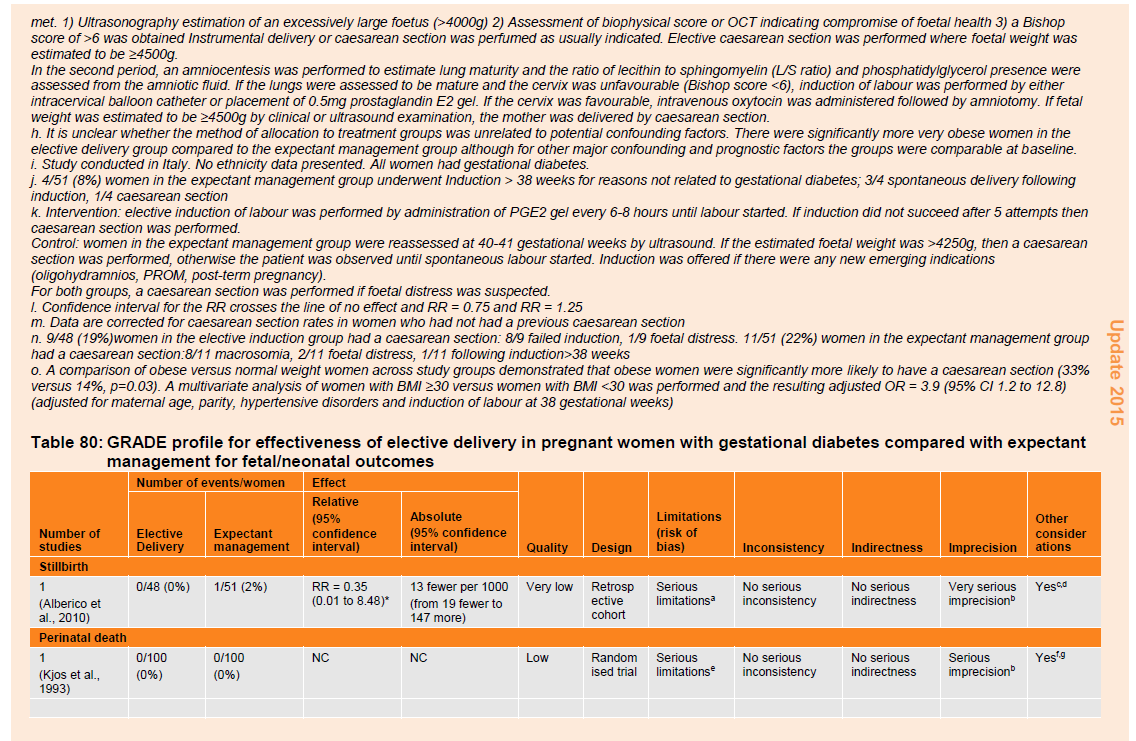
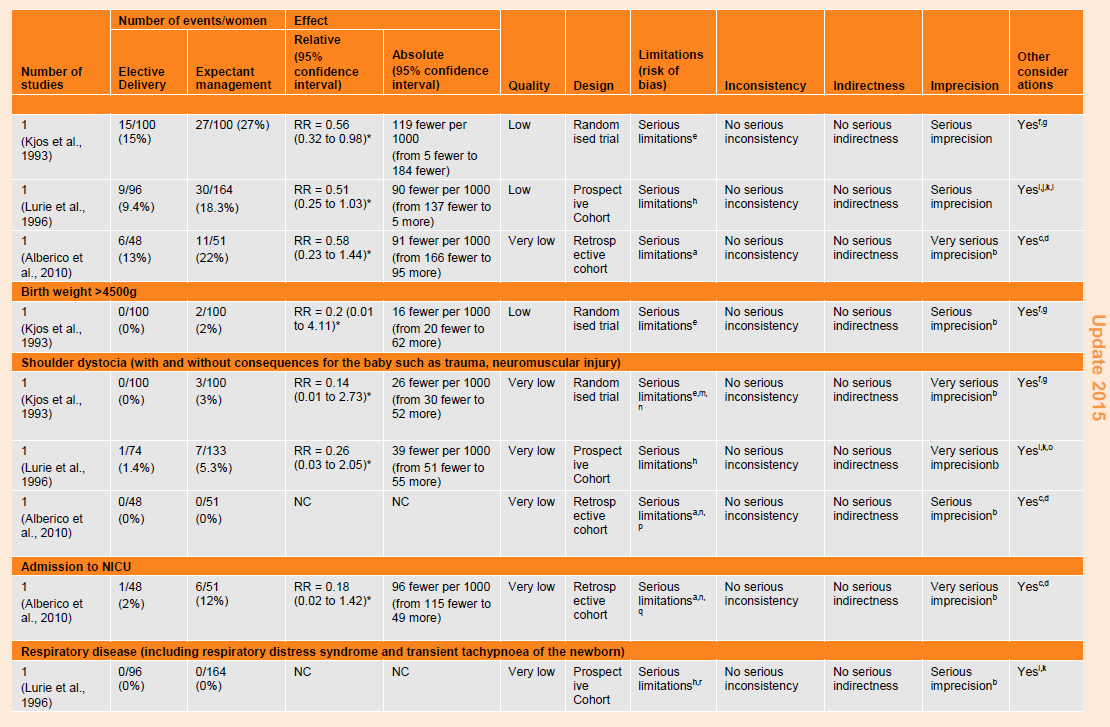
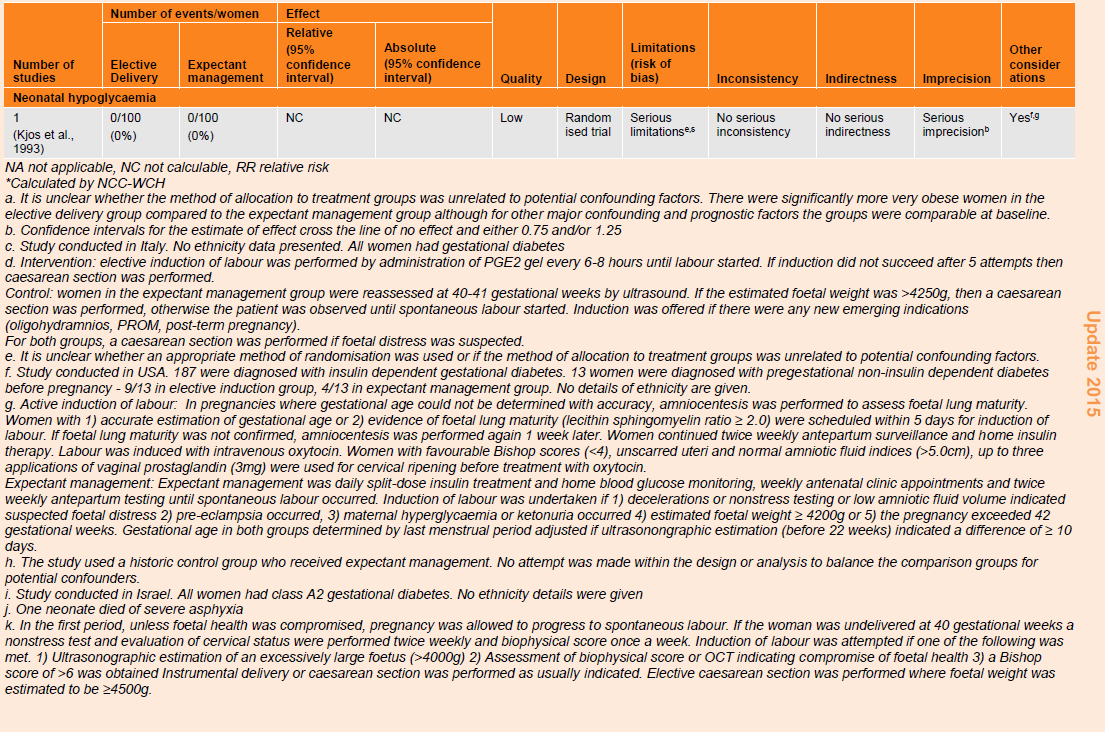
Table 80: GRADE profile for effectiveness of elective delivery in pregnant women with gestational diabetes compared with expectant management for fetal/neonatal outcomes.
6.1.2.5 Evidence statements
One retrospective cohort study (n=4,190,953 non anomalous deliveries, table 74) reported a trend of falling stillbirth rates from 36 to 40 weeks of gestation and higher rates thereafter in women with and without gestational diabetes. The incidence of stillbirth was higher in babies of women with gestational diabetes compared with those without throughout weeks 36 to 41, but the risk of stillbirth was increased only during weeks 37 (RR 1.34, 95% CI 1.06 to 1.70) and 39 (RR 1.30, 95% CI 1.01 to 1.66) of gestation in women with gestational diabetes compared with those without. In week 42, the incidence of stillbirth was higher in women without gestational diabetes compared with those with gestational diabetes.
The same study found U-shaped trends for the incidence of neonatal (table 75) and infant death (table 76) in the babies of women with and without gestational diabetes, which were highest for babies delivered at 36 weeks and which fell to a nadir at 39 to 40 weeks before rising again at 41 weeks. The neonatal death rate was higher in babies of women with gestational diabetes delivered at weeks 36, 37, 39 and 42 compared with the babies of women without gestational diabetes. However, there were no differences in the risk of neonatal death between the two groups at any time point. Although the infant death rates were higher in babies of women without gestational diabetes compared with those with gestational diabetes from 36 to 42 weeks gestation, there were no differences in the risk of infant death between the 2 groups at any time point.
In the second study (n=3,522,869), the incidence of stillbirth in women with type 1 and type 2 diabetes also demonstrated a U-shaped trend, being highest at 24 to 27 weeks of gestation, decreasing to a minimum at 37 to 38 weeks of gestation and then rising at 39 weeks’ gestation and later (table 77). The incidence of stillbirth in all women in England and Wales similarly decreased from 24 to 27 weeks of gestation but rather than rising, the minimum rate was observed at 39 weeks’ gestation and later. When the groups were compared, there were no differences in the risk of stillbirth between the two groups at any time point except at 39 weeks’ gestation and later, when there was a higher rate in women with type 1 and type 2 diabetes compared with all women in England and Wales (RR 7.2, 95% CI 1.31 to 39.63).
A third retrospective study (n=1,162,399) reported a U-shaped trend for rates of perinatal mortality in babies of women with type 1 diabetes, with the highest risk at a timepoint of 32 to 34 weeks, dipping to a nadir at week 38 before rising again at 39 weeks (table 78). The value at 40 weeks dipped and then rose again at 41 to 45 weeks. Similarly, rates of perinatal mortality in babies of women without type 1 diabetes was also highest at the 32 to 34 weeks timepoint, but thereafter fell and plateaued from week 39. The risk of perinatal mortality was higher in babies of women with type 1 diabetes compared with those without type 1 diabetes at week 39 (RR 4.25, 95% CI 1.38 to 13.11) and weeks 41–45 (RR 12.42, 95% CI 4.06 to 37.93).
The evidence for all the above mortality outcomes was of very low quality.
When women with gestational diabetes who had an elective delivery were compared with those who were managed expectantly, there were no differences in these mode of birth outcomes: vaginal delivery, spontaneous vaginal birth, operative deliveries or caesarean section (table 79):
- vaginal delivery (RR 1.09, 95% CI 0.91 to 1.29, one RCT, n=200);
- spontaneous vaginal birth (two cohort studies: RR 0.92, 95% CI 0.79 to 1.07, n=260; RR 0.98, 95% CI 0.78 to 1.23, n=99);
- operative deliveries (two cohort studies: RR 0.95, 95% CI 0.33 to 2.75, n=260; RR 3.19, 95% CI 0.34 to 29.60, n=99);
- caesarean section (one RCT: RR 1.28, 95% CI 0.70 to 2.37, n=200; and two cohort studies: RR 1.21, 95% CI 0.75 to 1.97, n=260; RR 0.87, 95% CI 0.40 to 1.91, n=99).
One study compared the risk of caesarean section in women having an elective delivery with those managed expectantly according to body mass index (BMI) but found no differences in caesarean section risk between groups for women with a normal (20 to 25) BMI (odds ratio [OR] 0.99, 95% CI 0.2 to 4.91, n=28) or an obese (30 or more) BMI (OR 0.31, 95% CI 0.04 to 2.14, n=78). The evidence for these findings was of low and very low quality.
There were no differences in the risk of stillbirth, perinatal death, shoulder dystocia or NICU admission in the babies of women with gestational diabetes who had an elective delivery compared with those who were managed expectantly (table 80):
- stillbirth (one cohort study: RR 0.35, 95% CI 0.01 to 8.48, n=99);
- perinatal death (one RCT: RR not calculable [NC], 95% CI NC, n=200; and one cohort study: RR NC, 95% CI NC, n=260);
- shoulder dystocia (one RCT: RR 0.14, 95% CI 0.01 to 2.73, n=200; and two cohort studies: RR 0.26, 95% CI 0.03 to 2.05, n=207; RR NC, 95% CI NC, n=99);
- NICU admission (one cohort study: RR 0.18, 95% CI 0.02 to 1.42, n=99).
The evidence for these findings was of low and very low quality.
With regard to fetal size (table 80), one RCT found that the risk of macrosomia (defined as birthweight more than 4000 g) was lower in babies of women with gestational diabetes who had an elective delivery compared with those who were managed expectantly (RR 0.56, 95% CI 0.32 to 0.98, n=200) although two cohort studies reported no difference in risk of macrosomia (RR 0.51, 95% CI 0.25 to 1.03, n=260; RR 0.58, 95% CI 0.23 to 1.44, n=99). When macrosomia was defined as birthweight more than 4500 g, there was no difference in risk for babies of women who had elective delivery compared with those who were managed expectantly. There were no incidences of respiratory disease (one cohort study, n=260) or neonatal hypoglycaemia (one RCT, n=200) reported in the studies that reported these outcomes. The evidence for these findings was of low and very low quality.
Zoeken en selecteren
Om de uitgangsvraag te beantwoorden is een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling(en):
- Is er verschil in risico op zwangerschaps-, partus- en neonatale complicaties tussen afwachten van het spontane begin van de bevalling en inleiden van de bevalling bij een zwangere vrouw met diabetes mellitus of GDM met insuline en/of orale glucoseverlagende medicatie zonder complicaties? En is er verschil in frequentie van ongeplande sectio’s caesarea?
- Als inleiden tot minder complicaties leidt, vanaf welke zwangerschapsduur is inleiden van de baring geïndiceerd?
Relevante uitkomstmaten
De werkgroep achtte de items sectio caesarea, schouderdystocie, neonataal trauma, perinatale sterfte en asfyxie voor de besluitvorming kritieke uitkomstmaten en de items macrosomie, vaginale kunstverlossing en fluxus postpartum voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar systematische reviews, RCT’s en observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 256 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- relevant voor beantwoording van de uitgangsvraag;
- betreft primair (origineel) onderzoek of systematische review;
- studiepopulatie komt overeen met patiëntengroep waarvoor richtlijn bedoeld is;
- uitkomstmaten komen overeen met gekozen uitkomstmaten.
Direct na de selectieperiode bleek een NICE-richtlijn (februari 2015) met onder meer dezelfde uitgangsvragen te zijn verschenen, waarin ook grotendeels dezelfde uitkomstmaten worden meegenomen. De werkgroep heeft deze richtlijn vergeleken met de eigen search en uitkomsten en heeft besloten dat deel van de NICE-richtlijn wat betreft literatuursamenvatting integraal over te nemen (NICE guideline Diabetes in Pregnancy, February 2015; 6.1.2 Timing of birth).
De werkgroep heeft ervoor gekozen de samenvatting en beoordeling van de literatuur over te nemen en niet de paragrafen waarin de mening of de overwegingen van de Britse werkgroep zijn opgenomen. De tekst, evidence tabellen en beoordeling van individuele studiekwaliteit zijn derhalve integraal overgenomen en kunt u onder het tabblad Onderbouwing vinden.
Uit de NICE-richtlijn zijn overgenomen uit hoofdstuk 6.1 Timing and mode of birth:
6.1.2 Timing of birth
6.1.2.1 Review question
6.1.2.3 Description of included studies
6.1.2.4 Evidence profile
6.1.2.5 Evidence statements
Voor de verantwoording van literatuursearch en -selectie bij dit hoofdstuk wordt verwezen naar de appendices bij de NICE-richtlijn (appendix D.13 review protocol, appendix E.9 Zoekstrategie, appendix F aantal gevonden en geïncludeerde studies, appendix G.16 verantwoording geëxcludeerde studies, appendix H Evidence tabellen).
Referenties
- Alberico S, Businelli C, Wiesenfeld U, et al. Gestational diabetes and fetal growth acceleration: induction of labour versus expectant management. Minerva Ginecologica. 2010;62:533-9.
- Baud D, Rouiller S, Hohlfeld P, et al. Adverse obstetrical and neonatal outcomes in elective and medically indicated inductions of labor at term. J Matern Fetal Neonatal Med. 2013;26:15951601.
- Eidem I, Vangen S, Hanssen KF, et al. Perinatal and infant mortality in term and preterm births among women with type 1 diabetes. Diabetologia 2011;54:2771-8.
- Holman N, Bell R, Murphy H, et al. Women with pre-gestational diabetes have a higher risk of stillbirth at all gestations after 32 weeks. Diabet Med 2014;31:1129-32.
- Kjos SL, Henry OA, Montoro M, et al. Insulin-requiring diabetes in pregnancy: a randomized trial of active induction of labor and expectant management. Am J Obstet Gynecol 1993;169:611-5.
- Lurie S, Insler V, Hagay ZJ. Induction of labor at 38 to 39 weeks of gestation reduces the incidence of shoulder dystocia in gestational diabetic patients class A2. Am J Perinatol 1996;13:293-6.
- NICE guideline Diabetes in Pregnancy, February. 2015;6.1.2. Timing of birth.
- Niu B, Lee VR, Cheng YW, Frias AE, Nicholson JM, Caughey AB. What is the optimal gestational age for women with gestational diabetes type A1 to deliver? Am J Obstet Gynecol 2014;211:418.e1-6.
- NVOG richtlijn. 2006. Inductie van de baring.
- NVOG richtlijn. 2007. Serotiniteit.
- Rosenstein MG, Cheng YW, Snowden JM, et al. The risk of stillbirth and infant death stratified by gestational age in women with gestational diabetes. Am J Obstet Gynecol. 2012;206:309.e1-7.
Evidence tabellen

Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-04-2018
Beoordeeld op geldigheid : 16-12-2021
Op niveau van de netwerkrichtlijn wordt door de NIV een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV en de NVOG zijn regiehouder van deze richtlijnmodules en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is de betrokken zorgprofessional handvatten te bieden bij het besluit wat een optimaal moment van bevallen is voor een zwangere vrouw met diabetes, en bij de keuze van de behandeling van zwangeren met diabetes type 2 of GDM die onvoldoende baat hebben bij een dieet. Het adequaat informeren van de patiënt, en het samen tot een optimale keuze komen is hierbij belangrijk.
Doelgroep
Deze modules zijn geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor zwangeren met diabetes (multidisciplinair behandelteam). Deze beroepsgroepen bestaan onder andere uit verloskundigen, gynaecologen, diabetesverpleegkundigen, diëtisten, huisartsen, internisten en apothekers.
Samenstelling werkgroep
De richtlijn Diabetes en zwangerschap is onderdeel van de Netwerkrichtlijn diabetes mellitus ontwikkeld onder overkoepelend voorzitterschap van Dr. P.H.L.M. (Nel) Geelhoed, internist-endocrinoloog, Haaglanden Medisch Centrum, Den Haag (Nederlandse Internisten Vereniging).
Voor het ontwikkelen van deze modules Diabetes en zwangerschap is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de beroepsverenigingen van verloskundigen, gynaecologen en internisten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De modules zijn voor commentaar voorgelegd aan andere partijen betrokken bij de zorg voor zwangere vrouwen met diabetes.
- Dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter), Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. I.M. Evers, gynaecoloog-perinatoloog, Meander Medisch Centrum, Amersfoort, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J. van Dillen, gynaecoloog-perinatoloog, RadboudUMC, Nijmegen, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. E.C. van der Wilk, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. L.D. Elving, internist, RadboudUMC, Nijmegen, Nederlandse Internisten Vereniging
- Dr. R.G. IJzerman, internist-endocrinoloog, VU Medisch Centrum, Amsterdam, Nederlandse Internisten Vereniging
- Dr. P.M. Offerhaus, senior docent/onderzoeker, lectoraat Midwifery Science, Academie Verloskunde, Maastricht, Koninklijke Nederlandse Organisatie van Verloskundigen
Met ondersteuning van:
- Drs. S.B. Muller-Ploeger, adviseur, Kennisinstituut van Medisch Specialisten
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
- Drs. A.J.P. Ranke, junior adviseur, Kennisinstituut van Medisch Specialisten
- C. Sloof, MSc, medisch informatiespecialist, St. Antonius Ziekenhuis, Nieuwegein
- S.K. Josso, senior projectsecretaresse, Kennisinstituut van Medisch Specialisten
- N.F. Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De “KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Ondernomen actie |
|
Duvekot |
gynaecoloog-perinatoloog |
opstellen van medische expertises |
geen |
geen |
lid 'verloskundige indicatielijst'(VIL) werkgroep |
geen |
geen |
voorzitter Otterlo werkgroep NVOG (tot okt 2014), voorzitter cie kwaliteitsdocumenten NVOG (vanaf okt 2014) |
geen |
|
Evers |
gynaecoloog-perinatoloog |
Voorzitter Richtlijn Basis Prenatale Zorg, NVOG |
geen |
geen |
geen |
Hoofdonderzoeker GLUCOMOMS studie, glucose monitoring met sensor tijdens de zwangerschap, subsidie van ZonMW, studie is nog lopende tot 2015 |
geen |
lid Otterlo werkgroep |
geen |
|
van Dillen |
gynaecoloog-perinatoloog |
Geen |
geen |
geen |
geen |
geen |
geen |
lid Otterlo werkgroep |
geen |
|
Elving |
Internist |
Geen |
geen |
geen |
Lid van de kerngroep diabetes van de NIV |
geen |
geen |
geen |
geen |
|
IJzerman |
internist-endocrinoloog, Mijn werkzaamheden zijn patientgebonden, maar ook onderzoek en onderwijs. Daarnaast ben ik via het Vumc werkzaam als adviseur/beoordelaar van diabetes-gerelateerde medicatie voor het CBG |
Geen |
geen |
geen |
geen |
In 2014 hoofdonderzoeker van 2 mechanistische onderzoeken naar acute en chronische effecten van GLP-1 (receptor agonisten) op de hersenen waarvoor het VU medisch centrum subsidie ontving (AstraZeneca en NovoNordisk). Sinds januari 2016 lokale onderzoeker van een internationaal observationeel onderzoek naar de veiligheid van verschillende insulines tijdens de zwangerschap. Dit is een "Post-Authorisation Safety Study" op verzoek van de "European Medicines Agency" (Novo Nordisk). Voor het VUmc recent subsidie aangevraagd voor mechanistisch onderzoek naar effecten van glucose-verlagende medicatie op de hersenen (farma). Vanaf april 2016 één van de onderzoekers van een groot Europees onderzoek naar ondervoeding bij ouderen (PROMISS, gesubsidieerd door het "EU Research and Innovation programme Horizon 2020"). Hoofdonderzoeker van 2 epidemiologische onderzoeken waarvoor VUmc subsidie ontving van de "European Foundation for the Study of Diabetes" en NWO. Beide afgerond. Van 2011 tot 2013 betrokken bij onderzoek naar effecten van insuline detemir en insuline NPH op de hersenen waarvoor het VU medisch centrum subsidie ontving (NovoNordisk). |
geen |
geen |
geen |
|
van der Wilk |
gynaecoloog-perinatoloog |
Geen |
geen |
geen |
geen |
geen |
geen |
lid Otterlo werkgroep |
geen |
|
Offerhaus |
beleidsmedewerker KNOV |
Geen |
geen |
geen |
geen (afgevaardigd namens beroepsorganisatie) |
geen |
geen |
team richtlijnen KNOV |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV, 2014). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland (DVN)).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference (gezamenlijk voor zes richtlijnen die deel uitmaken van de netwerkrichtlijn diabetes, diabetische voet, diabetische retinopathie, diabetische neuropathie, kinderen, ouderen en diabetes en zwangerschap) door: de NIV, Diabetesvereniging Nederland (DVN), Eerste Associatie Van Diabetesverpleegkundigen (EADV), Inspectie voor de Gezondheidszorg, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Menzis, Nefarma, Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlands Huisartsen Genootschap (NHG), Nederlands Oogheelkundig Gezelschap (NOG), Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging van Dietisten (NVD), Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse Vereniging voor Neurologie (NVN), Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), Nederlandse Vereniging van Diabetes Podotherapeuten (NVvDP), Optometristen Vereniging Nederland (OVN), Provoet (Brancheorganisatie voor de Pedicure), Verpleegkundigen & Verzorgenden Nederland (V&VN), Verenso, WCS Kenniscentrum Wondzorg, Zorgverzekeraars Nederland (ZN), en Zorginstituut Nederland (ZIN). Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep de definitieve uitgangsvragen vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria.
Direct na de selectieperiode bleek een NICE-richtlijn te zijn verschenen (februari 2015) met onder meer dezelfde uitgangsvragen. De werkgroep heeft deze richtlijn vergeleken met de eigen search en uitkomsten en heeft besloten dat deel van de NICE-richtlijn wat betreft literatuursamenvatting integraal over te nemen (NICE guideline Diabetes in Pregnancy, February 2015).
De werkgroep heeft ervoor gekozen de samenvatting en beoordeling van de literatuur over te nemen en niet de paragrafen waarin de mening of de overwegingen van de Britse werkgroep zijn opgenomen. De tekst, evidence tabellen en beoordeling van individuele studiekwaliteit zijn derhalve integraal overgenomen en kunt u onder het tabblad Onderbouwing vinden.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden door NICE systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De literatuuranalyse voor beide modules is overgenomen uit de NICE-richtlijn Diabetes in Pregnancy (2015). Voor de methodiek verwijst de werkgroep naar hoofdstuk 1.2 (2015 guideline update development methodology) uit de betreffende richtlijn.
NICE gebruikt net als het Kennisinstituut van Medisch Specialisten GRADE voor het bepalen van de kracht van het wetenschappelijk bewijs.
GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
De NICE-richtlijn vermeldt conclusies en het bijbehorende niveau van bewijs in de paragrafen die Evidence statement heten. Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. Voor de manier van totstandkoming van deze paragrafen wordt verwezen naar de NICE-richtlijn.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, specifiek Nederlandse omstandigheden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg voor zwangeren met diabetes staat beschreven in de NDF Zorgstandaard Diabetes.
Indicatorontwikkeling
Bij de richtlijn zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- NICE guideline Diabetes in Pregnancy, February. 2015
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
