Medicamenteuze behandeling vrouw met DM2/GDM
Uitgangsvraag
Wat is de behandeling van voorkeur bij een zwangere vrouw met diabetes mellitus type 2 of met diabetes gravidarum (GDM) die niet reageert op een dieet?
Aanbeveling
Adviseer vrouwen met type 2 diabetes mellitus tijdens de preconceptieperiode en de zwangerschap over te gaan op insulinetherapie.
Verwijs vrouwen met type 2 diabetes mellitus die zwangerschap overwegen preconceptioneel naar de internist voor behandeling/instelling van de diabetes op insuline en naar de gynaecoloog voor een preconceptioneel consult.
Adviseer vrouwen bij wie in het eerste trimester GDM wordt vastgesteld te streven naar euglykemie. Adviseer hier laagdrempelig behandeling met insuline omdat waarschijnlijk sprake is van pre-existente diabetes mellitus.
Adviseer zwangeren met type 2 diabetes mellitus of GDM met een nuchtere glucose >7 mmol/l en/of een niet-nuchtere glucose >11 mmol/l direct te starten met insuline.
Adviseer vrouwen met GDM allereerst behandeling met insuline indien dieet niet voldoende effect heeft. Metformine is een acceptabel alternatief voor vrouwen die insuline weigeren of die om andere redenen geen insuline kunnen of willen gebruiken.
Overweeg glibenclamide alleen bij vrouwen met type 2 diabetes mellitus of GDM die:
- met metformine alleen niet uitkomen en insuline weigeren;
- intolerant zijn voor metformine en insuline weigeren.
Informeer vrouwen die kiezen voor behandeling met metformine of glibenclamide tijdens de zwangerschap over het feit dat dit gebruik off-label is en dat daar met name voor het kind nog onbekende risico’s aan zijn verbonden.
Overwegingen
Behandeling van diabetes in de zwangerschap wordt beschreven in de NVOG richtlijn Diabetes en Zwangerschap uit 2010, de NIV richtlijn Diabetes en zwangerschap uit 2007 en de NDF Zorgstandaard Diabetes uit 2012.
Zwangerschap bij vrouwen met type 2 diabetes mellitus (DM)
Niet-zwangere vrouwen met type 2 DM worden in Nederland meestal behandeld door de huisarts. De behandeling bestaat in de meeste gevallen uit (een combinatie van) orale bloedsuikerverlagende middelen al dan niet met insuline. Volgens de NHG-standaard zal metformine hier altijd onderdeel van zijn, tenzij het niet kan worden gebruikt vanwege bijwerkingen of contra-indicaties. De huisarts/praktijkondersteuner zal deze vrouwen moeten voorlichten over het belang van goede periconceptionele diabetesregulatie. Zodra er een daadwerkelijke kinderwens/zwangerschap is wordt voor verdere behandeling en begeleiding doorverwezen naar de tweede lijn. Het behandelteam in de tweede lijn, onder verantwoordelijkheid van de internist, zal de gedetailleerde voorlichting en begeleiding in de preconceptionele periode ter hand nemen, waarbij specifieke aandacht is voor veranderende zelfmanagementvereisten in deze periode. Adequate communicatie en structurele afstemming tussen de verschillende zorgprofessionals in de eerste en tweede lijn is daarbij een absolute randvoorwaarde. De werkgroep verwijst hiervoor naar de NDF Zorgstandaard.
Vóór een (geplande) zwangerschap zullen potentieel teratogene medicamenten moeten worden gestaakt. Specifiek geldt dat hier voor de thiazolidinederivaten, SU-preparaten (behalve glibenclamide) en de nieuwe middelen zoals DPP-4 remmers en SGLT-2 remmers. Wanneer deze middelen worden gestaakt zal voor het behouden of bereiken van een goede diabetesregulatie vaak insulinetherapie moeten worden gestart waarbij de voorkeur uitgaat naar een basaal bolus regime zodat het tijdens de zwangerschap mogelijk is de instelling goed te monitoren en insulinedoseringen aan te passen.
Diabetes gravidarum (GDM)
De Zorgstandaard Diabetes uit 2012 adviseert om na het stellen van de diagnose GDM te verwijzen naar het multidisciplinair behandelteam voor diabeteseducatie, obstetrische evaluatie en behandeling. Over de begeleiding van de zwangere met GDM die alleen een dieet heeft en verder geen bijzonderheden kan lokaal worden afgesproken dat dit in de eerste lijn plaatsvindt. Goede lokale afspraken zijn hierbij essentieel.
Behandeling van GDM begint met een dieetadvies op geleide van dagcurves. Wanneer dit dieet binnen twee weken niet leidt tot een verbetering van de glucoseregulatie dient glucoseverlagende medicatie overwogen te worden.
Behandeling met insuline is zeker in het eerste trimester van de zwangerschap het middel van eerste keus omdat het erg waarschijnlijk is dat hier sprake is van preexistente diabetes (type 2 DM).
In de NICE-richtlijn uit 2015 wordt het advies gegeven om bij GDM primair te starten met metformine. In de NICE-richtlijn uit 2008 werd metformine reeds als alternatief voor insuline geadviseerd bij GDM. Metformine is daardoor meer geaccepteerd als standaard zorg tijdens de zwangerschap in het Verenigd Koninkrijk. Echter in de Nederlandse situatie is metformine als behandeling voor GDM niet gebruikelijk. In de NVOG-richtlijn van 2010 staat het wel als overweging genoemd maar in de praktijk wordt het naar ervaring van de leden van de werkgroep slechts weinig toegepast. Belangrijke argumenten hierbij zijn de bekende placentapassage van metformine en het ontbreken van langetermijnstudies naar de gevolgen voor de kinderen van metforminegebruik in de zwangerschap. Het gebruik van metformine in de vroege zwangerschap lijkt veilig met betrekking tot aangeboren afwijkingen, maar dit berust met name op observationele studies. In basaal onderzoek zijn negatieve effecten beschreven van metformine op de ontwikkeling van murine en humane testiscellen (Tartarin, 2012). Er is nog geen informatie beschikbaar over de langetermijnveiligheid van metformine met betrekking tot de testiculaire ontwikkeling.
In een follow-up studie gedurende 18 maanden na metforminegebruik van zwangeren met GDM bleek dat kinderen zwaarder en langer waren in vergelijking met kinderen van zwangeren die insuline kregen (Ijäs, 2014). Rowan (2011) onderzocht na twee jaar de kinderen van moeders die metformine hadden gebruikt tijdens de MIG-studie. Kinderen die waren blootgesteld aan metformine tijdens de zwangerschap hadden meer subcutaan vet dan de kinderen van moeders die met insuline waren behandeld, het overall vetpercentage was gelijk. Of dit van betekenis is moet blijken na langere follow-up.
Glibenclamide passeert ook de placenta, zij het mogelijk in mindere mate dan metformine. Kortetermijnstudies laten meer LGA (large for gestational age), macrosomie en neonatale hypoglykemieën zien. Net als van metformine ontbreken ook van glibenclamide gegevens over een langere follow-up. Omdat behandeling met glibenclamide frequent leidt tot hypoglykemieën, wordt het in Nederland nauwelijks meer gebruikt voor de behandeling van type 2 diabetes buiten de zwangerschap en het wordt het ook niet meer geadviseerd als SU-preparaat in de NHG standaard. Van de overige SU-preparaten die in Nederland wel veel worden gebruikt, waaronder gliclazide, tolbutamide en glimepiride, zijn slechts summiere gegevens bekend over gebruik in de zwangerschap. Deze worden dan ook ontraden voor behandeling in de zwangerschap.
Zoals geadviseerd in de NICE-richtlijn zou metformine en eventueel ook glibenclamide kunnen worden voorgeschreven aan zwangeren die geen insuline willen of kunnen gebruiken. Het gebruik van metformine of glibenclamide tijdens de zwangerschap is off-label en de risico’s voor het kind zijn daarom nog onvoldoende bekend. Vrouwen moeten hierover vóór aanvang van de behandeling geïnformeerd worden. Bij een aanzienlijk deel van de patiënten behandeld met orale middelen is er op een later moment toch insuline noodzakelijk om adequate glykemische controle te bereiken (Rowan, 2008). De orale medicatie kan dan weer gestopt worden.
De werkgroep is van mening dat er een risico is op vertraging in het bereiken van een optimale glucoseregulatie indien er na dieet en na orale glucoseverlagende medicatie steeds gedurende één tot twee weken het effect wordt geobserveerd. Conform de NICE-richtlijn wordt dan ook geadviseerd om bij een nuchtere glucose >7 mmol/l en/of een niet-nuchtere glucose >11 mmol/l direct te starten met insuline.
Door de geringe Nederlandse ervaring met orale antidiabetica tijdens de zwangerschap is er geen informatie over patiënttevredenheid. Dit kan gezien worden als een kennishiaat. In de buitenlandse MIG-studie bleek dat 77% van de vrouwen behandeld met metformine in een volgende zwangerschap metformine zou kiezen als behandeling, terwijl in de insuline behandelde groep maar 27% weer insuline zou kiezen (Rowan, 2008).
Onderbouwing
Achtergrond
Tot voor kort werd het gebruik van orale antidiabetica ontraden in de zwangerschap vanwege met name angst voor of risico op aangeboren aandoeningen bij de foetus. De voordelen van deze medicatie met betrekking tot de bloedglucoseregulatie en gebruiksgemak ten opzichte van insuline nopen toch om het gebruik hiervan tijdens de zwangerschap bij vrouwen met diabetes mellitus te onderzoeken.
Het aantal orale glucoseverlagende middelen is de laatste jaren flink uitgebreid maar voor gebruik in de zwangerschap zijn er alleen gegevens over metformine, glibenclamide en glyburide. Dit laatste middel wordt echter in Nederland niet gebruikt.
Samenvatting literatuur
NICE gebruikt in 3.8 de volgende evidence levels (EL):
Levels of evidence for intervention studies
Level Source of evidence
1++ High-quality meta-analyses, systematic reviews of randomised controlled trials (RCTs), or RCTs with a very low risk of bias
1+ Well-conducted meta-analyses, systematic reviews of RCTs, or RCTs with a low risk of bias
1− Meta-analyses, systematic reviews of RCTs, or RCTs with a high risk of bias
2++ High-quality systematic reviews of case-control or cohort studies; high-quality case-control or cohort studies with a very low risk of confounding, bias or chance and a high probability that the relationship is causal
2+ Well-conducted case-control or cohort studies with a low risk of confounding, bias or chance and a moderate probability that the relationship is causal
2− Case-control or cohort studies with a high risk of confounding, bias or chance and a significant risk that the relationship is not causal
3 Non-analytical studies (for example, case reports, case series)
4 Expert opinion, formal consensus
3.8 Safety of medicines for diabetes before and during pregnancy: Oral hypoglycaemic agents
Oral hypoglycaemic agents are used to maintain blood glucose control in people with type 2 diabetes. There are four main categories of oral hypoglycaemic agents: sulphonylureas (chlorpropamide, glibenclamide (also known as glyburide), gliclazide, glimepiride, glipizide, gliquidone and tolbutamide), biguanides (metformin), α-glucosidase inhibitors (acarbose) and thiazolidinediones (pioglitazone and rosiglitazone). Two other medications are used to stimulate insulin release (nateglinide and repaglinide). Each works in a different way and is suitable for different clinical situations.
A systematic review and meta-analysis examined the relationship between first-trimester exposure to oral hypoglycaemic agents and subsequent congenital abnormalities and neonatal mortality (Gutzin, 2003). The review sought to account for the potential confounding effect of maternal glycaemic control. The meta-analysis included ten studies which reported on 471 women exposed to oral hypoglycaemic agents in the first trimester and 1344 women not exposed. There were three prospective cohort studies, three retrospective cohort studies, three case series and one case– control study. The oral hypoglycaemic agents used in the studies included chlorpropamide (eight studies), tolbutamide (six studies), glibenclamide (four studies), metformin (five studies) and phenformin (three studies). Six studies were rated as of ‘poor’ quality, two were ‘fair’ and two were ‘good’. Most women in the studies had type 2 diabetes. Women with type 1 diabetes and gestational diabetes were also present in some studies. There was no significant difference in the rate of major malformations between those exposed to oral hypoglycaemic agents and those not exposed (10 studies, OR 1.05, 95% CI 0.65 to 1.70) [EL=2++].
A further systematic review included seven additional studies that looked at the use of metformin in the first trimester of pregnancy (Hawthorne, 2006). All the studies were small observational studies, six in women with polycystic ovary syndrome and one in women with type 2 diabetes. There were no reports of birth defects, increased incidence of pre-eclampsia or other adverse maternal or neonatal outcomes. The use of metformin during pregnancy in women with polycystic ovary syndrome is associated with a reduction in miscarriage in early pregnancy, weight loss, a reduction in fasting serum insulin levels and in the incidence of gestational diabetes [EL=2+].
Another systematic review evaluated the safety of metformin in pregnancy for women with diabetes and polycystic ovary syndrome (Gilbert, 2006). The review reported that metformin use during the first trimester of pregnancy was not associated with an increased risk of major malformations [EL=2+].
An RCT compared glibenclamide with insulin for the treatment of gestational diabetes (Langer, 2000). The study involved 404 women with gestational diabetes. Approximately 83% were Hispanic, 12% were white and 5% were black. Women were randomly assigned between 11 and 33 weeks of gestation to receive either glibenclamide (n=201) or insulin (n=203). The mean blood glucose concentrations during treatment were 5.9 ± 0.9 mmol/litre in the glibenclamide group and 5.9 ± 1.0 mmol/litre in the insulin group (P=0.99). Eight women (4%) in the glibenclamide group required insulin treatment. There were no significant differences between the glibenclamide and insulin groups in the percentage of babies who were LGA (12% versus 13%), macrosomic (7% versus 4%), had lung complications (8% versus 6%) or neonatal hypoglycaemia (9% versus 6%), were admitted to a NICU (6% versus 7%), or had fetal anomalies (2% and 2%). Cord-serum insulin concentrations were similar in the two groups and glibenclamide was not detected in the cord serum of any baby in the glibenclamide group [EL=1++].
An RCT of metformin for the treatment of gestational diabetes (the Metformin in Gestational Diabetes (MIG) trial) is due to report soon. A pilot study randomised 14 women to insulin and 16 to metformin. There were no differences in perinatal outcomes (Elder, 2003) [EL=1−].
A retrospective cohort study examined the effects of oral hypoglycaemic agents in 379 singleton pregnancies of women with type 2 diabetes (Ekpebegh, 2007). The women were subdivided into: oral hypoglycaemic agents alone (n=93 pregnancies); converted from oral hypoglycaemic agents to insulin (n=249); and insulin alone or converted from diet alone to insulin (n=37). The oral hypoglycaemic agents assessed were metformin and glibenclamide. Fetal anomaly rates were similar across the three groups, whereas perinatal mortality rates (per 1000 births) were higher in the group that used oral hypoglycaemic agents alone (125, P=0.003). Conversion from oral hypoglycaemic agents to insulin was protective for perinatal mortality compared with oral hypoglycaemic agents alone (OR 0.220, 95% CI 0.061 to 0.756, P=0.024). The data suggest that metformin and glibenclamide are not teratogenic [EL=2+].
A reference guide to medicines in pregnancy and lactation reported that there were limited data on the use of metformin, acarbose, nateglinide, glimepiride, glipizide and glibenclamide in pregnant women and suggested they present a low risk to the fetus. No data were found on the use of repaglinide or pioglitazone in pregnant women, but it was suggested that they present a moderate risk to the fetus. No comparative studies were found on the use of rosiglitazone in pregnant women, but it was suggested that it presents a risk to the fetus. Evidence suggested that chlorpropamide and tolbutamide present a risk to the fetus if taken by women in the third trimester of pregnancy. Gliclazide and gliquidone were not reviewed (Briggs, 2005) [EL=3].
The reference guide reported that 14 small observational studies had investigated the use of metformin in pregnant women with diabetes. Metformin has been shown to cross the placenta. The observational studies identified congenital malformations in some babies of women taking metformin, but the rate was not compared with the expected rate of congenital malformations in babies born to women with diabetes who were not taking metformin. The reference guide suggested that use of metformin may decrease fetal and infant morbidity and mortality in developing countries where the proper use of insulin is problematic, but that insulin is still the treatment of choice (Briggs, 2005) [EL=3].
…
The reference guide reported that several observational studies had investigated the use of glibenclamide in pregnant women. Small amounts of glibenclamide may cross the placenta. The observational studies suggested that use of glibenclamide may decrease fetal and infant morbidity and mortality in developing countries where the proper use of insulin is problematic, and the reference guide suggested that it may be an acceptable alternative to insulin for women with gestational diabetes (Briggs, 2005) [EL=3].
…
The British National Formulary recommends that metformin, acarbose and repaglinide should be avoided during pregnancy and are normally substituted with insulin (Joint Formulary Committee, 2007). The manufacturers of nateglinide, pioglitazone and rosiglitazone advise pregnant women to avoid them, and insulin is normally substituted in women with diabetes. Sulphonylureas can lead to neonatal hypoglycaemia, and insulin is normally substituted in women with diabetes. If oral hypoglycaemic medicines are used then therapy should be stopped at least 2 days before birth.
4.5 Interventions in women with gestational diabetes: pharmacological interventions (metformin, glibenclamide and insuline)
4.5.3 Introduction
The purpose of this review is to determine the effectiveness of interventions for gestational diabetes mellitus, alone or in combination. The search included randomised controlled trials (RCTs) and systematic reviews of RCTs. The same search criteria were used to identify results for each of the interventions addressed by this review. Interventions included:
- metformin – a biguanide which lowers hepatic glucose output and improves insulin sensitivity: this has a low risk of hypoglycaemia and does not cause weight gain
- glibenclamide – a sulfonylurea which works by stimulating insulin release from the pancreas: this can cause hypoglycaemia and is associated with weight gain.
The following combinations of intervention were identified by the guideline development group as being potentially important for reducing maternal and fetal adverse outcomes in women with gestational diabetes mellitus:
- pharmacological interventions:
- metformin versus Insulin;
- glibenclamide versus insulin;
- glibenclamide versus metformin.
4.5.4 Description of included studies
4.5.4.3 Pharmacological interventions
Fifteen randomised controlled trials met the inclusion criteria for this review (Bertini, 2005; Hague, 2003; Ijäs, 2010; Lain, 2009; Langer, 2000; Mesdaghinia, 2013; Moore, 2007; Moore, 2010; Mukhopadhyay, 2012; Niromanesh, 2012; Ogunyemi, 2007; Rowan, 2008; Silva, 2012; Spaulonci, 2013; Tertti, 2013).
Trial locations included Finland (Ijäs, 2010; Tertti, 2013), Australia (Hague, 2003; Rowan, 2008), the USA (Lain, 2009; Langer, 2000; Moore, 2007; Moore,2010; Ogunyemi, 2007), Brazil (Bertini, 2005; Silva, 2012; Spaulonci, 2013), India (Mukhopadhyay, 2013) and Iran (Mesdaghinia, 2013; Niromanesh, 2012). The number of participants ranged from 30 to 404 women.
All included women had gestational diabetes. An oral glucose tolerance test (OGTT) was used to diagnose women with gestational diabetes, although different glucose loads and diagnostic criteria were used in the trials and women could be diagnosed as early as 11 weeks of gestation in some studies.
4.5.4.3.1 Metformin versus insulin
Eight trials compared metformin with insulin (Hague, 2003; Ijäs, 2010; Mesdaghinia, 2013; Moore, 2007; Niromanesh, 2012; Rowan, 2008; Spaulonci, 2013; Tertti, 2013).
Two trials did not provide treatment details with regard to the doses of metformin and insulin that were used, nor were further details given with regard to any concurrent dietary or exercise interventions or monitoring techniques used (Hague, 2003; Spaulonci, 2013). Women in the remaining six trials received dietary advice/instruction and glucose levels were monitored (Ijäs, 2010; Mesdaghinia, 2013; Moore, 2007; Niromanesh, 2012; Rowan, 2008; Tertti, 2013). Women in three trials also received lifestyle counselling/exercise advice (Ijäs, 2010; Niromanesh, 2012; Rowan, 2008).
The initial dose of metformin was 500 mg/day (Mesdaghinia, 2013; Moore, 2007; Niromanesh, 2012; Rowan, 2008; Tertti, 2013) or 750 mg/day (Ijäs, 2010) increasing to a maximum dose of 2000 mg/day (Moore, 2007; Tertti, 2013), 2250 mg/day (Ijäs, 2009) or 2500 mg/day (Mesdaghinia, 2013; Niromanesh, 2012; Rowan, 2008). In the seven trials that described treatments, treatment failure with metformin occurred when normoglycaemia or targets were not reached on a maximum dose (Niromanesh, 2012; Tertti, 2013), or were not reached on a maximum dose over a one to two week period (Ijäs, 2010). One trial did not report criteria for starting insulin therapy when treatment with metformin failed but did report the use of supplementary insulin (Spaulonci, 2013). In four trials (Ijäs, 2010; Niromanesh, 2012; Rowan, 2008; Tertti, 2013) when failure of treatment with metformin occurred, supplementary insulin was added as required. In one study (Moore, 2007) metformin was stopped and insulin started. In one trial women who failed treatment with metformin were excluded from the study and from analyses and were replaced with women who did not fail treatment (Mesdaghinia, 2013).
Insulin treatment consisted of long-acting and rapid-acting insulin in one trial (Ijäs, 2010), split doses of regular insulin and NPH insulin in three trials (Mesdaghinia, 2013; Moore, 2007; Niromanesh, 2012) and NPH insulin and/or rapid acting insulin lispro or aspart in one trial (Tertti, 2013). One trial (Rowan, 2008) stated that insulin was prescribed according to usual practice.
Maternal outcomes reported were mode of birth, treatment failure (need for additional treatment with insulin) and acceptability of treatment. Outcomes related to mode of birth were spontaneous vaginal birth, induction of labour, operative vaginal, vacuum extraction and caesarean section. Acceptability of treatment was assessed using a questionnaire in one trial (Rowan, 2008). Reported neonatal outcomes were large for gestational age, NICU admission and length of stay, shoulder dystocia, neonatal hypoglycaemia fetal death and perinatal mortality. One composite outcome (Rowan, 2008) was included owing to its use in the health economic analysis for this review.
4.5.4.3.2.Glibenclamide versus insulin
Five trials compared glibenclamide with insulin (Bertini, 2005; Lain, 2009; Langer, 2000; Mukhopadhyay, 2012; Ogunyemi, 2007).
One trial (Langer, 2000) prescribed a diet for normal weight and obese women and confirmed all women performed self-monitoring of blood glucose. One trial prescribed a diet with caloric intake calculated according to pre-gestational BMI and asked women to self-monitor seven times a day; women included in the trial were those who had failed dietary treatment (Mukhopadhyay, 2012). However, three trials (Bertini, 2005; Lain, 2009; Ogunyemi, 2007) did not provide details of any concurrent dietary or exercise interventions, although one of these (Ogunyemi, 2007) was conducted in a population of women in whom diet therapy had failed. One trial reported that blood glucose was tested in the clinic weekly. The two remaining trials (Lain, 2009; Ogunyemi, 2007) did not detail the monitoring techniques used.
One trial did not provide treatment details with regard to the doses of metformin and insulin that were used (Ogunyemi, 2007). The initial dose of glibenclamide in the remaining four trials was 2.5 mg/day (Lain, 2009; Langer, 2000; Mukhopadhyay, 2012) or 5 mg/day (Bertini, 2005), increasing weekly to a maximum dose of 20 mg/day (Bertini, 2005; Lain, 2009; Langer, 2000; Mukhopadhyay, 2012). In all four trials, glibenclamide treatment failure occurred when glucose control was not achieved despite taking the maximum dose. Oral medication was stopped and insulin therapy started. Two trials stipulated that glucose control was assessed over a two week period for a decision of treatment failure to be made (Langer, 2000; Mukhopadhyay, 2012).
Insulin doses started at 0.7 U/kg (Bertini, 2005; Langer, 2000; Mukhopadhyay, 2012) or 0.8 U/kg (Langer, 2000) administered in multiple daily injections.
Maternal outcomes reported were caesarean section, treatment failure (need for additional treatment with insulin) and acceptability of treatment. Acceptability of treatment was assessed using reporting of maternal hypoglycaemic episodes. Reported neonatal outcomes were large for gestational age, NICU admission, shoulder dystocia, neonatal hypoglycaemia, intrauterine and neonatal mortality.
4.5.4.3.3 Glibenclamide versus metformin
Two trials compared metformin with glibenclamide (Moore, 2010; Silva, 2012).
In both trials all women were given instructions for a diet prescribed according to normal or obese weight and performed self-monitoring of blood glucose. In addition, in one trial the importance of exercise in controlling blood glucose was stressed and 30 minutes of walking per day was recommended (Moore, 2010).
In both trials, the initial dose of glibenclamide was 2.5 mg two times a day which, following a weekly review, was increased as necessary to a maximum dose of 20 mg/day.
In both trials, the initial dose of metformin was 500 mg/day in divided doses and was increased as necessary following a weekly review until glucose control was achieved or until a maximum dose was reached of 2000 mg/day (Moore, 2010) or 2500 mg/day (Silva, 2012).
Treatment failures were defined in one trial (Moore, 2010) as occurring when two or more glucose values in the same meal exceeded target glucose values by 10 mg/dl (0.56 mmol/litre) or more for two consecutive weeks while the maximum dose was taken. In this trial, oral medication was stopped and insulin therapy started. In the second trial (Silva, 2012), insulin therapy was started at 0.7 IU/kg/day regular insulin preprandially and neutral protamine hagedorn (NPH) insulin at bedtime when glycaemic goals were not met. Of the guideline development group’s priority outcomes, maternal data were available for caesarean section and treatment failure (need for additional treatment with insulin). Acceptability of treatment was assessed using reporting of maternal hypoglycaemic episodes.
Reported neonatal outcomes were large for gestational age, NICU admission, shoulder dystocia, neonatal hypoglycaemia, stillbirth and neonatal mortality.
A summary of the details of the studies of pharmacological interventions is shown in Table 36.
4.5.5 Evidence profile
The GRADE profiles for this review question are presented in tables 42 to 44:
Table 42 GRADE profile for comparison of metformin and insulin in women with gestational diabetes
Table 43 GRADE profile for comparison of glibenclamide and insulin in women with gestational diabetes
Table 44 GRADE profile for comparison of metformin and glibenclamide in women with gestational diabetes
4.5.6 Evidence statements
4.5.6.3 Pharmacological interventions
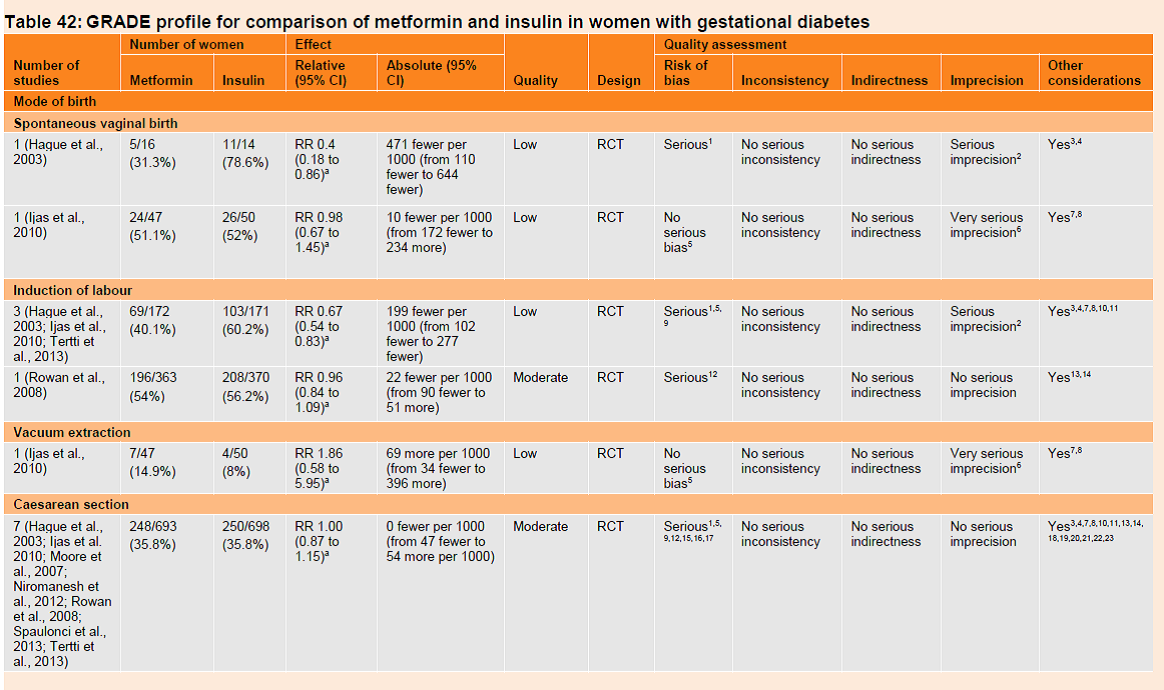
4.5.6.3.1 Metformin versus insulin (table 42)
Maternal outcomes
Mode of birth
Seven outcomes pertaining to mode of birth were reported in seven RCTs that compared metformin with insulin treatment in women with gestational diabetes. Heterogeneity prevented full meta-analysis of data for spontaneous vaginal birth (two trials), induction of labour (four trials) and elective caesarean section (two trials) and only one trial presented data on vacuum extraction, emergency caesarean section and assisted vaginal delivery.
Spontaneous vaginal birth
Data were conflicting in two trials that reported spontaneous vaginal birth. One small trial (n=30) found fewer spontaneous vaginal births among women who received metformin compared to those who received insulin (RR 0.4, 95% CI 0.18 to 0.86) and the evidence was of low quality, while another trial (n=97) provided low quality evidence which found no difference (RR 0.98, 95% CI 0.67 to 1.45).
Induction of labour
A meta-analysis of data from 3 trials (n=343) found that the risk of requiring induction of labour among women who received metformin compared with insulin treatment was lower (RR 0.67, 95% CI 0.54 to 0.83) and the evidence was of low quality. One further trial (n=733) found no difference in labour induction rates between treatment groups (RR 0.96, 95% CI 0.84 to 1.09) and the evidence was considered of moderate quality.
Vacuum extraction
One trial (n=97) provided low quality evidence of no difference between treatment groups in the number of births requiring vacuum extraction (RR 1.86, 95% CI 0.58 to 5.95).
Caesarean section
A meta-analysis of data from seven trials (n=1391) found no difference in the risk of caesarean section among women who received metformin compared with those receiving insulin (RR 1.00, 95% CI 0.87 to 1.15) and the evidence was of moderate quality.
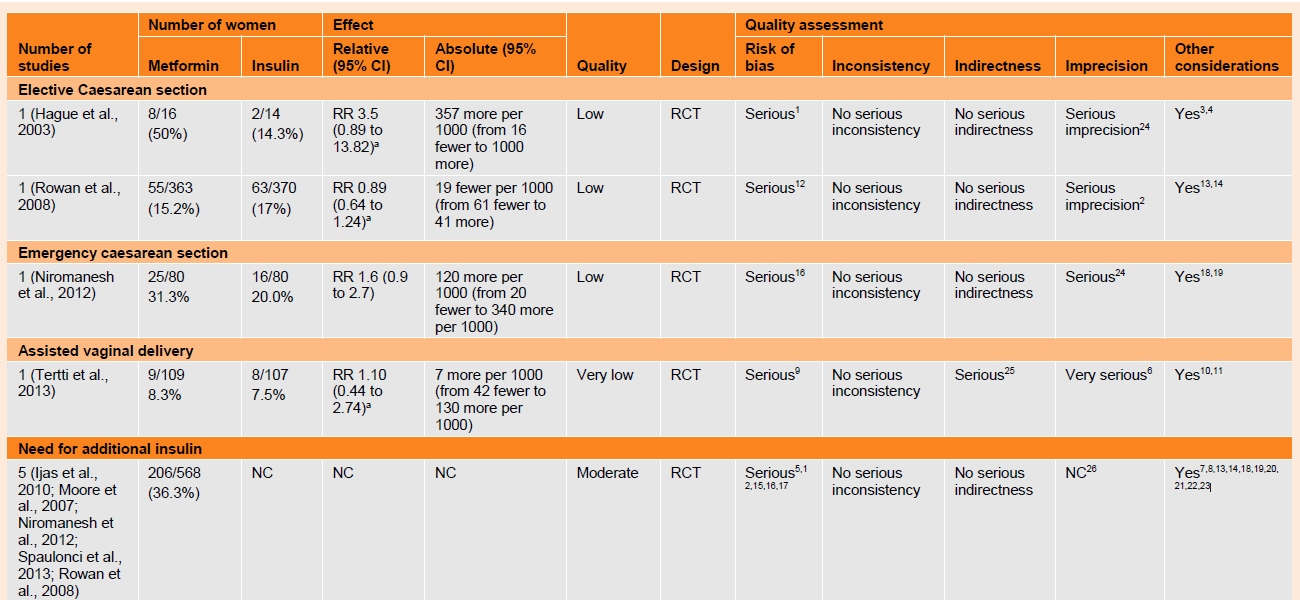
Elective caesarean section
Two trials (n=30; n =733) reported no difference in rates of elective caesarean section (RR 3.5, 95% CI 0.89 to 13.82 and RR 0.89, 95% CI 0.64 to 1.24, respectively) and the evidence was of low quality.
Emergency caesarean section
One trial (n=41) provided low quality evidence which demonstrated no difference in the risk of emergency caesarean section between groups (RR 1.6, 95% CI 0.9 to 2.7).
Assisted vaginal delivery
One further trial (n=216) found no difference in the risk of assisted vaginal delivery (RR 1.10, 95% CI 0.44 to 2.74) and the evidence was of very low quality.
Need for additional insulin
In terms of need for additional insulin, 36% of women who received metformin in 5 trials (206 out of 568 participants) had a treatment failure requiring insulin. The evidence for this finding was of moderate quality.
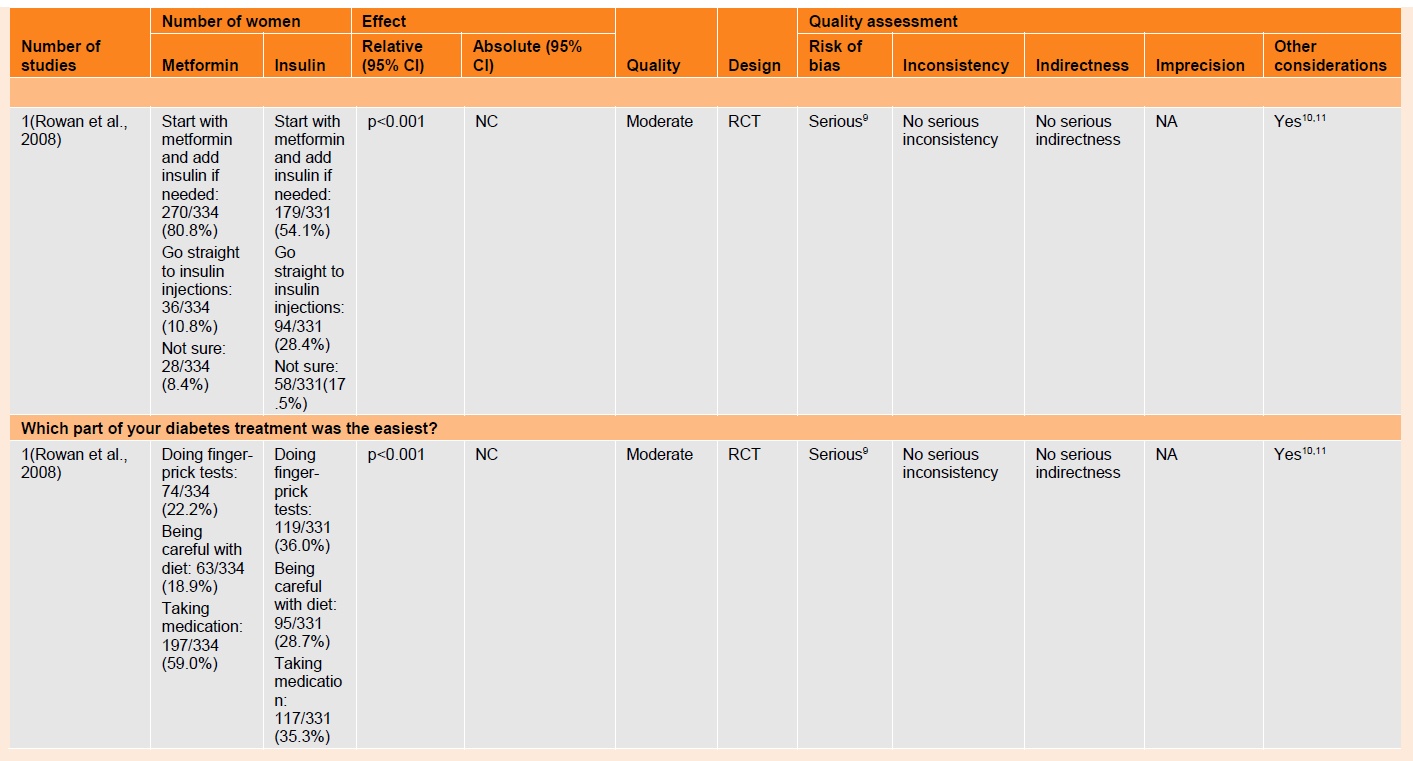
Acceptability
One trial (n=664) assessed the acceptability of metformin compared with insulin. More women forgot to take metformin compared with insulin (p<0.001) during the course of the study. However, more women would choose metformin over insulin in a subsequent pregnancy (p<0.001). If given the choice in a subsequent pregnancy, more women would start with metformin and add insulin if needed (p<0.001).
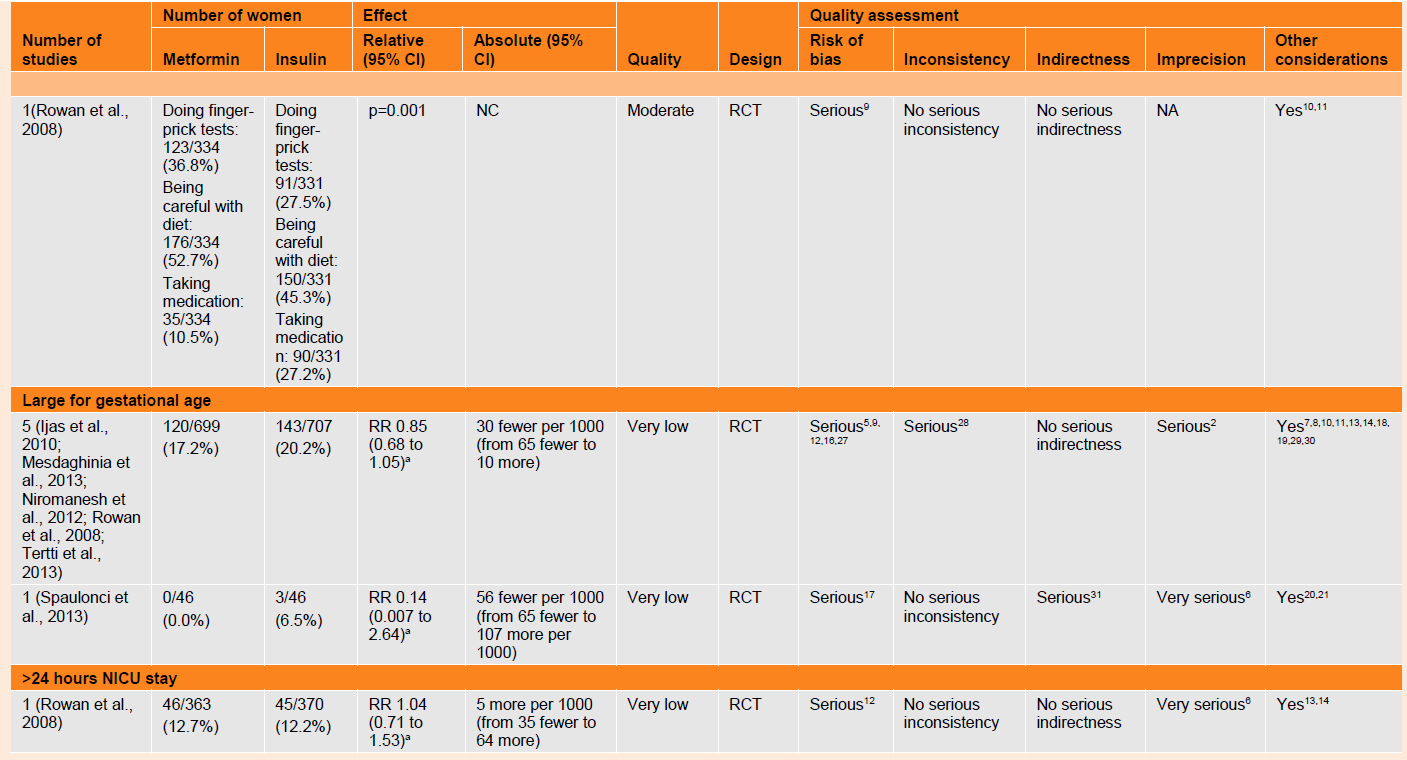
In terms of assessing the easiest part of the diabetes treatment, more women in the insulin group said that doing the finger-prick test was easiest. Less women in the metformin group (n=63 versus n=95) said that being careful with diet was the easiest aspect. More women in the metformin group (n=197 versus n=117) said that taking the medication was the easiest.
Neonatal outcomes
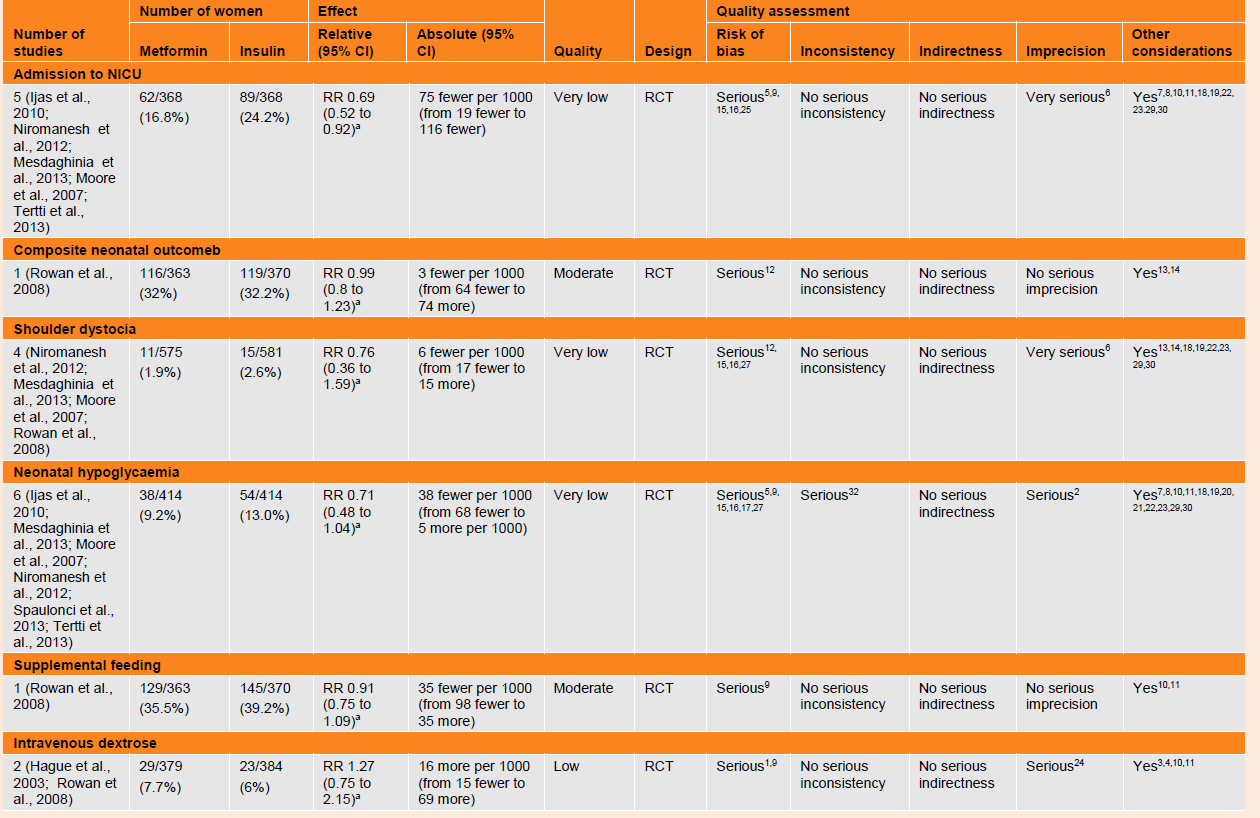
NICU admission
A meta-analysis of five trials (n=736) found a reduction in the risk of admission to NICU in babies of women with gestational diabetes who received metformin compared with babies of women who received insulin (RR 0.69, 95% CI 0.52 to 0.92). The quality of the evidence for this outcome was very low. An additional trial (n=733) found no difference between groups for a NICU stay of more than 24 hours for babies of women with gestational diabetes who received metformin compared with babies of women who received insulin (RR 1.04, 95% CI 0.71 to 1.53).
Large for gestational age/macrosomia
There were no differences in any other neonatal outcomes when metformin was compared with insulin treatment. Outcomes examined included large for gestational age, which included a meta-analysis of data from five trials (n=1406) that found no difference between treatment groups (RR 0.85, 95% CI 0.68 to 1.05) and was of very low quality. One trial (n=92) assessed macrosomia as a proxy for large for gestational age and the very low quality evidence found no difference between groups (RR 0.14, 95% CI 0.007 to 2.64).
Neonatal morbidity
One trial (n=733) assessed a composite neonatal morbidity outcome (RR 0.99, 95% CI 0.8 to 1.23) and found moderate quality evidence of no difference between groups.
Shoulder dystocia
Data from four trials (n=1156) were combined in a meta-analysis for shoulder dystocia (RR 0.76, 95% CI 0.36 to 1.59) which found low quality evidence of no difference between groups.
Neonatal hypoglycaemia
Six trials (n=828) combined in a meta-analysis examined neonatal hypoglycaemia and found very low quality evidence of no difference between groups (RR 0.71, 95% CI 0.48 to 1.04).
Supplemental feeding
One trial (n=733) found no difference between groups using supplemental feeding (RR 0.91, 95% CI 0.75 to 1.09); evidence was moderate quality.
Intravenous dextrose
Two trials (n=7636) that meta-analysed data for intravenous dextrose found low quality evidence of no difference between groups (RR 1.27, 95% CI 0.75 to 2.15).
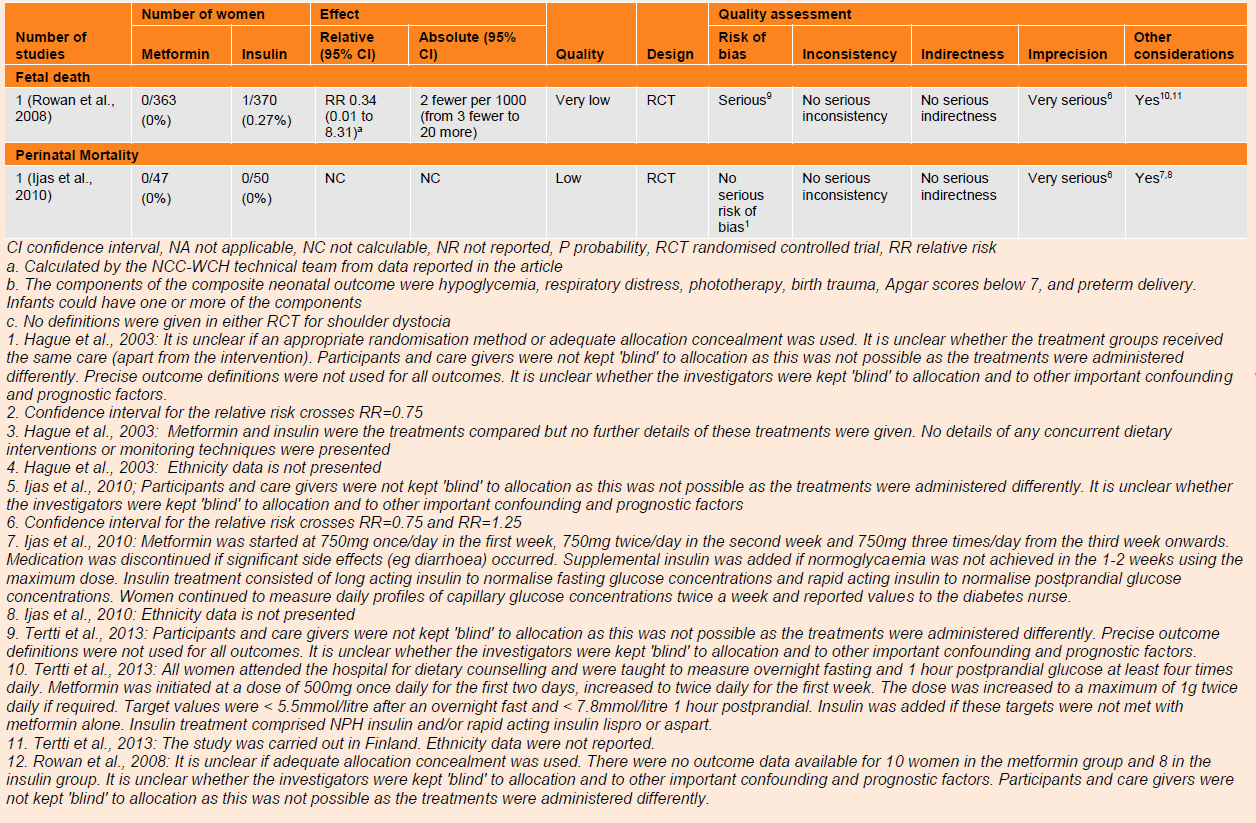
Fetal death
One trial (n=733) reported no difference between groups for fetal death (RR 0.34, 95% CI 0.01 to 8.31); evidence was very low quality.
Perinatal mortality
There were no cases of perinatal mortality in one trial (n=97) which was considered of very low methodological quality.
4.5.6.3.2 Glibenclamide versus insulin (table 43)
Maternal outcomes
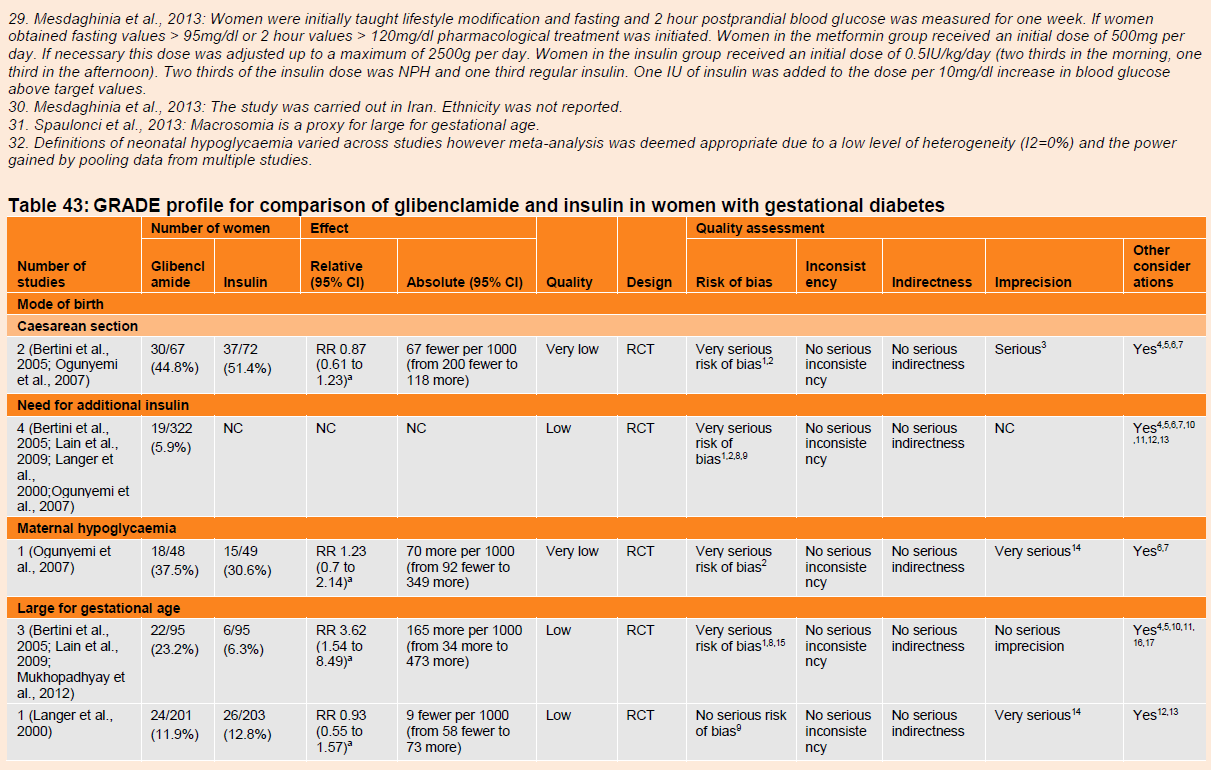
Caesarean section
A meta-analysis of two trials (n=139) found no difference in risk of caesarean section for women with gestational diabetes who received glibenclamide compared with those who received insulin (RR 0.87, 95% CI 0.61 to 1.23). The evidence for this outcome was of very low quality.
Need for additional insulin
In four trials, 5.9% (19 out of 322) of women who received glibenclamide experienced a treatment failure that required insulin. The evidence for this finding was of low quality.
Hypoglycaemia
One trial (n=33) reported no difference in the number of women with gestational diabetes experiencing hypoglycaemia when treated with glibenclamide compared with insulin treatment (RR 1.23, 95% CI 0.7 to 2.14). The quality of evidence for this finding was very low.
Neonatal outcomes
Large for gestational age
A meta-analysis of three trials (n=190) found that women with gestational diabetes who had been treated glibenclamide had a greater risk of giving birth to babies that were large for gestational age compared with women who had received treatment with insulin (RR 3.62, 95% CI 1.54 to 8.49). The evidence for this outcome was of low quality. A fourth trial (n=404) found no difference between groups in the risk of giving birth to babies that were large for gestational age (RR 0.93, 95% CI 0.55 to 1.57). The evidence for this outcome was of low quality.
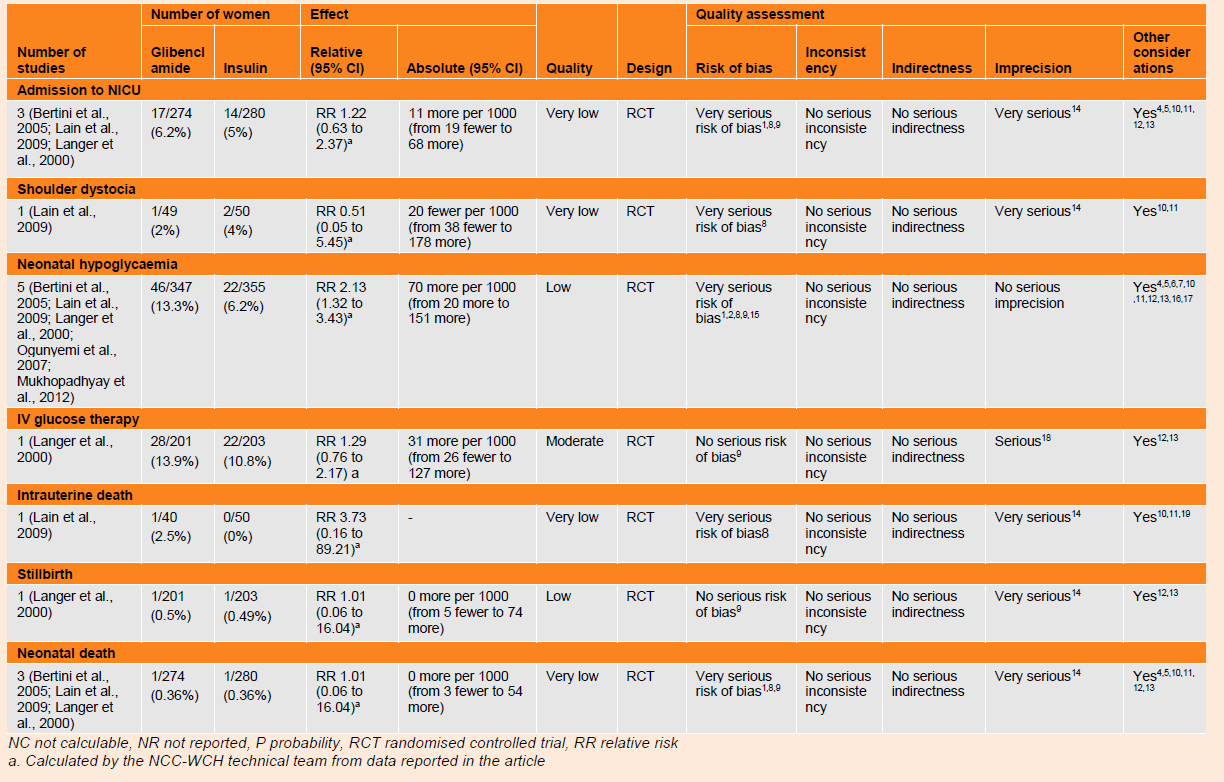
Neonatal hypoglycaemia
A meta-analysis of five trials (n=702) found higher risk of neonatal hypoglycaemia in the babies of women who received glibenclamide compared with those who received insulin (RR 2.13, 95% CI 1.32 to 3.43). The evidence for this outcome was of low quality.
Other outcomes
There were no differences in any other reported neonatal outcomes when glibenclamide was compared with insulin treatment in women with gestational diabetes. Data from three trials (n=554) were combined in a meta-analysis (RR 1.22, 95% CI 0.63 to 2.37) and provided low quality evidence for NICU admission; one trial (n=99) provided very low quality evidence for the outcome of shoulder dystocia (RR 0.51, 95% CI 0.05 - 5.45) and one trial (n=404) for intravenous glucose therapy (RR 1.29, 95% CI 0.76 to 2.17) which was of moderate quality. One trial (n=90) reported very low quality evidence finding no difference in the risk of intrauterine death between groups (RR 3.73, 95% CI 0.16 to 89.21). One trial (n=404) reported on risk of stillbirth (RR 1.01, 95% CI 0.06 to 16.04) which was of low quality evidence. Three trials reporting data for neonatal death (n=554) were combined in a meta-analysis (RR 1.01, 95% CI 0.06 to 16.04) giving very low quality evidence.
4.5.6.3.3 Glibenclamide versus metformin (table 44)
Maternal outcomes
Caesarean section
One trial (n=149) reported a lower risk of non-elective caesarean section in women with gestational diabetes who received glibenclamide compared with those who received metformin (RR 0.18, 95% CI 0.04 to 0.8). The evidence for this outcome was of moderate quality.
Need for additional insulin
Two trials presented conflicting findings with regard to treatment failure. One trial (n=149) found lower risk of treatment failure requiring insulin in women who received glibenclamide compared with those who received metformin (n=0.47, 95% CI 0.26 to 0.86), while the other trial (n=200) found no difference between treatment groups (RR 1.38, 95% CI 0.85 to 2.24). The evidence for both of these outcomes were of moderate quality.
Maternal hypoglycaemia
One trial (n=149) reported no difference in the risk of maternal hypoglycaemia between women with gestational diabetes who received treatment with glibenclamide compared with those who received metformin (RR 0.51, 95% CI 0.05 to 5.47). The evidence for this outcome was of low quality.
Neonatal outcomes
Large for gestational age
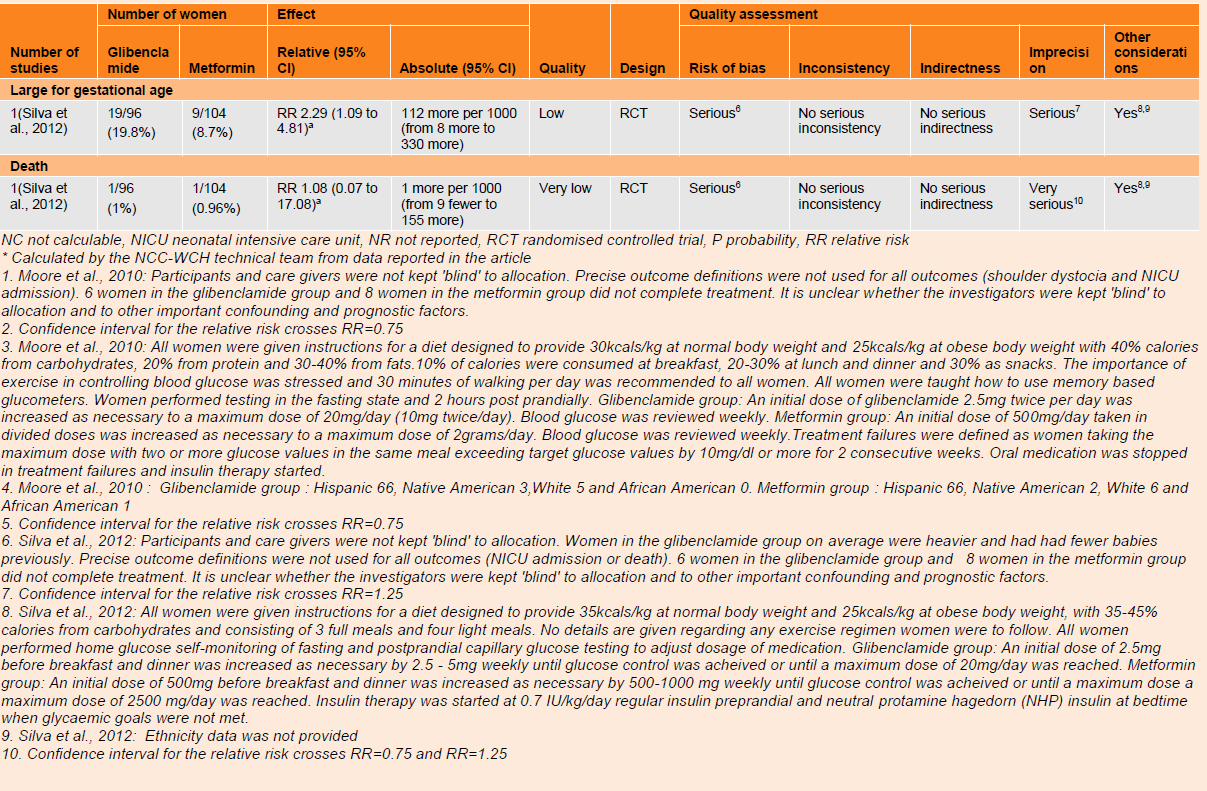
One trial (n=200) provided low quality evidence that demonstrated an increased risk of delivering a baby that was large for gestational age associated with glibenclamide compared with metformin (RR 2.29, 95% CI 1.09 to 4.81).
Other outcomes
There were no differences between groups for any other neonatal outcomes when treatment with glibenclamide was compared with treatment with metformin in women with gestational diabetes. Outcomes reported were neonatal hypoglycaemia, which included one trial (n=149) which was of low quality (RR 0.34, 95% CI 0.01 to 8.16) and another trial (n =200) which was also of low quality (RR 1.28, 95% CI 0.6 to 2.72). One trial (n=149) provided very low quality evidence for shoulder dystocia (RR 3.04, 95% CI 0.13 to 73.44). Data from two trials (n=346) assessing NICU admission was combined in a meta-analysis and assessed as being of very low quality (RR 0.66, 95% CI; 0.28 to 1.55). One trial (n=200) reported very low quality evidence which found no difference between groups for the risk of neonatal death (RR 1.08, 95% CI 0.07 to 17.08).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
- Wat is de effectiviteit van metformine, glibenclamide en insuline bij vrouwen met GDM?
- Zijn er ongewenste effecten voor de foetus/neonaat en de zwangere vrouw bij het gebruik van orale glucoseverlagende middelen (metformine en glibenclamide) bij een vrouw met diabetes mellitus type 2 of GDM die niet of onvoldoende reageert op een dieet?
De klinisch relevante vergelijkingen zijn die van metformine versus insuline (= gouden standaard), glibenclamide versus insuline (=gouden standaard) en metformine vs glibenclamide.
Relevante uitkomstmaten
De werkgroep achtte de items aangeboren afwijkingen bij de foetus/pasgeborene, macrosomie (P>95) van de foetus/pasgeborene, geboortetrauma bij de pasgeborene en hypoglykemie bij de moeder voor de besluitvorming als kritieke uitkomstmaten en de items Apgar-score <7 na 5 minuten, prematuur zijn van de pasgeborene; NICU-opname; noodzaak voor fototherapie, hypoglykemie bij de foetus/pasgeborene; complicaties aan de longen en afwijkingen op lange termijn bij de pasgeborene en gastro-intestinale bijwerkingen en therapiefalen bij de moeder voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (OVID), Embase and Cochrane is met relevante zoektermen gezocht naar systematische reviews en RCTs die orale bloedglucose verlagende middelen vergelijken met insuline bij zwangere vrouwen met diabetes mellitus type 2 of GDM. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 319 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- relevant voor beantwoording van de uitgangsvraag;
- betreft primair (origineel) onderzoek of systematische review;
- studiepopulatie komt overeen met patiëntengroep waarvoor richtlijn bedoeld is;
- uitkomstmaten komen overeen met gekozen uitkomstmaten.
Op basis van titel en abstract werden in eerste instantie 77 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 67 studies geëxcludeerd (zie exclusietabel) en tien studies definitief geselecteerd.
Direct na de selectieperiode bleek een NICE-richtlijn (februari, 2015) met onder meer dezelfde uitgangsvragen te zijn verschenen. De werkgroep heeft deze richtlijn vergeleken met de eigen search en uitkomsten en heeft besloten dat deel van de NICE-richtlijn wat betreft literatuursamenvatting integraal over te nemen (NICE guideline Diabetes in Pregnancy, February, 2015). De werkgroep heeft ervoor gekozen de samenvatting en beoordeling van de literatuur over te nemen en niet de paragrafen waarin de mening of de overwegingen van de Britse werkgroep zijn opgenomen. De tekst, evidence tabellen en beoordeling van individuele studiekwaliteit zijn derhalve integraal overgenomen en kunt u onder het tabblad Onderbouwing vinden.
De NICE-richtlijn is op onderdelen herzien en geactualiseerd. Het gedeelte over ‘Safety of medicines for diabetes before and during pregnancy’ (hoofdstuk 3.8) is niet veranderd en bevat de tekst uit 2008. Het hoofdstuk ‘Interventions in women with gestational diabetes’ (hoofdstuk 4.5) is wel geactualiseerd (met behulp van GRADE). Als gevolg hiervan is de manier van beoordelen en beschrijven van de literatuur verschillend voor de twee hoofdstukken.
Uit de NICE-richtlijn zijn overgenomen:
Uit hoofdstuk 3.8: Safety of medicines for diabetes before and during pregnancy:
3.8.1 Description of the evidence
3.8.1.1 Oral hypoglycaemic agents: alleen de tekst over orale bloedsuikerverlagende middelen
Uit hoofdstuk 4.5: Interventions in women with gestational diabetes:
4.5.3 Introduction (alleen de tekst over pharmacological interventions)
4.5.4 Description of included studies
4.5.4.3. Pharmacological interventions
4.5.4.3.1 Metformin vs insulin
4.5.4.3.2 Glibenclamide vs insulin
4.5.4.3.3 Glibenclamide vs metformin
4.5.5 Evidence profile
4.5.5.3 Pharmacologial interventions
4.5.6 Evidence statements
4.5.6.3 Pharmacological interventions
4.5.6.3.1 Metformin vs insulin
4.5.6.3.2 Glibenclamide vs insulin
4.5.6.3.3 Glibenclamide vs metformin
Referenties
- Bertini AM, Silva JC, Taborda W, et al. Perinatal outcomes and the use of oral hypoglycemic agents. J Perinat Med. 2005;33:519-23.
- Briggs GG, Freeman RK, Yaffe SJ. Drugs in Pregnancy and Lactation. A Reference Guide to Fetal and Neonatal Risk. 7th ed. Philadelphia: Lippincott, Williams and Wilkins. 2005.
- Ekpebegh CO, Coetzee EJ, van der Merwe L, et al. A 10-year retrospective analysis of pregnancy outcome in pregestational Type 2 diabetes: comparison of insulin and oral glucose-lowering agents. Diabet Med. 2007;24:253-8.
- Elder AT. Contraindications to use of metformin. Age and creatinine clearance need to be taken into consideration. BMJ. 2003;326(7392):762; author reply 762.
- Gilbert C, Valois M, Koren G. Pregnancy outcome after first-trimester exposure to metformin: a meta-analysis. Fertil Steril. 2006;86:658-63.
- Gutzin SJ, Kozer E, Magee LA, et al. The safety of oral hypoglycemic agents in the first trimester of pregnancy: a meta-analysis. Can J Clin Pharmacol. 2003;10:179-83.
- Hague WM, Davoren PM, Oliver J, et al. Contraindications to use of metformin. Metformin may be useful in gestational diabetes. BMJ 2003;326(7392):762. author reply 762.
- Hawthorne G. Metformin use and diabetic pregnancy-has its time come? Diabet Med. 2006;23:223-7.
- Ijäs H, Vääräsmäki M, Morin-Papunen L, et al. Metformin should be considered in the treatment of gestational diabetes: a prospective randomised study. BJOG. 2011;118:880-5.
- Joint Formulary Committee. British National Formulary. 53rd ed. London: British Medical Association and Royal Pharmaceutical Society of Great Britain; 2007.
- Lain KY, Garabedian MJ, Daftary A, et al. Neonatal adiposity following maternal treatment of gestational diabetes with glyburide compared with insulin. Am J Obstet Gynecol. 2009;200:501.e1-6.
- Langer O, Conway DL, Berkus MD, et al. A comparison of glyburide and insulin in women with gestational diabetes mellitus. N Engl J Med. 2000;343:1134-8.
- Mesdaghinia E, Samimi M, Homaei Z, et al. Comparison of newborn outcomes in women with gestational diabetes mellitus treated with metformin or insulin: a randomised blinded trial. Int J Prev Med. 2013;4:327-33.
- Moore LE, Briery CM, Clokey D, et al. Metformin and insulin in the management of gestational diabetes mellitus: preliminary results of a comparison. J Reprod Med. 2007;52:1011-5.
- Moore LE, Clokey D, Rappaport VJ, et al. Metformin compared with glyburide in gestational diabetes: a randomized controlled trial. Obstet Gynecol. 2010;115:55-9.
- Mukhopadhyay P, Bag TS, Kyal A, et al. Oral hypoglycemic glibenclamide: Can it be a substitute to insulin in the management of gestational diabetes mellitus? A comparative study. Journal of SAFOG. 2012;4:28-31.
- NDF. Zorgstandaard Diabetes. 2012.
- Niromanesh S, Alavi A, Sharbaf FR, et al. Metformin compared with insulin in the management of gestational diabetes mellitus: a randomized clinical trial. Diabetes Res Clin Pract. 2012;98:422-9.
- NIV. Richtlijn diabetes en zwangerschap. 2008.
- NVOG. Richtlijn Diabetes en Zwangerschap. 2010.
- Ogunyemi D, Jesse M, Davidson M. Comparison of glyburide versus insulin in management of gestational diabetes mellitus. Endocr Pract. 2007;13:427-8.
- Rowan JA, Hague WM, Gao W, et al. Metformin versus insulin for the treatment of gestational diabetes. N Engl J Med. 2008;358:2003-15.
- Rowan JA, Rush EC, Obolonkin V, et al. Metformin in gestational diabetes: the offspring follow-up (MiG TOFU): body composition at 2 years of age. Diabetes Care. 2011;34:2279-84.
- Silva JC, Fachin DR, Coral ML, et al. Perinatal impact of the use of metformin and glyburide for the treatment of gestational diabetes mellitus. J Perinat Med. 2012;40:225-8.
- Spaulonci CP, Bernardes LS, Trindade TC, et al. Randomized trial of metformin vs insulin in the management of gestational diabetes. Am J Obstet Gynecol. 2013;209:34.e1-7.
- Tartarin P, Moison D, Guibert E, et al. Metformin exposure affects human and mouse fetal testicular cells. Hum Reprod. 2012 Nov;27(11):3304-14. doi: 10.1093/humrep/des264. PMID: 22811314.
- Tertti K, Ekblad U, Koskinen P, et al. Metformin vs. insulin in gestational diabetes. A randomized study characterizing metformin patients needing additional insulin. Diabetes Obes Metab. 2013;15:246-51.
Evidence tabellen
Table 36: Details regarding diagnosis, blood glucose target values and treatment duration used in studies included in this review
|
Study |
Diagnostic criteria used |
Target values for blood glucose or the use of additional treatment |
Treatment initiation |
Intervention |
|
Bertini et al., 2005 |
2 hour OGTT (75 g), WHO criteria: ≥110 mg/dl (≥6.1 mmol/litre) fasting, ≥140 g/dl (≥7.8 mmol/litre) 2 hours |
Fasting plasma glucose 90 mg/dl (5.0 mmol/litre) and postprandial values <100 mg/dl (<5.6 mmol/litre) |
Between 11 and 33 weeks of gestation |
Glibenclamide versus insulin |
|
Hague et al., 2003 |
ADIPS criteria no further details reported |
Not reported |
Not reported |
Metformin versus insulin |
|
Ijäs et al., 2010 |
2 hour OGTT (75 g): >5.3 mmol/litre fasting, >11 mmol/litre 1 hour, >9.6 mmol/litre 2 hours (1 or more abnormal values required for diagnosis of gestational diabetes) |
Fasting plasma glucose <5.3 mmol/litre and postprandial values <6.7 mmol/litre |
Between 12 and 34 weeks of gestation |
Metformin versus insulin |
|
Lain et al., 2009 |
1 hour OGTT (50 g) as a screening test and 3 hour OGTT (100 g) when screen value >135 mg/dl (7.5 mmol/litre) Diagnosis of gestational diabetes when there were 2 abnormal values, a raised fasting value with 3 hour OGTT (100 g) or 1 hour OGTT (50 g) >200 mg/dl (11.1 mmol/litre) |
Not reported |
Not reported |
Glibenclamide versus insulin |
|
Langer et al., 2000 |
1 hour OGTT (50 g) as a screening test and 3 hour OGTT (100 g) Carpenter Coustan 1982 criteria when screen value >130 mg/dl (7.2 mmol/litre) Diagnosis of gestational diabetes 95-140 mg/dl (5.2-7.8 mmol/litre) fasting value or also enrolled if at testing <95 mg/dl (5.3 mmol/litre) fasting value, but following dietary advice, postprandial value >120 mg/dl (>6.7 mmol/litre) |
Fasting plasma glucose 60-90 mg/dl (3.4-5.0 mmol/litre), preprandial value 80-95 mg/dl (3.4-5.0 mmol/litre and postprandial values <120 mg/dl (<6.7 mmol/litre) |
Between 11 and 33 weeks of gestation |
Glibenclamide versus insulin |
|
Niromanesh et al., 2012 |
1 hour GCT (50 g) >130 mg/dl (7.2 mmol/litre) and 3 hour OGTT (100 g) according to Carpenter and Coustan 1982 criteria |
Fasting glucose <95 mg/dl (5.3 mmol/litre), postprandial (no time given) <120 mg/dl (6.7 mmol/litre) |
Between 20 and 34 weeks of gestation |
Metformin versus insulin |
|
Mesdaghinia et al., 2013 |
1 hour GCT (50 g) followed by OGTT (100 g) fasting >95 mg/dl (5.0 mmol/litre), 1 hour >180 mg/dl (10.0 mmol/litre), 2 hour >155 mg/dl (8.6 mmol/litre) or 3 hour >140 mg/dl (7.8 mmol/litre) |
Not reported |
Between 24 and 34 weeks of gestation |
Metformin versus insulin |
|
Moore et al., 2007 |
3 hour OGTT (not reported), ADA criteria: >105 mg/dl (5.8 mmol/litre) fasting, 190 mg/dl (10.5 mmol/litre) 1 hour, 165 mg/dl (9.2 mmol/litre) 2 hour, 145 mg/dl (8.0 mmol/litre) 3 hour (2 abnormal values required for diagnosis of gestational diabetes) |
Fasting plasma glucose 60-90 mg/dl (3.4-5.0 mmol/litre) and 2 hour postprandial values <120 mg/dl (<6.7 mmol/litre) |
Between 24 and 30 weeks of gestation |
Metformin versus insulin |
|
Moore et al., 2010 |
1 hour OGTT (50 g) as a screening test and 3 hour OGTT (100 g) Carpenter Coustan 1998 criteria when screen value >130 mg/dl (7.2 mmol/litre). Diagnosis of gestational diabetes when there were 2 abnormal values or also enrolled if normal at testing, but following dietary advice, >105 mg/dl (5.8 mmol/litre) fasting value or postprandial value >120 mg/dl (>6.7 mmol/litre) |
Not reported |
Between 11 and 33 weeks of gestation |
Glibenclamide versus metformin |
|
Mukhopadhyay et al., 2012 |
2 hour OGTT (75 g) >140 mg/dl (7.8 mmol/litre) according to the WHO criteria (1998). |
Fasting glucose <90 mg/dl (5.0 mmol/litre) and postprandial peaks <120 mg/dl (6.7 mmol/litre). |
Between 20 and 28 weeks of gestation |
Glibenclamide versus insulin |
|
Ogunyemi et al., 2007 |
Not reported. Participants were women with gestational diabetes refractory to dietary management |
Not reported |
Not reported |
Glibenclamide versus insulin |
|
Rowan et al., 2008 |
ADIPS criteria no further details reported. On monitoring, following lifestyle advice, women also had more than one fasting plasma glucose value >5.4 mmol/litre and more than one 2 hour postprandial value >6.7 mmol/litre |
Fasting plasma glucose <5.5 mmol/litre and 2 hour postprandial values <7 mmol/litre |
Between 20 and 33 weeks of gestation |
Metformin versus insulin |
|
Silva et al.,2012 |
ADA 2009 criteria no further details reported |
Fasting plasma glucose <90 mg/dl (<5.0 mmol/litre), and postprandial values <120 mg/dl (<6.7 mmol/litre) |
Not reported |
Glibenclamide versus metformin |
|
Spaulonci et al., 2013 |
Not reported |
Unsatisfactory glycaemic control was defined as >30% of capillary glucose results above the reference values. These values were not reported. |
Not reported |
Metformin versus insulin |
|
Tertti et al., 2013 |
Before December 2008: Fasting value ≥4.8 mmol/litre, 1 hour ≥10.0 mmol/litre, 2 hour ≥8.7 mmol/litre. After 2008: Fasting value ≥5.3 mmol/litre, 1 hour ≥10.0 mmol/litre, 2 hour ≥8.6 mmol/litre. |
Fasting glucose <5.5 mmol/litre and 1 hour postprandial <7.8 mmol/litre. |
Between 22 and 34 weeks of gestation |
Metformin versus insulin |




Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 16-04-2018
Beoordeeld op geldigheid : 22-02-2018
Uiterlijk in 2021 bepalen de besturen van de Nederlandse Internisten Vereniging (NIV) en de Nederlandse Vereniging voor Obstetrie en Gynaecologie (NVOG) of deze richtlijnmodules nog actueel zijn. Op niveau van de netwerkrichtlijn wordt door de NIV een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NIV en de NVOG zijn regiehouder van deze richtlijnmodules en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze richtlijn is de betrokken zorgprofessional handvatten te bieden bij het besluit wat een optimaal moment van bevallen is voor een zwangere vrouw met diabetes, en bij de keuze van de behandeling van zwangeren met diabetes type 2 of GDM die onvoldoende baat hebben bij een dieet. Het adequaat informeren van de patiënt, en het samen tot een optimale keuze komen is hierbij belangrijk.
Doelgroep
Deze modules zijn geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor zwangeren met diabetes (multidisciplinair behandelteam). Deze beroepsgroepen bestaan onder andere uit verloskundigen, gynaecologen, diabetesverpleegkundigen, diëtisten, huisartsen, internisten en apothekers.
Samenstelling werkgroep
De richtlijn Diabetes en zwangerschap is onderdeel van de Netwerkrichtlijn diabetes mellitus ontwikkeld onder overkoepelend voorzitterschap van Dr. P.H.L.M. (Nel) Geelhoed, internist-endocrinoloog, Haaglanden Medisch Centrum, Den Haag (Nederlandse Internisten Vereniging).
Voor het ontwikkelen van deze modules Diabetes en zwangerschap is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van de beroepsverenigingen van verloskundigen, gynaecologen en internisten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De modules zijn voor commentaar voorgelegd aan andere partijen betrokken bij de zorg voor zwangere vrouwen met diabetes.
- Dr. J.J. Duvekot, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam (voorzitter), Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. I.M. Evers, gynaecoloog-perinatoloog, Meander Medisch Centrum, Amersfoort, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J. van Dillen, gynaecoloog-perinatoloog, RadboudUMC, Nijmegen, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. E.C. van der Wilk, gynaecoloog-perinatoloog, Erasmus MC, Rotterdam, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. L.D. Elving, internist, RadboudUMC, Nijmegen, Nederlandse Internisten Vereniging
- Dr. R.G. IJzerman, internist-endocrinoloog, VU Medisch Centrum, Amsterdam, Nederlandse Internisten Vereniging
- Dr. P.M. Offerhaus, senior docent/onderzoeker, lectoraat Midwifery Science, Academie Verloskunde, Maastricht, Koninklijke Nederlandse Organisatie van Verloskundigen
Met ondersteuning van:
- Drs. S.B. Muller-Ploeger, adviseur, Kennisinstituut van Medisch Specialisten
- Dr. M.A. Pols, senior adviseur, Kennisinstituut van Medisch Specialisten
- Drs. A.J.P. Ranke, junior adviseur, Kennisinstituut van Medisch Specialisten
- C. Sloof, MSc, medisch informatiespecialist, St. Antonius Ziekenhuis, Nieuwegein
- S.K. Josso, senior projectsecretaresse, Kennisinstituut van Medisch Specialisten
- N.F. Bullock, projectsecretaresse, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De “KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie management |
Extern gefinancierd onderzoek |
Kennisvalorisatie |
Overige belangen |
Ondernomen actie |
|
Duvekot |
gynaecoloog-perinatoloog |
opstellen van medische expertises |
geen |
geen |
lid 'verloskundige indicatielijst'(VIL) werkgroep |
geen |
geen |
voorzitter Otterlo werkgroep NVOG (tot okt 2014), voorzitter cie kwaliteitsdocumenten NVOG (vanaf okt 2014) |
geen |
|
Evers |
gynaecoloog-perinatoloog |
Voorzitter Richtlijn Basis Prenatale Zorg, NVOG |
geen |
geen |
geen |
Hoofdonderzoeker GLUCOMOMS studie, glucose monitoring met sensor tijdens de zwangerschap, subsidie van ZonMW, studie is nog lopende tot 2015 |
geen |
lid Otterlo werkgroep |
geen |
|
van Dillen |
gynaecoloog-perinatoloog |
Geen |
geen |
geen |
geen |
geen |
geen |
lid Otterlo werkgroep |
geen |
|
Elving |
Internist |
Geen |
geen |
geen |
Lid van de kerngroep diabetes van de NIV |
geen |
geen |
geen |
geen |
|
IJzerman |
internist-endocrinoloog, Mijn werkzaamheden zijn patientgebonden, maar ook onderzoek en onderwijs. Daarnaast ben ik via het Vumc werkzaam als adviseur/beoordelaar van diabetes-gerelateerde medicatie voor het CBG |
Geen |
geen |
geen |
geen |
In 2014 hoofdonderzoeker van 2 mechanistische onderzoeken naar acute en chronische effecten van GLP-1 (receptor agonisten) op de hersenen waarvoor het VU medisch centrum subsidie ontving (AstraZeneca en NovoNordisk). Sinds januari 2016 lokale onderzoeker van een internationaal observationeel onderzoek naar de veiligheid van verschillende insulines tijdens de zwangerschap. Dit is een "Post-Authorisation Safety Study" op verzoek van de "European Medicines Agency" (Novo Nordisk). Voor het VUmc recent subsidie aangevraagd voor mechanistisch onderzoek naar effecten van glucose-verlagende medicatie op de hersenen (farma). Vanaf april 2016 één van de onderzoekers van een groot Europees onderzoek naar ondervoeding bij ouderen (PROMISS, gesubsidieerd door het "EU Research and Innovation programme Horizon 2020"). Hoofdonderzoeker van 2 epidemiologische onderzoeken waarvoor VUmc subsidie ontving van de "European Foundation for the Study of Diabetes" en NWO. Beide afgerond. Van 2011 tot 2013 betrokken bij onderzoek naar effecten van insuline detemir en insuline NPH op de hersenen waarvoor het VU medisch centrum subsidie ontving (NovoNordisk). |
geen |
geen |
geen |
|
van der Wilk |
gynaecoloog-perinatoloog |
Geen |
geen |
geen |
geen |
geen |
geen |
lid Otterlo werkgroep |
geen |
|
Offerhaus |
beleidsmedewerker KNOV |
Geen |
geen |
geen |
geen (afgevaardigd namens beroepsorganisatie) |
geen |
geen |
team richtlijnen KNOV |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een in een eerder stadium door de patiëntenvereniging uitgevoerde enquête onder haar leden (zie richtlijn Diabetes Mellitus; NIV, 2014). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de patiëntenvereniging (Diabetesvereniging Nederland (DVN)).
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen via een invitational conference (gezamenlijk voor zes richtlijnen die deel uitmaken van de netwerkrichtlijn diabetes, diabetische voet, diabetische retinopathie, diabetische neuropathie, kinderen, ouderen en diabetes en zwangerschap) door: de NIV, Diabetesvereniging Nederland (DVN), Eerste Associatie Van Diabetesverpleegkundigen (EADV), Inspectie voor de Gezondheidszorg, Koninklijke Nederlandse Organisatie van Verloskundigen (KNOV), Menzis, Nefarma, Nederlandse Federatie van Universitair Medische Centra (NFU), Nederlands Huisartsen Genootschap (NHG), Nederlands Oogheelkundig Gezelschap (NOG), Nederlandse Vereniging voor Anesthesiologie (NVA), Nederlandse Vereniging van Dietisten (NVD), Nederlandse Vereniging voor Kindergeneeskunde (NVK), Nederlandse Vereniging voor Klinische Geriatrie (NVKG), Nederlandse Vereniging voor Neurologie (NVN), Nederlandse Vereniging voor Obstetrie & Gynaecologie (NVOG), Nederlandse Vereniging van Diabetes Podotherapeuten (NVvDP), Optometristen Vereniging Nederland (OVN), Provoet (Brancheorganisatie voor de Pedicure), Verpleegkundigen & Verzorgenden Nederland (V&VN), Verenso, WCS Kenniscentrum Wondzorg, Zorgverzekeraars Nederland (ZN), en Zorginstituut Nederland (ZIN). Een verslag van de invitational conference is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep de definitieve uitgangsvragen vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Voor deze richtlijn is geen overkoepelende oriënterende zoekactie uitgevoerd. Voor de afzonderlijke uitgangsvragen is aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria.
Direct na de selectieperiode bleek een NICE-richtlijn te zijn verschenen (februari 2015) met onder meer dezelfde uitgangsvragen. De werkgroep heeft deze richtlijn vergeleken met de eigen search en uitkomsten en heeft besloten dat deel van de NICE-richtlijn wat betreft literatuursamenvatting integraal over te nemen (NICE guideline Diabetes in Pregnancy, February 2015).
De werkgroep heeft ervoor gekozen de samenvatting en beoordeling van de literatuur over te nemen en niet de paragrafen waarin de mening of de overwegingen van de Britse werkgroep zijn opgenomen. De tekst, evidence tabellen en beoordeling van individuele studiekwaliteit zijn derhalve integraal overgenomen en kunt u onder het tabblad Onderbouwing vinden.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden door NICE systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de evidence tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden weergegeven in evidence tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
De literatuuranalyse voor beide modules is overgenomen uit de NICE-richtlijn Diabetes in Pregnancy (2015). Voor de methodiek verwijst de werkgroep naar hoofdstuk 1.2 (2015 guideline update development methodology) uit de betreffende richtlijn.
NICE gebruikt net als het Kennisinstituut van Medisch Specialisten GRADE voor het bepalen van de kracht van het wetenschappelijk bewijs.
GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, matig, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Matig |
|
|
Laag |
|
|
Zeer laag |
|
Formuleren van de conclusies
De NICE-richtlijn vermeldt conclusies en het bijbehorende niveau van bewijs in de paragrafen die Evidence statement heten. Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. Voor de manier van totstandkoming van deze paragrafen wordt verwezen naar de NICE-richtlijn.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, specifiek Nederlandse omstandigheden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg voor zwangeren met diabetes staat beschreven in de NDF Zorgstandaard Diabetes.
Indicatorontwikkeling
Bij de richtlijn zijn geen nieuwe kwaliteitsindicatoren ontwikkeld omdat er voor diabetes al voldoende indicatoren bestaan, onder andere behorend bij de NDF Zorgstandaard Diabetes.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk onderzoek van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisatie voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
- Brouwers MC, Kho ME, Browman GP, et al. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010. Review. PubMed PMID: 20603348.
- Medisch Specialistische Richtlijnen 2.0. Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html. 2012.
- NICE guideline Diabetes in Pregnancy, February. 2015
- Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
- Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group. 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
- Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.


