Timing screening DDH
Uitgangsvraag
Wat is de optimale timing van de echografische screening voor DDH?
Aanbeveling
Verricht echografisch onderzoek voor DDH:
- Bij een belaste familieanamnese, stuitligging na week 32 van de zwangerschap en/of tijdens bevalling: bij een leeftijd van drie maanden.
- Bij een afwijkend lichamelijk onderzoek van de heupen (abductie < 70 graden, een abductieverschil van ≥ 20 graden, en/of een duidelijk zichtbaar kniehoogteverschil): binnen twee weken na verwijzing*.
*verwijzing voor lokale echo, ongeacht leeftijd, uitgaande van voldoende heupecho-expertise. Bij afwijkende echo verwijzen naar een kinderorthopeed in een kinderorthopedisch netwerk met DDH behandelteam.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In een Cochrane review van Shorter (2013) over de effectiviteit van screening werd geen bewijs gevonden voor universele screening, of het moment van screening. Het specifieke moment van drie maanden is in deze studie niet meegenomen (direct versus zes weken). De betreffende studie is niet meegenomen in de literatuursamenvatting, omdat er in deze Cochrane review geen artikelen waren geïncludeerd over de timing van screening. In een internationale consensus meeting zijn de conclusies van de Cochrane review niet overgenomen, dit bemoeilijkt het beleid.
Het Nederlandse onderzoek van Roovers (2005) liet zien dat er bij latere screening veel minder kinderen behandeld hoeven worden voor dysplasie, omdat het natuurlijk beloop mild blijkt en ruim 80% radiologisch spontaan verbetert. Tevens liet de recent gepubliceerde Nederlandse studie van Pollet (2020) zien dat bij milde dysplasie late behandeling (drie versus zes maanden) niet tot een significant verschil leidt in verbetering van de acetabulaire index. Echter, een mogelijk nadeel van later screenen is dat een aantal luxaties pas bij drie maanden of later ontdekt wordt, omdat zij bij het eerste contactmoment met de JGZ nog geen sterk afwijkend lichamelijk onderzoek hebben. In de nieuwe richtlijn uit 2018 wordt al geadviseerd om bij verdenking op een luxatie zo snel mogelijk een echo te laten maken. Onduidelijk is echter of latere diagnose van dysplasie met eventueel luxatie leidt tot slechtere behandeluitkomsten.
Er is geen duidelijk bewijs gevonden voor betere uitkomsten van vroege, of late dan wel selectieve of universele screening. Omdat in Nederland alle kinderen gescreend worden op risicofactoren en middels lichamelijk onderzoek en zowel de Cochrane review van Shorter (2013) als de literatuur samenvatting voor deze richtlijn geen aanleiding geven tot veranderen van het beleid stelt de werkgroep voor dit beleid te handhaven.
Waarden en voorkeuren van patiënten (en hun verzorgers)
Al hebben ouders wellicht de voorkeur voor snelle zekerheid, echo-screening onder de leeftijd van 3 maanden leidt over het algemeen tot overdiagnostiek, met name bij baby’s met een Graf 2A classificatie. Het gevolg is dan, dat deze baby’s na de leeftijd van 12 weken nogmaals een echo moeten ondergaan, waarbij de overgrote meerderheid genormaliseerd zal zijn.
Wel is het vermoeden van heupdysplasie met een luxatie o.b.v. lichamelijk onderzoek een indicatie om onder de leeftijd van 3 maanden een echo te vervaardigen, om zo nodig vroeger te beginnen met behandeling.
Kosten (middelenbeslag)
Het veranderen van het beleid naar bijvoorbeeld universele en/of vroegtijdige screening brengt veel kosten met zich mee omdat dan meer kinderen gescreend én behandeld zullen moeten worden. Daarnaast zou dan het hele logistieke proces in Nederland voor screening en behandeling moeten veranderen, zonder dat dit onderbouwd kan worden met literatuur.
Aanvaardbaarheid voor de overige relevante stakeholders
Het is wenselijk om bij dit onderwerp aan te sluiten bij de recente JGZ-richtlijn Heupdysplasie uit 2018.
Haalbaarheid en implementatie
Niet van toepassing.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Screening van kinderen is conform de JGZ-richtlijn Heupdysplasie (2018) klinisch in de eerste maand bij het consultatiebureau. Kinderen met een beperkte abductie en/of kniehoogteverschil worden direct doorverwezen voor een echo, ongeacht hun leeftijd. Kinderen met risicofactoren worden gescreend bij drie maanden. Zoals in de JGZ-richtlijn Heupdysplasie (2018) vermeldt staat wordt bij prematuriteit rekening gehouden met de gecorrigeerde leeftijd. De aanbevelingen in deze richtlijn sluiten grotendeels aan bij de verwijscriteria in de JGZ-richtlijn Heupdysplasie (2018).
Onderbouwing
Achtergrond
De screening voor de opsporing van DDH is in Nederland anders dan in de rest van de wereld. Waar elders de screening middels echo in de eerste levensweek of bij zes weken plaatsvindt, wordt in Nederland de echografische screening bij drie maanden gedaan. Wel wordt in de eerste maand op het consultatiebureau klinisch gescreend middels beoordeling van de abductie en de Galeazzi-test (kniehoogteverschil). Als er klinisch een verdenking is op een heupluxatie wordt direct een echo gemaakt en niet gewacht tot drie maanden. Overige kinderen met een beperkte of asymmetrische abductie of risicofactoren (JGZ-richtlijn Heupdysplasie, 2018) worden op de (gecorrigeerde) leeftijd van drie maanden verwezen voor een echografische controle. De vraag is of er noodzaak is tot aanpassing van dit beleid: is er voldoende bewijs is om het huidige beleid te rechtvaardigen of is er bewijs dat er een ander en beter moment is om te screenen?
Conclusies / Summary of Findings
|
Very low GRADE |
It is unclear whether screening at the age of three months compared to screening below three months of age and at three months combined is associated with less DDH at the age of three months in patients with risk factors for DDH.
Sources: (Malkawi, 1997; Roovers, 2005) |
Samenvatting literatuur
Description of studies
Roovers (2005) performed a population-based study in infants of 1 to 3 months of age. The aim of the study was to determine the natural history of sonographic developmental dysplasia of the hip. Between October 1998 and July 2000, 5,170 infants were included in the Soundchec Study and were screened by an ultrasound examination of the hip at the age of one, two and three months at the community health centre. For the purpose of evaluation, the children received an ultrasound reference test at the age of eight months. Infants were excluded from the study in case the quality of the ultrasound image was inadequate. The median age of these infants at the first screening was five weeks (range 2 to 7 weeks).
Malkawi (1997) performed a retrospective cohort study in newborns and infants. The study was carried out to find the most appropriate age and sonographic method to detect developmental dysplasia of the hip (DDH). From June 3rd until December 2nd, all infants between three and four months were included in the intervention group. From August 1988 until February 1989, newborns delivered consecutively in the maternity unit were included in the control group. The intervention consisted of a universal examination of all infants age between three and four months using Graf’s simple sonography technique and classification. In the control group all babies were universally examined in the first twelve hours after birth using Graf’s simple sonography technique and classification. They were examined again at the age of three months. Hips with risk factors (positive family history, breech presentation, congenital generalized laxity, oligohydramnios, club foot and other congenital anomalies), sonographically unstable hips and hips under treatment were followed-up monthly, while type II hips were followed-up only at the age of three months as recommended by Graf.
A total of 1077 infants were included in the intervention group and 1823 newborns in the control group. The mean age of the intervention group was 3.4 months and all newborns in the control were < 12 hours old. In addition, the percentage of males in the intervention and control group was 52% and 53.7%, respectively. No prognostic variables were taken into consideration to adjust for possible confounding.
Results
1.DDH at the age of three months
There were two studies that reported the outcome measure DDH at the age of three months.
Malkawi (1997) reported two patients (two hips, 0.19%) and 13 patients (20 hips, 0.71%) in the intervention and control group, respectively, who developed DDH at the age of three months. No statistic tests were performed.
Roovers (2005) reported that of the normal hips at the age of one month, 99.6% were still normal at the age of three months. Of the immature type IIa/IIa + and type IIa - hips, if untreated, 95.3 and 84.4% had become normal, respectively. This study shows that normal hips remain normal in nearly 100% of cases, but development to abnormality is possible. It shows also that most of the immature hips at the age of one month become normal without treatment.
Level of evidence of the literature
The level of evidence regarding the outcome measure DDH at the age of three months comes from an observational study and therefore starts low. The level of evidence was downgraded by one level because of study limitations (bias by indication, no adjustment for confounding). Resulting in a level of evidence of very low.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P: (patients) patients with risk factors for DDH;
I: (intervention) ultrasound of the hips at the age of less than three months;
C: (control) ultrasound of the hips at the age of three months;
O: (outcome measure) DDH at the age of three months.
Relevant outcome measures
The guideline development group considered DDH at the age of three months as a critical outcome measure for decision making.
A priori, the guideline development group did not define the outcome measures listed above but used the definitions used in the studies.
Search and select (Methods)
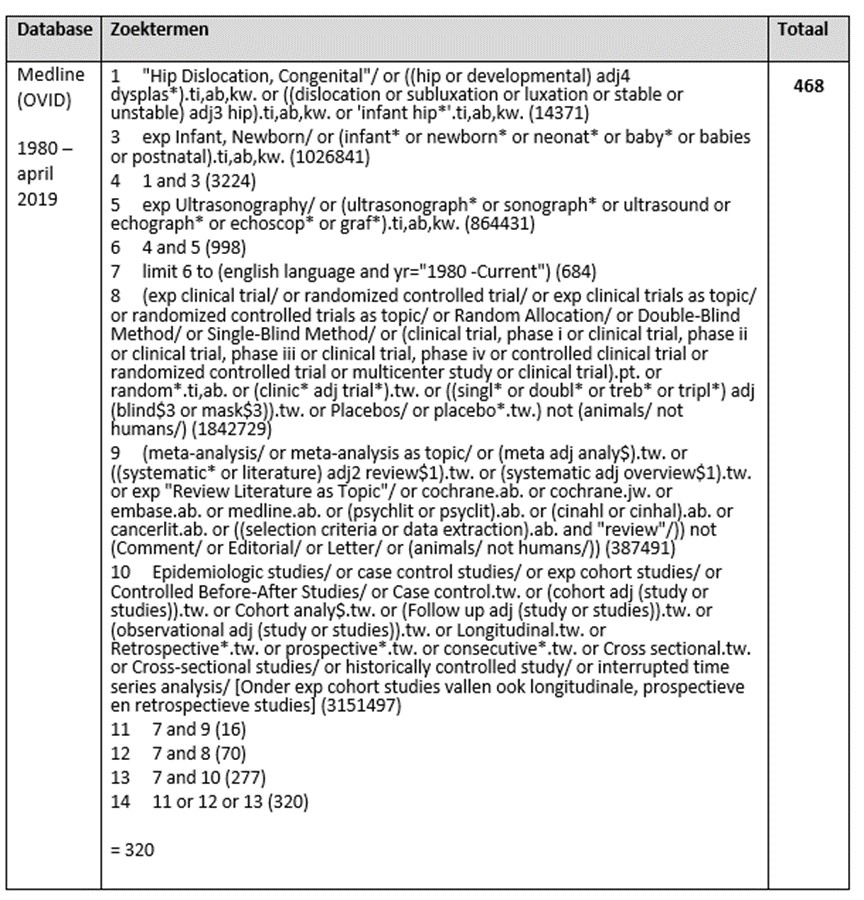
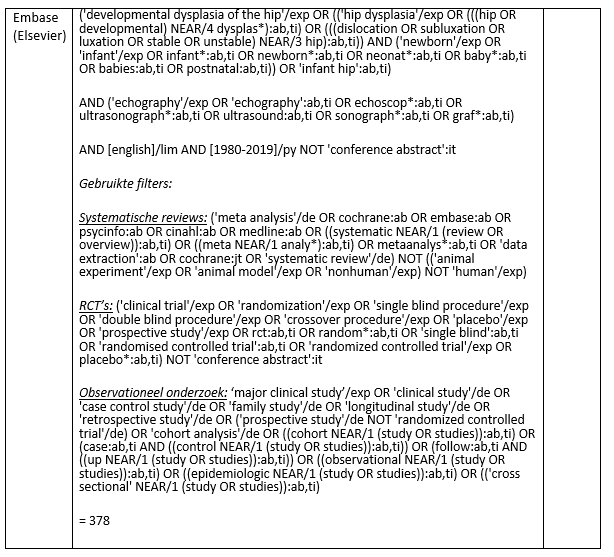
The databases Medline (via OVID) and Embase (via Elsevier) were searched with relevant search terms until 1st of April 2019. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 468 hits. Studies were selected based on the following criteria randomized controlled trials and comparative cohort studies including children and comparing the timing of ultrasound screening of the hips. In total, 25 studies were initially selected based on title and abstract screening. After reading the full text, 24 studies were excluded (see the table with reasons for exclusion under the tab Methods), and one study was included. During reference checking, one extra study was added to the literature review, Malkawi (1997) because of clinical relevancy. However, this study was not found in the literature search.
Results
Two studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Konijnendijk, A. A. J., Deurloo, J. A., Lanting, C. I., & Boere-Boonekamp, M. M. (2018). JGZ-richtlijn Heupdysplasie. JGZ Tijdschrift voor jeugdgezondheidszorg, 50(4), 76-81.
- Malkawi, H., Tadros, F., Khasawneh, Z., & Al-Asir, B. (1997). Simple or stress sonographic hip screening in the newborn versus simple hip screening at the age of three to four months. Saudi medical journal, 18(5), 507-511.
- Pollet, V., Castelein, R. M., van de Sande, M., Witbreuk, M., Mostert, A. K., Besselaar, A., ... & Sakkers, R. J. B. (2020). Abduction treatment in stable hip dysplasia does not alter the acetabular growth: results of a randomized clinical trial. Scientific Reports, 10(1), 1-7.
- Roovers, E. A., Boere-Boonekamp, M. M., Mostert, A. K., Castelein, R. M., Zielhuis, G. A., & Kerkhoff, T. H. (2005). The natural history of developmental dysplasia of the hip: sonographic findings in infants of 1–3 months of age. Journal of Pediatric Orthopaedics B, 14(5), 325-330.
- Shorter D, Hong T, Osborn DA. (2013) Cochrane Review: Screening programmes for developmental dysplasia of the hip in newborn infants. Evid Based Child Health, 8(1), 11-54.
Evidence tabellen
Risk of bias table
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Malkawi, 1997 |
Unlikely (goeie leeftijd, alleen geen selective screening gedaan) |
Unclear/unlikely (staat nergens dat ze follow-up data van kinderen missen) |
Likely (no blinding soft outcomes, detection bias) |
Likely (er zijn geen statistische analyses uitgevoerd) |
|
Roovers, 2005 |
Unlikely |
Unlikely |
Likely (no blinding soft outcomes, detection bias) |
Likely (er zijn geen statistische analyses uitgevoerd) |
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Shorter, 2013 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Shipman |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Shorter, 2011 |
Geen inclusie van artikelen over onze PICO |
|
Lehmann, 2000 |
Voldoet niet aan PICO: gaat niet over ultrasound |
|
Boere-Boonekamp, 1998 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Schaeffer, 2018 |
Geen systematische review |
|
Laborie, 2013 |
Voldoet niet aan PICO: universal versus selective US |
|
Clarke, 2012 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Afaq, 2011 |
Voldoet niet aan PICO: ultrasound versus clinical examination |
|
Holen, 2002 |
Voldoet niet aan PICO: universal versus selective US |
|
Bache, 2002 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Westacott, 2018 |
Voldoet niet aan PICO: universal versus selective US |
|
Lussier, 2018 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Rosendahl, 1992 |
Voldoet niet aan PICO: ultrasound versus clinical examination |
|
Marks, 1994 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Kolb, 2016 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Waheed, 2008 |
Niet leverbaar |
|
Riboni, 2003 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Bialik, 1999 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Vrdoljak, 1998 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Terjesen, 1996 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Catelein, 1992 |
Voldoet niet aan PICO: geen vergelijking van timing |
|
Castelein, 1988 |
Voldoet niet aan PICO: geen vergelijking van timing |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-12-2020
Beoordeeld op geldigheid : 07-12-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Orthopaedische Vereniging of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Orthopaedische Vereniging is de regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
Timing screening DDH |
NOV |
2020 |
2025 |
Eens in de vijf jaar |
NOV/WKO |
Wijzigingen in JGZ richtlijn/JGZ beleid |
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het doel van de richtlijn is om een meer uniforme en eenduidige diagnostiek en behandeling te verkrijgen voor kinderen onder één jaar met of met verdenking op DDH.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met (een verhoogde kans op) DDH.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor kinderen tot de leeftijd van één jaar waarbij het heupgewricht niet goed ontwikkeld is.
De werkgroepleden en klankbordgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn. De klankbordgroepleden hebben op het raamwerk en voor de commentaarfase schriftelijke input kunnen leveren voor de richtlijn.
Werkgroep
- Dr. M.M.E.H. Witbreuk, orthopedisch chirurg, werkzaam in het OLVG te Amsterdam en Amsterdam UMC, NOV (voorzitter)
- Dr. C.J.A. van Bergen, orthopedisch chirurg, werkzaam in het Amphia ziekenhuis te Breda, NOV
- Dr. B.J. Burger, orthopedisch chirurg, werkzaam in de Noordwest Ziekenhuisgroep te Alkmaar, NOV
- Dr. M.M.H.P. Foreman-van Dongelen, stafarts/heupechoscopiste werkzaam bij Diagnostiek voor U te Eindhoven, AJN
- Dr. Y.M. den Hartog, orthopedisch chirurg, werkzaam in het Medisch Spectrum Twente te Enschede, NOV
- Drs. J.H. van Linge, orthopedisch chirurg, werkzaam in het Reinier de Graaf ziekenhuis te Delft, NOV
- R.M. Pereboom, patiëntenvertegenwoordiger, Vereniging Afwijkende Heupontwikkeling
- Prof. Dr. S.G.F. Robben, radioloog, werkzaam in het Maastricht UMC+ te Maastricht, NVvR
- Dr. M.A. Witlox, orthopedisch chirurg, werkzaam in het Maastricht UMC+ te Maastricht, NOV
- Dr. P.B. de Witte, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum te Leiden, NOV
Klankbordgroep
- M.J. Becht, Gipsverbandmeester, werkzaam in het Wilhelmina Kinderziekenhuis te Utrecht, VGN
- Ing. S. Oostveen, Orthopedisch Technoloog, werkzaam in Centrum Orthopedie te Rotterdam, NBOT
- Dr. S.A. (Sandra) Prins, kinderarts, werkzaam in Amsterdam UMC locatie te Amsterdam, NVK
- L. de Vries, Wetenschappelijk medewerker NHG en huisarts (niet praktiserend), NHG
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
- Drs. B.L. de Geest, junior adviseur, Kennisinstituut van de Federatie van Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Witbreuk |
Orthopedisch chirurg werkzaam in het OLVG en in het AUMC |
voorzitter werkgroep kinderorthopedie tot december 2018, onbetaald Voorzitter opleidingscommissie onbetaald Lid van educational committee van de EPOS (European Pediatric Orthopaedic society) onbetaald
Bestuurslid ANNA fonds: onbetaald |
geen |
GEEN |
|
Bergen, van |
Orthopedisch chirurg Amphia |
Geen die belangenverstrengeling veroorzaken |
geen |
GEEN |
|
Burger |
Orthopedisch chirurg Opleider orthopedie Lid Medisch Specialisten Noord West Voorzitter Wetenschapscommissie Noord West Academie Bestuurslid Nederlandse Orthpaedische Vereniging |
Bestuurslid ANNA fonds: onbetaald
Bestuurslid CORAL (centre of orthopaedic research Alkmaar): onbetaald |
geen |
GEEN |
|
Foreman-van Drongelen |
Jeugdarts KNMG Jeugdgezondheidszorg 0-4 Stafarts/heupechoscopist (vlg. Graf) bij Diagnostiek voor U, eerstelijns diagnostisch centrum. |
Eigenaar van Weloverwogen Expertise
Gelicenseerd trainer Tijdsurfen |
geen |
GEEN |
|
den Hartog |
Orthopedisch chirurg Medisch Spectrum Twente |
geen |
geen |
GEEN |
|
van Linge |
Orthopedisch chirurg fulltime |
Commissie balansdruk kwaliteit van FMS betaald met lege gelden. Inmiddels project recent beëindigd. Docent kinderorthopedie huisartseninstituut Erasmus MC betaalt 4 uur per jaar |
geen |
GEEN |
|
Pereboom |
Secretaris vereniging Afwijkende Heupontwikkeling (onbetaald) |
geen |
geen |
GEEN |
|
Robben |
Kinderradioloog MUMC |
Geen |
geen |
GEEN |
|
Witlox |
Orthopedisch chirurg mumc |
Bestuur WKO (oud-voorzitter) niet betaald.
Bestuur Maastrichtse hockey club niet betaald. Penningmeester oudervereniging OBS Maastricht niet betaald |
geen |
GEEN |
|
De Witte |
Orthopeed Sophia-Erasmus MC Orthopeed LUMC vanaf 2020 |
Onderzoeker /epidemioloog |
geen |
GEEN |
|
Klankbordgroep |
|
|
|
|
|
Becht |
Gastdocent (anatomie kinderen) Erasmus MC opleiding gipsverbandmeester (betaald), Lid opleidingscommissie gipsverbandmeester CZO (college zorg opleidingen) (onbetaald) |
Geen |
geen |
GEEN |
|
Oostveen |
Penningmeester NBOT vereniging halve dag in de week
Orthopedisch (schoen) Technoloog at Centrum Orthopedie Rotterdam 40 uur |
Vereniging is onbetaald Orthopedisch (schoen) technoloog is betaald aanmeten hulpmiddelen voor aan het lichaam van schoenen, kniebrace, korsetten, polsspalken ect. |
geen |
GEEN |
|
Prins |
kinderarts neonatoloog |
Geen |
geen |
GEEN |
|
Vries, de |
Wetenschappelijk Medewerker afdeling richtlijnontwikkeling en wetenschap NHG,0,6 fte |
extern lid Richtlijn Advies commissie (RAC) geen directe betaling, vacatiegelden gaan naar NHG |
geen |
GEEN |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Vereniging Afwijkende Heupontwikkeling (VAH) in de werkgroep op te nemen. Het rapport hiervan (zie aanverwante producten) is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de VAH en de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn of richtlijnmodule in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van de NBOT, VAH, NVFK/KNGF, AJN en de VRA via een schriftelijke reactie op het raamwerk en schriftelijke knelpuntenanalyse. Deze zijn besproken in de gehele werkgroep.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De literatuursamenvatting (met de bijbehorende zoekcriteria) is in het Engels geschreven, om internationale uitwisseling van kennis te faciliteren. De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaald dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin, naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module met algemene uitgangspunten.
Indicatorontwikkeling
Voor deze richtlijn zijn geen interne kwaliteitsindicatoren ontwikkeld omdat naar inschatting van de werkgroep dit niet relevant zou zijn en dit de registratielast alleen maar zou vergroten.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de relevante (wetenschappelijke) verenigingen en (patiënten) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G.,... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwaliteit. https://richtlijnendatabase.nl/over_deze_site.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E.,... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104.
Zoekverantwoording