Chirurgische behandeling van unisuturale, niet-syndromale craniosynostose
Uitgangsvraag
Wat is het beleid rond chirurgische behandeling van niet-syndromale craniosynostose?
Aanbeveling
Indicaties chirurgische behandeling
- Corrigeer unisuturale niet-syndromale craniosynostose chirurgisch, met uitzondering van de metopica richel.
- Opereer kinderen met een milde vorm van trigonocephalie bij voorkeur niet.
- Voor kinderen met een matige vorm van trigonocephalie wordt geen aanbeveling gegeven.
Plastisch chirurg, neurochirurg en/of MKA-chirurg
- Evalueer het esthetisch resultaat van kinderen met een milde en matige vorm van trigonocephalie die niet geopereerd zijn, op de leeftijd van 5 jaar met behulp van een panelanalyse van gestandaardiseerde foto’s of 3D-fotogrammetrie.
Type ingreep
- Verricht bij een patiënt met sagittaalnaad synostose die bij verwijzing jonger is dan 5,5 maanden, een minimaal-invasieve chirurgie vanwege een lagere transfusiebehoefte.
- Verricht een open schedelcorrectie indien de patiënt bij verwijzing ouder is dan 6 maanden.
- Voor metopicanaad, coronanaad en lambdoidnaad synostose wordt geen aanbeveling gegeven ten aanzien van type ingreep.
Timing chirurgische behandeling
- Remodelleer de schedel bij niet-syndromale craniosynostose in het eerste levensjaar.
- Corrigeer, indien mogelijk, sagittaalnaad synostose voor de leeftijd van 6 maanden.
- Voor metopicanaad, coronanaad en lambdoïdnaad synostose wordt geen aanbeveling gegeven ten aanzien van timing.
- Verwijs als huisarts, jeugdarts of kinderarts ruim voor de leeftijd van 6 maanden, zodat de keuze voor minimaal-invasieve chirurgie mogelijk is.
Overwegingen
Bewijskracht van de conclusies
Indicatiestelling voor chirurgische behandeling
De indicatiestelling voor chirurgische behandeling van sagittaalnaad synostose, unilaterale coronanaad synostose en unilaterale lambdoïdnaad synostose berust op expert opinie.
De indicatiestelling voor de meest uitgesproken vorm van metopicanaad synostose berust op redelijke bewijskracht omdat de meeste observationele studies een direct-vergelijkende opzet hadden, en opzet en uitvoering adequaat (=geen ernstige risk of bias) waren.
Chirurgische techniek
De uitkomsten van minimaal-invasieve chirurgie ten opzichte van open schedelcorrectie bij sagittaalnaad synostose en en metopicanaad synostose, namelijk een kortere operatietijd, minder bloedverlies, minder bloedtransfusiebehoefte, kortere opnameduur en een vergelijkbaar esthetisch resultaat, berusten op redelijke bewijskracht omdat de meeste observationele studies een direct-vergelijkende opzet hadden, en opzet en uitvoering adequaat (=geen ernstige risk of bias) waren.
De vergelijkbare esthetische resultaten van minimaal invasieve chirurgie en open schedelcorrectie voor metopicanaad synostose berusten op zwak bewijs, omdat de meeste studies een niet-vergelijkende opzet hebben.
De betere oogheelkundige resultaten en het vergelijkbare esthetische resultaat van minimaal invasieve chirurgie en totale schedelcorrectie voor corona naad synostose berusten op zwak bewijs.
Het vergelijkbare esthetische resultaat van minimaal invasieve chirurgie en totale schedelcorrectie voor lambdoïdnaad synostose berust op zwak bewijs, namelijk slechts op één observationele studie.
Timing van de operatie
De uitkomst ‘prevalentie van papiloedeem’ bij sagittaalnaad synostose en metopicanaad synostose in het eerste levensjaar berust op zwak bewijs, namelijk slechts op één studie.
De betere oogheelkundige resultaten van vroege minimaal invasieve chirurgie voor coronanaad synostose ten opzichte van late totale schedelcorrectie berusten op zwak bewijs, namelijk op slechts één observationele studie.
Het vergelijkbare esthetische resultaat van vroege of late behandeling voor lambdoïdnaad synostose berust op zwak bewijs, namelijk op niet-vergelijkende studies met kleine aantallen.
Waarden en voorkeuren
Indicatiestelling voor chirurgische behandeling
Volgens de werkgroep vinden de meeste ouders van kinderen met een metopicanaad synostose, sagittaalnaad synostose, coronanaad synostose en lambdoïdnaad synostose, het esthetisch resultaat, neuro-cognitieve functies en visus, cruciale uitkomstmaten en kunnen zich daarom vinden in een operatief herstel.
Chirurgische techniek
Volgens de werkgroep vinden de meeste ouders van kinderen met een unisuturale, niet-syndromale craniosynostose het esthetisch resultaat wat betreft schedelvorm en zichtbaarheid van littekens, een zo klein mogelijk risico op een heroperatie, neuro-cognitieve functies en visus cruciale uitkomstmaten. In geval van een vergelijkbaar resultaat van behandeling, is er een voorkeur voor een operatie op jonge leeftijd, doordat ouders de periode met een operatie in het vooruitzicht als een last ervaren.
Timing van de operatie
Volgens de werkgroep hebben de meeste ouders van kinderen met een unisuturale, niet-syndromale craniosynostose een voorkeur voor een operatie op jonge leeftijd, doordat ouders de periode met een operatie in het vooruitzicht als een last ervaren.
Kosten en middelen
Het toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie niet of nauwelijks leiden tot een kostenverhoging, omdat de aanbevelingen aansluiten op de bestaande praktijk. Dit geldt voor alle aanbevelingen die betrekking hebben op:
- indicatiestelling voor chirurgische behandeling
- chirurgische techniek
- timing van de operatie.
Professioneel perspectief
Indicatiestelling voor chirurgische behandeling
Bij de metopica richel en de milde vorm van trigonocephalie is spontane verbetering van de afwijkende schedelvorm te verwachten. Spontaan herstel treedt bij de andere afwijkende schedelvormen niet op.
Gezien de discussie over de definitie van de milde/matige vorm is controle van (overwegend niet-geopereerde) patiënten met een milde/matige vorm van trigonocephalie op esthetisch resultaat op de leeftijd van 5 jaar gewenst.
De meest gebruikte methodes voor esthetische beoordeling zijn panelanalyse van gestandaardiseerde foto’s of 3D-fotogrammetrie.
Chirurgische techniek
Over het algemeen is er een voorkeur voor minimaal invasieve chirurgie vanwege 1. een lagere kans op bloedtransfusie behoefte en daarmee het vermijden van de daaraan verbonden risico’s en 2. minder zichtbare littekens. Voor sagittaalnaad synostose zijn de esthetische resultaten van de schedelvorm nagenoeg gelijk met een open schedelcorrectie en gaat de voorkeur dus uit naar minimaal invasief. Voor metopica, corona- en lambdoïdnaad synostose is er een stijgend aantal publicaties dat de esthetische (en voor coronanaad ook functionele in verband met visusafwijkingen) resultaten van endoscopische minimaal invasieve technieken gelijk (of mogelijk beter wat betreft visus bij corona naad) zijn dan deze van open remodellatie.
Desondanks blijft dit nog een omstreden punt in de (inter)nationale craniofaciale gemeenschap waarbij er dus nog niet voldoende grond bestaat om een duidelijke voorkeur voor endoscopische dan wel open remodellatie technieken aan te geven.
Een onderbouwde keuze voor het type minimaal invasieve chirurgie, te weten stripcraniëctomie met helm dan wel veerdistractie, is niet te geven en hangt met name af van de voorkeur en ervaring van de chirurg.
Timing van de operatie
Opereren voor de leeftijd van 3 maanden is vanuit anesthesiologische veiligheidsoverwegingen onwenselijk. Minimaal invasieve chirurgie na de leeftijd van 6 maanden is minder effectief dan voor die leeftijd omdat toegenomen ossificatie de schedel minder vervormbaar maakt. Een uitgebreide open schedelcorrectie voor de leeftijd van 6 maanden lijkt een groeibeperking van de schedel te induceren en wordt om die reden voornamelijk na die leeftijd uitgevoerd. Chirurgische correctie van de supra-orbitale rand met een open techniek (zoals gedaan wordt bij metopica en coronanaad synostose) is technisch lastiger voor de leeftijd van 6 à 9 maanden aangezien de ossificatie van dit botstuk nog beperkt is. Om enige te hebben voor de planning van de ingreep is het wenselijk dat de patient ten tijde van verwijzing vijfenhalve maand of jonger is.
Balans van voorziene gewenste en ongewenste uitkomsten
Indicatiestelling voor chirurgische behandeling
Alleen met chirurgie is verbetering van het esthetisch aspect mogelijk en kunnen neurocognitieve achterstand en visusstoornissen worden beperkt. Voor de metopica richel geldt dit niet vanwege spontaan herstel van de schedelvorm. Voor de milde en matige vorm van trigonocephalie is dit met minder zekerheid te zeggen gezien de afhankelijkheid van de gebruikte definitie.
Chirurgische techniek
Voordelen van minimaal invasieve technieken zijn kortere operatietijd en opnameduur, minder bloedverlies en minder kans op een bloedtransfusie. Daarmee slaat de balans positief uit richting minimaal invasieve technieken zolang deze even goede resultaten boekt qua verbeterde schedelvorm, neurocognitie en visus als de open remodellatie. De esthetische resultaten zijn waarschijnlijk vergelijkbaar op de korte termijn (1 jaar postoperatief). Of de esthetische resultaten op lange termijn (5 jaar postoperatief) gelijk zijn is onduidelijk, evenals hoe de neurocognitieve en visuele uitkomsten zich verhouden tussen de twee technieken.
Timing van de operatie
Verhoogde intracraniële druk, vastgesteld door aanwezigheid van papiloedeem bij fundoscopie, is schadelijk voor de visus en mogelijk voor de neurocognitieve uitkomsten. Vanwege de oplopende prevalentie van verhoogde intracraniële druk bij sagittaalnaad synostose in het eerste levensjaar is vroege behandeling wenselijk. Dit risico speelt niet bij metopicanaad synostose en daarbij kan veilig worden gewacht tot een later moment, waarop de supraorbitale rim technisch beter te corrigeren is, indien gekozen wordt voor een open behandeling. Voor coronanaad synostose en lambdoïdnaad synostose zijn geen evidente redenen voor een timingsvoorkeur, hoewel er mogelijk een betere outcome voor visusproblemen gezien wordt bij vroege minimaal invasieve behandeling van coronanaad synostose.
Aanvaardbaarheid en haalbaarheid van de aanbeveling(en)
Indicatiestelling voor chirurgische behandeling
Het willen en kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders (plastisch chirurgen, neurochirurgen, MKA-chirurgen, patiënten en hun ouders, leden van LAPOSA, kinderintensivisten, anesthesiologen, ZN, IGJ, NFU, VWS, ZIN, NZA, PFN), omdat de aanbevelingen grotendeels aansluiten bij de bestaande praktijk.
Chirurgische techniek
Het willen en kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders (plastisch chirurgen, neurochirurgen, MKA-chirurgen, patiënten en hun ouders, leden van LAPOSA, kinderintensivisten, anesthesiologen, ZN, IGJ, NFU, VWS, ZIN, NZA, PFN), omdat de aanbevelingen grotendeels aansluiten bij de bestaande praktijk.
Timing van de operatie
Het willen en kunnen toepassen van de aanbevelingen zal naar verwachting van de richtlijncommissie aanvaardbaar zijn voor alle stakeholders (plastisch chirurgen, neurochirurgen, MKA-chirurgen, patiënten en hun ouders, leden van LAPOSA, kinderintensivisten, anesthesiologen, ZN, IGJ, NFU, VWS, ZIN, NZA, PFN), omdat de aanbevelingen grotendeels aansluiten bij de bestaande praktijk.
Rationale van de aanbeveling(en)
Indicaties chirurgische behandeling
Leidend bij het opstellen van de aanbevelingen is dat bij de milde vorm van trigonocephalie de kans op spontaan herstel groot is in tegenstelling tot de ernstige vorm van trigonocephalie. Evaluatie van het esthetisch resultaat van de niet-geopereerde milde of matige vorm van trigonocephalie is pas betrouwbaar op de leeftijd van 5 jaar. Bij sagittaalnaad synostose, unilaterale coronanaad synostose en unilaterale lambdoïdnaad synostose treedt geen spontaan herstel op.
Chirurgische techniek
Leidend bij het opstellen van de aanbevelingen is dat beide operatietechnieken te overwegen zijn in geval van een verwijzing voor de leeftijd van 6 maanden. Het belangrijkste voordeel van minimaal invasieve chirurgie is een lagere kans op bloedtransfusiebehoefte. De esthetische verbetering van de schedeldeformiteit 1 jaar na operatie lijkt voor beide technieken gelijk in geval van sagittaalnaad synostose en mogelijk voor metopica-, corona en lambdoïdnaad synostose.
In geval van een latere verwijzing is een minimaal invasieve techniek over het algemeen niet meer mogelijk en is een open remodellatie aangewezen.
Timing van de operatie
Leidend bij het opstellen van de aanbevelingen betreffende timing is dat esthetische resultaten van de schedelvorm, neurocognitief functioneren en visus zo optimaal mogelijk zijn. De enige harde indicatie voor vroege behandeling is de oplopende prevalentie van papiloedeem bij sagittaalnaad synostose. Voor de overige drie typen craniosynostose is geen concrete reden om een timingsadvies te geven op dit ogenblik.
Onderbouwing
Achtergrond
De vier meest voorkomende vormen van unisuturale, niet-syndromale craniosynostose zijn in volgorde van prevalentie: sagittaalnaad synostose, metopicanaad synostose, unilaterale coronanaad synostose en unilaterale lambdoïdnaad synostose. Unicoronale synostose kan wel onderdeel zijn van een syndroom, zoals Muenke of Saethre-Chotzen syndroom, en een genetische oorzaak moet worden overwogen.
Definities
- Ernstige vorm van trigonocephalie: als het meest prominente deel van het voorhoofd in de midlijn ligt van het voorhoofd (rechter foto in onderstaande afbeelding). In bovenaanzicht zijn de laterale orbitaranden duidelijk zichtbaar door de retrusie van de laterale delen van het voorhoofd.
- Matige vorm van trigonocephalie: als het meest prominente deel van het voorhoofd tussen de mediale delen van de beide wenkbrauwen ligt. In bovenaanzicht zijn de laterale orbitaranden net wel of net niet zichtbaar.
- Milde vorm van trigonocephalie: als niet voldaan is aan bovenstaande definities. Er is discussie over deze definitie bij de experts aangezien het een glijdende schaal van deformatie is zonder afkappunt (linker foto in onderstaande afbeelding). In bovenaanzicht zijn de laterale orbitaranden niet of nauwelijks zichtbaar.
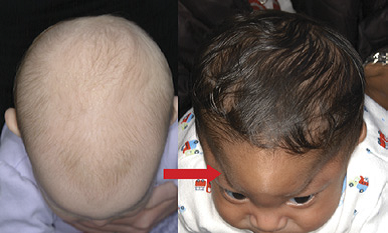
De patiënt aan linker zijde heeft een milde vorm van trigonocephalie, waarbij het voorhoofd normaal van vorm is, iets smal is en gecombineerd kan zijn met een botrichel over de (gesloten) metopica naad. De patiënt aan rechter zijde heeft een ernstige presentatie van trigonocephalie; het meest prominente deel van het voorhoofd ligt in de midlijn van het voorhoofd en door retrusie van de laterale delen van het voorhoofd (rode pijl) zijn de laterale orbitaranden van bovenaf duidelijk zichtbaar.
Conclusies / Summary of Findings
1. Wat is de indicatiestelling voor chirurgische behandeling?
|
Niveau 2 |
Alleen voor de meest uitgesproken vorm van metopicanaad synostose is de operatie-indicatie onbetwist. Bij één op de drie patiënten is er twijfel onder experts over de diagnose milde of matige metopica craniosynostose en daarmee over de operatie-indicatie.
B Birgfeld et al., 2013; Cho et al., 2016; Anolik et al., 2016 |
|
Niveau 4 |
Chirurgische behandeling van sagittaalnaad synostose, unilaterale coronanaad synostose en unilaterale lambdoïdnaad synostose is aangewezen aangezien er geen spontane verbetering van de afwijkende schedelvorm te verwachten is.
D Expert opinion |
2. Wat zijn de patiënt-relevante effecten van verschillende chirurgische technieken, met name minimaal invasieve correctie versus open schedelcorrectie voor de 4 typen unisuturale synostose?
|
Niveau 2 |
Sagittaalnaad synostose
Minimaal invasieve chirurgie gaat waarschijnlijk gepaard met statistisch significant minder bloedverlies, minder bloedtransfusie, kortere operatietijd en kortere opnameduur met een vergelijkbaar esthetisch resultaat ten opzichte van open schedelcorrectie.
B Chummun et al., 2016 ; Maltese et al., 2015 ; Gerety et al., 2015; Arts et al., 2018 C Ridgway et al., 2011; Han et al., 2016; Van Veelen et al., 2018 |
|
Niveau 3 |
Sagittaalnaad synostose
Veerdistractie gaat waarschijnlijk gepaard met een lagere prevalentie papiloedeem (als teken van verhoogde intracraniële druk) in de follow-up periode ten opzichte van open schedelcorrectie.
C Van Veelen et al., 2013 ; Van Veelen et al., 2015 ; Van Veelen et al., 2018 |
|
Niveau 2 |
Metopicananaad synostose
Open schedelcorrectie voor metopicanaad synostose resulteert in een kleiner frontaal volume en intracranieel volume op de leeftijd van 3 jaar ten opzichte van een controlegroep. In een zelfde vergelijkende studie voor minimaal invasieve operatie voor metopicanaad synostose met dezelfde follow-up tijd werd een normaal frontaal volume en intracranieel volume gevonden.
B De Jong et al., 2017; Maltese et al., 2014 C Arab et al., 2016 |
|
Niveau 3 |
Coronanaad synostose
Het risico op papiloedeem (als teken van verhoogde intracraniële druk) in een 6 jarige follow-up periode na open schedelcorrectie is mogelijk extreem laag.
C Taylor et al., 2015 |
|
Niveau 3 |
Coronanaad synostose
Minimaal invasieve chirurgie gaat waarschijnlijk gepaard met minder bloedverlies, geringere transfusiebehoefte, kortere operatietijd en kortere opnameduur. Mogelijk geeft minimaal invasieve chirurgie voor coronanaad synostose dezelfde esthetische resultaten als open schedelcorrectie
B Arts et al., 2016 C Tan et al., 2011; Jimenez et al., 2013; Delye et al., 2016; Han et al., 2016; Masserano et al., 2018 |
|
Niveau 3 |
Lambdoïdnaad synostose
Mogelijk geeft minimaal invasieve chirurgie dezelfde esthetische resultaten als totale schedelcorrectie voor lambdoïdnaad synostose.
B Al-Jabri et al., 2014 |
3. Wat zijn de patiënt-relevante effecten van een verschillende timing van de operatie, te weten ‘vroeg’, gedefinieerd als vóór de leeftijd van 6 maanden, versus ‘laat’, namelijk na de leeftijd van 6 maanden?
|
Niveau 3 |
Sagittaalnaad synostose
Voor minimaal invasieve behandeling met distractieveren, is er binnen een range van 1,9 tot 9,2 maanden een relatie tussen de leeftijd bij operatie en verandering in craniale index: voor elke extra maand in leeftijd neemt de verandering in CI met 1,3 af.
C Sun et al., 2018 |
|
Niveau 3 |
Coronanaad synostose
De oogheelkundige resultaten van vroege minimaal invasieve chirurgie lijken voor coronanaad synostose beter te zijn dan die van late totale schedelcorrectie. Het is onduidelijk of dit verschil wordt veroorzaakt door ernst van presentatie, type chirurgie of timing.
B MacKinnon et al., 2013 |
|
Niveau 3 |
Lambdoïdnaad synostose
Mogelijk geeft vroege of late behandeling voor lambdoïdnaad synostose een vergelijkbaar esthetisch resultaat.
C Al-Jabri et al., 2014 |
Samenvatting literatuur
1. Wat is de indicatiestelling voor chirurgische behandeling?
Indicatiestelling voor chirurgische behandeling voor metopicanaad synostose
De twee uitersten van het spectrum van klinische presentatie van metopicanaad synostose zijn een botrichel over de metopicanaad bij een verder normaal voorhoofd en een klassieke trigonocephalie oftewel wigschedel waarbij sprake is van een smal voorhoofd, een prominente botrichel ter plaatse van de metopicanaad, hypotelorisme, laterale orbitale hypoplasie, bipariëtale verbreding, epicanthus plooien en oplopende wenkbrauwen (Birgfeld et al., 2013). Er zijn weinig objectieve maten die bepalend zijn voor het stellen van een operatie-indicatie. Alleen voor de meest uitgesproken presentatie van trigonocephalie is een onbetwiste winst van esthetisch resultaat door chirurgie te behalen, maar of deze ook behaald wordt voor mildere presentaties is onduidelijk. Of er winst behaald wordt op het gebied van neurocognitie door te opereren is zelfs voor de extreme presentatie nog niet vastgesteld. Birgfeld et al. (2013) beschrijven een analyse om de operatie-indicatie te objectiveren, gebruikmakend van de fenotypische beschrijving door de arts, foto analyse en CT-scan metingen. Bij 34% van de foto’s waren de beoordelaars het oneens over de classificatie als metopica richel dan wel metopica craniosynostosis (oftewel trigonocephalie). Onderscheidend voor echte trigonocephalie blijkt het op jongere leeftijd herkennen van de afwijking door ouders en de relatie tussen laterale delen van het voorhoofd en de laterale oogkasrand van bovenaf gezien, waarbij het os frontale een recht verloop heeft en de laterale oogkasrand zichtbaar wordt.
Cho et al. (2016) beschrijft een CT-methodiek om de metopica richel van metopicanaad synostose te onderscheiden door curvatuur metingen van voorhoofd en laterale oogkas, al blijft het afkappunt subjectief in het bepalen van een operatie-indicatie. Een vergelijkbare scoringsmethode voor foto’s en CT’s beschrijft Anolik et al (2016). Ook zij vinden een slechte overeenstemming van meningen van experts voor de intermediaire presentatie van metopicanaad synostose.
Indicatiestelling voor chirurgische behandeling voor sagittaalnaad synostose, unilaterale coronanaad synostose en unilaterale lambdoïdnaad synostose
In de literatuur over sagittaalnaad, coronanaad en lambdoïdnaad synostose wordt geen discussie gevoerd over wel of geen operatie-indicatie en spitst dit item zich met name toe op metopicanaad synostose. Er is geen spontane verbetering van de afwijkende schedelvorm te verwachten.
2. Wat zijn de patiënt-relevante effecten van verschillende chirurgische technieken, met name minimaal invasieve correctie versus open schedelcorrectie voor de 4 typen unisuturale synostose?
Sinds de eerste operatieve interventie in verband met een craniosynostose zijn er vele chirurgische technieken voor de diverse vormen van craniosynostose beschreven. Grofweg kan men een onderscheid maken tussen minimaal invasieve chirurgie en open schedelcorrectie. Bij de eerste groep wordt de gesloten schedelnaad met omliggend bot verwijderd of wordt een osteotomie verricht ter plaatse van de gesloten schedelnaad of aan weerszijde ervan. De ingreep wordt veelal gevolgd door helmtherapie ter remodellatie van de schedelvorm, dan wel worden bij de ingreep veren of distractoren aangebracht om door middel van distractie actieve verruiming van de schedel te bewerkstelligen. Bij de open schedelcorrectie techniek tracht men direct de gewenste schedelvorm te bereiken door een correctie van een groot deel van de schedel. In Nederland worden in de twee expertisecentra voor craniosynostose naast de open schedelcorrectie techniek ook minimaal invasieve technieken aangeboden (Delye et al., 2016) (Van Veelen et al., 2018).
Gerandomiseerde vergelijkingen van de verschillende chirurgische technieken hebben nooit plaatsgevonden. Voor de verschillende vormen van niet-syndromale craniosynostose zullen we een overzicht van de literatuur ten aanzien van de verschillende technieken in deze twee groepen geven.
A) Sagittaalnaad synostose
Minimaal invasieve technieken
De stripcraniëctomie wordt veelal gevolgd door helmtherapie voor enkele maanden tot 1 jaar (Barone and Jimenez, 1999; Jimenez et al. 2012), dan wel gecombineerd met veerdistractie (Lauritzen et al., 2008; Maltese et al., 2015; Fischer et al., 2016). Voordelen van deze minimaal invasieve methoden zijn een laag bloedverlies, een lage transfusiebehoefte, een korte opnameduur, een korte operatieduur en een goede craniale index (CI) postoperatief. Meerdere studies hebben deze positieve resultaten beschreven voor de minimaal invasieve methoden, maar hebben zelden informatie over het optreden van verhoogde ICP tijdens de follow-up, het esthetische resultaat op lange termijn of over de neurocognitieve uitkomsten. Alleen Bonfield et al., 2014 rapporteert dat 2,7% van de patiënten een heroperatie kreeg vanwege een symptomatische groeibeperking van de schedel, zijnde bewezen verhoogde ICP of hoofdpijn.
Schedelcorrectie
In 2013 publiceert Van Veelen een serie van 79 kinderen met sagittaalnaad synostose die een extended stripcraniectomie ondergaan. Het betreft een open techniek waarbij de botstrip met sagittaalnaad wordt verwijderd en de pariëtaal botten naar buiten worden gebogen. Deze techniek kent 4 varianten waarin een aantal details variëren. Het bloedverlies bedroeg gemiddeld 213 ml, met een range van 50 tot 400 ml. Na een follow-up van 2 jaar wordt bij 9% (7/79) papiloedeem vastgesteld en worden 4 patiënten geheropereerd vanwege verhoogde intracraniële druk. De schedelomtrek stabiliseerde rond 0,6 SD.
Van Veelen et al. (2015) beschrijft twee varianten van frontobipariëtale remodelling bij sagittaalnaad synostose met 7 jaar follow-up. Het gemiddelde bloedverlies was 1042 ml (range 300 tot 7000). De craniale index (CI) blijkt met name afhankelijk van de preoperatieve CI en niet zozeer van de chirurgische techniek. De hoofdomtrek nam langzaam af in de 4 jaar postoperatief, was ook met name afhankelijk van de preoperatieve waarde en stabiliseerde op 0,9 SD. 7% van de patiënten ontwikkelt postoperatief papiloedeem ten teken van verhoogde ICP.
Minimaal invasief versus open schedelcorrectie
Han et al. (2016) vergelijkt in een retrospectieve studie de operatievariabelen, complicaties en reoperatie frequentie tussen 140 endoscopisch (waarvan 94 sagittaalnaad) en 155 open (waarvan 76 sagittaalnaad) behandelde niet-syndromale craniosynostose kinderen. De keuze voor techniek werd bepaald door leeftijd bij verwijzen (indien 6 maanden of ouder dan altijd open techniek), comorbiditeit en mogelijk te verwachten problemen met helmtherapie. Hij vindt voor beide technieken gelijke complicatiefrequenties, met lagere re-operatie frequentie voor endoscopische operaties (3/140, waarvan 2 vanwege een persisterend schedeldefect en 1 vanwege tegenvallend esthetisch resultaat; follow-up tijd gemiddeld 25 maanden) dan voor open operaties (10/155, waarvan 1 vanwege een chronische wond, 2 vanwege een hematoom, 2 voor verwijderen van een implantaat, 2 vanwege een schedeldefect en 3 vanwege tegenvallend esthetisch resultaat; follow-up tijd gemiddeld 37 maanden) en duidelijk gunstigere operatieprofiel (kortere operatieduur, minder bloedverlies, lagere transfusiebehoefte) voor de endoscopische techniek. Vergelijkbare data worden beschreven door Arts (2018). Arts analyseert een prospectief complicatieregister waarin 120 endoscopische (waarvan 63 sagittaalnaad) operaties worden vergeleken met 66 open (waarvan 30 sagittaalnaad). Ook hij vond gelijkaardige complicatiefrequenties met duidelijk gunstiger operatieprofiel voor de endoscopische ingreep. Er was telkens 1 re-operatie in beide groepen voor sagittaalnaad synostose.
In een systematisch review over het gebruik van veerdistractie is laag tot zeer laag bewijs dat veerdistractie een betere techniek zou zijn dan een open schedelcorrectie; de CI was niet verschillend en factoren als operatietijd, opnameduur en bloedverlies waren iets lager (Maltese et al., 2015). Mundinger et al (2016) vindt in de systematische review naar gebruik van distractie osteogenese voor schedelcorrecties (inclusief veerdistractie) ten opzichte van open chirurgie geen verschil in deze factoren.
Er is slechts één studie die minimaal invasieve veerdistractie vergelijkt met open correcties. Deze studie betreft de eerste 7 patiënten geopereerd met de minimaal invasieve benadering, vergeleken met 7 retrospectieve patiënten (Taylor et al., 2011). Omwille van de inclusiecriteria van deze richtlijn is deze buiten beschouwing gelaten.
Er zijn wel drie systematic reviews en meta-analyses die open correcties met distractoren of veren vergelijken met open correcties zonder distractoren of veren.
Gerety et al., 2015 verrichtten een meta-analyse van 3 chirurgische technieken, te weten schedelcorrectie, stripcraniëctomie en open veerdistractie en includeerde 12 artikelen. De CI was significant iets beter na schedelcorrectie ten opzichte van stripcraniëctomie en niet verschillend na schedelcorrectie ten opzichte van veerdistractie. Er was geen verschil in CI na stripcraniëctomie ten opzichte van veerdistractie. Schedelcorrectie heeft een significant langere operatietijd, opnameduur, bloedverlies en hogere kosten ten opzichte van de andere twee technieken. In een systematische review over het gebruik van open veerdistractie is laag tot zeer laag bewijs dat veerdistractie een betere techniek zou zijn dan een open schedelcorrectie; de CI was niet verschillend en factoren als operatietijd, opnameduur en bloedverlies waren iets lager (Maltese et al., 2015). In de systematisch review door Mundinger et al., (2016) naar verschillen tussen voornamelijk traditionele distractie osteogenesis van het schedeldak bij enkelvoudige en meervoudige synostose en open schedelcorrectie wordt geen verschil gevonden voor operatietijd, bloedverlies, IC opname of transfusie.
In de systematisch review van Chummun et al., (2016) naar CI en neuropsychologische outcome van behandeling van sagittaalnaad synostose voldeden 6 artikelen waarvan 4 een vergelijkende populatie hadden en daarmee werden geïncludeerd voor CI-analyse. Voor neuropsychologische outcome voldeden slechts 2 artikelen. Volgens GRADE was het niveau van bewijs voor beide outcomes erg laag en kunnen hier dus geen conclusies aan worden verbonden. Delye et al. (2016) rapporteert een CI van 0,72 na ongespecificeerde follow-up duur, maar van tenminste 6 maanden na endoscopische stripcraniectomie met helmtherapie. Van Veelen et al. (2018) rapporteert een CI van 0,74 na 2 jaar en 0,72 na 5 jaar volgend op een minimaal invasieve veerdistractie.
Andere studies tonen tot op heden wisselende resultaten ten aanzien van intracranieel volume als outcome tussen de open en minimaal invasieve technieken: Ghenbot et al. (2015) vindt 1 jaar na operatie geen verschil terwijl Van Veelen et al. (2016) bij een gemiddelde leeftijd postoperatief van 2 jaar wel een klein verschil vindt, met een mogelijk relatie met hoofdpijnklachten en papiloedeem. Bergquist et al. (2016) beschrijft een grote afname van intracranieel volume met de tijd voor kinderen die voor de leeftijd van 6 maanden zijn geopereerd. Arab et al. (2016) vinden alleen een statistisch significant kleiner postoperatief volume voor de schedelcorrectie volgens de pi-techniek en niet voor stripcraniëctomie of veerdistractie.
Ridgway et al. (2011) beschrijft 56 patiënten met sagittaal naad synostose die behandeld zijn met een stripcraniectomie en helmtherapie. Slechts 2 patiënten hadden een transfusie nodig (3,6%) en de auteurs beschrijven een toename van de schedelomtrek van gemiddeld 61% preoperatief naar 89% bij 3 jaar follow-up. Arts et al. (2018) rapporteert voor 63 opeenvolgende patiënten met sagittaalnaad synostose die een endoscopische behandeling ondergingen, een transfusie percentage van 28%, bij gemiddeld bloedverlies van 32 (+30) ml.
In een beschrijving van 83 achtereenvolgende patiënten met sagittaal naad synostose die een veerdistractie ondergingen en een follow-up periode van bijna 3 jaar vindt Van Veelen (2018) een transfusiepercentage van 19%, gemiddeld bloedverlies 70 (+50) ml voor de combinatie van veren plaatsen en veren verwijderen. papiloedeem 2,4% (2/83), een vergelijkbaar resultaat qua schedelvorm met de eerder beschreven open technieken (Van Veelen et al., 2013; Van Veelen et al., 2015) en een schedelomtrek die lijkt te stabiliseren op 0,7 SD. In vergelijking met de eerder door Van Veelen beschreven cohorts van open technieken is de prevalentie papiloedeem lager, waarbij een vergelijkbare screening is toegepast.
B) Metopicanaad synostose
Minimaal invasieve technieken
De Jong et al. (2017) beschreef de evolutie van hoofdvorm en volume van 86 kinderen na endoscopische behandeling van metopicanaad synostose gevolgd door helmtherapie in relatie tot deze van niet aangedane kinderen. Hierbij werd een objectief corrigeren van het voorhoofd vastgesteld, waarbij het schedelvolume (zowel totaal als frontaal) na de ingreep normaliseerde en gelijk liep met dat van niet aangedane kinderen, en dit tot de leeftijd van bijna 4 jaar. De korte operatietijd, kortere opnameduur en reductie in transfusiebehoefte van de minimaal invasieve techniek wordt eveneens voor trigonocephalie beschreven (Delye et al., 2016).
Seruya et al. (2014) beschrijven in een follow-up studie van 3 jaar na open schedelcorrectie dat er een belangrijke relapse in de tijd optreedt van de breedte van het voorhoofd. Geen van de 31 patiënten had tekenen van verhoogde ICP tijdens follow-up. Wes et al. (2014) beschrijft vergelijkbare resultaten en vindt temporale hollowing en laterale orbitawand retrusie met name vanaf 5 jaar follow-up of meer. Lange termijn studies zijn dus essentieel om een goede beoordeling van het esthetisch resultaat te kunnen geven. Ook wordt er 3 jaar na operatie een kleiner intracranieel volume gevonden door Arab et al. (2016). Dit is in overeenstemming met de studie van Maltese et al. (2014) waarbij 60 kinderen met trigonocephalie worden vergeleken met 198 controle kinderen. Preoperatief hebben beide groepen een gelijk intracranieel volume maar is het frontale volume kleiner bij trigonocephalie, terwijl op de leeftijd van 3 jaar zowel het totale volume als het frontale volume kleiner is bij trigonocephalie.
Minimaal invasief versus open schedelcorrectie
In een vergelijkend onderzoek naar open versus endoscopisch techniek voor metopicanaad synostose beschrijft Nguyen et al. (2015) dat een vergelijkbare correctie van het hypotelorisme en de wigvorm van het voorhoofd wordt verkregen na een korte follow-up van maximaal 1 jaar.
In een vergelijking van 67 microscopische minimaal invasieve operaties en 113 open techniek operaties over 10 jaar tijd voor verschillende typen craniosynostose (Teichgraeber et al., 2014) wordt een hogere frequentie van uitgebreide heroperaties gevonden voor de minimaal invasieve techniek- metopica naden in dit centrum van 2/8 patiënten (25%) versus 1/26 patiënten (3,8%) voor de open techniek. In vergelijking met de regulier beschreven endoscopische minimaal invasieve operaties verschilt de gebruikte techniek in deze studie op een aantal cruciale punten: 1. om het gebruik van de microscoop mogelijk te maken worden aanzienlijk meer incisies gemaakt; 2. postoperatief wordt de redressiehelm slechts 3 maanden toegepast, waar de meeste centra 10 à 12 maanden aanhouden. Dit maakt de vergelijking van deze minimaal invasieve techniek met een open techniek specifiek voor deze operateur en niet algemeen toepasbaar. Han et al. (2016) vergelijkt in een retrospectieve studie operatievariabelen, complicaties en reoperatie frequentie tussen 140 endoscopisch (waarvan 24 metopicanaad) en 155 open (waarvan 31 metopicanaad) behandelde niet syndromale craniosynostose kinderen. De keuze voor techniek werd bepaald door leeftijd bij verwijzen (indien 6 maanden of ouder dan altijd open techniek), comorbiditeit en mogelijk te verwachten problemen met helmtherapie. Hij vindt voor beide technieken gelijke complicatiefrequenties, met lagere re-operatie frequentie voor endoscopische operaties (3/140, waarvan 2 vanwege een persisterend schedeldefect en 1 vanwege tegenvallend esthetisch resultaat; follow-up tijd gemiddeld 25 maanden) dan voor open operaties (10/155, waarvan 1 vanwege een chronische wond, 2 vanwege een hematoom, 2 voor verwijderen van een implantaat, 2 vanwege een schedeldefect en 3 vanwege tegenvallend esthetisch resultaat; follow-up tijd gemiddeld 37 maanden) en duidelijk gunstigere operatieprofiel (kortere operatieduur, minder bloedverlies, lagere transfusiebehoefte) voor de endoscopische techniek. Vergelijkbare data worden beschreven door Arts (2018). Arts analyseert een prospectief complicatieregister waarin 120 endoscopische (waarvan 35 metopicanaad) operaties vergeleken worden met 66 open (waarvan 15 metopicanaad). Ook hij vond gelijkaardige complicatiefrequenties met duidelijk gunstiger operatieprofiel voor de endoscopische ingreep.
C) Coronanaad synostose
Minimaal invasieve technieken
Tan et al. (2013) rapporteert 11 patiënten die vroeg endoscopisch zijn behandeld en 11 laat met een open procedure, waarbij de techniekkeuze is gebaseerd op leeftijd bij verwijzing. De beoordeling van symmetrie van de orbitale rim en het gezicht door antropometrische metingen na een follow-up van 3 à 4 jaar toont betere resultaten voor alleen de gezichtssymmetrie voor de vroege endoscopische behandeling. Jimenez (2013) noemt de behandeling zeer goed wat betreft bloedverlies, opnameduur maar ook esthetisch resultaat. De orbitale dystopie zou goed gecorrigeerd worden bij de meerderheid: 51% zou zelfs een 100% correctie hebben. De korte operatietijd, kortere opnameduur en reductie in transfusiebehoefte van de minimaal invasieve techniek wordt eveneens voor corona naadsynostose beschreven door Delye et al. (2016).
Open Schedelcorrectie
De 6 jaar follow-up resultaten van fronto-orbitale remodellatie bij 207 patiënten met coronanaad tonen aan dat er geen heroperaties nodig waren vanwege verhoogde ICP (Taylor et al., 2015). Supraorbitale retrusie en temporale hollowing werden met name vanaf 5 jaar postoperatief gezien en dus zijn lange termijn studies nodig om het uiteindelijke resultaat te beoordelen.
Minimaal invasief versus open schedelcorrectie
De vergelijking van 21 en 22 patiënten die respectievelijk een endoscopische versus een open techniek ondergingen voor corona synostose gaat met name over de resterende oogheelkundige afwijkingen (MacKinnon et al., 2013). Betere oogheelkundige resultaten werden gevonden bij de endoscopische techniek, mogelijk als gevolg van de vroegere timing van de chirurgie.
Han et al. (2016) vergelijkt in een retrospectieve studie tussen 10 endoscopisch en 28 open behandelde coronanaad synostose de operatievariabelen, complicaties en reoperatie frequentie. De keuze voor techniek werd bepaald door leeftijd bij verwijzen (indien 6 maanden of ouder dan altijd open techniek), comorbiditeit en mogelijk te verwachten problemen met helmtherapie. Hij vindt voor beide technieken gelijkaardige complicatiefrequenties, met lagere re-operatie frequentie voor de groep endoscopische operaties (3/140) dan voor open operaties (10/155) en duidelijk gunstigere operatieprofiel (kortere operatieduur, minder bloedverlies, lagere transfusiebehoefte) voor de endoscopische techniek. Gelijkaardige data wordt beschreven door Arts (2018) die 120 endoscopische (waarvan 12 corona naad) operaties vergeleek met 66 open (waarvan 14 corona naad). Ook hij vond gelijkaardige complicatiefrequenties met duidelijk gunstiger operatieprofiel voor de endoscopische ingreep. Masserano et al. (2018) vergeleek de mate waarin aangezichtssymetrie en verbreding temporaal en ter hoogte van de oogkas optrad 1 jaar na endoscopisch behandelde coronanaad synostose (24 patiënten) versus open behandelde coronanaad synostose (32 patiënten). Deze 56 patiënten betreffen een selectie uit 120 patiënten met een geopereerde coronanaad synostose (95 open en 25 endoscopisch), geselecteerd op basis van de beschikbaarheid van een pre- en postoperatieve CT scan. Op welke basis een CT-scan postoperatief werd gemaakt is onduidelijk en geeft mogelijk een bias. Tevens werden de bereikte maten vergeleken met leeftijds-gematchte controles (10 controles). De vergelijking toonde aan dat de resultaten voor beide technieken gelijk waren en dat geen van beide technieken significante verbetering van temporale breedte opleverde.
D) Lambdoïdnaad synostose
Minimaal invasief versus open schedelcorrectie
Het aantal publicaties over lambdoïdnaad synostose is zeer beperkt, waarschijnlijk als gevolg van de zeer lage prevalentie. De morfologische veranderingen zijn een asymmetrie van het gelaat en een asymmetrische basale occipitale regio. Al-Jabri et al. (2014) geeft een systematic review over de resultaten van lambdoïd synostose chirurgie en outcome van 1966 tot 2013 en includeert 17 studies met tezamen 188 patiënten met lambdoïdnaad synostose. Zowel minimaal invasieve chirurgie als open schedelcorrectie worden beschreven. Faciale asymmetrie is een belangrijk item met matige correctie hiervan na operatie. Minimaal invasieve technieken worden gebruikt met de bekende voordelen ten aanzien van bloedverlies, operatietijd en opnametijd.
3. Wat zijn de patiënt-relevante effecten van een verschillende timing van de operatie, te weten ‘vroeg’, gedefinieerd als vóór de leeftijd van 6 maanden, versus ‘laat’, namelijk na de leeftijd van 6 maanden?
De timing hangt onder meer af van de toegepaste chirurgische techniek, waarbij minimaal invasieve technieken vrijwel altijd voor de leeftijd van 6 maanden worden uitgevoerd. Open schedelcorrecties worden overwegend na de leeftijd van 6 maanden verricht, maar worden ook wel als vroege procedure beschreven.
A) Sagittaalnaad synostose
Van Veelen laat zien dat het percentage papiloedeem bij scaphocephalie kinderen van gemiddeld 11 maanden oud 10% bedraagt (Van Veelen., 2015) en bij kinderen van 6 maanden oud 2,5%. Dit is een objectiveerbare reden om vroege chirurgie te bepleiten.
In Sun et al. (2018) wordt een analyse gedaan van 36 patiënten met scaphocephalie die behandeld zijn middels minimaal invasieve techniek met distractieveren waarbij op een gemiddelde leeftijd van 3,9 maanden (range 1,9 – 9,2 maanden) de leeftijd bij operatie sterk gerelateerd bleek aan de verandering in craniale index: voor elke extra maand in leeftijd nam de verandering in CI met 1,3 af (p=0.03).
B) Metopicanaad synostose
Cornelissen et al. (2017) laat zien dat de prevalentie van papiloedeem bij kinderen met trigonocephalie rond de leeftijd van 11 maanden onder de 2% ligt en dat er dus veilig kan worden gewacht tot deze leeftijd voor wat betreft risico op verhoogde ICP.
C) Coronanaad synostose
MacKinnon et al. (2013) vergelijkt 21 en 22 patiënten met vroege, endoscopische versus late, open remodellatie techniek voor corona synostose en vindt betere oogheelkundige resultaten bij de endoscopische techniek, mogelijk als gevolg van de vroegere timing van de chirurgie. Indien dit in vervolgstudies wordt bevestigd zou dit een goede reden voor vroege operatie kunnen zijn. Indien alleen mildere vormen van corona synostose een endoscopische techniek ondergingen, kan dit ook een verklaring voor de bevinding zijn.
D) Lambdoïdnaad synostose
Tegenstrijdige bevindingen worden gerapporteerd over de resultaten van chirurgie naar timing in een beperkt aantal studies in de systematic review door Al-Jabri et al. (2014).
Zoeken en selecteren
Voor de volgende specifieke vragen zijn (systematische reviews van) oorspronkelijke wetenschappelijke studies geïncludeerd:
- Wat is de indicatiestelling voor chirurgische behandeling voor metopicanaad synostose?
- Wat zijn de patiënt-relevante effecten van verschillende chirurgische technieken, met name minimaal invasieve correctie versus open schedelcorrectie voor de 4 typen unisuturale synostose?
- Wat zijn de patiënt-relevante effecten van een verschillende timing van de operatie, te weten ‘vroeg’, gedefinieerd als vóór de leeftijd van 6 maanden, versus ‘laat’, namelijk na de leeftijd van 6 maanden?
In de databases Medline (OVID) en Embase werd één overkoepelende search verricht naar studies over craniosynostose. Na ontdubbelen leverde de literatuurzoekactie 2732 treffers op.
Gezien het grote aantal studies selecteerde de voorzitter van de werkgroep eerst die studies voor, die voldeden aan de volgende algemene selectiecriteria:
|
Algemene selectie- en exclusiecriteria |
|
|
Type studies |
|
|
Follow-up duur |
|
|
Exclusiecriteria |
|
De voorgeselecteerde studies die voldeden aan de in onderstaande tabel vermelde specifieke selectiecriteria zijn opgenomen in de samenvatting van de literatuur van deze module.
|
Specifieke selectie- en exclusiecriteria |
|
|
Selectiecriteria voor indicatiestelling: |
|
Referenties
- Al-Jabri T, Eccles S. Surgical correction for unilateral lambdoid synostosis: a systematic review. J Craniofac Surg. 2014 Jul;25(4):1266-72.
- Anolik RA, Allori AC, Pourtaheri N, Rogers GF, Marcus JR. Objective assessment of the interfrontal angle for severity grading and operative decision-making in metopic synostosis. Plast Reconstr Surg. 2016 May;137(5):1548-55.
- Arab K, Fischer S, Bahtti-Softeland M, Maltese G, Kolby L, Tarnow P. Comparison Between Two Different Isolated Craniosynostosis Techniques: Does It Affect Cranial Bone Growth? J Craniofac Surg. 2016 Jul;27(5):e454-7.
- Arts S, Delye H, van Lindert EJ. Intraoperative and postoperative complications in the surgical treatment of craniosynostosis: minimally invasive versus open surgical procedures. J Neurosurg Pediatr. 2018 Feb;21(2):112-8.
- Barone CM, Jimenez DF. Plast Reconstr Surg. 1999 Dec;104(7):1965-73; discussion 1974-5.
- Bergquist CS, Nauta AC, Selden NR, Kuang AA. Age at the time of surgery and maintenance of head size in nonsyndromic sagittal craniosynostosis. Plast Reconstr Surg. 2016 May;137(5):1557-65.
- Birgfeld CB, Saltzman BS, Hing AV, Heike CL, Khanna PC, Gruss JS, Hopper RA. Making the diagnosis: Metopic ridge versus metopic craniosynostosis. J Craniofac Surg. 2013 Jan;24(1):178-85.
- Bonfield CM, Lee PS, Adamo MA, Pollack IF. Surgical treatment of sagittal synostosis by extended strip craniectomy: Cranial index, nasofrontal angle, reoperation rate, and a review of the literature. J Cranio-Maxillo-Fac Surg. 2014 Oct;42(7):1095-101.
- Cho MJ, Kane AA, Seaward JR, Hallac RR. Metopic “ridge” vs. “craniosynostosis”. Quantifying severity with 3D curvature analysis. J Craniomaxillofac Surg. 2016 Sep;44(9):1252-8.
- Chummun S, McLean NR, Flapper WJ, David DJ. The management of nonsyndromic, isolated sagittal synostosis. J Craniofac Surg. 2016 Mar;27(2):299-304.
- Cornelissen MJ, Loudon SE, van Doorn FE, Muller RP, van Veelen MC, Mathijssen IM. Very low prevalence of intracranial hypertension in trigonocephaly. Plast Reconstr Surg 2017 Jan;139(1):97e-104e.
- Delye HHK, Arts S, Borstlap WA, Blok LM, Driessen JJ, Meulstee JW, Maal TJJ, Van Lindert EJ. Endoscopically assisted craniosynostosis surgery (EACS): The craniofacial team Nijmegen experience. J Cranio-Maxillo-Fac Surg. 2016 Aug;44(8):1029-36.
- De Jong G, Tolhuisen M, Meulstee J, van der Heijden F, van Lindert E, Borstlap W, Maal T. Delye H. Radiation-free 3D head shape and volume evaluation after endoscopically assisted strip craniectomy followed by helmet therapy for trigonocephaly. J Craniomaxillofac Surg 2017 May;45(5):661-71.
- Fischer S, Maltese G, Tarnow P, Wikberg E, Bernhardt P, Kolby L. Comparison of intracranial volume and cephalic index after correcton of sagittal synostosis with spring-assisted surgery or Pi-plasty. J Craniofac Surg. 2016 Mar;27(2):410-3.
- Gerety PA, Basta MN, Fischer JP, Taylor JA. Operative management of nonsyndromic sagittal synostosis: A head-to-head meta-analysis of outcomes comparing 3 techniques. J Craniofac Surg. 2015 Jun;26(4):1251-57.
- Ghenbot RG, Patel KB, Skolnick GB, Naidoo SD, Smyth MD, Woo AS. Effects of open and endoscopic surgery on skull growth and calvarial vault volumes in sagittal synostosis. J Craniofac Surg. 2015 Jan;26(1):161-4.
- Han RH, Nguyen DC, Bruck BS, Skolnick GB, Yarbrough CK, Naidoo SD, Patel KB, Kane AA, Woo AS, Smyth MD. Characterization of complications associated with open and endoscopic craniosynostosis surgery at a single institution. J Neurosurg Pediatr 2016 Mar;17(3):361-70.
- Jimenez Early treatment of coronal synostosis with endoscopy-assisted craniectomy and postoperative cranial orthosis therapy: 16-year experience. J Neurosurg Pediatr. 2013 Sep;12(3):207-19.
- Lauritzen CGK, Davis C, Ivarson A, Sanger C, Hewitt TD. The evolving role of springs in craniofacial surgery: the first 100 clinical cases. Plast Reconstr Surg. Feb;121(2): 545-54, 2008.
- MacKinnon S, Proctor MR, Rogers GF, Meara JG, Whitecross S, Dagi LR. Improving ophthalmic outcomes in children with unilateral coronal synostosis by treatment with endoscopic strip craniectomy and helmet therapy rather than fronto-orbital advancement. J AAPOS 2013 Jun;17(3):259-65.
- Maltese G, Tarnow P, Wikberg E, Bernhardt P, Lagerlof JH, Tovetjarn R, Kolby L. Intracranial volume before and after surgical treatment for isolated metopic synostosis. J Craniofac Surg. 2014 Jan;25(1):262-6.
- Maltese G, Fischer S, Strandell A, Tarnow P, Kolby L. Springs-assisted surgery in the treatment of sagittal synostosis: A systematic review. J Plast Surg Hand Surg. 2015 Jun;49(3):177-82.
- Masserano B, Woo AS, Skolnick GB, Naidoo SD, Proctor MR, Smyth MD, Patel KB. The temporal region in unilateral coronal craniosynostosis: Fronto-orbital advancement versus endoscopy-assisted strip craniectomy. Cleft Palate Craniofac J. 2018 Mar;5(3):423-9.
- Mundinger GS, Rehim SA, Johnson III O, Zhou J, Tong A, Wallner C, Dorafshar AH. Distraction osteogenesis for surgical treatment of craniosynostosis: A systematic review. Plast Reconstr Surg. 2016 Sep;138(3):657-69.
- Nguyen DC, Patel KB, Skolnick GB, Naidoo SD, Huang AH, Smyth MD, Woo AS. Are endoscopic and open treatments of metopic synostosis equivalent in treating trigonocephaly and hypotelorism? J Craniofac Surg. 2015 Jan;26(1):129-34.
- Ridgway EB, Berry-Candelario J, Grondin RT, Rogers GF, Proctor MR. The management of sagittal synostosis using endoscopic suturectomy and postoperative helmet therapy. J Neurosurg Ped 2011 Jun;7:620-6.
- Seruya M, Shen SH, Wang LL, Penington AJ, Wray AC, Greensmith AL, Holmes AD, Chong DK. Three patterns of fronto-orbital remodelling or metopic synostosis: Comparison of cranial growth outcomes. Plast Reconstr Surg. 2014 Nov;134(5):787e-95e.
- Sun J, Ter Maaten NS, Mazzaferro DM, Wes AM, Naran S, Bartlett SP, Taylor JA. Spring-mediated cranioplasty in sagittal synostosis: does age at placement affect expansion? J Craniofac Surg 2018 Jan Epub ahead of print.
- Tan SPK, Proctor MR, Mulliken JB, Rogers GF. Early frontofacial symmetry after correction of unilateral coronal synostosis: Frontoorbital advancement vs endoscopic strip craniectomy and helmet therapy. J Craniofac Surg. 2013 Jul;24(4):1190-4.
- Taylor JA, Paliga JT, Wes AM, Tahiri Y, Goldstein JA, Whitaker LA, Bartlett SP. A critical evaluation of long-term aesthetic outcomes of fronto-orbital advancement and cranial vault remodelling in nonsyndromic unicoronal craniosynostosis. Plast Reconstr Surg. 2015 Jan;135(1):220-31.
- Teichgraeber JF, Baumgartner JE, Vivian SL, Gateno J, Xia JJ. Microscopic versus open approach to craniosynostosis: A long-term outcomes comparison. J Craniofac Surg. 2014 Jul;25(4):1245-8.
- Van Veelen ML, Eelkman Rooda OH, de Jong T, Dammers R, van Adrichem LN, Mathijssen IM. Results of early surgery for sagittal suture synostosis: long-term follow-up and the occurrence of raised intracranial pressure. Childs Nerv Syst 2013 June;29(6):997-1005.
- Van Veelen MLC, Mihajlovic D, Dammers R, Lingsma H, Van Adrichem LNA, Mathijssen IMJ. Frontobiparietal remodeling with or without a widening bridge for sagittal synostosis: comparison of 2 cohorts for aesthetic and functional outcome. J Neurosurg Pediatr. 2015 Jul;16(1):86-93.
- Van Veelen MLC, Jippes M, Carolina JCA, De Rooi J, Dirven CMF, Van Adrichem LNA, Mathijssen IMJ. Volume measurements on three-dimensional photogrammetry after extended strip versus total cranial remodelling for sagittal synostosis: A comparative cohort study. J Cranio-Maxillo-Fac Surg. 2016 Oct;44(10):1713-8.
- Van Veelen MLC, Touw C, Kamst N, Mauff K, Bredero HH, Van Adrichem L, Versnel S, Dammers R, De Jong THR, Prasad V, Mathijssen IM. Minimally invasive, spring-assisted correction of sagittal suture synostosis. Technique, outcome and complications in 83 cases. Plast Reconstr Surg. 2018 Feb;141(2):423-33.
- Wes AM, Paliga JT, Golstein JA, Whitaker LA, Bartlett SP, Taylor JA. An evaluation of complications, revisions, and long-term aesthetic outcomes in nonsyndromic metopic craniosynostosis. Plast Reconstr Surg. 2014 Jun;133(6):1453-64.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 20-03-2020
Beoordeeld op geldigheid : 17-02-2020
Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Plastische Chirurgie (NVPC) of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding geven een herzieningstraject te starten.
De NVPC is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
In 2017 tot en met 2018
Koninklijk Nederlands Genootschap voor Fysiotherapie
Landelijke Vereniging Medische Psychologie
Nederlands Instituut voor Psychologen
Nederlandse Vereniging voor Fysiotherapie in de Kinder- en Jeugdgezondheidszorg
Nederlandse Vereniging voor Kinderneurologie
Nederlandse Vereniging voor Logopedie en Foniatrie
Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
Nederlandse Vereniging voor Orthodontisten
Nederlandse Vereniging voor Psychiatrie*
Nederlandse Vereniging voor Relatie- en Gezinstherapie
Patiënten- en oudervereniging LAPOSA
* Het bestuur van de Nederlandse Vereniging voor Psychiatrie onthoudt zich van bestuurlijke autorisatie, omdat het om een zeldzame aandoening gaat waar slechts een zeer beperkt aantal centra in Nederland bij betrokken is.
In 2009 tot en met 2010
Nederlands Oogheelkundig Gezelschap
Nederlandse Vereniging voor Anesthesiologie
Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde
Nederlandse Vereniging voor Kindergeneeskunde
Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
Nederlandse Vereniging voor Neurochirurgie
Nederlandse Vereniging voor Plastische Chirurgie
Nederlandse Vereniging voor Relatie- en Gezinstherapie
Patiënten- en oudervereniging LAPOSA
Met ondersteuning van
Voor de revisie in 2017/2019
B.S. Niël-Weise, zelfstandig richtlijnmethodoloog
J.J.A. de Beer, zelfstandig richtlijnmethodoloog
In 2010
Orde van Medisch Specialisten
De revisie van de richtlijn werd ondersteund door J.J.A. de Beer, zelfstandig richtlijnmethodoloog en B. Niël-Weise, zelfstandig richtlijnmethodoloog en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van de revisie is het ontwikkelen van een up-to-date multidisciplinaire richtlijn voor de diagnostiek en behandeling van kinderen met (verdenking op) craniosynostose en de begeleiding van ouders die een kind hebben met een craniosynostose.
Doelgroep
De richtlijn is primair bedoeld voor alle zorgverleners die betrokken zijn bij de zorg voor kinderen met een craniosynostose: prenataal artsen, gynaecologen, verloskundigen, huisartsen, consultatiebureauartsen, jeugdartsen, kinderartsen, plastisch chirurgen, neurochirurgen, MKA-chirurgen, orthodontisten, oogartsen, KNO-artsen, logopedisten, anesthesiologen, klinisch genetici, neurologen, medisch psychologen, (kinder)fysiotherapeuten en maatschappelijk werkers. De secundaire doelgroep betreft de ouders en patiënten.
Samenstelling werkgroep
Voor de revisie van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg rond kinderen met craniosynostose (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende 18 maanden aan de revisie van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
In 2017 tot en met 2019 hebben de volgende personen deelgenomen aan het updaten en reviseren van de richtlijn:
Nederlandse Vereniging voor Plastische Chirurgie
- Prof. dr. I.M.J. Mathijssen, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. S.L. Versnel, Erasmus Universitair Medisch Centrum, Rotterdam
Patiënten- en oudervereniging LAPOSA
- Mw. B. Lieuwen, Msc, Ma
Nederlands Instituut voor Psychologen + Landelijke Vereniging Medische Psychologie
- Dr. J.M.E. Okkerse, Erasmus Universitair Medisch Centrum, Rotterdam
- Drs. J.J. Reuser, Radboud Universitair Medisch Centrum, Nijmegen
Nederlands Oogheelkundig Gezelschap
- Dr. S.E. Loudon, Erasmus Universitair Medisch Centrum, Rotterdam
Nederlandse Vereniging voor Anesthesiologie
- Drs. A. Gonzalez Candel, Erasmus Universitair Medisch Centrum, Rotterdam
Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde
- Dr. M.P. van der Schroeff, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Drs. H.H.W. de Gier, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Kindergeneeskunde
- Dr. K.F.M. Joosten, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Dr. N. Bannink, Franciscus Gasthuis & Vlietland, Rotterdam en Schiedam
- Drs. L.G.F.M. van ’t Hek, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Prof. dr. E.B. Wolvius, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. W.A. Borstlap, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Neurochirurgie
- Dr. M.L.C. van Veelen, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. H.H.K. Delye, Radboud Universitair Medisch Centrum, Nijmegen
- Vereniging Klinische Genetica Nederland
Vereniging Klinisch Genetische Laboratoriumdiagnostiek
- Dr. M.F. van Dooren, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. R. Pfundt, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Logopedie en Foniatrie
- Dr. M.C.J.P. Franken, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Mw. E. Kerkhofs, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Obstetrie & Gynaecologie (Prenatale geneeskunde)
- Dr. T.E. Cohen-Overbeek, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Drs. M. Woiski, Radboud Universitair Medisch Centrum, Nijmegen
- Dr S.T.H. Tjoa, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Radiologie
- Dr. M.H.G. Dremmen, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging Relatie- en Gezinstherapie
- Mw. F. Meertens, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Koninklijk Nederlands Genootschap voor Fysiotherapie/ Nederlandse Vereniging voor Fysiotherapie in de Kinder- en Jeugdgezondheidszorg
- Dr. L.A. van Vlimmeren, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Psychiatrie
- Drs. M.H.M. van Lier, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Neurologie
- prof. dr. M.A.A.P. Willemsen, Radboud Universitair Medisch Centrum, Nijmegen
Met ondersteuning van:
- Drs. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Mw. Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Voor de samenstelling van de werkgroep in 2010 en de ondersteuning:
Zie richtlijn 2010
In 2017 tot en met 2019 hebben de volgende personen deelgenomen aan het updaten en reviseren van de richtlijn:
Nederlandse Vereniging voor Plastische Chirurgie
- Prof. dr. I.M.J. Mathijssen, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. S.L. Versnel, Erasmus Universitair Medisch Centrum, Rotterdam
Patiënten- en oudervereniging LAPOSA
- Mw. B. Lieuwen, Msc, Ma
Nederlands Instituut voor Psychologen + Landelijke Vereniging Medische Psychologie
- Dr. J.M.E. Okkerse, Erasmus Universitair Medisch Centrum, Rotterdam
- Drs. J.J. Reuser, Radboud Universitair Medisch Centrum, Nijmegen
Nederlands Oogheelkundig Gezelschap
- Dr. S.E. Loudon, Erasmus Universitair Medisch Centrum, Rotterdam
Nederlandse Vereniging voor Anesthesiologie
- Drs. A. Gonzalez Candel, Erasmus Universitair Medisch Centrum, Rotterdam
Nederlandse Vereniging voor Keel-, Neus- en Oorheelkunde
- Dr. M.P. van der Schroeff, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Drs. H.H.W. de Gier, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Kindergeneeskunde
- Dr. K.F.M. Joosten, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Dr. N. Bannink, Franciscus Gasthuis & Vlietland, Rotterdam en Schiedam
- Drs. L.G.F.M. van ’t Hek, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Prof. dr. E.B. Wolvius, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. W.A. Borstlap, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Neurochirurgie
- Dr. M.L.C. van Veelen, Erasmus Universitair Medisch Centrum, Rotterdam
- Dr. H.H.K. Delye, Radboud Universitair Medisch Centrum, Nijmegen
Vereniging Klinische Genetica Nederland
- Dr. M.F. van Dooren, Erasmus Universitair Medisch Centrum, RotterdamVereniging Klinisch Genetische Laboratoriumdiagnostiek
- Dr. R. Pfundt, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Logopedie en Foniatrie
- Dr. M.C.J.P. Franken, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Mw. E. Kerkhofs, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Obstetrie & Gynaecologie (Prenatale geneeskunde)
- Dr. T.E. Cohen-Overbeek, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
- Drs. M. Woiski, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Orthodontisten
- Dr S.T.H. Tjoa, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Radiologie
- Dr. M.H.G. Dremmen, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging Relatie- en gezinstherapie
- Mw. F. Meertens, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Koninklijk Nederlands Genootschap voor Fysiotherapie/Nederlandse Vereniging voor Fysiotherapie in de Kinder- en Jeugdgezondheidszorg
- Dr. L.A. van Vlimmeren, Radboud Universitair Medisch Centrum, Nijmegen
Nederlandse Vereniging voor Psychiatrie
- Drs. M.H.M. van Lier, Erasmus Universitair Medisch Centrum/locatie Sophia, Rotterdam
Nederlandse Vereniging voor Neurologie
- Prof. dr. M.A.A.P. Willemsen, Radboud Universitair Medisch Centrum, Nijmegen
Met ondersteuning van:
- Drs. B.S. Niël-Weise, arts-microbioloog (niet praktiserend), zelfstandig richtlijnmethodoloog, Deventer
- Dr. ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht
- Drs. H. Deurenberg, SIROSS, informatiespecialist, Oss
Voor de samenstelling van de werkgroep in 2010 en de ondersteuning:
Zie richtlijn 2010
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Plastische Chirurgie, een overzicht vindt u hieronder:
|
Werkgroeplid |
Functie |
Nevenfuncties |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis Valorisatie |
Overige belangen |
|
Irene Mathijssen |
Plastisch chirurg |
geen |
geen |
geen |
Coördinator ERN cranio (onbetaald) |
Stichting Hoofdzaak |
geen |
geen |
|
Sarah Versnel |
Plastisch chirurg |
Werkgroepleider Craniofacial Dysostosis European Reference Network Zeldzame ziektes (onbetaald); Secretaris stichting Hoofdzaak voor onderzoek naar craniofaciale aandoeningen (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Barbara Lieuwen |
Voorzitter LAPOSA |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jolanda Okkerse |
Klinisch psycholoog |
Raad van advies van Stichting Eigen Gezicht (onbetaald), Raad van Advies Alopecia Vereniging (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jolanda Reuser |
GZ-psycholoog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Sjoukje Loudon |
Oogarts |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Antonia Gonzalez Candel |
Anesthesioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Marc van der Schroeff |
KNO-arts, epidemioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Jet de Gier |
KNO-arts |
geen |
geen |
geen |
Bestuurslid van de Nederlandse Vereniging voor Schisis en Craniofaciale afwijkingen (lid) |
geen |
geen |
geen |
|
Koen Joosten |
Kinderarts, intensivist |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Natalja Bannink |
Kinderarts-EAA |
Lid regionaal netwerk EAA Zuidwest Nederland Lid expertisenetwerk craniofaciale afwijkingen Lid werkgroep Beter Keten EAA Vertrouwenspersoon volleybalvereniging Inter Rijswijk
Alle nevenwerkzaamheden onbetaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Louis van ’t Hek |
Kinderarts-intensivist |
Instructeur Advanced Pediatric Life Support / Stichting Spoedeisende Hulp Kinderen (onkostenvergoeding) 2) 3-4x/ iaar korte 2 uur cursus "Herkenning en behandeling anafylaxie bij kinderen" / doelgroep: landelijke thuiszorg verpleegkundigen, die RS virus immunoprofylaxe toedienen. Betaling door Fa. Abbvie BV. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Eppo Wolvius |
MKA-chirurg |
Chair AOCMF Research & Development (betaald); lid int. Board AOCMF (betaald). |
geen |
geen |
geen |
Project Outcome Schisis gefinancieedr door LZI Theia. |
geen |
geen |
|
Wilfred Borstlap |
MKA-chirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Marie-Lise van Veelen-Vincent |
Neurochirurg |
Bestuurslid SIOP Brain Tumor Group (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Hans Delye |
Neurochirurg |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Marieke van Dooren |
Klinisch geneticus |
VKGN dagelijks bestuur, vice voorzitter |
geen |
geen |
geen |
geen |
geen |
geen |
|
R. Pfundt |
Laboratoriumspecialist klinische genetica |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Marie-Christine Franken |
Klinisch linguïst
|
Wetenschappelijk onderzoeker (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
E. Kerkhofs |
Logopedist |
Bestuur werkgroep logopedie NVSCA (onbetaald); Ontwikkelen logopedie game Ipad voor kinderen met een schisis (onderdeel werk); WPM schisisteam Nijmegen (onderdeel werk). |
geen |
geen |
geen |
geen |
geen |
geen |
|
Titia Cohen-Overbeek |
Arts prenatale geneeskunde |
Member Basis Training Task Force of the International Society Utrasound Obstetrics & Gynaecology (ISUOG) (onbetaald); voorzitter Raad van Advies van de Stichting prenatale Screening Zuidwest Nederland (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Mallory Woiski |
Gynaecoloog - perinatoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Stephen Tjoa |
Orthodontist |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Marjolein Dremmen |
Radioloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Francien Meertens |
Systeemtherapeut/maatschappelijk werker |
Systeemtherapeut psychotherapie praktijk Drechtsteden, betaald |
geen |
geen |
geen |
geen |
geen |
geen |
|
Leo van Vlimmeren |
Kinderfysiotherapeut |
Docent en organisator workshops zuigelingenasymmetrie voor kinderfysiotherapeuten (betaald) Lid congrescommissie NVFK [kinderfysiotherapie] (onbetaald) Lid landelijke werkgroep wiegendood (onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
|
Monique van Lier |
Kinder- en jeugdpsychiater /-psychotherapeut |
Deelnemer expertisegroep IMH Kenniscentrum Kinder- en Jeugdpsychiatrie, onbetaald |
geen |
geen |
Deelname aan craniofaciaal centrum in Erasmus MC-Sophia Rotterdam |
geen |
geen |
geen |
|
Michèl Willemsen |
Hoogleraar kinderneurologie |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
|
Hans de Beer |
richtlijnmethodoloog
|
Lid GRADE Working Group. Lid Guidance committee GRADE network Netherlands. Alle onbetaald. |
geen |
geen |
geen |
geen |
geen |
geen |
|
Barbara Niël-Weise |
richtlijnmethodoloog |
geen |
geen |
geen |
geen |
geen |
geen |
geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door in de voorbereidende fase de Patiëntenfederatie Nederland te vragen om schriftelijke input omtrent knelpunten en aandachtspunten. Zij hebben het verzoek voor het aanleveren van knelpunten doorgestuurd naar LAPOSA en Stichting Kind en Ziekenhuis. Er werden geen knelpunten aangedragen. Tevens had de voorzitter van LAPOSA zitting in de werkgroep. Tijdens de commentaarfase werd de conceptrichtlijn ook voorgelegd aan de Patiëntenfederatie Nederland, LAPOSA en Stichting Kind en Ziekenhuis.
Ter info: bij de ontwikkeling van de richtlijn in 2010 werd een focusgroepbijeenkomst georganiseerd dit verslag is nog steeds geldig.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie het implementatieplan).
Werkwijze
Werkwijze in 2010
De onderbouwing van de richtlijn is gebaseerd op bewijs uit gepubliceerd wetenschappelijk onderzoek. Relevante artikelen werden gezocht door het verrichten van systematische zoekacties. Er werd gezocht in Medline en Embase en de Cochrane Library. Tevens werd specifiek gezocht naar al bestaande richtlijnen in online raadpleegbare (inter)nationale guideline clearinghouses.
Hierbij werd de taal gelimiteerd tot Nederlands, Engels en Frans. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur. Dit leverde bij enkele uitgangsvragen nog aanvullende artikelen op.
Zorg voor kinderen met craniosynostose is gestart eind jaren ‘60 en dus is de Engelstalige literatuur vanaf die tijd geïncludeerd. De searches zijn verricht tot 1 december 2009 waarbij artikelen die beschikbaar waren als “Epub ahead of publication” werden meegenomen.
Voor alle uitgangsvragen is gebruik gemaakt van een uniforme formulering van de patiëntencategorie.
De gehanteerde zoektermen zijn: craniofacial, craniosynostosis gecombineerd met: genetics, hydrocephalus, Chiari, cerebral pressure, otitis, hearing, vision, psychology, anesthesia, complications, infection, development, growth, maxilla, mandible, distraction, osteotomy, Fort, midface, RED, halo, monobloc, facial bipartition, median faciotomy, hypertelorism.
Op verzoek zijn de volledige zoekstrategieën beschikbaar. Daarnaast werden artikelen geëxtraheerd uit referentielijsten van opgevraagde literatuur en zijn enkele relevante publicaties tot 1 november 2009 meegenomen. Lopend onderzoek is buiten beschouwing gelaten. Onder samenvatting van de literatuur / conclusies worden alleen gepubliceerde onderzoeken / richtlijnen uitgewerkt. Case reports en letters zijn uitgesloten, tenzij het een vermelding van een complicatie betrof.
De geselecteerde artikelen zijn beoordeeld op kwaliteit van het onderzoek en gegradeerd naar mate van bewijs. Hierbij is de standaardindeling gebruikt: zie tabel 1. Na selectie bleven de artikelen over die als onderbouwing bij de verschillende conclusies staan vermeld. De beoordeling van de verschillende artikelen is opgenomen onder het kopje ‘samenvatting van de literatuur’. Het wetenschappelijk bewijs is vervolgens kort samengevat in een ‘conclusie’. De belangrijkste literatuur waarop deze conclusie is gebaseerd staat bij de conclusie vermeld, inclusief de mate van bewijs (zie tabel 2).
Voor het formuleren van een aanbeveling zijn er naast het wetenschappelijk bewijs vaak nog andere aspecten van belang, bijvoorbeeld patiëntenvoorkeuren (afgeleid uit de resultaten van de focusgroep besprekingen of relevante literatuur met betrekking tot het patiënten perspectief), kosten, beschikbaarheid of organisatorische aspecten. Deze aspecten worden, voor zover niet wetenschappelijk onderzocht, vermeld onder het kopje ‘overwegingen’. In de overige overwegingen spelen de ervaring en de mening van de werkgroepleden een belangrijke rol. De ‘aanbeveling’ is het resultaat van de combinatie van het beschikbare bewijs en de overige overwegingen.
Tabel 1: Indeling van methodologische kwaliteit van individuele studies
|
|
Diagnostische accuratesse onderzoek |
Schade of bijwerkingen, etiologie, prognose* |
|
|
A1 |
Systematische review van tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van A2-niveau |
||
|
A2 |
Gerandomiseerd dubbelblind vergelijkend klinisch onderzoek van goede kwaliteit van voldoende omvang |
Onderzoek ten opzichte van een referentietest (een ‘gouden standaard’) met tevoren gedefinieerde afkapwaarden en onafhankelijke beoordeling van de resultaten van test en gouden standaard, betreffende een voldoende grote serie van opeenvolgende patiënten die allen de index- en referentietest hebben gehad |
Prospectief cohort onderzoek van voldoende omvang en follow-up, waarbij adequaat gecontroleerd is voor ‘confounding’ en selectieve follow-up voldoende is uitgesloten |
|
B |
Vergelijkend onderzoek, maar niet met alle kenmerken als genoemd onder A2 (hieronder valt ook patiënt-controleonderzoek, cohort onderzoek) |
Onderzoek ten opzichte van een referentietest, maar niet met alle kenmerken die onder A2 zijn genoemd |
Prospectief cohort onderzoek, maar niet met alle kenmerken als genoemd onder A2 of retrospectief cohort onderzoek of patiënt-controle onderzoek |
|
C |
Niet-vergelijkend onderzoek |
||
|
D |
Mening van deskundigen |
||
* Deze classificatie is alleen van toepassing in situaties waarin om ethische of andere redenen gecontroleerde trials niet mogelijk zijn. Zijn die wel mogelijk dan geldt de classificatie voor interventies.
Tabel 2: Niveau van bewijs van de conclusie
|
Conclusie gebaseerd op: |
|
|
1 |
Onderzoek van niveau A1 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau A2 |
|
2 |
Eén onderzoek van niveau A2 of tenminste twee onafhankelijk van elkaar uitgevoerde onderzoeken van niveau B |
|
3 |
Eén onderzoek van niveau B of C |
|
4 |
Mening van deskundigen |
Werkwijze in 2017/18
AGREE
Deze richtlijn is gereviseerd conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II), dat een internationaal breed geaccepteerd instrument is en op ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit van richtlijnen.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter en de adviseurs van de werkgroep de knelpunten en stelden zij een concept raamwerk (= nieuwe onderwerpen en te reviseren onderwerpen) op. Dit concept werd vervolgens aan de werkgroep voorgelegd met de vraag voor schriftelijke input. Tijdens de eerste werkgroepvergadering werd dit concept besproken. Tegelijk werd aan de volgende stakeholderpartijen input gevraagd omtrent gepercipieerde knelpunten en aandachtspunten van medisch-inhoudelijke, organisatorische en financiële aard voor de te reviseren en te updaten richtlijn: Zorginstituut Nederland, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Zorgautoriteit, Patiëntenfederatie Nederland, LAPOSA, Stichting Kind en Ziekenhuis, Nederlands Huisartsen Genootschap, Zorgverzekeraars Nederland, Nederlandse Federatie van Universitair Medische Centra en Samenwerkende topklinische ziekenhuizen.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseurs concept uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld.
Voor de nieuwe uitgangsvragen (3.1; 3.5 en 13.2)
Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken.
Strategie voor zoeken en selecteren van literatuur
Er werd oriënterend gezocht naar bestaande buitenlandse richtlijnen en naar systematische reviews. De zoekactie of gebruikte trefwoorden van de zoekactie zijn te vinden in de zoekverantwoording.
Voor de nieuwe uitgangsvragen:
Omdat werd besloten dat voor de vragen 3.1 en 3.5 systematisch literatuuronderzoek niet zinvol was, werd alleen voor 13.2 systematisch naar literatuur gezocht. Hiertoe werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met wat studieopzet betreft de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de module van desbetreffende uitgangsvraag.
Voor het updaten van de bestaande uitgangsvragen
Er werd één overkoepelende systematische search verricht in de databases van Medline en Embase. Op basis van algemene selectiecriteria heeft de voorzitter van de werkgroep voor alle uitgangsvragen de relevante literatuur voorgeselecteerd. Op basis van specifieke selectiecriteria maakten de werkgroepleden een definitieve selectie. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in de zoekverantwoording.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen zijn te vinden in de methodologische checklijsten.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen (voor de nieuwe uitgangsvraag). De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Beoordelen van de kracht van het wetenschappelijke bewijs
Voor de nieuwe uitgangsvragen (13.2):
Een methodoloog beoordeelde de kwaliteit van bewijs (‘quality of evidence’) met behulp van GRADE (Guyatt et al., 2008). GRADE is een methode die per uitkomstmaat van een interventie, of voor een risico- of prognostische factor, een gradering aan de kwaliteit van bewijs toekent op basis van de mate van vertrouwen in de schatting van de effectgrootte (tabel 3 en 4).
Tabel 3 Indeling van de kwaliteit van bewijs (Eng: quality / certainty of evidence) volgens GRADE
|
Hoog |
Er is veel vertrouwen dat het werkelijke effect dicht in de buurt ligt van het geschatte effect. |
|
|
|
|
Matig |
Er is matig vertrouwen in het geschatte effect: het werkelijk effect ligt waarschijnlijk dicht bij het geschatte effect, maar er is een mogelijkheid dat het hiervan substantieel afwijkt. |
|
|
|
|
Laag |
Er is beperkt vertrouwen in het geschatte effect: het werkelijke effect kan substantieel verschillen van het geschatte effect. |
|
|
|
|
Zeer laag |
Er is weinig vertrouwen in het geschatte effect: het werkelijke effect wijkt waarschijnlijk substantieel af van het geschatte effect. |
Tabel 4 De kwaliteit van bewijs (Eng: quality / certainty of the evidence/ confidence in the effect estimate) wordt bepaald op basis van de volgende criteria
|
Type bewijs |
Voor studies over interventies: RCT start in de categorie ‘hoog’. Observationele studie start in de categorie ‘laag’. Alle overige studietypen starten in de categorie ‘zeer laag’.
Voor studies over een risico- of prognostische factor: Prospectieve of retrospectieve cohortstudie start in de categorie ‘hoog’. Voor andere studieontwerpen wordt afgewaardeerd via ‘risk of bias’. |
|
|
|
|
|
|
Afwaarderen |
‘Risk of bias’ |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Inconsistentie |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Indirect bewijs |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Onnauwkeurigheid |
- 1 ernstig - 2 zeer ernstig |
|
|
|
|
|
|
Publicatiebias |
- 1 waarschijnlijk - 2 zeer waarschijnlijk |
|
|
|
|
|
|
|
|
|
Opwaarderen |
Groot effect |
+ 1 groot + 2 zeer groot |
|
|
|
|
|
|
Dosis-respons relatie |
+ 1 bewijs voor gradiënt |
|
|
|
|
|
|
Alle plausibele residuele ‘confounding’[1] |
+ 1 zou een effect kunnen reduceren + 1 zou een tegengesteld effect kunnen suggereren terwijl de resultaten geen effect laten zien. |
Voor het updaten van de bestaande uitgangsvragen
De werkgroepleden bepaalden zelf de bewijskracht van de conclusie volgens de gebruikelijke EBRO-methode conform tabel 1 en 2 (van Everdingen et al, 2004). Zo nodig, werden de werkgroepleden ondersteund door een methodoloog.
Formuleren van de conclusies
Voor de nieuwe uitgangsvragen:
Een conclusie verwijst niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence) en per uitkomstmaat.
Voor het updaten van de bestaande uitgangsvragen
Het wetenschappelijke bewijs is samengevat in een of meerdere conclusies, waarvan het niveau is gebaseerd op de beste bewijskracht van de relevante studies.
Overwegingen
Om tot een aanbeveling te komen zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie, of over de effectgrootte van een risico- of prognostische factor, vaak nog andere aspecten van belang.
Naast de afweging van gunstige en ongunstige effecten kunnen genoemd worden:
- kosten,
- waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- balans van gewenste en ongewenste effecten van interventies,
- aanvaardbaarheid van interventies,
- haalbaarheid van een aanbeveling.
Bij voorkeur wordt, afgezien van de balans van gewenste en ongewenste effecten van interventies, ook voor deze aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Deze aspecten worden besproken na de ‘conclusie’ onder het kopje ‘overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de EBRO- en de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module ‘Criteria craniosynostose expertisecentrum en teamleden’.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn werden er interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. Hiervoor werd gebruik gemaakt van de methodiek zoals beschreven in Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in de Kennislacunes.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken wetenschappelijke verenigingen voorgelegd voor commentaar. Tevens werd de richtlijn voorgelegd aan de volgende organisaties ter becommentariëring: Zorginstituut Nederland, Inspectie voor de Gezondheidszorg en Jeugd, Nederlandse Zorgautoriteit, Patiëntenfederatie Nederland, LAPOSA, Stichting Kind en Ziekenhuis, Nederlands Huisartsen Genootschap, Zorgverzekeraars Nederland, Nederlandse Federatie van Universitair Medische Centra en Samenwerkende topklinische ziekenhuizen. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor autorisatie en door hen geautoriseerd.
Literatuurlijst
Guyatt et al., 2008Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ; GRADE Working Group (2008). GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 336: 924-6.
Programm für Nationale VersorgungsLeitlinien von BÄK, KBV und AWMF Qualitätsindikatoren. Manual für Autoren: 6. Qualitätsindikatoren für Nationale VersorgungsLeitlinien (2009)
[1] Dit criterium wordt sporadisch toegepast. Soms doet zich de situatie voor dat alle plausibele ‘confounders’ (variabelen die vertekening van resultaten veroorzaken) waarvoor in ‘high-quality’ observationele studies niet is gecorrigeerd (residuele ‘confounders’) zouden resulteren in een onderschatting van een ogenschijnlijk behandeleffect. Als bijvoorbeeld alleen ziekere patienten een experimentele behandeling ondergaan, en ze toch beter af zijn, dan is het waarschijnlijk dat het werkelijke behandeleffect zelfs groter is dan de data suggereren. Een analoge situatie doet zich voor wanneer observationele studies geen behandeleffect laten zien.
Zoekverantwoording
Oriënterende search
Database: MEDLINE <1946 to Present, updated daily>
Search Strategy:
--------------------------------------------------------------------------------
1 Craniosynostoses/ (4177)
2 craniosynost*.ti,ab. (3705)
3 craniosynost*.kf. (473)
4 (synost* and skull*).ti,ab. (409)
5 Craniofacial Abnormalities/ (4976)
6 Skull/ab [Abnormalities] (4181)
7 or/1-6 (13734)
8 (dutch or german or french or english).la. (24648574)
9 (animals not humans).sh. (4352462)
10 7 not 9 (12633)
11 8 and 10 (11628)
12 11 (11628)
13 limit 12 to yr="2009 -Current" (3738)
14 guideline/ or practice guideline/ (29716)
15 guideline?.ti,ab. (263589)
16 guideline?.ti. (63073)
17 guideline?.kf. (7264)
18 14 or 16 or 17 (84274)
19 13 and 18 (7)
Database: Embase <1974 to 2017 April 14>
Search Strategy:
--------------------------------------------------------------------------------
1 Craniosynostoses/ (3672)
2 craniosynost*.ti,ab. (4498)
3 (synost* and skull*).ti,ab. (503)
4 (dutch or german or french or english).la. (27774599)
5 craniosynost*.kw. (1808)
6 practice guideline/ (316127)
7 guidelin?.ti. (14801)
8 guidelin*.kw. (26530)
9 or/6-8 (326660)
10 crouzon syndrome/ (2211)
11 ((crouzon or pfeiffer or mu?nke) adj3 syndrom*).ti,ab. (934)
12 1 or 2 or 3 or 5 or 10 or 11 (7981)
13 4 and 12 (7282)
14 13 (7282)
15 limit 14 to yr="2009 -Current" (2946)
16 9 and 15 (17)
database: MEDLINE <1946 to Present, updated daily>
Search Strategy:
--------------------------------------------------------------------------------
1 (dutch or german or english).la. (23957500)
2 (animals not humans).sh. (4353447)
3 guideline/ or practice guideline/ (29728)
4 guideline?.ti,ab. (263887)
5 guideline?.ti. (63128)
6 guideline?.kf. (7291)
7 3 or 5 or 6 (84349)
8 craniofacial.tw. (19809)
9 craniosynost*.ti. (1921)
10 craniosynostoses/ or acrocephalosyndactylia/ (5311)
11 craniosynost*.kf. (475)
12 acrocephalosyndactyli*.kf. (33)
13 9 or 10 or 11 or 12 (5694)
14 craniosynost*.tw. (3708)
15 13 or 14 (6421)
16 1 and 15 (5744)
17 16 not 2 (5388)
18 17 (5388)
19 limit 18 to yr="2009 -Current" (2174)
Database: Embase <1974 to 2017 April 18>
Search Strategy:
--------------------------------------------------------------------------------
1 (dutch or german or english).la. (26994938)
2 craniofacial synostosis/ (6239)
3 acrocephalosyndactyly/ (2178)
4 craniosynost*.tw. (4506)
5 craniosynost*.kw. (1810)
6 acrocephalosyndactylia.tw. (54)
7 acrocephalosyndactylia.kw. (13)
8 or/2-7 (8059)
9 1 and 8 (7274)
10 animal/ (1760092)
11 human/ (18679533)
12 10 not (10 and 11) (1338035)
13 9 not 12 (7186)
14 13 (7186)
15 limit 14 to yr="2009 -Current" (3430)
16 letter.pt. (987377)
17 15 not 16 (3294)
18 practice guideline/ (316468)
19 guideline*.ti. (82216)
20 guideline*.kw. (26571)
21 or/18-20 (347662)
22 17 and 21 (28)
23 limit 17 to embase status (431)
24 limit 17 to article (2065)
25 24 not 22 (2058)

