Vitamine D
Uitgangsvraag
Wat is de plaats van vitamine D bij de behandeling van patiënten met COVID-19?
Aanbeveling
Gebruik vitamine D niet als behandeling van COVID-19
Opmerking: voor aanbevelingen ten aanzien van het gebruik van vitamine D in de populatie wordt u verwezen naar het advies van de Gezondheidsraad
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de verschillen in klinische uitkomsten tussen behandeling met en zonder vitamine D. Tot en met 30 september 2021 werden er 3 gerandomiseerde gecontroleerde studies (RCT’s) gevonden in patiënten die waren opgenomen in het ziekenhuis (n=259 in de interventiegroep en n=243 in de controlegroep) en 1 RCT bij patiënten buiten het ziekenhuis.
De geïncludeerde studies onderzochten verschillende preparaten van vitamine D: veelal gespecificeerd naar de specifieke vorm van vitamine D3 (genoemd vitamine D3 ofwel colecalciferol, calcifediol (vitamine D dat in de lever is omgezet in 25-hydroxyvitamine D) of calcitriol (het actieve 1,25-dihydroxycolecalciferol)). Daarnaast waren zowel de dosering als de frequentie van toediening variabel.
Er werden alleen randomiseerde trials geïncludeerd in de analyse, waardoor de kwaliteit van bewijs initieel hoog was. Omdat de studies een relatief kleine populatie includeerden en omdat er mede hierdoor een grote spreiding van het betrouwbaarheidsinterval rondom de puntschatter van de uitkomstmaat was (imprecision), werd de kwaliteit van dit bewijs naar beneden bijgesteld. Daarnaast waren er twee open-label trials (Elamir, 2021; Enteras Castillo, 2020) met een mogelijk risico op vertekening van de studieresultaten (risk of bias) bij subjectieve uitkomstmaten. Ook om deze reden werd de kwaliteit van dit bewijs waar nodig naar beneden bijgesteld.
Vitamine D bij patiënten die waren opgenomen in het ziekenhuis
Op basis van de drie geïncludeerde studies (Elamir, 2021; Enteras Castillo, 2020; Murai, 2021) zijn we onzeker over het effect van behandeling met vitamine D op de cruciale uitkomstmaat mortaliteit. De bewijskracht is, bij beoordeling volgens de GRADE methodiek, ‘zeer laag’. Er is dus sprake van een kennislacune. Bij een gepoolde analyse van drie studies, werd er met zeer lage zekerheid een voordeel aangetoond van vitamine D (risico verschil -4% op de mortaliteit; 95% CI -13 tot 5%). Echter, de grootste en best uitgevoerde studie van Murai (2021) liet geen voordeel van vitamine D op de mortaliteit zien. Deze Braziliaanse studie liet ook geen verschil zien in opnameduur of de noodzaak tot mechanische ventilatie. Wel werd er een stijging van het serum vitamine D vastgesteld.
Vitamine D bij ambulante patiënten
Op basis van één geïncludeerde Indiase studie (Rastogi, 2020) konden er geen conclusies getrokken worden over het effect van vitamine D op de vooraf geformuleerde uitkomstmaten zoals mortaliteit, kans op opname in het ziekenhuis of extra zuurstofbehoefte of resolutie van klachten. Wel werd er gekeken naar de virale klaring. In deze studie werden opgenomen patiënten met milde of asymptomatische COVID-19 behandeld met colecalciferol wanneer de patiënten bij opname vitamine D deficiënt waren (25 [OH] vitamine D spiegel <20 ng/ml). Patiënten kregen dagelijks 60.000 IU colecalciferol of placebo. Op dag 21 waren meer patiënten in de colecalciferol-groep SARS-CoV2 negatief. Deze studie had echter kleine patiënten aantallen en patiënten met significante comorbiditeiten weren geëxcludeerd, waardoor de populatie zich niet goed laat vergelijken met de opgenomen populatie in Nederland.
Overig beschikbaar onderzoek
Over de rol van vitamine D bij COVID-19 zijn ook een groot aantal observationele studies gepubliceerd met forse methodologische beperkingen. Zo keken een drietal studies naar de relatie tussen 25 (OH) vitamine D spiegels en het risico op het krijgen van (een ernstig beloop van) COVID-19 (Abdollahi, 2020; De Smet, 2020; Luo, 2021). Hierbij werden patiënten met een (ernstige) COVID-19 retrospectief gematcht aan patiënten zonder COVID-19 of met een milder beloop. De spiegel van 25 (OH) vitamine D bleek statistisch significant lager bij patiënten met ernstige COVID, maar verschilde in alle genoemde studies in absolute zin minder dan 4 ng/ml tussen de verschillende groepen. De klinische relevantie van een dergelijk klein verschil is twijfelachtig. Daarnaast zijn de comorbiditeiten onvoldoende gerapporteerd in de studies, waardoor een vergelijking op basis van andere risicofactoren voor het krijgen van (ernstige) COVID niet te maken is. Of een lagere 25 (OH) vitamine D spiegel een verhoogd risico geeft op het krijgen van een ernstiger beloop van COVID-19 valt derhalve niet te zeggen.
In een groot genetisch cohortonderzoek (biobank van > 400.000 witte Britse en > 40.000 Europese mensen) kon door middel van “Mendelian randomisation” geen associatie van (ernst van) COVID-19 met vitamine D spiegels en single-nucleotide polymorphisms (SNP’s) die geassocieerd zijn met lage vitamine D spiegels worden aangetoond (Butler-Laporte, 2021). Dit zou te verwachten zijn als er een invloed op de ziekte zou bestaan. Echter was de vrije fractie van vitamine D niet bekend in dit cohort en er is op basis van deze data ook geen uitspraak over een echte vitamine D deficiëntie mogelijk.
In maart 2021 sprak ook de Gezondheidsraad zich uit over de toevoeging van vitamine D aan de behandeling van COVID-19. Zij concludeerden dat er op dat moment te weinig bewijs was om een uitspraak te doen over een eventuele aanbeveling van extra vitamine D. Wel benadrukken zij dat een deel van de Nederlandse bevolking in aanmerking komt voor ‘reguliere’ suppletie van het vitamine D. Zie voor deze indicaties het rapport van de Gezondheidsraad uit 2008.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Op grond van de bekende onderzoeksgegevens wordt vitamine D niet aanbevolen als behandeling van COVID-19. Behandeling met vitamine D is wel relatief veilig, al zijn ernstige bijwerkingen als hypercalciëmie en hypercalciurie gemeld. Ondanks het advies om vitamine D niet te gebruiken als behandeling van COVID-19, verwachten wij dat patiënten bij hun waardering van vitamine D ook hun persoonlijke voorkeur en maatschappelijke beeldvorming zullen laten meewegen.
Kosten (middelenbeslag)
Gezien het gebrek aan effectiviteit wordt vitamine D niet aanbevolen als behandeling van COVID-19.
Aanvaardbaarheid, haalbaarheid en implementatie
Vitamine D wordt niet aanbevolen als behandeling van COVID-19, dus de werkgroep voorziet geen problemen qua implementatie.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Op dit moment zijn er onvoldoende data om het gebruik van vitamine D aan- of af te raden in de behandeling of preventie van patiënten met COVID-19.
Er blijft wel indicatie voor vitamine D suppletie met bekende doseringen buiten de indicatie van bescherming tegen COVID-19, zoals dit door de Gezondheidsraad wordt geadviseerd voor grote groepen in de bevolking.
Onderbouwing
Achtergrond
De vitamine D receptor komt tot expressie in immuuncellen, zoals B cel, T cel en antigeen-presenterende cellen, waardoor vitamine D de potentie heeft om de aangeboren en verworven immuniteit te moduleren (Aranow, 2011). In observationeel onderzoek is aangetoond dat vitamine D suppletie het aantal regulerende T cellen verhoogt en een verbeterde T cel activiteit geeft in gezonde vrijwilligers en mensen met auto-immuun ziektes (Fisher, 2019). Een lage vitamine D spiegel is geassocieerd met een hoger risico op een community-acquired pneumonie (CAP) bij zowel volwassenen als kinderen (Lu, 2017; Science, 2013). Ook een meta-analyse toonde dat vitamine D suppletie beschermt tegen het ontstaan van acute respiratoire infecties (Martineau, 2017). Echter, in twee gerandomiseerde, dubbelblinde, placebo-gecontroleerde onderzoeken leidde het toedienen van hoge dosis vitamine D aan zeer ernstig zieke patiënten met vitamine D deficiëntie niet tot een verkorting van de opnameduur of een verlaging van de mortaliteit ten opzichte van placebo (Amrein, 2014; Ginde, 2019). Daarnaast kunnen hoge spiegels van vitamine D leiden tot hypercalciëmie en nefrocalcinose (Del Valle, 2011).
Inmiddels hebben diverse gerandomiseerde gecontroleerde studies (RCT’s) de effectiviteit van vitamine D onderzocht om de plaats van dit middel bij de behandeling van COVID-19 patiënten te bepalen. Klinische dose-finding studies zijn in deze setting nooit verricht.
Conclusies / Summary of Findings
Conclusions hospitalized COVID-19 patients
Mortality (crucial)
|
Very low GRADE
|
The evidence is very uncertain about the effect of treatment with vitamin D on mortality when compared with treatment without vitamin D in hospitalized patients with COVID-19. Sources: Entrenas Castillo, 2020; Murai, 2021 and Elamir, 2021 |
Extensive respiratory support (crucial)
|
Very low GRADE
|
The evidence is very uncertain about the effect of treatment with vitamin D on extensive respiratory support when compared with treatment without vitamin D in hospitalized patients with COVID-19.
Source: Murai, 2021 and Elamir, 2021 |
Duration of hospitalization (important)
|
Low GRADE
|
Treatment with vitamin D may result in little to no difference in length of stay when compared with treatment without vitamin D in hospitalized patients with COVID-19. Source: Murai, 2021 and Elamir, 2021 |
Time to clinical improvement (important)
|
- GRADE |
No evidence was found regarding the effect of treatment with vitamin D on time to clinical improvement when compared to treatment without vitamin D in hospitalized patients with COVID-19.
Source: - |
Treatment with vitamin D in non-hospitalized COVID-19 patients
Rastogi (2020) did not report on the crucial outcome measure mortality nor on the important outcome measures respiratory support, hospitalization and time to clinical improvement. Therefore, it is not possible to conclude on the effect of treatment with vitamin D on mortality, respiratory support, hospitalization and time clinical improvement in non-hospitalized patients with mild COVID-19 and vitamin D deficiency (<20 ng/ml).
|
- GRADE |
No conclusions can be drawn about the effect of treatment with vitamin D, compared with treatment without vitamin D in non-hospitalized patients, because no studies were found that reported relevant outcomes for the comparison. |
Samenvatting literatuur
Treatment with vitamin D in hospitalized COVID-19 patients
Elamir (2021) described an open-label, pilot randomized clinical trial, which was performed in Israel. Elamir (2021) studied the efficacy and safety of calcitriol supplementation in hospitalized patients with moderate COVID-19 disease. They included hospitalized adults with COVID-19 disease. Patients in the intervention group received a daily dose of 0.5 μg calcitriol for 14 days or until hospital discharge, plus standard of care. Patients in the control group received standard of care. Standard of care may include supplemental O2, treatment with remdesivir (200 mg for one day followed by 100 mg for four days, 15% of the people in the intervention group and 11% of the control group received remdesivir), dexamethasone (6 mg daily for ten days, 13% of the people in the intervention group and 12% in the control group received dexamethasone), or convalescent plasma (less than 5% in both groups). The primary outcome measure was SaO2/FIO2. In the intervention group the average (±SD) increase in SaO2/FIO2 was 91.04±119.08, compared to an increase of 13.2±127.7 in the control group. No postintervention scores were reported. Besides, the following relevant outcome measures were reported: mortality, extensive respiratory support, duration of hospitalization.
Entrenas Castillo (2020) described an open-label, double-masked pilot randomized clinical trial, which was performed in Spain. This was a pilot study prior to carrying out the COVIDIOL-trial. Entrenas Castillo (2020) studied the efficacy of vitamin D supplementation in hospitalized patients with moderate or severe COVID-19 disease. They included non-pregnant patients ≥ 18 years with COVID-19 clinical picture of acute respiratory infection, confirmed by radiographic pattern of viral pneumonia and a positive COVID-19 PCR test with CURB-65 severity scale. Patients in the intervention group (n=50) received calcifediol (0.532 mg on day 0 and 0.266 mg on day 3, day 7 and then weekly), plus standard of care. Patients in the control group (n=26) received standard of care. Standard of care consisted of hydroxychloroquine (400 mg every 12 h on day 1, 200 mg every 12 h for day 2-6), azithromycin (500 mg orally for 5 days) and for patients with pneumonia and NEWS score≥5, a broad spectrum antibiotic was added. Patients were followed until hospital discharge or death. The primary outcome measures were admission to the intensive care unit (ICU) and mortality. In the intervention group 0/50 patients died, compared to 2/26 (7.7%) patients in the control group. The risk difference (RD) (95%CI) was -0.08 (-0.19 to 0.04), in favour of the intervention group. In the intervention group 1/50 (2.0%) patient was referred to the ICU, compared to 13/26 (50.0%) patients in the control group. The RD (95%CI) was -0.48 (-0.68 to -0.28), in favour of the intervention group. No other relevant outcome measures were reported.
Murai (2021) described an multi-center, double-blind, placebo-controlled randomized clinical trial, which was performed in Brazil. Murai (2021) studied the efficacy and safety of vitamin D supplementation in hospitalized patients with moderate or severe COVID-19 disease. They included patients ≥ 18 years with a positive COVID-19 PCR test or CT scan findings compatible with the disease and diagnosis of flu syndrome with institutional criteria for hospitalization on hospital admission (respiratory rate > 24/min, saturation <93% or risk factors for complications). Patients in the intervention group (n=119) received an oral dose of 200.000 IU of vitamin D, plus standard of care. The control group (n=188) received placebo, on top of standard of care. Standard of care was not further described. Patients were followed until hospital discharge. The primary outcome was duration of hospitalization. In the intervention group the median (IQR) duration of hospitalization was 7 (4 to 10) days, compared to 7 (5 to 13) days in the control group. Besides, the following relevant outcome measures were reported: mortality (in-hospital), respiratory support.
Table 1. Overview of RCTs comparing vitamin D with standard of care in hospitalized COVID-19 patients.
|
Author |
Disease severity |
Vitamin D level at inclusion |
Sample size |
Dosage |
|
Elamir, 2021 |
Moderate |
No criteria |
I: 25 C: 25 Total: 50 |
Daily dose of 0.5 μg calcitriol for 14 days or until discharge. |
|
Entrenas Castillo, 2020 |
Moderate to severe |
No criteria |
I: 50 C: 26 Total: 76 |
Dose of 0.532 mg calcifediol on day 0 and of 0.266 mg on day 3 and 7, and then weekly until discharge or ICU admission. |
|
Murai, 2021 |
Moderate to severe |
No criteria |
I: 119 C: 118 Total: 237 |
Single dose of 200000 IU vitamin D3
|
Results
Elamir (2021), Entrenas Castillo (2020) and Murai (2021) did not report on the important outcome measure time to clinical improvement.
Mortality (crucial)
Elamir (2021), Enteras Castillo (2020) and Murai (2021), reported on the outcome measure mortality. Murai (2021) and Entrenas Castillo (2020) reported on mortality until hospital discharge. Elamir (2021) did not report on the follow-up period. In total, 9/194 (4.6%) patients in the intervention groups died, compared to 11/169 (6.5%) patients in the control group (Figure 1). The risk difference (RD) (95%CI) was -0.04 (-0.13 to 0.05), in favour of the intervention group. This difference is considered clinically relevant.
Figure 1: Mortality in hospitalized patients
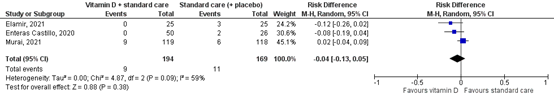
Z: p-value of overall effect; df: degrees of freedom; I2: statistical heterogeneity; CI: confidence interval
Because of study heterogeneity and small sample sizes, we do not report mortality stratified according to disease severity.
Level of evidence of the literature
The evidence for the outcome measure mortality comes from RCTs and therefore started at high certainty. The level of evidence was downgraded to very low. There was risk of bias (unclear allocation concealment, baseline differences and selective reporting of results, downgraded one level for risk of bias). Furthermore, the effect estimate (95%CI) crossed the thresholds for clinical relevance (downgraded two levels for imprecision).
Extensive respiratory support (crucial)
Elamir (2021) and Murai (2021) reported on the outcome measure extensive respiratory support. In the intervention group of Elamir (2021) none of the 25 patients was intubated, compared to 2/25 (8.0%) patients in the control group. In the intervention group of Murai (2021), 9/119 (7.6%) patients needed invasive mechanical ventilation (IMV), compared to 17/118 (14.4%) patients in the control group. The RR (95%CI) was 0.52 (0.24 to 1.13), in favour of the intervention group. The RD (95%CI) was -0.07 (-0.15 to 0.01), in favour of the intervention group. This is considered clinically relevant (RD>5%). Murai (2021) reported also on the duration of the respiratory support. Mean duration of IMV was 15.0 days in the intervention group, compared to 12.8 days in the control group (SD not reported). The mean difference (95%CI) is 2.2 (-8.4 to 12.8) days, in favor of the control group.
Level of evidence of the literature
The evidence for the outcome measure extensive respiratory support comes from RCTs and therefore started at high certainty. The level of evidence was downgraded to low. There was risk of bias in one of the studies (unclear allocation concealment, baseline differences, open label study and unclear follow-up, downgraded one level for risk of bias). Furthermore, the effect estimate (95%CI) crossed one of the thresholds for clinical relevance and only two studies were included (downgraded two levels for imprecision).
Duration of hospitalization (important)
Elamir (2021) and Murai (2021) reported on the outcome measure duration of hospitalization. In the intervention group of Elamir (2021) the mean (±SD) length of stay was 5.5±3.9 days, compared to 9.2±9.4 days in the control group. The mean difference (95%CI) was -3.7 (-7.7 to 0.3), in favor of the intervention group. This difference is considered clinically relevant (>three days). In the intervention group of Murai (2021) the median (IQR) duration of hospitalization was 7 (4 to 10) days, compared to 7 (5 to 13) days in the control group. This difference in medians is not considered clinically relevant (<three days).
Level of evidence of the literature
The evidence for the outcome measure duration of hospitalization comes from RCTs and therefore started at high certainty. The level of evidence was downgraded to low. There was risk of bias in one study (unclear allocation concealment, baseline differences, open label study and unclear follow-up, downgraded one level for risk of bias). The effect estimate (95%CI) crossed one of the thresholds for clinical relevance and only two studies were included (downgraded one level for imprecision).
Time to clinical improvement (important)
Elamir (2021), Entrenas Castillo (2020) and Murai (2021) did not report on the important outcome measure time to clinical improvement. Therefore, it is not possible to conclude on the effect of treatment with vitamin D on time to clinical improvement in hospitalized patients with moderate to severe COVID-19.
Level of evidence of the literature
-
Treatment with vitamin D in non-hospitalized COVID-19 patients
Summary of literature
Description of studies
Rastogi (2020) described a placebo-controlled randomized clinical trial (SHADE-study), which was performed in India. Rastogi (2020) studied the efficacy and safety of cholecalciferol supplementation in patients with mild COVID-19 and vitamin D deficiency. They included patients with mildly symptomatic or asymptomatic COVID-19, 25 (OH)D level <20 ng/ml and with/without comorbidities. Median baseline 25 (OH)D levels were 8.36 (IQR 7.1 to 13.1) in the intervention group versus 9.5 (IQR 8.1 to 12.5) in the control group. Patients who were unable to take oral supplementation were excluded (e.g., invasive ventilation or severe comorbidities). Patients in the intervention group (n=16) received 60000 IU daily of cholecalciferol for 7 days plus standard of care, in order to achieve 25 (OH)D level>50 ng/ml. When 25 (OH)D levels >50 ng/ml at day 7, patients received weekly supplementation of 60.000IU. In case of lower 25 (OH)D levels, daily supplementation of 60.000 IU was continued. Patients in the control group (n=24) received placebo (distilled water) and standard of care (per institute protocol). Patients were followed until day 21 or virus negativity. The primary outcome measure was the proportion of participants being SARS-CoV-2 negative before the third week. In the intervention group, 10/16 (62.5%) patients were SARS-CoV-2 negative before the third week, compared to 5/24 (20.8%) patients in the control group. The Risk Difference (RD) (95%CI) was 0.42 (0.13 to 0.70), in favour of the intervention group. No other relevant outcome measures were reported.
Table 3. Overview of RCTs comparing vitamin D with standard of care in non-hospitalized COVID-19 patients
|
Author |
Vitamin D level at inclusion |
Sample size |
Dosage |
|
Rastogi, 2020 |
<20 ng/ml |
I: 16 C: 24 Total: 40 |
Daily dose of 60000 IU cholecalciferol for 7 days - 25 (OH)D levels >50 ng/ml at day 7 à weekly supplementation of 60000IU - 25 (OH)D levels <50 ng/ml à daily supplementation of 60000 IU |
Results
Rastogi (2020) did not report on the crucial outcome measure mortality nor on the important outcome measures respiratory support, hospitalization and time to clinical improvement.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the effectivity of treatment with vitamin D compared to standard treatment without vitamin D in patients with COVID-19?
PICO 1
P: hospitalized patients with COVID-19 (subgroups mild, moderate, severe)
I: vitamin D + standard care
C: standard care only / placebo treatment + standard care
O: 28-30 day mortality (if not available, any other report of mortality), extensive respiratory support, duration of hospitalization, time to clinical improvement
PICO 2
P: non-hospitalized patients with COVID-19
I: vitamin D + standard care
C: standard care only / placebo treatment + standard care
O: 28-30 day mortality (if not available, any other report of mortality), respiratory support, hospitalization, time to clinical improvement
Relevant outcome measures
PICO 1: For hospitalized COVID-19 patients, mortality and need for extensive respiratory support were considered as crucial outcome measures for decision making. Duration of hospitalization and time to clinical improvement were considered as important outcome measures for decision making.
PICO 2: For non-hospitalized COVID-19 patients, mortality was considered as a critical outcome measure for decision making. Hospitalization, respiratory support and time to clinical improvement were considered as important outcome measures for decision making.
Extensive respiratory support was defined as high flow nasal cannula (HFNC)/Optiflow, continuous positive airway pressure (CPAP), non-invasive ventilation (NIV), mechanical ventilation or extracorporeal membrane oxygenation (ECMO or ECLS). Non-invasive respiratory support was defined as supplemental oxygen low flow oxygen or non-rebreathing mask.
The working group defined 3% points absolute difference as a minimal clinically important difference for mortality (resulting in a NNT of 33), 3 days for duration of hospitalization and time to clinical improvement, 5% points absolute difference need for respiratory support and hospital admission (resulting in a NNT of 20).
The results of studies in non-hospitalized and hospitalized patients are summarized separately. Studies of hospitalized patients were categorized based on the respiratory support that was needed at baseline (preferably based on patient inclusion/exclusion criteria; otherwise on baseline characteristics). The following categories were used:
- mild disease (no supplemental oxygen);
- moderate disease (supplemental oxygen: low flow oxygen, non-rebreathing mask);
- severe disease (supplemental oxygen: high flow oxygen [high flow nasal cannula (HFNC)/Optiflow], continuous positive airway pressure [CPAP], non-invasive ventilation [NIV], mechanical ventilation, extracorporeal membrane oxygenation [ECMO or ECLS]).
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until September 30th, 2021. The detailed search strategy is outlined under the tab Methods. Studies were selected based on the following criteria: (systematic review of) randomized controlled trial(s), peer reviewed and published in indexed journal, comparing treatment with vitamin D and standard of care to standard of care alone or treatment with vitamin D and standard of care to placebo and standard of care in patients with COVID-19.
The systematic literature search resulted in 77680 hits. Studies were selected based on the following criteria: systematic review or randomized controlled trials (RCTs). One systematic review (Stroehlein, 2021) and four RCTs (Murai, 2021; Castillo, 2020; Elamir, 2021 and Rastogi, 2021) fulfilled the inclusion criteria. Since Stroehlein (2021) only included Murai (2021), Castillo (2020) and Rastogi (2021), we decided not to use this systematic review in the literature analysis. Additionally, published articles that were subsequently retracted were not included.
Statistical methods
Statistical analyses were conducted using Review Manager (RevMan) software 5.4. For dichotomous outcomes, Mantel Haenszel random‐effects risk ratios (RRs) and risk differences (RDs) were calculated. For continuous outcomes, a random‐effects mean difference (MD) weighted by the inverse variance was calculated. The random-effects model estimates the mean of a distribution of effects.
Results
Four RCTs were included in the analysis of the literature (Murai, 2021; Castillo, 2020; Elamir, 2021 and Rastogi, 2021). Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Amrein, K., Schnedl, C., Holl, A., Riedl, R., Christopher, K. B., Pachler, C., Urbanic Purkart, T., Waltensdorfer, A., Münch, A., Warnkross, H., Stojakovic, T., Bisping, E., Toller, W., Smolle, K. H., Berghold, A., Pieber, T. R., & Dobnig, H. (2014). Effect of high-dose vitamin D3 on hospital length of stay in critically ill patients with vitamin D deficiency: the VITdAL-ICU randomized clinical trial. JAMA, 312(15), 1520–1530. https://doi-org.saz.idm.oclc.org/10.1001/jama.2014.13204
- Aranow C. (2011). Vitamin D and the immune system. Journal of investigative medicine : the official publication of the American Federation for Clinical Research, 59(6), 881–886. https://doi-org.saz.idm.oclc.org/10.2310/JIM.0b013e31821b8755
- Elamir, Y. M., Amir, H., Lim, S., Rana, Y. P., Lopez, C. G., Feliciano, N. V., Omar, A., Grist, W. P., & Via, M. A. (2022). A randomized pilot study using calcitriol in hospitalized COVID-19 patients. Bone, 154, 116175. https://doi-org.saz.idm.oclc.org/10.1016/j.bone.2021.116175
- Entrenas Castillo, M., Entrenas Costa, L. M., Vaquero Barrios, J. M., Alcalá Díaz, J. F., López Miranda, J., Bouillon, R., & Quesada Gomez, J. M. (2020). "Effect of calcifediol treatment and best available therapy versus best available therapy on intensive care unit admission and mortality among patients hospitalized for COVID-19: A pilot randomized clinical study". The Journal of steroid biochemistry and molecular biology, 203, 105751. https://doi-org.saz.idm.oclc.org/10.1016/j.jsbmb.2020.105751
- Fisher, S. A., Rahimzadeh, M., Brierley, C., Gration, B., Doree, C., Kimber, C. E., Plaza Cajide, A., Lamikanra, A. A., & Roberts, D. J. (2019). The role of vitamin D in increasing circulating T regulatory cell numbers and modulating T regulatory cell phenotypes in patients with inflammatory disease or in healthy volunteers: A systematic review. PloS one, 14(9), e0222313. https://doi-org.saz.idm.oclc.org/10.1371/journal.pone.0222313
- Gezondheidsraad advies ’Naar een toereikende inname van vitamine D’ 2008. URL: https://www.gezondheidsraad.nl/binaries/gezondheidsraad/documenten/adviezen/2008/09/30/naar-een-toereikende-inname-van-vitamine-d/dossier-naar-een-toereikende-inname-van-vitamine-d.pdf
- Gezondheidsraad advies ‘Vitamine D en de preventie van COVID-19 en acute luchtweginfecties’ 2021. URL: https://www.gezondheidsraad.nl/binaries/gezondheidsraad/documenten/adviezen/2021/03/03/vitamine-d-en-de-preventie-van-covid-19-en-acute-luchtweginfecties/Advies-Vitamine-D-en-de-preventie-van-COVID-19-en-acute-luchtweginfecties.pdf
- Ginde, A. A., Brower, R. G., Caterino, J. M., Finck, L., Banner-Goodspeed, V. M., Grissom, C. K., Hayden, D., Hough, C. L., Hyzy, R. C., Khan, A., Levitt, J. E., Park, P. K., Ringwood, N., Rivers, E. P., Self, W. H., Shapiro, N. I., Thompson, B. T., Yealy, D. M., & Talmor, D. (2019). Early High-Dose Vitamin D3 for Critically Ill, Vitamin D-Deficient Patients. The New England journal of medicine, 381(26), 2529–2540. https://doi-org.saz.idm.oclc.org/10.1056/NEJMoa1911124
- Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Ross, A. C., Taylor, C. L., Yaktine, A. L., & Del Valle, H. B. (Eds.). (2011). Dietary Reference Intakes for Calcium and Vitamin D. National Academies Press (US).
- JamaliMoghadamSiahkali, S., Zarezade, B., Koolaji, S., SeyedAlinaghi, S., Zendehdel, A., Tabarestani, M., Sekhavati Moghadam, E., Abbasian, L., Dehghan Manshadi, S. A., Salehi, M., Hasannezhad, M., Ghaderkhani, S., Meidani, M., Salahshour, F., Jafari, F., Manafi, N., & Ghiasvand, F. (2021). Safety and effectiveness of high-dose vitamin C in patients with COVID-19: a randomized open-label clinical trial. European journal of medical research, 26(1), 20. https://doi-org.saz.idm.oclc.org/10.1186/s40001-021-00490-1
- Martineau, A. R., Jolliffe, D. A., Hooper, R. L., Greenberg, L., Aloia, J. F., Bergman, P., Dubnov-Raz, G., Esposito, S., Ganmaa, D., Ginde, A. A., Goodall, E. C., Grant, C. C., Griffiths, C. J., Janssens, W., Laaksi, I., Manaseki-Holland, S., Mauger, D., Murdoch, D. R., Neale, R., Rees, J. R., … Camargo, C. A., Jr (2017). Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ (Clinical research ed.), 356, i6583. https://doi-org.saz.idm.oclc.org/10.1136/bmj.i6583
- Murai, I. H., Fernandes, A. L., Sales, L. P., Pinto, A. J., Goessler, K. F., Duran, C., Silva, C., Franco, A. S., Macedo, M. B., Dalmolin, H., Baggio, J., Balbi, G., Reis, B. Z., Antonangelo, L., Caparbo, V. F., Gualano, B., & Pereira, R. (2021). Effect of a Single High Dose of Vitamin D3 on Hospital Length of Stay in Patients With Moderate to Severe COVID-19: A Randomized Clinical Trial. JAMA, 325(11), 1053–1060. https://doi-org.saz.idm.oclc.org/10.1001/jama.2020.26848
- Rastogi, A., Bhansali, A., Khare, N., Suri, V., Yaddanapudi, N., Sachdeva, N., Puri, G. D., & Malhotra, P. (2022). Short term, high-dose vitamin D supplementation for COVID-19 disease: a randomised, placebo-controlled, study (SHADE study). Postgraduate medical journal, 98(1156), 87–90. https://doi-org.saz.idm.oclc.org/10.1136/postgradmedj-2020-139065
- Science, M., Maguire, J. L., Russell, M. L., Smieja, M., Walter, S. D., & Loeb, M. (2013). Low serum 25-hydroxyvitamin D level and risk of upper respiratory tract infection in children and adolescents. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, 57(3), 392–397. https://doi-org.saz.idm.oclc.org/10.1093/cid/cit289
- Stroehlein, J. K., Wallqvist, J., Iannizzi, C., Mikolajewska, A., Metzendorf, M. I., Benstoem, C., Meybohm, P., Becker, M., Skoetz, N., Stegemann, M., & Piechotta, V. (2021). Vitamin D supplementation for the treatment of COVID-19: a living systematic review. The Cochrane database of systematic reviews, 5(5), CD015043. https://doi-org.saz.idm.oclc.org/10.1002/14651858.CD015043
- Thomas, S., Patel, D., Bittel, B., Wolski, K., Wang, Q., Kumar, A., Il'Giovine, Z. J., Mehra, R., McWilliams, C., Nissen, S. E., & Desai, M. Y. (2021). Effect of High-Dose Zinc and Ascorbic Acid Supplementation vs Usual Care on Symptom Length and Reduction Among Ambulatory Patients With SARS-CoV-2 Infection: The COVID A to Z Randomized Clinical Trial. JAMA network open, 4(2), e210369. https://doi-org.saz.idm.oclc.org/10.1001/jamanetworkopen.2021.0369
- Zhang, J., Rao, X., Li, Y., Zhu, Y., Liu, F., Guo, G., Luo, G., Meng, Z., De Backer, D., Xiang, H., & Peng, Z. (2021). Pilot trial of high-dose vitamin C in critically ill COVID-19 patients. Annals of intensive care, 11(1), 5. https://doi-org.saz.idm.oclc.org/10.1186/s13613-020-00792-3
Evidence tabellen
Research question: What is the role of vitamin D in the treatment of patients with COVID-19?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Stroehlein, 2021
Study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of RCTs
Literature search up to march 2021.
A: Murai, 2021 B: Entrenas Castillo, 2020 C: Rastogi, 2020
Study design: A: RCT, placebo controlled B: RCT, open-label C: RCT, placebo controlled
Setting and Country: A: inpatient, Brazil B: inpatient, Spain C: outpatient, India
Source of funding and conflicts of interest: A: non-commercial B: non-commercial C: non-commercial |
Inclusion criteria SR:
Exclusion criteria SR:
3 studies included
Important patient characteristics at baseline:
N, age mean (SD)/median (IQR) A: 240 patients I: 56.8 (14.2) yrs C: 55.8 (15.0) yrs B: 76 patients I: 53.14 (10.77) C: 52.77 (9.35) C: 40 patients I: 50 (36 to 51) C: 47.5 (39.3 to 49.2)
Sex (% Male) A: I: 58.3 C:54.2 B: I: 54 C: 69 C: I: 37.5 C: 58.3
Groups comparable at baseline? Gender was not equally distributed in Entrenas Castillo (2020) and Rastogi (2020). Not all relevant factors are reported in the SR (see ET for separate studies). |
Describe intervention:
A: 25(OH)-vitamin D 200,000 IU, single dose, orally, and standard of care B: Calcifediol 0.532 mg orally on day 1, calcifediol 0.266 mg on days 3 and 7, and then weekly until discharge or ICU admission C: 25 (OH)-vitamin D 60,000 IU daily for 7 days followed by: - daily supplementation until day-14, if 25(OH)Vitamin D3 level at day 7 < 50 ng/mL. - weekly supplementation of 60, 000 IU if 25(OH)Vitamin D3 level at day 7 > 50 ng/mL
|
Describe control:
A: placebo B: standard of care C: placebo |
End-point of follow-up:
A: until hospital discharge or death B: until admission to ICU, hospital discharge or death C: NR
For how many participants were no complete outcome data available? (intervention/control) A: NR B: NR C: NR
|
All cause mortality Defined as mortality until hospital discharge Effect measure: RR [95% CI]: A: 1.49 (0.55 to 4.05) B: 0.11 (0.01 to 2.13) C: NR Pooled effect: NA
Respiratory support (NIV) Effect measure: RR [95% CI]: A: 0.52 (0.24 to 1.13) B: NR C: NR Pooled effect: NA
Duration of hospitalisation Effect measure: MD [95% CI]: A: 1.07 (0.81 to 1.41) B: NR C: NR Pooled effect: NA
Admission to the ICU Effect measure: RR [95% CI]: A: 0.75 (0.44 to 1.29) B: 0.04 (0.01 to 0.29) C: NR Pooled effect: NA
Adverse events Effect measure: RR [95% CI]: A: 2.98 (0.12 to 72.30) B: NR C: no events of hypercalcaemia were observed during the study period Pooled effect: NA
|
Facultative: This is a living systematic review on vitamin D and COVID-19.
Authors conclusion Based on the current evidence, we are very uncertain about the effectiveness of vitamin D supplementation for participants with COVID-19. Moreover, inconsistency in the reporting of adverse and serious adverse events impeded evaluation of safety of vitamin D supplementation. Therefore, we cannot draw conclusions about vitamin D supplementation as a treatment for individuals with COVID-19. With respect to the identified studies in trial registries, our results are subject to change in the future.
Remarks Rastogi (2020) did not report on prioritised outcomes. Therefore Stroehlein (2021) did not formally assess risk of bias by RoB 2.0.
GRADE Assessed by Stroehlein (2021)
Mortality: very low GRADE Respiratory support: low GRADE Admission to ICU: not assessed with GRADE Duration of hospitalization: not assessed with GRADE Adverse events: very low GRADE
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies [cohort studies, case-control studies, case series])
Research question: What is the role of vitamin D in the treatment of patients with COVID-19?
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Hospitalized patients |
|||||||
|
Entrenas Castillo, 2020 |
Type of study: RCT, pilot, double-masked (?)
Setting and country: University hospital, Spain
Funding and conflicts of interest: Source of funding is not reported, might be FIBICO in Spain, COI not reported. |
COVID-19 patients, (hospitalized, moderate to severe disease)
Inclusion criteria: Hospitalized patients with COVID-19 infection clinical picture of acute respiratory infection, confirmed by a radiographic pattern of viral pneumonia and by a positive SARS-CoV-2 PCR with CURB65 severity scale
Exclusion criteria:
N total at baseline: 76 Intervention: 50 Control: 26
Important prognostic factors2: age ± SD: I: 53.14y±10.77 C: 52.77±9.35
Sex: I: 27/50 (54%) male C: 18/26 (69%) male
Disease severity: I: NR C: NR
At least one prognostic bad risk factor, n/N (%)* I: 24/50 (48) C: 16/26 (61.5)
C-reactive protein mg/l±SD) I: 82.93±62.74 C: 94.71±63.64
Pao2/FiO2 mean±SD I: 346.57±73.38 C: 334.62±66.33
*Patients with at least one of the following risk factors (age >60, previous lung disease, chronic kidney disease, diabetes mellitus, hypertension, cardiovascular disease or Immunosuppressed and transplanted patients).
Groups comparable at baseline? No, differences with regard to e.g. hypertension an diabetes |
Calcifediol + standard of care
Oral Calcifediol (Faes- Farma, Lejona, Spain), in soft capsules (0.532 mg) on the day of admission. Treatment was continued with oral calcifediol (0.266 mg) on day 3 and 7, and then weekly until discharge or ICU admission.
Standard of care: see control group. |
Standard of care
Per hospital protocol, a combination of hydroxychloroquine (400 mg every 12 h on the first day, and 200 mg every 12 h for the following 5 days), azithromycin (500 mg orally for 5 days) and for patients with pneumonia and NEWS score≥5, a broad spectrum antibiotic (ceftriaxone2 g intravenously every 24 h for 5 days) was added. |
Length of follow-up: Until admission to ICU, hospital discharge or death.
Loss-to-follow-up: Intervention: 0 (0%) Reasons NA
Control: 0 (0%) Reasons NA
Incomplete outcome data: Intervention: NR Reasons NA
Control: NR Reasons NA
|
Mortality (28-30 day) - crucial Not reported
Mortality (in-hospital ?), n/N (%) I: 0/50 (0) C: 2/26 (7.7) Effect (95%CI): NR P=NR
Respiratory support - mechanical respiratory support, optiflow ) - crucial Not reported
Duration of hospitalization - important Not reported
ICU admission, n/N (%) I: 1/50 (2) C: 13/26 (50) Effect (95%CI): 0.03 (0.003 to 0.25).* P=NR *Adjusted for hypertension and DM.
Time to symptom resolution - important Not reported
Respiratory support - non-invasive respiratory support - important Not reported
Adverse events - important Not reported
Viral clearance - important Not reported
|
Definitions: NR
Remarks:
Authors conclusion: Our pilot study demonstrated that administration of a high dose of Calcifediol or 25-hydroxyvitamin D, a main metabolite of vitamin D endocrine system, significantly reduced the need for ICU treatment of patients requiring hospitalization due to proven COVID-19. Calcifediol seems to be able to reduce severity of the disease, but larger trials with groups properly matched will be required to show a definitive answer.
|
|
Murai, 2021
|
Type of study: RCT; multicentre, double-blind, randomized, placebo-controlled
Setting and country: 2 sites in Sao Paulo, Brazil; enrollment from June 2, 2020, to Aug 27, 2020; final follow-up on Oct 7, 2020.
Country: Brazil
Source of funding: This study was supported by FAPESP and Conselho Nacional de Desenvolvimento Científico e Tecnológico. The funders had no role in the design and conduct of the study; collection, management, analysis, and interpretation of the data; preparation, review, or approval of the manuscript; and decision to submit the manuscript for publication.
|
Hospitalized patients with moderate to severe COVID-19
Inclusion criteria:
Exclusion criteria:
N total at baseline: N = 237 (randomized 240) Intervention: 119 (random. 120) Control: 118 (random. 120)
Important prognostic factors2: Age (SD): I: 56.5 (13.8) C: 56.0 (15.0)
Sex, n/N (%) male: I: 70 (58.8) C: 63 (53.4)
Disease severity: I: NR C: NR
25-hydroxyvitamin D ng/ml (SD): I: 21.2 (10.1) C: 20.6 (8.1)
Total calcium, ng/ml (SD): I: 8.7 (0.5) C: 8.7 (0.5)
C-reactive protein, median (IQR) I: 57.9 (23.3 to 100.5) C: 68.4 (31.5 to 111.5)
Oxygen supplementation, n (%) No I: 16 (13.4) C: 9 (7.6) Oxygen therapy I: 86 (72.3) C: 95 (80.5) NIV I: 17 (14.3) C: 14 (11.9)
*Also available: coexisting diseases, acute COVID-19 symptoms and concomitant medications.
Groups comparable at baseline? Yes
|
Vitamin D3
Single, oral dose of 200 000 IU of vitamin D3 dissolved in a 10-mL peanut oil solution. |
Placebo
10 mL of a peanut oil solution. The solutions were identical in colour, taste, smell, consistency, and container. |
Length of follow-up: Until hospital discharge
Loss-to-follow-up: Intervention: 1/120 (0.8%) Reasons: withdrew consent
Control: 2/120 (1.7%) Reasons: withdrew consent
Incomplete outcome data: Intervention: NR Reasons: NA
Control: NR Reasons: NA
|
Mortality (28-30 day) – crucial Not reported
In-hospital mortality (% (95%CI)) I: 7.6 (3.5 to 13.9) C: 5.1 (1.9 to 10.7) Difference (95%CI): 2.5 (–4.1 to 9.2) P=0.43
Subgroup: Patients with 25-hydroxyvitamin D deficiency (<20 ng/mL) n = 57 n = 58 I: 7.0 (1.9 to 17.0) C: 1.7 (0.04 to 9.2) Difference (95%CI): 5.3 (–3.3 to 15.1) P=0.21
Respiratory support - mechanical respiratory support, optiflow ) - crucial Need for mechanical ventilation, % (95%CI) I: 7.6 (3.5 to 13.9) C: 14.4 (8.6 to 22.1) Difference (95%CI): –6.8 (–15.1 to 1.2) P=0.09
Duration of mechanical ventilation, mean: I: 15.0 C: 12.8 days Difference (95%CI): 2.2 (–8.4 to 12.8) P=0.69
Subgroup: Patients with 25-hydroxyvitamin D deficiency (<20 ng/mL) n = 57 n = 58 I: 7.0 (1.9 to 17.0) C: 8.6 (2.9 to 19.0) Difference –1.6% (–12.5 to 9.2) P=>0.99
Duration of hospitalization - important Hospital length of stay; median days (IQR) I: 7.0 (4.0-10.0) C: 7.0 (5.0-13.0) Unadj. HR (95%CI): 1.07 (0.82 to 1.39) P=0.62 Adj. HR (95%CI): 0.99 (0.71 to 1.37) P=0.94
Admission to the intensive care unit, % (95%CI); I: 16.0 (9.9 to 22.5) C: 21.2 (14.2 to 29.7) Difference (95%CI): –5.2 (–15.1 to 4.7)
Subgroup: Patients with 25-hydroxyvitamin D deficiency (<20 ng/mL) n = 57 n = 58 I: 19.3 (10.0 to 31.9) C: 15.5 (7.4 to 27.4) Difference (95%CI): 3.8 (–10.3 to 17.8)
Time to symptom resolution - important Not reported
Respiratory support - non-invasive respiratory support - important Not reported
Adverse events - important Serious adverse events I: 0 C: 0 Adverse events I: 1 (vomiting after vitamin d3 administration) C: 0
Viral clearance - important Not reported
|
Definitions: Hospital length of stay: defined as the total number of days that patients remained hospitalized from the date of randomization until the date of hospital discharge; The criteria used for patient discharge were no need for supplemental oxygen in the past 48 hours, no fever in the past 72 hours, and oxygen saturation greater than 93% without supplemental oxygen and without respiratory distress.
Remarks:
Authors conclusion: Among hospitalized patients with COVID-19, a single high dose of vitamin D3, compared with placebo, did not significantly reduce hospital length of stay. The findings do not support the use of vitamin D3 for treatment of moderate to severe COVID-19.
|
|
Elamir, 2021 |
Type of study: RCT, open-label
Setting and country: Mount Sinai Beth Israel, Mount Sinai Morningside, and Mount Sinai West Hospitals, enrolment between September 2020 and December 2020
Funding and conflicts of interest: No funding. The authors declare no competing interests. |
COVID-19 patients, (hospitalized, moderate disease)
Inclusion criteria:
Exclusion criteria:
N total at baseline:
Intervention: = 25 Control: N = 25
Important characteristics: Age, mean (SD): I: 69 y (18.0) C: 64 y (16)
Sex, n/N (%) male: I: 12/25 (48.0%) C: 13/25 (52%)
Groups comparable at baseline? No differences between the groups with regard to age and prognostic factors.
|
Vitamin D + standard of care
Calcitriol 0.5 μg daily for 14 days or until hospital discharge
Standard of care: see control group. |
Standard of care
‘Standard of care’ may include treatment with remdesivir (200 mg for one day followed by 100 mg for 4 days), examethasone (6 mg daily for 10 days), or convalescent plasma, as well as supplemental O2. |
Length of follow-up: At least 14 days
Loss-to-follow-up: Intervention: 0 Reasons: NA
Control: 0 Reasons: NA
Incomplete outcome data: Intervention: NR Reasons: NA
Control: NR Reasons: NA
|
Mortality - crucial Mortality, n/N (%) I: 0/25 (0.0%) C: 3/25 (12.0%) P= 0.23
Respiratory support - mechanical respiratory support, optiflow ) - crucial Not reported
Duration of hospitalization – important Hospital stay, mean days±SD Days, mean (SD) I: 5.5 (3.9%) C: 9.2 (9.4%) P=0.14
ICU admission - important ICU admission, n/N (%) I: 5/25 (20.0 %) C: 8/25 (32.0%) P=0.33
Time to symptom resolution - important Not reported
Respiratory support - non-invasive respiratory support - important Not reported
Adverse events - important Reduction in glomerular filtration rate by >10% I: 0/25 (8.0 %) C: 4/25 (16.0%) P=0.1 No adverse effects were observed, including no hypercalcemia or hyperphosphatemia.
Viral clearance - important Not reported
|
Definitions: -
Remarks:
Authors conclusion: This pilot study illustrates improvement in oxygenation among hospitalized patients with COVID-19 treated with calcitriol and suggests the need for a larger randomized trial. |
|
Non-hospitalized patients |
|||||||
|
Rastogi, 2020 (SHADE study) |
Type of study: RCT, placebo controlled
Setting and country: Tertiary care hospital, India
Funding and conflicts of interest: The authors have not declared a specific grant for this research from any funding agency in the public, commercial or not-for-profit sectors. No competing interests were declared. |
COVID-19 patients, hospitalized, mild or moderate disease
Inclusion criteria: Patients with vitamin D deficiency defined as 25 (OH)D level<20 ng/ml
Exclusion criteria: Patients requiring invasive ventilation and patients with significant comorbidities like uncontrolled hyperglycaemia or hypertension.
N total at baseline: N = 40 Intervention: N = 16 Control: N = 24
Important characteristics: Age, median (IQR): I: 50.0 y (36 to 51) C: 47.5 y (39.3 to 49.2)
Sex, n/N (%) male: I: 6/16 (37.5%) C: 14/24 (58.3%)
Disease severity: not reported
25 (OH) D3 (ng/ml)(median;IQR) I: 8.6 (7.1 to 13.1) C: 9.54 (8.1 to 12.5) P=0.730
Procalcitonin (nl/ml) (median;IQR) I: 0.02 (0.02 to 0.03) C: 0.03 (0.02 to 0.09) P=0.411
C reactive protein( mg/L) (median;IQR) I: 2.1 (0.8 to 20.4) C: 2.6 (0.7 to 14) P=0.295
Calcium (mg/dl) (median;IQR) I: 9.4 (9.2 to 9.7) C: 8.8 (8.0 to 9.2) P=0.042
Groups comparable at baseline? Unclear, since important factors like disease severity were not reported. |
Cholecalciferol + standard of care
60000 IU of cholecalciferol (5 ml oral solution in nano droplet form) daily, for 7 days with the aim to achieve 25 (OH)D level>50 ng/ml. When 25 (OH)D levels >50 ng/ml at day 7, patients received weekly supplementation of 60000IU. In case of lower 25 (OH)D levels, daily supplementation of 60000 IU was continued.
|
Placebo + standard of care
5 ml distilled water for 7 days
Standard of care: per institute protocol.
|
Length of follow-up: Until day 21 or virus negativity
Loss-to-follow-up: Intervention: 0 (0%) Reasons NA
Control: 0 (0%) Reasons NA
Incomplete outcome data: Intervention: NR Reasons NA
Control: NR Reasons NA
|
Mortality (28-30 day) - crucial Not reported
Respiratory support - mechanical respiratory support, optiflow ) - crucial Not reported
Duration of hospitalization - important Not reported
Time to symptom resolution - important Not reported
Respiratory support - non-invasive respiratory support - important Not reported
Adverse events - important No episodes of hypercalcaemia were observed in either group.
Viral clearance - important SARS-CoV-2 negativity (n/N) I: 10/16 (62.5%) C: 5/24 (20.8%) P=0.018
Mean duration to SARS-CoV-2 negativity, mean±SD I: 17.6±6.1 C: 17.6±6.4
|
Definitions: NA
Remarks:
Authors conclusion: In conclusion, a high dose, oral vitamin D supplementation to augment 25(OH)D >50 ng/ml helped to achieve SARS-CoV-2 RNA negativity in greater proportion of asymptomatic vitamin D-deficient individuals with SARS-CoV-2 infection along with a significant decrease in inflammatory marker. SARS-CoV-2 RNA negativity by cholecalciferol supplementation may help in reducing transmission rates of the highly contagious SARS-CoV-2 infection. A reassurance for public health workers regarding greater likelihood of SARS CoV-2 RNA negativity in individuals receiving therapeutic cholecalciferol supplementation will be encouraging.
|
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Research question: What is the role of vitamin D in the treatment of patients with COVID-19?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
Hospitalized patients |
|||||||
|
Entrenas Castillo, 2020 |
Definitely yes
Reason: An electronically generated randomization 2:1 list was prepared by independent statisticians. |
Probably no
Reason: Randomization list was only accessible to non-masked specialists. |
Probably no
Reason: Blinding of participants is not described. Randomization list was only accessible to non-masked specialists. Technical data collectors and data analysts were blinded. |
Definitely yes
Reason: None of the participants was lost to follow-up. |
Probably no
Reason: Outcome measures described in the method section are also reported. However, definition of mortality differed between trial registry and publication (unclear FU of patients and definition of mortality in the protocol) |
Definitely no
Reason: ITT analysis was performed, the study was not placebo-controlled. |
HIGH Mortality Unclear concealment process; Risk of selective reporting.
Other outcomes Unclear concealment process; No blinding of participants (might not induce high risk of bias in objective outcomes).
|
|
Murai, 2021 |
Definitely yes
Reason: Patients were assigned in a 1:1 ratio to the vitamin D3 group or the placebo group. The randomization list was created using a computer-generated code with block sizes of 20. |
Probably yes
Reason: A staff member who had no role in the study managed the randomization. Unclear whether the randomization list was accessible before patient enrolment and whether allocation was concealed. |
Definitely yes
Reason: Patients and investigators remained blinded to randomization until the final analysis. |
Definitely yes
Reason: Resp. 1 and 2 patients dropped out; withdrew consent
|
Probably yes
Reason: Relevant outcomes reported; described in publication why some outcomes are to follow and some were not possible.
|
Probably yes
Reason: No ITT protocol, but low dropout rates.
|
Some concerns All outcomes Unclear allocation concealment |
|
Elamir, 2021 |
Definitely yes
Reason: Eligible patients were allocated at a 1:1 ratio through electronic randomization on the day of admission.
|
Probably yes
Reason: Unclear whether the randomization list was accessible before patient enrolment and whether allocation was concealed.
|
Definitely no
Reason: It is an open label study.
|
Definitely yes
Reason: None of the participants was lost to follow-up.
|
Probably yes
Reason: the outcome measure adverse effects is not mentioned in the methods.
|
Probably no
Reason: baseline differences between the groups (e.g. with regard to age and prognostic factors), follow-up is not clear |
HIGH Mortality Baseline differences, follow-up was not clear.
Other outcomes Open label study, baseline differences, follow-up was not clear.
|
|
Non-hospitalized patients |
|||||||
|
Rastogi, 2020 |
No information
Method of randomisation not reported. |
No information
Method of randomisation and concealment not reported. |
No information
Blinding is not described. |
Definitely yes
None of the participants was lost to follow-up. |
Definitely yes
Outcome measures described in the method section are also reported. |
Probably yes
ITT analysis was performed, disease severity at baseline is not reported. Placebo was not exactly matched with regards to the taste and consistency with the intervention. |
HIGH Mortality Unclear randomization and allocation concealment
Other outcomes Unclear randomization and allocation concealment; unclear blinding (might not induce high risk of bias in objective outcomes); placebo and intervention were not matched. |
Table of quality assessment for systematic reviews of RCTs and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 07-11-2022
Beoordeeld op geldigheid : 03-10-2022
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut). Deze ondersteuning werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De werkgroep werd gefinancierd uit een VWS subsidie.
De financiers hebben geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodules is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de behandeling van patiënten met COVID-19.
In 2020 is een multidisciplinair expertiseteam behandeling ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het expertiseteam behandeling) die betrokken zijn bij de zorg voor patiënten met COVID-19. Dit expertiseteam fungeerde als stuurgroep, welke opdracht heeft gegeven tot het ontwikkelen van de module, alsmede fungeerde als klankbordgroep.
Werkgroep
- Dr. Marjolein Hensgens, internist-infectioloog, Afdeling Infectieziekten, UMC Utrecht en LUMC Leiden (Stichting Werkgroep Antibiotica Beleid)
- Drs. Emilie Gieling, apotheker, Afdeling Klinische Farmacie, UMC Utrecht.
- Prof. Dr. Dylan de Lange, intensivist, Afdeling Intensive Care, UMC Utrecht.
- Dr. Wim Boersma, longarts, Afdeling Longziekten, Noordwest Ziekenhuisgroep, Alkmaar.
- Dr. Paul van der Linden, apotheker, Afdeling Klinische Farmacie, Tergooi MC, Hilversum (Stichting Werkgroep Antibiotica Beleid).
- Prof. Dr. Bhanu Sinha, arts-microbioloog, Afdeling Medische Microbiologie & Infectiepreventie, UMCG, Groningen (Stichting Werkgroep Antibiotica Beleid).
- Dr. Mark de Boer, internist-infectioloog, Afdelingen Infectieziekten en Klinische Epidemiologie, LUMC, Leiden (Stichting Werkgroep Antibiotica Beleid).
- Tot 1-11-2021 tevens deel van de werkgroep: Dr. Albert Vollaard, internist-infectioloog, LCI, RIVM
Stuurgroep (expertiseteam Behandeling COVID-19)
- Dr. L.M. van den Toorn (voorzitter), longarts, Erasmus Medisch Centrum (Erasmus MC), NVALT
- Dr. M.G.J. de Boer, internist-infectioloog, Leids Universitair Medisch Centrum (LUMC), SWAB/NIV)
- Drs. A.J. Meinders, internist-intensivist, St. Antonius Ziekenhuis, NVIC
- Prof. dr. D.W. de Lange, intensivist-toxicoloog, Universitair Medisch Centrum Utrecht (UMC Utrecht), NVIC
- Dr. C.H.S.B. van den Berg, infectioloog-intensivist Universitair Medisch Centrum Groningen (UMCG), NVIC
- Dr. S.U.C. Sankatsing, internist-infectioloog, Diakonessenhuis, NIV
- Dr. E.J.G. Peters, internist-infectioloog, Amsterdam University Medical Centers (Amsterdam UMC), NIV
- Drs. M.S. Boddaert, arts palliatieve geneeskunde, Leids Universitair Medisch Centrum (LUMC), IKNL
- Dr. P.L.A. Fraaij, kinderarts-infectioloog, Erasmus Medisch Centrum (Erasmus MC), Sophia Kinderziekenhuis, NVK
- Dr. E. van Leeuwen, gynaecoloog, Amsterdam University Medical Centers (Amsterdam UMC), NVOG
- Dr. J.J. van Kampen, arts-microbioloog, Erasmus Medisch Centrum (Erasmus MC), NVMM
- Dr. M. Bulatović-Ćalasan, internist allergoloog-immunoloog en klinisch farmacoloog, Universitair Medisch Centrum Utrecht (UMC Utrecht), Amsterdam University Medical Centers (Amsterdam UMC), NIV
- Drs. A.F.J. de Bruin, anesthesioloog-intensivist, St. Antonius Ziekenhuis, NVA
- Drs. A. Jacobs, klinisch geriater, Catharina Ziekenhuis, NVKG
- Drs. B. Hendriks, ziekenhuisapotheker, Leids Universitair Medisch Centrum (LUMC), NVZA
- Drs. M. Nijs, huisarts, NHG
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten
Meelezer
- Drs. K. (Klaartje) Spijkers, senior adviseur patiëntenbelang, Patiëntenfederatie Nederland, Utrecht
Met ondersteuning van:
- dr. S.N. Hofstede, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. L.M.P. Wesselman, adviseur, Kennisinstituut van Medisch Specialisten
- dr. D. Nieboer, adviseur, Kennisinstituut van Medisch Specialisten
- drs. A.L.J. (Andrea) Kortlever - van der Spek, adviseur, Kennisinstituut van Medisch Specialisten
-
M. Griekspoor MSc., junior adviseur, Kennisinstituut van Medisch Specialisten
- drs. I. van Dusseldorp, senior literatuurspecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
De Lange |
1. Afdelingshoofd Nationaal Vergiftigingen Informatie Centrum (NVIC) van het UMC Utrecht (0,6 fte) |
Secretaris Stichting Nationale Intensive Care Evaluatie (Stichting NICE), onbezoldigd. |
Geen |
Geen actie nodig |
|
De Boer |
Internist-Infectioloog, klinisch epidemioloog, senior medisch specialist, Leids Universitair Medisch Centrum, afdeling Infectieziekten |
- Voorzitter Stichting Werkgroep Antibioticabeleid (onkostenvergoeding) |
Geen |
Geen actie nodig |
|
Sinha |
Arts-microbioloog/hoogleraar, Universitair Medisch Centrum Groningen (voltijd) (zie ook https;//www.rug.nl/staff/b.sinha/) |
- SWAB-bestuur: secretaris [onbetaald; vacatiegeld voor instelling] |
- Projectsubsidie EU (Cofund): deelprojecten, cofinanciering
Mogelijk boedbeeldfunctie SWAB |
Geen actie nodig |
|
Van der Linden |
Ziekenhuisapotheker |
Penningmeester SWAB, vacatiegeld |
Geen |
Geen actie nodig |
|
Vollaard |
Internist-infectioloog, Landelijke Coordinatie Infectieziektebestrijding, RIVM |
Arts voor ongedocumenteerde migranten, Dokters van de Wereld, Amsterdam (onbetaald) |
Geen |
Geen actie nodig |
|
Gieling |
Ziekenhuisapotheker - Klinisch Farmacoloog, UMC Utrecht |
Lid OMT Nederlandse Vereniging voor Ziekenhuisapothekers (onbetaald) |
Geen |
Geen actie nodig |
|
Boersma |
Longarts Noordwest Ziekhuisgroep |
Lid sectie infectieziekten NVALT, onbetaald |
Eenmalige digitale deelname aan adviesraad MSD Pneumovax over Pneumococcal disease, betaald
|
Geen actie nodig |
|
Hensgens |
Internist-infectioloog, UMC Utrecht (0.8 aanstelling, waarvan nu 0.4 gedetacheerd naar LUMC) Internist-infectioloog, LUMC (via detachering, zie boven) |
Geen |
Geen |
Geen actie nodig |
Stuurgroep
|
Achternaam stuurgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Van den Toorn (voorzitter) |
Voorzitter NVALT |
Geen |
Geen |
Geen actie nodig |
|
De Boer |
Internist-Infectioloog, senior medisch specialist, LUMC, afdeling infectieziekten |
- Voorzitter Stichting Werkgroep Antibioticabeleid (onkostenvergoeding) |
Geen |
Geen actie nodig |
|
Meinders |
Internist-intensivist, St.-Antonius ziekenhuis, Nieuwegein |
commissie werk |
Geen |
Geen actie nodig |
|
De Lange |
Afdelingshoofd Nationaal Vergiftigingen Informatie Centrum (NVIC) van het UMC Utrecht |
secretaris Stichting Nationale Intensive Care Evaluatie (Stichting NICE) (onbetaald) |
Geen |
Geen actie nodig |
|
Van den Berg |
Infectioloog-intensivist, UMCG |
Geen |
Geen |
Geen actie nodig |
|
Sankatsing |
Internist-infectioloog/internist-acute geneeskunde, Diakonessenhuis, Utrecht |
- Bestuurslid Nederlandse Vereniging van Internist-Infectiologen (NVII) (onbetaald). |
Geen |
Geen actie nodig |
|
Peters |
Internist - aandachtsgebieden infectieziekten en Acute Geneeskunde Amsterdam UMC, locatie Vumc |
Wetenschappelijk Secretaris International Working Group on the Diabetic Foot (onbetaald) |
Geen |
Geen actie nodig |
|
Boddaert |
Medisch adviseur bij Integraal Kankercentrum Nederland (IKNL) en Palliatieve Zorg Nederland (PZNL) Arts palliatieve geneeskunde in LUMC |
Geen |
Geen |
Geen actie nodig |
|
Fraaij |
Kinderarts infectioloog- immunoloog, Erasmus MC-Sophia, Rotterdam |
Bestuur Stichting Infecties bij Kinderen (onbetaald) |
deelname aan RECOVER, European Union's Horizon 2020 research |
Geen actie nodig |
|
Van Leeuwen |
Gyaecoloog Amsterdam Universitair Medisch Centra |
Geen |
Geen |
Geen actie nodig |
|
Van Kampen |
Arts-microbioloog, afdeling Viroscience, Erasmus MC |
- associate editor antimicrobial resistance & infection control (onbetaald) - lid antibioticacommissie Erasmus MC (onbetaald) |
1. Mede uitvinder patent: 1519780601-1408/3023503 2. R01AI147330 (NIAID/NH) (HN onderzoek (1+2 niet gerelateerd aan COVID-19)
|
Geen actie nodig |
|
Bulatovic |
Internist allergoloog-immunoloog en klinische farmacoloog, UMC Utrecht en Diakonessenhuis Utrecht |
Functie 1: arts |
Geen |
Geen actie nodig |
|
De Bruin |
Anesthesioloog - Intensivist St. Antonius ziekenhuis Nieuwegein en Utrecht |
Geen |
Geen |
Geen actie nodig |
|
Jacobs |
Klinisch geriater en klinisch farmacoloog |
Geen |
Geen |
Geen actie nodig |
|
Hendriks |
Ziekenhuisapotheker farmaceutische patiëntenzorg, afd. Kiinische Farmacie en Toxicoiogie, Leids Universitair Medisch Centrum |
Lid SWAB werkgroep surveillance antibioticagebruik, onbetaald Lid SWAB richtlijncommissie antibiotica allergie, onbetaald |
Geen |
Geen actie nodig |
|
Nijs |
Huisarts |
Geen |
Geen |
Geen actie nodig |
|
Hofstede |
Senior adviseur Kennisinstituut van Medisch Specialisten |
Geen |
Geen |
Geen actie nodig |
Meelezer
|
Achternaam |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Spijkers |
Senior adviseur patiëntenbelang |
Voorzitter Stichting Samen voor Duchenne |
Geen |
Geen actie nodig |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde patiëntenvereniging in de klankbordgroep. De verkregen input is meegenomen bij het opstellen van de module. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
Van leidraad naar richtlijnmodules
Bij aanvang van de pandemie in 2020 was het onduidelijk of bestaande of nieuwe medicijnen een relevante bijdrage konden leveren aan het herstel van patiënten geïnfecteerd met het SARS-CoV-2. Vandaar dat eind februari 2020 werd aangevangen met de eerste versie van de leidraad ‘Medicamenteuze behandeling voor patiënten met COVID-19 (infectie met SARS–CoV-2)’, welke begin maart 2020 online beschikbaar werd gesteld op de website van de SWAB (https://swab.nl/nl/covid-19). Sindsdien werd het adviesdocument op wekelijkse basis gereviseerd en indien nodig op basis van nieuwe publicaties van onderzoek aangepast. Het initiatief en de coördinatie hiertoe werden genomen door de SWAB Leidraadcommissie, ondersteund door het kennisinstituut van de Federatie Medisch Specialisten en een brede klankbordgroep waarbinnen de betrokken specialisten(verenigingen) zijn vertegenwoordigd. In september 2021 is gestart met het doorontwikkelen van de leidraad naar richtlijnmodules.
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de COVID-19 pandemie zijn knelpunten op verschillende manieren geïnventariseerd:
1. De expertiseteams benoemde de knelpunten in de zorg voor patiënten met COVID-19.
2. Er is een mailadres geopend (covid19@demedischspecialist.nl) waar verschillende partijen knelpunten konden aandragen, die vervolgens door de expertiseteams geprioriteerd werden.
3. Door de Federatie van Medisch Specialisten zijn webinars georganiseerd waarbij vragen konden worden ingestuurd. Deze vragen zijn na afloop van de webinars voorgelegd aan de expertiseteams en geprioriteerd.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Wanneer mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
On request.
