E-health
Uitgangsvraag
Welk effect heeft het gebruik van e-health op de zorg voor COPD-patiënten?
Aanbeveling
Zet digitale zorgtoepassingen, zoals telemonitoring, op maat in, passend bij de doelstellingen, de mogelijkheden en wensen van de zorgvrager en zorgverlener/instelling.
Als gekozen wordt voor digitale zorgtoepassingen dan heeft het de voorkeur dit in te passen in de huidige organisatie van zorg.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
- Er zijn geen duidelijke aanwijzingen in deze review van voordelen of schade van digitale toepassingen om zelfmanagement te ondersteunen. Ook eenmulti-component aanpak met daarin een digitale zelfmanagement toepassing om gezondheidsgedrag te beïnvloeden is neutraal in de uitkomsten.
- De review van Janjua betreft 14 studies met in totaal 1518 patiënten met een mild tot zeer ernstig COPD. De duur van de studies varieerde van 13-52 weken.
- De review heeft gekeken naar twee soorten interventies:
- Digitale interventie aanvullend op routine zelfmanagement zorg versus routine zelfmanagement zorg
- Digitale interventie versus iedere andere zelfmanagement interventie of routine zorg.
- Telemedicine interventies zijn niet meegenomen. Longaanvallen en kwaliteit van leven zijn de primaire uitkomsten, ziekenhuisopname en adversed events zijn de secondaire uitkomsten.
In de 14 studies worden verschillende digitale toepassingen gebruikt, SMS service, whatsapp berichten, metingen thuis (temperatuur, SpO2, longfunctie) tot volledige portals met metingen en vragenlijsten. Al deze toepassingen leiden niet tot voordelen ten opzichte van de routine zorg. Geen verbetering qua longaanvallen, ziekenhuisopname of patiënt tevredenheid. Mogelijk dat de kwaliteit van leven verbeterd wordt maar niet duidelijk is of dit ook een lange termijn effect is. Belangrijk is wel dat al deze toepassingen geen schadelijke effecten laten zien.
In deze review is nog specifiek gekeken naar de invloed van de interventies op gedragsverandering. Ook hier kunnen door gebrek aan onderzoeksgegevens geen conclusies aan verbonden worden.
Telemedicine is door dezelfde auteur onderzocht in een review met 29 studies met 5654 patiënten met COPD. Ook hier zijn de uitkomsten neutraal qua voor- en nadelen. Geen significant effect maar ook geen adverse events.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
In 2012 kende minder dan 10% van de mensen COPD de term e-health. Al zag ruim 40% de mogelijkheden van digitale vernieuwing om als patiënt meer verantwoordelijkheid in de zorg te krijgen. Unaniem was men van mening dat het gebruik van e-health altijd een vrije keuze moet blijven (Nivel, 2012).
Patiënten die ervaring hebben met het gebruik van eHealth zijn over het algemeen positief. Patiënten zonder ervaring hebben echter geen duidelijke ideeën over de voordelen. Ze moeten eerst worden overtuigd, en het benadrukken van de mogelijkheden voor meer persoonlijke controle kan een belangrijk argument zijn om hen te overtuigen (Hofstede, 2014).
Het begin van de COVID-19-epidemie en de maatregelen om die te bestrijden hebben tot grote verschuivingen in de gezondheidszorg geleid: sommige zorg kwam geheel stil te liggen, soms werd ook zorg in aangepaste vorm gegeven, zoals via de telefoon of via beeldbellen. Bij 69% van de COPD-patiënten is deze zorg op de een of andere manier veranderd, 55% telefonisch en 14% via de chat, video of e-consult. 26% gebruikt een patiënten portaal en 42% geeft aan dat ze dat wel zouden willen. Gebruik van apps, wearables en websites wordt door mensen met COPD in 20% van de gevallen gebruikt. De veranderde zorg leidde niet tot grote knelpunten in de ervaren kwaliteit van zorg (Nivel, 2021).
Verondersteld kan worden dat dit beeld inmiddels weer veranderd is.
Maar ondanks het grote aanbod profiteren nog te weinig patiënten met COPD van de nieuwe mogelijkheden. De beschikbaarheid van patiënten portalen, zelfmetingen, beeldbellen en ondersteunende applicaties worden ad hoc ingezet of onder de aandacht gebracht bij de patiënt. Belangrijk is het dan wel om rekening te houden met mensen met verminderde digitale vaardigheden.
Zie ook: Leidraad Kwaliteitscriteria bij invoeren telebegeleiding, 2022
Kosten (middelenbeslag)
29% van de medisch specialisten vindt dat kosten en vergoedingsstructuur één van de drie meest belangrijke factoren zijn die invloed hebben op de implementatie van e-health binnen hun organisatie.
Het werk van zorgverleners én de zorgverlener-patiënt relatie kan veranderen door de introductie van nieuwe technologie zoals e-health. Dit maakt digitale zorgtransformatie meer dan alleen een technisch proces (RIVM, 2021). Zorgverleners kunnen bijvoorbeeld een andere rol krijgen. Dit vraagt om nieuwe vaardigheden, kennis en attitudeverandering bij zorgverleners én patiënten.
Onderbouwing
Achtergrond
Er is een scala aan beschikbare digitale zorgtoepassingen op de markt. Bij elkaar ook wel e-health genoemd.
Digitale zorgtoepassingen kunnen mogelijkheden geven om de uitdagingen in de zorg zoals het groeiende aantal mensen met een chronische ziekte en de krapte op de arbeidsmarkt van zorgpersoneel, het hoofd te bieden.
We onderscheiden hierbij:
- Digitale zelfhulp in de vorm van informatiesites, apps en wearables.
- Digitale communicatie tussen zorgverleners en zorgvragers (beeldbellen en e-consult).
- Telemonitoring waarbij patiënten op afstand gevolgd worden door het meten van vitale parameters en vragenlijsten zodat b.v. longaanvallen voorkomen kunnen worden.
- Gebruik van patiënten portalen en PGO (persoonlijke gezondheidsomgeving).
- Verder bestaan er ook digitale toepassingen voor zorgondersteuning zoals elektronische medicijndispensers en
- Beslisondersteuning software bv meldingssystemen voor geneesmiddeleninteractie.
Het toegepaste middel is sterk afhankelijk van wat je er mee wilt bereiken zoals meten, monitoren, informeren of communiceren.
Via videobellen kan een consult gedaan worden zodat de patiënt niet naar het ziekenhuis hoeft te komen en thuis kan blijven. Andere toepassingen kunnen de patiënt meer regie over zijn eigen zorg geven of zoals bij monitoring om longaanvallen proberen te voorkomen.
Covid-19 heeft voor een versnelling in de ontwikkeling en toepassing van digitale zorg gezorgd en ook de politiek en zorgverzekeraars omarmen digitale toepassingen volop.
Om een oordeel te vormen over het effect van de gebruikte toepassingen bij de huidige COPD zorg, is het nodig meer inzicht te krijgen in een aantal aspecten van digitale zorg. Zoals: Wat zijn de voordelen en wat de nadelen van deze vormen van zorg op afstand vergeleken bij de standaardzorg voor COPD-patiënten? Welke toepassingen voegen iets toe voor de patiënt en welke voor de zorgverlener? Hoe adapteer je deze zorginnovaties in de bestaande zorgprocessen? Zitten er gevaren aan deze toepassingen? Waar liggen kansen, waar belemmeringen en wat zijn de zgn. randvoorwaarden? Is een combinatie van digitale zorg en “fysieke” zorg de toekomst?
Conclusies / Summary of Findings
|
Very low GRADE |
The evidence is very uncertain about the effect of a single-component e-health intervention on reducing exacerbations compared to usual care.
Sources: Janjua, 2021 |
|
Very low GRADE |
The evidence is very uncertain about the effect of a multi-component e-health intervention on the number of people experiencing one or more adverse events compared to standard care at 52 weeks.
Sources: Janjua, 2021 |
|
Very low GRADE |
The evidence is very uncertain about the effect of a multi-component e-health intervention on the number of people admitted to hospital compared to standard care at 52 weeks.
Sources: Janjua, 2021 |
|
Low GRADE |
An internet-based coaching programme may result in a large improvement in quality of life measured by St George's Respiratory Questionnaire compared to standard care at 52 weeks.
Sources: Janjua, 2021 |
|
Very low GRADE |
The evidence on a mobile e-health intervention for self-management on patient satisfaction is very unclear.
Sources: Janjua, 2021 |
Samenvatting literatuur
Description of studies
The study of Janjua (2021) was a Cochrane systematic review that assessed the question what the advantageous and disadvantageous effects of digital interventions were for COPD patients with regard to their condition and their self-management behaviour. In this study, a systematic search was performed to find randomised controlled trials that investigated adults with chronic obstructive pulmonary disease, defined as COPD by a generally-accepted staging system such as the GOLD criteria (Global initiative for Obstructive Lung Disease). Notably, the study investigated two comparisons: digital technology intervention in addition to routine supported self-management versus per se routine supported self-management; digital technology versus any other self-management intervention or usual care. The review excluded RCTs that investigated telemedicine interventions. Exacerbation rate and health-related quality of life were among the primary outcomes, and adverse events and hospital utilisation were among the secondary outcomes. Fourteen studies were included in this review, which included 1,518 mild to very severe COPD patients. The minimal follow-up duration was 13 weeks, up to a maximum of 52 weeks. All studies had a high risk of bias, because due to the nature of the intervention blinding of patients and healthcare providers was impossible. Furthermore, the interventions varied from text message reminders to smartphone applications or multi-component interventions.
Results
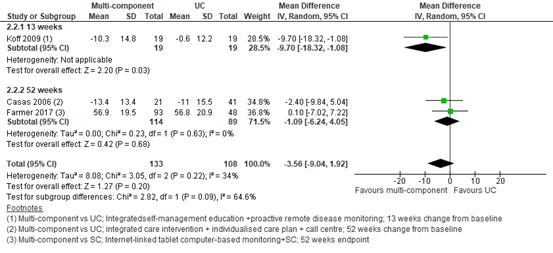
The systematic review of Janjua (2021) analysed several outcomes, of which exacerbations, safety, COPD-specific health-related quality of life (HRQoL), and COPD-related hospital admissions were of interest for this guideline. Here we summarise findings per outcome in the form of a table (Table 1). Results are described as pooled estimates when results could be pooled. The pooled estimate for the outcome health-related quality of life is shown in Figure 1.Otherwise the results represent results of single studies.
Table 1 – Summary of effect measures of single- and multi-component interventions on relevant outcome measures for COPD guideline development.
Abbreviations: 95% CI, 95 percent confidence interval; HR, hazard ratio; I2, heterogeneity; MD, mean difference; OR, odds ratio; RE, random effects; SGRQ, St. George’s respiratory questionnaire;
|
Outcome |
Intervention |
Outcome measure |
Effect measure and size (95% CI) |
|
Exacerbations |
Single-component |
Mean number of exacerbations at 26 weeks |
MD -0.17 (-0.50 to 0.16) |
|
|
Multi-component |
No studies with this combination of intervention and outcome reported |
|
|
Safety |
Single-component |
No studies with this combination of intervention and outcome reported |
|
|
|
Multi-component |
Number of patients with adverse events at 52 weeks |
OR 1.07 (0.51 to 2.25) |
|
COPD-related hospitalisations |
Single-component |
Number of patients with COPD-related hospitalisations at 26 weeks |
OR 0.90 (0.11 to 7.07) |
|
|
|
COPD-related emergency department visits at 26 weeks |
OR 2.86 (0.11 to 74.31) |
|
COPD-specific health-related quality of life |
Single-component |
SGRQ score at 52 weeks |
MD 26.57 (-34.09 to -19.05) |
|
|
Multi-component |
SGRQ score at 45 weeks |
Pooled MD -3.56 (-9.04 to 1.92), RE, I2: 34% |
|
Patient satisfaction |
Single-component |
Number of patients satisfied with healthcare at 52 weeks |
OR 0.87 (0.42 to 1.80) |
|
|
Multi-component |
Number of patients satisfied with healthcare at 52 weeks |
OR 9.35 (0.51 to 172.10) |
Figure 1 – Effect of multi-component intervention on St. George’s Respiratory Questionnaire.
95% CI, 95 percent confidence interval; df, degrees of freedom; DI, digital intervention; I2, heterogeneity; IV, inverse variance; SC, standard care; UC, usual care
Level of evidence of the literature
The level of evidence regarding the effect of a single-component intervention on the outcome measure exacerbations was downgraded by two levels because of imprecision (confidence interval wide and included null), no blinding, and missing outcome data: Very low GRADE.
The level of evidence regarding the outcome measure safety (AEs) was downgraded by three levels because of imprecision (confidence interval wide and included null), no blinding, and attrition to the intervention : Very Low GRADE.
The level of evidence regarding the outcome measure hospitalisations was downgraded by three levels because of imprecision (confidence interval wide and included null), and high risk of bias (no blinding, attrition bias): Very low GRADE.
The level of evidence regarding the outcome measure health-related quality of life was downgraded by two levels because of imprecision (confidence interval wide and included null), high risk of bias (performance and attrition bias): Low GRADE.
The level of evidence regarding the outcome measure patient satisfaction was downgraded by three levels because of imprecision (confidence interval wide and included null), high risk of bias (performance, attrition, and reporting bias): Very low GRADE.
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following question:
P: patients COPD patients.
I: intervention digital intervention (in addition to routine supported self-
management).
C: control usual care.
O: outcome exacerbations, adverse events (AEs), COPD-specific health-related
quality of life (HRQoL), patient satisfaction, and COPD-related
hospital admissions (HA).
Relevant outcome measures
The guideline development group considered exacerbations and safety (adverse events, AEs) as crucial outcomes for decision-making. COPD-specific health-related quality of life (HRQoL), patient satisfaction, and respiratory related hospital admissions (HA) are important outcomes for decision making. A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined a set of minimal clinically (patient) important differences (see introduction for further details). For this intervention, the following set was chosen:
- Exacerbation reduction: ≥20%
- SGRQ-score: ≥4 units
- Hospital admissions: ≥20% difference in relative risk
- Adverse events: ≥25% difference in relative risk
- Patient satisfaction: ≥10% difference in probability
Search and select (Methods)
For this question, no literature search was performed, because a recent Cochrane review (2021) was available.
Results
One systematic review was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence table. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Baan, D., Heijmans, M., Spreeuwenberg, P., Rijken, M. Zelfmanagement vanuit het perspectief van mensen met astma of COPD. Utrecht: NIVEL, 2012.
- E-healthmonitor 2021 - Stand van zaken digitale zorg. RIVM. 2022.
- Hallensleben, M. C., Kasteleyn, M., Petrus, A., Sekhuis, L., Rolink, E., & Chavannes, N. Handreiking Digitale Zorgtoepassingen voor patiëntgerichte COPD zorg.
- Heijmans, M., Willems, A., Scherpenzeel, A. Eigen regie over ziekte en zorg: ervaringen van mensen met een chronische longziekte. Utrecht: Nivel, 2022.
- Hofstede, J., Heijmans, M. Kennis en ervaringen met e-health van mensen met een chronische longziekte. www.nivel.nl: NIVEL, 2012.
- Hofstede J, de Bie J, van Wijngaarden B, Heijmans M. Knowledge, use and attitude toward eHealth among patients with chronic lung diseases. Int J Med Inform. 2014 Dec;83(12):967-74. doi: 10.1016/j.ijmedinf.2014.08.011. Epub 2014 Sep 8. PMID: 25269992.
- Horsselenberg, M., Menting, J., Heijmans, M. Tweede coronagolf zorgt bij longpatiënten voor weinig problemen in de zorg. Utrecht: Nivel, 2021.
- Janjua S, Banchoff E, Threapleton CJ, Prigmore S, Fletcher J, Disler RT. Digital interventions for the management of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Apr 19;4(4):CD013246. doi: 10.1002/14651858.CD013246.pub2. PMID: 33871065; PMCID: PMC8094214.
- Kruis AL, van Schayck OC, in 't Veen JC, van der Molen T, Chavannes NH. Successful patient self-management of COPD requires hands-on guidance. Lancet Respir Med. 2013 (9):670-2.
- Samenwerkingsafspraken en kwaliteitscriteria telebegeleiding COPD, 2022
- Wegwijzer bekostiging digitale zorg 2022. NZa. 2022.
- Wouters, M., Huygens, M., Voogdt, H., Meurs, M., Groot, J. de, Bruin, K. de, Brabers, A., Hofstede, C., Friele, R., Gennip, L. van. Samen aan zet! eHealth-monitor 2019. Den Haag/Utrecht: Nictiz, Nivel, 2019.
- Implementatie van e-health vraagt om durf en ruimte (Briefadvies). Eerste Kamer der Staten Generaal. 2017.
- van Zelst CM, Kasteleyn MJ, van Noort EMJ, et al. The impact of the involvement of a healthcare professional on the usage of an eHealth platform: a retrospective observational COPD study. Respir Res 2021; 22: 88.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Janjua (2021)
|
SR and meta-analysis of RCTs Literature search up to April 2020
A: Boer, 2019 B: Casas, 2006 C: Chan, 2016 D: Farmer, 2017 E: Kessler, 2018 F: Koff, 2009 G: Nguyen, 2008 H: Nguyen, 2013 I: Nield, 2012 J: Park, 2020 K: Poureslami, 2016 L: Sano, 2016 (conference abstract, not included in pooled results) M: Stamenova, 2020 N: Tabak, 2014 O: Wang, 2017
Study design: RCT
Setting and Country: The Netherlands, Belgium, Spain, Taiwan, United Kingdom, France, Germany, Italy, United States, Korea, Canada, China
Medisch Spectrum Twente, Department of Pulmonary Medicine, EnschedeNetherlands, University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands, Medisch Spectrum Twente, Department of Pulmonary Medicine, EnschedeNetherlands, University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands, Medisch Spectrum Twente, Department of Pulmonary Medicine, EnschedeNetherlands, University of Twente, Department of Health Technology and Services Research, Faculty of Behavioural Sciences, EnschedeNetherlands, Flinders University, School of Medicine, AdelaideAustralia, Repatriation General Hospital, Department of Respiratory Medicine, AdelaideAustralia, University Medical Center Utrecht, Julius Center for Health Sciences and Primary Care, PO Box 85500, UtrechtNetherlands,
Source of funding and conflicts of interest: The Lung Foundation Australia/Cochrane Airways Australia Scholarship 2016; no other potential sources of conflicts of interest |
Inclusion criteria SR:
Participants diagnosed with COPD according to the Global Initiative for Chronic Obstructive Lung Disease (GOLD 2017) classification criteria; people with a post- bronchodilator forced expiratory volume in one second (FEV )-to-forced vital capacity (FVC) ratio < 0.70.
Exclusion criteria SR: Mixed population <50% COPD or <80% without stratification; digital intervention aimed at physical activity; non-validated scales for outcomes.
14 studies included (all RCTs)
Setting: A: primary and secondary care B: tertiary care C: secondary care D: secondary care, primary care, community services E: secondary care F: secondary care G: secondary care H: secondary care I: secondary care J: secondary care K: secondary care L: Not reported M: secondary care N: primary and secondary care O: secondary care
Important patient characteristics at baseline:
N, mean age A: 87, 67y B: 155, I:70y, C72y C: 71, 72y D: 166, 69.8y E: 319, 66.9y F: 40, 66y G: 50, 70y H: 125, 69y I: 22, 65y J: 44, 67.9y K: 91, 67y L: 29, 70.3y M: 122, 72y N: 29, 63y O: 130, 71y
Sex, Male (%): A: 62% B: I67%, C88% C: 83% D: I:62%, C: 61% E: 69.6% F: 48% G: 56% H: 54% I: 100% J: 79% K: 62% L: 86.2% M: 55% N: 50% O: 48%
Groups comparable at baseline? Differences were noted in small studies, probably due to small numbers, as all studies were randomized. Study characteristics from larger studies (C, F, O, R, U) were comparable between groups |
Describe intervention (all):
Digital interventions:
Not telemedicine interventions such as remote patient monitoring |
Describe control (all):
1. Routine supported self-management 2. Routine clinical care
|
End-point of follow-up:
A: 9-12m B: 12m C: 13w D: 12m E: 12m F: 13w G: 26w (but stopped early with no reason reported) H: 52w I: 12w J: 26w K: 13w L: 16w M: 26w N: 13w O: 52w
For how many participants were no complete outcome data available? (intervention/control) A: I:16%/C:9% B: I:17/65 (26%), C: 18/90 (20%) C: 22% (I and C) D: I: 15.5%/C: 14.3% E: I: 20 (12.7%) / C: 34 (21%) F: 5% (both arms) G: I:4/C:7 H: Not reported I: 2 more in I than in C J: I:1/C:1 K: 0 L: 14%, not reported which arms M: I17.5%/C14.6% N: I:33%/C:86% O: I:11%/4%
|
Outcome measure-1
Exacerbations: Effect measure (95% CI): Single component intervention: M: Mean difference -0.17 (-0.50 to 0.16) @ 26 weeks; number of exacerbations Multi-component intervention: D: Odds ratio 1.05 (0.54 to 2.01) @ 52 weeks; number of individuals with at least one exacerbation D: Hazard ratio 1.05 (0.67 to 1.65) @ 52 weeks; time to first exacerbation E: Odds ratio 0.76 (0.46 to 1.26) @ 52 weeks; number of individuals with at least one exacerbation
Pooled effect OR individuals with at least one exacerbation (random effects model): 0.86 (0.58 to 1.28), no effect Heterogeneity (I2): 0%
Outcome measure-2 Safety Multi-component intervention: D: Odds ratio 1.07 (0.51 to 2.25) @ 52 weeks; number of patients with adverse events E: Odds ratio 0.85 (0.55 to 1.34) @ 52 weeks; number of patients with serious adverse events
Outcome measure-3 Health related quality of life (HRQoL) with SGRQ
Effect measure: mean difference (95% CI): Single component intervention: O: 26.57 (-34.09 to -19.05) Multi-component intervention: B: -2.40 (-9.84 to 5.04) @ 52 weeks D: 0.10 (-7.02 to 7.22) @ 52 weeks F: -9.70 (-18.32 to -1.08) @ 13 weeks
Outcome measure-4 COPD-related hospitalisations: Effect measure (95% CI): Single component intervention: J: Odds ratio 0.90 (0.11 to 7.07) @ 26 weeks; COPD-related hospitalisations J: Odds ratio 2.86 (0.11 to 74.31) @ 26 weeks; COPD-related emergency department visits Multi-component intervention: B: Odds ratio 0.40 (0.21 to 0.78) @ 52 weeks; number of people who had one or more readmission B: Hazard ratio 0.55 (0.35 to 0.86) @ 52 weeks; rehospitalisation rate D: Odds ratio 0.76 (0.39 to 1.47) @ 52 weeks; number of people admitted to hospital (all cause)
|
Facultative:
Brief description of author’s conclusions.
In general, there was sparse evidence regarding digital interventions aimed at improving conditions of COPD patients. These interventions may improve QoL in the short term, but it is unclear whether this effect persist in the long term. Also, in the long term breathing difficulties may improve. Evidence was unclear regarding walking distance of self-perceived disease control, or flare-ups. Total improvement of health is not clear with the evidence in situ.
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
In general:
a) due to the nature of the interventions, it was not possible to blind patients or healthcare providers with regard to the treatment
b) Digital interventions were not always clearly defined and could differ widely between studies. Subcategories were made for single- and multi-component interventions. ‘Usual care’ remained completely undefined (this may lead to misclassification).
Follow-up was relatively short, the effects of digital interventions after one year is not clear.
Some studies had high percentages of loss-to-follow-up, suggesting that some patients may have had problems with following digital interventions. Four studies suffered from differential loss-to-follow-up, which may have lead to selection bias.
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Outcome 1: Low GRADE; downgraded for imprecision (confidence interval wide and included null), optimal information size not met, risk of performance bias
Outcome 2: Very Low GRADE (AE); downgraded for imprecision (optimal information size, and confidence intervals wide), high risk of bias (performance and detection bias) Low GRADE (SAE); downgraded for high risk of bias (performance, detection, and attrition bias), imprecision (confidence interval crossed null effect)
Outcome 3: No GRADE reported
Outcome 4: Low GRADE; downgraded for optimal information size not met, high risk of bias (performance, detection and attrition bias).
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Subgroup analyses showed more improvement in health-related quality of life (HRQoL) in studies that included a smoking cessation program as part of the self-management intervention (mean difference -4.98, 95% CI -7.17 to -2.78) compared to studies with no smoking cessation program (mean difference -1.33, 95% CI -2.94 to 0.27). The number of behavioural change technique (BCT) clusters integrated in the self-management intervention, intervention duration, and adaptation of maintenance medication as part of an action plan did not affect HRQoL. Subgroup analyses did not detect potential explanatory variables for differences in respiratory-related hospital admissions among studies. Subgroup analyses were not performed for the other outcomes of interest |
Risk of Bias table
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Janjua, 2021 |
|
Yes |
Yes |
Yes |
Na |
Yes |
No |
Yes |
Yes |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-09-2023
Beoordeeld op geldigheid : 31-08-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met COPD.
Samenstelling van de werkgroep
Werkgroep
- Dr. F. (Folkert) Brijker, longarts, werkzaam in het Spaarne Gasthuis te Haarlem, NVALT (voorzitter, vanaf oktober 2022)
- Dr. J.S. (Jaring) van der Zee, longarts, NVALT (voorzitter, tot oktober 2022)
- Dr. W.H. (Wouter) van Geffen, longarts, werkzaam in het Medisch Centrum Leeuwarden te Leeuwarden, NVALT
- Drs. R. (Renée) van Snippenburg, werkzaam bij Ksyos en waarnemend longarts, NVALT
- Dr. J.C.C.M. (Hans) in ’t Veen, longarts, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVALT
- M. (Moniek) Wouters, longarts, werkzaam in het Ziekenhuis Gelderse Vallei te Arnhem, NVALT
- Prof. H.A.M. (Huib) Kerstjens, hoogleraar longziekten, longarts, werkzaam in het UMCG te Groningen, NVALT (vanaf oktober 2022)
- J. (Jeanine) Antons, longarts, werkzaam in het RadboudUMC te Nijmegen, NVALT (vanaf oktober 2022)
- Drs C.L.Y. (Chantal) Knoops, AIOS longgeneeskunde, werkzaam in het Catharina Ziekenhuis te Eindhoven (vanaf oktober 2022)
- Prof. J.W.M. (Jean) Muris, huisarts, werkzaam bij de Universiteit Maastricht, lid van de NHG-Expertgroep CAHAG, NHG
- Drs. E.R. (Erik) van der Meijs, apotheker, KNMP
- W.J.M. (Walter) van Litsenburg, verpleegkundig specialist longgeneeskunde, Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. M.J.H. (Maurice) Sillen, fysiotherapeut, werkzaam bij CIRO, KNGF
- R.A. (Renée) Kool, projectleider, Longfonds
- R. (Ramona) Leysner, diëtiste, Nederlandse Vereniging van Diëtisten (NVD)
- Drs. M. (Menno) Wagenaar, patiëntvertegenwoordiger, Longfonds
- J. (Johan) Smit, patiëntvertegenwoordiger, Longfonds
Met ondersteuning van
- Dr. M. (Margriet) Moret, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. N. (Nicole) Verheijen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten en longarts
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Inbreng patiëntenperspectief
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Brijker (voorzitter, vanaf oktober 2022) |
Longarts Spaarne Gasthuis |
Voorzitter sectie COPD NVALT. Dit is een onbetaalde functie binnen de longartsenvereniging NVALT. Lid regionale kwaliteitscommissie COPD/astma. Deze Commissie heeft 2x per jaar vergadering a 2 uur per keer in de avonduren en hiervoor ontvang ik onkostenvergoeding. Docent CASPIR cursussen. dit betreft scholing voor spirometrie voor huisartsen en POH-ers in de regio. Dit vindt een aantal keer per jaar plaats (<5 keer) in de avonduren en hiervoor ontvang ik een onkostenvergoeding |
Geen |
Geen |
|
*Van der Zee (voorzitter, tot oktober 2022) |
Longarts OLVG Amsterdam 0,2FTE tot 1-1-2020 Longarts Amsterdam UMC, locatie AMC, 0,2 FTE |
Lid MEC-U Locatie Nieuwegein, onkosten vergoeding Lid Gezondheidsraad Commissie Gespoten PUR, onkosten vergoeding Incidenteel medische expertises (o.a. DAS, ARAG, Triage, de Rechtspraak), betaald 2019 Speakers fee, Astra-Zeneca, Novartis, Chiesi 2019 1x Ad hoc Advies m.b.t. biologicals bij astma, GSK, betaald |
Geen |
Geen advieswerk tijdens het richtlijnontwikkeltraject |
|
Van Geffen |
Longarts Medisch Centrum Leeuwarden, maatschap Friese Longartsen |
Editorial board Cochrane Airways: Onbetaald Commisie Bronkhorst Nvalt: Onbetaald Richtlijn Commissie NVALT NSCLC: Onbetaald |
Deelname aan een investigator initiated onderzoek firma Novartis. financiering is overgemaakt aan UMCG (2017 beëindigd). Voor de bedrijven Chiesi, Roche, Boehringer en AstraZeneca deelname aan adviesraden betreffende oncologie. Deze gingen niet over COPD of biologicals. De hiervoor gebruikelijke CGR vergoeding werd geweigerd. Chiesi en Boehringer waren wel COPD, maar niet in de laatste 1.5 jaar. |
Geen advieswerk op gebied van COPD of biologicals tijdens het richtlijnontwikkeltraject |
|
In 't Veen |
Longarts bij In 't Veen Longarts BV. Verbonden aan de vakgroep longziekten en STZ expertisecentrum Astma, COPD & Respiratoire Allergie van het Franciscus Gasthuis en Vlietland, Rotterdam. |
Onbetaald: Opleider longziekten Franciscus Gasthuis en Vlietland Lid Concilium Opleiding NVALT Lid Vrij Ademen Akkoord namens NVALT Betrokken longarts bij Schone Lucht Akkoord Lid Move2Improve Lid werkgroep Ziektelastmeter; Generiek en COPD (afgerond) Voorzitter StichtingRoLeX (Rotterdam Leeuwarden eXpertise voor obstructieve longzieken), een stichting die nascholing voor longartsen (i.o.) verzorgd. Bestuurslid LAN Betaald: Longfunctiebeoordelaar Huisartsenlaboratorium STAR-SHL NHG richtlijn COPD namens NVALT Adviseurschap m.b.t. astma: Sanofi, GSK, Boehringer Ingelheim, Chiesi. (laatste 2 jaar (datum invullen 30-6-19) geen persoonlijke betrokkenhied als adviseur bij COPD gerelateerde issues, mede vanwege mijn betrokkenheid bij de NHG richtlijn). Speakers Bureau: Chiesie, Novartis, Boehringer Ingelheim, Inhalatie Technologie Werkgroep Health Agency Stichting RoLeX Sanofi |
Ik beoordeel longfuncties voor een huisarts laboratorium, en heb adviseurschap verricht voor diverse farmaceutische firma's. Er is nooit advies gegeven door mij over medicamenteuze COPD-behandeling, ook niet over biologicals. het genoemde adviseurschap is inmiddels meer dan 3-4 jaar geleden beëindigd. Zie eerder. Research faculty grants, (subsidiegevers Boehringer, Chiesi, Teva, Franciscus wetenschapsbureau) m.b.t. onderzoek bij astma en COPD, via ons expertisecentrum. Van belang hierbij is dat al het onderzoek niet medicatie-gerelateerd is. Zie boven bij onbetaald: Ik ben betrokken bij de bevordering van luchtkwaliteit en als zodanig word ik af en toe geconsulteerd met betrekking tot het schone Lucht Akkoord, een nationaal (door de overheid in gang gezet) platform dat maatregelen hierover in kaart brengt. Voorts ben ik betrokken bij het Vrij Ademen Akkoord, dat oa vanuit LAN, Longfonds, NRS en NVALT aandacht vraagt voor de (toekomstige) patient met een longziekte. |
Geen advieswerk over COPD of biologicals tijdens ontwikkeltraject van de richtlijn. Geen uitwerking van uitgangsvragen over longmedicatie of biologicals. |
|
Van Snippenburg |
Waarnemend Longarts; |
Secretaris Sectie COPD NVALT, onbetaald Werkgroep longen Huisartsen Utrecht Stad, betaald
|
Geen |
Geen |
|
Antons (vanaf oktober 2022) |
Longarts Radboudumc, Nijmegen |
Geen |
Geen |
Geen |
|
Kerstjens (vanaf oktober 2022) |
Hoogleraar longziekten UMCG, 1,0 FTE |
"Voorzitter Noordelijke CARA Stichting. Subsidiegevend orgaan. Onbetaald - Lid RvT bureau bijwerkingen geneesmiddelen LAREB. Betaald aan UMCG - Vz Stichting BEBO. Onafhankelijke METc. Betaald aan UMCG (per 1-1-2023 vz) - Vice-vz Netherlands Respiratory Society. Stichting ter bevordering van wetenschap en wetenschapsklimaat Longziekten NL. Onbetaald. (per 1-1-2023 vz).
Op afroep (geen vaste contracten of afspraken) deelname aan adviesraden van farmaceutische industrieën, en betaling voor lezingen: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. Alles betaald aan UMCG." |
"Geen persoonlijk financieel belang; alles wat er door mij binnenkomt wordt betaald aan UMCG. En krijg ik ook in tweede instantie nooit wat van. 2. Geen dienstverband 3. Betaald adviseurschappen zie bij overige item over nevenwerkzaamheden voor AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. 4. Geen directe fianicee belangen of via aandelen of opties. 5. Geen patenten"
"Veel gesponsord onderzoek, o.a. ZonMW VWS Innovatiefonds verzekeraars Industrie: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis." |
restricties ten aanzien van besluitvorming met betrekking tot modules over medicatie |
|
Knoops (vanaf oktober 2022) |
AIOS longziekten, Catharina Ziekenhuis Eindhoven |
Geen |
Geen |
Geen |
|
Tazmi (tot oktober 2020) |
Verpleegkundig specialist - werkzaam bij Laurens locatie Intermezzo |
Geen |
Geen |
Geen |
|
Van Jaarsveld |
Adviseur Zorg bij Longfonds |
Geen |
Geen |
Geen |
|
Muris |
Hoogleraar huisartsgeneeskunde, Universiteit Maastricht |
Vervangende werkzaamheden huisartspraktijk Geulle (betaald) |
Geen |
Geen |
|
Van der Meijs |
Apotheker, sinds 1 februari niet meer praktiserend lid namens de KNMP |
SIG-long (SIG = specialist interest group) van KNMP – vacatiegeld |
Geen |
Geen |
|
Van Litsenburg (vanaf oktober 2020) |
Verpleegkundig specialist astma en COPD 36 uur per week 24-uurs thuiszorgverpleegkundige 24 uur per week |
Bestuurslid IMIS (inhalatiemedicatie instructie school) 2u per week Coördinator IMIS Zuid Nederland IMIS trainer Docent Hogeschool Arnhem en Nijmegen Kernteam Picasso voor COPD (momenteel niet actief) Werkgroeplid palliatieve richtlijn COPD |
Kernteamlid Picasso (niet actief) |
Geen |
|
Leysner |
dietist Merem medische revalidatie in Hilversum" |
Incidenteel scholing geven aan studenten hogeschool Holland; betaald |
Geen |
Geen |
|
Wouters |
Bij aanvang AIOS longziekten, Rijnstate Ziekenhuis en thans longarts Ziekenhuis Gelderse Vallei Ede |
Geen |
Geen |
Geen |
|
Wagenaar |
Longervaringsdeskundige bij het Longfonds Geen betaalde functies |
Geen |
Geen |
Geen |
|
Kool |
Projectleider Zorgveld, Longfonds |
Geen |
Geen |
Geen |
|
Sillen |
Resultaatverantwoordelijk fysiotherapeut CIRO+, expertisecentrum voor chronisch orgaanfalen Horn |
Bestuurslid Vereniging voor Hart-, Vaat- en Longfysiotherapie (vacatievergoeding) Extern adviseur Fontys Hogeschool Eindhoven (betaald) Gastdocent Saxion Hogeschool, Enschede en Hogeschool van Amsterdam (betaald) |
Geen |
Geen |
|
Smit |
Longervaringsdeskundige Longfonds (vrijwilligerswerk) |
Geen |
Geen |
Geen |
Implementatie
Er werd aandacht besteed aan het patiëntenperspectief doordat een afgevaardigde patiëntenvereniging zitting nam in de werkgroep. De inbreng van de afgevaardigden is tevens verwerkt in de verslagen hiervan. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met COPD. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVALT, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de NVALT, V&VN Longverpleegkundigen, het Longfonds, NHG, NAPA en KNMP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
De werkgroep heeft uitgebreid over de belangrijkste uitkomstmaten voor de te bespreken interventies gediscussieerd. Het werd wenselijk geacht de set uitkomsten over de verschillende modules waar mogelijk hetzelfde te houden, en zeker met de zelfde minimale klinisch relevante verschillen. Bij specifieke interventies werden soms specifieke relevante uitkomsten toegevoegd. Voor sommige parameters kon geen referentie gevonden worden en werd als onderstaand beschreven een consensus standpunt ingenomen. De werkgroep onderkent dat de absolute risico reductie klinisch beter interpretabel is dan de relatieve, maar kon voor onvoldoende studies die getallen er bij vinden en hield dus vast aan de relatieve risico’s, met toelichting waar mogelijk.
• Exacerbation reduction: ≥20% (Jones, 2014; Chapman 2013)
• Pneumonia: ≥20% difference in relative risk
• Hospital admissions: ≥20% difference in relative risk
• Mortality: ≥10% difference in relative risk
• SGRQ-score: ≥4 units (Jones, 2014)
• CAT-score: >2 units (Kon 2014)
• CCQ-score: >0.4 units
• FEV1: >100 ml (Donohue 2005; Jones, 2014)
• Adverse events: ≥25% difference in relative risk
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1.1 Gebruik van inhalatiecorticosteroïden (ICS) bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.2 Triple therapie in 1 vs in meerdere devices bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.3 Onderhoudsantibiotica bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.4 Poliklinische behandeling van een COPD-longaanval |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.5 Biologicals bij COPD |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven
|
|
Module 2.1 Fysiotherapie in de eerste lijn
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.2 tweede en derdelijnsrevalidatie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.3 Voeding bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.1 Zuurstoftherapie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.2 Longvolumereductie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
|
Module 3.3 Chronische beademing bij COPD
|
n.v.t. |
Verwijzing naar andere richtlijn |
|
Module 4 COPD zelfmanagement
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 5 E-health
|
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten) en dat het een nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Het inzetten van digitale zorgtoepassingen zal zijn georganiseerd op lokaal/regionaal niveau en daarom worden op landelijk niveau geen substantiële financiële gevolgen verwacht.
|
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Chapman KR, Bergeron C, Bhutani M, et al. Do we know the minimal clinically important
difference (MCID) for COPD exacerbations? COPD 2013;10(2):243-9.
DOI:10.3109/15412555.2012.733463.
Donohue JF. Minimal clinically important differences in COPD lung function. COPD
2005;2(1):111-124. (http://www.ncbi.nlm.nih.gov/pubmed/17136971).
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Jones PW, Beeh KM, Chapman KR, Decramer M, Mahler DA, Wedzicha JA. Minimal clinically
important differences in pharmacological trials. Am J Respir Crit Care Med
2014;189(3):250-5. DOI: 10.1164/rccm.201310-1863PP.
Kon SS, Canavan JL, Jones SE, et al. Minimum clinically important difference for the COPD
Assessment Test: a prospective analysis. Lancet Respir Med 2014;2(3):195-203. DOI:
10.1016/S2213-2600(14)70001-3.
Kocks JW, Tuinenga MG, Uil SM, van den Berg JW, Stahl E, van der Molen T. Health status
measurement in COPD: the minimal clinically important difference of the Clinical
COPD Questionnaire. Respir Res 2006;7(1):62.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.