COPD zelfmanagement
Uitgangsvraag
Wat is nodig om een patiënt met COPD te ondersteunen om zelfmanagement (kennis en vaardigheden) te behouden en te bevorderen?
Aanbeveling
Het is wenselijk dat iedere COPD patiënt een individueel zorgplan krijgt op basis van persoonlijke behandeldoelen. Een belangrijk onderdeel van een individueel zorgplan is een longaanval actieplan.
De continuïteit van zorg moet gewaarborgd zijn, onderdeel van zelfmanagement is dat duidelijk moet zijn bij welke zorgverleners een patiënt terecht kan.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De review van Lenferink en de 6 aanvullende studies geven voornamelijk een goed beeld van zelfmanagementinterventies gericht op het voorkomen en/of verkorten van matige- en ernstige longaanvallen. Er zijn in totaal 28 studies meegenomen met iets meer dan 4000 patiënten die gedurende 3-24 maanden gevolgd zijn. 23 studies hebben patiënten met COPD geïncludeerd vanuit het ziekenhuis en 5 studies vanuit de huisarts. De studies zijn naast het voorkomen en/of verkorten van longaanvallen ook gericht op kwaliteit van leven.
Met betrekking tot de uitkomst HRQoL werd de als klinisch relevant beschouwde verandering van 4 punten bij SGRQ, niet gehaald. Het resultaat bedroeg slechts een verbetering van 2,69 punten. Het niveau van bewijs was redelijk. Er werd een significant effect gevonden voor de subgroep die in combinatie met de zelfmanagementinterventie ook actief deelnam in een stoppen met roken programma (-4.98 punten) (Lenferink 2017). Het probleem van subgroep analyses in de SR van Lenferink (2017) is dat subgroep analyses slechts uitgezocht konden worden in een deel van de studies omdat niet alle studies subgroepen rapporteerden.
Een bijkomend probleem binnen alle geïncludeerde studies is dat verschillende definities voor zelfmanagement gebruikt werden en soms de definitie slechts summier werd toegelicht.
Een andere beperkende factor is dat de follow-up voor de onderzochte uitkomsten beperkt was (range 3-24 maanden). Het is daardoor onduidelijk of de gevonden effecten van zelfmanagement blijven bestaan over een langere follow-up duur. Lenferink (2017) rapporteert dat slechts de helft van de geïncludeerde trials iets hebben gezegd over de therapietrouw van de te volgen interventie. Het hoge aantal deelnemers dat ‘lost to follow-up’ raakte in sommige trials suggereert dat de therapietrouw van de interventie mogelijk een probleem is. Uit de SR van Lenferink (2017) en aanvullende individuele trials komt niet naar voren hoe deze therapietrouw verbeterd kan worden. Mogelijk heeft deze “therapie trouw” ook nog te maken met de wijze waarop de interventie aangeboden wordt. Het gebruik van digitale middelen neemt toe, dit kan zowel na- als voordelen hebben, maar is in de huidige trial selectie niet onderzocht.
Voor de uitkomsten ‘ziekenhuisopname wegens een respiratoire aandoening’ en ‘ziekenhuisopname algemeen’ werd een klinisch relevant verschil gevonden ten voordele van zelfmanagement interventies.
Voor het gemiddeld aantal COPD longaanvallen, zowel matige longaanvallen in de thuissituatie als ernstige longaanvallen met ziekenhuis opname, werd geen verschil gevonden tussen zelfmanagementinterventies en gebruikelijke zorg. Hier dient opgemerkt te worden dat de analyse bemoeilijkt werd omdat niet alle studies konden worden gepoold omdat hiervoor relevante aanvullende informatie ontbrak. Ook werd de statistische analyse bemoeilijkt omdat de studies verschillende definities van een longaanval gebruiken.
Voor totale mortaliteit werd geen verschil gezien tussen zelfmanagement en gebruikelijke zorg.
Over het geheel genomen dient opgemerkt te worden dat alle studies verschillende exclusiecriteria hanteerden waardoor de generaliseerbaarheid van de gevonden verschillen niet zo maar één op één kunnen worden vertaald tot de dagelijkse praktijk. De gevonden gemiddelde verschillen zijn toepasbaar voor de gehele onderzochte groep, maar het beste advies voor een individuele patiënt kan toch anders uitvallen. Helaas bevatten de trials te weinig informatie om te kijken naar kwetsbare subgroepen zoals bijvoorbeeld patiënten met angst of stemmingsklachten of ernstige co-morbiditeit.
Conclusie; Studies over zelfmanagementinterventies zijn moeilijk met elkaar te vergelijken door verschillende in- en exclusiecriteria, outcome en interventies. Hierdoor zijn de resultaten niet consistent en is de bewijslast laag. Dat wil niet zeggen dat zelfmanagementinterventies bij patiënten met COPD niet zinvol zijn.
Nota bene: na het afronden van bovenstaande literatuurstudie is in 2022 een update gepubliceerd van de Cochrane review van Lenferink (Schrijver, 2022) met in de grote lijnen dezelfde conclusies als hierboven beschreven. De auteurs bevelen aan dat in nieuwe studies gestreefd wordt naar meer homogeniteit in uitkomstmaten, waarbij ook gedragsmatige veranderingen gemeten worden.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Binnen de zorg aan chronisch zieken neemt zelfmanagement een steeds belangrijkere plaats in. Van patiënten wordt verwacht dat zij zo goed mogelijk leren omgaan met (de gevolgen van) hun chronische ziekte in het dagelijks leven en dat zij hierin een actieve rol nemen. De gevolgen van een chronische aandoening uit zich op fysiek, sociaal en psychisch vlak. Het vervullen van een actieve rol in communicatie met zorgverleners en meebeslissen over de eigen behandeling wordt zowel door zorgverleners als door mensen met een chronische ziekte gezien als een belangrijk onderdeel van zelfmanagement en als teken van eigen regievoering (Heijmans, 2014; CBO, 2014). Maar slechts twee derde (62%) van de mensen met COPD ervaart meestal of altijd betrokken te zijn bij de behandeling of controle van de ziekte (Nivel, 2022). Voldoende gezondheidsvaardigheden zijn een belangrijke voorwaarde voor eigen regievoering en zelfmanagement. Mensen met onvoldoende of beperkte gezondheidsvaardigheden slagen er minder goed in om de regie te houden over hun ziekte en behandeling en hun leven als geheel (Heijmans, 2021).
46% van de mensen met COPD is onvoldoende of beperkt gezondheidsvaardig in vergelijking met 37% in de algemene Nederlandse bevolking. Met name de communicatie en (herhaalde) informatievoorziening op het juiste moment moet hierop worden afgestemd (Nivel, 2018).
Kennis over de aandoening is noodzakelijk om voldoende in staat te zijn om zelfmanagement toe te passen. Hierom is educatie een belangrijk onderdeel van een zelfmanagementprogramma.
Bovendien geeft bijna de helft van de mensen met COPD (47%) aan dat zij onvoldoende bruikbare informatie van hun arts krijgen om te werken aan hun gezondheid en welzijn (Nivel, 2022).
Omdat elke patiënt anders is moet er ruimte zijn voor een persoonlijke aanpak. Gebruik van een hulpmiddel zoals een individueel zorgplan (IZP) kan hierbij helpen. De eigen behandeldoelen van een patiënt op medisch, psychosociaal en maatschappelijk vlak spelen een centrale rol in een IZP. Slechts 10% van de mensen met COPD geeft aan een individueel zorgplan te hebben waarin hun wensen op het gebied van gezondheid, welzijn en het omgaan met hun longziekten zijn opgenomen; Het percentage mensen met een IZP is laag en is over de tijd niet significant veranderd. Van de mensen met een individueel zorgplan geeft 54% van de mensen met COPD aan dit daadwerkelijk te gebruiken.
Hoewel deze percentages laag zijn geeft de meerderheid van de mensen met een zorgplan wel aan dat het hen helpt bij zelfmanagement en bijdraagt aan een betere afstemming van de zorg (Nivel, 2018). Onderdeel van een IZP is een longaanval actieplan, gericht op zelfmanagement bij toename van klachten en acute longaanvallen COPD.
Kosten (middelenbeslag)
Het voorkomen en/of verkorten van een longaanval, vooral als dit een ernstige longaanval betreft, bespaart kosten door het voorkomen van een ziekenhuisopname. In de SR van Lenferink, 2017 wordt zeker positieve bewijslast gevonden dat zelfmanagement een gemiddeld effect heeft op ziekenhuisopnames in het algemeen en ook als het gaat om alleen respiratoire opnames. Het is niet onderzocht was het effect is van zelfmanagementinterventies op arbeidsparticipatie en de kostenaspecten daarvan.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
De werkgroep is van mening dat het toepassen van zelfmanagementinterventies bij patiënten met COPD zinvol is. De uitkomsten in de literatuursearch geven een wat beperkt overzicht van de voordelen omdat er vooral onderzoek gedaan is naar het effect van een longaanval actieplan. Hierbij werd een klinisch relevant verschil gevonden ten gunste van zelfmanagement op de uitkomsten ‘ziekenhuisopname wegens een respiratoire aandoening’ en ‘ziekenhuisopname algemeen’ en een klein effect op HRQoL.
Zoals in de inleiding van deze module is aangegeven is zelfmanagement veel breder dan alleen het voorkomen van longaanvallen (Fan, 2012). Namelijk het toepassen van persoonsgerichte zorg met aandacht voor;
- De individuele behoefte, motivatie en mogelijkheden van de patiënt en zijn omgeving
- Gedeelde besluitvorming/ Samen beslissen
- Het bevorderen van zelfmanagement met het oog op het ondersteunen van de eigen regie van de patiënt over gezondheid en ziekte.
- Het vraagt specifieke gespreksvaardigheden van een zorgverlener en voldoende tijd om de patiënt en zijn omgeving kennis en gezondheidsvaardigheden aan te leren die leiden tot een beter zelfmanagement. Dit vastleggen in een gezamenlijk, met de patiënt en zijn omgeving opgesteld individueel zorgplan, inclusief een longaanval actieplan, kan leiden tot een betere kwaliteit van leven en een betere communicatie tussen de patiënt en zijn omgeving en met de zorgverleners. Persoonlijke behandeldoelen van een patiënt dienen centraal te staan in het komen tot een IZP. Het longfonds biedt belangrijke handvatten voor een IZP, minimale onderdelen zijn;
- Diagnose(s)
- Beschrijving van de klachten/vragen en van gezondheidsproblemen
- Beschrijving van problemen in functioneren en participeren bijv. werk, huishouden
- Bevindingen lichamelijk en ander onderzoek (bijv. longfunctietest, allergieën)
- Meet- en streefwaarden bijv. van bewegen, BMI, indien relevant
- Beschrijving van motivatie en bereidheid tot gedragsverandering en (zelfmanagement) vaardigheden.
- Medicatieoverzicht
- Doelen van de patiënt die de patiënt en zorgverlener kiezen om aan te werken
- Het prioriteren van behandelopties gericht op de doelen van de patiënt
- Afspraken over de aanpak die nodig is om de gestelde doelen te bereiken, onderscheiden naar wat de patiënt zelf doet, welke ondersteuning waarbij nodig is en wie die ondersteuning zal bieden.
- Vastleggen begeleiding van de patiënt door de zorgverleners.
- Vastleggen vast aanspreekpunt / centrale zorgverlener / case manager voor de patiënt.
- Vastleggen hoe en wanneer afspraken worden geëvalueerd.
- Toevoegen van instrumenten voor zelfzorg en zelfmeting.
- Toevoegen van een dagboekfunctie.
- Toevoegen van informatie en educatie bijv. een zelfmanagementprogramma
Hierbij wordt specifiek benoemd dat het voor een patiënt heel belangrijk is dat continuïteit van zorg geboden wordt en duidelijk afgesproken is bij welke zorgverlener op welk moment een patiënt om hulp of advies kan vragen. In het streven naar één loket zal het niet altijd mogelijk zijn om alle zorg in één hand te houden, maar dient voor een individuele patiënt wel duidelijk te zijn tot wie hij/zij zich kan wenden.
Het is aannemelijk dat als bovenstaande wordt toegepast zowel door behandelaars als patiënt en eigen omgeving de uitkomsten op patiëntniveau op vele onderdelen kunnen verbeteren.
Onderbouwing
Achtergrond
Gezondheid wordt steeds meer gezien als het vermogen je aan te passen aan veranderende omstandigheden en je eigen regie te voeren in het licht van de sociale, fysieke en emotionele uitdagingen van het leven. Het vermogen je aan te passen kan geleerd en ontwikkeld worden.
Dit vraagt om de juiste begeleiding van de zorgverlener waarbij persoonsgerichte zorg als basis dient.
Persoonsgerichte zorg:
- Is aandacht voor de behoefte, motivatie en mogelijkheden van de patiënt.
- Kent gedeelde besluitvorming
- Leidt tot het bevorderen van zelfmanagement met het oog op het ondersteunen van de eigen regie van de patiënt over gezondheid en ziekte.
De zorgverlener bepaald hierin niet wat goed is voor de patiënt maar vraagt wat de patiënt belangrijk vindt.
Zelfmanagement is onderdeel van persoonsgerichte zorg en betekent gestructureerd zorg op maat aanbieden met als doel het motiveren van de patiënt tot het ontwikkelen van kennis en vaardigheden die hun gedrag beïnvloeden om beter met hun ziekte om te gaan. Onderdelen waarmee deze ondersteuning geboden kan worden zijn het geven van voorlichting, educatie en het aanleren van gezondheidsvaardigheden.
Een individueel zorgplan (IZP) is een hulpmiddel dat op basis van juiste diagnostiek en aangrijpingspunten voor behandeling gebruikt kan worden om patiënten te begeleiden in het omgaan met hun chronische ziekte door patiënten de regie te geven over hun eigen ziekte en de behandeling daarvan. Door concrete en haalbare doelen in het individueel zorgplan op te nemen, waaronder een longaanval actieplan, leren zij de chronische aandoening beter in te passen in hun leven en adequaat te handelen bij verergering van klachten. Zodoende is het individueel zorgplan helpend voor zorgverlener en patiënt.
Onderwerpen die in het individueel zorgplan kunnen staan zijn;
- Ziektegerelateerd zoals adequaat bewegen, medicatie waaronder inhalatietechniek en gebruik, zuurstof gebruik, balans tussen draagkracht en draaglast, rookgedrag, voeding, longaanval actieplan.
- Sociaal gerelateerd zoals communicatie met eigen omgeving en zorgverleners, bijvoorbeeld het informeren van je omgeving over de ziekte, afstemming van activiteiten met je omgeving, vragen stellen over beloop van de ziekte en levenseinde.
- Materieel gerelateerd zoals inspanningen doen voor aanvraag hulpmiddelen, hoe om te gaan met inkomensverlies
- Persoonlijk gerelateerd zoals verliesverwerking, ziektecognitie en stressverwerking.
Een longaanval actieplan kan onderdeel zijn van het individueel zorgplan. Een longaanval actieplan kan stapsgewijs hulp bieden bij toename van klachten. Idealiter worden zowel medicamenteuze als niet-medicamenteuze adviezen, bijvoorbeeld ten aanzien van opvang dyspnoe, gegeven in een longaanval actieplan en wordt duidelijk afgesproken tot welke zorgverlener een patiënt zich kan wenden bij toename van klachten.
Naast het individueel zorgplan zijn er andere middelen die gebruikt (kunnen) worden ter behoud/verbetering van zelfmanagement. Het is op dit moment niet duidelijk welke vorm van ondersteuning het meest geschikt is voor het bevorderen van zelfmanagement en op welk doel dit aangrijpt. Zelfmanagementinterventies, activiteiten of procedures ter verbetering van de manier waarop patiënten zelf hun COPD beheren, kunnen patiënten mogelijk helpen omgaan met de dagelijkse gevolgen van hun aandoening, en hoe zij een optimale levenskwaliteit kunnen bereiken of behouden. Een individueel zorgplan is een voorbeeld van een zelfmanagement interventie, die belangrijk is in de gezondheidszorg omdat een zorgplan mogelijk kan bijdragen tot gedragsverandering en betere gezondheidsresultaten. Een individueel zorgplan omvat, evenals andere zelfmanagementinterventies een regelmatige evaluatie van de vooruitgang en de problemen betreffende het managen van COPD.
Conclusies / Summary of Findings
Health related quality of life (HRQoL)
|
Moderate GRADE |
Self-management interventions including a written action plan for acute exacerbations of COPD (AECOPD) likely results in a small but inconsistent effect on HRQoL (measured by the St. George’s Respiratory Questionnaire (SGRQ)) when compared with usual care
Lenferink (2017) |
Respiratory-related hospital admissions
|
Moderate GRADE |
Self-management interventions including an action plan for acute exacerbations of COPD (AECOPD) probably results in a reduction in respiratory-related hospital admissions when compared with usual care
Lenferink (2017) |
All cause related hospital admissions
|
Moderate GRADE |
Self-management interventions including an action plan for acute exacerbations of COPD (AECOPD) probably results in a reduction in all cause related hospital admissions when compared with usual care
Lenferink (2017) |
Acute exacerbations of COPD
|
Low GRADE |
Self-management interventions including an action plan for acute exacerbations of COPD (AECOPD) may result in little to no difference in number of acute exacerbations of COPD when compared with usual care
Lenferink (2017) |
All-cause mortality
|
Moderate GRADE |
Self-management interventions including an action plan for acute exacerbations of COPD (AECOPD) probably do not reduce all-cause mortality when compared with usual care
Lenferink (2017) |
Samenvatting literatuur
Description of studies
Design
Lenferink (2017) performed a systematic review (SR) with meta-analysis (when appropriate) to investigate the efficacy of COPD-specific self-management interventions that include an action plan for exacerbations of COPD compared with usual care. The literature search was performed from January 1995 until May 2016.
The design of the 6 randomized clinical trials that were additionally included were all open label trials and also investigated the efficacy of COPD-specific self-management interventions that include an action plan for exacerbations of COPD compared with usual care.
Participants
In Lenferink (2017), Participants diagnosed with COPD according to the Global Initiative for Chronic Obstructive Lung Disease (GOLD 2017) classification criteria were included; people with a post- bronchodilator forced expiratory volume in one second (FEV )-to-forced vital capacity (FVC) ratio < 0.70. Participants with primary diagnoses of asthma were excluded.
In Johnson Warrington (2016), participants were included if they had an established diagnosis of COPD and grade 2–5 dyspnea according to the Medical Research Council. Patients were excluded if an admission was not due to an acute exacerbation of COPD.
In Zwerink (2016), participants were eligible when they had a clinical diagnosis of COPD according to Global Initiative for Chronic Obstructive Lung Disease (GOLD);3 forced
expiratory volume in 1 s (FEV1) of 25–80% of predicted; at least three exacerbations or one respiratory related hospital admission in the 2 years prior to inclusion. Patients were excluded when they had comorbidities with a low survival rate, or influencing lung function or bronchial symptoms.
In Sanchez-Nieto (2016), participants were recruited from a hospital’s database if they had been treated in the A&E or had been hospitalized for an exacerbation of COPD at least once during the year prior to inclusion in the study. Patients were called to participate in the study if at least 3 months had elapsed since the episode of hospital care. Exclusion criteria were not described.
In Lenferink (2019), patients with COPD and one to five highly prevalent comorbidities were included. Exclusion criteria were not described.
In Benzo (2016), Patients admitted for a COPD exacerbation were contacted in the hospital before their discharge and invited to participate. Patients were excluded if they had any medical conditions that would impair their ability to participate in the study or to provide informed consent or if they were receiving hospice care.
In Folch-Ayora (2019), Patients diagnosed with COPD were included in the study, based on a history of smoking (active or previous) of at least 20 packs per year, along with barely reversible air flow obstruction defined as a ratio of forced expiratory volume in the first second (FEV1)/forced vital capacity (FVC) below 70 after bronchodilation. The principal motive for their hospital admission was COPD exacerbation as determined by the International Classification of Diseases, 9th Revision (ICD-9) 491.2. All the patients were admitted to the hospital at the time of the uptake. Patients were excluded if they could not communicate due to physical or psychological disabilities and patients in a terminal state with a life expectancy under six months
according to clinical criterion.
Exposure definitions
In the SR of Lenferink (2017) and the additional 6 randomized clinical trials, the intervention treatment was defined as a COPD self-management intervention that included a written action plan for acute exacerbations of AECOPD. An action plan refers to specific behavior to be initiated when respiratory symptoms deteriorate; the plan needed to describe when, where and how one should act. An action plan is an agreed strategy by which people act appropriately when symptoms deteriorate (indicating the start of a COPD exacerbation), for example, by contacting a healthcare provider for support or initiating self-treatment. It may also include maintenance treatment and advice to avoid situations in which viral infection might be prevalent. The intervention content could be delivered to participants verbally, in writing (hard copy or digital) or via audiovisual media.
Of note, The actions defined for AECOPD differed among studies (e.g., take direct action
when symptoms get worse versus start action 48 hours after onset of symptoms if AECOPD symptoms persist or do not improve), and were not always very detailed (e.g., participants could call a team if they think they have an infection and the team would “maybe” advise to take antibiotics (Hernández 2015)).
The comparator treatment was usual care defined as de facto routine clinical care.
Outcomes
In all reported studies, with the exception of Zwerink (2016) and Lenferink (2019), the primary outcome was health-related quality of life (HRQoL) and/or respiratory related hospital admissions. Secondary outcomes were total hospital admissions, COPD exacerbations and all-cause mortality. In Zwerink (2016), the primary outcome was severity and duration of COPD exacerbations. In Lenferink (2019), the total number of COPD exacerbation days per patient per year was defined as the primary outcome.
Study characteristics
In total 28 studies (all open label randomized clinical trials) met de inclusion criteria (total n=4141). 23 studies recruited participants from hospitals, of which 14 studies from outpatient clinics. Five studies recruited participants from general practices.
The median follow-up duration in Lenferink (2017) was 12 months (interquartile range 5.3-12.0) and In total 3293 (85%) participants completed the study follow-up. The median follow-up duration of the additional 6 trials was 12 months (range 3-27 months) in which 812 (92%) participants completed the study follow-up
Results
Health-related quality of life (HRQoL)
COPD-specific HRQoL was measured by the St. George’s Respiratory Questionnaire (SGRQ) in 11 studies. Over 12 months of follow-up, Lenferink (2017) showed that the included studies showed lower mean SGRQ total scores (meaning better HRQoL) in the self-management intervention compared with the usual care group. The mean difference of -2.69 (95% CI -4.49 to -0.90), indicated better HRQoL in the intervention group compared to the control group (see also the evidence table). The pooled mean difference of -2.69 did not reach the minimal clinically important difference (- 4 units). Folch-Ayora (2018) reported a mean difference of -6.83 points in the intervention group and -0.26 in the control group over a 27 month follow-up. This study could not be included in the meta-analysis because SDs were not reported.
Please note that the forest plot that was produced by Lenferink (2017) (Figure 5 in that study) could not be reproduced here as Lenferink (2017) only provided the mean differences in the intervention group vs the control group (and not a mean or a mean difference in both the intervention group and the control group).
Respiratory-related hospital admissions
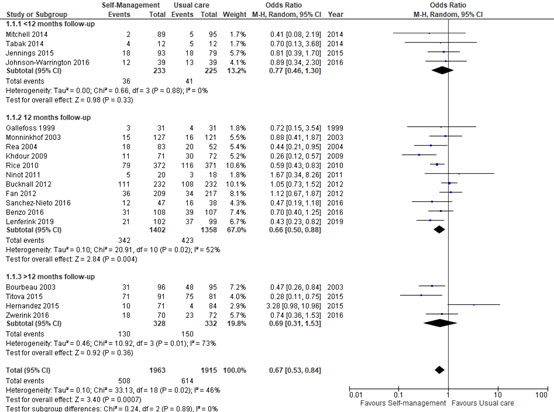
Respiratory-related hospital admissions were reported in 19 studies. A lower
probability of at least one respiratory-related hospital admission (follow-up range 3-24 months) was noted among participants who received the self-management intervention that included an action plan compared with those who received usual care (OR 0.67, 95% CI 0.53 to 0.84). The pooled OR of 0.67 did reach the minimal clinically important difference (OR <0.8). A subgroup analysis stratified on follow-up time (< 12 months vs 12 months vs > 12 months) did not show a waning off of the effect.
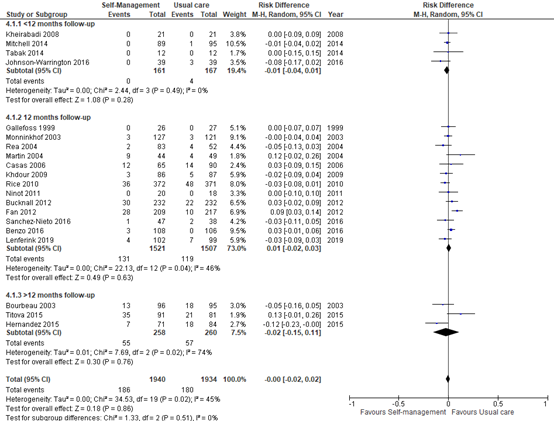
Figure 1. Forest plot of comparison: Self-management versus usual care, outcome: Respiratory-related hospital admissions (number of patients with at least one admission)
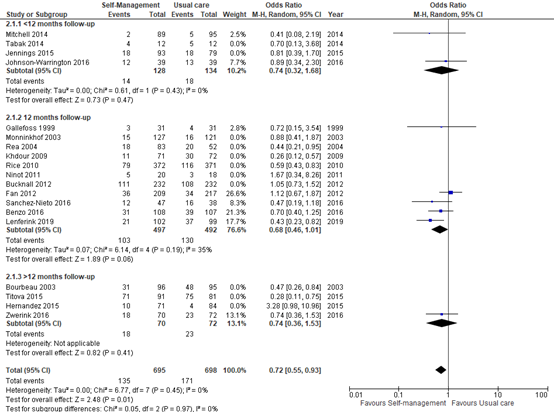
Results were somewhat inconsistent. To explore if the inconsistency could be due to bias, the analysis was restricted to those studies that had few issues of bias. ‘Few issues of bias’ was defined as follows:
by the judgement of Lenferink (2017), where of the seven potential sources of bias that were scored, there should be at least 5 in which the score was considered as low risk of bias
By the judgment of the risk of bias assessment of the 6 additional trials, where the overall concerns were scored as ‘Low concerns’ or ‘Some concerns’
Figure 2. Forest plot of comparison: Self-management versus usual care, outcome: Respiratory-related hospital admissions (number of patients with at least one admission): sensitivity analysis: only studies with low risk of bias are included
The pooled OR was now 0.72 (95% CI, 0.55-0.93) with less inconsistency (I2=0 in the sensitivity analysis vs I2=46% in the main analysis).
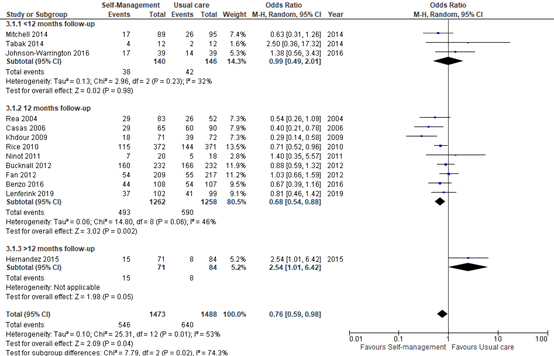
All-cause hospital admissions
All-cause hospital admissions were reported in 11 studies. The OR in all-cause hospital admissions (follow-up range 6-24 months) was 0.76 (95% CI 0.59 to 0.98). Only one study (Hernandez, 2015) reported outcomes after a follow-up of >1 year. The pooled OR of 0.76 did reach the minimal clinically important difference (OR <0.8), but the result was inconsistent.
Figure 3. Forest plot of comparison: Self-management versus usual care, outcome: all cause hospital admission (number of patients with at least one admission)
We could not explore if the inconsistency could be due to bias, as this led too few studies to make a valid comparison (high risk of imprecision).
COPD exacerbations
Bischoff (2012) defined exacerbations as a change for at least two consecutive days in either two or more major symptoms (dyspnoea, sputum purulence, sputum amount) or any one major symptom plus at least one minor symptom (colds, wheeze, sore throat, cough). Fan (2012) defined AECOPD as an increase in or new onset of one or more respiratory symptoms (cough, sputum, wheezing, dyspnoea or chest tightness) persisting for at least two days. Jennings (2015) defined an exacerbation as an acute event characterized by a worsening of the participant’s respiratory symptoms beyond normal day-to-day variations, leading to a change in medication. Bösch (2007) did not provide a definition of exacerbations, but indicated that exacerbations were treated with antibiotics. Monninkhof (2003) defined exacerbations as worsening of respiratory symptoms that required treatment with a short course of systemic corticosteroids or antibiotics. Zwerink (2016) did not define exacerbation. Sanchez-Nieto (2016) defined exacerbation as a sustained worsening of the patient’s condition from a stable state, with acute onset and beyond normal day-to-day variations, which requires treatment or additional care. Lenferink (2019) defined exacerbation as a clear negative change in two
symptoms classified major (dyspnoea, sputum purulence, sputum volume) or one major and one minor symptom (coughing, wheezing, fever) from baseline, for ⩾2 consecutive days.
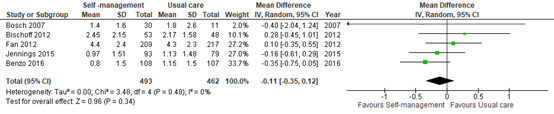
Data from five studies on the mean number of exacerbations per participant (follow-up range 3-24 months) were not different (mean difference -0.11, 95% CI -0.35 to 0.12).
Monninkhof (2003) reported an average of 2.8 exacerbations in the intervention group and 1.5 in the control group over a 12 month follow-up. This study could not be included in the meta-analysis because SDs were not reported. Sanchez Nieto reported an average of 0.89 exacerbations in the intervention group and 1.37 in the control group over a 12 month follow-up period. This study could not be included in the meta-analysis because SDs were not reported. Zwerink (2016) reported that the median number of excacerbations over a 24 month follow up period was six in both groups. This study could also not be included in the meta-analysis because SDs were not reported. Lenferink (2019) reported a median of 2.0 excacerbations in the control group versus 1.1 in the intervention group. This study could also not be included in the meta-analysis because SDs were not reported.
Figure 4. Forest plot of comparison: Self-management versus usual care, outcome: COPD excacerbations (mean number per patient)
Of note, the mean/ median number of excacerbations in patients differed between studies, which might have to do with the exposure definition which was different in all studies. It may also have to do with the clinical setting or duration of follow-up (see below).
Study Setting Follow-up
Bösch 2007 hospital (outpatient) 12 months
Fan 2012 hospital (outpatient) 12 months
Bischoff 2012 general practice 24 months
Jennings 2015 hospital (inpatient) 3 months
Monnikhof 2003 hospital (outpatient) 12 months
Zwerink (2016) hospital (outpatient) 24 months
All-cause mortality
Twenty studies in a meta-analysis of all-cause mortality were included (follow-up range 3-24 months). No differences in mortality were found between intervention and control group participants (risk difference 0.00, 95% CI -0.02 to 0.02)
Figure 5. Forest plot of comparison: Self-management versus usual care, outcome: all-cause mortality
Level of evidence of the literature
The level of evidence (GRADE method) is determined per comparison and outcome measure and is based on results from systematic review of randomized trials and therefore starts at level “high”. Subsequently, the level of evidence was downgraded if there were relevant shortcomings in one of the several GRADE domains: risk of bias, inconsistency, indirectness, imprecision, and publication bias.
The level of evidence regarding the outcome measure health related quality of life (HRQoL) was downgraded by 1 level because of imprecision. Of note, this is not in accordance with the assessment of Lenferink (2107), who graded the level of evidence for this outcome measure as high. However, since the clinical relevance of the outcome measure (more than 4 units) was not achieved (i.e., 2.69 units in favor of self-management), while the 95% confidence interval (-4.49 to -0.90) included the clinical relevance level, it was decided to downgrade the evidence by 1 level for imprecision.
The level of evidence regarding the outcome measure respiratory related hospital admission was downgraded by 1 level because of risk of bias (1 level, open label study potential of diagnostic suspicion bias). Although the overall result showed inconsistency, a sensitivity analysis showed with sufficient power that this inconsistency was due to studies that had a high risk of bias.
The level of evidence regarding the outcome measure all cause hospital admission was downgraded by 1 level because of inconsistency (1 level, conflicting results).
The level of evidence regarding the outcome measure COPD excacerbations was downgraded by 2 levels because of risk of bias (1 level, unclear definition of COPD exacerbation in the individual studies) and imprecision (1 level)
The level of evidence regarding the outcome measure all-cause mortality
was downgraded by 1 level because of risk of inconsistency (1 level, conflicting results).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
Do COPD-specific self-management interventions, that include action plans for acute exacerbations of COPD (AECOPD) in patients with COPD lead to better health outcomes compared with usual care only?
P: patients patients with COPD
I: intervention a self-management intervention that includes a written action plan for
AECOPD and an iterative process between participant and healthcare
provider(s) in which feedback was provided
C: comparison usual care
O: outcome health-related quality of life (HRQoL), respiratory related hospital
admissions, all hospital admissions, COPD exacerbations, all-cause
mortality
Relevant outcome measures
The guideline development group considered Health-related quality of life (HRQoL), respiratory related hospital admissions, all hospital admissions, COPD exacerbations, as outcomes for decision making.
The working group defined a set of minimal clinically (patient) important differences (see introduction for further details). For this intervention, the following set was chosen:
- Exacerbation reduction: ≥20%
- Pneumonia: ≥20% difference in relative risk
- CAT-score: >2 units
- CCQ-score: >0.4 units
- SGRQ-score: ≥4 units
- Hospital admissions: ≥20% difference in relative risk
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 16 March 2021. This search strategy can be found in the Methods section. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 642 hits, including 128 systematic reviews, 356 randomized controlled trials (RCTs) and 258 comparative observational studies, which included all elements of the PICOs:
- Patients with COPD
- Self-management intervention that includes a written action plan for AECOPD
- Usual care.
- Investigated at least one of the outcomes as reported in the PICOs
A total of 11 systematic reviews of randomized clinical trials were initially selected based on title and abstract screening. After reading the full text, 10 systematic reviews were excluded (see the table with reason for exclusion under the tab Methods), and 1 systematic review (a Cochrane review of Lenferink, 2017) was included. The systematic review of Lenferink (2017) was performed until May 2016. Additional randomized trials that were published after this date were also selected based on title and abstract screening. After reading the full text, 6 additional randomized trials were included.
Results
One systematic review and 6 additional randomized clinical trials were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Baan, D., Heijmans, M., Spreeuwenberg, P., Rijken, M. Zelfmanagement vanuit het perspectief van mensen met astma of COPD. Utrecht: NIVEL, 2012.
- Benzo R, Vickers K, Novotny PJ, Tucker S, Hoult J, Neuenfeldt P, Connett J, Lorig K, McEvoy C. Health Coaching and Chronic Obstructive Pulmonary Disease Rehospitalisation. A Randomized Study. Am J Respir Crit Care Med. 2016 Sep 15;194(6):672-80. doi: 10.1164/rccm.201512-2503OC. PMID: 26953637; PMCID: PMC5027231.
- Fan VS, Gaziano JM, Lew R, Bourbeau J, Adams SG, Leatherman S, Thwin SS, Huang GD, Robbins R, Sriram PS, Sharafkhaneh A, Mador MJ, Sarosi G, Panos RJ, Rastogi P, Wagner TH, Mazzuca SA, Shannon C, Colling C, Liang MH, Stoller JK, Fiore L, Niewoehner DE. A comprehensive care management program to prevent chronic obstructive pulmonary disease hospitalisations: a randomized, controlled trial. Ann Intern Med. 2012 May 15;156(10):673-83. doi: 10.7326/0003-4819-156-10-201205150-00003. PMID: 22586006.Folch-Ayora A, Orts-Cortés MI, Macia-Soler L, Andreu-Guillamon MV, Moncho J. Patient education during hospital admission due to exacerbation of chronic obstructive pulmonary disease: Effects on quality of life-Controlled and randomized experimental study. Patient Educ Couns. 2019 Mar;102(3):511-519. doi: 10.1016/j.pec.2018.09.013. Epub 2018 Sep 16. PMID: 30279028.
- Heijmans, M., Willems, A., Scherpenzeel, A. Eigen regie over ziekte en zorg: ervaringen van mensen met een chronische longziekte. Utrecht: Nivel, 2022.
- Heins, M.J., Spreeuwenberg, P., Heijmans, M. Leven met een longziekte in Nederland: cijfers en trends over de zorg- en leefsituatie van mensen met een longziekte 2018. Utrecht: Nivel, 2019.
- Johnson-Warrington V, Rees K, Gelder C, Morgan MD, Singh SJ. Can a supported self-management program for COPD upon hospital discharge reduce readmissions? A randomized controlled trial. Int J Chron Obstruct Pulmon Dis. 2016 Jun 2;11:1161-9. doi: 10.2147/COPD.S91253. PMID: 27330284; PMCID: PMC4898045.
- Lenferink A, Brusse-Keizer M, van der Valk PD, Frith PA, Zwerink M, Monninkhof EM, van der Palen J, Effing TW. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Aug 4;8(8):CD011682. doi: 10.1002/14651858.CD011682.pub2. PMID: 28777450; PMCID: PMC6483374.
- Lenferink A, van der Palen J, van der Valk PDLPM, Cafarella P, van Veen A, Quinn S, Groothuis-Oudshoorn CGM, Burt MG, Young M, Frith PA, Effing TW. Exacerbation action plans for patients with COPD and comorbidities: a randomised controlled trial. Eur Respir J. 2019 Nov 7;54(5):1802134. doi: 10.1183/13993003.02134-2018. PMID: 31413163.
- Sánchez-Nieto JM, Andújar-Espinosa R, Bernabeu-Mora R, Hu C, Gálvez-Martínez B, Carrillo-Alcaraz A, Álvarez-Miranda CF, Meca-Birlanga O, Abad-Corpa E. Efficacy of a self-management plan in exacerbations for patients with advanced COPD. Int J Chron Obstruct Pulmon Dis. 2016 Aug 17;11:1939-47. doi: 10.2147/COPD.S104728. PMID: 27574418; PMCID: PMC4994798.
- Schrijver J, Lenferink A, Brusse-Keizer M, Zwerink M, van der Valk PDLPM, van der Palen J, Effing TW. Self?management interventions for people with chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews 2022, Issue 1. Art. No.: CD002990. DOI: 10.1002/14651858.CD002990.pub4.
- Zwerink M, Kerstjens HA, van der Palen J, van der Valk P, Brusse-Keizer M, Zielhuis G, Effing T. (Cost-)effectiveness of self-treatment of exacerbations in patients with COPD: 2 years follow-up of a RCT. Respirology. 2016 Apr;21(3):497-503. doi: 10.1111/resp.12697. Epub 2015 Dec 9. PMID: 26647766.
Evidence tabellen
Evidence tables
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Do COPD-specific self-management interventions, that include action plans for acute exacerbations of COPD (AECOPD) in patients with COPD lead to better health outcomes compared with usual care only?
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Lenferink (2017) |
Yes |
Yes |
Yes |
Yes |
not applicable |
Yes |
Yes |
Unclear. Funnel plot analyses performed for the study outcomes HRQoL and respiratory-related hospital admissions, but not for the other outcomes |
Yes. Sponsored by the Lung Foundation Australia/Cochrane Airways Australia Scholarship 2016; no other potential sources of conflicts of interest. |
Table of quality assessment for systematic reviews of RCTs
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
Risk of bias tables
Risk of bias table for intervention studies (randomized controlled trials; based on Cochrane risk of bias tool and suggestions by the CLARITY Group at McMaster University)
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-09-2023
Beoordeeld op geldigheid : 31-08-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met COPD.
Samenstelling van de werkgroep
Werkgroep
- Dr. F. (Folkert) Brijker, longarts, werkzaam in het Spaarne Gasthuis te Haarlem, NVALT (voorzitter, vanaf oktober 2022)
- Dr. J.S. (Jaring) van der Zee, longarts, NVALT (voorzitter, tot oktober 2022)
- Dr. W.H. (Wouter) van Geffen, longarts, werkzaam in het Medisch Centrum Leeuwarden te Leeuwarden, NVALT
- Drs. R. (Renée) van Snippenburg, werkzaam bij Ksyos en waarnemend longarts, NVALT
- Dr. J.C.C.M. (Hans) in ’t Veen, longarts, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVALT
- M. (Moniek) Wouters, longarts, werkzaam in het Ziekenhuis Gelderse Vallei te Arnhem, NVALT
- Prof. H.A.M. (Huib) Kerstjens, hoogleraar longziekten, longarts, werkzaam in het UMCG te Groningen, NVALT (vanaf oktober 2022)
- J. (Jeanine) Antons, longarts, werkzaam in het RadboudUMC te Nijmegen, NVALT (vanaf oktober 2022)
- Drs C.L.Y. (Chantal) Knoops, AIOS longgeneeskunde, werkzaam in het Catharina Ziekenhuis te Eindhoven (vanaf oktober 2022)
- Prof. J.W.M. (Jean) Muris, huisarts, werkzaam bij de Universiteit Maastricht, lid van de NHG-Expertgroep CAHAG, NHG
- Drs. E.R. (Erik) van der Meijs, apotheker, KNMP
- W.J.M. (Walter) van Litsenburg, verpleegkundig specialist longgeneeskunde, Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. M.J.H. (Maurice) Sillen, fysiotherapeut, werkzaam bij CIRO, KNGF
- R.A. (Renée) Kool, projectleider, Longfonds
- R. (Ramona) Leysner, diëtiste, Nederlandse Vereniging van Diëtisten (NVD)
- Drs. M. (Menno) Wagenaar, patiëntvertegenwoordiger, Longfonds
- J. (Johan) Smit, patiëntvertegenwoordiger, Longfonds
Met ondersteuning van
- Dr. M. (Margriet) Moret, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. N. (Nicole) Verheijen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten en longarts
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Inbreng patiëntenperspectief
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Brijker (voorzitter, vanaf oktober 2022) |
Longarts Spaarne Gasthuis |
Voorzitter sectie COPD NVALT. Dit is een onbetaalde functie binnen de longartsenvereniging NVALT. Lid regionale kwaliteitscommissie COPD/astma. Deze Commissie heeft 2x per jaar vergadering a 2 uur per keer in de avonduren en hiervoor ontvang ik onkostenvergoeding. Docent CASPIR cursussen. dit betreft scholing voor spirometrie voor huisartsen en POH-ers in de regio. Dit vindt een aantal keer per jaar plaats (<5 keer) in de avonduren en hiervoor ontvang ik een onkostenvergoeding |
Geen |
Geen |
|
*Van der Zee (voorzitter, tot oktober 2022) |
Longarts OLVG Amsterdam 0,2FTE tot 1-1-2020 Longarts Amsterdam UMC, locatie AMC, 0,2 FTE |
Lid MEC-U Locatie Nieuwegein, onkosten vergoeding Lid Gezondheidsraad Commissie Gespoten PUR, onkosten vergoeding Incidenteel medische expertises (o.a. DAS, ARAG, Triage, de Rechtspraak), betaald 2019 Speakers fee, Astra-Zeneca, Novartis, Chiesi 2019 1x Ad hoc Advies m.b.t. biologicals bij astma, GSK, betaald |
Geen |
Geen advieswerk tijdens het richtlijnontwikkeltraject |
|
Van Geffen |
Longarts Medisch Centrum Leeuwarden, maatschap Friese Longartsen |
Editorial board Cochrane Airways: Onbetaald Commisie Bronkhorst Nvalt: Onbetaald Richtlijn Commissie NVALT NSCLC: Onbetaald |
Deelname aan een investigator initiated onderzoek firma Novartis. financiering is overgemaakt aan UMCG (2017 beëindigd). Voor de bedrijven Chiesi, Roche, Boehringer en AstraZeneca deelname aan adviesraden betreffende oncologie. Deze gingen niet over COPD of biologicals. De hiervoor gebruikelijke CGR vergoeding werd geweigerd. Chiesi en Boehringer waren wel COPD, maar niet in de laatste 1.5 jaar. |
Geen advieswerk op gebied van COPD of biologicals tijdens het richtlijnontwikkeltraject |
|
In 't Veen |
Longarts bij In 't Veen Longarts BV. Verbonden aan de vakgroep longziekten en STZ expertisecentrum Astma, COPD & Respiratoire Allergie van het Franciscus Gasthuis en Vlietland, Rotterdam. |
Onbetaald: Opleider longziekten Franciscus Gasthuis en Vlietland Lid Concilium Opleiding NVALT Lid Vrij Ademen Akkoord namens NVALT Betrokken longarts bij Schone Lucht Akkoord Lid Move2Improve Lid werkgroep Ziektelastmeter; Generiek en COPD (afgerond) Voorzitter StichtingRoLeX (Rotterdam Leeuwarden eXpertise voor obstructieve longzieken), een stichting die nascholing voor longartsen (i.o.) verzorgd. Bestuurslid LAN Betaald: Longfunctiebeoordelaar Huisartsenlaboratorium STAR-SHL NHG richtlijn COPD namens NVALT Adviseurschap m.b.t. astma: Sanofi, GSK, Boehringer Ingelheim, Chiesi. (laatste 2 jaar (datum invullen 30-6-19) geen persoonlijke betrokkenhied als adviseur bij COPD gerelateerde issues, mede vanwege mijn betrokkenheid bij de NHG richtlijn). Speakers Bureau: Chiesie, Novartis, Boehringer Ingelheim, Inhalatie Technologie Werkgroep Health Agency Stichting RoLeX Sanofi |
Ik beoordeel longfuncties voor een huisarts laboratorium, en heb adviseurschap verricht voor diverse farmaceutische firma's. Er is nooit advies gegeven door mij over medicamenteuze COPD-behandeling, ook niet over biologicals. het genoemde adviseurschap is inmiddels meer dan 3-4 jaar geleden beëindigd. Zie eerder. Research faculty grants, (subsidiegevers Boehringer, Chiesi, Teva, Franciscus wetenschapsbureau) m.b.t. onderzoek bij astma en COPD, via ons expertisecentrum. Van belang hierbij is dat al het onderzoek niet medicatie-gerelateerd is. Zie boven bij onbetaald: Ik ben betrokken bij de bevordering van luchtkwaliteit en als zodanig word ik af en toe geconsulteerd met betrekking tot het schone Lucht Akkoord, een nationaal (door de overheid in gang gezet) platform dat maatregelen hierover in kaart brengt. Voorts ben ik betrokken bij het Vrij Ademen Akkoord, dat oa vanuit LAN, Longfonds, NRS en NVALT aandacht vraagt voor de (toekomstige) patient met een longziekte. |
Geen advieswerk over COPD of biologicals tijdens ontwikkeltraject van de richtlijn. Geen uitwerking van uitgangsvragen over longmedicatie of biologicals. |
|
Van Snippenburg |
Waarnemend Longarts; |
Secretaris Sectie COPD NVALT, onbetaald Werkgroep longen Huisartsen Utrecht Stad, betaald
|
Geen |
Geen |
|
Antons (vanaf oktober 2022) |
Longarts Radboudumc, Nijmegen |
Geen |
Geen |
Geen |
|
Kerstjens (vanaf oktober 2022) |
Hoogleraar longziekten UMCG, 1,0 FTE |
"Voorzitter Noordelijke CARA Stichting. Subsidiegevend orgaan. Onbetaald - Lid RvT bureau bijwerkingen geneesmiddelen LAREB. Betaald aan UMCG - Vz Stichting BEBO. Onafhankelijke METc. Betaald aan UMCG (per 1-1-2023 vz) - Vice-vz Netherlands Respiratory Society. Stichting ter bevordering van wetenschap en wetenschapsklimaat Longziekten NL. Onbetaald. (per 1-1-2023 vz).
Op afroep (geen vaste contracten of afspraken) deelname aan adviesraden van farmaceutische industrieën, en betaling voor lezingen: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. Alles betaald aan UMCG." |
"Geen persoonlijk financieel belang; alles wat er door mij binnenkomt wordt betaald aan UMCG. En krijg ik ook in tweede instantie nooit wat van. 2. Geen dienstverband 3. Betaald adviseurschappen zie bij overige item over nevenwerkzaamheden voor AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. 4. Geen directe fianicee belangen of via aandelen of opties. 5. Geen patenten"
"Veel gesponsord onderzoek, o.a. ZonMW VWS Innovatiefonds verzekeraars Industrie: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis." |
restricties ten aanzien van besluitvorming met betrekking tot modules over medicatie |
|
Knoops (vanaf oktober 2022) |
AIOS longziekten, Catharina Ziekenhuis Eindhoven |
Geen |
Geen |
Geen |
|
Tazmi (tot oktober 2020) |
Verpleegkundig specialist - werkzaam bij Laurens locatie Intermezzo |
Geen |
Geen |
Geen |
|
Van Jaarsveld |
Adviseur Zorg bij Longfonds |
Geen |
Geen |
Geen |
|
Muris |
Hoogleraar huisartsgeneeskunde, Universiteit Maastricht |
Vervangende werkzaamheden huisartspraktijk Geulle (betaald) |
Geen |
Geen |
|
Van der Meijs |
Apotheker, sinds 1 februari niet meer praktiserend lid namens de KNMP |
SIG-long (SIG = specialist interest group) van KNMP – vacatiegeld |
Geen |
Geen |
|
Van Litsenburg (vanaf oktober 2020) |
Verpleegkundig specialist astma en COPD 36 uur per week 24-uurs thuiszorgverpleegkundige 24 uur per week |
Bestuurslid IMIS (inhalatiemedicatie instructie school) 2u per week Coördinator IMIS Zuid Nederland IMIS trainer Docent Hogeschool Arnhem en Nijmegen Kernteam Picasso voor COPD (momenteel niet actief) Werkgroeplid palliatieve richtlijn COPD |
Kernteamlid Picasso (niet actief) |
Geen |
|
Leysner |
dietist Merem medische revalidatie in Hilversum" |
Incidenteel scholing geven aan studenten hogeschool Holland; betaald |
Geen |
Geen |
|
Wouters |
Bij aanvang AIOS longziekten, Rijnstate Ziekenhuis en thans longarts Ziekenhuis Gelderse Vallei Ede |
Geen |
Geen |
Geen |
|
Wagenaar |
Longervaringsdeskundige bij het Longfonds Geen betaalde functies |
Geen |
Geen |
Geen |
|
Kool |
Projectleider Zorgveld, Longfonds |
Geen |
Geen |
Geen |
|
Sillen |
Resultaatverantwoordelijk fysiotherapeut CIRO+, expertisecentrum voor chronisch orgaanfalen Horn |
Bestuurslid Vereniging voor Hart-, Vaat- en Longfysiotherapie (vacatievergoeding) Extern adviseur Fontys Hogeschool Eindhoven (betaald) Gastdocent Saxion Hogeschool, Enschede en Hogeschool van Amsterdam (betaald) |
Geen |
Geen |
|
Smit |
Longervaringsdeskundige Longfonds (vrijwilligerswerk) |
Geen |
Geen |
Geen |
Implementatie
Er werd aandacht besteed aan het patiëntenperspectief doordat een afgevaardigde patiëntenvereniging zitting nam in de werkgroep. De inbreng van de afgevaardigden is tevens verwerkt in de verslagen hiervan. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met COPD. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVALT, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de NVALT, V&VN Longverpleegkundigen, het Longfonds, NHG, NAPA en KNMP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
De werkgroep heeft uitgebreid over de belangrijkste uitkomstmaten voor de te bespreken interventies gediscussieerd. Het werd wenselijk geacht de set uitkomsten over de verschillende modules waar mogelijk hetzelfde te houden, en zeker met de zelfde minimale klinisch relevante verschillen. Bij specifieke interventies werden soms specifieke relevante uitkomsten toegevoegd. Voor sommige parameters kon geen referentie gevonden worden en werd als onderstaand beschreven een consensus standpunt ingenomen. De werkgroep onderkent dat de absolute risico reductie klinisch beter interpretabel is dan de relatieve, maar kon voor onvoldoende studies die getallen er bij vinden en hield dus vast aan de relatieve risico’s, met toelichting waar mogelijk.
• Exacerbation reduction: ≥20% (Jones, 2014; Chapman 2013)
• Pneumonia: ≥20% difference in relative risk
• Hospital admissions: ≥20% difference in relative risk
• Mortality: ≥10% difference in relative risk
• SGRQ-score: ≥4 units (Jones, 2014)
• CAT-score: >2 units (Kon 2014)
• CCQ-score: >0.4 units
• FEV1: >100 ml (Donohue 2005; Jones, 2014)
• Adverse events: ≥25% difference in relative risk
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1.1 Gebruik van inhalatiecorticosteroïden (ICS) bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.2 Triple therapie in 1 vs in meerdere devices bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.3 Onderhoudsantibiotica bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.4 Poliklinische behandeling van een COPD-longaanval |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.5 Biologicals bij COPD |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven
|
|
Module 2.1 Fysiotherapie in de eerste lijn
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.2 tweede en derdelijnsrevalidatie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.3 Voeding bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.1 Zuurstoftherapie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.2 Longvolumereductie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
|
Module 3.3 Chronische beademing bij COPD
|
n.v.t. |
Verwijzing naar andere richtlijn |
|
Module 4 COPD zelfmanagement
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 5 E-health
|
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten) en dat het een nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Het inzetten van digitale zorgtoepassingen zal zijn georganiseerd op lokaal/regionaal niveau en daarom worden op landelijk niveau geen substantiële financiële gevolgen verwacht.
|
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Chapman KR, Bergeron C, Bhutani M, et al. Do we know the minimal clinically important
difference (MCID) for COPD exacerbations? COPD 2013;10(2):243-9.
DOI:10.3109/15412555.2012.733463.
Donohue JF. Minimal clinically important differences in COPD lung function. COPD
2005;2(1):111-124. (http://www.ncbi.nlm.nih.gov/pubmed/17136971).
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Jones PW, Beeh KM, Chapman KR, Decramer M, Mahler DA, Wedzicha JA. Minimal clinically
important differences in pharmacological trials. Am J Respir Crit Care Med
2014;189(3):250-5. DOI: 10.1164/rccm.201310-1863PP.
Kon SS, Canavan JL, Jones SE, et al. Minimum clinically important difference for the COPD
Assessment Test: a prospective analysis. Lancet Respir Med 2014;2(3):195-203. DOI:
10.1016/S2213-2600(14)70001-3.
Kocks JW, Tuinenga MG, Uil SM, van den Berg JW, Stahl E, van der Molen T. Health status
measurement in COPD: the minimal clinically important difference of the Clinical
COPD Questionnaire. Respir Res 2006;7(1):62.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
Howcroft (2016) |
More recent systematic review, combination of randomized trials and quasi randomized trials |
|
Walters (2010) |
more recent systematic review |
|
Jonkman (2016) |
More recent systematic review including same studies |
|
Cannon (2016) |
More recent systematic review |
|
Newman (2017) |
More recent systematic review |
|
Russell (2018) |
Qualitative review |
|
Zwerink (2014) |
More recent systematic review |
|
Effing (2007) |
More recent systematic review |
|
Barbosa (2020) |
Does not fit PICO |
|
McCabe (2017) |
Does not fit PICO |
Literature search strategy
Algemene informatie
|
Richtlijn: NVALT herziening richtlijn COPD |
|
|
Uitgangsvraag: UV12a COPD-longaanval en zelfmanagement |
|
|
Database(s): Ovid/Medline, Embase |
Datum: 15-2-2021, 16-3-2021 |
|
Periode: |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting en opmerkingen:
Toelichting en opmerkingen: 16-3-2021
De werkgroep heeft op basis van onderstaande uitkomst besloten om e-health niet me te nemen in de uitkomst. Daarnaast is in afstemming met de adviseur ervoor gekozen om Majors te gebruiken in Embase. De zoekstrategie bestaat uit de volgende elementen: (COPD en COPD-longaanval) EN zelfmanagement
Beide sleutelartikelen worden gevonden.
15-2-2021 Voor UV12 is de eerste opzet gemaakt in Embase. Helaas is het aantal gevonden referenties erg groot. Ca. 450 SR, 1000 RCT en 700 OBS in 1 database. De woorden zoals geformuleerd in de interventie heb ik vertaald naar:
'self care'/exp OR 'blended learning'/exp OR 'blended learning':ti,ab,kw OR 'selfcare':ti,ab,kw OR 'selfmanagement':ti,ab,kw OR 'selftreatment':ti,ab,kw OR 'self-care software'/exp OR 'self-care software':ti,ab,kw OR 'mobile health application'/exp OR 'moovcare':ti,ab,kw OR 'mobile health application':ti,ab,kw OR ((self NEAR/3 (care OR management OR treatment OR nurtur*)):ti,ab,kw) OR 'action plan*':ti,ab,kw OR 'treatment planning'/exp OR 'therapy planning':ti,ab,kw OR 'treatment planning':ti,ab,kw OR 'treatment planning software'/de OR 'crs-master':ti,ab,kw OR 'final fit (device)':ti,ab,kw OR 'finalfit':ti,ab,kw OR 'treatment planning software':ti,ab,kw OR 'treatment planning system':ti,ab,kw OR 'telehealth'/exp OR 'e-health':ti,ab,kw OR 'ehealth':ti,ab,kw OR 'tele-health':ti,ab,kw OR 'telehealth':ti,ab,kw OR 'blended care':ti,ab,kw OR 'patient education'/exp OR 'patient education':ti,ab,kw OR 'copd education':ti,ab,kw OR 'computer assisted therapy'/exp OR 'computer assisted therap*':ti,ab,kw OR 'mobile application'/exp OR 'mobile app*':ti,ab,kw OR 'portable software app*':ti,ab,kw OR 'tablet app*':ti,ab,kw
|
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 16 maart 2021 met relevante zoektermen gezocht naar systematische reviews, RCTs en observationele studies over COPD en zelfmanagement longaanval actieplan. De literatuurzoekactie leverde 642 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
105 |
66 |
128 |
|
RCTs |
300 |
186 |
356 |
|
Observationele studies |
143 |
96 |
258 |
|
Overig |
|
|
|
|
Totaal |
|
|
642 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#18 |
#3 AND #9 |
2 |
|
#17 |
#15 NOT #14 NOT #13 |
143 |
|
#16 |
#14 NOT #13 |
300 |
|
#15 |
#9 AND #12 |
306 |
|
#14 |
#9 AND #11 |
357 |
|
#13 |
#9 AND #10 |
105 |
|
#12 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6420629 |
|
#11 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2539067 |
|
#10 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
548971 |
|
#9 |
#8 AND (1-1-2000)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
954 |
|
#8 |
#6 AND #7 |
1488 |
|
#7 |
'self care'/exp OR 'blended learning'/exp OR 'treatment planning'/exp OR 'mobile application'/exp OR 'self-care software'/exp OR 'computer assisted therapy'/exp OR 'patient education'/exp OR 'blended learning':ti,ab,kw OR 'selfcare':ti,ab,kw OR 'selfmanagement':ti,ab,kw OR 'selftreatment':ti,ab,kw OR 'self-care software':ti,ab,kw OR 'mobile health application'/exp OR 'moovcare':ti,ab,kw OR 'mobile health application':ti,ab,kw OR ((self NEAR/3 (care OR management OR treatment OR nurtur*)):ti,ab,kw) OR 'action plan*':ti,ab,kw OR 'therapy planning':ti,ab,kw OR 'treatment planning':ti,ab,kw OR 'treatment planning software'/de OR 'crs-master':ti,ab,kw OR 'final fit (device)':ti,ab,kw OR 'finalfit':ti,ab,kw OR 'treatment planning software':ti,ab,kw OR 'treatment planning system':ti,ab,kw OR 'patient education':ti,ab,kw OR 'copd education':ti,ab,kw OR 'computer assisted therap*':ti,ab,kw OR 'mobile app*':ti,ab,kw OR 'portable software app*':ti,ab,kw OR 'tablet app*':ti,ab,kw |
411623 |
|
#6 |
#4 AND #5 |
37344 |
|
#5 |
'chronic obstructive lung disease'/exp OR ('chronic obstructive' NEAR/2 (lung OR pulmonary OR airway)) OR 'copd':ab,ti,kw OR 'chronic bronchitis':ab,ti,kw OR emphysema:ab,ti,kw OR aecopd:ti,ab,kw |
204704 |
|
#4 |
'disease exacerbation'/exp OR 'aggravation':ti,ab,kw OR 'disease flare':ti,ab,kw OR 'progression':ti,ab,kw OR exacerbat*:ti,ab,kw OR attack*:ti,ab,kw OR worse*:ti,ab,kw |
1608026 |
|
#3 |
#1 OR #2 |
2 |
|
#2 |
computer AND mobile AND technology AND interventions AND for AND self‐management AND in AND chronic AND obstructive AND pulmonary AND disease AND mccabe |
1 |
|
#1 |
self‐management AND interventions AND including AND action AND plans AND for AND exacerbations AND versus AND usual AND care AND in AND patients AND with AND chronic AND obstructive AND pulmonary AND disease |
1 |
Ovid/Medline
|
# |
Searches |
Results |
|
15 |
13 not 12 not 11 |
96 |
|
14 |
12 not 11 |
186 |
|
13 |
8 and 10 |
175 |
|
12 |
7 and 10 |
218 |
|
11 |
6 and 10 |
66 |
|
10 |
limit 9 to yr="2000 -Current" |
621 |
|
9 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
643 |
|
8 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies) |
3778274 |
|
7 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2094133 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
484483 |
|
5 |
3 and 4 |
655 |
|
4 |
Self Care/ or Mobile Applications/ or "Patient Education as Topic"/ or Therapy, Computer-Assisted/ or blended learning.ti,ab,kf. or selfcare.ti,ab,kf. or selfmanagement.ti,ab,kf. or selftreatment.ti,ab,kf. or self-care software.ti,ab,kf. or moovcare.ti,ab,kf. or mobile health application.ti,ab,kf. or (self adj3 (care or management or treatment or nurtur*)).ti,ab,kf. or action plan*.ti,ab,kf. or therapy planning.ti,ab,kf. or treatment planning.ti,ab,kf. or crs-master.ti,ab,kf. or finalfit.ti,ab,kf. or patient education.ti,ab,kf. or copd education.ti,ab,kf. or computer assisted therap*.ti,ab,kf. or mobile app*.ti,ab,kf. or portable software app*.ti,ab,kf. or tablet app*.ti,ab,kf. |
206017 |
|
3 |
1 and 2 |
18775 |
|
2 |
exp Disease Progression/ or aggravation.ti,ab,kf. or disease flare.ti,ab,kf. or progression.ti,ab,kf. or exacerbat*.ti,ab,kf. or attack*.ti,ab,kf. or worse*.ti,ab,kf. |
1101900 |
|
1 |
exp Pulmonary Disease, Chronic Obstructive/ or ('chronic obstructive' adj2 (lung or pulmonary or airway)).ab,ti,kf. or copd.ab,ti,kf. |
91386 |