Zuurstoftherapie bij COPD
Uitgangsvraag
Wat is de meerwaarde van zuurstoftherapie ten tijde van inspanningsgebonden activiteiten of als onderhoudsbehandeling bij COPD-patiënten met hypoxemie in rust en/of tijdens inspanning.
Aanbeveling
1. Zuurstoftherapie als onderhoudsbehandeling (LTOT)
Overweeg een onderhoudsbehandeling met zuurstof bij de stabiele COPD-patiënt met matig tot ernstige hypoxemie in rust. Deze behandeling geldt in principe voor 24 uur per dag. Hypoxemie wordt hier omschreven als een PaO2 <7.3 kPa (55 mmHg) of een PaO2 >7.3 en <8 kPa (>55 en <60 mmHg) mét aanwijzingen voor rechter hartfalen en/of verhoogd hematocriet.
Geef geen onderhoudsbehandeling met zuurstof aan COPD-patiënten die roken.
2. Zuurstoftherapie ‘on demand’ tijdens dagelijks inspanning
Behandeling met zuurstoftherapie bij COPD-patiënten met hypoxemie tijdens inspanning zonder de aanwezigheid van hypoxemie in rust, wordt niet aanbevolen. Afname van kortademigheid, afname van mortaliteit of toename van uithoudingsvermogen kon onvoldoende wetenschappelijk onderbouwd worden.
Bij diepe desaturaties (<85%, PaO2 <6,7 kPa of PaO2 <50 mmHg) tijdens inspanning kan, vanuit pathofysiologische overwegingen, zuurstofsuppletie tijdens inspanning overwogen worden.
3. Zuurstoftherapie tijdens pulmonale inspanningstraining
Behandeling met zuurstoftherapie bij COPD-patiënten met hypoxemie tijdens inspanningstraining zonder de aanwezigheid van ernstige hypoxemie in rust wordt niet aanbevolen.
Bij diepe desaturaties (<85%, PaO2 <6,7 kPa of PaO2 <50 mmHg) tijdens training kan, vanuit pathofysiologische overwegingen, zuurstofsuppletie tijdens training overwogen worden.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van het literatuuronderzoek is de bewijskracht laag tot zeer laag voor het gebruik van zuurstoftherapie bij patiënten met stabiel COPD, zowel als onderhoudsbehandeling, als ten tijde van inspanningsgebonden activiteiten. Hierbij dient wel opgemerkt te worden dat er weinig studies zijn, allen bovendien met kleine aantallen patiënten. Ook zijn bepaalde studies door het gebruik van de GRADE-systematiek, zoals de NOTT-trial (Nocturnal Oxygen Therapy Trial Group 1980), buiten de wetenschappelijke beschouwing gebleven. Tenslotte includeerden de meeste studies geen patiënten met een ernstiger hypoxemie (< 7.3 kPa (55 mmHg). De verwachting is dat ook in de toekomst geen vergelijkende studies verricht zullen worden, onder andere op basis van ethische bezwaren. Toch is het, ondanks de lage bewijskracht van de gevonden literatuur, klinisch van belang om tot een implementeerbare richtlijn te komen.
1. Zuurstoftherapie als onderhoudsbehandeling (LTOT)
De GOLD 2022, ATS en BTS-richtlijnen doen met lage bewijskracht toch sterke aanbevelingen om zuurstofsuppletie te starten bij COPD-patiënten met ernstige hypoxemie. Ook in een CBO-richtlijn uit 2001 worden aanbevelingen gedaan over indicaties voor zuurstoftherapie bij COPD-patiënten (Kampelmacher 2001).
Naast het bestaande wetenschappelijke evidence is er ook een aantal pathofysiologische mechanismen van belang om mee te nemen in de afweging of zuurstoftherapie toegevoegde waarde heeft bij COPD-patiënten. Hypoxemie kan invloed hebben op het ontstaan van comorbiditeiten waarbij chronische hypoxemie naast pulmonale vasoconstrictie ook kan zorgen voor structurele vaatveranderingen en leiden tot pulmonale hypertensie (Nathan 2019, .
Derhalve geeft de werkgroep een positieve aanbeveling ten aanzien van zuurstofsuppletie bij een bewezen ernstige persisterende hypoxemie bij de patiënt met stabiel, optimaal behandeld COPD. Er moet een kanttekening worden geplaatst bij de rokende (sigaretten/sigaren/e-sigaret/waterpijp etc.) patiënt. Door de veel sterkere binding van koolstofmonoxide dan zuurstof aan hemoglobine zal zuurstofsuppletie geen toegevoegde waarde hebben bij deze patiëntencategorie. Daarnaast brengt schade, veroorzaakt door brand of brandwonden, een groot risico voor de patiënt en zijn omgeving met zich mee. Bhat (2020) beschrijft een model-estimated odds voor een ‘fire-related incident’ in een roker van 31.6 (5.1-372.7) keer de odds voor een dergelijk incident occurring in een niet-roker.
Eerdere richtlijnen deden een harde uitspraak over de duur van de zuurstofsuppletie, namelijk meer dan 15 uur per dag. Dit advies was gebaseerd op de NOTT (Nocturnal Oxygen Therapy) and MRC (Medical Research Council) studies uit de Jaren 70. Duur van behandeling en therapietrouw was echter in deze studies niet goed gemeten, waardoor het redelijker lijkt dat, indien er zuurstoftherapie gegeven wordt bij persisterende hypoxemie, dit geldt voor in principe 24 uur per dag.
De recente meta-analyse van Lacasse (2022, Lancet) ondersteunt het advies om alleen zuurstofsuppletie te starten in de groep COPD patiënten met een ernstige hypoxemie (PaO2 < 56 mmHg, 7.3kPa) aangezien zuurstofsuppletie bij milde mate van hypoxemie niet leidt tot een lagere mortaliteit.
2. Zuurstoftherapie ‘on demand’ tijdens dagelijkse inspanning en
3. zuurstoftherapie tijdens pulmonale inspanningstraining
Een inspanning geïnduceerde hypoxemie bij patiënten met stabiel COPD lijkt niet te leiden tot een verslechterende gezondheidstoestand (Afzal, 2018; Alison, 2019; Walsh, 2019). Zo toonde de studie van Alison (2019) dat de inspanningscapaciteit en kwaliteit van leven gelijk bleef voor zowel de groep COPD patiënten die trainde met zuurstof als zonder zuurstofsuppletie (bij een desaturatie tijdens inspanning tot maximaal 80%). Langdurige, extremere hypoxemie bij inspanning kan echter, net als bij patiënten met chronische hypoxemie in rust, leiden tot cardiale ischemie en hartritmestoornissen. Hoewel de bewijskracht ten aanzien van zuurstofsuppletie bij hypoxemie bij inspanning/training zeer laag of niet te waarderen is, valt dus wel te overwegen om een diepe desaturatie onder de 85%, grofweg vergelijkbaar met een PaO2 van lager dan 6,7 kPa (50 mmHg), te voorkomen door zuurstofsuppletie bij inspanning. Bijkomend theoretisch voordeel is dat hierdoor langer doorgegaan kan worden met de inspanning dan wel inspanningstraining (West, 2021) . In het kader van uniformiteit in richtlijnen: deze suggestie sluit pragmatisch aan bij de richtlijn COPD van de KNGF adviseert daarom de fysieke oefentherapie bij een transcutaan gemeten SpO2 van <85% te staken, dan wel zuurstof te suppleren.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Het belangrijkste doel van zuurstoftherapie is het voorkomen van ontstaan van comorbiditeiten veroorzaakt door de chronische hypoxemie en daarmee het verlengen van de levensduur en verbeteren van de kwaliteit van leven. De effecten op de subjectieve kortademigheidsbeleving (bij inspanning) blijken moeilijk aantoonbaar. Nadelige effecten van de zuurstoftherapie kunnen onder andere zijn; irritatie van het neusslijmvlies, gevoel van afhankelijkheid, stigma, afname mobiliteit door gebondenheid aan zuurstofapparatuur of beperktere tijd buitenshuis door beperkingen aan het zuurstofcilinder volume. Daarnaast moet de patiënt ook in staat zijn om op een veilige manier thuis de zuurstofinstallatie te kunnen bedienen. Daarom is naast inschatting van de veiligheidsrisico’s ook scholing over de apparatuur van belang.
Kosten (middelenbeslag)
Het gebruik van zuurstoftherapie kost per gebruiker ongeveer 800 euro per jaar (Gipdatabank). Op indicatie worden deze kosten vooralsnog vergoed door de zorgverzekeraars. Daarnaast is er een bijdrage voor elektriciteit door de zorgverzekeraar. Aangezien het doel van zuurstoftherapie onder andere de beïnvloeding op het ontstaan van comorbiditeiten is, brengt het de verwachting dat het bij de juiste patiëntenselectie een besparing van de zorgkosten oplevert (Chandra, 2012).
Aanvaardbaarheid, haalbaarheid en implementatie
Het starten van zuurstoftherapie hoort onderdeel te zijn van een multidimensionale aanpak en niet beschouwd te worden als een opzichzelfstaande behandeling van een COPD patiënt met hypoxemie.Doordat zuurstoftherapie in de thuissituatie al vele jaren wordt ingezet en voor steeds meer uiteenlopende indicaties (bijvoorbeeld in het kader van vervroegd ontslag en thuismonitoring na een opname), bestaat er reeds een groot netwerk waar gebruik van kan worden gemaakt. In de spreekkamer zal samen met de patiënt een inschatting gemaakt moeten worden of de zuurstoftherapie in de thuissituatie op een veilige manier kan worden gebruikt en of het een zinvolle behandeling is. Patiënt specifieke factoren zoals cognitie en rookstatus, kunnen de haalbaarheid beperken.
Het voorschrijven van zuurstoftherapie bij patiënten met COPD is een voorbehouden medische handeling. Naast weging van indicaties en contra-indicaties, is zowel onder- als overdosering een punt van aandacht: Zuurstofsuppletie bij patiënten met chronische hypoxemie kan namelijk leiden tot (verergering van) hypercapnie (Abdo, 2012). Ook daarbij is goede samenwerking tussen zorgverleners uit de eerste en tweede lijn van belang.
Onderbouwing
Achtergrond
Bij patiënten met ernstig COPD kunnen zowel oxygenatie als ventilatie stoornissen optreden. Bij toenemende ernst van de ziekte kan de hypoxemie zowel tijdens inspanning als in rust aanwezig zijn. Aanhoudende hypoxemie kan onder andere leiden tot inadequate weefseloxygenatie en pulmonale hypertensie, met hierdoor oversterfte. Hypoxemie kan ook de beperkende factor zijn bij inspanning waardoor training bij revalidatie mogelijk minder effectief is. Overbehandeling met zuurstof kan tot koolzuurretentie leiden.
Is zuurstoftherapie bij COPD-patiënten een zinvolle behandeling? Er is m.b.t. zuurstoftherapie sprake van praktijkvariatie, zowel met betrekking tot indicatiestelling en adviesduur van de behandeling, als met betrekking tot gebruik tijdens inspanning bij revalidatie- en reactiveringsgroepen.
Conclusies / Summary of Findings
9.1 Long-term oxygen therapy in patients with resting hypoxemia
Mortality (crucial outcome)
|
Very low GRADE |
The evidence is very uncertain about the effect of long-term oxygen therapy on mortality in COPD patients with severe hypoxemia (PaO2 ≤ 50 mmHg; 6.7 kPa), compared to COPD patients with severe hypoxemia not using long-term oxygen therapy.
Sources: COPD Working Group (2012) |
|
Very low GRADE |
The evidence is very uncertain about the effect of long-term oxygen therapy on mortality in COPD patients with mild/moderate hypoxemia (PaO2 59–65 mmHg; 7,9-8,5 kPa) compared to COPD patients with mild/moderate hypoxemia not using long-term oxygen therapy.
Sources: COPD Working Group (2012) |
Endurance (crucial outcome)
|
No GRADE |
No conclusions could be drawn regarding endurance in COPD patients using LTOT compared to COPD patients not using LTOT.
Sources: not applicable |
Dyspnea (crucial outcome)
|
No GRADE |
No conclusions could be drawn regarding dyspnea in COPD patients with severe hypoxemia (PaO2 ≤ 50 mmHg; 6.7 kPa) using LTOT compared to COPD patients with severe hypoxemia not using LTOT.
Sources: not applicable |
|
Very low GRADE |
The evidence is very uncertain about the effect of long-term oxygen therapy on dyspnea in COPD patients with mild/moderate hypoxemia (PaO2 59–65 mmHg; 7,9-8,5 kPa) compared to COPD patients with mild/moderate hypoxemia not using long-term oxygen therapy.
Sources: COPD Working Group (2012) |
Quality of life (important outcome)
|
No GRADE |
No conclusions could be drawn regarding quality of life in COPD patients using LTOT compared to COPD patients not using LTOT.
Sources: not applicable |
Comorbidities (important outcome)
|
No GRADE |
No conclusions could be drawn regarding comorbidities in COPD patients using LTOT compared to COPD patients not using LTOT.
Sources: not applicable |
9.2 Ambulatory ‘on demand’ oxygen therapy only during exertion in patients with hypoxemia during exercise
Mortality (crucial outcome)
|
No GRADE |
No conclusions could be drawn regarding mortality in COPD patients using ambulatory oxygen compared to COPD patients not using oxygen
Sources: not applicable |
Endurance (crucial outcome)
|
Very low GRADE |
The evidence is very uncertain about the effect of ambulatory oxygen on endurance in patients with COPD, compared to no oxygen.
Sources: Ejiofor et al. (2016) |
Dyspnea (crucial outcome)
|
Very low GRADE |
The evidence is very uncertain about the effect of ambulatory oxygen on dyspnea in patients with COPD, compared to no oxygen.
Sources: Ameer et al. (2014) |
Quality of life (important outcome)
|
No GRADE |
No conclusions could be drawn regarding quality of life in COPD patients using ambulatory oxygen compared to COPD patients not using oxygen.
Sources: not applicable |
Comorbidities (important outcome)
|
No GRADE |
No conclusions could be drawn regarding comorbidities in COPD patients using ambulatory oxygen compared to COPD patients not using oxygen.
Sources: not applicable |
9.3 Supplemental oxygen therapy during pulmonary exercise training
Mortality (crucial outcome)
|
No GRADE |
No conclusions could be drawn regarding mortality in COPD patients using supplemental oxygen during pulmonary exercise training compared to COPD patients not using supplemental oxygen.
Sources: not applicable |
Endurance (crucial outcome)
|
Very low GRADE |
The evidence is very uncertain about the effect of supplemental oxygen during pulmonary exercise training on endurance in patients with COPD compared to exercise training without using supplemental oxygen.
Sources: Freitag et al. (2020) |
Dyspnea (crucial outcome)
|
Very low GRADE |
The evidence is very uncertain about the effect of supplemental oxygen during pulmonary exercise training on dyspnea in patients with COPD compared to exercise training without using supplemental oxygen.
Sources: Ejiofor et al. (2016) |
Quality of life (important outcome)
|
No GRADE |
No conclusions could be drawn regarding quality of life in COPD patients using supplemental oxygen during pulmonary exercise training compared to COPD patients not using supplemental oxygen.
Sources: not applicable |
Comorbidities (important outcome)
|
No GRADE |
No conclusions could be drawn regarding comorbidities in COPD patients using supplemental oxygen during pulmonary exercise training compared to COPD patients not using supplemental oxygen.
Sources: not applicable |
Samenvatting literatuur
Description of studies
9.1 Long-term oxygen therapy in patients with resting hypoxemia
A systematic review by the COPD Working Group (2012) presented results on mortality, end-exercise dyspnea score and quality of life in COPD patient groups with either mild/moderate or severe hypoxemia. Literature was searched by the COPD Working Group from Jan 2007 – Sept 2010 and revealed 3 RCTs’ (MRC 1981; Gorecka 1997; Haidl 2004), of which 2 were multicenter. All these RCT’s compared use of long-term oxygen therapy (≥15 hours/day) to no use of oxygen. All were unblinded studies. Studies comparing different oxygen regimes were excluded. No meta-analyses were performed, mainly because studies were too few. For mortality no meta-analysis was performed due to different follow-up lengths and potential clinical heterogeneity. Only one study (MRC 1981) compared the effect of long-term oxygen therapy in patients with severe hypoxemia (mean PaO2 50mmHg; 6.65 kPa). Patients were included if they had at least 1 episode of heart failure. Adherence to oxygen therapy was not checked. Follow-up was up to 5 years. Two other studies (Gorecka 1997, Haidl 2004) compared the effect of long-term oxygen in patients with mild/moderate hypoxemia (PaO2 60.4 mmHg and 66 mmHg, respectively; 8.033 and 8.778 kPa). Adherence to oxygen was checked. Follow-up was ≥3 years (Gorecka, 1997) and 3 years (Haidl 2004).
9.2 Ambulatory ‘on demand’ oxygen therapy only during exertion in patients with hypoxemia during exercise
Ameer (2014) performed a systematic review and meta-analysis on the effects of ambulatory oxygen on mortality and dyspnea in COPD patients with moderate hypoxemia. Adults with stable COPD were included when resting PaO2 was < 60 mmHg (7.98 kPa) without cor pulmonale or when resting PaO2 was ≥ 60 mmHg (7.98 kPa) with hypoxemia on activity (PaO2 <60 mmHg or SpO2 <88%). Literature was searched for RCTs until November 2012. Four studies were included in this systematic review. Only 2 studies (1 cross-over study by Mc Donald (1995) and 1 RCT by Moore (2011)) addressed the outcome variable mortality. The number of patients in these 2 studies was small, and only 3 patients died. As the study by Mc Donald (1995) is a cross-over trial, it is believed to be difficult to attribute these deaths to either intervention or control group. Additionally, mortality was only assessed during the 12 weeks study time. Due to these methodological concerns, the working group decided, not to include these data on mortality in this literature review.
A systematic review by Ejiofor (2016) searched the literature from 1980 to June 2014. Studies were selected if they included patients with stable COPD, having evidence for exercise desaturation or exertional dyspnea, but who did not use long-term oxygen therapy. Patient follow-up had to be longer than 6 weeks. Exclusion criteria for the systematic review were not mentioned, nor were conflicts of interest. Two studies in this systematic review (Mc Donald 1995, Moore 2011) (94 cases, 101 controls) compared the effect of ambulatory oxygen (4 L/min and 6 L/min respectively) on exercise capacity (6MWT distance). Both studies were double blinded. One study (Mc Donald 1995) was a crossover design and excluded patients with cardiac disease. Follow-up was 12 weeks in both studies.
For definition of dyspnea, the Borg-score was used. This outcome variable was only described by Mc Donald (1995). The studies by Mc Donald (1995) and Moore (2011) were included in the systematic review by Ejiofor (2016) and are described above.
9.3 Supplemental oxygen therapy during pulmonary exercise training
Freitag (2020) investigated whether exercise with supplemental oxygen leads to superior effects in physical fitness and well-being. Literature was searched until December 2019. In this systematic review and meta-analysis, RCT’s and non-randomized controlled trials comparing supervised training with supplemental oxygen to supervised training without oxygen, were included. Studies without an exercise component were excluded. Included patients had to have at least one chronic disease (11 of 12 studies were on patients with COPD). Only three RCT’s in this systematic review by Freitag (Rooyackers 1997; Wadell 2001; Spielmanns 2015), (42 cases, 40 controls) addressed the outcome measure endurance in COPD patients. Exercise training schedules were between 8-24 weeks (training frequency 3-5x/week) with supplemental oxygen of 4-5 L/min. In 2 studies (Wadell 2001; Spielmanns 2015) controls used compressed air as placebo treatment during supervised training. Exercise training schedules were between 7-10 weeks (training frequency 3-5x/week) with supplemental oxygen 2-5 L/min. In 1 study (Wadell 2001) controls used compressed air as placebo treatment during supervised training.
The systematic review by Ejiofor (2016) has already been described in paragraph 9.2 (Ambulatory ‘on demand’ oxygen therapy during exertion).
Two RCTs in this systematic review (Janaudis-Ferreira 2009, Rooyackers 1997) (22 cases, 22 controls) compared the effect of ambulatory oxygen (5 L/min and 4L/min, respectively) on exercise-induced dyspnea (Borg score) in patients in pulmonary rehabilitation. Both studies were not fully blinded, study design was not specified. Both studies excluded patients with cardiac disease (Janaudis-Ferreira 2009, Rooyackers 1997). Follow-up was 8 and 10 weeks, respectively.
Results
9.1 Long-term oxygen therapy in patients with resting hypoxemia
9.1.1 mortality (crucial outcome)
A systematic review by the COPD Working Group (2012) reported on mortality in 2 subgroups of patients:
In patients with severe hypoxemia (1 study (MRC 1981 (42 cases, 45 controls)) RR was 0.68 (95% CI 0.46 to 1.00) in favor of LTOT. LTOT (> 15 hours/day) decreased all-cause mortality with 32% within the next 5 years compared to not using LTOT in patients with COPD who have severe hypoxemia (PaO2 ≤ 50 mmHg; 6.65 kPa) and heart failure. The effect for all-cause mortality had borderline statistical significance. This difference fulfils the threshold for a clinically important effect on the outcome mortality as defined by the working group (a 25 % difference in relative risk (RR) for dichotomous outcomes (see the section ‘Search and select’) and could therefore be clinically relevant. Data were derived from registry data without blinding, which could introduce bias.
In patients with mild-to-moderate hypoxemia (PaO2 59–65 mmHg) using LTOT compared to not using LTOT (2 studies (Gorecka 1997, Haidl 2004) there is no beneficial effect of LTOT on all-cause mortality at 3- and 7-years follow-up . Results of these 2 studies were not pooled due to heterogeneity, relative risks were 1.17 (95% CI 0.84 to 1.62) in favor of no LTOT (68 patients, 67 controls) in the study by Gorecka (1997), and 1.33 (95% CI 0.36 to 4.90) in favor of no LTOT (14 patients, 14 controls) in the study by Haidl (2004), respectively. These results do not fulfil the threshold for a clinically relevant effect on the risk of mortality.
9.1.2 endurance (crucial outcome)
The systematic literature search returned no comparative studies investigating endurance in COPD patients using LTOT compared to ambient air.
9.1.3 dyspnea (crucial outcome)
The COPD Working Group (2012) found no data on dyspnea in patients with COPD who had severe hypoxemia (PaO2 ≤ 50 mmHg). This systematic review found only 1 study (14 cases, 14 controls) (Haidl 2004) that described dyspnea in mild/moderate hypoxemia (PaO2 59–65 mmHg). In this study, the exercise test used was a formal laboratory-based test using a stationary bicycle. Dyspnea was measured using the Borg scale, mean difference was -1.20 (-2.51 to 0.11) in favor of no LTOT. This result does not fulfil the threshold for a clinically relevant effect, as the confidence interval includes the MCID.
9.1.4 quality of life (important outcome)
The systematic literature search returned no comparative studies investigating quality of life in COPD patients using LTOT compared to ambient air.
9.1.5 comorbidities (important outcome)
The systematic literature search returned no comparative studies investigating comorbidities in COPD patients using LTOT compared to ambient air.
9.2 Ambulatory ‘on demand’ oxygen therapy only during exertion in patients with hypoxemia during exercise
9.2.1 mortality (crucial outcome)
As described in the ‘summary of literature’ the systematic literature search returned no comparative studies of good enough quality investigating mortality in COPD patients using ambulatory oxygen therapy compared to no oxygen therapy.
9.2.2 endurance (crucial outcome)
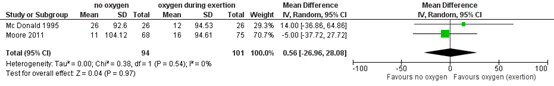
Two studies (Mc Donald, 1995; Moore, 2011) from the systematic review and meta-analysis by Ejiofor (2016) presented results of using domiciliary oxygen (37 patients) during a 6MWT compared to no use of oxygen (94 patients). Mean pooled difference was 0.56 meters (95% CI -26.96 to 28.08) in favor of ambulatory oxygen (figure 1). This difference does not fulfil the threshold of a clinically important effect. Additionally, numbers in this meta-analysis are small and the confidence interval is broad, resulting in imprecision.
Figure 1: effect of ‘on demand’ oxygen therapy, only during exertion, on 6-minute walking distance (6MWT) (from: Ejiofor 2016)
9.2.3 dyspnea (crucial outcome)
Dyspnea, defined as Borg-score, when using ambulatory oxygen, was reported on by Mc Donald (1995) in a cross-over trial which included 26 cases. This study was included in the systematic review of Ameer (2014). Mean difference was -0.6 (-1.39 to 0.19) favoring oxygen over ambient air, although not statistically significant. Additionally, numbers were small and the confidence interval is broad, resulting in serious imprecision.
9.2.4 quality of life (important outcome)
The systematic literature search returned no comparative studies investigating SGRQ in COPD patients using ambulatory oxygen therapy compared to no oxygen therapy
9.2.5 comorbidities (important outcome)
The systematic literature search returned no comparative studies investigating comorbidities in COPD patients using ambulatory oxygen therapy compared to no oxygen therapy.
9.3 Supplemental oxygen therapy during pulmonary exercise training
9.3.1 mortality (crucial outcome)
The systematic literature search returned no comparative studies investigating mortality in COPD patients using oxygen therapy compared to ambient air during pulmonary exercise training.
9.3.2 endurance (crucial outcome)
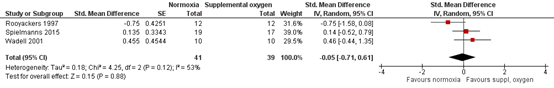
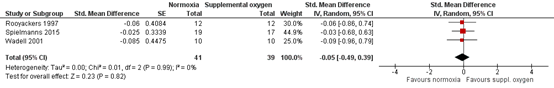
In a systematic review by Freitag (2020), the studies of Rooyackers (1997), Wadell (2001) and Spielmanns (2015) were included in a meta-analysis on results of the 6MWT after 10-24 weeks training. In total, 41 cases (training with supplemental oxygen) and 39 controls (training without supplemental oxygen) were included in this meta-analysis. The standardized mean difference of the pooled post-intervention walking distance was -0.05 (95% CI - 0.72 to 0.62) (figure 2a) favoring training without oxygen. When considering pre to post training changes in 6MWT (Δ6MWT) (figure 2b), the pooled standardized mean was -0.05 (95% CI -0.49 to 0.39) favoring training without oxygen. Both effects are not statistically significant, nor do they fulfil the threshold for a clinically important effect. Additionally, the effect estimate is broad, covering both, a positive and a negative effect of supplementary oxygen, resulting in serious imprecision.
Figure 2a: effect of supplemental oxygen during training on 6MWT (from: Freitag 2020)
Figure 2b: effect of supplemental oxygen during training on Δ6-minute walking distance (Δ6MWT) (from: Freitag 2020)
9.3.3 dyspnea (crucial outcome)
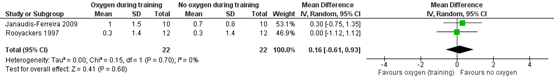
Freitag (2020) presented a meta-analysis of post-intervention dyspnea. As it was unclear which measurements of dyspnea from studies were included, it was decided not to present these results. Instead, results of the meta-analysis by Ejiofor (2016) (2 studies, Janaudis-Ferreira 2009; Rooyackers 1997) were included in this review. This study presents Borg-scores for 22 cases and 22 controls. Pooled mean difference is 0.16 (95% CI -0.61 to 0.93) in favor of ambient air (figure 3). This is not a statistically significant effect, nor does it fulfil the threshold for a clinically important effect. As the confidence interval includes both, a positive and a negative effect of supplementary oxygen, this results in imprecision.
Figure 3: effect of supplemental oxygen during training on dyspnea (Borg-scores) (from: (Ejiofor 2016)
9.3.4 quality of life (important outcome)
The systematic literature search returned no comparative studies investigating SGRQ in COPD patients using oxygen therapy compared to ambient air during pulmonary exercise training.
9.3.5 comorbidities (important outcome)
The systematic literature search returned no comparative studies investigating comorbidities in COPD patients using oxygen therapy compared to ambient air during pulmonary exercise training.
Level of evidence of the literature
9.1 Long-term oxygen therapy in patients with resting hypoxemia
The level of evidence regarding the outcome measure ‘mortality’ in patients with severe hypoxemia (PaO2 ≤ 50 mmHg) started at high and was downgraded by 3 levels because of risk of bias (1 level), and because of imprecision (small numbers and confidence intervals including the possibility that LTOT may decrease mortality or have no effect, 2 levels).
The level of evidence regarding the outcome measure ‘mortality’ in patients with mild/moderate hypoxemia (PaO2 59–65 mmHg) started at high and was downgraded by 3 level(s) because of risk of bias (1 level, and because of imprecision (confidence intervals included the possibility that LTOT may decrease or increase mortality (2 levels).
Due to the absence of comparative studies, the level of evidence for the crucial outcome measure ‘endurance’ could not be assessed.
The level of evidence regarding the outcome measure ‘dyspnea’ in patients with severe hypoxemia (PaO2 ≤ 50 mmHg) could not be assessed, because no studies comparing LTOT to no LTOT in this subgroup were found.
The level of evidence regarding the outcome measure ‘dyspnea’ in patients with mild/moderate hypoxemia (PaO2 59–65 mmHg) started at high and was downgraded by 3 level(s) because of risk of bias (1 level) and because of imprecision (confidence intervals included the possibility that LTOT may decrease or increase mortality (imprecision, 2 levels)
Due to the absence of comparative studies, the level of evidence for the crucial outcome measure ‘quality of life’ could not be assessed.
Due to the absence of comparative studies, the level of evidence for the crucial outcome measure ‘comorbidities’ could not be assessed.
9.2 Ambulatory ‘on demand’ oxygen therapy only during exertion in patients with hypoxemia during exercise
Due to absence of comparative studies, the level of evidence for the crucial outcome measure ‘mortality’ could not be assessed.
The level of evidence regarding the outcome measure ‘endurance‘ started at high and was downgraded by 3 levels because of risk of bias (2 levels, no or incomplete blinding, no exclusion criteria mentioned), imprecision (1 level, small numbers and confidence intervals included the possibility that ambulatory oxygen may decrease or increase the effect).
The level of evidence regarding the outcome measure ‘dyspnea’ started at high and was downgraded by 3 levels because of risk of bias (1 level, publication bias, no or incomplete blinding of participants), imprecision (2 levels, small numbers and the possibility that ambulatory oxygen may decrease dyspnea or have no effect).
Due to the absence of comparative studies, the level of evidence for the crucial outcome measure ‘quality of life’ could not be assessed.
Due to the absence of comparative studies, the level of evidence for the important outcome measure ‘comorbidities’ could not be assessed
9.3 Supplemental oxygen therapy during pulmonary exercise training
Due to the absence of comparative studies, the level of evidence for the crucial outcome measure ‘mortality’ could not be assessed.
The level of evidence regarding the outcome measure ‘endurance’ started at high and was downgraded by 3 levels because of risk of bias (1 level, no or incomplete blinding), inconsistency (1 level, heterogeneity regarding cardiac diseases), and imprecision (2 levels, small numbers and confidence intervals included the possibility that supplemental oxygen may decrease or increase the effect (imprecision).
The level of evidence regarding the outcome measure ‘dyspnea’ started at high and was downgraded by 3 levels because of risk of bias (1 level, no or incomplete blinding), inconsistency (1 level, heterogeneity regarding cardiac diseases), and imprecision (1 level, small numbers and the possibility that supplemental oxygen may decrease or increase dyspnea ).
Due to the absence of comparative studies, the level of evidence for the important outcome measure ‘quality of life’ could not be assessed.
Due to the absence of comparative studies, the level of evidence for the important outcome measure ‘comorbidities’ could not be assessed.
Zoeken en selecteren
Search and select
A systematic review of the literature was performed to answer the following questions:
1. What are the (un)favorable effects of long-term oxygen therapy (LTOT) on mortality, development of comorbidities, dyspnea score, endurance quality of life, compared to no long-term oxygen therapy in COPD patients with stable disease and resting hypoxemia.
P: patients COPD patients with stable disease who have resting hypoxemia
I: intervention long-term oxygen therapy
C: controle no oxygen therapy
O: outcome mortality, comorbidities (right heart failure, pulmonary hypertension),
dyspnea score (CAT*, CCQ*, Borg-score), endurance (6MWT*), quality of
life (SGRQ*)
2. What are the (un)favorable effects of ambulatory oxygen therapy only during exertion on mortality, development of comorbidities, dyspnea score, endurance and quality of life, compared to no oxygen therapy during exertion in COPD patients with stable disease and hypoxemia during exercise.
P: patient COPD patients with stable disease who have hypoxemia during exercise
I: intervention oxygen therapy during exertion
C: control no oxygen therapy during exertion
O: outcome mortality, comorbidities (right heart failure, pulmonary hypertension),
dyspnea score (CAT*, CCQ*, Borg-score), endurance (6MWT*), quality of
life (SGRQ*)
3. What are the (un)favorable effects of pulmonary exercise training with supplemental oxygen therapy on mortality, development of comorbidities, dyspnea score, endurance and quality of life, compared to training without oxygen therapy in COPD patients with stable disease and hypoxemia during exercise.
P: patient COPD patients with stable disease who have hypoxemia during exercise
I: intervention oxygen therapy during pulmonary exercise training
C: control no oxygen therapy during training
O: outcome mortality, comorbidities (right heart failure, pulmonary hypertension),
dyspnea score (CAT*, CCQ*, Borg-score), endurance (6MWT*), quality of
life (SGRQ*)
*Abbreviations:
6MWT: 6 minutes walk test
CAT: COPD Assessment Test
CCQ: Clinical COPD Questionnaire
SGRQ: St. George´s respiratory questionnaire
Relevant outcome measures
The guideline development group considered mortality, endurance, and dyspnea as crucial outcome measure for decision making; and comorbidities, exertional desaturation and quality of life as important outcome measure for decision making.
The working group defined the outcome measures as follows:
Comorbidities: right heart failure or pulmonary hypertension
Dyspnea score: CAT-score or CCQ-score or Borg-score
Endurance: 6MWT-distance
Quality of life: SGRQ-score
The working group defined a set of minimal clinically (patient) important differences (see introduction for further details). For this intervention, the following set was chosen:
• Mortality: ≥10% difference in relative risk
• CAT-score: >2 units
• CCQ-score: >0.4 units
• SGRQ-score: ≥4 units
• Adverse events: ≥25% difference in relative risk
6-MWT: ≥30 meters
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms until 1-4-2021. All 3 PICO’s were included in 1 search strategy. This search strategy can be found in the Methods section. Studies were selected based on the following criteria: comparing use of oxygen during exercise training to no oxygen during exercise training (PICO 3), comparing use of ambulatory oxygen during exertion to no oxygen therapy during exertion (PICO 2) or comparing long-term oxygen with no use of oxygen (PICO 1) in patients with COPD. At first, only systematic reviews were selected. This resulted in 100 hits of which 22 systematic reviews were selected based on title and abstract screening.
After reading the full text, 18 systematic reviews were excluded (see the table with reasons for exclusion under the tab Methods).
In addition, an updated literature search, using the same criteria as before, was performed to select RCTs. Additional RCTs were selected from the date of publication of the used systematic review onwards. and PICO 2 (oxygen therapy during exertion) For PICO 3 (pulmonary exercise training) RCTs were selected from 1-1-2015 until 22-6-21. For PICO 1 (long-term oxygen therapy) RCTs were selected from 1-1-2011 until 22-6-2021. The detailed search strategy can be found in the Methods section. Selections on title and abstract resulted in 4 extra studies being selected, all of which were excluded after reading the full text. (See the table with reasons for exclusion in the Methods section).
Results
Four systematic reviews studies were included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Abdo, Wilson F., and Leo MA Heunks. 2012. Oxygen-Induced Hypercapnia in COPD: Myths and Facts. Critical Care 16(5):323. doi: 10.1186/cc11475.
- Afzal, Sumbla, Angela T. Burge, Annemarie L. Lee, Janet Bondarenko, and Anne E. Holland. 2018. Should the 6-Minute Walk Test Be Stopped If Oxyhemoglobin Saturation Falls Below 80%? Archives of Physical Medicine and Rehabilitation 99(11):237072. doi: 10.1016/j.apmr.2018.07.426.
- Alison, Jennifer A., Zoe J. McKeough, Regina W. M. Leung, Anne E. Holland, Kylie Hill, Norman R. Morris, Sue Jenkins, Lissa M. Spencer, Catherine J. Hill, Annemarie L. Lee, Helen Seale, Nola Cecins, and Christine F. McDonald. 2019. Oxygen Compared to Air during Exercise Training in COPD with Exercise-Induced Desaturation. The European Respiratory Journal 53(5):1802429. doi: 10.1183/13993003.02429-2018.
- Ameer, Faisal, Kristin V. Carson, Zafar A. Usmani, and Brian J. Smith. 2014. Ambulatory Oxygen for People with Chronic Obstructive Pulmonary Disease Who Are Not Hypoxaemic at Rest. The Cochrane Database of Systematic Reviews (6):CD000238. doi: 10.1002/14651858.CD000238.pub2.
- Bhat, Udaya. 2020. Long-Term Oxygen Therapy and Risk of Fire-Related Events. Federal Practitioner (Vol 37 No 10). doi: 10.12788/fp.0048.
- Chandra, K., G. Blackhouse, B. R. McCurdy, M. Bornstein, K. Campbell, V. Costa, J. Franek, K. Kaulback, L. Levin, S. Sehatzadeh, N. Sikich, M. Thabane, and R. Goeree. 2012. Cost-Effectiveness of Interventions for Chronic Obstructive Pulmonary Disease (COPD) Using an Ontario Policy Model. Ontario Health Technology Assessment Series 12(12):161.
- COPD Working Group. 2012. Long-Term Oxygen Therapy for Patients with Chronic Obstructive Pulmonary Disease (COPD): An Evidence-Based Analysis. Ontario Health Technology Assessment Series 12(7):164.
- Ejiofor, Stanley I., Susan Bayliss, Abubacarr Gassamma, and Alice M. Turner. 2016. Ambulatory Oxygen for Exercise-Induced Desaturation and Dyspnea in Chronic Obstructive Pulmonary Disease (COPD): Systematic Review and Meta-Analysis. Chronic Obstructive Pulmonary Diseases (Miami, Fla.) 3(1):41934. doi: 10.15326/jcopdf.3.1.2015.0146.
- Freitag, Nils, Kenji Doma, Daniel Neunhaeuserer, Sulin Cheng, Wilhelm Bloch, and Moritz Schumann. 2020. Is Structured Exercise Performed with Supplemental Oxygen a Promising Method of Personalized Medicine in the Therapy of Chronic Diseases? Journal of Personalized Medicine 10(3):135. doi: 10.3390/jpm10030135.
- Kampelmacher, M. J., J. M. Rooyackers, and J. W. J. Lammers. 2001. CBO-richtlijn Zuurstofbehandeling thuis. Nederlands Tijdschrift voor Geneeskunde 41(145):1975.
- Lacasse Y, Casaburi R, Sliwinski P, Chaouat A, Fletcher E, Haidl P, Maltais F. Home oxygen for moderate hypoxaemia in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Lancet Respir Med. 2022 Nov;10(11):1029-1037. doi: 10.1016/S2213-2600(22)00179-5. Epub 2022 Jul 8. PMID: 35817074.
- Nathan, Steven D., Joan A. Barbera, Sean P. Gaine, Sergio Harari, Fernando J. Martinez, Horst Olschewski, Karen M. Olsson, Andrew J. Peacock, Joanna Pepke-Zaba, Steeve Provencher, Norbert Weissmann, and Werner Seeger. 2019. Pulmonary Hypertension in Chronic Lung Disease and Hypoxia. European Respiratory Journal 53(1). doi: 10.1183/13993003.01914-2018.
- Nocturnal Oxygen Therapy Trial Group. 1980. Continuous or Nocturnal Oxygen Therapy in Hypoxemic Chronic Obstructive Lung Disease: A Clinical Trial. Nocturnal Oxygen Therapy Trial Group. Annals of Internal Medicine 93(3):39198. doi: 10.7326/0003-4819-93-3-391.
- Walsh, Jessica A., Matthew Maddocks, and William D. C. Man. 2019. Supplemental Oxygen during Exercise Training in COPD: Full of Hot Air? The European Respiratory Journal 53(5):1900837. doi: 10.1183/13993003.00837-2019.
- West, John B., and Andrew M. Luks. 2021. Wests Respiratory Physiology: The Essentials, 11e.
Evidence tabellen
Evidence tables
Evidence table for systematic review of RCTs and observational studies (intervention studies)
Research question: Zuurstoftherapie bij COPD
Risk of bias tables
UV9 Oxygen therapy, table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Ameer, 2014 |
Yes, research question and predefined inclusion criteria |
Yes At least Medline, Emase and Cinahl were searched, search strategy included
|
Yes |
Yes |
Not applicable |
Yes, risk of bias table |
Yes |
Yes |
Yes |
|
COPD Working Group, 2012 |
Yes, research question and predefined inclusion criteria |
Yes Period and strategy described. Medline, Embase, CINAHL, corchrane library searched
|
No Included studies are described, but excluded studies are not referenced |
Yes |
Not applicable |
Yes, risk of bias table |
No, not enough similarities in intervention |
No |
Yes |
|
Ejofor, 2016 |
Yes, PICO is formulated |
Yes At least Medline/Embase, Cochrane were searched, search strategy included |
No reasons for exclusion are mentioned. But excluded individual studies are not listed |
No, age and sex are not mentioned, |
Not apllicable |
Yes, Jadad score was used |
Yes |
No |
No |
|
Freitag, 2020 |
Yes, PICO is formulated |
Yes, At least Medline, Embase, Cinhal, Cochrane library were searcjed |
No reasons for exclusion are mentioned. But excluded individual studies are not listed |
Yes |
Not applicable |
Yes Cochrane risk of bias table and PEDro Scale |
Yes |
Yes Funnel plot included |
No Conflicts of interest only reported in systematic review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-09-2023
Beoordeeld op geldigheid : 31-08-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2020 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met COPD.
Samenstelling van de werkgroep
Werkgroep
- Dr. F. (Folkert) Brijker, longarts, werkzaam in het Spaarne Gasthuis te Haarlem, NVALT (voorzitter, vanaf oktober 2022)
- Dr. J.S. (Jaring) van der Zee, longarts, NVALT (voorzitter, tot oktober 2022)
- Dr. W.H. (Wouter) van Geffen, longarts, werkzaam in het Medisch Centrum Leeuwarden te Leeuwarden, NVALT
- Drs. R. (Renée) van Snippenburg, werkzaam bij Ksyos en waarnemend longarts, NVALT
- Dr. J.C.C.M. (Hans) in ’t Veen, longarts, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVALT
- M. (Moniek) Wouters, longarts, werkzaam in het Ziekenhuis Gelderse Vallei te Arnhem, NVALT
- Prof. H.A.M. (Huib) Kerstjens, hoogleraar longziekten, longarts, werkzaam in het UMCG te Groningen, NVALT (vanaf oktober 2022)
- J. (Jeanine) Antons, longarts, werkzaam in het RadboudUMC te Nijmegen, NVALT (vanaf oktober 2022)
- Drs C.L.Y. (Chantal) Knoops, AIOS longgeneeskunde, werkzaam in het Catharina Ziekenhuis te Eindhoven (vanaf oktober 2022)
- Prof. J.W.M. (Jean) Muris, huisarts, werkzaam bij de Universiteit Maastricht, lid van de NHG-Expertgroep CAHAG, NHG
- Drs. E.R. (Erik) van der Meijs, apotheker, KNMP
- W.J.M. (Walter) van Litsenburg, verpleegkundig specialist longgeneeskunde, Catharina Ziekenhuis te Eindhoven, V&VN
- Dr. M.J.H. (Maurice) Sillen, fysiotherapeut, werkzaam bij CIRO, KNGF
- R.A. (Renée) Kool, projectleider, Longfonds
- R. (Ramona) Leysner, diëtiste, Nederlandse Vereniging van Diëtisten (NVD)
- Drs. M. (Menno) Wagenaar, patiëntvertegenwoordiger, Longfonds
- J. (Johan) Smit, patiëntvertegenwoordiger, Longfonds
Met ondersteuning van
- Dr. M. (Margriet) Moret, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Drs. N. (Nicole) Verheijen, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten en longarts
- Dr. T. (Tim) Christen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Inbreng patiëntenperspectief
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Brijker (voorzitter, vanaf oktober 2022) |
Longarts Spaarne Gasthuis |
Voorzitter sectie COPD NVALT. Dit is een onbetaalde functie binnen de longartsenvereniging NVALT. Lid regionale kwaliteitscommissie COPD/astma. Deze Commissie heeft 2x per jaar vergadering a 2 uur per keer in de avonduren en hiervoor ontvang ik onkostenvergoeding. Docent CASPIR cursussen. dit betreft scholing voor spirometrie voor huisartsen en POH-ers in de regio. Dit vindt een aantal keer per jaar plaats (<5 keer) in de avonduren en hiervoor ontvang ik een onkostenvergoeding |
Geen |
Geen |
|
*Van der Zee (voorzitter, tot oktober 2022) |
Longarts OLVG Amsterdam 0,2FTE tot 1-1-2020 Longarts Amsterdam UMC, locatie AMC, 0,2 FTE |
Lid MEC-U Locatie Nieuwegein, onkosten vergoeding Lid Gezondheidsraad Commissie Gespoten PUR, onkosten vergoeding Incidenteel medische expertises (o.a. DAS, ARAG, Triage, de Rechtspraak), betaald 2019 Speakers fee, Astra-Zeneca, Novartis, Chiesi 2019 1x Ad hoc Advies m.b.t. biologicals bij astma, GSK, betaald |
Geen |
Geen advieswerk tijdens het richtlijnontwikkeltraject |
|
Van Geffen |
Longarts Medisch Centrum Leeuwarden, maatschap Friese Longartsen |
Editorial board Cochrane Airways: Onbetaald Commisie Bronkhorst Nvalt: Onbetaald Richtlijn Commissie NVALT NSCLC: Onbetaald |
Deelname aan een investigator initiated onderzoek firma Novartis. financiering is overgemaakt aan UMCG (2017 beëindigd). Voor de bedrijven Chiesi, Roche, Boehringer en AstraZeneca deelname aan adviesraden betreffende oncologie. Deze gingen niet over COPD of biologicals. De hiervoor gebruikelijke CGR vergoeding werd geweigerd. Chiesi en Boehringer waren wel COPD, maar niet in de laatste 1.5 jaar. |
Geen advieswerk op gebied van COPD of biologicals tijdens het richtlijnontwikkeltraject |
|
In 't Veen |
Longarts bij In 't Veen Longarts BV. Verbonden aan de vakgroep longziekten en STZ expertisecentrum Astma, COPD & Respiratoire Allergie van het Franciscus Gasthuis en Vlietland, Rotterdam. |
Onbetaald: Opleider longziekten Franciscus Gasthuis en Vlietland Lid Concilium Opleiding NVALT Lid Vrij Ademen Akkoord namens NVALT Betrokken longarts bij Schone Lucht Akkoord Lid Move2Improve Lid werkgroep Ziektelastmeter; Generiek en COPD (afgerond) Voorzitter StichtingRoLeX (Rotterdam Leeuwarden eXpertise voor obstructieve longzieken), een stichting die nascholing voor longartsen (i.o.) verzorgd. Bestuurslid LAN Betaald: Longfunctiebeoordelaar Huisartsenlaboratorium STAR-SHL NHG richtlijn COPD namens NVALT Adviseurschap m.b.t. astma: Sanofi, GSK, Boehringer Ingelheim, Chiesi. (laatste 2 jaar (datum invullen 30-6-19) geen persoonlijke betrokkenhied als adviseur bij COPD gerelateerde issues, mede vanwege mijn betrokkenheid bij de NHG richtlijn). Speakers Bureau: Chiesie, Novartis, Boehringer Ingelheim, Inhalatie Technologie Werkgroep Health Agency Stichting RoLeX Sanofi |
Ik beoordeel longfuncties voor een huisarts laboratorium, en heb adviseurschap verricht voor diverse farmaceutische firma's. Er is nooit advies gegeven door mij over medicamenteuze COPD-behandeling, ook niet over biologicals. het genoemde adviseurschap is inmiddels meer dan 3-4 jaar geleden beëindigd. Zie eerder. Research faculty grants, (subsidiegevers Boehringer, Chiesi, Teva, Franciscus wetenschapsbureau) m.b.t. onderzoek bij astma en COPD, via ons expertisecentrum. Van belang hierbij is dat al het onderzoek niet medicatie-gerelateerd is. Zie boven bij onbetaald: Ik ben betrokken bij de bevordering van luchtkwaliteit en als zodanig word ik af en toe geconsulteerd met betrekking tot het schone Lucht Akkoord, een nationaal (door de overheid in gang gezet) platform dat maatregelen hierover in kaart brengt. Voorts ben ik betrokken bij het Vrij Ademen Akkoord, dat oa vanuit LAN, Longfonds, NRS en NVALT aandacht vraagt voor de (toekomstige) patient met een longziekte. |
Geen advieswerk over COPD of biologicals tijdens ontwikkeltraject van de richtlijn. Geen uitwerking van uitgangsvragen over longmedicatie of biologicals. |
|
Van Snippenburg |
Waarnemend Longarts; |
Secretaris Sectie COPD NVALT, onbetaald Werkgroep longen Huisartsen Utrecht Stad, betaald
|
Geen |
Geen |
|
Antons (vanaf oktober 2022) |
Longarts Radboudumc, Nijmegen |
Geen |
Geen |
Geen |
|
Kerstjens (vanaf oktober 2022) |
Hoogleraar longziekten UMCG, 1,0 FTE |
"Voorzitter Noordelijke CARA Stichting. Subsidiegevend orgaan. Onbetaald - Lid RvT bureau bijwerkingen geneesmiddelen LAREB. Betaald aan UMCG - Vz Stichting BEBO. Onafhankelijke METc. Betaald aan UMCG (per 1-1-2023 vz) - Vice-vz Netherlands Respiratory Society. Stichting ter bevordering van wetenschap en wetenschapsklimaat Longziekten NL. Onbetaald. (per 1-1-2023 vz).
Op afroep (geen vaste contracten of afspraken) deelname aan adviesraden van farmaceutische industrieën, en betaling voor lezingen: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. Alles betaald aan UMCG." |
"Geen persoonlijk financieel belang; alles wat er door mij binnenkomt wordt betaald aan UMCG. En krijg ik ook in tweede instantie nooit wat van. 2. Geen dienstverband 3. Betaald adviseurschappen zie bij overige item over nevenwerkzaamheden voor AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis. 4. Geen directe fianicee belangen of via aandelen of opties. 5. Geen patenten"
"Veel gesponsord onderzoek, o.a. ZonMW VWS Innovatiefonds verzekeraars Industrie: AstraZeneca, Boehringer Ingelheim, Chiesi, GSK, Novartis." |
restricties ten aanzien van besluitvorming met betrekking tot modules over medicatie |
|
Knoops (vanaf oktober 2022) |
AIOS longziekten, Catharina Ziekenhuis Eindhoven |
Geen |
Geen |
Geen |
|
Tazmi (tot oktober 2020) |
Verpleegkundig specialist - werkzaam bij Laurens locatie Intermezzo |
Geen |
Geen |
Geen |
|
Van Jaarsveld |
Adviseur Zorg bij Longfonds |
Geen |
Geen |
Geen |
|
Muris |
Hoogleraar huisartsgeneeskunde, Universiteit Maastricht |
Vervangende werkzaamheden huisartspraktijk Geulle (betaald) |
Geen |
Geen |
|
Van der Meijs |
Apotheker, sinds 1 februari niet meer praktiserend lid namens de KNMP |
SIG-long (SIG = specialist interest group) van KNMP – vacatiegeld |
Geen |
Geen |
|
Van Litsenburg (vanaf oktober 2020) |
Verpleegkundig specialist astma en COPD 36 uur per week 24-uurs thuiszorgverpleegkundige 24 uur per week |
Bestuurslid IMIS (inhalatiemedicatie instructie school) 2u per week Coördinator IMIS Zuid Nederland IMIS trainer Docent Hogeschool Arnhem en Nijmegen Kernteam Picasso voor COPD (momenteel niet actief) Werkgroeplid palliatieve richtlijn COPD |
Kernteamlid Picasso (niet actief) |
Geen |
|
Leysner |
dietist Merem medische revalidatie in Hilversum" |
Incidenteel scholing geven aan studenten hogeschool Holland; betaald |
Geen |
Geen |
|
Wouters |
Bij aanvang AIOS longziekten, Rijnstate Ziekenhuis en thans longarts Ziekenhuis Gelderse Vallei Ede |
Geen |
Geen |
Geen |
|
Wagenaar |
Longervaringsdeskundige bij het Longfonds Geen betaalde functies |
Geen |
Geen |
Geen |
|
Kool |
Projectleider Zorgveld, Longfonds |
Geen |
Geen |
Geen |
|
Sillen |
Resultaatverantwoordelijk fysiotherapeut CIRO+, expertisecentrum voor chronisch orgaanfalen Horn |
Bestuurslid Vereniging voor Hart-, Vaat- en Longfysiotherapie (vacatievergoeding) Extern adviseur Fontys Hogeschool Eindhoven (betaald) Gastdocent Saxion Hogeschool, Enschede en Hogeschool van Amsterdam (betaald) |
Geen |
Geen |
|
Smit |
Longervaringsdeskundige Longfonds (vrijwilligerswerk) |
Geen |
Geen |
Geen |
Implementatie
Er werd aandacht besteed aan het patiëntenperspectief doordat een afgevaardigde patiëntenvereniging zitting nam in de werkgroep. De inbreng van de afgevaardigden is tevens verwerkt in de verslagen hiervan. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is tevens voor commentaar voorgelegd aan het Longfonds en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerden de werkgroep de knelpunten in de zorg voor patiënten met COPD. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVALT, 2010) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door de NVALT, V&VN Longverpleegkundigen, het Longfonds, NHG, NAPA en KNMP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
De werkgroep heeft uitgebreid over de belangrijkste uitkomstmaten voor de te bespreken interventies gediscussieerd. Het werd wenselijk geacht de set uitkomsten over de verschillende modules waar mogelijk hetzelfde te houden, en zeker met de zelfde minimale klinisch relevante verschillen. Bij specifieke interventies werden soms specifieke relevante uitkomsten toegevoegd. Voor sommige parameters kon geen referentie gevonden worden en werd als onderstaand beschreven een consensus standpunt ingenomen. De werkgroep onderkent dat de absolute risico reductie klinisch beter interpretabel is dan de relatieve, maar kon voor onvoldoende studies die getallen er bij vinden en hield dus vast aan de relatieve risico’s, met toelichting waar mogelijk.
• Exacerbation reduction: ≥20% (Jones, 2014; Chapman 2013)
• Pneumonia: ≥20% difference in relative risk
• Hospital admissions: ≥20% difference in relative risk
• Mortality: ≥10% difference in relative risk
• SGRQ-score: ≥4 units (Jones, 2014)
• CAT-score: >2 units (Kon 2014)
• CCQ-score: >0.4 units
• FEV1: >100 ml (Donohue 2005; Jones, 2014)
• Adverse events: ≥25% difference in relative risk
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Module 1.1 Gebruik van inhalatiecorticosteroïden (ICS) bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.2 Triple therapie in 1 vs in meerdere devices bij COPD |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.3 Onderhoudsantibiotica bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.4 Poliklinische behandeling van een COPD-longaanval |
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 1.5 Biologicals bij COPD |
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven
|
|
Module 2.1 Fysiotherapie in de eerste lijn
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.2 tweede en derdelijnsrevalidatie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 2.3 Voeding bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.1 Zuurstoftherapie bij COPD
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar is (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 3.2 Longvolumereductie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven.
|
|
Module 3.3 Chronische beademing bij COPD
|
n.v.t. |
Verwijzing naar andere richtlijn |
|
Module 4 COPD zelfmanagement
|
Geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht.
|
|
Module 5 E-health
|
Geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten) en dat het een nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Het inzetten van digitale zorgtoepassingen zal zijn georganiseerd op lokaal/regionaal niveau en daarom worden op landelijk niveau geen substantiële financiële gevolgen verwacht.
|
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Chapman KR, Bergeron C, Bhutani M, et al. Do we know the minimal clinically important
difference (MCID) for COPD exacerbations? COPD 2013;10(2):243-9.
DOI:10.3109/15412555.2012.733463.
Donohue JF. Minimal clinically important differences in COPD lung function. COPD
2005;2(1):111-124. (http://www.ncbi.nlm.nih.gov/pubmed/17136971).
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Jones PW, Beeh KM, Chapman KR, Decramer M, Mahler DA, Wedzicha JA. Minimal clinically
important differences in pharmacological trials. Am J Respir Crit Care Med
2014;189(3):250-5. DOI: 10.1164/rccm.201310-1863PP.
Kon SS, Canavan JL, Jones SE, et al. Minimum clinically important difference for the COPD
Assessment Test: a prospective analysis. Lancet Respir Med 2014;2(3):195-203. DOI:
10.1016/S2213-2600(14)70001-3.
Kocks JW, Tuinenga MG, Uil SM, van den Berg JW, Stahl E, van der Molen T. Health status
measurement in COPD: the minimal clinically important difference of the Clinical
COPD Questionnaire. Respir Res 2006;7(1):62.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, Glasziou P, Jaeschke R, Vist GE, Williams JW Jr, Kunz R, Craig J, Montori VM, Bossuyt P, Guyatt GH; GRADE Working Group. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008 May 17;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008 May 24;336(7654). doi: 10.1136/bmj.a139.
Schünemann, A Holger J (corrected to Schünemann, Holger J). PubMed PMID: 18483053; PubMed Central PMCID: PMC2386626.
Wessels M, Hielkema L, van der Weijden T. How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. J Med Libr Assoc. 2016 Oct;104(4):320-324. PubMed PMID: 27822157; PubMed Central PMCID: PMC5079497.
Zoekverantwoording
Table of excluded studies
|
Author and year |
Reason for exclusion |
|
|
Systematic reviews |
||
|
Bradley |
2005 |
more recent meta-analysis |
|
Cranston |
2005 |
more recent meta-analysis including same studies |
|
Criner |
2000 |
more recent meta-analysis |
|
Crockett |
2001 |
narrative review |
|
Cullen |
2009 |
narrative review |
|
Ekström |
2016 |
too much clinical heterogeneity |
|
Ergan |
2017 |
narrative review |
|
Fu |
2020 |
does not fit PICO |
|
Gloeckl |
2019 |
does not fit PICO |
|
Jacobs |
2020 |
narrative review |
|
Koczulla |
2018 |
narrative review |
|
Liu. |
2019 |
more recent meta-analysis including same studies |
|
Nonoyama |
2007 |
more recent meta-analysis |
|
O'Neill |
2006 |
does not fit PICO |
|
Puhan |
2004 |
more recent meta-analysis including same studies |
|
Ram |
2002 |
more recent meta-analysis including partly same studies |
|
Uronis |
2011 |
does not fit PICO |
|
Uronis |
2015 |
does not fit PICO |
|
|
|
|
|
RCTs |
||
|
Albert |
2016 |
Does not fit PICO |
|
Bao |
2017 |
wrong outcome measures |
|
Ekström |
2018 |
publication lacks search strategy, list of excluded studies and quality assessement |
|
Jarosch |
2017 |
univariate |
Literature search strategy
|
Richtlijn: NVALT herziening COPD |
|
|
Uitgangsvraag: Wat is de meerwaarde van zuurstoftherapie ten tijde van inspanning gebonden activiteiten of als onderhoudsbehandeling bij COPD-patiënten?
|
|
|
Database(s): Embase Ovid/Medline |
Datum: 1-4-2021, 22-6-2021 |
|
Periode: SR geen limiet. RCT lange termijn 2015- RCT inspanningsgebonden 2011- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting:
22-6-2021 Update uitgevoerd en onderscheid gemaakt tussen de twee zoekstrategieën: Vanaf 2011: lange termijn(onderhoudsbehandeling) RCTs Vanaf 2015: revalidatie (inspanningsgebonden) RCTs
Er werden geen nieuwe systematische reviews aangetroffen. Om dubbele referenties in beide sets te voorkomen is de set revalidatie ontdubbeld t.o.v. de set lange termijn.
1-4-2021 Voor deze vraag is gezocht met de volgende elementen: COPD EN Zuurstoftherapie EN (onderhoudsbehandeling OF inspanningsgebonden)
In eerste instantie zijn alleen de SRs aangeboden. Deze kunnen later zo nodig worden aangevuld met de meest recente RCT’s
Alle sleutelartikelen worden gevonden. |
|
|
Te gebruiken voor richtlijnen tekst: In de databases Embase en Ovid/Medline is op 22 juni 2021 met relevante zoektermen gezocht naar systematische reviews en RCTs, over de meerwaarde van zuurstoftherapie ten tijde van inspanning gebonden activiteiten of als onderhoudsbehandeling. De literatuurzoekactie leverde 295 unieke treffers op. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
83 |
65 |
100 |
|
RCT langetermijn |
98 |
64 |
117 |
|
RCT revalidatie |
64 |
58 |
78 |
|
Overig |
|
|
|
|
Totaal |
|
|
|
Zoekstrategie
Embase
22-6-2021
|
No. |
Query |
Results |
|
#27 |
#19 OR #26 |
83 |
|
#26 |
#21 AND #25 |
83 |
|
#25 |
#20 AND #24 |
2845 |
|
#24 |
#22 OR #23 |
7470 |
|
#23 |
('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) AND ('sport'/exp OR 'training'/exp OR 'endurance'/exp OR 'physiotherapy'/exp OR 'exercise'/exp OR 'physical therap*':ti,ab,kw OR 'physio therap*':ti,ab,kw OR 'physiotherap*':ti,ab,kw OR exercis*:ti,ab,kw OR 'endurance':ti,ab,kw OR 'physical activit*':ti,ab,kw OR 'sport':ti,ab,kw OR sports:ti,ab,kw) |
3210 |
|
#22 |
('long term care'/mj OR 'long term') AND ('home care'/exp OR home:ti,ab,kw OR domiciliar*:ti,ab,kw) AND ('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) OR ltot:ti,ab,kw OR 'long term oxygen therapy':ti,ab,kw |
2528 |
|
#21 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
533576 |
|
#20 |
'chronic obstructive lung disease'/exp OR ('chronic obstructive' NEAR/2 (lung OR pulmonary OR airway)) OR 'copd':ab,ti,kw OR 'chronic bronchitis':ab,ti,kw OR emphysem*:ab,ti,kw OR aecopd:ti,ab,kw |
209064 |
|
#19 |
#7 OR #14 |
45 |
|
#18 |
#9 NOT #16 |
98 |
|
#17 |
#9 OR #16 |
162 |
|
#16 |
#15 NOT #14 |
64 |
|
#15 |
#4 AND #13 |
76 |
|
#14 |
#3 AND #13 |
31 |
|
#13 |
#12 AND (1-1-2015)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
208 |
|
#12 |
#10 AND #11 |
1076 |
|
#11 |
('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) AND ('sport'/exp OR 'training'/exp OR 'endurance'/exp OR 'physiotherapy'/exp OR 'exercise'/exp OR 'physical therap*':ti,ab,kw OR 'physio therap*':ti,ab,kw OR 'physiotherap*':ti,ab,kw OR exercis*:ti,ab,kw OR 'endurance':ti,ab,kw OR 'physical activit*':ti,ab,kw OR 'sport':ti,ab,kw OR sports:ti,ab,kw) |
3269 |
|
#10 |
'chronic obstructive lung disease'/exp OR ('chronic obstructive' NEAR/2 (lung OR pulmonary OR airway)) OR 'copd':ab,ti,kw OR 'chronic bronchitis':ab,ti,kw OR emphysem*:ab,ti,kw OR aecopd:ti,ab,kw |
212201 |
|
#9 |
#8 NOT #7 |
118 |
|
#8 |
#4 AND #6 |
128 |
|
#7 |
#3 AND #6 |
22 |
|
#6 |
#5 AND (1-1-2011)/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
405 |
|
#5 |
#1 AND #2 |
1633 |
|
#4 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3315026 |
|
#3 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
739052 |
|
#2 |
('long term care'/mj OR 'long term') AND ('home care'/exp OR home:ti,ab,kw OR domiciliar*:ti,ab,kw) AND ('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) OR ltot:ti,ab,kw OR 'long term oxygen therapy':ti,ab,kw |
2555 |
|
#1 |
'chronic obstructive lung disease'/exp OR ('chronic obstructive' NEAR/2 (lung OR pulmonary OR airway)) OR 'copd':ab,ti,kw OR 'chronic bronchitis':ab,ti,kw OR emphysem*:ab,ti,kw OR aecopd:ti,ab,kw |
212201 |
1-4-2021
|
No. |
Query |
Results |
|
#15 |
#2 AND #13 SR |
83 |
|
#14 |
#9 AND #13 |
4 |
|
#13 |
#1 AND #12 |
2338 |
|
#12 |
#10 OR #11 |
5295 |
|
#11 |
('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) AND ('sport'/exp OR 'training'/exp OR 'endurance'/exp OR 'physiotherapy'/exp OR 'exercise'/exp OR 'physical therap*':ti,ab,kw OR 'physio therap*':ti,ab,kw OR 'physiotherap*':ti,ab,kw OR exercis*:ti,ab,kw OR 'endurance':ti,ab,kw OR 'physical activit*':ti,ab,kw OR 'sport':ti,ab,kw OR sports:ti,ab,kw) |
3210 |
|
#10 |
('long term care'/mj OR 'long term') AND ('home care'/exp OR home:ti,ab,kw OR domiciliar*:ti,ab,kw) AND ('oxygen therapy'/exp/mj OR (((o2 OR oxygen) NEAR/2 (administration OR therap* OR insufflation OR treatment OR supplemental)):ti,ab,kw)) OR ltot:ti,ab,kw OR 'long term oxygen therapy':ti,ab,kw |
2530 |
|
#9 |
#5 OR #6 OR #7 OR #8 |
4 |
|
#8 |
27886372 AND 2016 |
1 |
|
#7 |
oxygen AND compared AND to AND air AND during AND exercise AND training AND in AND copd AND with AND 'exercise induced' AND desaturation AND alison AND 2019 |
1 |
|
#6 |
'long term' AND oxygen AND treatment AND trial AND research AND group AND albert AND 2016 |
1 |
|
#5 |
domiciliary AND oxygen AND for AND chronic AND obstructive AND pulmonary AND disease AND cranston AND 2005 |
1 |
|
#4 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6440602 |
|
#3 |
('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it |
2500470 |
|
#2 |
('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT ('conference abstract'/it OR 'conference review'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) |
533576 |
|
#1 |
'chronic obstructive lung disease'/exp OR ('chronic obstructive' NEAR/2 (lung OR pulmonary OR airway)) OR 'copd':ab,ti,kw OR 'chronic bronchitis':ab,ti,kw OR emphysem*:ab,ti,kw OR aecopd:ti,ab,kw |
209064 |
Ovid/Medline
22-6-2021
Search Strategy:
|
# |
Searches |
Results |
|
24 |
23 not 8 |
0 |
|
23 |
12 or 18 |
32 |
|
22 |
21 not 20 |
69 |
|
21 |
14 not 12 |
86 |
|
20 |
19 not 18 |
58 |
|
19 |
13 and 17 |
69 |
|
18 |
6 and 17 |
21 |
|
17 |
16 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
160 |
|
16 |
limit 15 to yr="2015 -Current" |
170 |
|
15 |
1 and 3 |
748 |
|
14 |
11 and 13 |
94 |
|
13 |
(exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) |
2131980 |
|
12 |
6 and 11 |
16 |
|
11 |
10 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
337 |
|
10 |
limit 9 to yr="2011 -Current" |
350 |
|
9 |
1 and 2 |
853 |
|
8 |
6 and 7 |
67 |
|
7 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1352 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
502813 |
|
5 |
1 and 4 |
1399 |
|
4 |
2 or 3 |
3319 |
|
3 |
(Oxygen Inhalation Therapy/ or ((o2 or oxygen) adj2 (administration or therap* or insufflation or treatment or supplemental)).ti,ab,kf. or ltot.ti,ab,kf. or long term oxygen therapy.ti,ab,kf.) and (exp Sports/ or Exercise Therapy/ or exp Physical Therapy Modalities/ or physical therap*.ti,ab,kf. or physio therap*.ti,ab,kf. or physiotherap*.ti,ab,kf. or exercis*.ti,ab,kf. or endurance.ti,ab,kf. or physical activit*.ti,ab,kf. or sport.ti,ab,kf. or sports.ti,ab,kf.) |
2067 |
|
2 |
((Long-Term Care/ or long term.ti,ab,kf.) and (Ambulatory Care/ or home.ti,ab,kf. or domiciliar*.ti,ab,kf.) and (Oxygen Inhalation Therapy/ or ((o2 or oxygen) adj2 (administration or therap* or insufflation or treatment or supplemental)).ti,ab,kf.)) or (ltot or long term oxygen therapy).ti,ab,kf. |
1517 |
|
1 |
exp Pulmonary Disease, Chronic Obstructive/ or ('chronic obstructive' adj2 (lung or pulmonary or airway)).ab,ti,kf. or copd.ab,ti,kf. |
93073 |
1-4-2021
|
# |
Searches |
Results |
|
8 |
6 and 7 SR |
65 |
|
7 |
5 not ((exp animals/ or exp models, animal/) not humans/) not (letter/ or comment/ or editorial/) |
1343 |
|
6 |
(meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf.) not (comment/ or editorial/ or letter/ or ((exp animals/ or exp models, animal/) not humans/)) |
487296 |
|
5 |
1 and 4 |
1390 |
|
4 |
2 or 3 |
3277 |
|
3 |
(Oxygen Inhalation Therapy/ or ((o2 or oxygen) adj2 (administration or therap* or insufflation or treatment or supplemental)).ti,ab,kf. or ltot.ti,ab,kf. or long term oxygen therapy.ti,ab,kf.) and (exp Sports/ or Exercise Therapy/ or exp Physical Therapy Modalities/ or physical therap*.ti,ab,kf. or physio therap*.ti,ab,kf. or physiotherap*.ti,ab,kf. or exercis*.ti,ab,kf. or endurance.ti,ab,kf. or physical activit*.ti,ab,kf. or sport.ti,ab,kf. or sports.ti,ab,kf.) |
2042 |
|
2 |
((Long-Term Care/ or long term.ti,ab,kf.) and (Ambulatory Care/ or home.ti,ab,kf. or domiciliar*.ti,ab,kf.) and (Oxygen Inhalation Therapy/ or ((o2 or oxygen) adj2 (administration or therap* or insufflation or treatment or supplemental)).ti,ab,kf.)) or (ltot or long term oxygen therapy).ti,ab,kf. |
1499 |
|
1 |
exp Pulmonary Disease, Chronic Obstructive/ or ('chronic obstructive' adj2 (lung or pulmonary or airway)).ab,ti,kf. or copd.ab,ti,kf. |
91635 |