Effectiviteit van CGA
Uitgangsvraag
Wat is de effectiviteit van het CGA?
Aanbeveling
Overweeg kwetsbare ouderen middels een CGA te onderzoeken.
Maak naar aanleiding van de uitkomsten van het CGA afspraken over de regievoering en de setting waarin dit plaatsvindt.
Overwegingen
De literatuur laat zien dat het CGA in verschillende settingen (kliniek, medehandeling, polikliniek, SEH) mogelijk positieve effecten heeft op de volgende uitkomstmaten: het aantal ouderen dat bij ontslag en tijdens de follow-up zelfstandig thuis woont, het aantal ouderen na ontslag en tijdens follow-up institutionaliseert, de duur van de ziekenhuisopname en de duur en ernst van het doorgemaakte delier.
Er is in de nieuwere literatuur weinig verschil in effectiviteit van het CGA in verschillende settingen. Dit is onder andere te verklaren door de verbeterde basis zorg voor ouderen.
Er lijken voordelen te zijn van een klinische afdeling met geriatrische/interne ouderen geneeskundige expertise; namelijk dat ouderen vaker naar huis werden ontslagen en tijdens follow-up nog zelfstandig woonden. Bij een CGA in medebehandeling lijkt er een voordeel te zijn voor patienten met een heupfractuur, alsmede is er mogelijk sprake van een lagere delier incidentie. Bij een CGA op de SEH of polikliniek lijkt er ook enig bewijs te zijn dat mensen zelfstandig wonen, en is er mogelijk een effect op duur van ziekenhuisopname.
Er zijn helaas geen studies die de effectiviteit van het verrichten van een CGA op een geriatrische/interne ouderen geneeskundige afdeling vergelijken met een CGA verricht in medebehandeling.
Volgens de werkgroep is voldoende aangetoond dat een CGA, uitgevoerd op zowel een geriatrische / interne ouderengeneeskunde afdeling als op de SEH en de polikliniek, ervoor zorgt dat ouderen langer zelfstandig kunnen blijven wonen. Positieve effecten van het CGA worden niet in alle studies gerapporteerd. Met name studies van voor 2000 laten positieve effecten van het CGA zien, terwijl meer recentere studies deze positieve effecten niet meer aantonen. Een mogelijke verklaring hiervoor is dat de algehele zorg rondom kwetsbare ouderen de afgelopen decennia sterk is verbeterd waardoor de positieve effecten van het CGA minder gemakkelijk aangetoond kunnen worden. Hoewel er studies zijn die geen positieve effecten hebben aangetoond, zijn er geen studies die negatieve effecten van het CGA rapporteren.
Hoewel er veel onderzoek is gedaan naar de effectiviteit van het CGA is de bewijskracht per uitkomstmaat gegradeerd als LAAG. Dit heeft te maken met de heterogene bevindingen die zijn gerapporteerd in de studies. Een mogelijke verklaring hiervoor is dat de studies verschillende definities van een CGA hanteren en er verschillen in patiënten populatie zijn. Ook werd de inhoud van de verschillende CGA-interventies niet eenduidig beschreven en waren er verschillende domeinen en disciplines betrokken. Daarnaast zijn de uitkomstmaten niet eenduidig beschreven.
De selectie van de patiënten verschilde per onderzoek. Soms was alleen een hoge leeftijd (> 65 jaar) voldoende om geïncludeerd te worden. Soms werd een definitie van kwetsbaarheid beschreven, waarbij dan aandacht was voor cognitieve- en mobiliteitsfuncties en zelfredzaamheid. Soms betrof het een specifieke patiëntenpopulatie zoals oncologie, dialyse of chirurgie. In de artikelen werd over het algemeen veel aandacht besteed aan het beschrijven van de afdelingen waar de patiënten werden opgenomen. Op een afdeling geriatrie of ouderengeneeskunde werkt ten opzichte van een algemene verpleegafdeling meer verpleegkundig personeel, evenals meer paramedici (onder andere fysiotherapeuten, ergotherapeuten en maatschappelijk werkers). In de beschreven studies vond wekelijks multidisciplinair overleg plaats. Ook werd vastgelegd welke informatie verzameld werd over de geriatrische patiënt. Dit betrof altijd informatie over cognitieve, mobiliteit en zelfredzaamheidfuncties. Daarnaast was er aandacht voor het ontslagtraject, dat al begon bij opname.
In deze module werden verschillende uitkomstmaten onderzocht. Er werd niet voor alle uitkomstmaten bewijs gevonden voor effect van het CGA. Mogelijk is dit het gevolg van het individueel onderzoeken van uitkomstmaten in een populatie die heterogeen is met verschillen in problematiek en is er wel effect aan te tonen bij combineren van uitkomstmaten. Opvallend is verder dat, hoewel alle studies de kwaliteit van leven een prominente plaats geven, er nauwelijks metingen van de kwaliteit van leven werden verricht.
Overweeg bij alle kwetsbare ouderen een CGA om ervoor te zorgen dat ouderen na ziekenhuisopname vaker zelfstandig kunnen wonen, de delierincidentie verminderd en de duur van de ziekenhuisopname te bekorten.
Onderbouwing
Achtergrond
In deze module wordt beschreven wat de effectiviteit van het CGA is bij alle ouderen die in aanmerking komen voor een CGA in de kliniek, in het kader van hoofdbehandelaarschap, bij consulten en medebehandeling, op de polikliniek en op de SEH. Het CGA is een uitgebreid geriatrisch/ouderengeneeskundig onderzoek. Het is een multidisciplinair onderzoek dat de multipele problemen (lichamelijk, psychisch, functioneel en sociaal) van een oudere zo veel mogelijk opspoort, beschrijft en verklaart en de capaciteiten en de zorgbehoeften van de persoon onderzoekt. Het doel is te komen tot een gecoördineerd en integraal zorgplan voor het individu. Hierbij is het belangrijk afspraken te maken over regievoering. Deze module betreft een herziening van de oude richtlijn module met update van de literatuur en uitbreiding van de uitgangsvraag.
De meerwaarde van het CGA wordt breed erkent, wat ervoor heeft gezorgd dat het CGA in steeds meer settings wordt uitgevoerd. De afgelopen jaren is de effectiviteit van het CGA verder onderzocht waarbij meer specifiek is gekeken naar de setting waarbinnen het CGA wordt uitgevoerd. Zo heeft de Cochrane review van Ellis (2017) onderzocht wat de effectiviteit van het CGA is bij klinische patiënten en rapporteerde dat patiënten vaker in leven waren en thuis woonden tijdens de follow-up meting. Een ander recent gepubliceerde Cochrane review van Eamer (2018) onderzocht de effectiviteit van het CGA in de medebehandeling bij ouderen die voor een operatie zijn opgenomen op een chirurgische afdeling (heupfractuur en oncologie). Eamer (2018) rapporteerde gunstige effecten op mortaliteit en ontslag naar een zorgafdeling met een toegenomen zorgzwaarte (increased level of care). De systematische review van Pilotto (2017) beschrijft dat er slechts enkele studies zijn gedaan naar de effectiviteit van het CGA op de SEH. Deze studies laten tegenstrijdige resultaten zien met betrekking tot de effectiviteit van het CGA op de SEH. Echter de meeste studies zijn relatief lang geleden uitgevoerd. Omdat de laatste decennia het zorglandschap rondom ouderen is veranderd en de kwaliteit van basiszorg sterk is verbeterd, is een up-to-date module wenselijk. Om de effectiviteit van het CGA te bepalen zijn er uitkomstmaten gedefinieerd die relevant zijn voor oudere patiënten. Omdat oudere patiënten kwaliteit van leven en functionele status vaak belangrijker vinden dan het verlengen van het leven, zijn deze als primaire uitkomstmaten gekozen. Dit wordt vertaald in de uitkomstmaten: kwaliteit van leven, zelfstandig wonen, institutionalisering, afhankelijkheid ADL-activiteit. Daarnaast worden ook de geriatrische/ouderengeneeskundige uitkomstmaten meegenomen zoals: valincidenten, delier en cognitief functioneren; en de ‘klassieke uitkomstmaten’ zoals: mortaliteit, heropname, duur ziekenhuisopname en kosten.
Conclusies / Summary of Findings
|
Laag GRADE |
Het CGA heeft in verschillende settingen (kliniek, medebehandeling, poli, SEH) mogelijk positieve effecten op: het aantal ouderen dat bij ontslag en tijdens de follow-up zelfstandig thuis woont, het verminderen van het aantal ouderen dat na ontslag en tijdens follow-up institutionaliseert, duur ziekenhuisopname en duur en ernst van een doorgemaakt delier.
Op andere uitkomsten zijn geen studies gevonden of is het effect onvoldoende aangetoond. |
Samenvatting literatuur
Beschrijving studies
Voor het beantwoorden van de uitgangsvraag werden individuele RCT’s uit vier systematische reviews gedestilleerd (Ellis, 2017; Eemer, 2018; Van Grootven, 2017; Pilotto, 2017). De Cochrane review van Ellis (2017) includeert 29 RCT’s (n=13766) waarin de effectiviteit van het CGA werd onderzocht in vergelijking met een controle behandeling bij oudere patiënten (> 65 jaar) opgenomen in het ziekenthuis. Ellis (2017) dekt de literatuur tot 6 oktober 2016. Ellis (2017) hanteert stringente inclusiecriteria. Studies includeerden patiënten met een leeftijd van 65 jaar en ouder, opgenomen in het ziekenhuis of een klinische revalidatieafdeling na acute opname wegens medische, psychologische, functionele of sociale problematiek. De Cochrane review van Eamer (2018) includeert 8 RCT’s waarin de effectiviteit van het CGA werd onderzocht in vergelijking met een controle behandeling bij oudere patiënten (> 65 jaar) opgenomen op een chirurgische afdeling; 7 RCT’s includeerden patiënten met een heupfractuur en één RCT includeerde patiënten voor electieve oncologische chirurgie. Eamer (2018) dekt de literatuur tot 1 juli 2015. In alle studies werd de effectiviteit van het CGA bepaald wanneer deze door een geriatrisch team werd uitgevoerd in de medebehandeling op een chirurgische afdeling. De systematische review van Van Grootven (2017) onderzocht de effectiviteit van het CGA in de geriatrische medebehandeling bij oudere patiënten (> 65 jaar) opgenomen op een algemene ziekenhuisafdeling. Van Grootven (2017) dekt de literatuur tot 6 mei 2016 en includeert 12 publicaties waarvan zes RCT’s konden worden ogenomen in de samenvatting van de literatuur. Pilotto (2017) beschrijft een systematische review waarin de effectiviteit van het CGA werd onderzocht in verschillende settingen: op een geriatrische afdeling, in de geriatrische medebehandeling, op de polikliniek en op de spoedeisende hulp. Pilotto (2017) dekt de literatuur tot 1 juni 2016 en includeert 18 studies waarvan 9 RCT’s konden worden opgenomen in de samenvatting van de literatuur. In aanvulling op deze reviews zijn negen RCT’s geïncludeerd, gepubliceerd na de systematische zoekacties uit de reviews (Corre, 2016; Eckerstad, 2017a; Eckerstad, 2017b; Ekdahl, 2016; Hempenius, 2016; Lundqvist, 2018; Mazya, 2019; Ommundsen, 2018; Zintchouk, 2018).
De literatuursamenvatting beschrijft de effectiviteit van het CGA uitgevoerd in verschillende settingen: het CGA op een geriatrische afdeling, het CGA in de medebehandeling, het CGA op de spoedeisende hulp en het CGA op de polikliniek. Studies in specifieke patiëntengroepen zoals oncologie, dialyse en chirurgie zijn opgenomen in de analyse als ze volden aan de selectiecriteria. De resultaten zijn niet uitgesplitst per patiëntengroep, dit vinden wij meer passen in andere richtlijnen over de beste zorg voor deze specifieke groepen. De volgende uitkomsten werden meegenomen: kwaliteit van leven, gezondheid gerelateerde kwaliteit van leven, zelfstandig wonen bij ontslag, zelfstandig wonen tijdens follow-up, institutionalisering bij ontslag, institutionalisering op follow-up, afhankelijkheid ADL-activiteit, valincidenten, delier tijdens opname, aantal delierdagen tijdens opname, ernst van het delier, cognitief functioneren, mortaliteit gedurende de opname, mortaliteit op follow-up, duur ziekenhuisopname, heropname in het ziekenhuis en kosten.
Resultaten
Kwaliteit van leven
CGA uitgevoerd op een geriatrische afdeling /ouderengeneeskundige afdeling
Het verschil in kwaliteit van leven tussen de CGA-groep, CGA uitgevoerd in de medebehandeling en de controlegroep is onderzocht in één RCT (Goldberg, 2013). Goldberg (2013) gebruikte de EuroQoL-5 dimension (EQ-5D) om de kwaliteit van leven te bepalen. De gemiddelde schaal-score in de CGA-groep was aan het eind van de follow-up (90 dagen) 0,59 (SD= 0,31) en in de controlegroep 0,57 (SD= 0,31), gemiddeld verschil= 0,02 (95%BI= (-0,08 tot 0,08); p=0,98; n=251), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in kwaliteit van leven tussen de CGA-groep, CGA behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in twee RCT’s (Kircher, 2007; Prestmo, 2015). De resultaten van de studies kunnen niet worden gepoold vanwege de methodologische heterogeniteit. De studie van Kircher (2007) gebruikte de Quality of life Philidelphia Geriatric Centre Morale Scale om de kwaliteit van leven te bepalen. De mediane schaal-score in de CGA-groep was aan het eind van de follow-up (12 maanden) 8 (IQR: 7 tot 9) en in de controlegroep 8 (IQR: 7 tot 10), geen statistisch significant verschil tussen beide groepen (p>0,05, n=161 ouderen). De studie van Prestmo (2015) gebruikte de EuroQoL-5 dimension-3L (EQ-5D-3L) om de kwaliteit van leven te bepalen. De gemiddelde schaal-score in de CGA-groep was aan het eind van de follow-up (12 maanden) 0,52 (SE= 0,22) en in de controlegroep 0,45 (SE= 0,23), gemiddeld verschil= 0,09 (95%BI= (0,02 tot 0,16); p=0,015; n=332), statistisch significant in het voordeel van de CGA-groep.
CGA uitgevoerd op de SEH
Geen studies.
CGA uitgevoerd op de polikliniek
Het verschil in kwaliteit van leven tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in één RCT (Sattar, 2018). Sattar (2018) gebruikte de EuroQoL-5 dimension (EQ-5D) om de kwaliteit van leven te bepalen. De gemiddelde schaal-score in de CGA-groep was aan het eind van de follow-up (12 maanden) 0,87 (SD= 0,09) en in de controlegroep 0,77 (SD= 0,19), gemiddeld verschil= 0,10 (95%BI= (-0,04 tot 0,24); p=0,16; n=21), geen statistisch significant verschil tussen beide groepen.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege imprecisie en heterogeniteit. De bewijskracht is ZEER LAAG.
Gezondheid gerelateerde kwaliteit van leven
CGA uitgevoerd op een geriatrische/ouderengeneeskundige afdeling
Het verschil in gezondheid-gerelateerde kwaliteit van leven tussen de CGA-groep, CGA uitgevoerd op een geriatrische afdeling, en de controlegroep is onderzocht in twee RCT’s (Cohen, 2002; Ekerstad, 2016). Cohen (2002) gebruikte de Short Form (SF)-36 om gezondheid gerelateerde kwaliteit van leven te onderzoeken. De SF-36 beslaat 8 domeinen gerelateerd aan de gezondheid. In vergelijking met de controle groep zorgde het CGA aan het einde van de follow-up (12 maanden) voor een verbetering op het domein lichamelijk discomfort (MD= 4,9; p= 0,01). Het CGA had geen effect op de overige domeinen: fysiek functioneren (MD= 2,2; p=0,30), fysieke beperkingen (MD= 4,2; p=0,13), emotionele belemmeringen (MD= 1,7; p=0,58), vitaliteit (MD= 2,7; p= 0,12), mentale gezondheid (MD= 2,0; p= 0,24), sociale activiteiten (MD= 1,9; p= 0,48), algemene gezondheid (MD= 1,6; p=0,32). Ekerstad (2016) gebruikte de health Utility Index (HUI)-3 om gezondheid gerelateerde kwaliteit van leven te onderzoeken en beslaat 8 domeinen. In vergelijking met de controle groep zorgde het CGA voor een verbetering op de volgende domeinen: gehoor (MD= 0,066; p= 0,013), spraak (MD= 0,024; p= 0,003). Het CGA had geen effect op de overige domeinen: visus (MD= 0,002; p= 0,937), activiteiten (MD= 0,029; p= 0,388), vaardigheid (MD= 0,011; p= 0,692), emotie (MD= 0,043; p= 0,077), cognitie (MD= 0,021; p= 0,363) en pijn (MD= 0,010; p= 0,830).
CGA uitgevoerd in de medebehandeling
Het verschil in gezondheid-gerelateerde kwaliteit van leven tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in twee RCT’s (Hempenius, 2013; Shyu, 2005). Hempenius (2013) gebruikte de Short Form (SF)-36 om gezondheid gerelateerde kwaliteit van leven te onderzoeken. In vergelijking met de controle groep zorgde het CGA op geen van de domeinen voor een verbetering in gezondheid gerelateerde kwaliteit van leven: fysiek functioneren (p= 0,47), sociale activiteiten (p= 0,99), fysieke beperkingen (p= 0,98), emotionele belemmeringen (p= 0,98), mentale gezondheid (p= 1,00), vitaliteit (p= 0,99), lichamelijk discomfort (p= 0,84) en algemene gezondheid (p= 0,17). Shyu (2005) onderzocht gezondheid gerelateerde kwaliteit van leven met behulp van de SF-36. In vergelijking met de controle groep zorgde het CGA op het eind van de follow-up (3 maanden) voor een verbetering op de domeinen: lichamelijk discomfort (MD= 11,3; p= 0,03), vitaliteit (MD= 13,7; p< 0,001), sociale activiteiten (MD= 8,9; p= 0,05), mentale gezondheid (MD= 11,3; p= 0,02), fysiek functioneren (MD=20,1; p< 0,001), fysieke beperkingen (MD= 21,4; p= 0,006). Het CGA had geen effect op de domeinen: emotionele beperkingen (MD= 1,8; p= 0,80) en algemene gezondheid (MD= 8,2; p= 0,11).
CGA uitgevoerd op de SEH
Geen studies.
CGA uitgevoerd op de polikliniek
Het verschil in gezondheid-gerelateerde kwaliteit van leven tussen de CGA-groep, CGA uitgevoerd op de polikliniek, en de controlegroep is onderzocht in twee RCT’s (Cohen, 2002; Zintchouk, 2019). Cohen (2002) gebruikte de SF-36 om gezondheid gerelateerde kwaliteit van leven te onderzoeken. In vergelijking met de controle groep zorgde het CGA aan het einde van de follow-up (12 maanden) voor een verbetering op de domeinen: vitaliteit (MD= 4,4; p= 0,009), mentale gezondheid (MD= 5,5; p= 0,001) en algemene gezondheid (MD= 3,8; p= 0,01). Het CGA had geen effect op de overige domeinen: fysiek functioneren (MD= 2,3; p=0,23), fysieke beperkingen (MD= 1,2; p= 0,65), emotionele belemmeringen (MD= 1,9; p=0,52), lichamelijk discomfort (MD= 1,0; p= 0,66) en sociale activiteiten (MD= 1,9; p= 0,46). Zintchouk (2019) maakte gebruik van de Depression List (DL)-somscore om de gezondheid gerelateerde kwaliteit van leven te bepalen. Er werd geen verschil gevonden in DL-somscore tussen de CGA groep en de controlegroep: MD= -0,21 (95%BI= (-2,1; 0,74); p= 0,69).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat gezondheid gerelateerde kwaliteit van leven start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege imprecisie en heterogeniteit. De bewijskracht is ZEER LAAG.
Zelfstandig wonen bij ontslag
CGA uitgevoerd op een geriatrische/ouderengeneeskundige afdeling
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in acht RCT’s (Barnes, 2012; Boustani, 2012; Collard, 1985; Kay, 1992; Landefeld, 1995; Rubenstein, 1984; Wald, 2011; White, 1994). Het percentage ouderen dat zelfstandig thuis kan blijven wonen na ontslag in de CGA-groep was 65,6% (n= 1205) en 62,1% in de controlegroep (n= 2004). Het gemiddelde relatieve risico (RR) voor ontslag naar huis was RR: 1,09; 95%BI= (1,01; 1,18); p=0,03; n= 3841 ouderen, statistisch significant in het voordeel van de groep ouderen die een CGA hebben gehad op een geriatrische afdeling. Vanwege de statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd. Random effect-model laat een overall statistische heterogeniteit zien van I2= 48%; p= 0,06.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen tussen de CGA-groep, CGA uitgevoerd in de medebehandeling en de controlegroep is onderzocht in zes RCT’s (Germain, 1995; Hempenius, 2016; McVey, 1989; Naugton, 1994; Ommundsen, 2018; Winogard, 1993). Het percentage ouderen dat zelfstandig thuis kan blijven wonen na ontslag in de CGA-groep was 72,1% (n= 296) en 68,0% in de controlegroep (n= 317). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen was RR: 0,99 (95%BI= (0,88; 1,11); p= 0,84; n= 909 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in twee RCT’s (Asplund, 2000; Fretwell, 1990). Het percentage ouderen dat zelfstandig thuis kan blijven wonen na ontslag in de CGA-groep was 64,0% (n= 263) en 57,8% in de controlegroep (n= 253). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen was RR: 1,12 (95%BI= (1,00; 1,24); p= 0,04; n= 849 ouderen), statistisch significant in het voordeel van de groep ouderen waarbij een CGA is uitgevoerd op de SEH.
CGA uitgevoerd op de polikliniek
Niet relevant.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor ontslag naar huis was RR: 1,06 (95%BI= (1,00; 1,12); p= 0,06; n= 5599 ouderen), geen statistisch significant verschil tussen beide groepen. Vanwege de statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd. Random effect-model laat een overall statistische heterogeniteit zien van I2= 49%; p= 0,01.
Figuur 1 Meta-analyse en forest plot van het relatieve risico voor het aantal ouderen dat ontslagen wordt naar huis tussen de CGA-groep en controlegroep
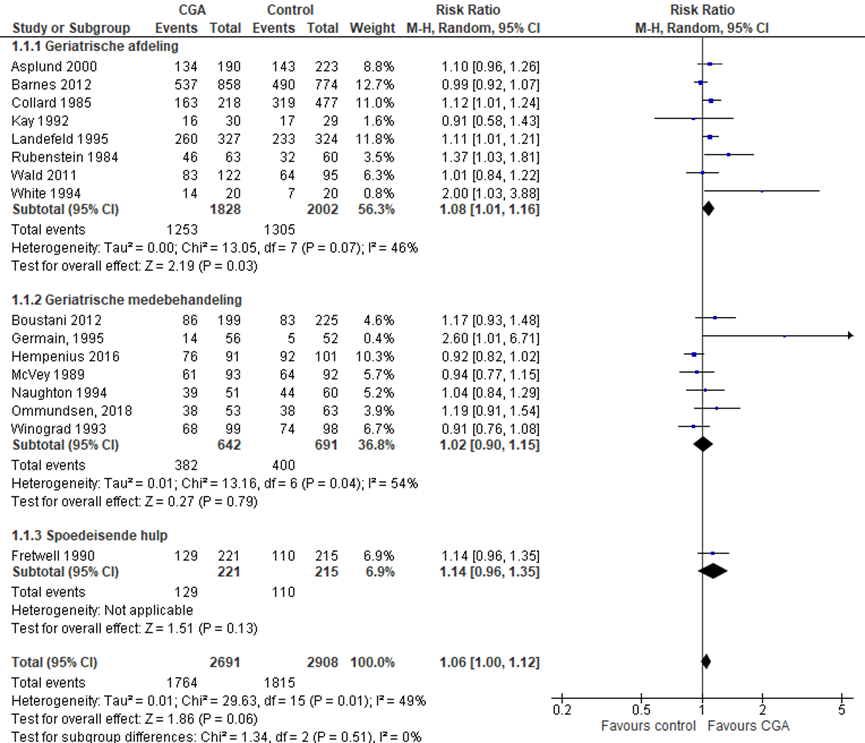
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat zelfstandig wonen bij ontslag start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Zelfstandig wonen op follow-up
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in elf RCT’s (Applegate, 1990; Cohen, 2002 (GEMC); Counsell, 2000; Goldberg 2013; Landefeld, 1995; Nikolaus, 1999; Nikolaus, 1999 (plus ESD); Rubenstein 1984; Saltvedt, 2002; Somme, 2010). Het percentage ouderen dat op 3 tot 12 maanden follow-up zelfstandig kon blijven wonen in de CGA-groep was 59,7% (n= 1548) en 56,0% in de controlegroep (n= 1353). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen op 3 tot 12 maanden follow-up was RR: 1,07; 95%BI= (1,01; 1,12); p= 0,01; n= 5009 ouderen, statistisch significant in het voordeel van de CGA-groep. Random effect-model laat een overall statistische heterogeniteit zien van I2= 9%; p= 0,36.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in vijf RCT’s (Edmans, 2013; Germain, 1995; Kircher, 2007; McVey, 1989; Winograd, 1993). Het percentage ouderen dat zelfstandig kon blijven wonen op 3 tot 12 maanden follow-up in de CGA-groep was 55,6% (n= 310) en 56,7% in de controlegroep (n= 304). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen was RR: 0,97 (95%BI= (0,88; 1,07); p= 0,54; n= 614 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op de SEH en de controlegroep is onderzocht in twee RCT’s (Asplund, 2000; Saltvedt, 2004). Het percentage ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up in de CGA-groep was 65,6% (n= 208) en 56,6% in de controlegroep (n= 198). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen was RR: 1,16 (95%BI= (1,03; 1,31); p= 0,02; n= 667 ouderen), statistisch significant in het voordeel van de groep ouderen waarbij een CGA is uitgevoerd op de SEH.
CGA uitgevoerd op de polikliniek
Het verschil in aantal ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op polikliniek, en de controlegroep is onderzocht in één RCT (Cohen, 2002 (UCOP)). Het percentage ouderen dat zelfstandig thuis kan blijven wonen op 3 tot 12 maanden follow-up in de CGA-groep was 62,3% (n= 217) en 53,2% in de controlegroep (n= 185). Het gemiddelde relatieve risico (RR) voor zelfstandig wonen was RR: 1,17 (95%BI= (1,03; 1,32); p= 0,01; n= 696 ouderen), statistisch significant in het voordeel van de groep ouderen waarbij een CGA is uitgevoerd op de polikliniek.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor zelfstandig wonen op 3 tot 12 maanden follow-up was RR: 1,07; 95%BI= (1,02; 1,12); p= 0,004; n= 7053 ouderen, statistisch significant in het voordeel van de CGA-groep. Random effect-model laat een overall statistische heterogeniteit zien van I2= 21%; p= 0,21.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat zelfstandig wonen op drie tot twaalf maanden follow-up start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Figuur 2 Meta-analyse en forest plot van het relatieve risico voor het aantal oudere volwassenen dat zelfstandig kan blijven wonen op 3 tot 12 maanden follow-up tussen de CGA-groep en controlegroep
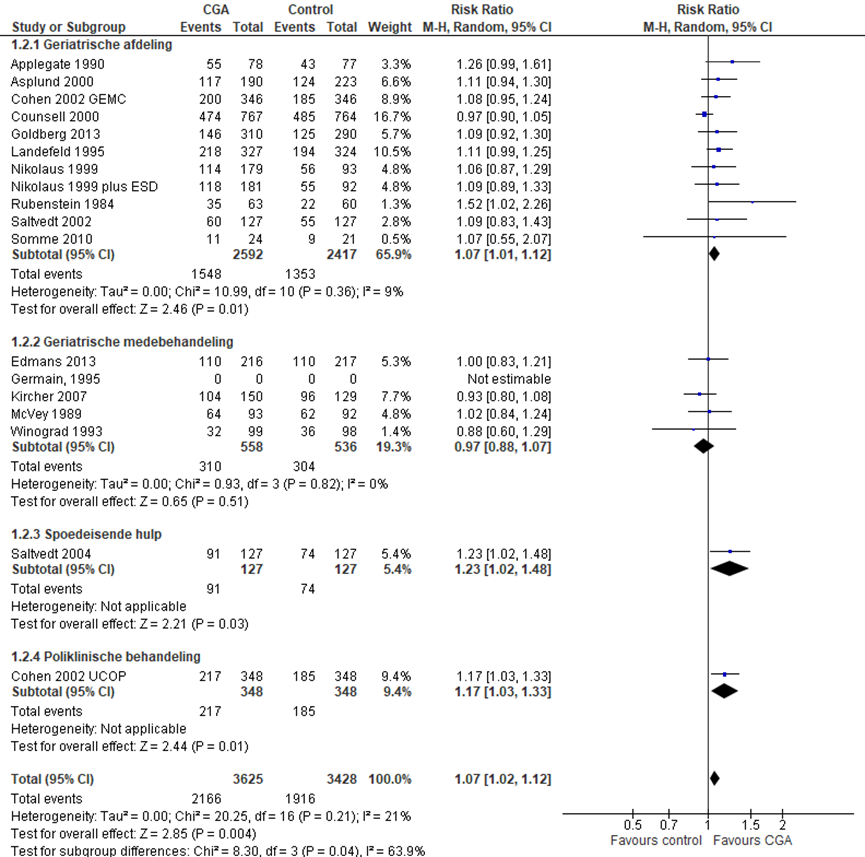
Institutionalisering bij ontslag
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat wordt opgenomen in een chronische zorginstelling bij ontslag tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in acht RCT’s (Barnes, 2012; Collard, 1985; Kay, 1992; Landefeld, 1995; Pitakala, 2006; Rubenstein 1984; Wald, 2011; White, 1994). Het percentage ouderen dat wordt opgenomen op een chronische zorginstelling bij ontslag in de CGA-groep was 25,1% (n= 481) en 27,2% in de controlegroep (n= 568). Het gemiddelde relatieve risico (RR) voor opname op een chronische zorginstelling bij ontslag was RR: 0,83 (95% BI= (0,69; 0,99); p= 0,04; n= 4004 ouderen), statistisch significant in het voordeel van de CGA-groep (minder opname op chronische zorginstelling). Vanwege de statistische heterogeniteit moet de meta-analyse kritisch worden beschouwd. Random effect-model laat een overall statistische heterogeniteit zien van I2= 50%; p= 0,04.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat wordt opgenomen op een chronische zorginstelling bij ontslag tussen de CGA-groep, CGA uitgevoerd in de medebehandeling en de controlegroep is onderzocht in 10 RCT’s (Edmans, 2013; Gerain, 1995; Hempsall, 1990; Hogan, 1987; Kennie, 1988; McVey, 1989; Naughton, 1994; Ommundsen, 2018; Swanson, 1998; Winograd, 1993). Het percentage ouderen dat wordt opgenomen op een chronische zorginstelling bij ontslag in de CGA-groep was 16,1% (n= 114) en 17,9% in de controlegroep (n= 126). Het gemiddelde relatieve risico (RR) voor opname op een chronische zorginstelling bij ontslag was RR: 0,92 (95% BI= (0,74; 1,14); p= 0,62; n= 1410 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat wordt opgenomen op een chronische zorginstelling bij ontslag tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in twee RCT’s (Fretwell, 1990). Het percentage ouderen dat wordt opgenomen op een chronische zorginstelling bij ontslag in de CGA-groep was 31,7% (n= 70) en 39,5% in de controlegroep (n= 85). Het gemiddelde relatieve risico (RR) voor opname op een chronische zorginstelling bij ontslag was RR: 0,80 (95%BI= (0,62; 1,03); p= 0,09; n= 436 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de polikliniek
Geen studies.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor opname op een chronische zorginstelling bij ontslag was RR: 0,86 (95%BI= (0,76; 0,96); p= 0,009; n= 5850 ouderen, statistisch significant in het voordeel (minder opname op chronische zorginstelling bij ontslag) van de CGA-groep.
Figuur 3 Meta-analyse en forest plot van het relatieve risico voor opname op een chronische zorginstelling bij ontslag tussen de CGA-groep en controlegroep
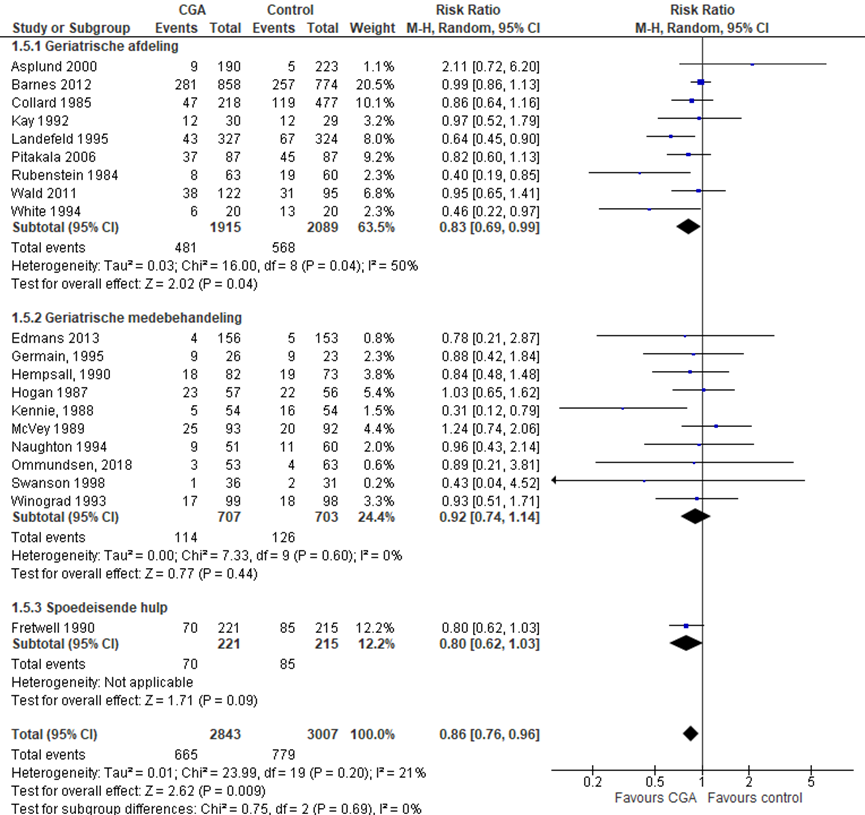
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat opname op een chronische zorginstelling bij ontslag start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Institutionalisering op follow-up
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat is opgenomen op een chronische zorginstelling op 3 tot 12 maanden follow-up tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in 12 RCT’s (Applegate, 1990; Asplund, 2000; Cohen, 2002 (GEMC); Cohen, 2002 (UCOP); Counsell, 2000; Goldberg 2013; Landefeld, 1995; Nikolaus, 1999; Nikolaus, 1999 (ESD); Rubenstein 1984; Saltvedt, 2002; Watne, 2014). Het percentage ouderen dat is opgenomen op een chronische zorginstelling op 3 tot 12 maanden follow-up in de CGA-groep was 14,3% (n= 419) en 18,1% in de controlegroep (n= 504). Het gemiddelde relatieve risico (RR) voor opname op een chronische zorginstelling op 3 tot 12 maanden follow-up was RR: 0,77 (95%BI= (0,68; 0,87); p< 0,0001; n= 5707 ouderen), statistisch significant in het voordeel van de CGA-groep (minder opname op verpleegafdeling).
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat is opgenomen in een zorginstelling op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in acht RCT’s (Deschodt, 2011; Edmans, 2013; Kircher, 2007; McVey, 1989; Naglie, 2002; Prestmo, 2015; Stenvall, 2007). Het percentage ouderen dat is opgenomen op een chronische zorginstelling na 3 tot 12 maanden follow-up in de CGA-groep was 15,6% (n= 122) en 16,3% in de controlegroep (n= 122). Het gemiddelde relatieve risico (RR) voor opname in een zorginstelling gedurende follow-up was RR: 1,00 (95%BI= (0,83; 1,21); p= 0,97; n= 1533 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat is opgenomen in een zorginstelling op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in één RCT (Fretwell, 1990). Het percentage ouderen dat is opgenomen in eenzorginstelling tijdens de follow-up in de CGA-groep was 10,0% (n= 22) en 9,3% in de controlegroep (n= 20). Het gemiddelde relatieve risico (RR) voor opname in een zorginstelling gedurende de follow-up was RR: 1,07 (95% BI= (0,60; 1,90); p= 0,82; n= 436 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de polikliniek
Het verschil in aantal ouderen dat is opgenomen in een zorginstelling op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op de polikliniek en de controlegroep is onderzocht in één RCT (Ekdahl, 2016). Het percentage ouderen dat is opgenomen in een zorginstelling op 3 tot 12 maanden follow-up in de CGA-groep was 14,4% (n= 30) en 18,4% in de controlegroep (n= 32). Het gemiddelde relatieve risico (RR) voor opname in een zorginstelling gedurende de follow-up was RR: 0,78 (95% BI= (0,50; 1,24); p= 0,57; n= 382 ouderen), geen statistisch significant verschil tussen beide groepen.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor opname in een zorginstelling op 3 tot 12 maanden was RR: 0,83 (95%BI= (0,76; 0,92); p< 0,001; n= 8056 ouderen, statistisch significant in het voordeel (minder opname in een zorginstelling gedurende de follow-up) van de CGA-groep.
Figuur 4 Meta-analyse en forest plot van het relatieve risico voor opname in zoginstelling op 3 tot 12 maanden follow-up tussen de CGA-groep en controlegroep
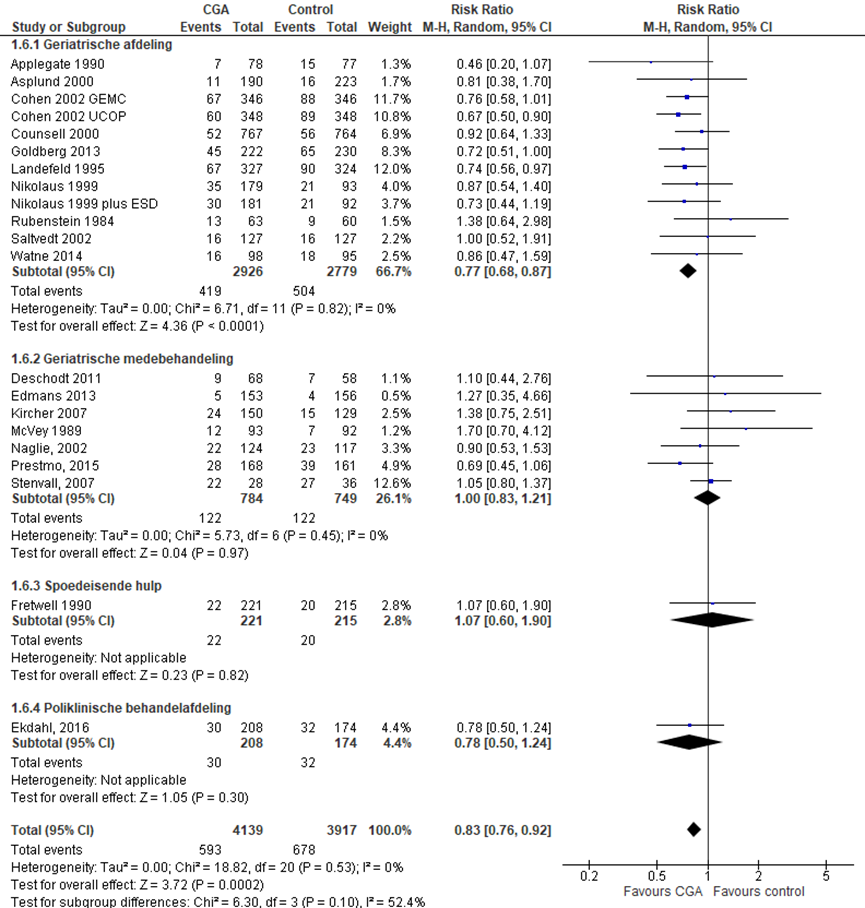
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat opname in een zorginstelling na drie tot twaalf maanden follow-up start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Afhankelijkheid ADL-activiteiten
CGA uitgevoerd op geriatrische/ ouderengeneeskundige afdeling
Het verschil in aantal ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in zeven RCT’s (Asplund, 2000; Collard, 1985; Counsell, 2000; Nikolaus, 1999; Nikolaus, 1999 (ESD); Rubenstein 1984; Saltvedt, 2002; Somme, 2010). Het percentage ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten in de CGA-groep was 26,0% (n= 424) en 30,4% in de controlegroep (n= 479). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 0,97 (95%BI= (0,87; 1,08); p=0,60; n= 3202 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in vier RCT’s (Edmans, 2013; Hempenius, 2013; Kennie, 198; Naglie, 2002). Het percentage ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten in de CGA-groep was 40,0% (n= 191) en 45,0% in de controlegroep (n= 217). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 0,88 (95%BI= (0,68; 1,13); p=0,31; n= 960 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in twee RCT’s (s). Het percentage ouderen dat afhankelijk is in het uitvoeren van ADL-activiteiten in de CGA-groep was 29,9% (n= 66) en 23,3% in de controlegroep (n= 50). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 1,28 (95%BI= (0,94; 1,76); p=0,12; n= 436 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de polikliniek
Geen studies.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor een afhankelijkheid in ADL-activiteiten was RR: 0,98 (95%BI= (0,89; 1,08); p= 0,67; n= 4598 ouderen), geen statistisch significant verschil tussen beide groepen.
Figuur 5 Meta-analyse en forest plot van het relatieve risico voor afhankelijkheid in ADL-activiteiten tussen de CGA-groep en controlegroep
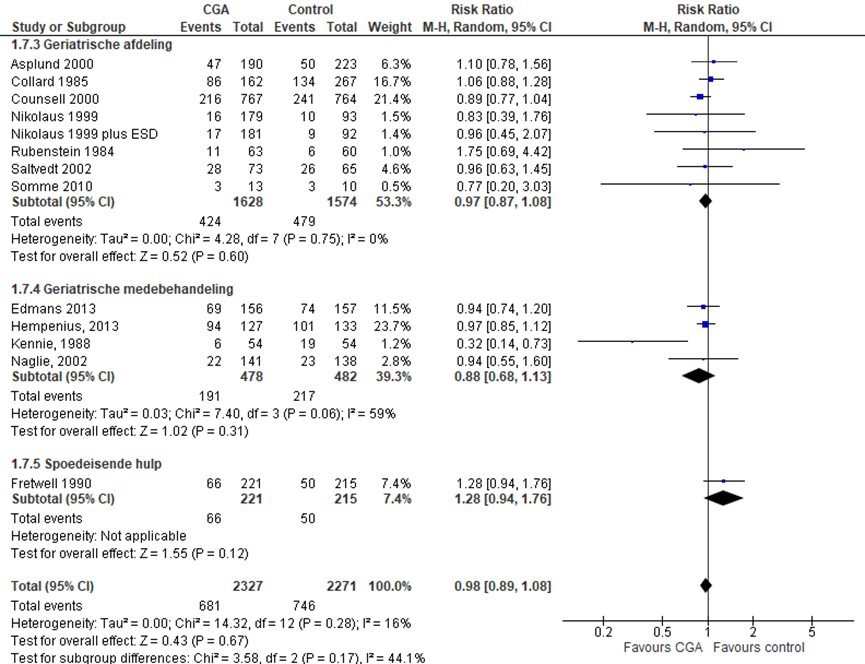
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat afhankelijkheid start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
CGA uitgevoerd op geriatrische/ ouderengeneeskundige afdeling
Het verschil in aantal ouderen dat een valincident rapporteerde tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in twee RCT’s (Goldberg, 2013; Watne, 2014). Het percentage ouderen met een valincident in de CGA-groep was 14,9% (n= 56) en 15,1% in de controlegroep (n= 54). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 0,95 (95%BI= (0,43; 2,12); p=0,10; n= 534 ouderen), geen statistisch significant verschil tussen beide groepen.
Het was niet mogelijk om de data uit de studie van Wald (2011) toe te voegen aan de meta-analyse. De data in de studie van Wald (2011) laten zien dat de valincidentie niet verschilt tussen patiënten in de CGA-groep en de controlegroep, 4,8 vallen per 1000 patiëntdagen versus 6,7 vallen per 1000 patiëntdagen (95%BI= (9,6; 13,3)), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat een valincident rapporteerde tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in vier RCT’s (Edmans, 2013; Hempenius, 2013; Reuben, 1995; Shyu, 2008). Het percentage ouderen met een valincident in de CGA-groep was 22,7% (n= 266) en 22,7% in de controlegroep (n= 225). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 0,97 (95%BI= (0,69; 1,36); p= 0,85 n= 2160 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH of op de polikliniek
Geen studies.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor een valincident was RR: 0,97 (95%BI= (0,72; 1,31); p= 0,84; n= 2893 ouderen), geen statistisch significant verschil tussen beide groepen.
Figuur 6 Meta-analyse en forest plot van het relatieve risico voor valincidenten tussen de CGA-groep en controlegroep
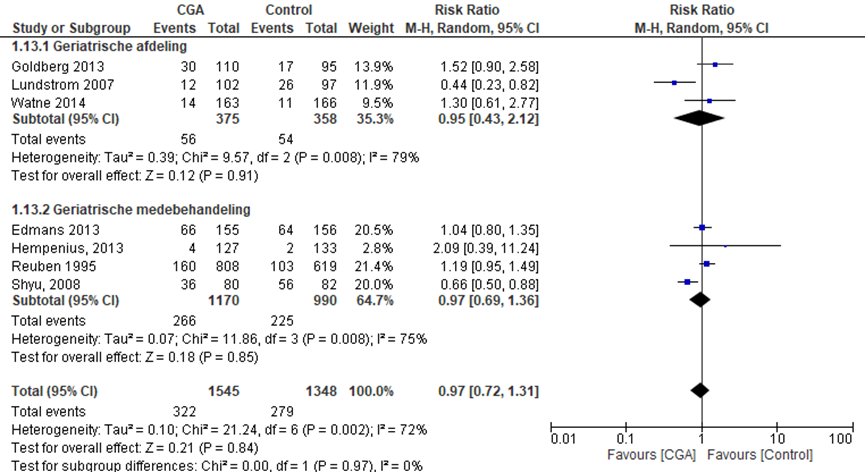
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat valincidenten start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege ernstige imprecisie. De bewijskracht is LAAG.
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat met een delier tijdens ziekenhuisopname tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in vier RCT’s (Boustani, 2012; Lundstrom, 2007; Wald, 2011; Watne, 2014). Het percentage ouderen met een delier in de CGA-groep was 40,3% (n= 236) en 42,0% in de controlegroep (n= 245). Het gemiddelde relatieve risico (RR) voor een delier was RR: 0,94 (95%BI= (0,73; 1,20); p=0,60; n= 1169 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen met een delier tijdens ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in vier RCT’s (Hempenius, 2013; Marcantonio, 2001; Stenvall, 2007; Vidan, 2005). Het percentage ouderen met een delier tijdens ziekenhuisopname in de CGA-groep was 27,9% (n= 104) en 38,5% in de controlegroep (n= 153). Het gemiddelde relatieve risico (RR) voor een valincident was RR: 0,59 (95%BI= (0,42; 0,82); p= 0,002 n= 769 ouderen), statistisch significant in het voordeel van de CGA groep.
CGA uitgevoerd op de SEH of op de polikliniek
Geen studies.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor delier was RR: 0,80 (95%BI= (0,65; 0,97); p= 0,02; n= 1938 ouderen), statistisch significant in het voordeel van de CGA groep.
Figuur 7 Meta-analyse en forest plot van het relatieve risico voor delirium tussen de CGA-groep en controlegroep
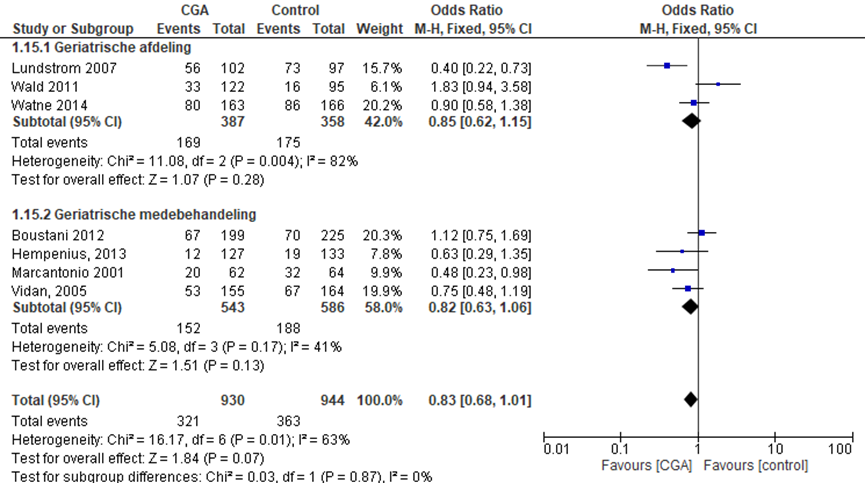
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat delier start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Aantal dagen met delier tijdens opname
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal dagen dat ouderen een delier hebben tijdens de ziekenhuisopname tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in één RCT (Lundstrom, 2007). Het gemiddelde verschil in aantal delier dagen tussen beide groepen was 9,60 dagen (95%BI= (-13,22;-5,98)), statistisch significant in het voordeel van de CGA-groep. De data uit de studie van Watne (2014) aangaande het aantal delierdagen kan niet worden toegevoegd aan de meta-analyse omdat deze geen gemiddelde (SD) presenteert. Watne (2014) laat zien dat de mediaan voor aantal delierdagen in de CGA-groep 3 dagen was (IQR: 2 tot 7), en in de controlegroep was dit 4 dagen (IQR: 2 tot 6), geen statistisch significant verschil tussen beide groepen (p=0,85).
CGA uitgevoerd in de medebehandeling, op de SEH of op de polikliniek
Geen studies.
Figuur 8 Meta-analyse en forest plot van de gestandaardiseerde gemiddelde verschilscore voor de duur van de ziekenhuisopname tussen de CGA-groep en controlegroep
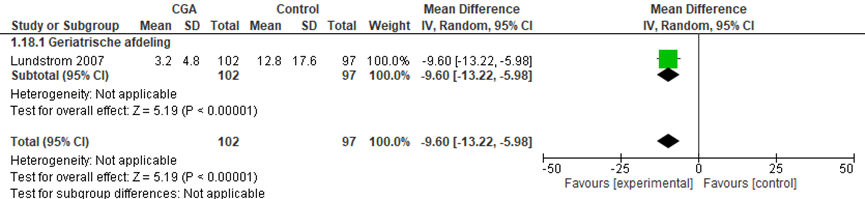
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat delierdagen start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege imprecisie. De bewijskracht is ZEER LAAG.
Ernst van het delier
CGA uitgevoerd op geriatrische afdeling of afdeling interne ouderengeneeskunde
Het verschil in ernst van het delier tijdens ziekenhuisopname tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in twee RCT’s (Hempenius, 2013; Watne, 2014). Gezien de statistische heterogeniteit kan de data uit beide studies niet worden gepoold. Hempenius gebruikt de Delirium Rating Scale R-98 om de ernst van het delier te bepalen. De mediaan voor de ernst van het delier in de CGA-groep was 9 (IQR: 3-30), en in de controlegroep was de mediaan 15 (IQR: 5-29), geen statistisch significant verschil tussen beide groepen (p=0,23). Watne (2014) gebruikt de Memorial Delirium Assessment Scale (MDAS) om de ernst van het delier te bepalen. De mediaan voor de ernst van het delier in de CGA-groep was 21,5 (IQR: 15,3-25), en in de controlegroep was de mediaan 20 (IQR: 13,8-26), geen statistisch significant verschil tussen beide groepen (p=0,44). Marcantonio (2001) gebruikt de MDAS om de ernst van het delier te bepalen waarbij het aantal ouderen met een ernstig delier werd gedefinieerd als een MDAS-score ≥ 18 gedurende één opnamedag. Het percentage ouderen met een ernstig delier in de CGA-groep was 12 (n= 7) en 29% in de controlegroep (n= 18). Het gemiddelde relatieve risico (RR) voor een delier was RR: 0,40 (95%BI= (0,19; 0,89); p=0,02; n= 126 ouderen), statistisch significant in het voordeel van de CGA-groep.
CGA uitgevoerd in de medebehandeling, op de SEH of polikliniek
Geen studies.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernst van het delier start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege imprecisie. De bewijskracht is ZEER LAAG.
Cognitief functioneren
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in cognitieve functies tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in twee RCT’s (Asplund, 2000; Goldberg, 2013). Het gestandaardiseerde gemiddelde verschil tussen de CGA-groep en de controlegroep was SMD= 0,18 (95%BI= (-0,08; 0,43); p=0,17), geen statistisch significant verschil tussen beiden groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in cognitieve functies tussen de CGA-groep, behandeld in de geriatrische medebehandeling, en de controlegroep is onderzocht in drie RCT’s (Kircher, 2007; Reuben, 1995; Winogard, 1993). Het gestandaardiseerde gemiddelde verschil tussen de CGA-groep en de controlegroep was SMD= 0,05 (95%BI= (-0,19; 0,30); p=0,67), geen statistisch significant verschil tussen beiden groepen.
CGA uitgevoerd in de SEH, of polikliniek
Geen studies.
Overall effect CGA
Het gemiddelde overall verschil in cognitief functioneren tussen de CGA-groep en de controle groep was SMD= 0,10 (95%BI= (-0,06; 0,26); p= 0,22), geen statistisch significant verschil tussen beide groepen.
Figuur 9 Meta-analyse en forest plot van de gestandaardiseerde gemiddelde verschilscore voor cognitieve functies tussen de CGA-groep en controle groep
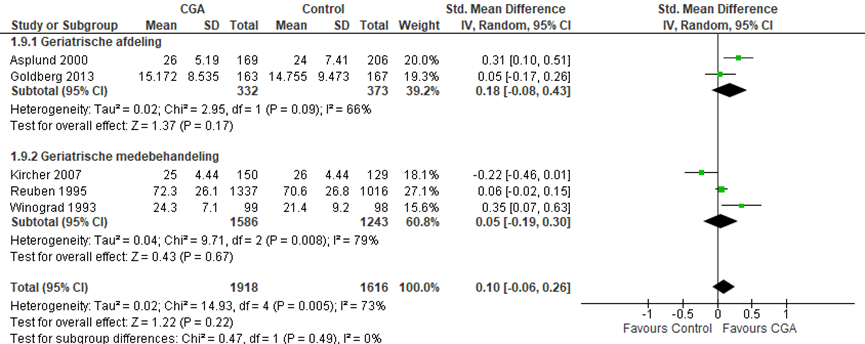
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cognitieve functies start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege ernstige imprecisie (tegenstrijdige resultaten). De bewijskracht is ZEER LAAG.
Mortaliteit gedurende opname
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat komt te overlijden tijdens ziekenhuisopname tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in elf RCT’s (Asplund, 2000; Barnes, 2012; Collard, 1985; Eckerstad, 2017a; Kay, 1992; Landefeld, 1995; Rubenstein, 1984; Saltvedt, 2005; Wald, 2011; Watne, 2014; White, 1994). Het percentage ouderen dat overlijdt tijdens ziekenhuisopname in de CGA-groep was 4,9% (n= 114) en 5,4% in de controlegroep (n= 135). Het gemiddelde relatieve risico (RR) voor mortaliteit na ontslag was RR: 0,94; 95%BI= (0,68; 1,30); p= 0,71; n= 4821 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat komt te overlijden tijdens ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in tien RCT’s (Corre, 2016; Germain, 1995; Hempenius, 2016; Hogan, 1990; McVey, 1989; Naughton, 1994; Suhm, 2014; Swanson, 1998; Vidan, 2005; Winograd, 1993). Het percentage ouderen dat komt te overlijden tijdens ziekenhuisopname in de CGA-groep was 6,8% (n= 77) en 7,8% in de controlegroep (n= 90). Het gemiddelde relatieve risico (RR) voor mortaliteit na ontslag was RR: 0,86; 95%BI= (0,59; 1,24); p= 0,42; n= 2285 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat komt te overlijden tijdens ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in één RCT (Fretwell, 1990). Het percentage ouderen dat komt te overlijden tijdens ziekenhuisopname in de CGA-groep was 10% (n= 4222 en 5,9% in de controlegroep (n= 20). Het gemiddelde relatieve risico (RR) voor mortaliteit na ontslag was RR: 1,07; 95%BI= (0,60; 1,90); p= 0,62; n= 1596 ouderen, geen statistisch significant verschil tussen beide groepen.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor mortaliteit tijdens ziekenhuisopname was RR: 0,93 (95%BI= (0,75; 1,15); p= 0,82; n= 7542 ouderen, geen statistisch significant verschil tussen beide groepen.
Figuur 10 Meta-analyse en forest plot van het relatieve risico voor mortaliteit tijdens ziekenhuisopname tussen de CGA-groep en controlegroep
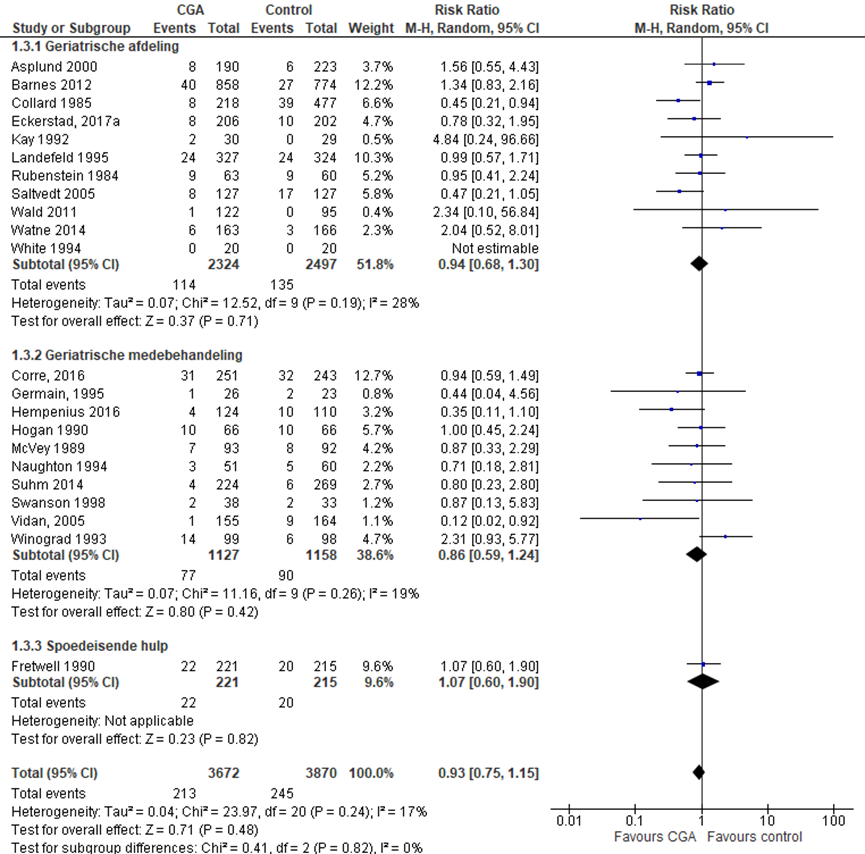
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit tijdens ziekenhuisopname start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias) en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Mortaliteit bij follow-up
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in aantal ouderen dat komt te overlijden op 3 tot 12 maanden follow-up tussen de CGA-groep, behandeld op een geriatrische afdeling en de controlegroep is onderzocht in 15 RCT’s (Applegate, 1990; Asplund, 2000; Cohen, 2002 (GEMC); Counsell, 2000; Eckerstad, 2017a; Goldberg 2013; Harris 1991; Landefeld, 1995; Nikolaus, 1999; Nikolaus, 1999 (ESD); Pitakala, 2006; Rubenstein 1984; Saltvedt, 2002; Shamian, 1984; Somme, 2010). Het percentage ouderen dat komt te overlijden op 3 tot 12 maanden follow-up in de CGA-groep was 22,6% (n= 713) en 24,0% in de controlegroep (n= 724). Het gemiddelde relatieve risico (RR) voor mortaliteit op 3 tot 12 maanden follow-up was RR: 0,94 (95%BI= (0,85; 1,04); p= 0,24; n= 6177 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in aantal ouderen dat komt te overlijden op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in 14 RCT’s (Boustani, 2012; Deschodt, 2011; Edmans, 2013; Germain, 1995 Kircher, 2007; McVey, 1989; Naglie, 2002; Prestmo, 2015; Reuben, 1995; Shyu, 2005; Stenvall, 2007; Thomas, 1993; Vidan, 2005; Winograd, 1993). Het percentage ouderen dat komt te overlijden op 3 tot 12 maanden follow-up in de CGA-groep was 19,7% (n= 584) en 20,0% in de controlegroep (n= 523). Het gemiddelde relatieve risico (RR) voor mortaliteit gedurende de follow-up was RR: 0,95 (95%BI= (0,86; 1,06); p= 0,38; n= 5581 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in aantal ouderen dat komt te overlijden op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in vier RCT’s (Fretwell, 1990). Het percentage ouderen dat komt te overlijden op 3 tot 12 maanden follow-up na ontslag in de CGA-groep was 23,2% (n= 177) en 18,9% in de controlegroep (n= 159). Het gemiddelde relatieve risico (RR) voor mortaliteit gedurende de follow-up was RR: 1,18 (95%BI= (0,90; 1,55); p= 0,23; n= 1596 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de polikliniek
Het verschil in aantal ouderen dat komt te overlijden op 3 tot 12 maanden follow-up tussen de CGA-groep, CGA uitgevoerd op de polikliniek, en de controlegroep is onderzocht in twee RCT’s (Cohen, 2002 (UCOP); Mayza, 2019; Sattar, 2018). Het percentage ouderen dat komt te overlijden op 3 tot 12 maanden follow-up in de CGA-groep was 20,3% (n= 48) en 27,5% in de controlegroep (n= 56). Het gemiddelde relatieve risico (RR) voor mortaliteit gedurende de follow-up was RR: 0,79 (95%BI= (0,56; 1,11); p= 0,18; n= 440 ouderen, geen statistisch significant verschil tussen beide groepen.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor mortaliteit op 3 tot 12 maanden follow-up was RR: 0,95 (95%BI= (0,88; 1,03); p= 0,22; n= 13794 ouderen, geen statistisch significant verschil tussen beide groepen.
Figuur 11 Meta-analyse en forest plot van het relatieve risico voor mortaliteit op 3 tot 12 maanden na ontslag tussen de CGA-groep en controlegroep
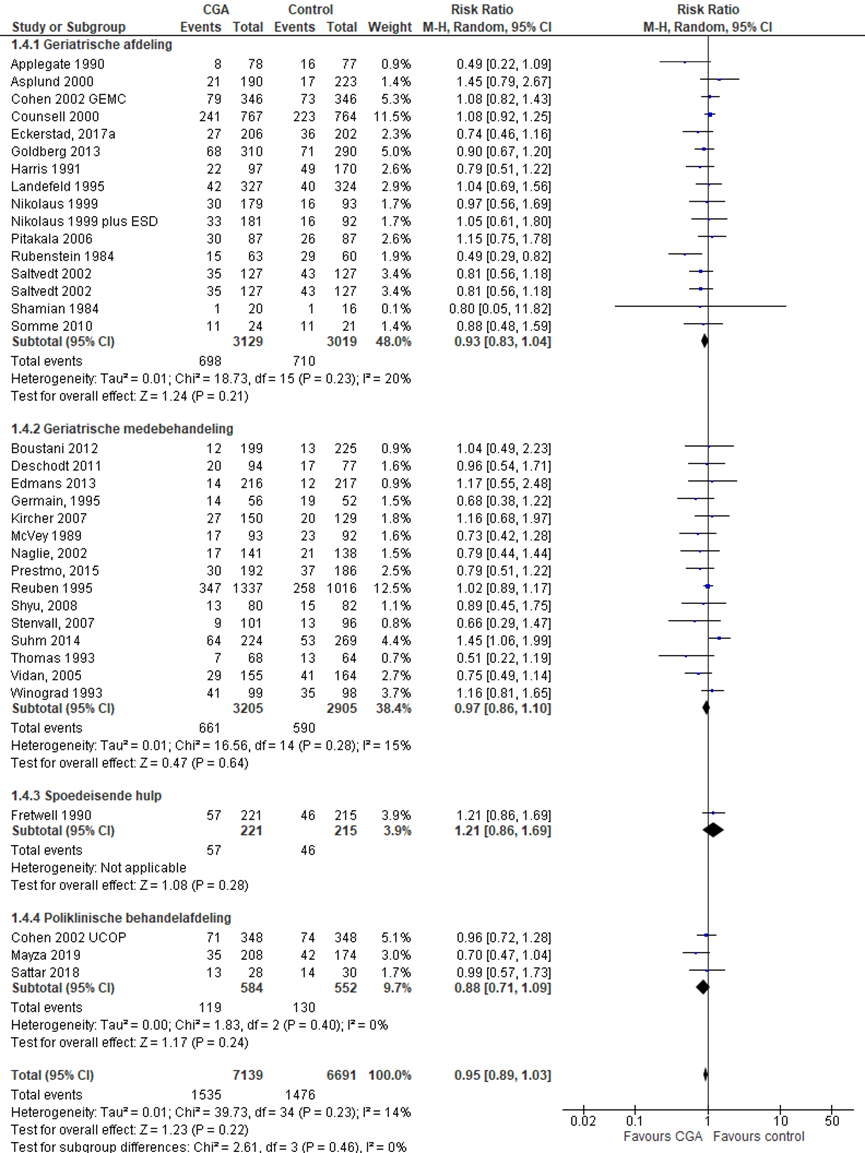
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit op 3 tot 12 maanden follow-up start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Duur ziekenhuisopname
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in de duur van de ziekenhuisopname tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in 10 RCT’s (Asplund, 2000; Boustani, 2012; Cohen, 2002 (GEMC); Cohen, 2002 (UCOP); Goldberg 2013; Harris, 1991; Nikolaus, 1999; Nikolaus, 1999 (ESD); Saltvedt, 2002; Somme, 2010; Wald, 2011). Het gemiddelde verschil in de duur van de ziekenhuisopname was -1,89 dagen (95%BI= (-0,16; 3,94); p=0,07; n= 3730 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in de duur van de ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in 16 RCT’s (Deschodt, 2011; Edmans, 2013; Hempsall, 1990; Hogan, 1987; Lundstrom, 2007; McVey, 1989; Naglie, 2002; Naughton, 1994; Ommundsen, 2018; Prestmo, 2015; Shyu, 2005; Stenvall, 2007; Swanson, 1998; Thomas, 1993; Vidan, 2005; Winograd, 1993). Het gemiddelde verschil in de duur van de ziekenhuisopname was -0,86 dagen (95%BI= (-2,24; 0,53); p=0,22; n= 2991 ouderen), geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de SEH
Het verschil in de duur van de ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd op de SEH, en de controlegroep is onderzocht in drie RCT’s (Fretwell, 1990; Suhm, 2014). Het gemiddelde verschil in de duur van de ziekenhuisopname was -2,01 dagen (95%BI= (-3,06; -0,96); p=0,0002; n= 1342 ouderen), statistisch significant in het voordeel van de CGA groep.
CGA uitgevoerd op de polikliniek
Het verschil in de duur van een ziekenhuisopname tussen de CGA-groep, CGA uitgevoerd op de polikliniek, en de controlegroep is onderzocht in één RCT (Ekdahl, 2016). Het gemiddelde verschil in de duur van de ziekenhuisopname was -5,90 dagen (95%BI= (-10,38; -1,42) p=0,010; n= 382 ouderen), statistisch significant in het voordeel van de CGA groep.
Overall effect CGA
Het gemiddelde overall verschil in de duur van de ziekenhuisopname was -0,25 dagen (95%BI= (-1,27; 0,77); p=0,63; n= 8445 ouderen), geen statistisch significant verschil tussen beide groepen.
Figuur 12 Meta-analyse en forest plot van het gemiddelde verschilscore voor de duur van de ziekenhuisopname tussen de CGA-groep en controlegroep
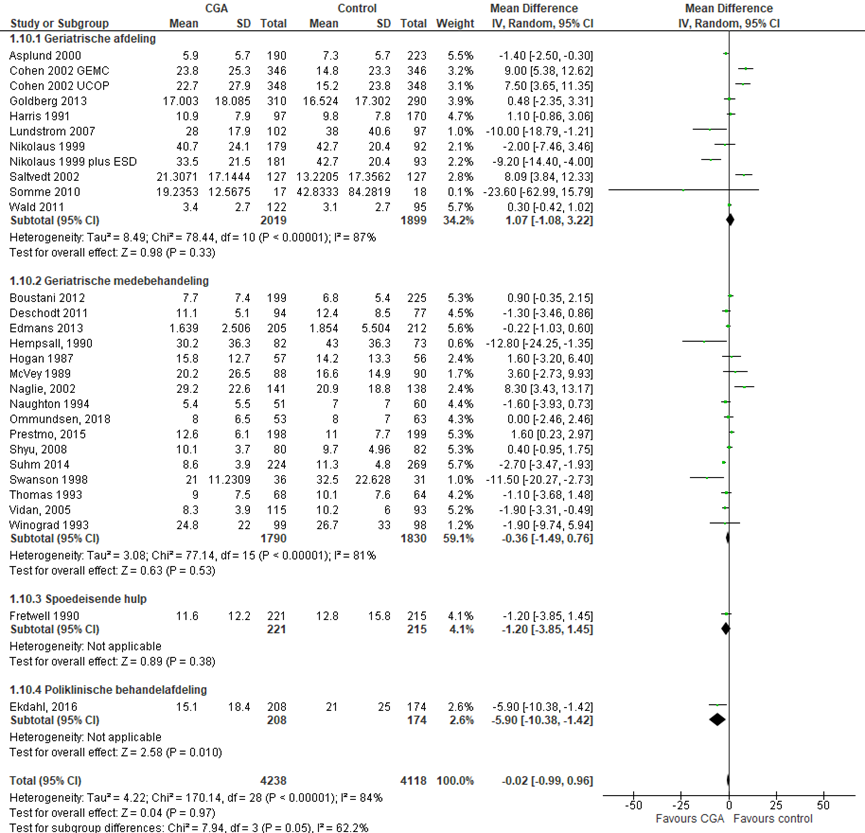
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat duur ziekenhuis opname start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Heropname in het ziekenhuis
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Het verschil in ziekenhuisheropnames tussen de CGA-groep, behandeld op een geriatrische afdeling, en de controlegroep is onderzocht in 14 RCT’s (Applegate, 1990; Barnes, 2012; Boustani, 2012; Counsell, 2000; Eckerstad, 2017a; Goldberg 2013; Landefeld, 1995; Nikolaus, 1999; Nikolaus, 1999 (ESD); Rubenstein 1984; Saltvedt, 2002; Wald, 2011; Watne, 2014; White, 1994). Het percentage ouderen met een ziekenhuisheropname in de CGA-groep was 24,17% (n= 828) en 24,3% in de controlegroep (n= 766). Het gemiddelde relatieve risico (RR) voor ziekenhuisheropname was RR: 0,99 (95%BI= (0,91; 1,07); p= 0,73; n= 6593 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd in de medebehandeling
Het verschil in ziekenhuisheropnames tussen de CGA-groep, CGA uitgevoerd in de medebehandeling, en de controlegroep is onderzocht in 11 RCT’s (Deschodt, 2011; Edmans, 2013; Germain, 1995; Hempenius, 2016; Hogan, 1987; Kircher, 2007; Ommundsen, 2018; Prestmo, 2015; Reuben, 1995; Stenvall, 2007). Het percentage ouderen met een ziekenhuisheropname in de CGA-groep was 33,3% (n= 824) en 35,4% in de controlegroep (n= 754). Het gemiddelde relatieve risico (RR) voor ziekenhuisheropname was RR: 0,98 (95%BI= (0,91; 1,13); p= 0,84; n= 4768 ouderen, geen statistisch significant verschil tussen beide groepen.
CGA uitgevoerd op de polikliniek
Het verschil in ziekenhuisheropnames tussen de CGA-groep, CGA uitgevoerd op de polikliniek, en de controlegroep is onderzocht in twee RCT’s (Shyu, 2016; Zintchouk, 2018). Het percentage ouderen met een ziekenhuisheropname in de CGA-groep was 59,9% (n= 170) en 60,6% in de controlegroep (n= 171). Het relatieve risico (RR) voor ziekenhuisheropname was RR: 0,98 (95%BI= (0,86; 1,13); p= 0,84; n= 566 ouderen, geen statistisch significant verschil tussen beide groepen.
Overall effect CGA
Het gemiddelde overall relatieve risico (RR) voor ziekenhuisheropname was RR: 0,98 (95%BI= (0,93; 1,04); p= 0,50; n= 11765 ouderen, geen statistisch significant verschil tussen beide groepen.
Figuur 13 Meta-analyse en forest plot van het relatieve risico voor heropname in het ziekenhuis tussen de CGA-groep en controlegroep
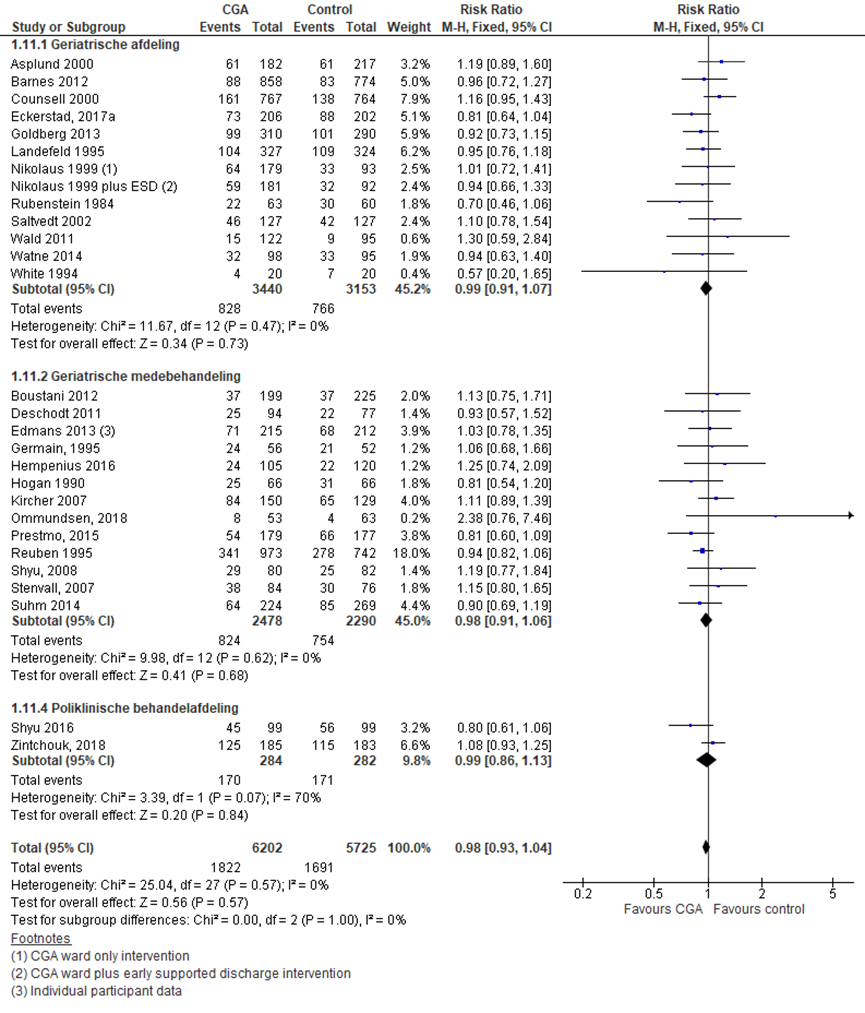
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat heropname ziekenhuis start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met één niveau vanwege imprecisie. De bewijskracht is LAAG.
Kosten
CGA uitgevoerd op afdeling geriatrie of interne ouderengeneeskunde
Ekerstad (2018) heeft een analyse uitgevoerd om de kosteneffectiviteit van het CGA te bepalen. De primaire uitkomstmaat in de studie was de gecorrigeerde kosteneffectiviteitsratio welke werd bepaald in de interventie en controlegroep op drie maanden follow-up. Het gemiddelde verschil in gecorrigeerde quality adjusted life years (QALYs) tussen de groepen op drie maanden was: 0,0252 QALYs (95%BI= (0,0082; 0,0422), met een verschil van -3226 dollars aan kosten (incremental cost) tussen beide interventies (95%BI= (-6167; -285)).
CGA uitgevoerd in de medebehandeling, op de SEH of polikliniek
Geen studies.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kosten start op hoog vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (risk of bias); en met twee niveaus vanwege ernstige imprecisie (te kleine patiëntenpopulatie). De bewijskracht is ZEER LAAG.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
Wat zijn de (on)gunstige effecten van het CGA in de behandeling van kwetsbare oudere patiënten?
P: ouderen, ouder, oud, kwetsbaar, kwetsbaarheid, Multi-morbiditeit, geriatrische patiënten, 65 years+;
I: comprehensive geriatric assessment, CGA, multi-domein assessment, multidisciplinaire assessment, patient-centered, geriatric evaluation, geriatric service;
C: standaard behandeling, géén geriatrisch onderzoek
O: kwaliteit van leven, gezondheid gerelateerde kwaliteit van leven, zelfstandig wonen bij ontslag, zelfstandig wonen tijdens follow-up, institutionalisering bij ontslag, institutionalisering op follow-up, afhankelijkheid ADL-activiteit, valincidenten, delier tijdens opname, aantal delierdagen tijdens opname, ernst van het delier, cognitief functioneren, mortaliteit gedurende de opname, mortaliteit op follow-up, duur ziekenhuisopname, heropname in het ziekenhuis, kosten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley)) is op 16 augustus 2018 met relevante zoektermen gezocht naar publicaties waarin studies worden beschreven naar de effectiviteit van het CGA in kwetsbare ouderen patiënten. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 647 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: gerandomiseerd onderzoek naar de effectiviteit van het CGA. Op basis van titel en abstract werden in eerste instantie 79 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 66 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 13 studies definitief geselecteerd. In totaal zijn 13 publicaties opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- 1 - Applegate WB, Miller ST, Graney MJ, Elam JT, Burns R, Akins DE. A randomized, controlled trial of a geriatric assessment unit in a community rehabilitation hospital. N Engl J Med. 1990 May 31;322(22):1572-8. PubMed PMID: 2186276.
- 2 - Barnes DE, Palmer RM, Kresevic DM, Fortinsky RH, Kowal J, Chren M-M, Landefeld CS. Acute care for elders unit produced shorter hospital stays at lower cost while maintaining patients’ functional status. Health Affairs 2012; 31(6):1227–36.
- 3 - Boustani MA, Campbell NL, Khan BA, Abernathy G, Zawahiri M, Campbell T, et al. Enhancing care for hospitalised older adults with cognitive impairment: a randomised controlled trial. Journal of General Internal Medicine 2012;27(5):561–7.
- 4 - Cohen HJ, Feussner JR, Weinberger M, Carnes M, Hamdy RC, Hsieh F, et al. A controlled trial of inpatient and outpatient geriatric evaluation and management. New England Journal of Medicine 2002;346:905–12.
- 5 - Collard AF, Bachman SS, Beatrice DF. Acute care delivery for the geriatric patient: an innovative approach. Quarterly Review Bulletin 1985;June:180–5.
- 6 - Counsell SR, Holder CM, Liebenauer LL, Palmer RM, Fortinsky RH, Kresevic DM, et al. Effects of a multicomponent intervention on functional outcomes and process of care in hospitalised older patients: a randomised controlled trial of acute care for elders (ACE) in a community hospital. Journal of the American Geriatrics Society 2000;48:1572–81.
- 7 - Eamer G, Taheri A, Chen SS, Daviduck Q, Chambers T, Shi X, Khadaroo RG. Comprehensive geriatric assessment for older people admitted to a surgical service. Cochrane Database Syst Rev. 2018 Jan 31;1:CD012485. doi: 10.1002/14651858.CD012485.pub2. Review. PubMed PMID: 29385235; PubMed Central PMCID: PMC6491328.
- 8 - Edmans J, Bradshaw L, Franklin M, Gladman J. Specialist geriatric medical assessment for patients discharged from hospital acute assessment units: randomised controlled trial. BMJ 2013;347:doi: 10.1136/bmj.f5874.
- 9 - Ekerstad N, Dahlin Ivanoff S, Landahl S, Östberg G, Johansson M, Andersson D, Husberg M, Alwin J, Karlson BW. Acute care of severely frail elderly patients in a CGA-unit is associated with less functional decline than conventional acute care. Clin Interv Aging. 2017 Aug 8;12:1239-1249. doi: 10.2147/CIA.S139230. eCollection 2017. PubMed PMID: 28848332; PubMed Central PMCID: PMC5557103.
- 10 - Ellis G, Gardner M, Tsiachristas A, Langhorne P, Burke O, Harwood RH, Conroy SP, Kircher T, Somme D, Saltvedt I, Wald H, O'Neill D, Robinson D, Shepperd S. Comprehensive geriatric assessment for older adults admitted to hospital. Cochrane DatabaseSystev. 2017 Sep 12;9:CD006211. doi: 10.1002/14651858.CD006211.pub3. Review. PubMed PMID: 28898390; PubMed Central PMCID: PMC6484374.
- 11 - Fretwell MD, Raymond PM, McGarvey ST, Owens N, Traines M, Silliman RA, et al. The senior care study. A controlled trial of a consultative / unit based geriatric assessment program in acute care. Journal of the American Geriatrics Society 1990;38:1073–81.
- 12 - Goldberg SE, Bradshaw LE, Kearney FC, Russell C, Whittamore KH, Foster PER, et al. Care in specialist medical and mental health unit compared with standard care for older people with cognitive impairment admitted to general hospital: randomised controlled trial (NIHR TEAM trial). BMJ 2013;347:doi: 10.1136/bmj.f4132.
- 13 - Harris RD, Henschke PJ, Popplewell PY, Radford AJ, Bond MJ, Turnbull RJ, et al. A randomised study of outcomes in a defined group of acutely ill elderly patients managed in a geriatric assessment unit or a general medical unit. Australian and New Zealand Journal of Medicine 1991;21: 230–4.
- 14 - Hempenius L, Slaets JP, van Asselt D, de Bock TH,Wiggers T, van Leeuwen BL. Long term outcomes of a geriatric liaison intervention in frail elderly cancer patients. PloS One 2016;11(2):e0143364.
- 15 - Hempsall VJ, Robertson DR, Campbell MJ, Briggs RS. Orthopaedic geriatric care - is it effective? A prospective population-based comparison of outcome in fractured neck of femur. Journal of the Royal College of Physicians of London 1990;24(1):47–50.
- 16 - Hogan DB, Fox RA, Badley BWD, Mann OE. Effect of a geriatric consultation service on management of patients in an acute care hospital. Canadian Medical Association Journal 1987;April:713–7.
- 17 - Kay G, MacTavish M, Moffat C, Lau G. Development and evaluation of a geriatric assessment unit in a community hospital. Fall 1992;16(3):2–9.
- 18 - Kennie DC, Reid J, Richardson IR, Kiamari AA, Kelt C. Effectiveness of geriatric rehabilitative care after fractures of the proximal femur in elderly women: A randomised clinical trial. BMJ 1988;297(6656):1083–6.
- 19 - Kircher TJ, Wormstall H, Muller PH, Schwarzler F, Buchkremer G, Wild K, et al. A randomised trial of a geriatric evaluation and management consultation services in frail hospitalised patients. Age & Ageing 2007;36:36–42. MEDLINE: 932.
- 20 - Landefeld CS, Palmer RM, Krescevic DM, Fortinsky RH, Kowal J. A randomised trial of care in a hospital medical unit especially designed to improve the functional outcomes of acutely ill older patients. New England Journal of Medicine 1995;332:1338–44.
- 21 - Li TR, Li Y, Zhang L, Tan AJ. Effects of comprehensive geriatric assessment intervention on Chinese Han older patients with multiple chronic comorbidities. Journal of the American Geriatrics Society 2015;63:S397–8.
- 22 - Marcantonio ER, Flacker JM, Wright RJ, Resnick NM. Reducing delirium after hip fracture: A randomized trial. Journal of the American Geriatrics Society 2001;49(5): 516–22.
- 23 - McVey LJ, Becker PM, Saltz CC, Feussner JR, Cohen HJ. Effect of a geriatric consultation team on functional status of elderly hospitalized patients. Annals of Internal Medicine 1989;110(1):79–84. MEDLINE: 927.
- 24 - Naglie G, Tansey C, Kirkland JL, Ogilvie-Harris DJ, Detsky AS, Etchells E, et al. Interdisciplinary inpatient care for elderly people with hip fracture: A randomized controlled trial. CMAJ: Canadian Medical Association Journal 2002; 167(1):25–32.
- 25 - Naughton BJ, Moran MB, Feinglass J, Falconer J, Williams ME. Reducing ho spital costs for the geriatric patient admitted from the emergency department: a randomized trial. Journal of the American Geriatrics Society 1994;41: 1045–9.
- 26 - Nikolaus T, Specht-Leible N, Bach M, Oster P, Schuerf G. A randomised trial of comprehensive geriatric assessment and home intervention in the care of hospitalised patients. Age & Ageing 1999;28:543–50.
- 27 - Ommundsen N, Wyller TB, Nesbakken A, Bakka AO, Jordhøy MS, Skovlund E, Rostoft S. Preoperative geriatric assessment and tailored interventions in frail older patients with colorectal cancer: a randomized controlled trial. Colorectal Dis. 2018 Ja n;20(1):16-25. doi: 10.1111/codi.13785. PubMed PMID: 28649755.
- 28 - Powell C, Montgomery P. The age study: the admission of geriatric patients through emergency. Age & Ageing 1990; 19(Suppl):21–2. MEDLINE: 933.
- 29 - Prestmo A, Hagen G, Sletvold O, Helbostad JL, Thingstad P, Taraldsen K, et al. Comprehensive geriatric care for patients with hip fractures: A prospective, randomised, controlled trial. Lancet 2015;385(9978):1623–33.
- 30 - Reuben DB, Borok GM, Wolde-Tsadik G, Ershoff DH, Fishman LK, Ambrosini VL, et al. A randomised trial of comprehensive geriatric assessment in the care of hospitalised patients. New England Journal of Medicine 1995;332:1345–50.
- 31 - Rubenstein LZ, Josephson KR, Harker JO, Miller DK, Wieland DG. The Sepulveda GEU Study revisited: longterm outcomes, use of services, and costs. Ageing Clinical & Experimental Research 1995;7:212–7. MEDLINE: 936
- 32 - Rubenstein LZ, Josephson KR, Wieland DG, English PA, Sayre JA, Kane RL. Effectiveness of a geriatric evaluation unit. New England Journal of Medicine 1984;311:1664–70. MEDLINE: 935.
- 33 - Saltvedt I, Jordhoy M, Opdahl Mo ES, Fayers P, Kaasa S, Sletvold O, et al. Randomised trial of in-hospital geriatric intervention: impact on function and morale (Sletvold O). Gerontology 2006;52:223–30.
- 34 - Shamian J, Clarfield AM, Maclean J. A randomized trial of intra-hospital relocation of geriatric patients in a tertiarycare teaching hospital. Journal of the American Geriatrics Society 1984;32:794–800. MEDLINE: 937.
- 35 - Shyu YI, Liang J, Tseng MY, Li HJ, Wu CC, Cheng HS, Chou SW, Chen CY, Yang CT. Enhanced interdisciplinary care improves self-care ability and decreases emergency department visits for older Taiwanese patients over 2 years after hip-fracture surgery: A randomised controlled trial. Int J Nurs Stud. 2016. Apr;56:54-62. doi: 10.1016/j.ijnurstu.2015.12.005. Epub 2015 Dec 21. PubMed PMID: 26742606.
- 36 - Sattar S, Alibhai SMH, Brennenstuhl S, Kulik M, MacDonald ME, McWatters K, Lee K, Jang R, Amir E, Krzyzanowska MK, Joshua AM, Monette J, Wan-Chow-Wah D, Puts MTE. Health status, emergency department visits, and oncologists' feedback: An analysis of secondary endpoints from a randomized phase II geriatric assessment trial. J Geriatr Oncol. 2019 Jan;10(1):169-174. doi: 10.1016/j.jgo.2018.06.014. Epub 2018 Jul 21. PubMed PMID: 30041978.
- 37 - Somme D, Andrieux N, Guerot E, Lahjibi-Paulet H, Lazarovici C, Gisselbrecht M, et al. Loss of autonomy among elderly patients after a stay in a medical intensive care unit (ICU): a randomised study of the benefit of transfer to a geriatric ward. Archives of Gerontology and Geriatrics 2010; 50:e36–e40.
- 38 - Stenvall M, Berggren M, Lundström M, Gustafson Y, Olofsson B. A multidisciplinary intervention program improved the outcome after hip fracture for people with dementia--subgroup analyses of a randomized controlled trial. Archives of Gerontology and Geriatrics 2012;54(3): e284–9.
- 39 - Thomas DR, Brahan R, Haywood BP. Inpatient community-based geriatric assessment reduces subsequent mortality. Journal of the American Geriatrics Society 1993; 41:101–4.
- 40 - VidánM, Serra JA,Moreno C, Riquelme G, Ortiz J. Efficacy of a comprehensive geriatric intervention in older patients hospitalized for hip fracture: A randomized, controlled trial. Journal of the American Geriatrics Society 2005;53(9): 1476–82. (DOI: 10.1111/j.1532-5415.2005.53466.x.
- 41 - Wald HL, Glasheen JJ, Guerrasio J, Youngwerth JM, Cumbler EU. Evaluation of a hospitalist-run acute care for the elderly service. Journal of Hospital Medicine 2011;6(6): 313–21.
- 42 - Watne LO, Torbergsen AC, Conroy S, Engedal K, Frihagen F, Hjorthaug GA, Juliebo V, Raeder J, Saltvedt I, Skovlund E, Wyller TB. The effect of a pre- and postoperative orthogeriatric service on cognitive function in patients with hip fracture: randomized controlled trial (Oslo Orthogeriatric Trial). BMC Med. 2014 Apr 15;12:63. doi: 10.1186/1741-7015-12-63. PubMed PMID: 24735588; PubMed Central PMCID: PMC4022270.
- 43 - White SJ, Powers JS, Knight JR, Harrell D, Varnell L, Vaughn C, et al. Effectiveness of an inpatient geriatric service in a university hospital. Journal of the Tennessee Medical Association 1994;87:425–8.
- 44 - Winograd CH, Gerety MB, Lai NA. A negative trial of inpatient geriatric consultation. Archives of Internal Medicine 1993;153:2017–23.
- 45 - Zintchouk D, Gregersen M, Lauritzen T, Damsgaard EM. Geriatrician-performed comprehensive geriatric care in older adults referred to an outpatient community rehabilitation unit: A randomized controlled trial. Eur J Intern Med. 2018 May;51:18-24. doi: 10.1016/j.ejim.2018.01.022. Epub 2018 Feb 1. PubMed PMID: 29395938.
Evidence tabellen
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
1st author, year of publication
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs / cohort / case-control studies]
Literature search up to [month/year]
A: Applegate,1980 B: Asplund, 2000 C: Barnes, 2012 D: Boustani, 2012 E: Cohen, 2002 GEMC F: Cohen 2002 UCOP G: Collard, 1985 H: Corre, 2016 I: Counsell, 2000 J: Edmans, 2013 K: Eckerstad, 2016 L: Ekdahl, 2016 M: Goldberg, 2013 N: Germain, 1995 O: Fretwell, 1990 P: Hempenius, 2016 Q: Hempsall, 1990 R: Hogan, 1987 S: E: Kay, 1992 T: Kennie, 1988 U: Kircher, 2007 V: Landefeld, 1995 W: Lundqvist, 2018 X: Mazya, 2019 Y: Nikolaus, 1999 Z: McVey, 1989 A1: Naglie, 2002 B1: Naughton, 1994 C1: Ommundsen 2018 D1: Pitakala, 2006 E1: Prestmo, 2015 F1: Winograd, 1993 G1: Rubenstein, 1984 H1: Saltvedt, 2002 I1: Sattar, 2018 J1: Shyu, 2005 K1: Somme, 2010 L1: Stenvall, 2007 M1: Swanson, 1998 N1: Watne, 2014 O1: Wald, 2011 P1: White, 1994 Q1: Zintchouk, 2018 R1: Nikolauss, 1999 plus ESD S1: Saltvedt, 2004
.....
Study design: RCT [parallel / cross-over], cohort [prospective / retrospective], case-control
Setting and Country:
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship]
|
Inclusion criteria SR: A:> 65 years of age; at risk for nursing home placement and/or functional Impairment
B: patients over 70 admitted acutely
C: patients ≥ 70 years of age admitted to general medical service
D: > 65 years of age; screening for cognitive impairment; hospitalised; English speaking
E: age ≥ 65; hospitalised on a medical ward; expected length of stay >2 days; frailty (presence of stroke, history of falls, inability to perform ADLs, prolonged bed rest, incontinence)
F: age ≥ 65; hospitalised on a medical ward; expected length of stay > 2 days; frailty (presence of stroke, history of falls, inability to perform ADLs, prolonged bed rest, incontinence)
G: > 65 years of age; under the care of a participating physician; medical or surgical admissions
I: community-dwelling persons ≥ 70 years of age admitted to medical or family practice service
J: patient discharged from an acute medical unit within 72 hours of attending hospital; ≥ 70 years of age; identified as at heightened risk for future health problems (score ≥ 2/6 on the identification of seniors at risk tool)
M:emergencymedical admissions; > 65 years of age; identified by physicians as “confused”
O: > 75 years of age; physician given consent; did not require CCU or ICU
P: Aged over 65 years, elective surgery for a solid tumour andGroningen Frailty Indicator > 3
Q: Fractured neck of femur aged over 65 years.
R:emergencymedical admissions; > 65 years of age; identified by physicians as “confused”
S: > 70 years of age; medically stable; possible acute confusion; functional impairment; multiple geriatric problems
T: Women aged 65 years and over with proximal femur fracture.
U: > 65 years of age with evidence of functional impairment; potential breakdown of the home situation
V: patients ≥ 70 years of age admitted for general medical care
Y: elderly patients (> 65 years) with multiple chronic conditions or functional deterioration; at risk of nursing home placement
Z: patients ≥ 75 years of age
A1: Aged at least 70 years, surgical repair of hip fracture.
B1: patients 70 years of age admitted from ED to medicine service; did not regularly receive care from attending internist on staff at study hospital at time of admission
E1: Hip fractures, home-dwelling people, aged 70 years or older who had been able to walk 10 m before the fracture
G1: patients > 65 years of age still in hospital 1 week after admission with persistent medical, functional, or psychosocial problem
H1: frail patients > 75 years of age with acute impairment of ADL, imbalance, dizziness, impaired mobility, chronic disability, weight loss, falls, confusion, depression, malnutrition, vision or hearing impairment, mild or moderate dementia, urinary incontinence, social or family problems, polypharmacy
K1: patients ≥ 75 years; scheduled for transfer from ICU
L1: Femoral neck fracture, aged ≥ 70 years.
O1: patients ≥ 70 years of age; admitted to Anschutz Inpatient Pavilion (AIP) of University Colorado Hospital (UCH)
P1: patients ≥ 70 years of age; admitted to Anschutz Inpatient Pavilion (AIP) of University Colorado Hospital (UCH)
R1: elderly patients (> 65 years) with multiple chronic conditions or functional deterioration; at risk of nursing home placement
Exclusion criteria A: unstable medical conditions; short-term monitoring required; survival < 6months; serious chronicmental impairment; nursing home placement inevitable
B: patients requiring specialist unit (ICU, CCU, stroke)
C: admitted to intensive care units/other speciality units, electively; length of stay < 2 days
D: no cognitive impairment; non-English speaking; aphasic; non-responsive
E: admission from nursing home; terminal illness
F: admission from nursing home; terminal illness
G: none given.
I: transferred from other hospital or nursing home; required speciality unit admission; elective admissions; LOS < 2 days
J: not a resident in the hospital catchment area; lackingmental capacity to give informed consent and without a consultee any exceptional reason cited by acute medical unit staff why patients should not be recruited; participation in other related studies
M: patients with clinical need for another specialist service (such as critical care, surgery, or stroke unit)
O: none given.
P: Groningen Frailty Indicator ≤ 3, unable to complete the study protocol and follow-up schedule, unable to fill in the questionnaires used in this study
Q: No exclusion criteria were reported
R: ICU; stroke; permission refused by patient or attending physician
S: medically unstable; chronic cognitive impairment; independent
T: Died before becoming fit enough to enter the trial, pathological fractures, likely to be discharged within seven days of entering the trial, patient would return to nursing home after operation for further rehab, unfit for transfer
U: nursing home patients; independent patients with no functional impairment; terminal condition; severe dementia; not able to speak German; living > 60 miles from the hospital
V: patients admitted to a speciality unit - ICU, cardiology, telemetry, oncology
Z: admitted to ICU; had previously received geriatric care; expected length of stay < 48 hours
A1: Fracture occurring in an acute care hospital, pathologic fracture, multiple trauma, previous surgery on the fractured hip, expected survival fewer than 6 months, residence in a nursing home and dependence on at least one person for ambulation before the fracture, or residence outside metropolitan Toronto
B1: admission to ITU; transferred to a surgical service
E1: Pathological fractures, multiple traumas, short life expectancy, who were living permanently in nursing homes or already participating in the investigation Pretreatment: Baseline characteristics did not differ between the groups (table 2)
G1: severe dementia or disabling disease resistant to furthermedicalmanagement; no social supports; functioning well and would definitely return to community
H1: nursing home patients; fully independent; cancer with metastasis; severe dementia
K1: residence more than 50 km from hospital; language or cognitive disorders ruling out informed consent; transfer to ICU from an acute ward (preventing randomisation after ICUstay); need for highly specialised treatments (i.e. cardiac surgery, neurosurgery, and invasive cardiac examinations)
L1: Severe rheumatoid arthritis, severe hip osteoarthritis, pathological fracture, severe kidney failure, bedridden before the fracture
O1: patients admitted to a medicine subspeciality service (such as cardiology, pulmonary, or oncology); transferred to or from the Hospital-ACE or control services to another service (e.g. intensive care unit, orthopaedic surgery service)
P1: not explicitly stated
R1: terminal illness; severe dementia; patients who lived > 15 km away
studies included
|
Describe intervention:
A: Team members: specialist nurse, ward nurses, social workers, physiotherapists, occupational therapists, dieticians, speech and language pathologists, audiologists, psychologists
B: Team members: senior geriatrician, ward nurses, social workers, physiotherapists, occupational therapists, dieticians
C: Intervention team members: attending geriatrician, trained nursing, social workers, physiotherapists
D: Intervention teammembers: attending geriatrician, trained nurses, socialworkers, physiotherapists, occupational therapists, pharmacists
E: Team members: senior geriatrician, specialist nurse, social workers, physiotherapists, occupational therapists, dieticians, pharmacists
F: Team members: senior geriatrician, specialist nurse, social workers, physiotherapists, occupational therapists, dieticians, pharmacists
G: Team members: ward nurses, social workers, senior physician, physiotherapist, occupational therapist
I: Team members: senior geriatrician, specialist nurse, ward nurses, social workers, physiotherapists
J: Intervention team members: attending geriatrician
M: Intervention team members: attending geriatrician, trained nurses, physiotherapists, occupational therapists, speech and language therapists
O: Team members: specialist nurses, ward nurses, senior geriatrician, pharmacist, physiotherapist, dietician, social worker Team organisation: at least weekly
P: Geriatric care • Intervention: “The geriatric team was supervised by a geriatrician, and helped devise the individual care plan. The preoperative comprehensive geriatric assessment by a geriatrician consisted of a medical history, physical examination and follow-up examinations on indication.” “An individual treatment plan was drawn up paying specific attention to patient-related risk factors for delirium, namely, cognitive impairment, visual impairment, hearing impairment, malnutrition and impaired mobility. Preventive pharmacological measures were an optional but non-imperative part of the intervention protocol.” “The patients in the intervention group were assessed daily by a geriatric nurse” and if issues arose a treatment plan was developed with the treatment team.
Q: Intervention characteristics Geriatric care • Intervention: “A medical assessment was carried out between 3 and 7 days postoperatively by a senior registrar in geriatric medicine” “Patients were subsequently seen at least twice weekly and formally reviewed every 2 weeks during their inpatient stay.” Participants were transferred to the orthogeriatric unit after the acute surgical recovery. Adverse events occurring before the eighth postoperative day were not included in the analysis due to the delayed transfer to geriatric care.
R: Team members: senior geriatrician, specialist nurse, physiotherapists
S: Team members: specialist nurses, social workers, occupational therapists, physiotherapists, pharmacists, dietician
T: Geriatric care • Intervention: “Every woman aged 65 and over who had fractured the proximal femur was assessed after operation by a senior doctor in the department of geriatric medicine.” Once deemed ready for rehabilitation the intervention participants were transferred to another hospital where “a general practitioner provided their day to day medical attention, and a consultant physician in geriatric medicine attended two ward rounds and one conference of the multidisciplinary team each week.”
U: Team members: senior geriatrician, social worker, specialist nurse plus other associated healthcare professionals as required
V: Team members: attending geriatrician, trainee geriatrician, ward nurses, social workers, physiotherapists, occupational therapists, dieticians
Y: terminal illness; severe dementia; patients who lived > 15 km away
Z: Team members: senior geriatrician, trainee geriatrician, specialist nurse, social worker
A1: Geriatric care • Intervention: “The principles of care on the interdisciplinary care ward included protocols and standardized orders to try to prevent problems common in older participants with hip fracture (e.g. delirium, urinary problems, constipation, pressure sores, venous thrombosis, polypharmacy, malnutrition and depression), early mobilization (full weight-bearing and twice-daily physiotherapy sessions Monday to Friday, whenever possible), early participation in self-care and individualized discharge planning (e.g. pre- discharge home visits, home care and additional rehabilitation in a rehabilitation facility). All nursing staff on the interdisciplinary care ward received specialized education about the care of older people with hip fracture. A physiotherapist, occupational therapist, clinical nurse specialist and social worker assigned to the ward routinely assessed all study patients within 72 hours and gave priority to these patients.” “Participants in the interdisciplinary care group received routine postoperative surgical care, as well as daily medical care by a senior internal medicine resident supervised by an internist-geriatrician.”
B1: Team members: senior geriatrician, social worker, specialist nurse, physiotherapist
E1: Geriatric care • Intervention: “The clinical pathway for comprehensive geriatric care was organised both before and after the operation as a systematic and interdisciplinary process, with an emphasis on comprehensive medical assessment and treatment, initiation of rehabilitation through mobilisation, and planning of discharge started early.” Care was provided on a dedicated geriatric care unit. Orthopedic specialists did not routinely round on participants postoperatively.
G1: Team members: senior geriatrician, trainee geriatrician, specialist nurses, ward nurses, social workers, physiotherapists, occupational therapists, dietician, audiologists, dentists, psychologists
H1: Team members: senior geriatrician, trainee geriatrician, specialist nurse, social workers, physiotherapists, occupational therapists, dentists
K1: Intervention teammembers: attending geriatrician, trained nurses, socialworkers, physiotherapists, dieticians, psychologists
L1: Geriatric care • intervention: “The intervention ward was a geriatric unit specializing in geriatric orthopaedic patients. The staff worked in teams to apply comprehensive geriatric assessments and rehabilitation. Active prevention, detection and treatment of postoperative complications, such as falls, delirium, pain, decubital ulcers, and malnutrition, were systematically implemented daily during the hospitalisation. Early mobilization, with daily training, was provided by physiotherapists, occupational therapists and care staff during the hospital stay.”
O1: Intervention team members: trained nurses, social workers, physiotherapists, occupational therapists, pharmacists
P1: Team members: senior geriatrician, geriatric nurse specialist, social worker, dietician, pharmacist, physiotherapist, occupational therapist, speech and language therapist
R1: Team members: senior geriatrician, specialist nurses, physiotherapists, occupational therapists, social workers. (Home intervention team consisted of 3 nurses, a physiotherapist, an occupational therapist, a social worker, and secretarial support.)
|
Describe control:
A: usual care provided by physicians
B: 2 internal mixed medical wards, each with 30 beds, where acutely ill patients from local hospital catchment area constituted the majority of patients
C: general inpatient unit, where younger and older patients resided together
D: patients admitted under physician care
E: Inpatients assigned to receive usual care received all appropriate hospital services except those provided by the team on the geriatric evaluation and management unit. Outpatients assigned to receive usual care were provided with at least 1 follow-up appointment in an appropriate clinic
F: Inpatients assigned to receive usual care received all appropriate hospital services except those provided by the team on the geriatric evaluation and management unit. Outpatients assigned to receive usual care were provided with at least 1 follow-up appointment in an appropriate clinic
G: care on one of the traditional medical/surgical units
I: usual care units with attending resident physician
J: usual care on themedical unit before recruitment; assessment and treatment by a consultant physician and attending medical team; some patients referred to multi-disciplinary team (physiotherapist, occupational therapist, and nurse); general practitioner responsible for all participant aftercare
M: 5 acute geriatricmedicalwards and 6 generalmedicalwards; practice on geriatric medical wards based on comprehensive geriatric assessment; general experience of staff members in management of delirium and dementia; mental health support provided on request from visiting psychiatrists on a consultation basis
O: usual hospital care
P: Control intervention: “Patients in the usual-care group received standard [post-operative] care, which means that additional geriatric care was only provided at the request of the treating physician.”
Q: Control intervention: Participants received standard postoperative orthopedic care before being transferred to a rehabilitation centre as needed.
R: Usual care.
S: traditional acute care
T: • Control: “The control group generally remained in the orthopaedic admission ward, a few of these participants being moved into other short stay wards at the discretion of the consultant orthopaedic surgeon.
U: appropriate hospital services except those provided by the consultation team
V: usual care provided by physicians and nurses in acute care medical units
Z: Usual care.
A1: Control • Intervention: “On the usual care ward, participants had access to allied health care professionals if a consultation was requested; they had limited access to an occupational therapist or a clinical nurse specialist.”
B1: usual care by medical house staff and an attending physician; services of social workers and discharge planners available on request
E1: Control • Intervention: Participants received standard postoperative care on an orthopaedic trauma ward and did not have routine access to a geriatrician.
G1: acute care services including 3 acute care mixed medical wards
H1: usual care on general medical ward
K1: standard ward with similar numbers of nurses and nursing assistants on each ward. An occupational therapist from the functional rehabilitation unit intervenes on demand
L1: Control • intervention: “The control ward was a specialist orthopaedic unit following conventional postoperative routines.”
O1: Control: general medical services consisting of a hospitalist, a general internist, or an internal medicine subspecialist attending physician with 1 medical resident, 1 intern, and medical students
P1: usual care group reviewed by senior nurse and geriatrician, recommendations made to the usual care team
R1: assessment of activities of daily living and cognition, followed by usual care in hospital and at home
|
End-point of follow-up:
A: 6 months and at 1 year B: Not reported C: Not reported D: Not reported E: Not reported F: Not reported G: Not reported I: Not reported J: Not reported M: Not reported O: Not reported P: Not reported Q: Not reported R: Not reported S: Not reported T: Not reported U: Not reported V: Not reported Y: Not reported Z: Not reported A1: Not reported B1: Not reported E1: Not reported F1: Not reported G1: Not reported H1: Not reported K1: Not reported L1: Not reported O1: Not reported P1: Not reported R1: Not reported
For how many participants were no complete outcome data available? (intervention/control) A: B: C: D: E: F: G: H: I: ….
|
Outcome measure-1 Effect measure: RR[95% CI]:
Zelfstandig wonen follow-up
A: RR= 1.26 [0.99; 1.61] B: RR= 1.11 [0.94, 1.30] E: RR= 1.08 [0.95, 1.24] F: RR= 1.17 [1.03, 1.33] I: RR= 0.97 [0.90, 1.05] J: RR= 1.00 [0.83, 1.21] M: RR= 1.09 [0.92, 1.30] N: RR= Not estimable U: RR= 0.93 [0.80, 1.08] V: RR= 1.11 [0.99, 1.25] Y: RR= 1.06 [0.87, 1.29] Z: RR= 1.02 [0.84, 1.24] F1: RR= 0.88 [0.60, 1.29] G1: RR= 1.52 [1.02, 2.26] H1: RR= 1.09 [0.83, 1.43] K1: RR= 1.07 [0.55, 2.07] R1: RR= 1.09 [0.89, 1.33 S1: RR= 1.23 [1.02, 1.48]
Outcome measure-2 Effect measure: RR[95% CI]:
Zelfstandig wonen bij ontslag B: RR= 1.10 [0.96, 1.26] C: RR= 0.99 [0.92, 1.07] D: RR= 1.17 [0.93, 1.48] G: RR= 1.12 [1.01, 1.24] N: RR=2.60 [1.01, 6.71] O: RR= 1.14 [0.96, 1.35] P: RR= 0.92 [0.82, 1.02] S: RR= 0.91 [0.58, 1.43] V: RR= 1.11 [1.01, 1.21] Z: RR= 0.94 [0.77, 1.15] B1: RR= 1.04 [0.84, 1.29] C1: RR= 1.19 [0.91, 1.54] F1: RR= 0.91 [0.76, 1.08] G1: RR= 1.37 [1.03, 1.81] P1: RR= 2.00 [1.03, 3.88]
Outcome measure-3 Effect measure: RR[95% CI]: Institutionalisering bij ontslag B: RR= 2.11 [0.72, 6.20] C: RR= 0.99 [0.86, 1.13] G: RR= 0.86 [0.64, 1.16] J: RR= 0.78 [0.21, 2.87] N: RR= 0.88 [0.42, 1.84] O: RR= 0.80 [0.62, 1.03] Q: RR= 0.84 [0.48, 1.48] R: RR= 1.03 [ 0.65, 1.62] S: RR= 0.97 [0.52, 1.79] T: RR= 0.31 [0.12, 0.79] V: RR= 0.64 [0.45, 0.90] Z: RR= 1.24 [0.74, 2.06] B1: RR= 0.96 [0.43, 2.14] C1: RR= 0.89 [0.21, 3.81] D1: RR= 0.82 [ 0.60, 1.13] F1: RR= 0.93 [0.51, 1.71] G1: RR= 0.40 [0.19, 0.85] M1: RR= 0.43 [0.04, 4.52] O1: RR= 0.95 [0.65, 1.41] P1: RR= 0.46 [0.22, 0.97]
Outcome measure-4 Effect measure: RR[95% CI]:
Institutionalisering op follow-up A: RR= 0.46 [0.20, 1.07] B: RR= 0.81 [0.38, 1.70] E: RR= 0.76 [0.58, 1.01] F: RR= 0.67 [0.50, 0.90] I: RR= 0.92 [0.64, 1.33] J: RR= 1.27 [0.35, 4.66] L: RR= 0.78 [0.50, 1.24] M: RR= 0.72 [0.51, 1.00] U: RR= 1.38 [0.75, 2.51] V: RR= 0.74 [0.56, 0.97] Y: RR= 0.87 [0.54, 1.40] Z: RR= 1.70 [0.70, 4.12] A1: RR= 0.90 [0.53, 1.53] E1: RR= 0.69 [0.45, 1.06] G1: RR= 1.38 [0.64, 2.98] H1: RR= 1.00 [0.52, 1.91] L1: RR= 1.05 [0.80, 1.37] N1: RR= 0.86 [0.47, 1.59] R1: RR= 0.73 [0.44, 1.19]
Outcome measure-5 Effect measure: RR[95% CI]:
Afhankelijkheid ADL-activiteiten B: RR= 1.10 [0.78, 1.56] G: RR= 1.06 [0.88, 1.28] I: RR= 0.89 [0.77, 1.04] J: RR= 0.94 [0.74, 1.20] O: RR= 1.28 [0.94, 1.76] P: RR= 0.97 [0.85, 1.12] T: RR= 0.32 [0.14, 0.73] Y: RR= 0.83 [0.39, 1.76] A1: RR= 0.94 [0.55, 1.60] G1: RR= 1.75 [0.69, 4.42] H1: RR= 0.96 [0.63, 1.45] K1: RR= 0.77 [0.20, 3.03] R1: RR= 0.96 [0.45, 2.07]
Outcome measure-6 Effect measure: RR[95% CI]:
Valincidenten J: RR= 1.04 [0.80, 1.35] M: RR= 1.52 [0.90, 2.58] P: RR= 2.09 [0.39, 11.24] N1: RR= 1.30 [0.61, 2.77]
Outcome measure-7 Effect measure: RR[95% CI]:
Delier tijdens opname
D: RR= 1.12 [0.75, 1.69] P: RR= 0.63 [0.29, 1.35] N1: RR= 0.90 [0.58, 1.38] O1: RR= 1.83 [0.94, 3.58]
Outcome measure-8 Effect measure: RR[95% CI]:
Cognitief functioneren B: RR= 0.31 [0.10, 0.51] M: RR= 0.05 [-0.17, 0.26] U: RR= -0.22 [-0.46, 0.01] F1: RR= 0.35 [0.07, 0.63]
Outcome measure-10 Effect measure: RR[95% CI]:
Mortaliteit gedurende opname
B: RR= 1.56 [0.55, 4.43] C: RR= 1.34 [0.83, 2.16] G: RR= 0.45 [0.21, 0.94] H: RR= 0.94 [0.59, 1.49] K: RR= 0.78 [0.32, 1.95] N: RR= 0.44 [0.04, 4.56] P: RR= 0.35 [0.11, 1.10] R: RR= 1.00 [0.45, 2.24] S: RR= 4.84 [0.24, 96.66] V: RR= 0.99 [0.57, 1.71] Z: RR= 0.87 [0.33, 2.29] B1: RR= 0.71 [0.18, 2.81] F1: RR= 2.31 [0.93, 5.77] G1: RR= 0.95 [0.41, 2.24] H1: RR= 0.47 [0.21, 1.05] M1: RR= 0.87 [0.13, 5.83] N1: RR= 2.04 [0.52, 8.01] O1: RR= 2.34 [0.10, 56.84] P1: RR= not estimable
Outcome measure-11 Effect measure: RR[95% CI]:
Mortaliteit bij follow-up A: RR= 0.49 [0.22, 1.09] B: RR= 1.45 [0.79, 2.67] D: RR= 1.04 [0.49, 2.23] E: RR= 1.08 [0.82, 1.43] I: RR= 1.08 [0.92, 1.25] J: RR= 1.17 [0.55, 2.48] K: RR= 0.74 [0.46, 1.16] M: RR= 0.90 [0.67, 1.20] N: RR= 0.68 [0.38, 1.22] U: RR= 1.16 [0.68, 1.97] V: RR= 1.04 [0.69, 1.56] Y: RR= 0.97 [0.56, 1.69] Z: RR= 0.73 [0.42, 1.28] A1: RR= 0.79 [0.44, 1.44] D1: RR= 1.15 [0.75, 1.78] E1: RR= 0.79 [0.51, 1.22] F1: RR= 1.16 [0.81, 1.65] G1: RR= 0.49 [0.29, 0.82] H1: RR= 0.81 [0.56, 1.18] K1: RR= 0.88 [0.48, 1.59] L1: RR= 0.66 [0.29, 1.47] R1: RR= 1.05 [0.61, 1.80]
Outcome measure-12 Effect measure: RR[95% CI]:
Duur ziekenhuisopname
B: RR= -1.40 [-2.50, -0.30] D: RR= 0.90 [-0.35, 2.15] E: RR= 9.00 [5.38, 12.62] F: RR= 7.50 [3.65, 11.35] J: RR= -0.22 [-1.03, 0.60] M: RR= 0.48 [-2.35, 3.31] Q: RR= -12.80 [-24.25, -1.35] R: RR= 1.60 [-3.20, 6.40] Y: RR= -2.00 [-7.46, 3.46] Z: RR= 3.60 [-2.73, 9.93] A1: RR= 8.30 [3.34, 13.17] B1: RR= -1.60 [-3.93, 0.73] C1: RR= 0.00 [-2.46, 2.46] E1: RR= 1.60 [0.23, 2.97] F1: RR= -1.90 [-9.74, 5.94] H1: RR= 8.09 [3.84, 12.33] K1: RR= -23.60 [-62.99, 15.79] M1: RR= -11.50 [-20.27, -2.73] O1: RR= 0.30 [-0.42, 1.02] R1: RR= -9.20 [-14.40, -4.00]
Outcome measure-13 Effect measure: RR[95% CI]:
Heropname in het ziekenhuis
B: RR= 1.19 [0.89, 1.60] C: RR= 0.96 [0.72, 1.27] D: 1.13 [0.75, 1.71 I: RR= 1.16 [0.95, 1.43] J: RR= 1.03 [0.78, 1.35] K: RR= 0.81 [0.64, 1.04] M: RR= 0.92 [0.73, 1.15] N: RR= 1.06 [0.68, 1.66] P: RR= 1.25 [0.74, 2.09] R: RR= 0.81 [0.54, 1.20] U: RR= 1.11 [0.89, 1.39] V: RR= 0.95 [0.76, 1.18] Y: RR= 1.01 [0.72, 1.41] C1: RR= 2.38 [0.76, 7.46] E1: RR= 0.81 [0.60, 1.09] G1: RR= 0.70 [0.46, 1.06] H1: RR= 1.10 [0.78, 1.54] L1: RR= 1.15 [0.80, 1.65] N1: RR= 0.94 [0.63, 1.40] O1: RR= 1.30 [0.59, 2.84] P1: RR= 0.57 [0.20, 1.65] Q1: RR= 1.08 [0.93, 1.25] R1: RR= 0.94 [0.66, 1.33]
|
Facultative:
Brief description of author’s conclusion
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Risk of Bias
|
Study
First author, year |
Appropriate and clearly focused question?1 Yes/no/unclear |
Comprehensive and systematic literature search?2 Yes/no/unclear |
Description of included and excluded studies?3 Yes/no/unclear |
Description of relevant characteristics of included studies?4 Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
|
Assessment of scientific quality of included studies?6 Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7 Yes/no/unclear |
Potential risk of publication bias taken into account?8 Yes/no/unclear |
Potential conflicts of interest reported?9 Yes/no/unclear |
|
Ellis, 2017 |
Yes |
Yes |
Yes |
Yes |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
|
Eamer, 2018 |
Yes |
Yes |
Yes |
No |
Not applicable |
Yes |
Yes |
Yes |
Unclear |
Table of quality assessment for systematic reviews of RCTs and observational studiesBased on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 24-11-2021
Beoordeeld op geldigheid :
Algemene gegevens
Voor het beoordelen van de actualiteit van deze richtlijn wordt de werkgroep niet in stand gehouden. Uiterlijk in 2024 bepaalt het bestuur van de Nederlandse Vereniging voor Klinische Geriatrie (NVKG) of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De NVKG is regiehouder van deze richtlijnmodules en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de modules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
De richtlijn is ontwikkeld in samenwerking met:
- Verpleegkundigen & Verzorgenden Nederland
- Patiëntenfederatie NL
Doel en doelgroep
Doel
Het doel van deze richtlijn is verantwoording en optimalisering/ kwaliteitsverbetering van het specialistisch geriatrisch onderzoek. Er is nieuwe literatuur beschikbaar, waardoor een herziening gerechtvaardigd is. Daarnaast is er sinds het opleveren van de richtlijn in 2010 op het gebied van patiënten inbreng bij richtlijnen veel veranderd. De gezamenlijke besluitvorming (shared decision making) heeft een belangrijke plaats ingenomen in het zorgproces en is een belangrijk onderdeel van het CGA. Daarom zal in dit herzieningstraject een module worden ontwikkeld over Gezamenlijke besluitvorming binnen het CGA.
Doelgroep
Deze richtlijn is in eerste instantie bestemd voor klinisch geriaters en internisten ouderengeneeskunde in de tweede lijn. Ook voor verpleegkundig specialisten, geriatrie verpleegkundigen en paramedici die samenwerken met klinisch geriaters of internisten ouderengeneeskunde bevat deze richtlijn relevante informatie. Daarnaast is deze richtlijn geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten waarbij het geriatrisch/ouderengeneeskundig team in medebehandeling is gevraagd. Tevens zal de mogelijkheid worden beschreven voor medisch specialisten niet gespecialiseerd in de ouderengeneeskunde om elementen van het CGA uit te voeren om inzicht krijgen in de mogelijke kwetsbaarheden zodat de patiënt de meest optimale en gepaste zorg krijgt.
Samenstelling werkgroep
Voor het herzien van deze richtlijn is in 2018 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij het CGA. De werkgroep leden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- drs. M. Hartgerink, klinisch geriater, werkzaam in het Wilhelmina Ziekenhuis, Assen, NVKG (voorzitter)
- drs. E.J. Huinink-Broeshart, klinisch geriater, werkzaam in het Medisch Centrum Leeuwarden, Leeuwarden, NVKG
- drs. A.C. van der Meer, klinisch geriater, werkzaam in het Groene Hart Ziekenhuis, Gouda, NVKG
- drs. F.M.M. Oud, AIOS en promovendus klinische geriatrie, werkzaam bij Cluster midden en Gelre ziekenhuis Apeldoorn & Zutphen en UMC Groningen NVKG
- dr. T.R. Ruiter, internist-ouderengeneeskunde & klinisch farmacoloog, werkzaam in het Maassstad Ziekenhuis, Rotterdam, NIV
- drs. G. Labots, internist-ouderengeneeskunde, werkzaam in het HagaZiekenhuis, Den Haag, NIV
- R.M.J. Warnier MANP., verpleegkundig specialist AGZ, afd. ouderengeneeskunde, Maastricht UMC+, Maastricht, V&VN (tot december 2018)
- drs. H.P.J.M. Habets, verplegingswetenschapper & seniordocent, werkzaam in het Zuyderland MC, Sittard-Geleen, V&VN (vanaf januari 2019)
- R. Lammers MSc., patiëntvertegenwoordiger, PFNL
Klankbordgroep
- dr. N.S.M Schoonenboom, neuroloog, Spaarnegasthuis, NVN
- drs. M.A. Sluman, cardioloog, Jeroen Bosch Ziekenhuis, NVVC
- dr. A.M.J.S. Vervest, orthopedisch chirurg, Tergooi, NOV
- drs. M. Bezemer, specialist ouderengeneeskunde, Zorgspectrum, Verenso
- dr. I. Groeneweg-Koolhoven, psychiater ouderenpsychiatrie, Bavo Europoort (onderdeel van Parnassia Groep), NVvP
Met ondersteuning van
- dr. W.J. Harmsen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht.
- A.A. Lamberts MSc., senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten, Utrecht.
Belangenverklaringen
De KNMG-Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling” is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatie management, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaand tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Achternaam werkgroeplid |
Hoofdfunctie |
Nevenwerkzaamheden |
Gemelde belangen |
Ondernomen acties |
|
Warnier |
Verpleegkundig Specialist Ouderengeneeskunde MUMC+ |
- Promovendus MUMC "Opsporen van kwetsbare ouderen |
geen |
geen |
|
Habets |
Verplegingswetenschapper & seniordocent, werkzaam in het Zuyderland MC, Sittard-Geleen |
- Senior lecturer Hogeschool Zuyd |
geen |
geen |
|
Huinink |
- Klinisch geriater Medisch Centrum Leewarden |
geen |
geen |
nee |
|
Ruiter |
- Internist-ouderengeneeskunde & klinisch farmacoloog, Maasstad Ziekenhuis, Rotterdam |
- Postdoctoraal wetenschappelijk onderzoeker afdeling Epidemiologie, Erasmus MC |
geen |
geen |
|
Oud |
- AIOS Klinische Geriatrie |
Bestuurslid opleiding, onderwijs en wetenschap, Nederlandse Vereniging voor Geriatrie Junior (onbetaald) |
geen |
geen |
|
Meer, van der |
Klinisch geriater, Groene Hart Ziekenhuis te Gouda |
geen |
geen |
geen |
|
Hartgerink |
Klinisch geriater Wilhelmina Ziekenhuis, Assen |
- |
geen |
geen |
|
Labots |
- Internist-ouderengeneeskunde, HagaZiekenhuis, Den Haag |
nvt |
geen |
nvt |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door de Patiëntenfederatie te vragen om input te leveren tijdens de schriftelijke knelpuntenanalyse. De conceptmodules zijn tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden in de bijlagen.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (Nederlandse Vereniging voor Klinische Geriatrie, 2012), op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen via een schriftelijke knelpunteninventarisatie. Een rapportage hiervan kan worden aangevraagd via de Richtlijnendatabase. De werkgroep prioriteerde de knelpunten vervolgens en stelde het raamwerk vast.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur conceptuitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de kritieke uitkomstmaten welke verschillen zij klinisch relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; ACROBAT-NRS - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de modules is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers MC, Kho ME, Browman GP, et al. AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann HJ, Oxman AD, Brozek J, et al. Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ. 2008;336(7653):1106-10. doi: 10.1136/bmj.39500.677199.AE. Erratum in: BMJ. 2008;336(7654). doi: 10.1136/bmj.a139. PubMed PMID: 18483053.
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
