Acute presentatie coloncarcinoom
Uitgangsvraag
Deze module omvat de volgende deelvragen:
- Wat is de optimale behandeling van een coloncarcinoom met perforatie, en hangt dit af van de oorzaak en lokalisatie van de perforatie?
- Wat is de optimale behandeling van een klinisch manifeste bloeding (acute Hb daling, hemodynamische instabiliteit) vanuit een coloncarcinoom?
- Wat is de optimale behandeling van een peritumoraal abces?
- Wat is de definitie van een (sub)acute obstructie?
- Wat zijn de indicaties voor een acute resectie of overbruggingsstrategie (stent of stoma) bij een acute obstructie door een linkszijdig coloncarcinoom, en is dit afhankelijk van het operatief risico van de patiënt (leeftijd, ASA, klinische conditie), tumor lengte, cT stadium, behandelintentie (curatief versus palliatief), en beschikbare expertise in het ziekenhuis van presentatie?
- Wat zijn de indicaties voor een acute resectie of overbruggingsstrategie (stent of stoma) bij een acute obstructie door een rechtszijdig coloncarcinoom, en is dit afhankelijk van het operatief risico van de patiënt (leeftijd, ASA, klinische conditie), tumor lengte, cT stadium, behandelintentie (curatief versus palliatief), en beschikbare expertise in het ziekenhuis van presentatie?
- Welk type overbruggingsstrategie heeft de voorkeur, stent of stoma, en welke factoren kunnen bepalend zijn voor de keuze?
- Welk type stoma heeft de voorkeur bij een acute linkszijdige obstructie?
- Wat is de optimale duur van het overbruggingsinterval tot electieve resectie, en verschilt dit tussen stent en stoma?
Aanbeveling
Stel de diagnose (sub)acute obstructie op basis van de kliniek en beeldvorming, en niet op basis van endoscopie.
Bepaal bij acute presentatie van een coloncarcinoom de behandelintentie en bespreek de mogelijke behandelopties in een proces van gedeelde besluitvorming. Overweeg bij zeer kwetsbare patiënten de optie om af te zien van invasieve interventies.
Doe een resectie voor een coloncarcinoom vanwege perforatie, bloeding, peritumoraal abces of obstructie volgens oncologische principes.
Overweeg bij bloeding of peritumoraal abces een overbrugging naar electieve resectie met respectievelijk coiling of percutane drainage.
Overweeg bij acute resectie een primaire anastomose, eventueel met deviërend stoma.
Verricht in de acute setting alleen een subtotale colectomie wanneer dit strikt nodig is, zoals bij een beschadigd colon.
Overweeg bij patiënten onder de 70 jaar met een curatief te behandelen linkszijdig obstructief, niet lokaal gevorderd coloncarcinoom een overbrugging naar electieve resectie (stent of stoma) als alternatief voor een acute resectie.
Kies bij patiënten boven de 70 jaar met een curatief te behandelen linkszijdig obstructief coloncarcinoom voor een overbrugging naar electieve resectie (stent of stoma).
Overweeg bij patiënten met een curatief te behandelen rechtszijdig obstructief coloncarcinoom een overbrugging naar electieve resectie (stent of stoma) als alternatief voor een acute resectie.
Neem in de keuze voor de verschillende behandelopties in de curatieve setting de conditie en wensen van de patient en technische geschiktheid en expertise ten aanzien van stenting mee in de overwegingen.
Beschouw in een curatieve setting een stoma als overbrugging naar electieve resectie als eerste keus behandeling wanneer er sprake is van een cT4 obstructief coloncarcinoom die in aanmerking komt voor inductie systemische therapie en/of een uitgebreide Multi viscerale resectie.
Kies als palliatieve behandeling van een obstructief coloncarcinoom voor een stent indien dit technisch mogelijk is en expertise beschikbaar, en leg anders een decomprimerend stoma aan.
Voer na een succesvolle stent de resectie uit na ongeveer 2 weken, en houdt na een decomprimerend stoma een overbruggingsinterval van 2 tot 4 weken aan.
Overwegingen
Over behandeling van coloncarcinoom met perforatie, acute bloeding of een peritumoraal abces bestaat nauwelijks literatuur om aanbevelingen mee te kunnen onderbouwen. Segmentresectie volgens oncologische principes is de basis van de behandeling, ook indien de resectie acuut moet worden uitgevoerd. Bij goede patiëntselectie en chirurgische expertise lijkt een anastomose met of zonder deviërend stoma in de spoed setting veilig, en lijkt daarmee de kans op een permanent stoma te worden verkleind.
Een peritumoraal abces wordt vaak beschouwd als bewijs voor tumorperforatie, en daarmee zou het een cT4 stadium kunnen zijn. Histopathologische analyse van het invasieve front laat echter zien dat dit zeker niet altijd het geval is, en een peritumoraal abces eenzelfde prognose heeft als een pT3 tumor, zelfs als tumorcellen in het aangrenzende weefsel worden gevonden (Kim, 2019). Daarmee lijkt percutane drainage een goede optie als voorbereiding op een oncologische resectie, waarbij het risico op entmetastasering mogelijk beperkt is.
Een subacute obstructie reageert op conservatieve behandeling (laxantia) en volgens de ESGE 2020 richtlijn moeten deze patiënten ook niet beschouwd worden als kandidaat voor een colonstent. Een endoscopisch stenoserende tumor zonder klachten dient überhaupt niet geclassificeerd te worden als een obstructie. Een acute obstructie is daarentegen een gecombineerd klinisch en radiologische diagnose.
Behandeling van obstructief coloncarcinoom is complex en afhankelijk van verschillende factoren. Bij patiënten onder de 70 jaar kan een acute resectie nog steeds worden overwogen, met een overbrugging met stent of stoma als alternatief. Bij deze besluitvorming spelen het chirurgisch risico van de patiënt (hoge ASA, comorbiditeit), geschiktheid voor en expertise in stenting, voorkeuren van de patiënt, aantal interventies, en complexiteit van de chirurgie (eerdere laparotomie(n)) een rol. Hoewel in het algemeen een afkapwaarde voor leeftijd arbitrair is, kwam in de analyses van de Nederlandse data over dit onderwerp de leeftijdsgrens van 70 jaar wel duidelijk naar voren.
Bij palliatieve behandeling is een stent eerste keus indien dit technisch mogelijk is en ook expertise beschikbaar. Dat geeft een betere kwaliteit van leven dan een stoma, en chemotherapie kan veilig gegeven worden na plaatsing van een stent. In de meest recente ESGE guideline is zelfs aangegeven dat het starten van bevacizumab na plaatsing van een stent niet meer strikt gecontra-indiceerd is. Het plaatsen van een stent onder behandeling met bevacizumab wordt wel afgeraden gezien de kans op perforatie. Late complicaties van een palliatieve stent zijn migratie en obstructie, maar die kunnen relatief eenvoudig met opnieuw een endoscopische interventie worden behandeld.
Bij het niet lokaal gevorderd obstructief coloncarcinoom is er steeds meer bewijs voor de voordelen van een overbrugging naar electieve resectie, en wordt bij patiënten >70 jaar een acute resectie ontraden gezien de hoge kans op mortaliteit. Bepalend voor de keuze voor een stent of decomprimerend stoma als overbrugging zijn onder andere geschiktheid van de tumor voor stent, beschikbare expertise in stenting, kans op stentperforatie, concurrerende doodsoorzaken, en patiënt-preferenties ten aanzien van een stoma. Daarnaast kan een eventueel besluit tot inductie systemische therapie een rol spelen, omdat er geen literatuur is over stenting gevolgd door systemische therapie in de curatieve setting; een decomprimerend stoma is dan eerste keus.
Van het decomprimerend colostoma is nu voor het eerst een overlevingsvoordeel aangetoond ten opzichte van acute resectie in een groot Nederlands snapshot onderzoek (Veld, 2020). Ook wordt steeds vaker gekozen om dit stoma ten tijde van de resectie al op te heffen, zodat geen 3-stage procedure nodig is. Een stent is oncologisch veilig gebleken voor de groep als geheel, ondanks dat het kleine aantal patiënten dat een stentgerelateerde perforatie krijgt een slechtere oncologische uitkomst heeft. Het grote voordeel van een stent is de ongeveer 70% kans dat er in het hele behandeltraject geen stoma hoeft te worden geplaatst. Bij minder fitte patiënten waarbij ook de kans klein is dat een stoma later nog zal worden opgeheven is een stent dus een goede optie als dit technisch haalbaar is en expertise beschikbaar. Bovengenoemde is uitvoerig onderzocht voor linkszijdige obstructies, maar het lijkt dat dezelfde behandelprincipes gelden voor rechtszijdige obstructies.
Voor het lokaal gevorderd obstructief coloncarcinoom lijkt een decomprimerend stoma een goede keuze. Dit maakt het mogelijk om eventueel inductiebehandeling met chemotherapie te geven, en kan een Multi viscerale resectie door een optimaal team electief worden gepland.
Bij zeer kwetsbare patiënten zou ook van elke vorm van invasieve interventie kunnen worden afgezien bij een acute presentatie van een coloncarcinoom. Niet alleen als er eerder is gekozen om niets te doen, maar ook bij comorbiditeit en zeker een (neuro) degeneratieve aandoening waarvan de prognose en verlies van kwaliteit van leven op functioneel en sociaal domein goed te benoemen en bespreken zijn in de gezamenlijke besluitvorming.
Samenvatting van nationale data en populatiestudies
Er is een groot cross-sectioneel onderzoek gedaan in Nederland naar de chirurgische behandeling van maligne linkszijdige colonobstructie tussen 2009 en 2016 (Amelung, 2019; Veld, 2020; Veld, 2020). In de curatieve setting bij het niet gevorderd coloncarcinoom bleek een decomprimerend stoma in vergelijking met een acute resectie gepaard te gaan met lagere 90-dagen mortaliteit, en dat bleek in subgroep analyse voornamelijk bij patiënten > 70 jaar (3,5% versus 13,7%; p=0.027). Dit vertaalde zich ook in een betere 3-jaars algehele overleving (HR 0,36; 0,20 tot 0,65) en minder permanente stoma’s (23,4% versus 42,4%; p<0.001). Stenting resulteerde in vergelijking tot een acute resectie in een vergelijkbare oncologische uitkomst, maar significant minder permanente stoma’s (23,9% versus 45,3%; p<0.001), met name boven de 70 jaar (29,0% versus 57,9%; p<0.001). Het percentage stentperforaties was 7,7%, en patiënten met een stentperforatie hadden slechtere oncologische uitkomsten dan patiënten met een stent zonder perforatie, hoewel niet significant verschillend. De vergelijking tussen stent en stoma als overbruggingsstrategie toonde dat een stoma tot meer primaire anastomoses en minder majeure complicaties leidde, maar anderzijds tot meer reïnterventies (inclusief opheffen stoma), terwijl de oncologisch uitkomsten vergelijkbaar waren. Ten aanzien van het interval tussen stent en electieve resectie bleek dat een interval van 11 tot 17 dagen een goede balans geeft tussen optimalisatie van de patiënt en chirurgische condities en kans op stent gerelateerde complicaties, terwijl na een decomprimerend stoma de kans op laparoscopische resectie en primaire anastomose optimaal wordt bij een interval van 2 tot 4 weken, met de laagste ligduur (Veld, 2021). Overbruggingsinterval bleek niet geassocieerd met oncologische uitkomst.
Voor rechtszijdige maligne colonobstructies zijn populatiedata met korte termijn resultaten gepubliceerd, waarbij bleek dat in Nederland slechts een overbruggingsstrategie met een stent of stoma in elk ongeveer 2,5% werd toegepast (Amelung, 2016). In deze sterk geselecteerde subgroepen was de mortaliteit lager dan na acute resectie.
Onderbouwing
Achtergrond
Perforatie, klinisch manifeste bloeding, peritumoraal abces en obstructie zijn de acute presentatievormen van een coloncarcinoom. Standaard diagnostiek bij dergelijke presentaties is een CT abdomen, waarbij bevindingen zoals vrij lucht, vrij vocht, afgekapselde collectie, contrast extravasatie, tumor lokalisatie en lengte, doorgroei in omliggende structuren of organen, en aanwezigheid/uitgebreidheid van metastasen cruciaal zijn voor het verdere beleid. In deze module is conform de geldende definitie sprake van een coloncarcinoom indien de onderrand van de tumor boven het niveau van de sigmoid take-off ligt op beeldvorming.
Bij een vrije perforatie naar de buikholte ter hoogte van de primaire tumor met peritonitis is de algemeen geaccepteerde behandeling een acute resectie van het aangedane darmsegment, al dan niet met een stoma, hoewel in een terminale fase ook van chirurgische behandeling kan worden afgezien. Dit geldt ook voor iatrogene tumorperforaties (bijvoorbeeld door coloscopisch biopt of stent). Bij een perforatie proximaal van de tumor door blow-out wordt vaak voor een acute subtotale colectomie gekozen, maar zou ook een segmentele resectie van de perforatie met uitleiden van een dubbelloops stoma proximaal van de tumor een optie kunnen zijn. Een gedekte perforatie kan eventueel ook aanvankelijk met een deviërend stoma worden behandeld.
Bij een klinisch manifeste bloeding zijn coiling door de interventieradioloog of een acute resectie mogelijke behandelopties. Een peritumoraal abces wordt doorgaans behandeld met percutane drainage, waarbij het onduidelijk is of dit de kans op tumor spill vergroot en of de principes van een en bloc resectie moeten worden gevolgd, met radicaal meenemen van het draintraject en abceskapsel. Dit hangt samen met de vraag of een peritumoraal abces op een tumorperforatie en/of een cT4 stadium duidt.
Obstructie kan worden onderverdeeld in acute en subacute obstructie. Subacute obstructie gaat gepaard met milde symptomen, die reageren op conservatieve behandeling (laxantia) en waarbij geplande behandeling veelal mogelijk is. Een acute obstructie wordt daarentegen gekenmerkt door typische klachten (afwezige ontlasting sinds minimaal 2 dagen, verminderde intake, braken) en bevindingen bij lichamelijk onderzoek (bolle buik). Samen met een voor coloncarcinoom verdachte afwijking op CT en proximale dilatatie van de darm wordt een acute maligne colonobstructie gediagnosticeerd.
Over het obstructief coloncarcinoom is de meeste literatuur beschikbaar, maar dit is daarmee ook het meest controversiële onderwerp in deze module. Belangrijke afwegingen zijn of er sprake is van curatieve of palliatieve setting, en of het om een resectabele of lokaal gevorderd obstructief coloncarcinoom gaat. Een acute resectie kan in hoog risico groepen gepaard gaan met relatief hoge kans op morbiditeit, mortaliteit en permanent stoma. Overbrugging met een stent of decomprimerend stoma naar een electieve resectie zijn dan ook valide opties, maar over de specifieke indicatiegebieden en oncologische veiligheid van een colonstent bestaat discussie.
Samenvatting literatuur
Samenvatting van internationale richtlijnen en consensusdocumenten
In een consensus richtlijn van de World Society of Emergency Surgery (WSES) wordt onderscheid gemaakt tussen tumorperforatie met veelal afgekapselde locale peritonitis, en perforatie proximaal van een coloncarcinoom wat zich veelal presenteert met faecale peritonitis (Pisano, 2018). Er wordt aanbevolen om de acute resectie voor ‘source control’ volgens oncologische principes uit te voeren. Voor een tumorperforatie wordt een resectie met of zonder anastomose, en met of zonder stoma geadviseerd. De aanbeveling voor proximale perforatie is een oncologische resectie van de tumor en behandeling van de perforatie, met indicatie voor subtotale colectomie bij slechte conditie van de darmwand van het proximale colon. Vanwege lage kans van opheffen van eindstandige stoma’s wordt aangegeven dat een anastomose met eventueel deviërend stoma overwogen dient te worden.
Voor linkszijdige obstructie worden segmentresectie met anastomose bij laag risicopatiënten en Hartmann procedure bij hoog risico patiënten aanbevolen boven een decomprimerend stoma, en een subtotale colectomie dient alleen bij serosa scheuren, perforatie of ischaemie te worden uitgevoerd. ‘Tube’ decompressie wordt genoemd als overbruggingstrategie, en stent als voorkeur boven decomprimerend stoma bij palliatieve intentie.
De ASCRS richtlijn (2017) beveelt aan om bij acute bloeding op basis van een coloncarcinoom initieel niet-chirurgisch (endoscopisch, angiografie met coiling) te behandelen, en bij noodzaak tot acute resectie, deze volgens oncologische principes uit te voeren. Bij perforatie wordt een resectie volgens oncologische principes geadviseerd met lage drempel voor gefaseerde procedure. Bij obstructie en curatieve intentie kunnen zowel acute resectie als stent met uitgestelde resectie worden overwogen, en deze aanbeveling wordt zowel voor links- als rechtszijdige obstructie gegeven.
In de NICE richtlijn (Jan, 2020) wordt aanbevolen om bij acute linkszijdige colonobstructie in een palliatieve setting een stent te overwegen, en in een curatieve setting een stent of acute chirurgie.
De ESGE richtlijn (update 2020) beveelt bij linkszijdig obstructief coloncarcinoom in een curatieve setting aan om een stent als alternatief voor acute resectie te bediscussiëren binnen gedeelde besluitvorming, en stent als voorkeursbehandeling te beschouwen ter palliatie. Een vergelijkbare zwakke aanbeveling wordt gedaan voor rechtszijdige obstructie. Bij stent als overbrugging naar resectie wordt een interval van 2 weken gesuggereerd. Het wordt aanbevolen om stenting te laten uitvoeren of superviseren door iemand met aangetoonde competentie in coloscopie en fluoroscopische technieken, die dit op regelmatige basis doet. Wanneer een overbruggingsstrategie het beste is, maar een tumor niet voor stenting in aanmerking komt, of wanneer de ervaring ontbreekt, wordt een decomprimerend stoma als alternatief gesuggereerd.
Samenvatting van systematische reviews en meta-analyses
PICO 1, 2, en 3
Er werden geen relevante systematische reviews gevonden.
PICO 4 (definitie obstructie)
Een systematische review van Veld (2021) toonde dat er in de literatuur over colonobstructie in de meerderheid geen definitie wordt gegeven, met een vergelijkbaar percentage tussen prospectieve cohort studies en RCT’s (Veld, 2021). RCT’s met een definitie gebruikten vaker radiologische criteria dan cohort studies met een definitie.
PICO 5a (acute linkszijdige obstructie, curatief)
Stent werd met acute chirurgie vergeleken voor linkszijdige obstructie in een systematische review op basis van 21 vergelijkende studies (Amelung, 2018), waarbij geen verschil in 3- en 5-jaars ziektevrije (OR 0,96 (0,73 tot 1,26) en OR 0,86 (0,54 tot 1,36)) en algehele overleving (OR 0,85 (0,68 tot 1,08) en OR 1,04 (0,68 tot 1,57)) werd gevonden, en ook geen verschil in lokaal recidief (OR 1,32 (0,78 tot 2,23)). Wel resulteerde een stent in significant minder permanente stoma’s (OR 0,49 (0,32 tot 0,74)).
PICO 6a (acute rechtszijdige obstructie, curatief)
Voor rechtszijdige obstructie (Amelung, 2015) werd op basis van 14 studies gevonden dat een stent tot lagere mortaliteit (0% versus 10,8% (8,1 tot 18,5)) en lagere majeure morbiditeit (0,8% (0 tot 4,8) versus 23,9% (9,3 tot 35,6)) leidde, en ook tot minder naadlekkages (0% versus 9,1%) en permanente stoma’s (0% versus 1,0%). Daarbij werd wel aangegeven dat het om studies van laag niveau van bewijs gaat, en stenting van rechtszijdige tumoren technisch lastig is. Daarbij is er ook risico op selectie bias, met een gunstiger uitgangssituatie van patienten die stenting ondergingen.
PICO 5b en 6b (acute obstructie, palliatief)
In een systematische review van 18 studies (Veld, 2020) bleek een palliatieve stent ten opzichte van een spoedoperatie gepaard te gaan met lagere mortaliteit (3,9% versus 9,4%; OR 0,44 (0,28 tot 0,69)), minder complicaties (13,6% versus 25,5%; OR 0,46 (0,29 tot 0,74)), en minder stoma’s (14,3% versus 51,4%; OR 0,17 (0,09 tot 0,31)). Wel waren er meer late complicaties na stent (23,3% versus 9,8%; OR 2,55 (1,70 tot 3,83)), veelal stentobstructie. Geconcludeerd werd dat stent de voorkeursbehandeling is in de palliatieve setting.
PICO 7, 8 en 9
Er werden geen relevante systematische reviews gevonden.
Samenvatting van nationale data en populatiestudies
Voor de deelvragen zijn er geen relevante nationale data of populatiestudies beschikbaar.
Zoeken en selecteren
Morbiditeit (inclusief overbruggingsinterventie), post-procedurele mortaliteit, laparoscopische resectie, locoregionaal recidief, afstandsmetastasen, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma-gerelateerde operaties), opnameduur, start en interval tot systemische vervolgbehandeling, stomavrij behandeltraject, permanent stoma, kwaliteit van leven.
PICO(s)
PICO 1: (proximale perforatie)
P: patiënten met een perforatie proximaal van een obstructief coloncarcinoom en peritonitis in de curatieve setting;
I: segmentele resectie van de perforatie, al dan niet met anastomose/ deviërend stoma;
C: subtotale colectomie, al dan niet met anastomose / deviërend stoma;
O: morbiditeit, mortaliteit, laparoscopische resectie, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), permanent stoma.
PICO 2: (acute bloeding)
P: patiënten met een klinisch manifeste bloeding vanuit een primair coloncarcinoom (acute Hb daling, hemodynamische instabiliteit);
I: coiling door de interventieradioloog;
C: acute oncologische resectie;
O: morbiditeit, mortaliteit, laparoscopische resectie, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), permanent stoma.
PICO 3: (peritumoraal abces)
P: patiënten met een primair coloncarcinoom en een peritumoraal abces;
I: percutane drainage en electieve resectie;
C: acute oncologische resectie;
O: morbiditeit, mortaliteit, laparoscopische resectie, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), permanent stoma.
PICO 4
Voor deze uitgangsvraag werd geen PICO opgesteld.
PICO 5a: (acute linkszijdige obstructie, curatief)
P: patiënten met een acute linkszijdige obstructie door een coloncarcinoom in de curatieve setting, al dan niet lokaal gevorderd;
I: overbrugging naar electieve resectie (stent of stoma);
C: acute oncologische resectie;
O: technisch en klinisch succes, morbiditeit (inclusief overbruggingsinterventie), post-procedurele mortaliteit, laparoscopische resectie, locoregionaal recidief, afstandsmetastasen, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), opnameduur, start en interval tot systemische vervolgbehandeling, stomavrij behandeltraject, permanent stoma, kwaliteit van leven.
PICO 5b: (acute linkszijdige obstructie, palliatief)
P: patiënten met een acute linkszijdige obstructie door een coloncarcinoom in de palliatieve setting;
I: zelf-expanderende metalen colonstent (al dan niet bedekt);
C: decomprimerend stoma;
O: technisch en klinisch succes, morbiditeit (korte en lange termijn), post-procedurele mortaliteit, aantal reïnterventies, opnameduur, start en interval tot systemische vervolgbehandeling, stoma, kwaliteit van leven.
PICO 6a: (acute rechtszijdige obstructie, curatief)
P: patiënten met een acute rechtszijdige obstructie door een coloncarcinoom in de curatieve setting, al dan niet lokaal gevorderd;
I: overbrugging naar electieve resectie (stent of stoma);
C: acute oncologische resectie;
O: technisch en klinisch succes, morbiditeit (inclusief overbruggingsinterventie), post-procedurele mortaliteit, laparoscopische resectie, locoregionaal recidief, afstandsmetastasen, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), opnameduur, start en interval tot systemische vervolgbehandeling, stomavrij behandeltraject, permanent stoma, kwaliteit van leven.
PICO 6b: (acute rechtszijdige obstructie, palliatief)
P: patiënten met een acute rechtszijdige obstructie door een coloncarcinoom in de palliatieve setting;
I: zelf-expanderende metalen colonstent (al dan niet bedekt);
C: decomprimerend stoma;
O: technisch en klinisch succes, morbiditeit (korte en lange termijn), post-procedurele mortaliteit, aantal reïnterventies, opnameduur, start en interval tot systemische vervolgbehandeling, stoma, kwaliteit van leven.
PICO 7: (stent of stoma)
P: patiënten die in aanmerking komen voor overbrugging naar electieve resectie bij een acute links- of rechtszijdige obstructie door een coloncarcinoom;
I: zelf-expanderende metalen colonstent (al dan niet bedekt);
C: decomprimerend stoma (blow-hole of dubbelloops transversostoma, ileostoma);
O: morbiditeit (inclusief overbruggingsinterventie), post-procedurele mortaliteit, laparoscopische resectie, locoregionaal recidief, afstandsmetastasen, ziektevrije overleving, totale overleving, aantal reïnterventies (inclusief stoma gerelateerde operaties), opnameduur, start en interval tot systemische vervolgbehandeling, stomavrij behandeltraject, permanent stoma, kwaliteit van leven.
PICO 8: (type stoma)
P: patiënten met een acute linkszijdige obstructie door een coloncarcinoom die een overbrugging krijgen naar electieve resectie door middel van een deviërend stoma;
I: blow hole;
C: dubbelloops colostoma;
O: morbiditeit, kwaliteit van leven, reïnterventies.
PICO 9: (overbruggingsinterval)
P: patiënten met een status na stent of stoma en klinisch succesvolle decompressie die in de wachttijd zijn voor electieve resectie van een coloncarcinoom;
I: interval < 2 weken;
C: interval 2 tot 4 weken;
O: morbiditeit (tijdens het interval en post-resectie), laparoscopische resectie, post-resectie mortaliteit, ziektevrije overleving, totale overleving, opnameduur, permanent stoma.
Referenties
- Amelung FJ, de Beaufort HW, Siersema PD, Verheijen PM, Consten EC. Emergency resection versus bridge to surgery with stenting in patients with acute right-sided colonic obstruction: a systematic review focusing on mortality and morbidity rates. Int J Colorectal Dis. 2015 Sep;30(9):1147-55. doi: 10.1007/s00384-015-2216-8. Epub 2015 May 3. PMID: 25935448.
- Amelung FJ, Borstlap WAA, Consten ECJ, Veld JV, van Halsema EE, Bemelman WA, et al. Propensity score-matched analysis of oncological outcome between stent as bridge to surgery and emergency resection in patients with malignant left-sided colonic obstruction. Br J Surg. 2019 Jul;106(8):1075-1086. doi: 10.1002/bjs.11172. Epub 2019 May 10. PMID: 31074507.
- Amelung FJ, Burghgraef TA, Tanis PJ, van Hooft JE, Ter Borg F, Siersema PD, Bemelman WA, Consten ECJ. Critical appraisal of oncological safety of stent as bridge to surgery in left-sided obstructing colon cancer; a systematic review and meta-analysis. Crit Rev Oncol Hematol. 2018 Nov;131:66-75. doi: 10.1016/j.critrevonc.2018.08.003. Epub 2018 Sep 4. PMID: 30293707.
- Amelung FJ, Consten ECJ, Siersema PD, Tanis PJ. A Population-Based Analysis of Three Treatment Modalities for Malignant Obstruction of the Proximal Colon: Acute Resection Versus Stent or Stoma as a Bridge to Surgery. Ann Surg Oncol. 2016 Oct;23(11):3660-3668. doi: 10.1245/s10434-016-5247-7. Epub 2016 May 24. PMID: 27221360; PMCID: PMC5009151.
- Kim SW, Kim J, Hong SM, Yoon YS, Park IJ, Yu CS, Kim J. Detailed pathological analysis of the advancing edge of the tumour can effectively stratify clinical T4b colorectal cancer patients. Histopathology. 2019 May;74(6):883-891. doi: 10.1111/his.13820. Epub 2019 Apr 1. PMID: 30609091.
- Pisano M, Zorcolo L, Merli C, Cimbanassi S, Poiasina E, Ceresoli M, et al. World J Emerg Surg. 2018 Aug 13;13:36. doi: 10.1186/s13017-018-0192-3. eCollection 2018.PMID: 30123315
- van Hooft JE, Veld JV, Arnold D, Beets-Tan RGH, Everett S, Götz M, van Halsema EE, et al. Self-expandable metal stents for obstructing colonic and extracolonic cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2020. Endoscopy. 2020 May;52(5):389-407. doi: 10.1055/a-1140-3017. Epub 2020 Apr 7. PMID: 32259849.
- Veld JV, Amelung FJ, Borstlap WAA, Eise van Halsema E, Consten ECJ, Siersema PD, et al. Changes in Management of Left-Sided Obstructive Colon Cancer: National Practice and Guideline Implementation. J Natl Compr Canc Netw. 2019 Dec;17(12):1512-1520. doi: 10.6004/jnccn.2019.7326. PMID: 31805533.
- Veld JV, Amelung FJ, Borstlap WAA, van Halsema EE, Consten ECJ, Siersema PD, et al. Comparison of Decompressing Stoma versus Stent as a Bridge to Surgery for Left-Sided Obstructive Colon Cancer. JAMA Surg. 2020 Mar 1;155(3):206-215. doi: 10.1001/jamasurg.2019.5466. Erratum in: JAMA Surg. 2020 Mar 1;155(3):269. PMID: 31913422; PMCID: PMC6990965.
- Veld JV, Amelung FJ, Borstlap WAA, van Halsema EE, Consten ECJ, Dekker JWT, et al. Decompressing Stoma a s Bridge to Elective Surgery is an Effective Strategy for Left-sided Obstructive Colon Cancer: A National, Propensity-score Matched Study. Ann Surg. 2020 Nov;272(5):738-743. doi: 10.1097/SLA.0000000000004173. PMID: 32833768.
- Veld JV, Beek KJ, Consten ECJ, Ter Borg F, van Westreenen HL, Bemelman WA, et al. Definition of large bowel obstruction by primary colorectal cancer: A systematic review. Colorectal Dis. 2021 Apr;23(4):787-804. doi: 10.1111/codi.15479. Epub 2021 Jan 15. PMID: 33305454; PMCID: PMC8248390.
- Veld JV, Kumcu A, Amelung FJ, Borstlap WAA, Consten ECJ, Dekker JWT, et al. Time interval between self-expandable metal stent placement or creation of a decompressing stoma and elective resection of left-sided obstructive colon cancer. Endoscopy. 2021 Sep;53(9):905-913. doi: 10.1055/a-1308-1487. Epub 2020 Dec 18. PMID: 33339059.
- Veld J, Umans D, van Halsema E, Amelung F, Fernandes D, et al. Self-expandable metal stent (SEMS) placement or emergency surgery as palliative treatment for obstructive colorectal cancer: A systematic review and meta-analysis. Crit Rev Oncol Hematol. 2020 Nov;155:103110. doi: 10.1016/j.critrevonc.2020.103110. Epub 2020 Sep 22. PMID: 33038693.
- Vogel JD, Eskicioglu C, Weiser MR, Feingold DL, Steele SR. The American Society of Colon and Rectal Surgeons Clinical Practice Guidelines for the Treatment of Colon Cancer. Dis Colon Rectum. 2017 Oct;60(10):999-1017. doi: 10.1097/DCR.0000000000000926. PMID: 28891842.
Evidence tabellen
Samenvattingstabel van bevindingen uit systematische reviews en meta-analyses
|
PICO 5a
Summary of findings |
||||||
|
Stent placement as bridge to surgery or stoma compared to emergency surgery for patients with an acute left-sided obstruction due to a colon carcinoma in the curative setting, whether or not locally advanced |
||||||
|
Patient or population: patients with an acute left-sided obstruction due to a colon carcinoma in the curative setting, whether or not locally advanced Setting: hospital Intervention: stent placement as bridge to surgery or stoma Comparison: emergency surgery |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
Conclusion |
|
|
Risk with emergency surgery |
Risk with stent placement as bridge to surgery or stoma |
|||||
|
Overall survival (OS) |
32 per 100 |
34 per 100 |
RR 1.08 |
206 |
⨁⨁◯◯ |
The evidence suggests that stent placement as bridge to surgery or stoma results in little to no difference in overall survival when compared to emergency surgery. |
|
Disease-free survival (DFS) |
37 per 100 |
43 per 100 |
RR 1.17 |
165 |
⨁⨁◯◯ |
The evidence suggests that stent placement as bridge to surgery or stoma does not increase disease-free survival. |
|
Permanent stoma |
18 per 100 |
11 per 100 |
RR 0.63 |
191 |
⨁⨁◯◯ |
The evidence is very uncertain about the effect of stent placement as bridge to surgery or stoma on permanent stoma rate. |
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
|
GRADE Working Group grades of evidence |
||||||
Explanations
a. The certainty of the evidence was downgraded with two levels due to very serious imprecision (the confidence interval encloses a clinically relevant effect for both the intervention and comparator).
Forest plot 3-year overall survival
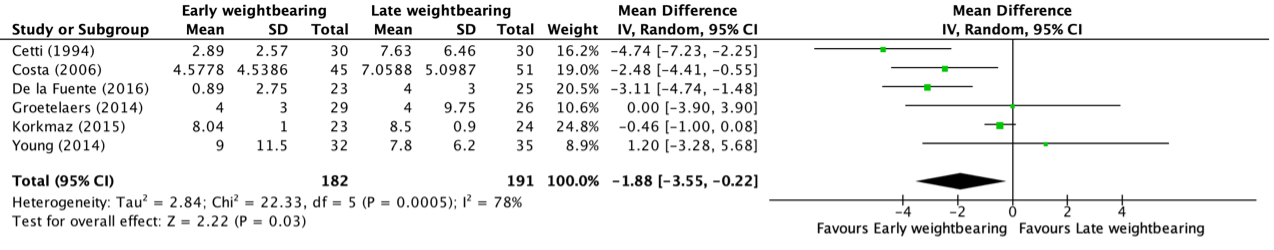
BTS = stent placement as bridge to surgery or stoma; ES = Emergency surgery
Forest plot 3-year disease-free survival
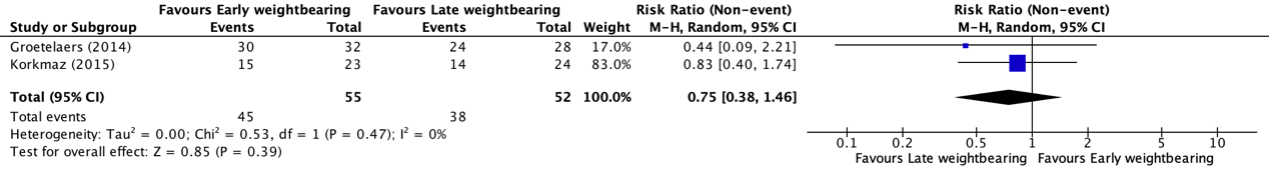
BTS = stent placement as bridge to surgery or stoma; ES = Emergency surgery
Forest plot permanent stoma rate
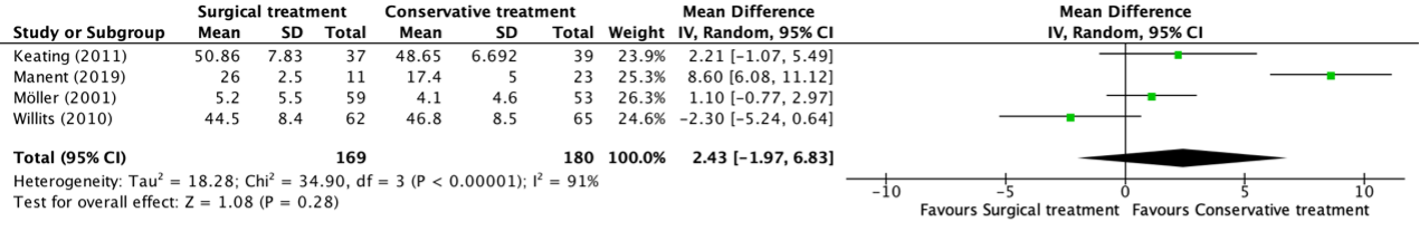
BTS = stent placement as bridge to surgery or stoma; ES = Emergency surgery
PICO 6a Summary of findings
No RCTs were available for this PICO and therefore no formal GRADE Summary of findings table is presented. The certainty of the evidence from the cohort studies on overall survival, disease-free survival and permanent stoma rate is very low.
PICO 5b en 6b
|
Summary of findings: |
||||||
|
Self-expandable metal stent (SEMS) placement compared to emergency surgery for patients with an acute obstruction due to a colon carcinoma in the palliative setting |
||||||
|
Patient or population: patients with an acute left-sided obstruction due to a colon carcinoma in the palliative setting Setting: hospital Intervention: self-expandable metal stent (SEMS) placement Comparison: emergency surgery |
||||||
|
Outcomes |
Anticipated absolute effects* (95% CI) |
Relative effect |
№ of participants |
Certainty of the evidence |
Comments |
|
|
Risk with emergency surgery |
Risk with self-expandable metal stent (SEMS) placement |
|||||
|
30-day and/or in-hospital mortality (Mortality) |
0 per 100 |
0 per 100 |
RR 4.58 |
76 |
⨁◯◯◯ |
The evidence is very uncertain about the effect of self-expandable metal stent (SEMS) placement on 30-day and/or in-hospital mortality. |
|
Quality of life (QoL) |
SEMS resulted in significantly better quality of life than resection at one month, while quality of life was similar at 3 months, and worse for SEMS than emergency surgery after 6 months. |
33 |
⨁◯◯◯ |
The evidence is very uncertain about the effect of self-expandable metal stent (SEMS) placement on quality of life. |
||
|
*The risk in the intervention group (and its 95% confidence interval) is based on the assumed risk in the comparison group and the relative effect of the intervention (and its 95% CI). |
||||||
|
GRADE Working Group grades of evidence |
||||||
Explanations
a. The certainty of the evidence was downgraded with one level due to serious risk of bias (methodological limitations in the studies)
b. The certainty of the evidence was downgraded with two levels due to very serious imprecision (the confidence interval encloses a clinically relevant effect for both the intervention and comparator).
Forest plot 30-day and/or in-hospital mortality
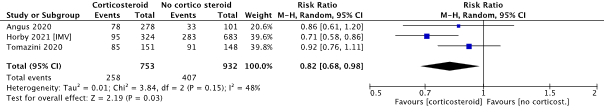
SEMS = self-expandable metal stent; ES = Emergency surgery
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 05-08-2022
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden voor een periode van 3 jaar, met optionele verlenging van 3 jaar. De werkgroep zal halfjaarlijks bijeenkomen voor een herbeoordeling van de geldigheid van de modules in deze richtlijn. De geldigheid van richtlijnmodules zal bij herbeoordeling komen te vervallen wanneer nieuwe ontwikkelingen aanleiding geven om een herzieningstraject te starten. De Nederlandse Vereniging voor Heelkunde (NVvH) is regiehouder van deze richtlijn en eindverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. Per module is aangegeven welke wetenschappelijke vereniging de eerstverantwoordelijke is voor de actualiteitsbeoordeling (zie de Algemene inleiding: Inhoud richtlijn colorectaal carcinoom en gepland modulair onderhoud).
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het tot stand brengen van een modulaire herziening van de richtlijn “Colorectaal Carcinoom”, zodat het beleid bij patiënten met een colorectaal carcinoom gestandaardiseerd en op hun wensen is afgestemd in alle fasen van de ziekte.
Doelgroep
Patiënten met een colorectaal carcinoom in de tweede en derde lijn.
Samenstelling werkgroep
Huidige samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom te maken hebben. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De huidige samenstelling van de werkgroep is:
- Prof. dr. P.J. (Pieter) Tanis, gastrointestinaal en oncologisch chirurg, Erasmus MC, Rotterdam, NVvH (voorzitter)
- Prof. dr. G.L. (Geerard) Beets, gastrointestinaal en oncologisch chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
- Mw. S. (Simone) Dokter MSc., verpleegkundig specialist, Antoni van Leeuwenhoek, Amsterdam, V&VN
- Dr. D.J.A. (Derk Jan) de Groot, internist-oncoloog, UMC Groningen, Groningen, NIV/NVMO
- Dr. M.E. (Marije) Hamaker, klinisch geriater, Diakonessenhuis, Utrecht, NVKG
- Dr. M.P.W. (Martijn) Intven, radiotherapeut, UMC Utrecht, Utrecht, NVRO
- Dr. O.J.L. (Olaf) Loosveld, internist-oncoloog, Amphia Ziekenhuis, Breda, NIV/NVMO
- Dr. M. (Monique) Maas, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- Prof. dr. C.A.M. (Corrie) Marijnen, radiotherapeut, Leids Universiteit Medisch Centrum, Leiden, NVRO
- Dr. M. (Martijn) Meijerink, interventieradioloog, Amsterdam UMC locatie VUmc, Amsterdam, NVvR
- Dr. L. (Leon) Moons, MDL-arts, UMC Utrecht, Utrecht, NVMDL
- Prof. dr. I.D. (Iris) Nagtegaal, patholoog, Radboud UMC, Nijmegen, NVvP
- Dr. M. (Mark) Roef, nucleair geneeskundige, Catharina Ziekenhuis, Eindhoven, NVNG
- Dr. P. (Petur) Snaebjornsson, patholoog, Nederlands Kanker Instituut, Amsterdam, NVvP
- Mw. I. (Iris) van der Veeken Msc., coloncare verpleegkundige, Flevoziekenhuis, Almere, V&VN
- Dr. H.M.W. (Henk) Verheul, internist-oncoloog, Radboudumc, Nijmegen, NIV/NVMO
- Prof. dr. C. (Kees) Verhoef, oncologisch chirurg, Erasmus MC, Rotterdam, NVvH
- Dr. M. (Marianne) de Vries, abdominaal radioloog, Erasmus MC, Rotterdam, NVvR
- Dr. H.L. (Erik) van Westreenen, chirurg, Isala Zwolle/ Isala Diaconessenhuis, Zwolle/Meppel, NVvH
Voormalig betrokken werkgroepleden
- Prof. dr. R.G.H. (Regina) Beets-Tan, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- C.M.J. (Christel) Gielen MSc., verpleegkundig specialist, Maastricht UMC+, Maastricht, V&VN
- Dr. C.J. (Corneline) Hoekstra, nucleair geneeskundige, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVNG
- Prof. dr. C.J.A. (Kees) Punt, medisch oncoloog, NIV/NVMO
- Prof. dr. J. (Jaap) Stoker, abdominaal radioloog, NVvR
- Dr. A.J. (Albert Jan) ten Tije, internist oncoloog, NIV/NVMO
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
De werkgroep heeft geconstateerd dat sommige werkgroepleden betrokken zijn bij wetenschappelijk onderzoek dat wordt gefinancierd door overheid, onafhankelijke subsidieverstrekkers, of commerciële partijen (in het laatste geval: unrestricted scientific grants). Om te voorkomen dat indirecte belangen (waaronder reputatie en kennisvalorisatie) de richtlijnaanbevelingen onbedoeld zouden kunnen beïnvloeden, heeft de werkgroep besloten dat geen van de modules/aanbevelingen worden opgesteld door één werkgroeplid met dergelijke indirecte belangen. Tenminste één ander werkgroeplid met hetzelfde specialisme of tenminste één ander werkgroeplid met vergelijkbare inhoudelijke kennis van het betreffende onderwerp zijn verantwoordelijk voor de inhoud (vier-ogen-principe).
De werkgroep zag in de gemelde (on)betaalde nevenfuncties geen aannemelijke reden voor onbedoelde beïnvloeding door belangenverstrengeling ten aanzien van de onderwerpen die in de richtlijn aan bod komen.
Huidige werkgroepleden
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. P.J. (Pieter) Tanis
|
1. Hoogleraar chirurgie, in het bijzonder colorectale chirurgie, Amsterdam UMC, Universiteit van Amsterdam (0 fte) 2. Oncologische en gastrointestinaal chirurg, Erasmus MC, Rotterdam (1,0 fte) |
- Lid van de Clinical Audit Board van de Dutch ColoRectal Audit (onbetaald) - Lid Medische adviesraad Lynch Polyposis vereniging (onbetaald) - Bestuurslid Stichting Opsporing Erfelijke Tumoren (onbetaald) - Associate Editor Colorectal Disease (onbetaald) |
Financiële belangen: Geen financiële belangen te vermelden in het kader van de richtlijn Colorectaal carcinoom. Vergoeding ontvangen voor het geven van voordrachten op wetenschappelijke bijeenkomsten van Johnson & Johnson, Medtronic, Servier, maar op onderwerpen niet gerelateerd aan de richtlijn.
Extern gefinancierd onderzoek: * KWF/ B Braun: Preventie en behandeling van naadlekkage na resectie rectumcarcinoom. IMARI trial - Projectleider * KWF: Rol van adjuvantie HIPEC bij T4/geperforeerd coloncarcinoom. COLOPEC trial - Projectleider * KWF: Waarde van second/ third look laparoscopie voor vroege detectie peritoneonale metastasen coloncarcinoom. COLOPEC 2 trial - Projectleider * KWF: Toepassing van een gluteale transpositie voor perineale wondsluiting bij APR voor rectumcarcinoom. BIOPEX-2 trial - Projectleider * KWF: Waarde van perioperatieve chemotherapie bij CRS/HIPEC voor peritoneale metastasen van CRC. CAIRO-6 trial - Geen projectleider * KWF: Landelijke snapshot studies naar verschillende facetten van de behandeling van rectumcarcinoom en complex coloncarcinoom - geen projectleider |
Geen actie ondernomen.
Subsidies zijn van KWF, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Prof. dr. G.L. (Geerard) Beets
|
Chirurg / Afdelingshoofd AVL |
Medisch consultant bij Champalimaud Foundation, oncologisch ziekenhuis in Lissabon, Portugal (betaalde functie) |
Geen. |
Geen actie ondernomen. |
|
S. Dokter (Simone) MSc. |
Verpleegkundig specialist MDL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. Derk Jan de Groot
|
Internist-oncoloog |
Geen. |
Klinische studies: Ipsen (betaling aan het instituut) |
Geen actie ondernomen. |
|
Dr. M.E. (Marije) Hamaker
|
Klinisch geriater |
Geen |
Roche: lid van werkgroep e-learning colorectaal carcinoom (niet relevant voor de richtlijn)
Astra Zeneca: financiering van onderzoek over dialyse bij ouderen |
Geen actie ondernomen. |
|
Dr. M.P.W. (Martijn) Intven
|
Radiotherapeut |
Lid redactieraad van het Nederlands tijdschrift voor oncologie |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. C.A.M. (Corrie) Marijnen
|
Radiotherapeut / Afdelingshoofd radiotherapie LUMC |
Voorzitter wetenschapscommissie NVRO
Redactielid leerboek Oncologie |
Geen. |
Geen actie ondernomen. |
|
Dr. Martijn Meijerink
|
Interventieradioloog, Amsterdam UMC locatie VUmc |
Voorzitter WCIR (wetenschapscommissie interventieradiologie), onbetaald.
Voortzitter SIO (Soc. Interv. Oncol.) Research Committee, onbetaald.
Raad van advies SPKS (stichting voor patiënten met kanker aan het spijsverteringskanaal), onbetaald.
Ambassadeur SBBvK en OZS, onbetaald |
Consultant Angiodynamics B.V. (vergoeding voor presentaties, workshops, proctorships) op het gebied van irreversibele electroporatie.
Research grants: Collision Trial (Medtronic) Diverse trials (Angiodynamics B.V.)
|
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. L. (Leon) Moons
|
MDL-arts |
Consultant voor Boston Scientific, met vergoeding. In 2018 betrof dit € 3220, in 2019 € 1885. Daarnaast heeft Zambon in 2019 een bijdrage geleverd aan het bezoek van de Digestive Disease Week in San Diego, VS voor het bedrag van € 1996. Deze consultancy gaat over specifieke apparatuur voor MDL-artsen, niet relevant voor deze richtlijn. |
Voorzitter van T1 CRC werkgroep en voorzitter van een internationaal samenwerkingsverband op het gebied van T CRC's (CRIT1C constortium)
PI van een gerandomiseerde studie (piecemeal EMR vs. ESD), gefinancierd door KWF.
PI van een studie naar risicomodellen voor het voorspellen van lymfekliermetastasen en lokale recidieven van T1 CRCs, gefinancierd door de MLDS.
PI van een studie naar tumor seedings tijdens coloscopie, gefinancierd door de Sacha Swarttouw-Hijmans stichting. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Prof. dr. I.D. (Iris) Nagtegaal
|
Patholoog Radboudumc/ Hoogleraar Radboud Universiteit (1 fte), met detachering als Expert Pathologie ten behoeve van het bevolkingsonderzoek darmkanker bij de Nederlandse screeningsorganisatie (0,2 fte) |
Voorzitter PALGA (Nederlands Digitale Pathologie Archief), vacatiegeld naar afdeling Pathologie, Radboudumc
Voorzitter European Taskforce for synoptic reporting in pathology, onbetaald
Voorzitter Nederlands TNM committee, onbetaald
Member data steering committee International Collaboration on Cancer Reporting (onbetaald)
Member YNM Global Advisory Group (onbetaald)
Member expert panel AJCC lower gastrointestinal cancer (onbetaald) |
* KWF - Tumour deposits: the origin of distant metastases? - Projectleider * KWF - Into the light: guided visualization of high-risk cander precursor lesions - geen projectleider * ZonMw - The impact of COVID-19 epidemic on diagnosis and treatment of canver patients: lessons for the future - geen projectleider * KWF - Coexistence with metastases: influence of microbiome on CRC metastases - geen projectleider * Hanarth fonds - CUP fight: detecting the origin of metastatic disease - Projectleider |
Geen actie ondernomen.
Subsidies zijn van ZonMw/KWF, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Dr. M. (Mark) Roef |
Nucleair geneeskundige |
Penningmeester NVNG Commissie Wetenschappelijke Ontmoetingen, onbetaald |
Geen. |
Geen actie ondernomen. |
|
Dr. P. (Petur) Snaebjornsson
|
Patholoog |
Bestuurslid Dutch Colorectal Cancer Group (onbetaald).
|
1. Op 1 oktober 2020: online Expert Input Forum, georganiseerd door MSD. Onderwerp: HSI-H colorectaalcarcinoom. Hiervoor betaling aan AVL. Hoofdstuk/module over MMR/MSI status en moleculaire pathologie is hiervoor al geschreven 2. Op 8 oktober 2020: deelname als expert aan nascholing Colorectaal carcinoom (talkshow). Onderwerp: gemetastaseerd colorectaalcarcinoom. Georganiseerd door MEDtalks. Hiervoor betaling aan ALV. Hoofdstuk/module over MMR/MSI status en moleculaire pathologie is hiervoor al geschreven
Andere: Betrokken bij COLOPEC trials en CAIRO6 trial. |
Geen actie ondernomen. |
|
I. (Iris) van der Veeken, Msc. |
Coloncare verpleegkundige |
Deelname V&VN tumorwerkgroep colorectaal - onbetaald |
Geen. |
Geen actie ondernomen. |
|
Prof. Dr. H. (Henk) Verheul |
Internist oncoloog Radboudumc Nijmegen, Professor Translation Cancer Research |
Geen. |
Externe financiering: Philips Diagnostics, Roche Pfizer, Frame Therapeutics |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Prof. dr. C. (Kees) Verhoef
|
Oncologisch chirurg |
Wetenschappelijke adviesraad KWF (onbetaald).
Wetenschappelijk raad Livermetsurvey (onbetaald).
Voorzitter Nederlandse Vereniging voor Chirurgische Oncologie (onbetaald).
Lid Algemeen Bestuur Nederlandse Vereniging van Heelkunde (onbetaald).
Voorzitter "Dutch chapter E-AHPBA" (onbetaald).
Nederlands TNM comite (onbetaald).
Adviesraad IKNL (onbetaald).
Nederlandse wetenschappelijke Sarcoom Werkgroep (onbetaald).
Bestuur Dutch Hepatocellular Carcinoma Group (onbetaald).
Bestuur Familiehuis, Daniel den Hoed Kliniek (onbetaald). |
Geen. |
Geen actie ondernomen. |
|
Dr. Marianne de Vries
|
Radioloog |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. H.L. (Erik) Van Westreenen
|
Gastrointestinaal en oncologisch chirurg |
Penningmeester werkgroep Coloproctologie (onbetaald) |
PI Limeric study (endoscopisch geassisteerde laparoscopische wigresectie van het colon).
Locale PI en mede aanvrager FORCE study (Zon-MW) (Randomisatie tussen best-supportive care of bekkenfysiotherapie na low-anterior resectie)
Locale PI TESAR study
Locale PI StarTrec study
Locale PI FIT trial |
Geen actie ondernomen.
Mede-aanvrager van ZonMW subsidie, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
Voormalige werkgroepleden
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. R.G.H. (Regina) Beets-Tan
|
Radioloog / Hoofd radiologie NKI/AVL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
C.M.J. (Christel) Gielen MSc.
|
Verpleegkundig specialist Coloncare |
Geen. |
Werkt mee aan de inclusie voor de ENCORE studie (energie voor het leven na colorectaalkanker). |
Geen actie ondernomen. |
|
Dr. C.J. (Corneline) Hoekstra
|
Nucleair geneeskundige |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. C.J.A. (Kees) Punt
|
Medisch oncoloog |
Voorzitter werkgroep medische oncologie, Dutch Colorectal Cancer Group (DCCG) (onbetaald).
Voorzitter Dutch Oncology Research Platform (onbetaald). |
Lid raad van advies SPKS
Unrestricted scientific grants van Roche en Amgen voor DCCG CAIRO5 studie. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. A.J. (Bert Jan) ten Tije |
Internist-oncoloog |
Geen. |
Geen. |
Geen actie ondernomen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS) voor de invitational conference. Daarnaast hebben patiëntvertegenwoordigers (dr. L. Meerman, mw. M. v.d. Bosch-Scholts en tot 2021 mw. A. van Heijst; Stomavereniging, anno 2022 Stichting Darmkanker, Nederlandse Federatie van Kankerpatiëntenorganisaties, NFK) modules meegelezen en de werkgroep van feedback vanuit het patiëntenperspectief voorzien. De conceptrichtlijn is tevens ter commentaar voorgelegd aan Stichting Darmkanker en NFK.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de herziene richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat interne en externe kwaliteitsindicatoren al ontwikkeld worden binnen de Dutch Colorectal Audit (DCRA), de clinical audit board betreffend colorectaal carcinoom onder de Dutch Institute for Clinical Auditing (DICA).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVRO, 2014) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van nieuwe evidence, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en werkgroepleden concept-uitgangsvragen opgesteld. Gedurende het richtlijnherzieningstraject heeft de werkgroep de definitieve uitgangsvragen in een hernieuwd raamwerk (de inhoudsopgave, zie ook de algemene inleiding) van de richtlijn vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep baseerde de keuze voor uitkomstmaten mede op basis van de “core outcome set” gepubliceerd door Zerillo (2017). De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Hiervoor sloot de werkgroep zich, waar mogelijk, aan bij de grenzen voor klinische besluitvorming volgens de PASKWIL criteria uit 2016. Wanneer er geen grenzen voor klinische besluitvorming conform de PASKWIL criteria geformuleerd konden worden (bijvoorbeeld bij non-inferioriteitsvraagstukken) werden de standaard GRADE grenzen gehanteerd, tenzij anders vermeld.
Strategie voor zoeken en selecteren van literatuur
De werkgroep raadpleegde voor de afzonderlijke uitgangsvragen reeds gepubliceerde systematische reviews (SRs). SRs kwamen in aanmerking indien: i) systematisch was gezocht in één of meerdere databases; ii) transparante in- en exclusiecriteria zijn toegepast en iii) idealiter de kwaliteit van de geïncludeerde literatuur was beoordeeld. De voor de uitgangsvragen relevante internationale richtlijnen en consensusdocumenten werden eveneens geraadpleegd. Overige literatuur, waar niet systematisch naar werd gezocht, is als bewijsvoering in de overwegingen opgenomen.
Relevante beschikbare populatiegegevens uit Nederland werden gebruikt voor het bepalen van knelpunten, praktijkvariatie en externe validiteit van internationale richtlijnen en gepubliceerde literatuur.
Kwaliteitsbeoordeling individuele studies
De (risk of bias) kwaliteitsbeoordelingen van de individuele studies uit de gebruikte SRs werden gebruikt, tenzij deze afwezig waren of onbruikbaar waren voor het beoordelen van de kracht van het wetenschappelijke bewijs. Indien afwezig of onbruikbaar werd aangenomen dat er een risico op bias aanwezig zou kunnen zijn. In enkele gevallen, wanneer studies informatie verschaften over de cruciale uitkomstma(a)t(en), werd er een nieuwe kwaliteitsbeoordeling van individuele studies uitgevoerd.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van de geselecteerde SRs werden weergegeven in ‘Summary of Findings’ tabellen. De belangrijkste bevindingen uit de literatuur werden kort beschreven onder “Samenvatting literatuur” (kopjes “Samenvatting van internationale richtlijnen en consensusdocumenten” en “Samenvatting van systematische reviews en meta-analyses”) en onder “Overwegingen”. Bestaande meta-analyses uit de gebruikte systematische reviews werden beschreven. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). Het resultaat van de gradering van het wetenschappelijk bewijs werd opgenomen in de ‘Summary of Findings’ tabellen.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’.
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek (te vinden in de ‘Summary of Findings’ tabellen). De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Aanbevelingen uit de richtlijn Colorectaal carcinoom 2014
De werkgroep beoordeelde alle aanbevelingen in de richtlijn Colorectaal carcinoom uit 2014 op geldigheid. De werkgroep heeft aanbevelingen gehandhaafd die als nog steeds geldig werden beschouwd. De werkgroep heeft deze aanbevelingen tekstueel opgefrist met als doel de implementeerbaarheid te vergroten. De aanbevelingen zijn niet inhoudelijk veranderd. De werkgroep heeft in het modulair onderhoudsschema vastgesteld wanneer herziening van deze modules gepland is. De werkgroep verwacht dat eind 2020 de gehele richtlijn is herzien.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DCRA indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en patiëntorganisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zerillo JA, Schouwenburg MG, van Bommel ACM, Stowell C, Lippa J, Bauer D, Berger AM, Boland G, Borras JM, Buss MK, Cima R, Van Cutsem E, van Duyn EB, Finlayson SRG, Hung-Chun Cheng S, Langelotz C, Lloyd J, Lynch AC, Mamon HJ, McAllister PK, Minsky BD, Ngeow J, Abu Hassan MR, Ryan K, Shankaran V, Upton MP, Zalcberg J, van de Velde CJ, Tollenaar R; Colorectal Cancer Working Group of the International Consortium for Health Outcomes Measurement (ICHOM). An International Collaborative Standardizing a Comprehensive Patient-Centered Outcomes Measurement Set for Colorectal Cancer. JAMA Oncol. 2017 May 1;3(5):686-694. doi: 10.1001/jamaoncol.2017.0417. PubMed PMID: 28384684.
