Radicaliteit en kwaliteit van het resectiepreparaat
Uitgangsvraag
Op welke wijze wordt de kwaliteit en de radicaliteit van een colorectale resectie vastgesteld?
De uitgangsvraag omvat de volgende deelvragen:
- Volgens welke standaard dient de kwaliteit van een totale mesorectale excisie (TME) voor rectumcarcinoom (a) en van een oncologische colonresectie (b) beoordeeld te worden?
- Dient het radiaire snijvlak te worden geïnkt?
- Dienen de transversale resectievlakken aan het proximale en distale darmuiteinde voor microscopisch onderzoek ingesloten te worden, indien deze macroscopisch vrij van tumor zijn?
- Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag te vermelden?
- Wanneer wordt een snijvlak als tumorpositief beschouwd en hoe wordt hierbij omgegaan met:
a. Tumor (directe betrokkenheid primaire tumor, “tumorbulk”)
b. Tumordepositie of tumorpositieve lymfklier
c. (lymf)angio-invasie
d. Perineurale groei
e. Acellulair slijm met/zonder neoadjuvante therapie
Aanbeveling
Bepaal bij een rectumresectie het niveau van de resectie en gebruik hierbij de volgende onderverdeling: muscularis propria, mesorectale vet of mesorectale fascie.
In het geval van een abdominoperineale resectie kan bovendien het niveau ter plaatse van het anale deel van het preparaat bepaald worden: submucosa/perforatie, sfincters, extralevator.
Bepaal bij oncologische colonresectie preparaten het niveau van de resectie en gebruik hierbij de volgende onderverdeling: muscularis propria, intramesocolisch, mesocolische fascie.
Inkt de circumferentiële snijvlakken van resectiepreparaten van het rectum.
Inkt de radiaire snijvlakken van colonpreparaten (tegenover de tumor) wanneer de tumor zich in het colon ascendens, flexura hepatica, flexura lienalis, colon descendens of sigmoid-rectum overgangszone bevindt.
Sluit van een colonresectiepreparaat het dichtstbijzijnde transversale snijvlak routinematig in. Het insluiten van het tegenoverliggende transversale snijvlak is optioneel, tenzij de tumor is ontstaan in het kader van inflammatoire darmziekte (IBD).
Sluit van een totale of partiële mesorectale excisie (TME, PME) het distale snijvlak routinematig in voor microscopisch onderzoek. Indien het proximale snijvlak op ruime afstand is van de tumor (>3,0 cm) kan overwogen worden om af te zien van het insluiten van het proximale snijvlak.
Sluit donuts alleen in voor microscopisch onderzoek, indien het betreffende resectievlak positief is.
Bepaal de marge van een colorectaal carcinoom tot het dichtstbijzijnde transversale snijvlak tot op de millimeter precies.
Beschouw een snijvlak als tumorpositief bij een marge van ≤ 1 mm.
Specificeer bij de vermelding van een tumorpositief snijvlak, waardóór het snijvlak tumorpositief is, indien het geen directe betrokkenheid van de primaire tumor betreft, zoals een tumordepositie, intravasculair, in lymfvaten of perineuraal gelegen tumorcellen, een tumorpositieve lymfklier (met of zonder kapseldoorbraak) of acellulair slijm. Naast deze marge dient in dat geval ook de afstand van de primaire tumor tot het snijvlak gerapporteerd te worden.
Beschouw snijvlakken met alleen acellulaire slijmmeren als tumornegatief, indien neoadjuvante therapie gegeven is.
Overwegingen
Wat is er nieuw?
De module is geüpdatet: er zijn deelvragen toegevoegd, waarbij meer expliciet op de macroscopische beoordeling van kwaliteit en radicaliteit van colorectale resecties, op de transversale en radiaire snijvlakken en de microscopische beoordeling hiervan ingegaan wordt.
Overwegingen
Uitgangsvraag 1a. Volgens welke standaard dient de kwaliteit van totale mesorectale excisie (TME) voor rectumcarcinoom beoordeeld te worden?
Het macroscopische vastgestelde niveau van een resectiepreparaat na totale mesorectale excisie (TME) is gerelateerd aan de circumferentiële resectiemarge (CRM) en beïnvloedt, ook onafhankelijk van de CRM, het risico op recidief en de overleving (Quirke, 2009; Garcia, 2009; Leite, 2011; Nagtegaal, 2002; Bosch, 2012; Maslekar, 2007). Chirurgische vaardigheid beïnvloedt het niveau van de resectie, hoewel ook patiënt- en tumorgerelateerde factoren een rol spelen. Terugkoppeling aan de chirurg vormt een belangrijk onderdeel van kwaliteitscontrole om de chirurgische techniek en oncologische uitkomsten te verbeteren (Quirke, 2009; Garcia-Granero, 2009; Bosch, 2012). Het beoordelen van het niveau van de resectie door de patholoog is in alle (internationale) richtlijnen opgenomen, waarbij dezelfde gradering wordt gebruikt. Wel wisselt de terminologie van kwaliteit, compleetheid en niveau van de resectie. In het Verenigd Koninkrijk en in Nederland verdient een objectieve omschrijving de voorkeur en is derhalve gekozen voor “niveau van de resectie”.
Wat betreft het niveau van de resectie met betrekking tot het anale deel van een abdominoperineale resectie (APR) is de prognostische waarde en ook het effect van terugkoppeling onvoldoende bewezen. Echter, aangezien de extra-levator APR oncologisch superieur is, kan worden overwogen om het niveau van deze resectie en of deze resectie dus optimaal uitgevoerd is wel vast te leggen. Het zou een kans zijn voor feedback (Martijnse, 2011).
Uitgangsvraag 1b. Volgens welke standaard dient de kwaliteit van een oncologische colonresectie beoordeeld te worden?
Het niveau van resectie bij coloncarcinoom is minder uitgebreid onderzocht dan bij rectumcarcinoom. Er zijn slechts observationele data zonder eenduidige resultaten beschikbaar. Volgens een observationele studie van West (2008) was de vijfjaarsoverleving van stadium III coloncarcinoom patiënten beter, indien het mesocolon intact was met een resectieniveau ter hoogte van de mesocolische fascie (West, 2008). Echter, een andere studie laat zien dat bij sigmoidresecties het door de patholoog vastgestelde resectievlak geen voorspellende waarde had met betrekking tot de oncologische uitkomst (Sakjah, 2022). Bovendien bestaat bij het beoordelen van het mesocolische vlak in colonresectiepreparaten een significante interobserver variabiliteit tussen pathologen (Munkedal, 2016). Mogelijk wordt dit veroorzaakt, doordat pathologen minder ervaring hebben met deze macroscopische beoordeling ten opzichte van de macroscopische beoordeling van totale mesorectale excisies.
Ondanks de beperkte evidence, wordt toch gekozen om de beoordeling van het chirurgische vlak in een oncologische colonresectiepreparaat in de richtlijn op te nemen. Al meer dan 10 jaar wordt getracht de oncologische uitkomsten van de chirurgische behandeling van coloncarcinoom net zoals het rectumcarcinoom te verbeteren door standaardisatie van de operatie (den Dulk, 2008). Complete mesocolische excisie (met centrale vasculaire ligatie) leidt tot significant betere oncologische uitkomsten (Seow-En, 2022). Een meetbaar substraat in het resectiepreparaat is van belang voor terugkoppeling aan de chirurg. Wanneer het resectieniveau structureel wordt beoordeeld, zal mogelijk de betrouwbaarheid van deze bepaling ook toenemen. Wel is het zo dat beoordelen van het niveau van resectie vooral relevant lijkt voor de colonsegmenten welke deels niet intraperitoneaal gelegen zijn, dat wil zeggen het colon ascendens, flexura hepatica, flexura lienalis en colon descendens. Bij resecties van het colon transversum en sigmoid, welke wel volledig intra-peritoneaal gelegen zijn en waarbij dus geen radiair dissectievlak te beoordelen is, zouden alleen eventuele defecten in het peritoneum van het mesenterium beoordeeld kunnen worden. Hiervoor bestaat geen bewezen relevantie en dit wordt in deze richtlijn niet overgenomen.
Uitgangsvraag 2. Dient het radiaire snijvlak te worden geïnkt?
De marge tot het circumferentiële snijvlak van rectumresectiepreparaten (CRM) is een sterke voorspeller van lokaal recidief en overleving, ook na neoadjuvante behandeling (Birbeck, 2002; Nagtegaal, 2008). De voorspellende waarde van een positief radiair snijvlak in colonresectiepreparaten is minder uitgebreid onderzocht. Volgens enkele retrospectieve studies was een positief radiair snijvlak in colonresecties gerelateerd aan een hogere kans op recidief (Amri, 2015; Scott, 2008; Bateman, 2005). Een positief radiair snijvlak komt volgens de landelijke registratie bij minder dan 5% van colon- en rectumresecties voor (Amri, 2015; jaarrapport DCRA 2019). Dit betreft voor colonresecties waarschijnlijk een onderschatting, omdat hierbij het radiaire snijvlak vaak niet routinematig wordt beoordeeld. Op basis van bovenstaande gegevens is microscopische beoordeling van de radiaire snijvlakken van zowel colon- als rectumresecties relevant. Wat betreft colonpreparaten is alleen bij resecties van het colon ascendens, flexura hepatica, flexura lienalis en colon descendens sprake van een relevant snijvlak, omdat deze deels niet intraperitoneaal gelegen zijn en alhier tezamen met de mesocolische fascie van het retroperitoneum worden los geprepareerd. Het identificeren van het radiaire snijvlak ter plaatse van het mesocolon transversum en mesocolon sigmoideum is niet aangetoond relevant. Deze is doorgaans op ruime afstand van de tumor en wordt ook niet standaard microscopisch onderzocht.
Het inkten van de radiaire snijvlakken helpt bij het betrouwbaar vaststellen van het reële snijvlak bij microscopisch onderzoek. Bij colonpreparaten kan worden volstaan met het inkten van het radiaire snijvlak ter hoogte van de tumor, zonder dit gehele vlak te inkten. Dit is in overeenstemming met de internationale richtlijnen.
Uitgangsvraag 3. Dienen de transversale darmresectievlakken aan het proximale en distale uiteinde ingesloten te worden indien deze macroscopisch vrij van tumor zijn?
Voor een succesvolle oncologische operatie dient de maligniteit radicaal met tumorvrije resectiemarges verwijderd te zijn. Op basis van retrospectieve data leidt een tumorpositief proximaal of distaal resectievlak van een colorectale resectie tot een verhoogd recidiefrisico (Floyd, 1966; Rocha, 2016; Zeng, 2017). De vraag is of microscopisch onderzoek van macroscopisch vrije marges noodzakelijk is. In hoeverre is de macroscopische beoordeling van de transversale resectievlakken betrouwbaar? Daarnaast rijst dezelfde vraag met betrekking tot het microscopisch onderzoek van de donuts (weefselringen afkomstig van de aanvoerende en afvoerende darmlis, welke in de stapler achterblijven), indien een anastomose aangelegd wordt (meestal bij linkszijdige resecties).
Op basis van de beschreven retrospectieve studies kan geconcludeerd worden dat in 1-1,5% van de colorectale resectiepreparaten tumorpositieve transversale resectievlakken gevonden worden, waarvan de helft macroscopisch wordt herkend. Voor donuts is het percentage maligniteit minder dan 1% (zoals beschreven in de samenvatting van de meta-analyses). Een coloncarcinoom kan 1,2-2,0 cm microscopisch uitbreiden zonder dat dit macroscopisch zichtbaar is (Hughes, 1983; Parfitt, 2007). Daarbij dient opgemerkt te worden dat in studies naar microscopische tumoruitbreiding verschillende momenten van meting gehanteerd werden, terwijl vanaf het moment dat het preparaat verwijderd wordt tot na fixatie in verschillende fases weefselkrimp plaats vindt tot maar liefst 45% (Sternberg, 2008).
Op basis van bovenstaande kan om werk en kosten te besparen ervoor gekozen worden om af te zien van het routinematig insluiten van beide transversale snijvlakken van een colonpreparaat en in plaats daarvan alleen het dichtstbijzijnde snijvlak in te sluiten. Wij bevelen aan om het dichtstbijzijnde snijvlak in elk geval wel routinematig in te sluiten om te voorkomen dat in tweede instantie dit materiaal extra ingesloten moet worden (zie de samenvatting van de richtlijn van de College of American Pathologists). Bovendien kan het dichtstbijzijnde transversale snijvlak dienen als een coupe door normaal colonslijmvlies, welke sowieso uitgenomen dient te worden. In geval van een coloncarcinoom dat ontstaan is in het kader van inflammatoire darmziekte (IBD) dienen beide transversale snijvlakken ingesloten te worden om aanwezigheid van ontsteking en dysplasie in de snijvlakken te kunnen beoordelen, zoals de CAP (College of American Pathologists) adviseert.
Omdat een rectumcarcinoom zich tot 5 cm distaal in het mesorectum kan uitbreiden, wordt geadviseerd bij een partiële of totale mesorectal excisie het distale resectievlak routinematig in te sluiten (Grüter, 2022). Indien het proximale snijvlak niet het dichtst bij de tumor gelegen is kan ervoor gekozen worden om deze niet in te sluiten.
Er is onvoldoende bewijs voor het insluiten van donuts. Deze dienen alleen ingesloten te worden als de tumor macroscopisch of microscopisch reikt tot aan het transversale snijvlak.
Uitgangsvraag 4. Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag aan te geven?
Wat de marges tot de transversale snijvlakken betreft, is het chirurgisch van belang dat de snijvlakken tumorvrij zijn. Klinisch is de lengte van de marge niet gerelateerd aan recidiefrisico of overleving (Kiran, 2011; Bujiko, 2012). Met betrekking tot de distale marge van het rectumcarcinoom is er wel een retrospectieve cohortstudie, waarin een slechtere uitkomst werd gezien van tumoren met een distale marge van minder dan 1 mm ten opzichte van marges van 1 mm en groter (Zeng, 2017). In overeenstemming hiermee houdt de Nederlandse kwaliteitsregistratie door de DCRA een tumorvrije marge van 1 mm aan. Omdat microscopische uitbreiding in het mesorectum voorkomt, wordt in geval van een partiële mesorectale excisie (PME), waarbij een deel van het mesorectum behouden blijft, een distale marge van 5,0 cm geadviseerd (Parfitt, 2006). Omdat het tijdens macroscopische beoordeling bij suboptimale klinische gegevens in de aanvraag niet altijd duidelijk is of het preparaat een totale mesorectale excisie (TME) of een PME betreft, kan de lengte van de distale marge bij rectumresecties relevant zijn, ook als deze langer is dan 1,0 cm. Dit is in overeenstemming met de richtlijn van de CAP (College of American Pathologists; Guideline Colon and Rectum resection v4.2.0.2). In geval van een colonresectie zijn de marges doorgaans ruimer. Hoewel de ESMO (European Society for Medical Oncology) een marge van tenminste 5,0 cm beiderzijds adviseert, is hier geen evidence voor en zijn er verder geen chirurgische afspraken over na te streven marges (Argilés, 2020).
Het is goed inpasbaar in de praktijk om tijdens de macroscopische beoordeling van zowel rectum- als colonresecties de afstand tot het dichtstbijzijnde transversale snijvlak op te meten en vast te leggen. In het geval van een rectumresectie zal dit vaak de distale marge betreffen.
Tot slot is het van belang bewust te zijn van de continue krimp van resectiepreparaten vanaf het moment van uitname tot na de fixatie wat de lengte van de gemeten marges kan beïnvloeden (Sternberg, 2008).
Uitgangsvraag 5. Wanneer wordt een snijvlak als positief beschouwd en hoe wordt hierbij omgegaan met: a. Tumor; b. Tumordepositie of tumorpositieve lymfklier; c. (Lymf)angio-invasie; d. Perineurale groei; e. Acellulair slijm met/zonder neoadjuvante therapie.
Wat betreft het circumferentiële snijvlak (CRM) van een totale mesorectale excisie (TME) zijn de internationale richtlijnen eenduidig: wanneer de tumor op afstand van 1 mm of minder van het snijvlak wordt aangetroffen, wordt dit als tumorpositief beschouwd, omdat dit gepaard gaat met een aanzienlijk verhoogd risico op lokaal recidief. Dit wordt ondersteund door de studies, welke in de bovenstaande paragrafen beschreven zijn. Bovendien blijkt uit deze studies dat de afstand tot het snijvlak ook van invloed is op de prognose, zelfs wanneer deze meer dan 1 mm bedraagt. Op basis hiervan wordt aanbevolen om de CRM bij rectumcarcinomen precies tot op de millimeter te vermelden.
Voor de distale marge van een TME is slechts één studie bekend (Zeng, 2017). Deze rechtvaardigt een grenswaarde van 1 mm.
Er zijn geen gegevens beschikbaar voor de overige transversale snijvlakken van colorectale resecties en het radiaire snijvlak van colonresecties. In de kwaliteitsregistratie van de DCRA (Dutch ColoRectal Audit) wordt een marge van 1 mm of minder ook in deze situaties als tumorpositief beschouwd. In deze richtlijn is ervoor gekozen dit over te nemen en dezelfde afkapwaarde te hanteren voor alle resectievlakken.
Behalve directe betrokkenheid van de primaire tumor in het snijvlak, bestaat wat betreft de vorm van betrokkenheid van het snijvlak geen consensus. Zoals hierboven beschreven gaan de internationale richtlijnen wisselend om met tumorpositieve lymfklieren (met of zonder kapseldoorbraak), tumordeposities, (lymf)angio-invasie en perineurale groei in het snijvlak. Hierover zijn weinig data bekend. Op basis van de studie van Birbeck et al. concluderen we dat het snijvlak bij betrokkenheid van de primaire tumor zelf, discontinue tumorgroei in de vorm van tumordeposities, (lymf)angio-invasie, perineurale groei en tumorpositieve lymfklieren als tumorpositief kan worden beschouwd (Birbeck, 2002). Het recidiefpercentage in deze laatste groep was slechts 10,5 %. Echter volgens de richtlijnen van de NCCN (National Comprehensive Cancer Network), RCPath (Royal College of Pathologists), GGPO (German Guideline Program in Oncology) en ICCR (bij kapseldoorbraak; International Collaboration on Cancer Reporting) wordt deze vorm van tumorpositief snijvlak wel meegenomen (Guideline Rectum Version 4.2022; G049 Dataset for histopathological reporting of colorecal carcinoma; Evidence-based Guideline for Colorectal Cancer Version 2.1 2019; Loughrey, 2022). Gezien de beperkte hoeveelheid data adviseren wij in deze richtlijn om in geval van een alternatieve vorm van betrokkenheid van het snijvlak dit specifiek te vermelden en daarnaast ook de afstand van het snijvlak tot de bulk van de tumor vast te leggen.
Over de aanwezigheid van acellulaire slijmmeren in het snijvlak worden in de internationale richtlijnen geen uitspraken gedaan en er zijn verder weinig data uit studies bekend. Volgens de UICC (Union of International Cancer Control) worden slijmmeren met tumorcellen als onderdeel van de tumor beschouwd. Echter, als er geen tumorcellen in de slijmmeren aanwezig zijn, worden het T-stadium en het N-stadium niet beïnvloed, wanneer er neoadjuvante therapie gegeven is (Amin, 2016). Er zijn onvoldoende gegevens om te concluderen of het risico op recidief door acellulair slijm in het snijvlak verhoogd wordt. Omwille van de uniformiteit wordt het advies met betrekking tot acellulaire slijmmeren na neoadjuvante therapie bij de beoordeling van de snijvlakken overgenomen.
Onderbouwing
Achtergrond
In navolging van de introductie van totale mesorectale excisie (TME) voor rectumcarcinoom, waarbij het aantal recidieven significant verlaagd is, is ook complete mesocolische excisie (CME) inmiddels de standaardoperatie voor coloncarcinoom (Heald, 1995; Seow-En, 2022). Bij beide operatietechnieken is de essentie dat de tumor, tezamen met zowel de regionale lymfklieren, waarop de tumor draineert, als vaten (lymfvaten en bloedvaten) in een intact, door fascie of peritoneum bekleed preparaat verwijderd wordt. De introductie van genoemde operatietechnieken impliceert bepaalde voorwaarden voor de beoordeling van het preparaat door de patholoog. Het vaststellen van het niveau van de resectie is niet alleen een terugkoppeling met betrekking tot de kwaliteit van de operatie, maar ook een prognostische parameter (Bosch, 2012; West 2008). De beoordeling van de kwaliteit (niveau van resectie) van TME en vooral CME preparaten wisselt sterk (Munkedal, 2016). In deze module komen de standaarden aan bod van de beoordeling van de chirurgische kwaliteit. Bovendien rijzen er in de dagelijkse praktijk vragen met betrekking tot het beoordelen van de radicaliteit van deze preparaten. Met macroscopisch ruime marges aan de proximale en distale darmuiteinden wordt bijvoorbeeld wisselend omgegaan: is het zinvol om deze in te sluiten voor microscopisch onderzoek? Bij microscopie van de snijvlakken worden ook vragen opgeroepen wanneer van tumorpositieve lymfklieren, tumor deposities, perineurale groei, (lymf)angio-invasie, of alleen slijm in de nabijheid van het resectievlak sprake is. Deze module gaat in op de betekenis hiervan en op de grenswaarde van de marge voor een tumorpositief snijvlak.
Bij uitgebreide multiviscerale resecties dient de status van de resectievlakken van extra verwijderde organen of anatomische structuren beoordeeld en vastgelegd te worden. Hierover is in deze module geen vraagstelling opgesteld.
Deze module beslaat niet de beoordeling van lokale resecties (zoals onder andere poliepectomie, TEM, ESD, EID; zie hiervoor module 4.7 ‘Histologische riscofactoren bij T1 CRC’).
Definities van termen in deze module
Transversale snijvlakken: met deze snijvlakken worden de snijvlakken aan de proximale en distale uiteinden van de darm bedoeld, welke door de patholoog (meestal) dwars op de lengterichting van de darm worden uitgenomen. Deze snijvlakken worden vaak de mucosale snijvlakken genoemd, hoewel het transmurale snijvlakken betreffen.
Radiaire snijvlak: met dit diepe snijvlak wordt in geval van een rectumresectie het circumferentiële snijvlak (CRM) bedoeld. In geval van een colonresectie wordt het snijvlak richting het retroperitoneum ter plaatse van het colon ascendens, flexura hepatica, flexura lienalis en colon descendens bedoeld. Dit wordt ook wel het mesocolische snijvlak genoemd, hoewel hiermee soms juist het snijvlak ter plaatse van de vasculaire ligatie wordt aangegeven. Daarnaast wordt het radiaire snijvlak van het deels niet intraperitoneaal gelegen colon (vaak omschreven als “deels retroperitoneaal gelegen”) ook aangeduid als dissectie- of klievingsvlak in plaats van snijvlak.
Mesocolon en mesorectum: het vetcompartiment van het distale deel van de tractus digestivus, waarin zowel de regionale lymfklieren als de aan-/afvoerende vaten zijn gelegen, heeft verschillende namen afhankelijk van de lokalisatie. Voor de dunne darm, appendix, colon en rectum beginnen deze namen met “mes-“ en heten respectievelijk in het volwassen lichaam mesenterium, mesoappendix, mesocolon en mesorectum. Mesenterium wordt soms ook voor het mesocolon gebruikt, met name i.p.v. de formelere terminologie mesocolon transversum en mesocolon sigmoideum voor de onderdelen colon transversum en sigmoideum. Ter voorkoming van verwarring met het mesenterium van de dunne darm wordt het gebruiken van mesocolon voor het gehele “meso” van het colon, conform ook anatomische terminologie, aangeraden.
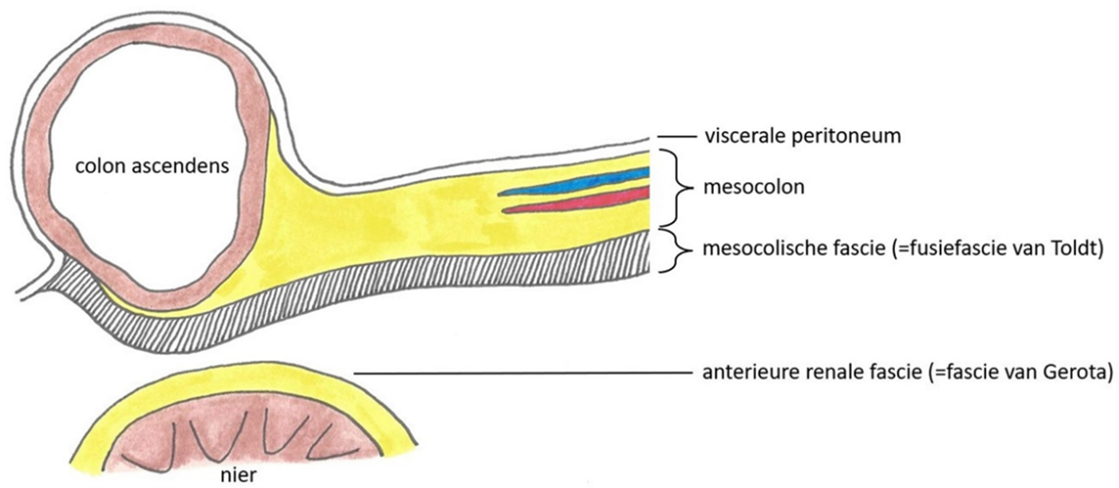
Mesocolische fascie: het losmazige bindweefsel op de plaats waar het viscerale peritoneum van het mesocolon gefuseerd is met het parietale peritoneum van het retroperitoneum. Dit wordt ook wel de fusiefascie van Toldt genoemd. Dorsaal hiervan bevindt zich ter plaatse van de nier de anterieure renale fascie, meestal de fascie van Gerota genoemd (Wedel, 2023; zie figuur 1).
Figuur 1. (M.M. Lange,2023)
Mesorectale fascie: het losmazige bindweefsel rondom het mesorectum, ook wel de viscerale pelviene fascie genoemd. Deze fascie is analoog aan de mesocolische fascie. De mesorectale fascie wordt vaak als MRF afgekort. Het is belangrijk te beseffen dat MRF en CRM niet hetzelfde is. MRF is een anatomisch structuur terwijl CRM een technisch begrip is, dat wil zeggen het radiaire snijvlak van een resectiepreparaat, gemaakt door de chirurg, en kan zich in de verschillende lagen/compartimenten bevinden.
Samenvatting literatuur
Samenvatting van internationale richtlijnen en consensusdocumenten
Uitgangsvraag 1a. Volgens welke standaard dient de kwaliteit van totale mesorectale excisie (TME) voor rectumcarcinoom beoordeeld te worden?
De internationale richtlijn van ESMO (European Society for Medical Oncology) schrijft voor dat de kwaliteit van het TME preparaat in verse toestand wordt beoordeeld en gefotografeerd (Glynne-Jones, 2017; Argilés, 2020). Volgens genoemde richtlijn dient bij deze kwaliteitscontrole de compleetheid van de mesorectale excisie en/of het niveau van de resectie bepaald te worden. Beiden kunnen volgens drie graden (Tabel 1) geclassificeerd worden. Dit fungeert als kwaliteitscontrole en heeft een voorspellende waarde voor recidief en overleving. Zodoende kan het ook gebruikt worden als surrogaat parameter voor oncologische uitkomsten. De kwaliteit van TME wordt beïnvloedt door T-stadium, tumorhoogte ten opzichte van de anus, leeftijd, body mass index (BMI), type chirurgie (low anterior resectie versus abdominoperineale resectie) en volume van chirurgische resecties van de betreffende chirurg (Garlipp, 2012; Bosch, 2012).
Tabel 1. Beoordeling kwaliteit van totale mesorectale excisie (TME) voor rectumcarcinoom
|
Niveau van resectie (Quirke, 2009) |
Omschrijving |
|
Chirurgisch vlak aan de buitenzijde van de viscerale mesorectale fascie |
Intact mesorectum met slechts minimale onregelmatigheden van het gladde mesorectale oppervlak; geen defecten dieper dan 5 mm; geen “coning” (taps toelopen van het preparaat richting distaal |
|
Intramesorectaal chirurgisch vlak |
Redelijke hoeveelheid mesorectum aanwezig maar met onregelmatigheden van het mesorectale oppervlak; matige distale “coning”; geen muscularis mucosa zichtbaar |
|
Chirurgisch vlak in de muscularis propria |
Weinig mesorectale massa met defecten tot in de muscularis propria |
In de Verenigde Staten onderschrijven zowel de CAP (College of American Pathologists) als het NCCN (National Comprehensive Cancer Network) het belang van kwaliteitscontrole volgens dezelfde methode, waarin de compleetheid van de resectie van het mesorectum door middel van drie graden gescoord wordt (Guideline Colon and Rectum resection v4.2.0.2.; Guideline Rectum Version 4.2022). Hierbij wordt opgemerkt dat het minst goede oppervlak van het resectiepreparaat leidend is voor de score.
De richtlijn in het Verenigd Koninkrijk van RCPath (Royal College of Pathologists) beschrijft dezelfde methode, waarbij over de bepaling van het niveau van de resectie in plaats van compleetheid of kwaliteit van de mesorectale excisie gesproken wordt (G049 Dataset for histopathological reporting of colorectal carcinoma). Hierbij wordt verwezen naar een publicatie, waarin voorbeeldfoto’s van de drie categorieën getoond worden (Quirke, 2007). In deze richtlijn wordt in geval van een abdominoperineale resectie (APR) ook aanbevolen het niveau van de resectie caudaal van het mesorectum rondom het anale kanaal te bepalen, onderverdeeld in drie niveau’s (Tabel 2; Moran, 2014). In de Duitse richtlijn (German Guideline Program in Oncology) zijn deze adviezen overgenomen (Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019).
Tabel 2. Beoordeling van het niveau van resectie ter plaatse van het anale deel van een abdominoperineale resectie (APR)
|
Niveau van resectie |
Omschrijving |
|
Extralevator |
Het chirurgische vlak ligt buiten de levator ani spieren. Deze zijn en bloc verwijderd tezamen met het mesorectum en het anale kanaal. Dit resulteert in een cylindrisch gevormd resectiepreparaat. Er zijn geen significante defecten in de sfincter of levator spieren. |
|
Sfincterisch |
Er is geen levator spier of slechts een smalle spierkoker aanwezig. Het buitenoppervlak wordt gevormd door de sfincter spieren. Het preparaat toont hierdoor een versmalling. Er zijn geen defecten in de sfincter. |
|
Intrasfincterisch/submucosaal/perforatie |
Er is een chirurgisch defect in de sfincter spier of zelfs tot dieper in de submucosa. Ook preparaten met perforaties behoren tot deze categorie. |
De overkoepelende ICCR (International Collaboration on Cancer Reporting) adviseert de beoordeling van het niveau van resectie ter plaatse van het mesorectum als verplicht item in de rapportage door de patholoog. Beoordeling van het resectieniveau ter plaatse van het anale deel in geval van een APR wordt vooralsnog niet voor de dagelijkse praktijk aanbevolen (Loughrey, 2022).
Uitgangsvraag 1b. Volgens welke standaard dient de kwaliteit van een oncologische colonresectie beoordeeld te worden?
De internationale richtlijn van de ICCR (International Collaboration on Cancer Reporting) adviseert het beoordelen van het niveau van de oncologische colonresectie, analoog aan de methode van het rectum, in drie graden (tabel 3; Loughrey, 2022). In Duitsland hanteert de GGPO (German Guideline Program in Oncology) hetzelfde advies (Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019).
Tabel 3. Beoordeling van het niveau van een colonresectie
|
Niveau van resectie |
Omschrijving |
|
Mesocolische fascie |
Intacte mesocolische fascie en/of serosa zonder defecten van >5 mm diep. |
|
Intramesocolisch |
Onregelmatig mesocolisch oppervlak met defecten van >5 mm diep, echter niet reikend tot in de muscularis propria. |
|
Muscularis propria |
Defecten in het mesocolon reikend tot aan/in de muscularis propria. |
In de internationale richtlijn van ESMO (European Society for Medical Oncology) wordt geen aanbeveling gedaan betreffende de evaluatie van de kwaliteit van oncologische colonresecties (Argilés, 2020). In de richtlijnen in de Verenigde Staten van zowel de CAP (College of American Pathologists) als het NCCN (National Comprehensive Cancer Network) en deze in het Verenigd Koninkrijk van de RCPath (Royal College of Pathologists) worden hier ook geen uitspraak over gedaan (Guideline Colon and Rectum resection v4.2.0.2.; Guideline Colon Version 3.2022; G049 Dataset for histopathological reporting of colorectal carcinoma).
Uitgangsvraag 2. Dient het radiaire snijvlak te worden geïnkt?
De (inter)nationale richtlijnen van GGPO (German Guideline Program in Oncology), ICCR (International Collaboration on Cancer Reporting), ESMO (European Society for Medical Oncology), CAP (College of American Pathologists), NCCN (National Comprehensive Cancer Network) en RCPath (Royal College of Pathologists) schrijven unaniem voor dat de circumferentiële resectiemarge (CRM) in rectumresecties vastgesteld moet worden (Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019; Loughrey, 2022; Argilés, 2020; Guideline Colon and Rectum resection v4.2.0.2; Guideline Rectum Version 4.2022; G049 Dataset for histopathological reporting of colorectal carcinoma). Volgens de ESMO, NCCN en RCPath richtlijnen dient ook in colonresectiepreparaten de radiaire marge onderzocht te worden (Guideline Colon Versions 3.2022).
In enkele richtlijnen wordt het inkten van de relevante snijvlakken ten behoeve van deze beoordeling opgevoerd. In de Amerikaanse richtlijn van de CAP wordt het inkten van colorectale preparaten, waar geen peritoneale bekleding aanwezig is, geadviseerd. Bij het rectum betreft dat het circumferentiële resectievlak (CRM). Bij het colon betreft dat het radiaire snijvlak ter plaatse van het colon ascendens, flexura hepatica, flexura lienalis en colon descendens. Geadviseerd wordt om het deel, dat het dichtst bij de tumor is gelegen, te inkten. Daarnaast is volgens de CAP strikt genomen het transversale mesocolische snijvlak ter plaatse van de vaatsteel ook een radiair snijvlak, waarbij geen advies wordt gegeven over het inkten hiervan.
Door de RCPath wordt aanbevolen om de radiaire snijvlakken van zowel colon- als rectumpreparaten te inkten. De NCCN adviseert alleen bij rectumpreparaten het circumferentiële snijvlak te inkten en geeft over colonresecties wat dit betreft geen advies.
Uitgangsvraag 3. Dienen de transversale resectievlakken aan het proximale en distale darmuiteinde ingesloten te worden, indien deze macroscopisch vrij van tumor zijn?
Hoewel in alle richtlijnen van GGPO (German Guideline Program in Oncology), ICCR (International Collaboration on Cancer Reporting), ESMO (European Society for Medical Oncology), CAP (College of American Pathologists), NCCN (National Comprehensive Cancer Network) en RCPath (Royal College of Pathologists) aangeven wordt dat de status van de proximale en distale snijvlakken vastgelegd moet worden, wordt alleen door de RCPath aangegeven of macroscopisch vrije snijvlakken door middel van microscopisch onderzoek bevestigd moeten worden (Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019; Loughrey, 2022; Argilés, 2020; Guideline Colon and Rectum resection v4.2.0.2; Guideline Rectum Version 4.2022; Guideline Colon Version 3.2022; G049 Dataset for histopathological reporting of colorectal carcinoma). In de richtlijn van de RCPath wordt het insluiten van de transversale snijvlakken alleen geadviseerd, als de tumor macroscopisch binnen 30 mm van het snijvlak is gelegen. Er worden echter enkele uitzonderingen genoemd, waarbij zowel het proximale als distale uiteinde ingesloten moet worden, ongeacht de macroscopische marge: uitzonderlijk infiltratieve groeiwijze, uitgebreide (lymf)angio-invasie, zegelringcelcarcinoom, hooggradig neuroendocrien of ongedifferentieerd carcinoom. In deze situaties is het daardoor dus volgens RCPath nodig om in tweede instantie naar aanleiding van het microscopische onderzoek beide uiteinden in te sluiten. Indien donuts zijn aangeleverd, dienen deze volgens RCPath alleen ingesloten te worden, wanneer de tumor macroscopisch tot aan het transversale snijvlak reikt. Daarnaast adviseert de CAP in geval van colorectaal carcinoom bij patiënten met inflammatoire darmziekte (IBD) het proximale en distale uiteinde voor microscopisch onderzoek in te sluiten om de aanwezigheid van ontsteking of dysplasie in de snijvlakken vast te leggen.
Uitgangsvraag 4. Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag aan te geven?
De richtlijnen van ESMO (European Society for Medical Oncology), NCCN (National Comprehensive Cancer Network) en GGPO (German Guideline Program in Oncology) vereisen dat de proximale en distale marges standaard vastgelegd worden (Argilés, 2020; Guideline Rectum Version 4.2022; Guideline Colon Version 3.2022; Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019). Volgens de ICCR (International Collaboration on Cancer Reporting) is het noodzakelijk om bij een marge onder de 1 mm tot op de tiende millimeter precies te zijn, en bij een marge onder de 10 mm tot op de millimeter nauwkeurig (Loughrey, 2022). De RCPath (Royal College of Pathologists) stelt dat het vastleggen van de dichtstbijzijnde transversale marge voldoende is (G049 Dataset for histopathological reporting of colorectal carcinoma). In de richtlijn van de CAP (College of American Pathologists) wordt dit ondergeschreven, waarbij aangegeven wordt dat bij een coloncarcinoom de exacte afmeting alleen vermeld hoeft te worden, indien deze kleiner is dan 10 mm (Guideline Colon and Rectum resection v4.2.0.2). De CAP adviseert echter wel om de afstand tot het distale snijvlak van een rectumcarcinoom standaard te vermelden en de proximale marge slechts dan, als deze het nauwst is.
Uitgangsvraag 5. Wanneer wordt een snijvlak als positief beschouwd en hoe wordt hierbij omgegaan met: a. Tumor; b. Tumordepositie of tumorpositieve lymfklier; c. (Lymf)angio-invasie; d. Perineurale groei; e. Acellulair slijm met/zonder neoadjuvante therapie.
In de (internationale) richtlijnen van GGPO (German Guideline Program in Oncology), ICCR (International Collaboration on Cancer Reporting), ESMO (European Society for Medical Oncology), CAP (College of American Pathologists), NCCN (National Comprehensive Cancer Network) en RCPath (Royal College of Pathologists) bestaat er concensus over de circumferentiële resectie marge (CRM) van een totale mesorectale excisie (TME; Evidenced-based Guideline for Colorectal Cancer Version 2.1 2019; Loughrey, 2022; Argilés, 2020; Guideline Colon and Rectum resection v4.2.0.2; Guideline Rectum Version 4.2022; Guideline Colon Version 3.2022; G049 Dataset for histopathological reporting of colorectal carcinoma). De CRM wordt beschouwd als tumorpositief, indien de marge 1 mm of kleiner is. Wat betreft de transversale snijvlakken van colorectale resecties wordt geen uitspraak met betrekking tot een afkapwaarde van 0 versus 1 mm gedaan. In het TNM-handboek van de UICC (Union of International Cancer Control) wordt ook voor de transversale snijvlakken dezelfde regel gehanteerd: het snijvlak is negatief indien de marge tenminste groter dan 1 mm is (Amin, 2016). Ook in de Nederlandse kwaliteitsregistratie door de DCRA (Dutch ColoRectal cancer Audit) wordt dezelfde regel aangehouden.
Bovenstaande betreft de afstand tot de tumor in de vorm van directe betrokkenheid van de primaire tumor. De richtlijnen hanteren verschillende benaderingen met betrekking tot tumorpositieve lymfklieren, tumordeposities, (lymf)angio-invasie en perineurale groei in of nabij het snijvlak (tot een afstand van één millimeter). De NCCN, RCPath, GGPO beschouwen het snijvlak als tumorpositief, indien hierin een tumorpositieve lymfklier gelegen is, waarbij de NCCN en de RCPath adviseren wel te specificeren dat een lymfkliermetastase de oorzaak is van de irradicaliteit. De ESMO en CAP adviseren een tumorpositieve lymfklier in het snijvlak te vermelden in het verslag, maar beschouwen dit niet als reden voor irradicaliteit. Wel dient volgens de ESMO postoperatieve radiotherapie overwogen te worden, indien extracapsulaire groei dichtbij de mesorectale fascie wordt gezien. De ICCR beoordeelt het snijvlak in deze situatie alleen als tumorpositief, indien de lymfkliermetastase kapseldoorbraak toont.
Tumordeposities in het snijvlak worden door de GGPO en RCPath als voldoende reden voor een tumorpositief snijvlak gezien. De ICCR geeft aan dat deze situatie apart beschreven dient te worden, omdat onzeker is wat de klinische consequentie is. In de overige richtlijnen wordt hierover geen advies gegeven.
(Lymf)angio-invasie kan volgens de richtlijnen van de GGPO en RCPath aanleiding voor een tumorpositief snijvlak zijn, waarbij volgens de RCPath wel gespecificeerd dient te worden dat dit niet door directe betrokkenheid van de tumor veroorzaakt is. In de richtlijn van de CAP is (lymf)angio-invasie onvoldoende om een tumorpositief snijvlak te veroorzaken. De ICCR geeft aan dat (lymf)angio-invasie in het snijvlak mogelijk het risico op lokaal recidief verhoogt, maar hierbij wordt geen advies gegeven hoe hiermee wordt omgegaan. De ESMO adviseert postoperatieve radiotherapie te overwegen, indien angio-invasie in de nabijheid van de mesorectale fascie wordt gezien.
Wat betreft perineurale groei in het snijvlak wordt alleen advies gegeven in de GGPO, waarbij dezelfde benadering als bij directe betrokkenheid van de tumor gehanteerd wordt. De ESMO adviseert om postoperatieve radiotherapie te overwegen, indien er perineurale groei in de buurt van de mesorectale fascie waargenomen wordt.
In de richtlijnen worden geen uitspraken gedaan met betrekking tot slijmmeren in het snijvlak. In het supplement TNM-handboek van de UICC wordt aangegeven dat tumorgroei in de vorm van slijmmeren alleen het T-stadium beïnvloedt, indien er geen neoadjuvante therapie is gegeven. Slijmmeren zonder tumorcellen na neoadjuvante therapie worden volgens de IUCC niet meegenomen in de stagering, dat wil zeggen als acellulair slijm tot in het snijvlak reikt na neoadjuvante therapie kan het snijvlak als tumorvrij worden geclassificeerd.
Samenvatting van systematische reviews en meta-analyses
Uitgangsvraag 1a. Volgens welke standaard dient de kwaliteit van totale mesorectale excisie (TME) voor rectumcarcinoom beoordeeld te worden?
In een meta-analyse van 12 studies met 3209 patiënten is de relatie tussen de kwaliteit van chirurgie bij rectumcarcinoom op de prognose van patiënten onderzocht (Bosch, 2012). Uit deze analyse bleek dat een incomplete totale mesorectale excisie (TME), waarbij het niveau van de resectie intra-mesorectaal of in de muscularis propria was, tot een hoger percentage lokaal recidieven leidde (RR 2.12). Indien het niveau van resectie in de muscularis propria was, werd een relatief risico van 2.72 op lokaal recidief en 1.84 op ziekteterugkeer in het algemeen gezien.
Uitgangsvraag 1b. Volgens welke standaard dient de kwaliteit van een oncologische colonresectie beoordeeld te worden?
Voor deze vraagstelling werden geen systematische reviews of meta-analyses gevonden.
Uitgangsvraag 2. Dient het radiaire snijvlak te worden geïnkt?
Voor deze vraagstelling werden geen systematische reviews of meta-analyses gevonden.
Uitgangsvraag 3. Dienen de transversale resectievlakken aan het proximale en distale darmuiteinde ingesloten te worden, indien deze macroscopisch vrij van tumor zijn?
Voor de vraag of de transversale resectievlakken ingesloten moeten worden voor microscopisch onderzoek werden geen systematische reviews gevonden. Wel zijn er twee systematische reviews gepubliceerd met betrekken tot het onderzoek van de donuts. Deze worden vaak aangeleverd door de chirurg na een operatie, waarbij de continuïteit door middel van een anastomose hersteld is. In een meta-analyse van 8 studies met 1754 patiënten werd in 0,29% een invasieve maligniteit in een van de donuts gevonden, waarbij niet beschreven is of het resectievlak hierbij ook tumorpositief was. In deze studie wordt geconcludeerd dat deze bevinding routinematig onderzoek van de donuts niet rechtvaardigt (Wlodarczyk, 2021). Een andere meta-analyse van 27 studies met 4368 onderzochte donuts kwam uit op 0,34% invasieve maligniteit in een donut en op basis van deze bevinding op 0,19% aanpassingen in het verdere beleid (Holden, 2022). Hierbij staat niet aangegeven hoe vaak het afgenomen proximale en distale resectievlak tumorpositief was en hoe dit zich tot de macroscopische beoordeling verhoudt. In 1,7% van de donuts werd een niet-maligne afwijking aangetroffen (zoals een divertikel, een adenoom met laaggradige dysplasie of ontsteking), hetgeen geen gevolgen voor het verdere beleid had.
Uitgangsvraag 4. Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag aan te geven?
Voor deze vraagstelling werden geen systematische reviews of meta-analyses gevonden.
Uitgangsvraag 5. Wanneer wordt een snijvlak als positief beschouwd en hoe wordt hierbij omgegaan met: a. Tumor; b. Tumordepositie of tumorpositieve lymfklier; c. (Lymf)angio-invasie; d. Perineurale groei; e. Acellulair slijm met/zonder neoadjuvante therapie.
In een systematische review en meta-analyse van meer dan 17500 patiënten wordt beschreven dat ten aanzien van de circumferentiële resectiemarge (CRM) in totale mesorectale excisie (TME) preparaten een marge van 1 mm of minder door de meeste studies als een tumorpositief snijvlak (Nagtegaal, 2008) gezien wordt. Het risico op een lokaal recidief neemt af naarmate de marge groter wordt en bij een marge van meer dan 1 mm is dit risico zeer klein. In deze meta-analyse werden zes vormen van aanwezigheid van tumor in het snijvlak gevonden: directe tumordoorgroei, discontinue tumoruitbreiding (tumordeposities), lymfkliermetastase, veneuze en lymfatische invasie en perineurale groei. In meer dan 30% van de patiënten was een combinatie van meerdere van deze vormen aanwezig.
Samenvatting van nationale data en populatiestudies
Uitgangsvraag 1a. Volgens welke standaard wordt de kwaliteit van totale mesorectale excisie (TME) voor rectumcarcinoom beoordeeld?
Voor deze vraagstelling werden geen nationale data of populatiestudies gevonden.
Uitgangsvraag 1b. Volgens welke standaard wordt de kwaliteit van een oncologische colonresectie beoordeeld?
Voor deze vraagstelling werden geen nationale data of populatiestudies gevonden.
Uitgangsvraag 2. Dient het radiaire snijvlak te worden geïnkt?
Voor deze vraagstelling werden geen nationale data of populatiestudies gevonden.
Uitgangsvraag 3. Dienen de transversale resectievlakken aan het proximale en distale darmuiteinde ingesloten te worden indien deze macroscopisch vrij van tumor zijn?
In enkele retrospectieve studies werd onderzocht wat de meerwaarde is van microscopisch onderzoek van de transversale resectievlakken bij colorectaal carcinoom (en soms ook van de donuts, indien deze door de chirurg na het aanleggen van een anastomose ingestuurd zijn). In een retrospectieve studie werden in 371 colorectale resectiepreparaten 5 tumorpositieve transversale resectievlakken gevonden, waarvan 4 resectievlakken al macroscopisch als tumorpositief werden beoordeeld en waarvan 1 een extramurale depositie betrof bij een patiënt met meerdere positieve lymfklieren (Cross, 1989). Andere bevindingen in de resectievlakken omvatten ontsteking en melanosis coli. In een tweede studie van 100 colorectale resectiepreparaten werd één tumorpositief transversaal resectievlak vastgesteld. Er werd echter niet aangegeven hoe dit resectievlak macroscopisch was beoordeeld. Daarnaast werden enkele goedaardige afwijkingen waargenomen, zoals een hyperplastische poliep, diverticulose en bestralingseffecten (Pullyblank, 2000). In deze studie werden ook de donuts onderzocht, waarbij 3 adenomen werden gevonden, naast andere uitsluitend goedaardige afwijkingen. In een andere studie van 336 resectiepreparaten waren zowel alle transversale resectievlakken als donuts vrij van tumor (Ng, 2014). Aan de hand van de grootste retrospectieve studie van 594 preparaten werd aangetoond dat er 7 tumorpositieve transversale resectievlakken waren (1,1%; Morlote, 2016). Van deze 7 tumorpositieve vlakken waren er 3 al macroscopisch als tumorpositief herkend. De overige 4 werden veroorzaakt door directe tumor betrokkenheid op 1,7 cm afstand van de macroscopisch zichtbare tumor bij een patiënt met gemetastaseerde ziekte, (lymf)angio-invasie op afstand van respectievelijk 6 en 7,5 cm van de tumor en door een extramurale depositie op 12,5 cm van de macroscopisch zichtbare tumor.
Uitgangsvraag 4. Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag aan te geven?
Voor deze vraagstelling werden geen nationale data of populatiestudies gevonden.
Uitgangsvraag 5. Wanneer wordt een snijvlak als positief beschouwd en hoe wordt hierbij omgegaan met: a. Tumor; b. Tumordepositie of tumorpositieve lymfklier; c. (Lymf)angio-invasie; d. Perineurale groei; e. Acellulair slijm met/zonder neoadjuvante therapie.
In een retrospectieve studie van 608 totale mesorectale exicise (TME) preparaten werd aangetoond dat bij een marge van 0-1 mm in vergelijking met een marge van >1mm een aanzienlijk verhoogd risico op lokaal recidief bestond (27,8 versus 10,0 procent). Verschillende vormen van betrokkenheid van het snijvlak, zoals (in)directe tumorgroei, perineurale groei, (lymf)angio-invasie en lymfkliermetastase werden in deze patiëntengroep beschreven (Birbeck, 2002). De specifieke vorm van betrokkenheid van de tumor in het snijvlak had in deze studie geen significante invloed op de kanker-specifieke overleving. Echter, het risico op lokaal recidief was het hoogst bij directe tumor betrokkenheid en (lymf)angio-invasie in het resectievlak, terwijl een lymfkliermetastase in het snijvlak opmerkelijk genoeg met weinig recidieven gecorreleerd was.
Uit een analyse van 1318 patiënten in de Nederlandse TME-studie blijkt eveneens dat het risico op lokaal recidief bij een marge van 1 mm of minder verhoogd is, namelijk 13,1% vergeleken met 8,5% bij een marge van 1-2 mm en 3,3% bij een marge van >2 mm (Nagtegaal, 2002). In deze studie werden lymfkliermetastasen op een afstand van 1 mm of minder van de circumferentiële resectiemarge (CRM) als positieve snijvlakken beschouwd. De specifieke invloed hiervan werd echter niet gerapporteerd.
In een retrospectieve studie van 686 rectumcarcinoom patiënten werd een recidiefpercentage van 22% gevonden bij een positieve CRM versus 5% bij een CRM van >1 mm (Wibe, 2002). In deze studie kon de CRM positief zijn door de primaire tumor zelf en ook door tumordeposities. Een aparte analyse van de invloed van de specifieke vorm van snijvlak betrokkenheid werd niet gerapporteerd.
Wat betreft de distale marge werd in een retrospectieve studie van 6574 patiënten, die een low anterior resectie (LAR) ondergingen, aangetoond dat een marge van 0-1 mm, waarbij geen tumor in het vlak zelf aanwezig is, een sterk verhoogd risico op lokaal recidief oplevert (24%), vergeleken met een distale marge van meer dan 1 mm (12%) (Zeng, 2017). Hierin wordt niet gespecificeerd welke vormen van betrokkenheid van het snijvlak zijn meegenomen.
Acellulair slijm na neoadjuvante therapie wordt niet meegenomen in het T stadium, zoals beschreven door de UICC (Union of International Cancer Control; Amin, 2016). Het meenemen van acellulair slijm na neoadjuvante therapie beïnvloedt volgens een retrospectieve studie de prognose niet (Shia, 2011). Weinig studies zijn gedaan naar de invloed van acellulaire slijmmeren in het snijvlak. In een retrospectieve studie met 12 patiënten, bij wie acellulair slijm na neoadjuvante therapie in het circumferentiële snijvlak of distale snijvlak van een TME preparaat gezien werd, werd gerapporteerd dat 2 patiënten een lokaal recidief ontwikkelden (Ingle, 2019). De auteurs concludeerden hiermee dat de aanwezigheid van acellulair slijm in het snijvlak het recidiefrisico in deze voorbehandelde patiëntengroep niet verhoogt, maar benadrukten dat de studie te klein was om definitieve conclusies te trekken.
Zoeken en selecteren
Uitkomstmaten
- Prognostische waarde van kwaliteitsbeoordeling (bepaling resectieniveau).
- Uniformiteit in het beoordelen van het niveau van de resectie.
- Accuratesse en reproduceerbaarheid van beoordeling radicaliteit.
- Tumorpositieve transversale snijvlakken bij macroscopisch vrije marge van 1,0 cm of groter.
Uitgangsvragen
1a. Volgens welke standaard dient de kwaliteit van een totale mesorectale excisie (TME) voor rectumcarcinoom beoordeeld te worden?
1b. Volgens welke standaard dient de kwaliteit van een oncologische colonresectie beoordeeld te worden?
2. Dient het radiaire snijvlak te worden geïnkt?
3. Dienen de transversale darmresectievlakken aan het proximale en distale uiteinde ingesloten te worden, indien deze macroscopisch vrij van tumor zijn?
4. Is het voldoende om een ruime tumorvrije marge tot het proximale of distale uiteinde van het darmpreparaat als 1,0 cm of groter zonder een precieze afmeting in het verslag te vermelden?
5a. Wanneer wordt een snijvlak als tumorpositief beschouwd?
5b. Wordt een snijvlak als tumorpositief beschouwd, indien hierin een tumordepositie of tumorpositieve lymfklier aanwezig is?
5c. Wordt een snijvlak als tumorpositief beschouwd, indien hierin (lymf)angio-invasie aanwezig is?
5d. Wordt een snijvlak als tumorpositief beschouwd, indien hierin perineurale groei aanwezig is?
5e. Wordt een snijvlak als tumorpositief beschouwd, indien acellulair slijm aanwezig is? Hoe wordt hiermee omgegaan als neoadjuvante therapie toegepast is?
De vraagstellingen in deze module werden door middel van systematisch literatuur onderzoek beantwoord.
Referenties
- Amin MB, Edge SB, Greene FL, Byrd DR, Brookland RK, Washington MK, Gershenwald JE, Compton CC, Hess KR, Sullivan DC (2016) AJCC cancer staging manual. Springer International Publishing
- Amri R, Bordeianou LG, Sylla P, Berger DL. Association of Radial Margin Positivity With Colon Cancer. JAMA Surg. 2015 Sep;150(9):890-8. doi: 10.1001/jamasurg.2015.1525. PMID: 26132363.
- Argilés G, Tabernero J, Labianca R, Hochhauser D, Salazar R, Iveson T, Laurent-Puig P, Quirke P, Yoshino T, Taieb J, Martinelli E, Arnold D; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020 Oct;31(10):1291-1305. doi: 10.1016/j.annonc.2020.06.022. Epub 2020 Jul 20. PMID: 32702383.
- Bateman AC, Carr NJ, Warren BF. The retroperitoneal surface in distal caecal and proximal ascending colon carcinoma: the Cinderella surgical margin? J Clin Pathol. 2005;58:426-428.
- Birbeck KF, Macklin CP, Tiffin NJ, Parsons W, Dixon MF, Mapstone NP, Abbott CR, Scott N, Finan PJ, Johnston D, Quirke P. Rates of circumferential resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg. 2002 Apr;235(4):449-57. doi: 10.1097/00000658-200204000-00001. PMID: 11923599; PMCID: PMC1422458.
- Bosch SL, Nagtegaal ID. The Importance of the Pathologist's Role in Assessment of the Quality of the Mesorectum. Curr Colorectal Cancer Rep. 2012 Jun;8(2):90-98. doi: 10.1007/s11888-012-0124-7. Epub 2012 Mar 27. PMID: 22611342; PMCID: PMC3343235.
- Bujko K, Rutkowski A, Chang GJ, Michalski W, Chmielik E, Kusnierz J. Is the 1-cm rule of distal bowel resection margin in rectal cancer based on clinical evidence? A systematic review. Ann Surg Oncol. 2012 Mar;19(3):801-8. doi: 10.1245/s10434-011-2035-2. Epub 2011 Aug 31. PMID: 21879269; PMCID: PMC3278608..
- Cross SS, Bull AD, Smith JH. Is there any justification for the routine examination of bowel resection margins in colorectal adenocarcinoma? J Clin Pathol. 1989 Oct;42(10):1040-2. doi: 10.1136/jcp.42.10.1040. PMID: 2584404; PMCID: PMC501860.
- den Dulk M, van de Velde CJ. Time to focus on the quality of colon-cancer surgery. Lancet Oncol. 2008 Sep;9(9):815-7. doi: 10.1016/S1470-2045(08)70216-X. PMID: 18760238.
- Floyd CE, Stirling CT, Cohn I Jr. Cancer of the colon, rectum and anus: review of 1,687 cases. Ann Surg. 1966 Jun;163(6):829-37. doi: 10.1097/00000658-196606000-00003. PMID: 5933797; PMCID: PMC1477028.
- Garcia-Granero E, Faiz O, Munoz E, Flor B, Navarro S, Faus C et al. Macroscopic assessment of mesorectal excision in rectal cancer: a useful tool for improving quality control in a multidisciplinary team. Cancer 2009;115:3400-3411.
- Garlipp B, Ptok H, Schmidt U et al. Factors influencing the quality of total mesorectal excision. Br J Surg 2012; 99: 714-720.
- Glynne-Jones R, Wyrwicz L, Tiret E, Brown G, Rödel C, Cervantes A, Arnold D; ESMO Guidelines Committee. Rectal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl_4):iv22-iv40. doi: 10.1093/annonc/mdx224. Erratum in: Ann Oncol. 2018 Oct 1;29(Suppl 4):iv263. PMID: 28881920.
- Grüter AAJ, van Lieshout AS, van Oostendorp SE, Ket JCF, Tenhagen M, den Boer FC, Hompes R, Tanis PJ, Tuynman JB. Required distal mesorectal resection margin in partial mesorectal excision: a systematic review on distal mesorectal spread. Tech Coloproctol. 2023 Jan;27(1):11-21. doi: 10.1007/s10151-022-02690-1. Epub 2022 Aug 29. PMID: 36036328; PMCID: PMC9807492.
- Heald RJ. Rectal cancer: the surgical options. Eur J Cancer. 1995 Jul-Aug;31A(7-8):1189-92. doi: 10.1016/0959-8049(95)00160-k. PMID: 7577019.
- Holden JR, McIntosh P, Johnson GGRJ, Park J, Hochman DJ, Vergis A, Yip B, Helewa RM, Hyun E. Routine pathologic evaluation of circular stapler anastomotic rings is not useful after resection for colorectal cancer: retrospective study and systematic review with meta-analysis. BJS Open. 2022 Sep 2;6(5):zrac122. doi: 10.1093/bjsopen/zrac122. PMID: 36221190; PMCID: PMC9553864.
- Hughes TG, Jenevein EP, Poulos E. Intramural spread of colon carcinoma. A pathologic study. Am J Surg. 1983 Dec;146(6):697-9. doi: 10.1016/0002-9610(83)90320-3. PMID: 6650750.
- Ingle P, Bal M, Engineer R, Ostwal V, Desouza A, Saklani A. Do Acellular Mucin Pools in Resection Margins for Rectal Cancer Influence Outcomes? Indian J Surg Oncol. 2019 Sep;10(3):515-519. doi: 10.1007/s13193-019-00921-w. Epub 2019 Apr 13. PMID: 31496602; PMCID: PMC6707992.
- Kiran RP, Lian L, Lavery IC. Does a subcentimeter distal resection margin adversely influence oncologic outcomes in patients with rectal cancer undergoing restorative proctectomy? Dis Colon Rectum. 2011 Feb;54(2):157-63. doi: 10.1007/DCR.0b013e3181fc9378. PMID: 21228662.
- Loughrey MB, Webster F, Arends MJ, Brown I, Burgart LJ, Cunningham C, Flejou JF, Kakar S, Kirsch R, Kojima M, Lugli A, Rosty C, Sheahan K, West NP, Wilson RH, Nagtegaal ID. Dataset for Pathology Reporting of Colorectal Cancer: Recommendations From the International Collaboration on Cancer Reporting (ICCR). Ann Surg. 2022 Mar 1;275(3):e549-e561. doi: 10.1097/SLA.0000000000005051. PMID: 34238814; PMCID: PMC8820778.
- Marijnen CA, Nagtegaal ID, Kapiteijn E, Kranenbarg EK, Noordijk EM, van Krieken JH, van de Velde CJ, Leer JW; Cooperative investigators of the Dutch Colerectal Cancer Group. Radiotherapy does not compensate for positive resection margins in rectal cancer patients: report of a multicenter randomized trial. Int J Radiat Oncol Biol Phys. 2003 Apr 1;55(5):1311-20. doi: 10.1016/s0360-3016(02)04291-8. PMID: 12654443.
- Martijnse IS, Dudink RL, West NP, Wasowicz D, Nieuwenhuijzen GA, van Lijnschoten I, Martijn H, Lemmens VE, van de Velde CJ, Nagtegaal ID, Quirke P, Rutten HJ. Focus on extralevator perineal dissection in supine position for low rectal cancer has led to better quality of surgery and oncologic outcome. Ann Surg Oncol. 2012 Mar;19(3):786-93. doi: 10.1245/s10434-011-2004-9. Epub 2011 Aug 23. PMID: 21861224.
- Moran BJ, Holm T, Brannagan G, Chave H, Quirke P, West N et al. The English national low rectal cancer development programme: key messages and future perspectives. Colorectal Dis 2014;16:173-178.
- Morlote DM, Alexis JB. Is the routine microscopic examination of proximal and distal resection margins in colorectal cancer surgery justified? Ann Diagn Pathol. 2016 Aug;23:35-7. doi: 10.1016/j.anndiagpath.2016.05.001. Epub 2016 May 7. PMID: 27402222.
- Munkedal DL, Laurberg S, Hagemann-Madsen R, Stribolt KJ, Krag SR, Quirke P, West NP. Significant Individual Variation Between Pathologists in the Evaluation of Colon Cancer Specimens After Complete Mesocolic Excision. Dis Colon Rectum. 2016 Oct;59(10):953-61. doi: 10.1097/DCR.0000000000000671. PMID: 27602926.
- Nagtegaal ID, Marijnen CA, Kranenbarg EK, van de Velde CJ, van Krieken JH; Pathology Review Committee; Cooperative Clinical Investigators. Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma: not one millimeter but two millimeters is the limit. Am J Surg Pathol. 2002 Mar;26(3):350-7. doi: 10.1097/00000478-200203000-00009. PMID: 11859207.
- Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol. 2008 Jan 10;26(2):303-12. doi: 10.1200/JCO.2007.12.7027. PMID: 18182672.
- Ng CW, Lieske B, Tan KK. Routine histological sampling of doughnuts post oncologic anterior resection is not necessary. Int J Colorectal Dis. 2014 Jul;29(7):843-5. doi: 10.1007/s00384-014-1886-y. Epub 2014 May 7. PMID: 24798632.
- Parfitt JR, Driman DK. The total mesorectal excision specimen for rectal cancer: a review of its pathological assessment. J Clin Pathol. 2007 Aug;60(8):849-55. doi: 10.1136/jcp.2006.043802. Epub 2006 Oct 17. PMID: 17046842; PMCID: PMC1994509.
- Pullyblank AM, Kirwan C, Rigby HS, Dixon AR. Is routine histological reporting of doughnuts justified after anterior resection for colorectal cancer? Colorectal Dis. 2001 May;3(3):198-200. doi: 10.1046/j.1463-1318.2001.00235.x. PMID: 12790989.
- Quirke P, Morris E. Reporting colorectal cancer. Histopathology 2007;50:103-112.
- Quirke P, Steele R, Monson J, Grieve R, Khanna S, Couture J et al. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial. Lancet 2009;373:821-828.
- Rocha R, Marinho R, Aparício D, Fragoso M, Sousa M, Gomes A, Leichsenring C, Carneiro C, Geraldes V, Nunes V. Impact of bowel resection margins in node negative colon cancer. Springerplus. 2016 Nov 11;5(1):1959. doi: 10.1186/s40064-016-3650-y. PMID: 27933239; PMCID: PMC5106413.
- Sakjah S, Olsen ASF, Gundestrup AK, Born PW, Bols B, Ingeholm P, Kleif J, Bertelsen CA. Plane of mesocolic dissection as predictor of recurrence after complete mesocolic excision for sigmoid colon cancer: A cohort study. Colorectal Dis. 2022 Aug;24(8):943-953. doi: 10.1111/codi.16125. Epub 2022 Apr 8. PMID: 35344254; PMCID: PMC9543653.
- Scott N, Jamali A, Verbeke C, et al. Retroperitoneal margin involvement by adenocarcinoma of the caecum and ascending colon: what does it mean? Colorectal Dis. 2008;10:289-293. 64.
- Seow-En I, Chen WT. Complete mesocolic excision with central venous ligation/D3 lymphadenectomy for colon cancer - A comprehensive review of the evidence. Surg Oncol. 2022 Jun;42:101755. doi: 10.1016/j.suronc.2022.101755. Epub 2022 Apr 2. PMID: 35405620.
- Shia J, McManus M, Guillem JG, Leibold T, Zhou Q, Tang LH, Riedel ER, Weiser MR, Paty PB, Temple LK, Nash G, Kolosov K, Minsky BD, Wong WD, Klimstra DS. Significance of acellular mucin pools in rectal carcinoma after neoadjuvant chemoradiotherapy. Am J Surg Pathol. 2011 Jan;35(1):127-34. doi: 10.1097/PAS.0b013e318200cf78. PMID: 21164296.
- Sternberg A. Carcinoma of the colon: margins of resection. J Surg Oncol. 2008 Dec 15;98(8):603-6. doi: 10.1002/jso.21032. PMID: 19072852.
- Wedel T, Heimke M, Fletcher J, Miskovic D, Benz S, Stelzner S, Heinze T. The retrocolic fascial system revisited for right hemicolectomy with complete mesocolic excision based on anatomical terminology: do we need the eponyms Toldt, Gerota, Fredet and Treitz? Colorectal Dis. 2023 Apr;25(4):764-774. doi: 10.1111/codi.16436. Epub 2022 Dec 11. PMID: 36457274.
- West NP, Morris EJ, Rotimi O, Cairns A, Finan PJ, Quirke P. Pathology grading of colon cancer surgical resection and its association with survival: a retrospective observational study. Lancet Oncol. 2008 Sep;9(9):857-65. doi: 10.1016/S1470-2045(08)70181-5. Epub 2008 Jul 28. PMID: 18667357.
- Wibe A, Rendedal PR, Svensson E, Norstein J, Eide TJ, Myrvold HE, Søreide O. Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg. 2002 Mar;89(3):327-34. doi: 10.1046/j.0007-1323.2001.02024.x. PMID: 11872058.
- Wlodarczyk J, Gaur K, Mertz K, Wickham C, Mirza KL, Hsieh C et al. Do or doughnut: a systematic review and pooled analysis on the utility of pathological evaluation of the anastomotic doughnut in oncological colorectal operations. Colorectal Dis 2022;24:8-15
- Zeng WG, Liu MJ, Zhou ZX, Wang ZJ. A Distal Resection Margin of ?1?mm and Rectal Cancer Recurrence After Sphincter-Preserving Surgery: The Role of a Positive Distal Margin in Rectal Cancer Surgery. Dis Colon Rectum. 2017 Nov;60(11):1175-1183. doi: 10.1097/DCR.0000000000000900. PMID: 28991082.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 08-04-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom. Deze werkgroep is ingesteld in het kader van het cluster oncologie onderste tractus digestivus.
De huidige samenstelling van de werkgroep
Prof. dr. P.J. (Pieter) Tanis, gastrointestinaal en oncologisch chirurg, Erasmus MC, Rotterdam, NVvH (voorzitter)
dr. J.W.A. (Pim) Burger, chirurg, Catharina Ziekenhuis, Eindhoven, NVvH
dr. M. (Myriam) Chalabi, internist, Antoni van Leeuwenhoek, Amsterdam, NIV/NVMO
S. Dokter (Simone) MSc., verpleegkundig specialist, Antoni van Leeuwenhoek, Amsterdam, V&VN
Dr. D.J.A. (Derk Jan) de Groot, internist-oncoloog, UMC Groningen, Groningen, NIV/NVMO (vanaf december 2018)
Dr. M.E. (Marije) Hamaker, klinisch geriater, Diakonessenhuis, Utrecht, NVKG
Dr. M.P.W. (Martijn) Intven, radiotherapeut, UMC Utrecht, Utrecht, NVRO
Dr. M. (Miranda) Kusters, colorectaal chirurg, AmsterdamUMC, Amsterdam, NVvH
Dr. M.M. (Marilyne) Lange, patholoog, AmsterdamUMC, Amsterdam, NVvPathologie
Dr. M. (Monique) Maas, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR (vice-voorzitter)
Prof. dr. C.A.M. (Corrie) Marijnen, radiotherapeut, Leids Universiteit Medisch Centrum, Leiden, NVRO
Dr. L. (Leon) Moons, MDL-arts, UMC Utrecht, Utrecht, NVMDL
Prof. dr. I.D. (Iris) Nagtegaal, patholoog, Radboud UMC, Nijmegen, NVvP
Dr. M. (Mark) Roef, nucleair geneeskundige, Catharina Ziekenhuis, Eindhoven, NVNG
Dr. M. (Maarten) Smits, radioloog, UMC Utrecht, Utrecht, NVvR
Dr. P. (Petur) Snaebjornsson, patholoog, Nederlands Kanker Instituut, Amsterdam, NVvP
I. (Iris) van der Veeken Msc., coloncare verpleegkundige, Flevoziekenhuis, Almere, V&VN
Dr. H.M.W. (Henk) Verheul, internist-oncoloog, Radboudumc, Nijmegen, NIV/NVMO
Prof. dr. C. (Kees) Verhoef, oncologisch chirurg, Erasmus MC, Rotterdam, NVvH
Dr. K.S. (Kathelijn) Versteeg, internist-oncoloog, AmsterdamUMC, Amsterdam, NIV/NVMO
Dr. M. (Marianne) de Vries, abdominaal radioloog, Erasmus MC, Rotterdam, NVvR (vanaf november 2018)
Dr. H.L. (Erik) van Westreenen, chirurg, Isala Zwolle/ Isala Diaconessenhuis, Zwolle/Meppel, NVvH
Dr. M.L. (Miriam) Wumkes, internist, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NIV/NVMO
Voormalig betrokken werkgroepleden
Prof. dr. G.L. (Geerard) Beets, gastrointestinaal en oncologisch chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
Prof. dr. R.G.H. (Regina) Beets-Tan, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
C.M.J. (Christel) Gielen MSc., verpleegkundig specialist, Maastricht UMC+, Maastricht, V&VN
Dr. C.J. (Corneline) Hoekstra, nucleair geneeskundige, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVNG
Dr. O.J.L. (Olaf) Loosveld, internist-oncoloog, Amphia Ziekenhuis, Brede, NIV/NVMO
Dr. M. (Martijn) Meijerink, interventieradioloog, Amsterdam UMC locatie VUmc, Amsterdam, NVvR
Prof. dr. C.J.A. (Kees) Punt, medisch oncoloog, NIV/NVMO
Prof. dr. J. (Jaap) Stoker, abdominaal radioloog, NVvR
Dr. A.J. (Albert Jan) ten Tije, internist oncoloog, NIV/NVMO
Met medewerking van
Dr. H.M.U. (Heike) Peulen, radiotherapeut-oncoloog, Catharina Ziekenhuis, Eindhoven
Met ondersteuning van
• R.J.S. (Rayna) Anijs, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• dr. J.S. (Julitta) Boschman, voormalig betrokken senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• dr. D. (Dagmar) Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
• I. (Ingeborg) van Dusseldorp, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
De werkgroep heeft bij aanvang van het richtlijnontwikkelingstraject geconstateerd dat sommige werkgroepleden betrokken zijn bij wetenschappelijk onderzoek dat wordt gefinancierd door overheid, onafhankelijke subsidieverstrekkers, of commerciële partijen (in het laatste geval: unrestricted scientific grants). Om te voorkomen dat indirecte belangen (waaronder reputatie en kennisvalorisatie) de richtlijnaanbevelingen onbedoeld zouden kunnen beïnvloeden, heeft de werkgroep besloten dat geen van de modules/aanbevelingen worden opgesteld door één werkgroeplid met dergelijke indirecte belangen. Tenminste één ander werkgroeplid met hetzelfde specialisme of tenminste één ander werkgroeplid met vergelijkbare inhoudelijke kennis van het betreffende onderwerp zijn verantwoordelijk voor de inhoud (vier-ogen-principe).
Samengevat, gelden de volgende restricties voor de modules over onderwerpen waar adviesraden, consultancy of industrie-gesponsord onderzoek betrekking op hebben:
- Werkgroeplid werkt niet als enige inhoudsdeskundige aan de module;
- Werkgroeplid werkt tenminste samen met een werkgroeplid met een vergelijkbare expertise in alle fasen (zoeken, studieselectie, data-extractie, evidence synthese, Evidence-to-decision, aanbevelingen formuleren) van het ontwikkelproces. Indien nodig worden werkgroepleden toegevoegd aan de werkgroep;
- In alle fasen van het ontwikkelproces is een onafhankelijk methodoloog betrokken;
- Overwegingen en aanbevelingen worden besproken en vastgesteld tijdens een werkgroepvergadering onder leiding van een onafhankelijk voorzitter (zonder gemelde belangen).
Voor overige modules gelden geen restricties.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. P.J. (Pieter) Tanis |
Gastro-intestinaal en oncologisch chirurg, Erasmus MC |
-Lid clinical audit board Dutch ColoRectal Audit, onbetaald |
Meerdere klinische multicenter trials: |
Geen actie ondernomen. |
|
Dr. D.J.A. (Derk-Jan) de Groot |
Internist oncoloog, UMC Groningen |
Geen. |
* Hoffman-La Roche - Fase 2 klinische geneesmiddelen studie - Projectleider
|
Geen actie ondernomen. |
|
Prof. Dr. M.P.W. (Martijn) Intven |
Radiotherapeut-oncoloog, UMC Utrecht |
Voorzitter NVRO (onbetaald). |
* KWF - ARCADE - radiotherapie bij geïsoleerd lokaal recidief pancreascarcinoom - Projectleider
|
Geen actie ondernomen. |
|
Dr. M. (Monique) Maas |
Radioloog, NKI-AVL |
Redacteur nascholingsblad 'Imago'; vergoeding 1x jaar.
|
Geen. |
Geen actie ondernomen. |
|
Dr. L.M.G. (Leon) Moons |
MLD-arts, UMC Utrecht |
-Voorzitter T1 CRC werkgroep
|
Consultant voor Boston Scientific, consultant voor Pentax Medical. Alleen KWF, ZonMW en MLDS gesponsorde onderzoeken:
|
Geen actie ondernomen. |
|
Dr. H.L. (Erik) van Westreenen |
Chirurg, Isala Zwolle |
Geen. |
* KWF - Complex Colon Carcinoom - Projectleider
|
Geen actie ondernomen. |
|
Drs. H. (Heidi) Rütten |
Radiotherapeut-Oncoloog, RadboudUMC |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Prof. Dr. H. (Henk) Verheul |
Internist oncoloog, RadboudUMC |
Geen. |
Externe financiering, Philips diagnostics, Roche, Pfizer, Frame Therapeutics. |
Geen actie ondernomen. |
|
Prof. Dr. I.D. (Iris) Nagtegaal |
Patholoog, RadboudUMC |
Expert patholoog BVO darmkanker (detachering).
|
* Hanarth Foundation - Cancer of unknown primary - Projectleider
|
Geen actie ondernomen. |
|
I. (Iris) van der Veeken |
Verpleegkundige, Flevoziekenhuis |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. K. (Kathelijn) Versteeg |
Internist-oncoloog en ouderengeneeskunde, Amsterdam UMC |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Prof. Dr. C. (Kees) Verhoef |
Oncologische en Gastro-intestinale Chirurg |
-Wetenschappelijke adviesraad KWF, onbetaald
|
Geen. |
Geen actie ondernomen. |
|
Dr. M.L.J. (Maarten) Smits |
Interventieradioloog, UMC Utrecht |
- Voorzitter wetenschapscommissie Nederlandse Vereniging voor Interventieradiologie (onbetaald)
|
* Terumo / Quirem Medical - HEPAR primary study, radioembolization for patients with hepatocellular carcinoma - Geen projectleider
|
Geen actie ondernomen. |
|
Dr. M. (Marianne) de Vries |
Radioloog, ErasmusMC |
Geen. |
Meewerken aan multicenter studies, geen projectleider, onbetaald (bijvoorbeeld SNAPshot studie AVL of PELVEX studie).
|
Geen actie ondernomen. |
|
Dr. M. (Marilyne) Lange |
Patholoog, Amsterdam UMC |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. M.E. (Marije) Hamaker |
Klinisch geriater, Diakonessenhuis
|
NTVG sectieredacteur - onbetaald
|
Europese Commissie - Nieuw zorgpad voor ouderen met kanker - Geen projectleider
|
Geen actie ondernomen. |
|
Dr. M.J. (Mark) Roef |
Nucleair Geneeskundige, Catharina Ziekenhuis |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. M. (Miranda) Kusters |
Colorectaal chirurg, AmsterdamUMC
|
Geen. |
KWF project Snapshot rectumcarcinoom. Betrokken bij diverse andere KWF projecten (CEA-specifieke fluorescentie, PELVEX2 etc.)
|
Geen actie ondernomen. |
|
Dr. M.L. (Miriam) Wumkes |
Internist-oncoloog, Jeroen Bosch Ziekenhuis |
-Voorzitter oncologiecommissie JBZ, betaald
|
Lokale PI van onderzoek in JBZ, geen projectleider.
|
Geen actie ondernomen. |
|
Dr. M. (Miryam) Chalabi |
Internist-oncoloog, AVL |
Richtlin rectumcarcinoom ASCO, niet betaald.
|
Roche-Genentech, Agenus, BMS, MSD, MLDS, ESMO fellowship.
Adviesraden voor diverse bedrijven (Roche, BMS, MSD). Lid scientific advisory board Kineta.IDMC NOUSCOM. Betaling altijd aan het instituut en nooit persoonlijk.
|
Geen actie ondernomen. |
|
S. (Simone) Dokter |
Verpleegkundig specialist, medische oncologie AVL |
Roche, scholing, bijwerkingen immuuntherapie, eenmalig betaald. |
Geen. |
Geen actie ondernomen. |
|
Dr. P. (Petur) Snaebjornsson
|
Patholoog, AVL |
-Bestuur Expertisegroep GE pathologie van NVVP sinds 2021 (sectie lower GI, onbetaald) -Bestuur DCCG 2018-2022 (onbetaald) -Les Pathasser opleiding in Hogeschool van Leiden sinds 2019 (betaald) -Richtlijncommissie PTO sinds 2022 (voorzitter, vacatiegelden) -estuur CUPP-NL sinds 2021 (onbetaald)
|
Betrokken bij diverse projecten door KWF gefinancierd (niet PI), waaronder COLOPEC 1 en 2, CAIRO5, CAIRO6, snapshot complex colon cancer, FAPI/PET bij peritoneale metastasen. Betrokken bij onderzoeken gefinancierd door RANNIS (Ijslands fonds) voor studies (mutaties in normaal darmslijmvlies, als PI) en mutaties in Lynch syndroom tumoren (niet PI). Betrokken bij DISCO trial gefinancierd door ZonMw (niet PI).
-Op 28-09-2022: deelname als expert aan nascholing Colorectaal carcinoom (talkshow). Georganiseerd door MEDtalks, betaald aan het instituut.
|
Geen actie ondernomen. |
|
Dr. J.W.A. (Pim) Burger
|
Oncologisch chirurg, Catharina Ziekenhuis |
Geen. |
* ZonMW - Multidisiplinaire zorg - Geen Projectleider
|
Geen actie ondernomen. |
|
S. (Silvie) Dronkers
|
Stichting Darmkanker
|
Geen. |
Geen. |
Geen actie ondernomen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Stichting Darmkanker en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) voor de invitational conferences in 2017 en 2023. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. Daarnaast zijn deze patiëntenorganisaties in de commentaarfase uitgenodigd om modules mee te lezen, te becommentariëren en de werkgroep van feedback vanuit het patiëntenperspectief voorzien.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
|
Module |
Uitkomst raming |
Toelichting |
|
n.v.t. |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Alle modules |
Geen financiële gevolgen |
Hoewel het niet duidelijk is of de aanbeveling breed toepasbaar is, volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
NB. Vanaf januari 2023 is Medisch Specialistische Richtlijnen 3.0 van kracht geworden. De ontwikkeling van deze modules is echter reeds daarvoor gestart.
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase in 2017 inventariseerde de werkgroep knelpunten en de werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVRO, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Medio 2023 is het grootste deel van de richtlijn herzien en worden nieuwe modules of herzieningen door de werkgroep besproken indien de werkgroep:
- Signalen krijgt van (nieuwe) knelpunten in de zorg voor patiënten met colorectaal carcinoom die geadresseerd dienen te worden in de richtlijn;
- Signaleert dat er nieuwe onderzoeksresultaten zijn die relevant zijn voor de richtlijn;
- Constateert dat er tekstuele verbeteringen of aanvullingen nodig zijn in de richtlijn om de bruikbaarheid of volledigheid van de richtlijn te verbeteren.
De werkgroep bespreekt welke aanvullingen of herzieningen geprioriteerd dienen te worden en stelt evt. passende (nieuwe) uitgangsvragen op. De werkroep bepaalt de prioriteit van aanvullingen of herzieningen op basis van: (1) klinische relevantie, (2) de beschikbaarheid van nieuwe evidence, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitkomstmaten
De werkgroep inventariseerde per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij men zowel naar gewenste als ongewenste effecten keek. De werkgroep baseerde de keuze voor uitkomstmaten mede op basis van de “core outcome set” gepubliceerd door Zerillo (2017). De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Hiervoor sloot de werkgroep zich, waar mogelijk, aan bij de grenzen voor klinische besluitvorming volgens de PASKWIL criteria uit 2023. Wanneer er geen grenzen voor klinische besluitvorming conform de PASKWIL criteria geformuleerd konden worden (bijvoorbeeld bij non-inferioriteitsvraagstukken) werden de standaard GRADE grenzen gehanteerd, tenzij anders vermeld.
Strategie voor zoeken en selecteren van literatuur
De werkgroep raadpleegde voor de afzonderlijke uitgangsvragen reeds gepubliceerde systematische reviews (SRs). SRs kwamen in aanmerking indien: i) systematisch was gezocht in één of meerdere databases; ii) transparante in- en exclusiecriteria zijn toegepast en iii) idealiter de kwaliteit van de geïncludeerde literatuur was beoordeeld. De voor de uitgangsvragen relevante internationale richtlijnen en consensusdocumenten werden eveneens geraadpleegd. Overige literatuur, waar niet systematisch naar werd gezocht, is als bewijsvoering in de overwegingen opgenomen.
Relevante beschikbare populatiegegevens uit Nederland werden gebruikt voor het bepalen van knelpunten, praktijkvariatie en externe validiteit van internationale richtlijnen en gepubliceerde literatuur.
Kwaliteitsbeoordeling individuele studies
De (risk of bias) kwaliteitsbeoordelingen van de individuele studies uit de gebruikte SRs werden gebruikt, tenzij deze afwezig waren of onbruikbaar waren voor het beoordelen van de kracht van het wetenschappelijke bewijs. Indien afwezig of onbruikbaar werd aangenomen dat er een risico op bias aanwezig zou kunnen zijn. In enkele gevallen, wanneer studies informatie verschaften over de cruciale uitkomstma(a)t(en), werd er een nieuwe kwaliteitsbeoordeling van individuele studies uitgevoerd.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van de geselecteerde SRs werden weergegeven in ‘Summary of Findings’ tabellen. De belangrijkste bevindingen uit de literatuur werden kort beschreven onder “Samenvatting literatuur” (kopjes “Samenvatting van internationale richtlijnen en consensusdocumenten” en “Samenvatting van systematische reviews en meta-analyses”) en onder “Overwegingen”. Bestaande meta-analyses uit de gebruikte systematische reviews werden beschreven. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek (te vinden in de ‘Summary of Findings’ tabellen). De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling beargumenteerd hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
De werkgroep ontwikkelde geen interne kwaliteitsindicatoren om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DCRA indicatoren.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken wetenschappelijke verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zerillo JA, Schouwenburg MG, van Bommel ACM, Stowell C, Lippa J, Bauer D, Berger AM, Boland G, Borras JM, Buss MK, Cima R, Van Cutsem E, van Duyn EB, Finlayson SRG, Hung-Chun Cheng S, Langelotz C, Lloyd J, Lynch AC, Mamon HJ, McAllister PK, Minsky BD, Ngeow J, Abu Hassan MR, Ryan K, Shankaran V, Upton MP, Zalcberg J, van de Velde CJ, Tollenaar R; Colorectal Cancer Working Group of the International Consortium for Health Outcomes Measurement (ICHOM). An International Collaborative Standardizing a Comprehensive Patient-Centered Outcomes Measurement Set for Colorectal Cancer. JAMA Oncol. 2017 May 1;3(5):686-694. doi: 10.1001/jamaoncol.2017.0417. PubMed PMID: 28384684.