MMR/ MSI-onderzoek bij CRC
Uitgangsvraag
Wanneer en met welke testen moet mismatch repair (MMR)/microsatelliet instabiliteit (MSI) onderzoek worden verricht?
De uitgangsvraag omvat de volgende deelvragen:
- Wat zijn de indicaties voor MMR/MSI bepaling?
- Welke test verdient de voorkeur (MMR IHC of MSI analyse)?
- Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (biopt primaire tumor of resectiepreparaat; primaire tumor of metastase)?
- Wanneer wordt MLH1 promotor hypermethyleringstest en/of BRAF mutatieanalyse uitgevoerd en welk test geniet de voorkeur?
- Is het screenen/testen met alleen PMS2 en MSH6 IHC voldoende?
- Wat zijn de minimale eisen aan de te gebruiken technieken voor deelvraag 2 en 4?
Aanbeveling
Voer structureel MMR immunohistochemie bij alle nieuw gediagnosticeerde CRC patiënten onder de leeftijd van 70 uit als screening voor Lynch-syndroom.
Voer ook MMR immunohistochemie uit bij patiënten uit die in aanmerking komen voor (1) adjuvante chemotherapie bij stadium II en III of (2) immuuntherapie bij gemetastaseerde ziekte.
Gebruik bij voorkeur immunohistochemisch onderzoek naar MMR eiwitten. Gebruik MSI analyse bij twijfel over interpretatie van de MMR kleuringen en in de context van klinisch genetische analyse bij suspecte families.
Gebruik bij voorkeur de biopten van de primaire tumor voor de MMR immunohistochemie (en op indicatie MLH1 promotor hypermethyleringsanalyse). Als de MMR status nog niet bekend is, gebruik dan het resectiepreparaat van de primaire tumor indien beschikbaar, en materiaal van een metastase indien het resectiepreparaat van de primaire tumor niet beschikbaar is.
Voer MLH1-promotor hypermethyleringstest uit bij afwezigheid van de kernkleuring van zowel MLH1 als PMS2. Wanneer het laboratorium geen MLH1-hypermethyleringstest kan verrichten, kan overwogen worden BRAF-mutatieanalyse uit te voeren. Bij te weinig tumorweefsel voor moleculaire diagnostiek kan BRAF-immunohistochemie worden verricht. Als er BRAF-mutatieanalyse verricht is maar geen BRAF-V600E mutatie gevonden wordt, voer dan alsnog aanvullende MLH1-promotor hypermethyleringsanalyse uit.
Gebruik conform de richtlijn voor erfelijke darmkanker bij voorkeur kleuringen voor alle 4 MMR eiwitten (MLH1, PMS2, MSH2 en MSH6).
Valideer de MMR immunohistochemie en moleculaire testen volgens gebruikelijke standaarden. Neem deel aan periodieke toetsing in externe kwaliteitsronden.
Overwegingen
Deelvraag 1 Wat zijn de indicaties voor MMR/MSI bepaling?
Mogelijk wordt MMR status belangrijk voor de keuze van neoadjuvante behandeling in de toekomst.
Deelvraag 2 Welke test verdient de voorkeur (MMR IHC of MSI analyse)?
In de huidige screeningspraktijk naar zowel sporadische als erfelijke MMR deficiënte/MSI tumoren zijn de MSI analyse en MMR IHC vergelijkbaar met slechts 0,4% discordantie (Hissong, 2018), wanneer de analyses zorgvuldig en met juiste criteria en interpretatie uitgevoerd zijn (Richtlijn erfelijke darmkanker, 2015). In oudere studies was de discordantie hoger, bijvoorbeeld 3,9% in een publicatie van 2011 (Bartley, 2012) en 2,5% in een publicatie van 2012 (Moreira, 2012).
De nadelen van MMR IHC zijn de volgende: (1) ervaring in de interpretatie van de MMR kleuringen is van belang (Overbeek, 2008), (2) soms zijn de MMR kleuringen niet eenduidig te interpreteren (Shia, 2008). Niet eenduidig te interpreteren MMR kleuringen zijn een belangrijke oorzaak voor discordantie en interobserver variabiliteit (Sarode, 2019). De frequentie van de niet eenduidig te interpreteren MMR kleuringen wordt beïnvloed door de volgende factoren:
- Technische instelling van de IHC kleuringen in combinatie met de gebruikte clones.
- Fixatie- en ischemie-gevoeligheid van de MMR eiwitten (met name MLH1 en PMS2).
- Positieve of deels positieve/heterogene kernaankleuring bij sommige mutaties in MMR genen, terwijl er wel sprake is van MSI. Dit wordt met name bij bepaalde MSH6 mutaties (Okkels, 2012) en PMS2 mutaties gezien maar kan bij bepaalde MLH1 kiembaanmutaties ook worden gezien (Mangold, 2005).
Fixatie/ischemie-effect op MMR immunohistochemie
Een gradiënt van weefseloppervlak (waar de fixatie begint) naar binnen, van zowel tumorcellen als de interne controle wijst op een fixatie/ischemie-effect. Op plaatsen waar de interne controle (grotendeels) geen aankleuring heeft wordt het interpreteren van MMR aankleuring in tumorcelkernen minder betrouwbaar.
Positieve kernaankleuring bij sommige mutaties in MMR genen
In circa 3% van de gevallen in de screeningssetting is er sprake van microsatelliet instabiele/MMR deficiënte tumoren, die toch wisselende mate van positieve kleuring laten zien (Sarode, 2019). Deze atypische aankleuringspatronen zijn niet eenduidig te interpreteren, en bestaan meestal uit een wisselende combinatie van een abnormaal zwakke kernaankleuring (ten opzichte van interne controle) en een wisselende hoeveelheid aankleurende cellen. De sterkte van kernaankleuring in tumorcellen is hierbij zwak of heterogeen (zwak tot sterk) ten opzichte van de interne controle. De hoeveelheid van aankleurende cellen is ook variabel, bijvoorbeeld 10% minder (Sarode, 2019), 25% minder (Watson, 2007) of toch aanwezig in een groot deel van de tumorcellen (Watson, 2007). De heterogeniteit kan zowel focaal, patchy als zonaal gezien worden (Watson, 2007). Het is belangrijk dat heterogene/patchy aankleuring vanwege suboptimale fixatie of ischemie herkend wordt en onderscheiden wordt van afwijkende aankleuringspatronen. Afwezige kernaankleuring vanwege fixatie wordt onder andere herkend door correlatie met aankleuring in nabijgelegen stroma (Shia, 2008).
Andere afwijkende scenario´s zijn:
- Zwakke dot-like (ook genoemd nucleolar of punctate) kernaankleuring is ook beschreven (Shia, 2013; Chen, 2017). Dit aankleuringspatroon wordt vaker bij bepaalde clones gezien (Dasgupta, 2019). Dot-like MLH1 aankleuring bij verlies van PMS2 kleuring kan als MLH1 verlies worden beschouwd. Dot-like MSH6 aankleuring is ook beschreven bij status na neoadjuvante behandeling (Radu, 2011).
- PMS2 en MSH6: soms gereduceerde/zwakke aankleuring na neoadjuvante behandeling (Chen, 2017).
- Cytoplasmatische aankleuring: cytoplasmatische aankleuring wordt soms gezien en heeft voor zover bekend geen betekenis (Shia, 2008).
MSI analyse
De literatuur omtrent de sensitiviteit van de standaard MSI test zal in de komende jaren veranderen, omdat nu talrijke microsatellieten met NGS getest kunnen worden. De huidige meest gebruikte MSI analyse is gebaseerd op een moleculair onderzoek naar 5 specifieke mononucleotide microsatellieten. Infrequent zien we MSH6 deficiënte tumoren die microsatelliet instabiliteit in andere gebieden laten zien (Zhang, 2008).
Het voordeel van de MSI analyse is dat de data meestal makkelijk te interpreteren en reproduceerbaar is (Zhang, 2008). Er moet echter wel aandacht zijn voor het tumorcel percentage (Wu, 2019).
Deelvraag 3a Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (biopt primaire tumor of resectiepreparaat)?
Er is een hoge concordantie in MMR status tussen preoperatieve endoscopische biopten en het resectiepreparaat (Kumarasinghe, 2010; Warrier, 2011; Shia, 2011). De interpretatie van de MMR kleuringen meer eenduidig als het biopten betreft (Kumarasinghe, 2010). Dit is vanwege meer uniforme en sterke aankleuring. Bij resectiepreparaten is de interpretatie soms niet conclusief, vermoedelijk met name vanwege suboptimale fixatie.
Deelvraag 3b Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (primaire tumor of metastase)?
Er zijn geen aanvullende overwegingen.
Deelvraag 4a en b Wanneer wordt MLH1-promotor hypermethyleringstest en/of BRAF-mutatieanalyse uitgevoerd en welk test geniet de voorkeur?
BRAF-V600E mutatie komt voor in 63,5% van tumoren met MLH1 promotor hypermethylering of MLH1/PMS2 deficiëntie (Parsons, 2012). BRAF mutatie komt zeer zelden bij Lynch patiënten voor. In een reviewpaper van Parsons (2012) was de frequentie van BRAF-mutatie in tumoren bij Lynch patiënten 1,4%. Het betrof 4 patiënten waarvan 2 met PMS2 kiembaanmutatie, 1 patiënt met MLH1 kiembaanmutatie en 1 patiënt met MSH2 kiembaanmutatie (Parsons, 2012). Andere mutaties in het BRAF-gen dan de specifieke V600E BRAF-mutatie zijn zeldzaam en hebben geen associatie met MSI/MMR status of erfelijkheid (Schirripa, 2019). Deze zeldzame niet-V600E BRAF-mutaties kunnen daarom niet in deze context worden gebruikt. De frequentie van MLH1-promotor hypermethylering en de sensitiviteit en specificiteit met betrekking tot Lynch-syndroom is afhankelijk van de gebruikte MLH1-hypermethyleringstest (Parsons, 2012).
Deelvraag 5 Is het screenen/testen met alleen PMS2 en MSH6 IHC voldoende?
In enkele studies is het effect van een 2 antilichaam panel (PMS2 en MSH6) onderzocht in vergelijking met een 4 antilichaam panel (MLH1, PMS2, MSH2 en MSH6) (Hall, 2010; Mojtahed, 2011; O´Regan, 2013; Pearlman, 2018; Shia, 2009). De 2 antilichaam panel is met name goedkoper, en de predictieve waarde zou vergelijkbaar zijn. Echter, bij een MSH2 kiembaanmutatie kan de MSH6 kleuring nog steeds (deels) positief zijn; deze patiënten worden dan dus gemist (Pearlman, 2018). Volgens Niu (2019) heeft dit onder andere met de fixatie-gevoeligheid van de MMR immuno´s te maken, dat wil zeggen met sterkere aankleuring in goed gefixeerd materiaal (Niu, 2019). In de setting van populatiescreening naar Lynch syndroom is het onbekend hoe vaak dit probleem voorkomt. Om een definitieve keuze te maken tussen 2 en 4 antilichaam panel is meer onderzoek nodig waaronder kosteneffectiviteitsstudies. In gecontroleerde setting kan een 2 antilichaam panel worden gebruikt als voorselectie waarbij de andere twee antilichamen bij het bestaan van twijfel laagdrempelig toegevoegd moeten worden.
Deelvraag 6 Wat zijn de minimale eisen aan de te gebruiken technieken voor deelvraag 2.
Er zijn geen aanvullende overwegingen.
Onderbouwing
Achtergrond
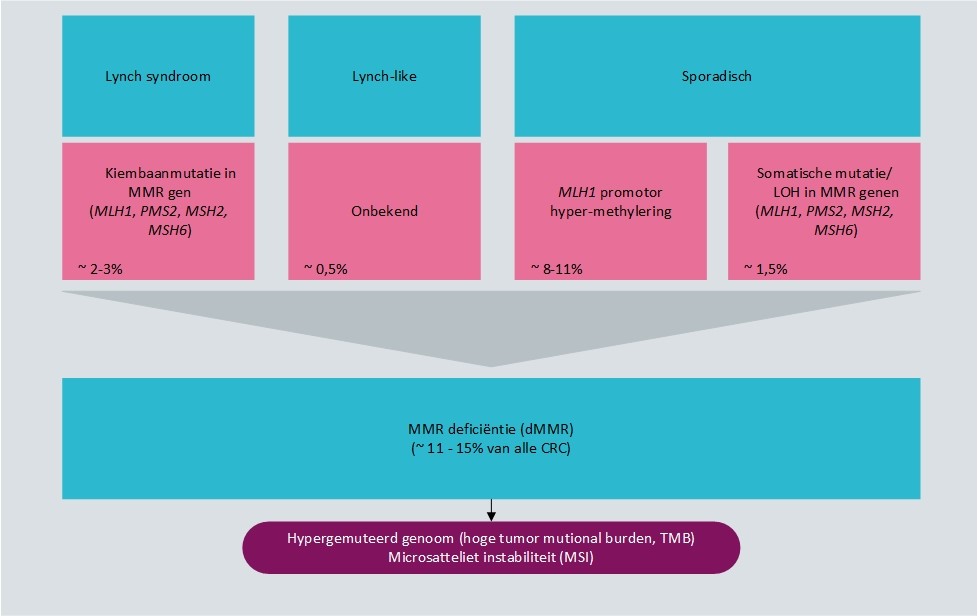
Colorectaal carcinoom kan moleculair in twee hoofdgroepen worden verdeeld: microsatelliet stabiele (MSS) en microsatelliet instabiele (MSI) tumoren, ook respectievelijk mismatch repair (MMR) proficiënte en MMR deficiënte tumoren genoemd. Met MSI status en MMR status bepaling wordt in essentie hetzelfde getest, maar op twee verschillende manieren: MSI met DNA analyse en MMR met immunohistochemie (eiwitexpressie). MSI/MMR status bepaling heeft een belangrijke rol bij het opsporen van patiënten met Lynch-syndroom en bij therapiekeuze (zie de relevante modules omtrent therapie).
MSI is het gevolg van inactivatie van één van vier belangrijkste MMR eiwitten (MLH1, PMS2, MSH2 en MSH6). MSI wordt gekenmerkt door variatie in lengtes van microsatellieten (kort segment DNA opgebouwd uit herhaalde sequenties) in tumorweefsel door inserties en deleties, die niet meer door de dysfunctionele MMR eiwitten gecorrigeerd worden. Bij instabiliteit in 2 of meer van 5 standaard geteste microsatellieten wordt een tumor als MSI beschouwd.
Een tumor wordt MMR deficiënt (dMMR) genoemd als één of meer van de vier MMR eiwitten immunohistochemisch (IHC) verlies van aankleuring in de tumorcelkernen laat zien. Tumoren met behoud van aankleuring van celkernen in alle vier de kleuringen worden MMR proficiënt genoemd.
Tot ongeveer 15% van alle CRC zijn MSI/dMMR. Het mechanisme daarachter kan sporadisch of erfelijk (Lynch-syndroom) zijn en komt in deze groep voor in respectievelijk circa 80% (12/15*100) en 20% (3/15*100). Lynch-syndroom is een autosomaal dominante aandoening als gevolg van kiembaanmutaties die de mismatch repair eiwitten aantasten. Sporadische MSI/dMMR tumoren ontstaan door biallelische somatische inactivatie van een MMR gen. Dat wordt meestal veroorzaakt door MLH1 promotor hypermethylering en minder frequent door mutatie of loss of heterozygosity (LOH). Met een MLH1 promotor hypermethyleringstest kan het onderscheid tussen sporadische en erfelijke origine voor het merendeel van MSI/dMMR tumoren worden bepaald. Dit onderscheid kan ook worden gemaakt door het detecteren van bepaalde somatische mutatie in het BRAF-gen (p.Val600Glu, ook beter bekend als V600E). Dit is omdat in 63,5% van de colorectale carcinomen met MLH1 promotor hypermethylering deze mutatie in het BRAF-gen gevonden wordt, en slechts heel uitzonderlijk bij patiënten met Lynch-syndroom (Parsons, 2012).
Samenvatting literatuur
Samenvatting van internationale richtlijnen en consensusdocumenten
PICO 1 Wat zijn de indicaties voor MMR/MSI bepaling?
In de Nederlandse landelijke richtlijn voor erfelijke darmkanker (versie 2.0 van 2015) wordt screening naar Lynch-syndroom voor alle colorectaal carcinomen onder de leeftijd van 70 geadviseerd. Vergelijkbare adviezen, danwel screening ongeacht de leeftijd, worden in andere richtlijnen geadviseerd (EGAPP, 2009; Giardiello, 2014; Klarskov, 2016; NCCN, 2019; NICE , 2017; Palomaki, 2009; Stoffel, 2015; Syngal, 2015; Vasen, 2013).
MMR/MSI status heeft predictieve waarde betreffende respons op zowel adjuvante chemotherapie bij patiënten met stadium II en III colorectaal carcinoom als immuuntherapie bij patiënten met gemetastaseerde ziekte. Daarom wordt MMR/MSI bepaling geadviseerd bij keuze van behandeling in die context (NCCN, 2019; Sepulveda, 2017; Stjepanovic, 2019).
PICO 2 Welke test verdient de voorkeur (MMR IHC of MSI analyse)?
Volgens de landelijke richtlijn voor erfelijke darmkanker (versie 2.0 van 2015) heeft MMR immunohistochemie de voorkeur boven MSI analyse. MSI analyse kost namelijk meer tijd, is duurder, kan niet in alle laboratoria worden uitgevoerd en stelt andere eisen aan het weefsel. De MSI analyse moet verricht worden op zowel tumorweefsel als normaal weefsel en het tumorcelpercentage dient minimaal 30% te bedragen. Verder moet bij het aantonen van microsatelliet instabiliteit alsnog MMR immunohistochemie worden verricht in veband met wel of niet verwijzen naar klinisch geneticus. In de NCCN en NICE richtlijn wordt geen voorkeur gegeven voor een van deze technieken (NCCN, 2019; NICE 2017).
Er is geen meerwaarde voor een combinatie van beide methoden in de screeningssetting (Richtlijn erfelijke darmkanker, 2015). Bij twijfel over de interpretatie van de immunohistochemische kleuringen en in de context van een klinisch genetische analyse van suspecte families kan toevoeging van MSI analyse wel van waarde zijn. Sommige inactiverende mutaties kunnen namelijk gepaard gaan met (heterogene) eiwitexpressie, waarbij er wel sprake is van MSI (Richtlijn erfelijke darmkanker, 2015). Zie hieromtrent verder rubriek overwegingen.
PICO 3a Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (biopt primaire tumor of resectiepreparaat)?
In de Nederlandse landelijke richtlijn voor erfelijke darmkanker (versie 2.0 van 2015) wordt MMR immunohistochemisch onderzoek op voorafgaande endoscopische biopten van de primaire tumor geadviseerd. In de Deense richtlijn (Klarskov, 2016) en de consensus statement van de US Multi-Society Task Force on Colorectal Cancer (Giariello, 2014) wordt dit ook aangeraden. In andere richtlijnen wordt geen voorkeur gegeven.
De genoemde voordelen van het testen op de biopten voorafgaand aan resectie zijn de volgende: In het geval van erfelijke belasting kan eventueel de uitgebreidheid van chirurgische behandeling worden aangepast (subtotale colectomie versus segmentele resectie). Door de test op het initiële biopt uit te voeren wordt de test structureel verricht, ook bij patiënten die geen resectie zullen ondergaan en bij patiënten waarbij het resectiepreparaat geen tumorrest bevat (vanwege status na neoadjuvante behandeling/poliepectomie). De interpretatie van de MSH6 kleuring kan door voorbehandeling worden bemoeilijkt. Het is efficiënt als alle screeningsdiagnostiek omtrent de MMR analyse (IHC en eventueel MLH1-hypermethyleringstest/BRAF-mutatieanalyse) klaar is voor het postoperatieve MDO vanwege eventueel verwijs-advies naar een klinisch geneticus.
De nadelen van het testen op het initiële biopt zijn:
- Mogelijk onvoldoende materiaal, bijvoorbeeld alleen dysplasie en geen zeker adenocarcinoom.
- Soms te weinig tumorweefsel voor aanvullende moleculaire diagnostiek (MLH1-hypermethyleringstest).
- Hogere kosten als de bepaling op de biopten niet conclusief is en de test daarom op het resectiepreparaat herhaald moet worden.
PICO 3b Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (primaire tumor of metastase)?
Wat betreft het testen van primaire tumor versus metastase staat in de NCCN-richtlijn (NCCN, 2019) dat vanwege goede concordantie tussen primaire tumor en metastase een metastase getest kan worden wanneer de primaire tumor niet beschikbaar is.
PICO 4a Wat zijn de indicaties voor MLH1-promotor hypermethyleringstest of BRAF-mutatieanalyse?
Volgens de Nederlandse landelijke richtlijn voor erfelijke darmkanker (versie 2.0 van 2015) wordt MLH1-promotor hypermethyleringstest of BRAF-mutatieanalyse uitgevoerd bij elke patiënt met afwezigheid van de kernkleuring van zowel MLH1 als PMS2. Deze test wordt uitgevoerd voordat een patiënt met een MLH1/PMS2 deficiënte tumor naar de klinisch geneticus verwezen wordt. Dit is omdat door het aantonen van een MLH1-promotor hypermethylering of BRAF-V600E mutatie een sporadische oorzaak van de MMR deficiëntie met redelijk grote zekerheid kan worden vastgesteld. Daarmee hoeft de patiënt niet naar een klinisch geneticus te worden verwezen.
PICO 4b MLH1 promotor hypermethyleringstest versus BRAF mutatieanalyse, welk test geniet de voorkeur?
Volgens de Nederlandse landelijke richtlijn voor erfelijke darmkanker en de NCCN richtlijn (NCCN, 2019) heeft MLH1-promotor hypermethyleringstest de voorkeur boven BRAF-mutatieanalyse. Dit is omdat de afwezigheid van hypermethylering van de MLH1-promotor een hogere voorspellende waarde voor Lynch-syndroom heeft dan de afwezigheid van de BRAF-V600E mutatie. Bij afwezigheid van een BRAF-V600E mutatie moet alsnog een MLH1-hypermethyleringstest worden uitgevoerd. Bij te weinig tumorweefsel voor moleculaire diagnostiek kan BRAF-immunohistochemie worden verricht (NCCN, 2019). In verschillende richtlijnen wordt geen voorkeur gegeven aan MLH1-promotor hypermethyleringstest versus BRAF-mutatieanalyse (Giariello, 2014; Stjepanovic, 2019; Stoffel, 2015; Syngal, 2015).
PICO 5 Is het screenen/testen met alleen PMS2 en MSH6 IHC voldoende?
Volgens de Nederlandse landelijke richtlijn voor erfelijke darmkanker verdient IHC van alle vier MMR eiwitten de voorkeur, omdat bij een beperking van dit panel een aantal gevallen zullen worden gemist. Zie verder overwegingen.
PICO 6 Wat zijn de minimale eisen aan de te gebruiken technieken voor PICO 2 en 4?
Voor betrouwbaarheid van de analyses (uitvoering en interpretatie), is validatie en periodieke toetsing in externe kwaliteitsronden belangrijk (Richtlijn erfelijke darmkanker, 2015; Sepulveda, 2017; NICE, 2017).
MMR analyse: In een richtlijn van de Verenigde staten over moleculaire biomarkers voor colorectaal carcinoom (Sepulveda, 2017) wordt verwezen naar een richtlijn van de College of American Pathologists en Laboratory Quality Center van 2014 betreffende validatie van IHC testen (Fitzgibbons, 2014). In die richtlijn zijn er 14 adviezen voor het betrouwbaar valideren van IHC testen waaronder predictieve biomarkers.
MSI analyse, MLH1-hypermethyleringstest en BRAF-mutatieanalyse: Voor MSI analyse moet rekening gehouden worden met de minimale hoeveelheid tumorcellen, die nodig is voor een betrouwbare analyse (Richtlijn erfelijke darmkanker,2015).
Samenvatting van systematische reviews en meta-analyses
PICO 1 Wat zijn de indicaties voor MMR/MSI bepaling?
Geen systemische reviews of meta-analyses beschikbaar.
PICO 2 Welke test verdient de voorkeur (MMR IHC of MSI analyse)?
In een recent systematisch review van de Britse National Institute for Health Research van 2017 (Snowsill, 2017) varieerde de sensitiviteit van MSI analyse voor het detecteren van Lynch-syndroom van 67% tot 100% en de specificiteit van 61% tot 93%. De geïncludeerde studies waren verschillend wat betreft de methodiek en variatie in panel van microsatellieten. In dezelfde systematische review varieerde de sensitiviteit van MMR analyse voor het detecteren van Lynch-syndroom van 81% tot 100% en de specificiteit was in twee geïncludeerde studies 81% en 92%. De sensitiviteit en specificiteit van de MSI en MMR testen is hoger voor het detecteren van MMR deficiënte/MSI tumoren ongeacht of deze van sporadische of erfelijke origine zijn, maar daarover ontbreken systematische reviews of meta-analyses. Zie hiervoor verder overwegingen.
PICO 3a Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (biopt primaire tumor of resectiepreparaat)?
Geen systemische reviews of meta-analyses beschikbaar.
PICO 3b Welk materiaal genie t de voorkeur voor de uitvoering van de analyses (primaire tumor of metastase)?
Er wordt hoge concordantie tussen primaire tumor en metastasen in de meeste studies aangetoond, maar het aantal studies is klein (Bhullar, 2019).
Geen PICO 4a Wat zijn de indicaties voor MLH1-promotor hypermethyleringstest of BRAF-mutatieanalyse?
Geen systemische reviews of meta-analyses beschikbaar.
PICO 4b MLH1-promotor hypermethyleringstest versus BRAF-mutatieanalyse, welk test geniet de voorkeur?
Geen systemische reviews of meta-analyses beschikbaar.
PICO 5 Is het screenen/testen met alleen PMS2 en MSH6 IHC voldoende?
Geen systemische reviews of meta-analyses beschikbaar.
PICO 6 Wat zijn de minimale eisen aan de te gebruiken technieken voor deelvraag 2 en 4?
Geen systemische reviews of meta-analyses beschikbaar.
Samenvatting van nationale data en populatiestudies
Voor de deelvragen zijn er geen relevante nationale data of populatiestudies beschikbaar.
Zoeken en selecteren
Uitkomstmaten
Sensitiviteit, specificiteit, concordantie tussen testen, haalbaarheid, verandering medisch beleid
PICO(s)
PICO 1 Wat zijn de indicaties voor MMR/MSI bepaling?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: structureel testen bij iedere patiënt met CRC jonger dan 70 en op indicatie bij patiënten ouder dan 70;
C: (a) niet structureel/screenend testen jonger dan 70; (b) testen bij alle CRC patiënten;
O: detectie van Lynch syndroom, invloed op therapiekeuze.
PICO 2 Welke test verdient de voorkeur (MMR IHC of MSI analyse)?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: MMR immunohistochemie;
C: MSI analyse;
O: sensitiviteit, specificiteit, kosten, haalbaarheid.
PICO 3a Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (biopt primaire tumor of resectiepreparaat)?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: biopt primaire tumor;
C: resectiepreparaat primaire tumor;
O: concordantie in MMR/MSI status tussen resectie primaire tumor en voorafgaand endoscopisch biopt, haalbaarheid.
PICO 3b Welk materiaal geniet de voorkeur voor de uitvoering van de analyses (primaire tumor of metastase)?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: metastase;
C: primaire tumor;
O: concordantie in MMR/MSI status tussen primaire tumor en metastase, haalbaarheid.
PICO 4a Wat zijn de indicaties voor MLH1 promotor hypermethyleringstest of BRAF mutatieanalyse?
P: patiënten met MLH1 deficiënt colorectaal carcinoom die voor MLH1 promotor hypermethyleringstest of BRAF mutatieanalyse in aanmerking komen;
I: structureel MLH1 promotor hypermethyleringsstatus of BRAF mutatiestatus bij iedere patiënt met MMR deficiënt CRC op basis van MLH1 deficiëntie bepalen;
C: niet MLH1 promotor hypermethyleringstest/BRAF mutatieanalyse verrichten;
O: detectie van Lynch syndroom.
PICO 4b MLH1 promotor hypermethyleringstest versus BRAF mutatieanalyse, welk test geniet de voorkeur?
P: patiënten met MLH1 deficiënt colorectaal carcinoom;
I: BRAF-mutatieanalyse;
C: MLH1 promotor hypermethyleringstest;
O: haalbaarheid, sensitiviteit, specificiteit.
PICO 5 Is het screenen/testen met alleen PMS2 en MSH6 IHC voldoende?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: panel van 2 kleuringen: IHC met PMS2 en MSH6;
C: panel van 4 kleuringen: IHC met MLH1, PMS2, MSH2 en MSH6;
O: sensitiviteit en specificiteit voor MMR deficiëntie detectie.
PICO 6 Wat zijn de minimale eisen aan de te gebruiken technieken voor deelvraag 2 en 4?
P: patiënten met colorectaal carcinoom die voor MMR/MSI analyse in aanmerking komen;
I: gevalideerde MMR IHC/ moleculaire testen;
C: laboratorium zonder kwalificatie;
O: betrouwbare testresultaten.
Referenties
- Bartley AN, Luthra R, Saraiya DS, Urbauer DL, Broaddus RR. Identification of cancer patients with Lynch syndrome: clinically significant discordances and problems in tissue-based mismatch repair testing. Cancer Prev Res (Phila). 2012 Feb;5(2):320-7. doi: 10.1158/1940-6207.CAPR-11-0288. Epub 2011 Nov 15. PubMed PMID: 22086678; PubMed Central PMCID: PMC3273660.
- Bhullar DS, Barriuso J, Mullamitha S, Saunders MP, O'Dwyer ST, Aziz O. Biomarker concordance between primary colorectal cancer and its metastases. EBioMedicine. 2019 Feb;40:363-374. doi: 10.1016/j.ebiom.2019.01.050. Epub 2019 Feb 4. PubMed PMID: 30733075; PubMed Central PMCID: PMC6413540.
- Chen W, Swanson BJ, Frankel WL. Molecular genetics of microsatellite-unstable colorectal cancer for pathologists. Diagn Pathol. 2017 Mar 4;12(1):24. doi: 10.1186/s13000-017-0613-8. Review. PubMed PMID: 28259170; PubMed Central PMCID: PMC5336657
- Dasgupta S, Ewing-Graham PC, Groenendijk FH, Stam O, Biermann KE, Doukas M, Dubbink HJ, van Velthuysen MF, Dinjens WNM, Van Bockstal MR. Granular dot-like staining with MLH1 immunohistochemistry is a clone-dependent artefact. Pathol Res Pract. 2019 Aug 5:152581. doi: 10.1016/j.prp.2019.152581. (Epub ahead of print) PubMed PMID: 31402167.
- Evaluation of Genomic Applications in Practice and Prevention (EGAPP) Working Group. Recommendations from the EGAPP Working Group: genetic testing strategies in newly diagnosed individuals with colorectal cancer aimed at reducing morbidity and mortality from Lynch syndrome in relatives. Genet Med. 2009 Jan;11(1):35-41. doi: 10.1097/GIM.0b013e31818fa2ff. PubMed PMID: 19125126; PubMed Central PMCID: PMC2743612.
- Evaluation of Genomic Applications in Practice and Prevention (EGAPP) Working Group. Recommendations from the EGAPP Working Group: genetic testing strategies in newly diagnosed individuals with colorectal cancer aimed at reducing morbidity and mortality from Lynch syndrome in relatives. Genet Med. 2009 Jan;11(1):35-41. doi: 10.1097/GIM.0b013e31818fa2ff. PubMed PMID: 19125126; PubMed Central PMCID: PMC2743612
- Fitzgibbons PL, Bradley LA, Fatheree LA, Alsabeh R, Fulton RS, Goldsmith JD, Haas TS, Karabakhtsian RG, Loykasek PA, Marolt MJ, Shen SS, Smith AT, Swanson PE; College of American Pathologists Pathology and Laboratory Quality Center. Principles of analytic validation of immunohistochemical assays: Guideline from the College of American Pathologists Pathology and Laboratory Quality Center. Arch Pathol Lab Med. 2014 Nov;138(11):1432-43. doi: 10.5858/arpa.2013-0610-CP. Epub 2014 Mar 19. PubMed PMID: 24646069
- Giardiello FM, Allen JI, Axilbund JE, Boland CR, Burke CA, Burt RW, Church JM, Dominitz JA, Johnson DA, Kaltenbach T, Levin TR, Lieberman DA, Robertson DJ, Syngal S, Rex DK. Guidelines on genetic evaluation and management of Lynch syndrome: a consensus statement by the US Multi-society Task Force on colorectal cancer. Am J Gastroenterol. 2014 Aug;109(8):1159-79. doi: 10.1038/ajg.2014.186. Epub 2014 Jul 22. PubMed PMID: 25070057
- Hall G, Clarkson A, Shi A, Langford E, Leung H, Eckstein RP, Gill AJ. Immunohistochemistry for PMS2 and MSH6 alone can replace a four antibody panel for mismatch repair deficiency screening in colorectal adenocarcinoma. Pathology. 2010;42(5):409-413. doi:10.3109/00313025.2010.493871
- Hissong E, Crowe EP, Yantiss RK, Chen YT. Assessing colorectal cancer mismatch repair status in the modern era: a survey of current practices and re-evaluation of the role of microsatellite instability testing. Mod Pathol. 2018 Nov;31(11):1756-1766. doi: 10.1038/s41379-018-0094-7. Epub 2018 Jun 28. PubMed PMID: 29955148.
- Klarskov L, Lindebjerg J. Danish Colorectal Cancer Group´s National Guidelines for Diagnosis and Treatment of Colorectal Cancer. 2016. https://dccg.dk/wp-content/uploads/2017/08/2016_pat_dMMR.pdf
- Kumarasinghe AP, de Boer B, Bateman AC, Kumarasinghe MP. DNA mismatch repair enzyme immunohistochemistry in colorectal cancer: a comparison of biopsy and resection material. Pathology. 2010;42(5):414-20. doi: 10.3109/00313025.2010.493862. PubMed PMID: 20632816.
- Mangold E, Pagenstecher C, Friedl W, Fischer HP, Merkelbach-Bruse S, Ohlendorf M, Friedrichs N, Aretz S, Buettner R, Propping P, Mathiak M. Tumours from MSH2 mutation carriers show loss of MSH2 expression but many tumours from MLH1 mutation carriers exhibit weak positive MLH1 staining. J Pathol. 2005 Dec;207(4):385-95. PubMed PMID: 16216036.
- Mojtahed A, Schrijver I, Ford JM, Longacre TA, Pai RK. A two-antibody mismatch repair protein immunohistochemistry screening approach for colorectal carcinomas, skin sebaceous tumors, and gynecologic tract carcinomas. Mod Pathol. 2011 Jul;24(7):1004-14. doi: 10.1038/modpathol.2011.55. Epub 2011 Apr 15. PMID: 21499234.
- Moreira L, Balaguer F, Lindor N, de la Chapelle A, Hampel H, Aaltonen LA, Hopper JL, Le Marchand L, Gallinger S, Newcomb PA, Haile R, Thibodeau SN, Gunawardena S, Jenkins MA, Buchanan DD, Potter JD, Baron JA, Ahnen DJ, Moreno V, Andreu M, Ponz de Leon M, Rustgi AK, Castells A; EPICOLON Consortium. Identification of Lynch syndrome among patients with colorectal cancer. JAMA. 2012 Oct 17;308(15):1555-65. doi: 10.1001/jama.2012.13088. PubMed PMID: 23073952; PubMed Central PMCID: PMC3873721.
- National Institute for Health and Care excellence. Molecular testing strategies for Lynch syndrome in poeple with colorectal cancer. NICE guideline (DG27), 2017. https://www.nice.org.uk/guidance/dg27/chapter/1-Recommendations
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Genetic/Familial High-Risk Assessment: Colorectal. Vesion 2.2019 – August 8, 2019. https://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Colon Cancer. Version 2.2019 – May 15, 2019. https://www.nccn.org/professionals/physician_gls/pdf/colon.pdf.
- Niu BT, Hammond RFL, Leen SLS, Gilks CB, Singh N. Two versus four immunostains for Lynch syndrome screening in endometrial carcinoma. Histopathology. 2019 Sep;75(3):442-445. doi: 10.1111/his.13898. Epub 2019 Jul 26. PubMed PMID: 31077605.
- Okkels H, Lindorff-Larsen K, Thorlasius-Ussing O, Vyberg M, Lindebjerg J, Sunde L, Bernstein I, Klarskov L, Holck S, Krarup HB. MSH6 mutations are frequent in hereditary nonpolyposis colorectal cancer families with normal pMSH6 expression as detected by immunohistochemistry. Appl Immunohistochem Mol Morphol. 2012 Oct;20(5):470-7. doi: 10.1097/PAI.0b013e318249739b. PubMed PMID: 22495361.
- O'Regan T, Chau K, Tatton M, Smith T, Parry S, Bissett I. Immunochemistry screening for Lynch syndrome in colorectal adenocarcinoma using an initial two antibody panel can replace a four antibody panel. N Z Med J. 2013 Sep 13;126(1382):70-7. PMID: 24154771.
- Overbeek LI, Ligtenberg MJ, Willems RW, Hermens RP, Blokx WA, Dubois SV, van der Linden H, Meijer JW, Mlynek-Kersjes ML, Hoogerbrugge N, Hebeda KM, van Krieken JH. Interpretation of immunohistochemistry for mismatch repair proteins is only reliable in a specialized setting. Am J Surg Pathol. 2008 Aug;32(8):1246-51. PubMed PMID: 18677806.
- Pagin A, Zerimech F, Leclerc J, Wacrenier A, Lejeune S, Descarpentries C, Escande F, Porchet N, Buisine MP. Evaluation of a new panel of six mononucleotide repeat markers for the detection of DNA mismatch repair-deficient tumours. Br J Cancer. 2013 May 28;108(10):2079-87. doi: 10.1038/bjc.2013.213. Epub 2013 May 7. PubMed PMID: 23652311; PubMed Central PMCID: PMC3670492.
- Palomaki GE, McClain MR, Melillo S, Hampel HL, Thibodeau SN. EGAPP supplementary evidence review: DNA testing strategies aimed at reducing morbidity and mortality from Lynch syndrome. Genet Med. 2009 Jan;11(1):42-65. doi: 10.1097/GIM.0b013e31818fa2db. Review. PubMed PMID: 19125127; PubMed Central PMCID: PMC2743613.
- Palomaki GE, McClain MR, Melillo S, Hampel HL, Thibodeau SN. EGAPP supplementary evidence review: DNA testing strategies aimed at reducing morbidity and mortality from Lynch syndrome. Genet Med. 2009 Jan;11(1):42-65. doi: 10.1097/GIM.0b013e31818fa2db. Review. PubMed PMID: 19125127; PubMed Central PMCID: PMC2743613.
- Parsons MT, Buchanan DD, Thompson B, Young JP, Spurdle AB. Correlation of tumour BRAF mutations and MLH1 methylation with germline mismatch repair (MMR) gene mutation status: a literature review assessing utility of tumour features for MMR variant classification. J Med Genet. 2012 Mar;49(3):151-7. doi: 10.1136/jmedgenet-2011-100714. Review. PubMed PMID: 22368298.
- Pearlman R, Markow M, Knight D, Chen W, Arnold CA, Pritchard CC, Hampel H, Frankel WL. Two-stain immunohistochemical screening for Lynch syndrome in colorectal cancer may fail to detect mismatch repair deficiency. Mod Pathol. 2018 Dec;31(12):1891-1900. doi: 10.1038/s41379-018-0058-y. Epub 2018 Jul 2. PubMed PMID: 29967423.
- Radu OM, Nikiforova MN, Farkas LM, Krasinskas AM. Challenging cases encountered in colorectal cancer screening for Lynch syndrome reveal novel findings: nucleolar MSH6 staining and impact of prior chemoradiation therapy. Hum Pathol. 2011 Sep;42(9):1247-58. doi: 10.1016/j.humpath.2010.11.016. Epub 2011 Feb 21. PubMed PMID: 21334712.
- Sarode VR, Robinson L. Screening for Lynch Syndrome by Immunohistochemistry of Mismatch Repair Proteins: Significance of Indeterminate Result and Correlation With Mutational Studies. Arch Pathol Lab Med. 2019 Mar 27. doi: 10.5858/arpa.2018-0201-OA. (Epub ahead of print) PubMed PMID: 30917047.
- Schirripa M, Biason P, Lonardi S, Pella N, Pino MS, Urbano F, Antoniotti C, Cremolini C, Corallo S, Pietrantonio F, Gelsomino F, Cascinu S, Orlandi A, Munari G, Malapelle U, Saggio S, Fontanini G, Rugge M, Mescoli C, Lazzi S, Reggiani Bonetti L, Lanza G, Dei Tos AP, De Maglio G, Martini M, Bergamo F, Zagonel V, Loupakis F, Fassan M. Class 1, 2, and 3 BRAF-Mutated Metastatic Colorectal Cancer: A Detailed Clinical, Pathologic, and Molecular Characterization. Clin Cancer Res. 2019 Jul 1;25(13):3954-3961. doi: 10.1158/1078-0432.CCR-19-0311. Epub 2019 Apr 9. PubMed PMID: 30967421.
- Sepulveda AR, Hamilton SR, Allegra CJ, Grody W, Cushman-Vokoun AM, Funkhouser WK, Kopetz SE, Lieu C, Lindor NM, Minsky BD, Monzon FA, Sargent DJ, Singh VM, Willis J, Clark J, Colasacco C, Rumble RB, Temple-Smolkin R, Ventura CB, Nowak JA. Molecular Biomarkers for the Evaluation of Colorectal Cancer: Guideline From the American Society for Clinical Pathology, College of American Pathologists, Association for Molecular Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017 May 1;35(13):1453-1486. doi: 10.1200/JCO.2016.71.9807. Epub 2017 Feb 6. Review. PubMed PMID: 28165299.
- Shia J, Holck S, Depetris G, Greenson JK, Klimstra DS. Lynch syndrome-associated neoplasms: a discussion on histopathology and immunohistochemistry. Fam Cancer. 2013 Jun;12(2):241-60. doi: 10.1007/s10689-013-9612-4. Review. PubMed PMID: 23435936.
- Shia J, Stadler Z, Weiser MR, Rentz M, Gonen M, Tang LH, Vakiani E, Katabi N, Xiong X, Markowitz AJ, Shike M, Guillem J, Klimstra DS. Immunohistochemical staining for DNA mismatch repair proteins in intestinal tract carcinoma: how reliable are biopsy samples? Am J Surg Pathol. 2011 Mar;35(3):447-54. doi: 10.1097/PAS.0b013e31820a091d. PubMed PMID: 21297438.
- Shia J, Tang LH, Vakiani E, Guillem JG, Stadler ZK, Soslow RA, Katabi N, Weiser MR, Paty PB, Temple LK, Nash GM, Wong WD, Offit K, Klimstra DS. Immunohistochemistry as first-line screening for detecting colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome: a 2-antibody panel may be as predictive as a 4-antibody panel. Am J Surg Pathol. 2009 Nov;33(11):1639-45.
- Shia J. Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome. Part I. The utility of immunohistochemistry. J Mol Diagn. 2008 Jul;10(4):293-300. doi: 10.2353/jmoldx.2008.080031. Epub 2008 Jun 13. PubMed PMID: 18556767; PubMed Central PMCID: PMC2438196.
- Snowsill T, Coelho H, Huxley N, Jones-Hughes T, Briscoe S, Frayling IM, Hyde C. Molecular testing for Lynch syndrome in people with colorectal cancer: systematic reviews and economic evaluation. Health Technol Assess. 2017 Sep;21(51):1-238. doi: 10.3310/hta21510. Review. PubMed PMID: 28895526; PubMed Central PMCID: PMC5611555.
- Stjepanovic N, Moreira L, Carneiro F, Balaguer F, Cervantes A, Balmaña J, Martinelli E. Hereditary gastrointestinal cancers: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019 Aug 5. pii: mdz233. doi: 10.1093/annonc/mdz233. (Epub ahead of print) PubMed PMID: 31378807.
- Stoffel EM, Mangu PB, Gruber SB, Hamilton SR, Kalady MF, Lau MW, Lu KH, Roach N, Limburg PJ; American Society of Clinical Oncology; European Society of Clinical Oncology. Hereditary colorectal cancer syndromes: American Society of Clinical Oncology Clinical Practice Guideline endorsement of the familial risk-colorectal cancer: European Society for Medical Oncology Clinical Practice Guidelines. J Clin Oncol. 2015 Jan 10;33(2):209-17. doi: 10.1200/JCO.2014.58.1322. Epub 2014 Dec 1. PubMed PMID: 25452455; PubMed Central PMCID: PMC5321096.
- Syngal S, Brand RE, Church JM, Giardiello FM, Hampel HL, Burt RW; American College of Gastroenterology. ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol. 2015 Feb;110(2):223-62; quiz 263. doi: 10.1038/ajg.2014.435. Epub 2015 Feb 3. Review. PubMed PMID: 25645574; PubMed Central PMCID: PMC4695986.
- Warrier SK, Trainer AH, Lynch AC, Mitchell C, Hiscock R, Sawyer S, Boussioutas A, Heriot AG. Preoperative diagnosis of Lynch syndrome with DNA mismatch repair immunohistochemistry on a diagnostic biopsy. Dis Colon Rectum. 2011 Dec;54(12):1480-7. doi: 10.1097/DCR.0b013e318231db1f. PubMed PMID: 22067175.
- Watson N, Grieu F, Morris M, Harvey J, Stewart C, Schofield L, Goldblatt J, Iacopetta B. Heterogeneous staining for mismatch repair proteins during population-based prescreening for hereditary nonpolyposis colorectal cancer. J Mol Diagn. 2007 Sep;9(4):472-8. Epub 2007 Jul 25. PubMed PMID: 17652638; PubMed Central PMCID: PMC1975100.
- Wu X, Snir O, Rottmann D, Wong S, Buza N, Hui P. Minimal microsatellite shift in microsatellite instability high endometrial cancer: a significant pitfall in diagnostic interpretation. Mod Pathol. 2019 May;32(5):650-658. doi: 10.1038/s41379-018-0179-3. Epub 2018 Nov 15. PubMed PMID: 30443012.
- Zhang L. Immunohistochemistry versus microsatellite instability testing for screening colorectal cancer patients at risk for hereditary nonpolyposis colorectal cancer syndrome. Part II. The utility of microsatellite instability testing. J Mol Diagn. 2008 Jul;10(4):301-7. doi: 10.2353/jmoldx.2008.080062. Epub 2008 Jun 13. PubMed PMID: 18556776; PubMed Central PMCID: PMC2438197.
Evidence tabellen
Samenvattingstabel van bevindingen uit systematische reviews en meta-analyses
Should MSI be used to diagnose Lynch syndrome in patients suspected of colorectal cancer?
Patient or population : patients suspected of colorectal cancer
Range of sensitivities : 0.67 to 1.00 | Range of specificities : 0.61 to 0.93
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants |
Certainty of the Evidence (GRADE) |
||
|
Prevalence 2.8% No age limit |
Prevalence 8.4% <50 years |
Prevalence 5.7% <60 years |
|||
|
True positives |
19 to 28 |
56 to 84 |
38 to 57 |
2430 |
⨁◯◯◯ |
|
False negatives |
0 to 9 |
0 to 28 |
0 to 19 |
||
|
True negatives |
593 to 904 |
559 to 852 |
575 to 877 |
2451 |
⨁⨁◯◯ |
|
False positives |
68 to 379 |
64 to 357 |
66 to 368 |
||
CI: Confidence interval
Explanations
a. Authors judged the RoB with the QUADAS tool, no RoB was reported.
b. It would be expected that studies recruiting high-risk population-based studies have higher sensitivity estimates compared to population-based studies. However, no great differences were observed (see review by Polomaki)
c. Factors such as the particular MSI testing methods, panel of markers and thresholds used, as well as methods used to conduct the reference standard, varied between studies.
d. The sensitivity within the high-risk sample ranged from 79.4% to 100%.
e. Moderate difference in sensitivity: 10 - 20% accros the single-gate studies recruiting high-risk samples.
f. Large difference in specificity: more than 30% accross the population-based single-gate studies.
|
GRADE Working Group grades of evidence |
Should IHC be used to diagnose Lynch syndrome in patients suspected of colorectal cancer?
Patient or population : patients suspected of colorectal cancer
Range of sensitivities : 0.81 to 1.00 | Range of specificities : 0.81 to 0.92
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants |
Certainty of the Evidence (GRADE) |
||
|
Prevalence 2.8% No age limit |
Prevalence 8.4% <50 years |
Prevalence 5.7% <60 years |
|||
|
True positives |
23 to 28 |
68 to 84 |
46 to 57 |
1854 |
⨁◯◯◯ |
|
False negatives |
0 to 5 |
0 to 16 |
0 to 11 |
||
|
True negatives |
782 to 893 |
737 to 842 |
759 to 867 |
326 |
⨁⨁◯◯ |
|
False positives |
79 to 190 |
74 to 179 |
76 to 184 |
||
CI: Confidence interval
Explanations
a. Sensitivity in single-gate studies recruiting high-risk samples ranges from 80.8 - 96.4.
b. Moderate difference in sensitivity: 10 - 20% accros the single-gate studies recruiting high-risk samples.
c. It would be expected that studies recruiting high-risk population-based studies have higher sensitivity estimates compared to population-based studies. However, no great differences were observed (see review by Polomaki).
d. No or trivial difference in specificity: 0-10%.
e. Small sample size.
|
GRADE Working Group grades of evidence |
|
Biomarker concordance between primary colorectal cancer and its metastases - BRAF |
|
|||
|
Patient or population: Studies were included provided that patients had a confirmed diagnosis of metastatic colorectal adenocarcinoma, and mutational biomarker analysis on biopsies both from the colorectal primary and at least one site of metastasis. Outcome: Pooled discordance |
|
|||
|
Outcome |
Disconcordance |
Certainty |
What happens |
|
|
Proportion Disconcordance |
0.01 |
⨁⨁⨁◯ |
Pooled discordance proportion: 0.01 (0.00; 0.02) Heterogeneity: I2 = 59 X2 = 50.81 (p < 0.01) |
|
|
CI: Confidence interval |
|
|||
|
GRADE Working Group grades of evidence |
|
|||
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-12-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden voor een periode van 3 jaar, met optionele verlenging van 3 jaar. De werkgroep zal halfjaarlijks bijeen komen voor een herbeoordeling van de geldigheid van de modules in deze richtlijn. De geldigheid van richtlijnmodules zal bij herbeoordeling komen te vervallen wanneer nieuwe ontwikkelingen aanleiding geven om een herzieningstraject te starten. De Nederlandse Vereniging voor Heelkunde (NVvH) is regiehouder van deze richtlijn en eindverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. Per module is aangegeven welke wetenschappelijke vereniging de eerstverantwoordelijke is voor de actualiteitsbeoordeling (zie de Algemene inleiding).
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het beschrijven van het beleid bij patiënten met een colorectaal carcinoom: gestandaardiseerd en op hun wensen afgestemd in alle fasen van de ziekte.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom in de tweede en derde lijn.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom te maken hebben. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De huidige samenstelling van de werkgroep
- Prof. dr. P.J. (Pieter) Tanis, gastrointestinaal en oncologisch chirurg, Erasmus MC, Rotterdam, NVvH (voorzitter)
- Prof. dr. G.L. (Geerard) Beets, gastrointestinaal en oncologisch chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
- Prof. dr. R.G.H. (Regina) Beets-Tan, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- S. Dokter (Simone) MSc., verpleegkundig specialist, Antoni van Leeuwenhoek, Amsterdam, V&VN
- C.M.J. (Christel) Gielen MSc., verpleegkundig specialist, Maastricht UMC+, Maastricht, V&VN
- Dr. D.J.A. (Derk Jan) de Groot, internist-oncoloog, UMC Groningen, Groningen, NIV/NVMO (vanaf december 2018)
- Dr. M.E. (Marije) Hamaker, klinisch geriater, Diakonessenhuis, Utrecht, NVKG
- Dr. C.J. (Corneline) Hoekstra, nucleair geneeskundige, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVNG
- Dr. M.P.W. (Martijn) Intven, radiotherapeut, UMC Utrecht, Utrecht, NVRO
- Dr. O.J.L. (Olaf) Loosveld, internist-oncoloog, Amphia Ziekenhuis, Brede, NIV/NVMO
- Dr. M. (Monique) Maas, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- Prof. dr. C.A.M. (Corrie) Marijnen, radiotherapeut, Leids Universiteit Medisch Centrum, Leiden, NVRO
- Dr. M. (Martijn) Meijerink, interventieradioloog, Amsterdam UMC locatie VUmc, Amsterdam, NVvR (vanaf november 2018)
- Dr. L. (Leon) Moons, MDL-arts, UMC Utrecht, Utrecht, NVMDL
- Prof. dr. I.D. (Iris) Nagtegaal, patholoog, Radboud UMC, Nijmegen, NVvP
- Dr. P. (Petur) Snaebjornsson, patholoog, Nederlands Kanker Instituut, Amsterdam, NVvP
- Dr. H.M.W. (Henk) Verheul, internist-oncoloog, Radboudumc, Nijmegen, NIV/NVMO
- Prof. dr. C. (Kees) Verhoef, oncologisch chirurg, Erasmus MC, Rotterdam, NVvH
- Dr. M. (Marianne) de Vries, abdominaal radioloog, Erasmus MC, Rotterdam, NVvR (vanaf november 2018)
- Dr. H.L. (Erik) van Westreenen, chirurg, Isala Zwolle/ Isala Diaconessenhuis, Zwolle/Meppel, NVvH
Voormalig betrokken werkgroepleden
- Prof. dr. C.J.A. (Kees) Punt, medisch oncoloog, NIV/NVMO
- Prof. dr. J. (Jaap) Stoker, abdominaal radioloog, NVvR
- Dr. A.J. (Albert Jan) ten Tije, internist oncoloog, NIV/NVMO
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
De werkgroep heeft bij aanvang van het richtlijnontwikkelingstraject geconstateerd dat sommige werkgroepleden betrokken zijn bij wetenschappelijk onderzoek dat wordt gefinancierd door overheid, onafhankelijke subsidieverstrekkers, of commerciële partijen (in het laatste geval: unrestricted scientific grants). Om te voorkomen dat indirecte belangen (waaronder reputatie en kennisvalorisatie) de richtlijnaanbevelingen onbedoeld zouden kunnen beïnvloeden, heeft de werkgroep besloten dat geen van de modules/aanbevelingen worden opgesteld door één werkgroeplid met dergelijke indirecte belangen. Tenminste één ander werkgroeplid met hetzelfde specialisme of tenminste één ander werkgroeplid met vergelijkbare inhoudelijke kennis van het betreffende onderwerp zijn verantwoordelijk voor de inhoud (vier-ogen-principe).
De werkgroep zag in de gemelde (on)betaalde nevenfuncties geen aannemelijke reden voor onbedoelde beïnvloeding door belangenverstrengeling ten aanzien van de onderwerpen die in de richtlijn aan bod komen.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. P.J. (Pieter) Tanis
|
Gastrointestinaal en oncologisch chirurg |
Voorzitter Dutch Colorectal Cancer Group (onbetaald)
Bestuurslid Dutch Peritoneal Oncology Group (onbetaald)
Bestuurslid Dutch Colorectal Audit (onbetaald)
Medische adviesraad Lynch Polyposis vereniging (onbetaald)
Associate Editor Colorectal Disease (onbetaald)
Coordinerend auteur hoofdstuk tumoren van de dunne en dikke darm, leerboek Oncologie (onbetaald) |
PI van COLOPEC 1 en 2 trials gefinancierd door ZonMW en KWF.
Steering committee van de CAIRO6 studie gefinancierd door KWF en unrestricted scientific grant Roche.
PI van de BIOPEX 1 studie, gefinancierd door unrestricted scientific grant van LifeCell.
PI van de BIOPEX 2 studie gefinancierd door KWF.
|
Geen actie ondernomen.
Biopex 1 is gepubliceerd in 2013 (verjaard).
Overige subsidies zijn van ZonMW en KWF, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Dr. H.L. (Erik) Van Westreenen
|
Gastrointestinaal en oncologisch chirurg |
Penningmeester werkgroep Coloproctologie (onbetaald) |
PI Limeric study (endoscopisch geassisteerde laparoscopische wigresectie van het colon).
Locale PI en mede aanvrager FORCE study (Zon-MW) (Randomisatie tussen best-supportive care of bekkenfysiotherapie na low-anterior resectie)
Locale PI TESAR study
Locale PI StarTrec study
Locale PI FIT trial |
Geen actie ondernomen.
Mede-aanvrager van ZonMW subsidie, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Prof. dr. C.J.A. (Kees) Punt
|
Medisch oncoloog |
Voorzitter werkgroep medische oncologie, Dutch Colorectal Cancer Group (DCCG) (onbetaald).
Voorzitter Dutch Oncology Research Platform (onbetaald). |
Lid raad van advies SPKS
Unrestricted scientific grants van Roche en Amgen voor DCCG CAIRO5 studie.
Adviseur Nordic Pharma. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. M.E. (Marije) Hamaker
|
Klinisch geriater |
Geen |
Roche: lid van werkgroep e-learning colorectaal carcinoom (niet relevant voor de richtlijn)
Astra Zeneca: financiering van onderzoek over dialyse bij ouderen |
Geen actie ondernomen. |
|
Dr. L. (Leon) Moons
|
MDL-arts |
Consultant voor Boston Scientific (consultancy over specifieke apparatuur voor MDL-artsen, niet relevant voor de richtlijn) |
Voorzitter van T1 CRC werkgroep.
PI van een gerandomiseerde studie (piecemeal EMR vs. ESD), gefinancierd door KWF.
PI van een studie naar risicomodellen voor het voorspellen van lymfekliermetastasen en lokale recidieven van T1 CRCs, gefinancierd door de MLDS.
PI van een studie naar tumor seedings tijdens coloscopie, gefinancierd door de Sacha Swarttouw-Hijmans stichting. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Prof. dr. C.A.M. (Corrie) Marijnen
|
Radiotherapeut / Afdelingshoofd radiotherapie LUMC |
Voorzitter wetenschapscommissie NVRO
Redactielid leerboek Oncologie |
Geen. |
Geen actie ondernomen. |
|
Dr. M.P.W. (Martijn) Intven
|
Radiotherapeut |
Lid redactieraad van het Nederlands tijdschrift voor oncologie |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. I.D. (Iris) Nagtegaal
|
Patholoog / Detachering als Expert Pathologie t.b.v. het bevolkingsonderzoek darmkanker bij FSB |
Voorzitter PALGA (Nederlands Digitale Pathologie Archief) (vacatiegelden naar afdeling Pathologie van RadboudUMC)
Lid adviesraad KWF (onbetaald)
Voorzitter European Taskforce for synoptic reporting in pathology (onbetaald)
Voorzitter Nederlands TNM committee (onbetaald) |
Amgen 2014: Discordance in mutation statis is not an issue for molecular testing in CRC (80.000 euro) |
Geen van de modules/ aanbevelingen zijn opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen. |
|
Dr. P. (Petur) Snaebjornsson
|
Patholoog |
Bestuurslid Dutch Colorectal Cancer Group (onbetaald)
Lid Dutch peritoneal Oncology Group (onbetaald)
Tot en met 2017: Organisator van Dodo couperclub regio Noord-Holland (onbetaald). |
Betrokken bij COLOPEC trials en CAIRO6 trial. |
Geen actie ondernomen. |
|
Prof. dr. R.G.H. (Regina) Beets-Tan
|
Radioloog / Hoofd radiologie NKI/AVL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. A.J. (Bert Jan) ten Tije |
Internist-oncoloog |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. Martijn Meijerink
|
Interventieradioloog, Amsterdam UMC locatie VUmc |
Voorzitter WCIR (wetenschapscommissie interventieradiologie), onbetaald.
Voortzitter SIO (Soc. Interv. Oncol.) Research Committee, onbetaald.
Raad van advies SPKS (stichting voor patiënten met kanker aan het spijsverteringskanaal), onbetaald.
Ambassadeur SBBvK en OZS, onbetaald |
Consultant Angiodynamics B.V. (vergoeding voor presentaties, workshops, proctorships) op het gebied van irreversibele electroporatie.
Research grants: Collision Trial (Medtronic) Diverse trials (Angiodynamics B.V.)
|
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. Marianne de Vries
|
Radioloog Erasmus MC Rotterdam |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. Monique Maas |
Radioloog |
Redactielid blad IMAGO (onkostenvergoeding) |
Geen. |
Geen actie ondernomen. |
|
Dr. Derk Jan de Groot
|
Internist-oncoloog Universitair Medisch Centrum Groningen |
Geen. |
Klinische studies: Ipsen (betaling aan het instituut) |
Geen actie ondernomen. |
|
C.M.J. (Christel) Gielen MSc.
|
Verpleegkundig specialist Coloncare MUMC |
Geen. |
Werkt mee aan de inclusie voor de ENCORE studie (energie voor het leven na colorectaalkanker). |
Geen actie ondernomen. |
|
S. Dokter (Simone) MSc. |
Verpleegkundig specialist MDL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. C.J. (Corneline) Hoekstra
|
Nucleair geneeskundige |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. C. (Kees) Verhoef
|
Oncologisch chirurg |
Wetenschappelijke adviesraad KWF (onbetaald).
Wetenschappelijk raad Livermetsurvey (onbetaald).
Voorzitter Nederlandse Vereniging voor Chirurgische Oncologie (onbetaald).
Lid Algemeen Bestuur Nederlandse Vereniging van Heelkunde (onbetaald).
Voorzitter "Dutch chapter E-AHPBA" (onbetaald).
Nederlands TNM comite (onbetaald).
Adviesraad IKNL (onbetaald).
Nederlandse wetenschappelijke Sarcoom Werkgroep (onbetaald).
Bestuur Dutch Hepatocellular Carcinoma Group (onbetaald).
Bestuur Familiehuis, Daniel den Hoed Kliniek (onbetaald). |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. G.L. (Geerard) Beets
|
Chirurg / Afdelingshoofd AVL |
Medisch consultant bij Champalimaud Foundation, oncologisch ziekenhuis in Lissabon, Portugal (betaalde functie) |
Geen. |
Geen actie ondernomen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS) voor de invitational conference. Daarnaast hebben dr. L. Meerman en mw. A. van Heijst (Stomavereniging, Nederlandse Federatie van Kankerpatiëntenorganisaties, NFK) modules meegelezen en de werkgroep van feedback vanuit het patiëntenperspectief voorzien. De conceptrichtlijn is tevens ter commentaar voorgelegd aan SPKS en NFK. In verbrand met de zeer verslechterde gezondheidstoestand en het overlijden van mw A. van Heijst wordt vanaf maart 2020 feedback vanuit het patiëntperspectief gegeven door dr. L. Meerman en mw. M. v.d. Bosch-Scholts.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de herziene richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat interne en externe kwaliteitsindicatoren al ontwikkeld worden binnen de Dutch Colorectal Audit (DCRA), de clinical audit board betreffend colorectaal carcinoom onder de Dutch Institute for Clinical Auditing (DICA).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVRO, 2014) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van nieuwe evidence, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en werkgroepleden concept-uitgangsvragen opgesteld. Gedurende het richtlijnherzieningstraject heeft de werkgroep de definitieve uitgangsvragen in een hernieuwd raamwerk (de inhoudsopgave, zie ook de algemene inleiding) van de richtlijn vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep baseerde de keuze voor uitkomstmaten mede op basis van de “core outcome set” gepubliceerd door Zerillo (2017). De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Hiervoor sloot de werkgroep zich, waar mogelijk, aan bij de grenzen voor klinische besluitvorming volgens de PASKWIL criteria uit 2016. Wanneer er geen grenzen voor klinische besluitvorming conform de PASKWIL criteria geformuleerd konden worden (bijvoorbeeld bij non-inferioriteitsvraagstukken) werden de standaard GRADE grenzen gehanteerd, tenzij anders vermeld.
Strategie voor zoeken en selecteren van literatuur
De werkgroep raadpleegde voor de afzonderlijke uitgangsvragen reeds gepubliceerde systematische reviews (SRs). SRs kwamen in aanmerking indien: i) systematisch was gezocht in één of meerdere databases; ii) transparante in- en exclusiecriteria zijn toegepast en iii) idealiter de kwaliteit van de geïncludeerde literatuur was beoordeeld. De voor de uitgangsvragen relevante internationale richtlijnen en consensusdocumenten werden eveneens geraadpleegd. Overige literatuur, waar niet systematisch naar werd gezocht, is als bewijsvoering in de overwegingen opgenomen.
Relevante beschikbare populatiegegevens uit Nederland werden gebruikt voor het bepalen van knelpunten, praktijkvariatie en externe validiteit van internationale richtlijnen en gepubliceerde literatuur.
Kwaliteitsbeoordeling individuele studies
De (risk of bias) kwaliteitsbeoordelingen van de individuele studies uit de gebruikte SRs werden gebruikt, tenzij deze afwezig waren of onbruikbaar waren voor het beoordelen van de kracht van het wetenschappelijke bewijs. Indien afwezig of onbruikbaar werd aangenomen dat er een risico op bias aanwezig zou kunnen zijn. In enkele gevallen, wanneer studies informatie verschaften over de cruciale uitkomstma(a)t(en), werd er een nieuwe kwaliteitsbeoordeling van individuele studies uitgevoerd.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van de geselecteerde SRs werden weergegeven in ‘Summary of Findings’ tabellen. De belangrijkste bevindingen uit de literatuur werden kort beschreven onder “Samenvatting literatuur” (kopjes “Samenvatting van internationale richtlijnen en consensusdocumenten” en “Samenvatting van systematische reviews en meta-analyses”) en onder “Overwegingen”. Bestaande meta-analyses uit de gebruikte systematische reviews werden beschreven. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). Het resultaat van de gradering van het wetenschappelijk bewijs werd opgenomen in de ‘Summary of Findings’ tabellen.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’.
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek (te vinden in de ‘Summary of Findings’ tabellen). De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Aanbevelingen uit de richtlijn Colorectaal carcinoom 2014
De werkgroep beoordeelde alle aanbevelingen in de richtlijn Colorectaal carcinoom uit 2014 op geldigheid. De werkgroep heeft aanbevelingen gehandhaafd die als nog steeds geldig werden beschouwd. De werkgroep heeft deze aanbevelingen tekstueel opgefrist met als doel de implementeerbaarheid te vergroten. De aanbevelingen zijn niet inhoudelijk veranderd. De werkgroep heeft in het modulair onderhoudsschema vastgesteld wanneer herziening van deze modules gepland is. De werkgroep verwacht dat eind 2020 de gehele richtlijn is herzien.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Indicatorontwikkeling
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DCRA indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en patiëntorganisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zerillo JA, Schouwenburg MG, van Bommel ACM, Stowell C, Lippa J, Bauer D, Berger AM, Boland G, Borras JM, Buss MK, Cima R, Van Cutsem E, van Duyn EB, Finlayson SRG, Hung-Chun Cheng S, Langelotz C, Lloyd J, Lynch AC, Mamon HJ, McAllister PK, Minsky BD, Ngeow J, Abu Hassan MR, Ryan K, Shankaran V, Upton MP, Zalcberg J, van de Velde CJ, Tollenaar R; Colorectal Cancer Working Group of the International Consortium for Health Outcomes Measurement (ICHOM). An International Collaborative Standardizing a Comprehensive Patient-Centered Outcomes Measurement Set for Colorectal Cancer. JAMA Oncol. 2017 May 1;3(5):686-694. doi: 10.1001/jamaoncol.2017.0417. PubMed PMID: 28384684.
