Locoregionale stadiëring rectumcarcinoom
Uitgangsvraag
Welke beeldvormende modaliteiten zijn geïndiceerd voor locoregionale stadiëring van een rectumcarcinoom en volgens welke criteria dienen ze te worden beoordeeld en gerapporteerd?
De uitgangsvraag omvat de volgende deelvragen:
- Is er naast MRI als standaard modaliteit nog plaats voor endo-echografie en bij welke patiënten?
- Wat is het optimale beeldvormende protocol voor primaire stadiering van het rectumcarcinoom?
- Hoe wordt het rectum gedefinieerd op MRI, op basis van welke criteria wordt een tumor geclassificeerd als rectumcarcinoom, en welke onderverdeling in lokalisatie van het rectumcarcinoom kan worden gemaakt?
- Hoe wordt invasie in (een deel van) de anus gestadieerd?
- Welke criteria worden gehanteerd voor de cN-stadiëring op MRI?
- Welke criteria worden gehanteerd voor MRF-invasie en EMVI op MRI?
- Welke criteria worden gehanteerd voor tumor deposities?
- Heeft MRI met diffusion-weighted imaging (DWI) een rol bij de primaire stadiëring?
- Welke items dienen in een gestructureerd verslag te worden opgenomen?
Aanbeveling
Gebruik voor primaire locoregionale stadiering van rectumcarcinomen MRI met 2D T2-gewogen series in 3 richtingen (coupedikte ≤ 3 mm) met DWI (b-waarde ≥ b800).
Definieer het rectum op basis van de ‘sigmoid take-off’ en benoem tumoren waarvan de onderrand op of distaal van de sigmoid take-off is gelegen als rectumcarcinoom.
Vermeld dit in het radiologisch verslag en in de conclusie.
Maak een tweedeling in lokalisatie van het rectumcarcinoom op basis van de MRI:
- Proximaal rectumcarcinoom: onderrand van de tumor meer dan 5 cm afstand van de anorectale overgang en distaal van of op het niveau van de ‘sigmoid take-off’.
- Distaal rectumcarcinoom: onderrand van de tumor op of minder dan 5 cm afstand van de anorectale overgang.
Noem de mesorectale fascie vrij (MRF-) als op MRI de afstand tussen tumor en mesorectale fascie > 1 mm is.
Noem de mesorectale fascie betrokken (MRF+) als op MRI de afstand tussen een tumor en mesorectale fascie ≤ 1 mm is (MRF+). Beschrijf de locatie van MRF-invasie.
Classificeer de MRF als betrokken (MRF+) wanneer EMVI, tumor deposities of irregulair begrensde klieren ≤ 1 mm afstand hebben tot de MRF. Beschrijf dit separaat.
Noem doorgroei voorbij de MRF tot in een ander orgaan of structuur (inclusief een ander anatomisch compartiment) cT4b.
Stadieer invasie in de externe sphincter of levator ani als cT4b.
Noem peritoneale invasie ter plaatse van de omslagplooi cT4a. Stadieer alleen directe invasie als cT4a; contact van de rectumwand zonder tumordoorgroei met de omslagplooi is niet voldoende om van invasie te spreken.
Classificeer mesorectale lymfeklieren als cN0 of cN+ en geef hierbij de mate van zekerheid aan (zeker cN+, twijfelachtig cN+, zeker cN0). Ken cN+ toe bij ≥ 1 pathologische klier(en).
Benoem mucineuze klieren en klieren met korte-as diameter >9mm altijd als verdacht. Benoem klieren <5mm korte-as als niet verdacht.
Wees beducht op overstadiering en kies bij twijfel het laagste stadium.
Benoem de locatie en korte-as diameter van de hoogst gelegen pathologische klier ivm de radiotherapieplanning.
NB Voor definitie van regionale (cN) en extraregionale (cM) lymfklieren bij rectumcarcinoom, zie module lymfeklieren.
Beschrijf de aanwezigheid van laterale klieren in de obturatorloge of a. iliaca interna regio en meet de korte-as diameter. Noem deze verdacht bij een korte-as diameter van ≥ 7 mm. Vermeld de verdachte laterale klieren ook in de conclusie.
Beschrijf de aan- of afwezigheid van extramurale veneuze invasie (EMVI), en classificeer graad 3 of 4 als EMVI+.
Beschrijf separaat de aan- of afwezigheid van tumor deposities.
Benoem bij zichtbare tumor deposities aantal en locatie, en classificeer dit tevens als cN+.
Maak een gestructureerd verslag.
|
Overzichtstabel MRI items primaire stadiering rectumcarcinoom |
||
|
Item |
score |
Definities, omschrijving en aandachtspunten |
|
cT |
cT1* |
|
|
|
cT2* |
|
|
|
cT3a-d |
Mesorectale invasiediepte voorbij de muscularis propria: T3a < 1 mm; T3b 1-5 mm; T3c 5-15mm; T3d >15 mm |
|
|
cT4a |
Directe invasie in het peritoneum. cT4a dient niet automatisch ook als MRF+ te worden gescoord. |
|
|
cT4b |
Doorgroei voorbij MRF in ander orgaan of structuur (ook externe sfincter, levator en bekkenzijwand) |
|
MRF |
MRF - |
>1 mm |
|
|
MRF+ |
≤ 1 mm; benoem betrokkenheid op basis van primaire tumor, EMVI en/of TD separaat, en lokalisatie. |
|
cN# |
Zeker cN0 |
Benoem klieren <5 mm korte-as als benigne, tenzij mucineus. |
|
|
Twijfelachtig cN+ |
|
|
|
Zeker cN+ |
Benoem mucineus en korte-as >9 mm altijd als verdacht. |
|
TD |
TD - |
|
|
|
TD + |
Benoem aantal en lokalisatie. Bij TD+ ook cN+ scoren. |
|
EMVI |
EMVI - |
Graad 0-2 |
|
|
EMVI + |
Graad 3-4 |
|
Laterale klieren |
Geen verdachte klieren of niet zichtbaar |
|
|
|
Wel zichtbaar |
Laterale klieren met >/=7mm korte-as diameter (of mucineus) zijn verdacht; benoem aantal, (incl. zijdigheid) locatie en korte-as diameter. |
*MRI kan cT1 niet accuraat onderscheiden van cT2
#Wees beducht op overstadiering en kies bij twijfel het laagste stadium
Overwegingen
Definitie van het rectum
Voor eenduidigheid in interpretatie van de richtlijn, dagelijkse praktijkvoering, kwaliteitsregistratie en wetenschappelijk onderzoek is het van belang een gestandaardiseerde definitie te hebben van het rectum. Vervolgens kan op basis van deze definitie worden bepaald wat beschouwd wordt als een rectumcarcinoom. In het verleden werd vaak de afstand van de onderrand tot de anus gehanteerd op basis van endoscopie (tot 15 cm), maar dit is onbetrouwbaar en respecteert ook niet de anatomische variatie tussen patiënten. In analogie aan de klinische TNM-stadiëring was er binnen de groep van experts consensus dat beeldvorming ook voor de definitie van het rectum de modaliteit van voorkeur is. Uiteindelijk werd consensus verkregen over de zogenaamde ‘sigmoid take-off’ op MRI of CT om het onderscheid tussen colon en rectum te maken (D’Souza, 2019). Binnen deze consensus meeting werd geen uitspraak gedaan hoe dit vertaald moet worden naar de definitie van een rectumcarcinoom. De werkgroep heeft een rectumcarcinoom gedefinieerd als een tumor waarvan de onderrand distaal van of op het niveau van de ‘sigmoid take-off’ ligt. Figuur 1 toont hoe de sigmoid take-off kan worden bepaald. Bij het identificeren van de sigmoid take-off wordt gebruik van de bocht die het rectum maakt naar ventraal op de sagittale en axiale serie. Echter, bij suboptimale scanhoek, anatomische variaties (bijv. enterocele, retroflexie van de uterus of descensus perinei) is de sigmoid take-off op deze manier niet altijd goed te zien. In deze gevallen is de peritoneale omslagplooi een behulpzaam anterieur landmark van de sigmoid take-off.
Figuur 1. Sigmoid take-off
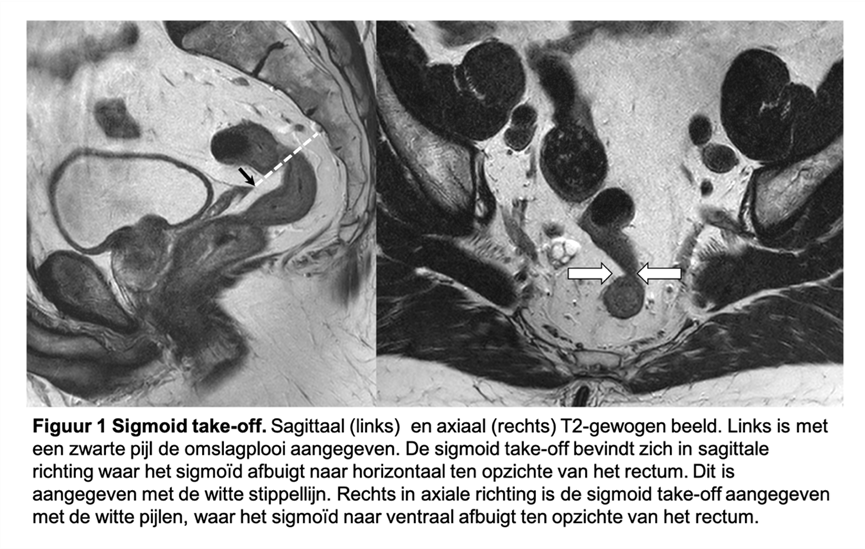
Subclassificatie van het rectum
In het pre-MRI tijdperk werd op basis van endoscopische afstand tot de anus een driedeling gemaakt: proximaal, mid-, en distaal rectumcarcinoom. Nu we rectumcarcinoom definiëren op basis van beeldvorming met de sigmoid take-off, lijkt deze onderverdeling niet langer bruikbaar. Endoscopische afstand tot de anus is namelijk vervangen door afstand tot de anorectale overgang op MRI. Distaal rectumcarcinoom werd doorgaans gedefinieerd als 0-5 cm vanaf de anus, maar eigenlijk zijn de eerste centimeters dan nog het anale kanaal. Een proximaal rectumcarcinoom werd doorgaans gedefinieerd als 10-15 cm vanaf de anus, maar de bovengrens wordt nu op individueel niveau op anatomische criteria bepaald. Het rectum tussen de anorectale overgang en de sigmoid take-off leent zich nu beter voor een tweedeling. De 5 cm afkapwaarde kan dan nu gehanteerd worden voor de afstand tot de anorectale overgang. Daarmee wordt een distaal rectumcarcinoom gedefinieerd als een tumor met de onderrand op of onder 5 cm afstand van de anorectale overgang. Een proximaal rectumcarcinoom is dan een tumor met de onderrand op >5 cm van de anorectale overgang en distaal van de sigmoid take-off. Dit geeft een tweedeling die goed praktisch te gebruiken is en beter aansluit bij de klinische praktijk en besluitvorming. Bij een rectumresectie voor een distaal rectumcarcinoom moet dan bijvoorbeeld altijd het gehele mesorectum worden meegenomen, terwijl voor een proximaal rectumcarcinoom op meer dan 5 cm afstand van de anorectale overgang een partiele mesorectale excisie (PME) kan worden overwogen. Daarmee is deze tweedeling van het rectum ook geharmoniseerd met het criterium van 5 cm distale marge voor een PME.
DWI
Diffusie-gewogen MRI wordt standaard geadviseerd bij primaire stadiëring. Het helpt met name voor het identificeren van de tumor als deze moeilijk zichtbaar is op T2-gewogen MRI en kan als uitgangssituatie gebruikt worden ter vergelijking na neoadjuvante therapie. Voor primaire stadiering van de tumor of klierstatus is DWI niet van waarde (Beets-Tan, 2018).
Beeldvorming bij vroegcarcinomen
MRI is ongeschikt om betrouwbaar cT1 tumoren te subclassificeren of onderscheid tussen cT1 en cT2 te maken. Endorectale echografie (ERUS) wordt dan soms toegevoegd. Men moet zich realiseren dat de resultaten van ERUS-studies enigszins beïnvloed zijn doordat deze vooral verricht zijn in expertcentra. Recente meta-analyses tonen aan dat ERUS een hogere accuratesse heeft om cT1 tumoren te detecteren dan MRI (Luglio, 2021). Ook voor diagnostiek van T3 tumoren heeft ERUS een goede accuratesse, maar door de onmogelijkheid om de tumor en het mesorectum verder adequaat te stadieren (cT3 vs cT4, MRF-invasie, EMVI, etc) blijft MRI de modaliteit van keuze voor de stadiering van rectumcarcinomen. De werkgroep heeft besloten om, gezien de beperkte toepassing van ERUS in Nederland en de twijfel over de daadwerkelijk toegevoegde waarde voor besluitvorming, geen aanbeveling op te nemen over ERUS.
In verband met een kans op overstadiëring bij een cT1-T2 rectum carcinoom wordt aangeraden de uitkomsten van de MRI bij verdenking op een vroegcarcinoom (cT1-T2) te wegen ten opzichte van de bevindingen bij optische diagnostiek. Zie module 6.1 Lokale excisie vroeg stadium RC.
Relatie tot de mesorectale fascie en cT4
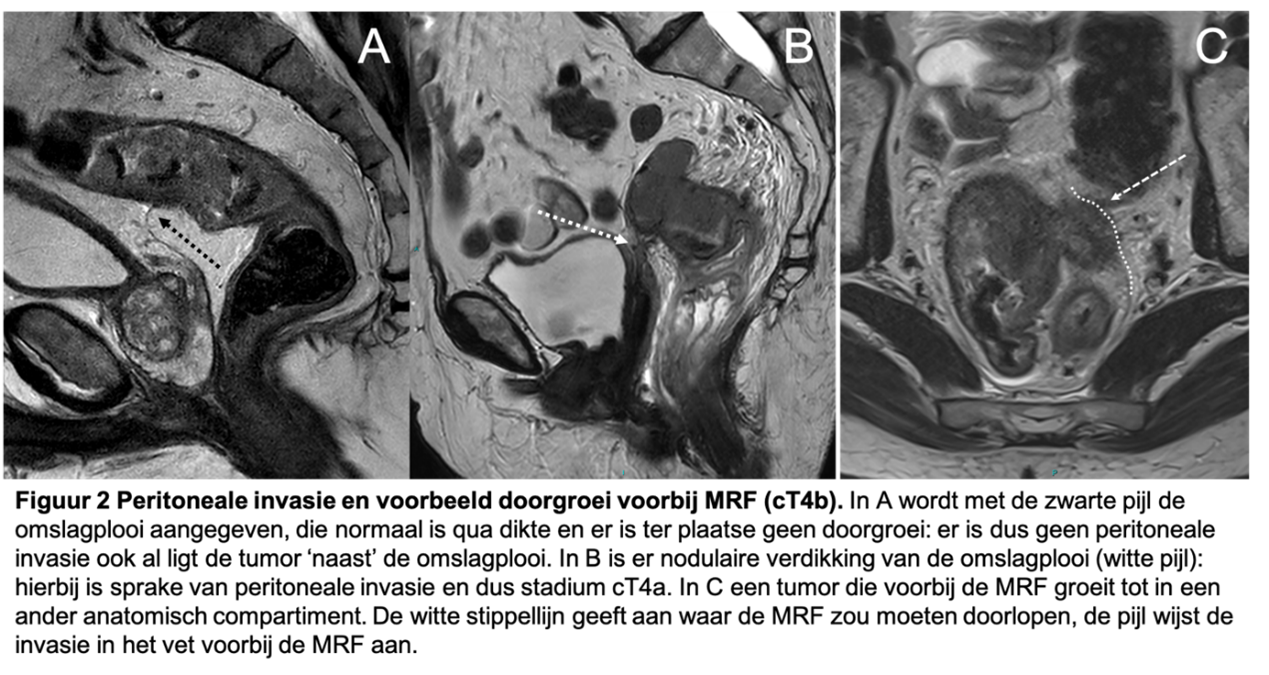
Bij een kortste afstand van de tumor van ≤ 1 mm wordt de MRF als betrokken geduid (MRF+) (Taylor, 2011). Met betrekking tot het cT-stadium is het verder van belang om op te merken dat bij MRF-invasie er in principe sprake moet zijn van tenminste een cT3 tumor. In geval van een T1 of T2 tumor kan er geen sprake zijn van MRF-invasie, immers er is geen doorgroei door de rectumwand. Een uitzondering hierop is in geval van een cT2 tumor die reikt tot in het meest perifere deel van de muscularis propria en heel distaal gelegen is. In dat geval kan de afstand van de tumor (dus de buitenste begrenzing van de muscularis propria) tot de MRF ≤ 1 mm zijn, doordat uiterst distaal de hoeveelheid mesorectaal vet rond het rectum ≤ 1 mm dik kan zijn. Als een tumor voorbij de MRF groeit tot in een ander orgaan of structuur (inclusief een ander anatomisch compartiment, bijv. obturatorloge) betreft het een cT4b tumor, zie ook figuur 2 (Lambregts, 2022). Let bij een cT4a of cT4b tumor op dat de MRF-status nog separaat moet worden vermeld, waarbij ook de locatie(s) moeten worden vermeld).
Bij distale tumoren is sfincter invasie moeilijk te vangen in een cT-stadium. De TNM-classificatie specificeert dit ook niet (Lambregts, 2022). In een recente consensus paper wordt daarom aanbevolen om invasie van de externe sfincter, m. puborectalis en levator ani als cT4b te classificeren. Dit is in lijn met de pathologische benadering van spierinvasie. Om de relatie met de sfincter te beoordelen kan het nuttig zijn om een aanvullende coronale T2-gewogen serie bij te maken exact parallel aan het anale kanaal. Het is met name van belang voor het chirurgische behandelplan om de relatie met de sfincter te beschrijven. Hierbij wordt geadviseerd om de diepte van de invasie te beschrijven (interne sfincter, intersfincterische ruimte en externe sfincter).
Bij peritoneale invasie ter plaatse van de omslagplooi is er sprake van een cT4a tumor. De omslagplooi is t.h.v. de rectosigmoid overgang tegen de darmwand aangelegen, aldus moet er (nodulaire of verdikte) zichtbare doorgroei in de omslagplooi zijn om een tumor als cT4a te kunnen classificeren. Een tumor zonder doorgroei in de omslagplooi is geen cT4a tumor (figuur 2).
Figuur 2. Peritoneale invasie en voorbeeld doorgroei voorbij MRF (cT4b)
Extramurale veneuze invasie (EMVI)
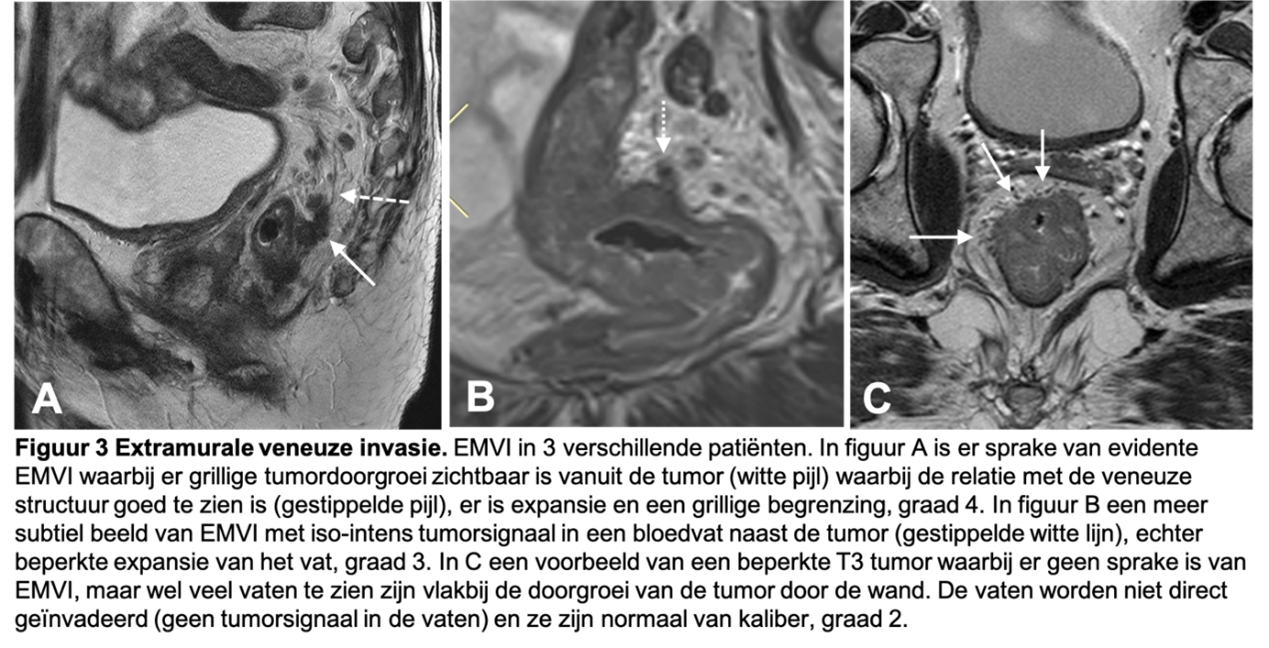
EMVI is van belang omdat het een belangrijke voorspeller is van slechtere ziektevrije overleving, met name de kans op afstandsmetastasen is hoger bij patiënten met EMVI (Chen, 2021). EMVI is gedefinieerd als directe tumordoorgroei (met intermediair signaal) in een nabijgelegen vat, waarbij opvulling van het bloedvat met tumor, al dan niet gepaard met expansie van het vat en/of irregulaire begrenzing van het vat. Er zijn 5 categorieën in de EMVI-gradering: (0) geen nodulaire doorgroei door de rectumwand en afwezigheid van bloedvaten nabij de tumor, (1) minimale extramurale stranding van de tumor, maar geen vaten nabij, (2) stranding nabij vaten, maar geen tumorsignaal in het lumen (3), intermediair tumorsignaal continu met de primaire tumor in een bloedvat en (4) intermediair tumorsignaal met (nodulaire) expansie van het geïnvadeerde bloedvat. Alleen graad 3 en 4 EMVI dienen als EMVI+ te worden beoordeeld. Het is van belang om alleen de aanwezigheid van een bloedvat naast de tumor niet als EMVI te overstadieren (zie figuur 3 voor voorbeelden van graad 2, 3 en 4 EMVI).
Figuur 3. Extramurale veneuze invasie
Lymfeklierstatus
Mesorectale klieren:
Op basis van de matige accuratesse en de relatief hoge kans op overstadiëring van mesorectale klieren, wordt nu geadviseerd om op MRI alleen aan te geven of er een cN0 of cN+ status is en de onderverdeling in cN1 en cN2 te verlaten. Het is daarbij wenselijk een mate van zekerheid aan te geven (bijv. zeker cN+, twijfelachtig cN+, zeker cN0). Daarnaast wordt geadviseerd om bij twijfel over de cN-status, altijd te kiezen voor het laagste stadium. Dit is conform de algemene regels voor het toepassen van de TNM. Mucineuze klieren dienen altijd als verdacht te worden beschouwd.
Tot op heden is er geen betrouwbare methode om de lymfklierstatus preoperatief te bepalen. Bij primaire stadiering is de grootte van de klieren op beeldvorming matig voorspellend. Er bestaat geen betrouwbare cut-off diameter voor maligniteit. Wel is bekend dat wanneer een klier een korte-as diameter heeft ≥ 9 mm, de kans op tumorinvasie 93% bedraagt (Wang, 2005). Een lymfklier die op de MRI tussen 2 en 5 mm groot is, betreft in 50% een kliermetastase. Andere morfologische criteria zoals irregulaire begrenzing, heterogene textuur en ronde vorm van de klier zijn voorspellend voor maligniteit, ongeacht de kliergrootte (Kim, 2004). Het is echter zo dat deze morfologische criteria niet altijd goed te beoordelen zijn op MRI, vooral bij kleinere klieren (≤ 5 mm diameter). De combinatie van grootte en maligne morfologische criteria geeft een hogere voorspellende waarde. Niu et al. hebben in een cohort van 154 patiënten de ESGAR-criteria vergeleken met morfologische kenmerken en de Node-RADS criteria (Niu, 2025). De accuratesse lag voor alle criteria rond de 80%. De Node-RADS criteria hadden een betere sensitiviteit (85%) dan de ESGAR-criteria, die een hogere specificiteit hadden (94%). De Node-RADS criteria kunnen worden gebruikt voor verschillende tumortypen en geven een inschatting van de zekerheid over lymfekliermetastasen. In de praktijk wordt geadviseerd om bij mucineuze klieren en klieren met een korte-as diameter >9mm uit te gaan van zeker maligne klieren en bij klieren <5mm korte-as diameter deze als zeker benigne te classificeren. In de klieren die niet voldoen aan deze klieren kunnen de Node-RADS of ESGAR criteria worden gebruikt om een inschatting van de cN-status te maken.
Laterale klieren:
Met laterale klieren worden de lymfeklieren bedoeld die zich bevinden in de obturatorloge of in het compartiment rond de a. iliaca interna. De term extramesorectale klieren is verlaten omdat laterale klieren de meest gebruikte (inter)nationale term is. Dit betreffen locoregionale lymfeklieren. In 2019 hebben Ogura et al. (2019) een grote multicentrische studie gepubliceerd over laterale klieren. In 741 patiënten werden de diameters van laterale klieren gemeten en later gecorreleerd aan uitkomsten op de lange termijn (lokaal recidief kans). Er werd geconcludeerd dat bij klieren primair ≥ 7 mm (korte as) de kans hoog is op lateraal klierrecidief. Een landelijk Nederlands cohort van alle rectumcarcinoom patiënten geopereerd in 2016 heeft ook laten zien dat laterale lymfklieren met een korte as ≥ 7 mm een verhoogde kans geven op een lateraal lokaal recidief (Sluckin, 2024). Er is beperkte ondersteuning voor het gebruik van morfologische criteria. Sluckin et al. hebben aangetoond dat patiënten met morfologisch afwijkende laterale klieren een hogere kans hebben op lokaal (lateraal) recidief. Mogelijkerwijs is het toevoegen van morfologische criteria in de subgroep van laterale klieren met een korte-as diameter van 5.0–6.9 mm nuttig voor de stadiering (van Geffen, 2024). Morfologische criteria voor maligniteit zijn dan bijvoorbeeld: heterogene textuur, verlies van vettige hilus en irregulaire contour. De waarde hiervan dient echter nog definitief te worden vastgesteld. In de praktijk is het ook behulpzaam om te kijken naar de locatie van EMVI, klieren en tumor deposities. De kans op laterale kliermetastasen is waarschijnlijk hoger aan de ipsilaterale zijde. Indien aan ipsilaterale zijde morfologisch afwijkende klieren zichtbaar zijn van 5.0-6.9 mm (en asymmetrisch tov contralaterale zijde) wordt het aanbevolen deze klieren laagdrempelig als pathologisch te beschouwen. Beoordeel laterale klieren in meerdere richtingen om de korte-as diameter en eventuele morfologische kenmerken goed te kunnen beoordelen.
Tumordeposities
Een aparte categorie betreffen de tumordeposities. Het gaat hierbij om irregulaire mesorectale nodi, niet vastzittend aan de primaire tumor, en waarbij geen sprake lijkt te zijn van een maligne lymfeklier. Tumordeposities liggen vaak in of tegen vasculair structuren, daarom wordt ook wel geponeerd dat het mogelijk een vorm is van EMVI (Lord, 2022). Met MRI is het niet mogelijk om de origine van het weefsel vast te stellen en derhalve kan een irregulaire nodus toch een pathologische klier zijn, maar ook een nodus van vasculaire invasie of perineurale invasie zijn. Indien er alleen tumordeposities zonder lymfkliermetastasen bij histopathologisch onderzoek worden gevonden is er sprake van pN1c stadium (dan zijn er geen verdachte klieren). Deze situatie is echter op basis van MRI niet goed vast te stellen. Daarom wordt aanbevolen om tumordeposities mee te tellen in het cN-stadium (Lambregts 2022), analoog aan de TNM-stadiering. Tumordeposities dienen daarnaast apart te worden beschreven, omdat deze naast de klierstatus een duidelijke negatieve invloed hebben op de prognose en beleidsbepalend zijn. Indien er sprake is van alleen tumordeposities en geen verdachte lymfklieren dient dit gestadieerd te worden op MRI als cN+ TD+.
Items in een verslag
- Bij de beoordeling van het rectumcarcinoom op MRI zijn de volgende items van belang:
- Relatie van de onderrand van de tumor ten opzichte van het niveau van de sigmoid take-off (onder, ter hoogte van, boven);
- Locatie in het rectum (bijv. anterieur);
- Afstand tussen de onderrand van de tumor en de anorectale overgang (exacte afstand in cm);
- Morfologie (polypoid, semicirculair, circulair, mucineus (deels of geheel));
- cT stadium (inclusief subclassificatie cT3a, cT3b, cT3c, cT3d, hierbij wordt geadviseerd om eveneens te vermelden waar het punt van diepste invasie zich bevindt) en bij cT4b specificatie in welk orgaan/structuur er invasie is;
- Sfincter invasie: interne sfincter, intersfincterische ruimte, externe sfincter;
- MRF-status: kortste afstand van tumor tot MRF en locatie hiervan (vrij > 1mm, betrokken </= 1 mm); specificeer of dit op basis van tumor is of op basis van EMVI, tumor depositie of irregulaire pathologische klier;
- Peritoneale invasie t.p.v. omslagplooi (cT4a);
- cN-stadium; onderscheid cN0 vs cN+, mate van zekerheid, benoem de locatie van de hoogst gelegen verdachte klier;
- Laterale klieren: aan- of afwezigheid, locatie en korte as diameter;
- Extramurale veneuze invasie (EMVI+ of EMVI-);
- Aan- of afwezigheid van tumor deposities; locatie en aantal.
Punten die tenminste in de conclusie dienen te worden benoemd zijn;
- lokalisatie (proximaal/distaal, anterieur/lateraal/posterieur);
- cT categorie met MRF (in geval >/=T3) en eventuele doorgroei (in geval T4b);
- cN categorie en tumor deposities;
- EMVI;
- laterale lymfklieren.
Onderbouwing
Achtergrond
Accurate locoregionale stadiering van het rectumcarcinoom is van belang voor het bepalen van de behandelstrategie. De parameters die worden beoordeeld op de beeldvorming bij diagnose zijn van invloed op de keuze van eerste behandelmodaliteit en de intentie van behandeling (bijvoorbeeld sfincter- of orgaansparend). MRI is de modaliteit van keuze bij primaire locoregionale stadiëring van rectumcarcinomen. MRI biedt het voordeel van een groot field of view om alle relevante structuren af te beelden, hoog contrast tussen de weefsels en een hoge spatiële resolutie. Een gestandaardiseerde beoordeling van MRI van het rectumcarcinoom met gestructureerde verslaglegging is van belang voor de kwaliteit van zorg, registratie en wetenschappelijk onderzoek.
Conclusies / Summary of Findings
Samenvattingstabel van bevindingen uit systematische reviews en meta-analyses
MRI versus EUS for diagnosing the T-stage of rectal carcinomas in patients with cT1-2 rectal carcinomas (Li 2016)
Patient or population: Patients with cT1-2 rectal carcinomas
Setting: Hospital
Intervention: MRI
Comparison: EUS
Pooled sensitivity MRI: 0.89 (95% CI: 0.86 to 0.91) | Pooled specificity MRI : 0.76 (95% CI: 0.71 to 0.80)
Pooled sensitivity EUS: 0.88 (95% CI: 0.85 to 0.90) | Pooled specificity EUS : 0.79 (95% CI: 0.72 to 0.84)
|
Test result |
Number of results per 1.000 patients tested (95% CI) |
Number of participants |
Certainty of the Evidence (GRADE) |
Comments |
|||||
|
Prevalence 25% |
Prevalence 50% |
Prevalence 75% |
|||||||
|
MRI |
EUS |
MRI |
EUS |
MRI |
EUS |
||||
|
True positives |
223 (215 to 228) |
220 (213 to 225) |
445 (430 to 455) |
440 (425 to 450) |
668 (645 to 683) |
660 (638 to 675) |
3887 |
⨁⨁◯◯ |
Staging with MRI might possibly not increase diagnostic accuracy compared to EUS in patients with a rectal carcinoma. |
|
3 more TP in MRI |
5 more TP in MRI |
8 more TP in MRI |
|||||||
|
False negatives |
27 (22 to 35) |
30 (25 to 37) |
55 (45 to 70) |
60 (50 to 75) |
82 (67 to 105) |
90 (75 to 112) |
No significant differences in diagnostic accuracy between MRI and EUS were found (p=0.58) |
||
|
3 fewer FN in MRI |
5 fewer FN in MRI |
8 fewer FN in MRI |
|||||||
|
True negatives |
570 (533 to 600) |
593 (540 to 630) |
380 (355 to 400) |
395 (360 to 420) |
190 (178 to 200) |
198 (180 to 210) |
6659 |
⨁◯◯◯ |
High resolution MRI showed a comparable however significant difference with EUS (p=0.06) |
|
23 fewer TN in MRI |
15 fewer TN in MRI |
8 fewer TN in MRI |
|||||||
|
False positives |
180 (150 to 217) |
157 (120 to 210) |
120 (100 to 145) |
105 (80 to 140) |
60 (50 to 72) |
52 (40 to 70) |
|
||
|
23 more FP in MRI |
15 more FP in MRI |
8 more FP in MRI |
|||||||
CI: Confidence interval
Explanations
a. Unclear risk of bias in about 60% of all included studies. High risk of bias for patient selection in about 40% of all included studies and about 25% unclear risk.
b. High concerns for patients selection regarding applicability in about 55% of all included studies
c. The authors state that the analysis for publication bias resulted in a statistically significant effect (for publication bias), p=0.01. EUS studies with smaller sample sized generally yielded higher diagnostic accuracy.
Patients who undergo preoperative chemoradiotherapy for locally advanced rectal cancer restaged by using diagnostic MR imaging: a systematic review and meta-analysis (van der Paardt 2013)
Patient or population: Patients with locally advanced rectal cancer after preoperative chemoradiotherapy
Setting: Hospital
New test: (DW) MRI
Comparator/reference standard: Histopathology, endoscopy, follow-up
Pooled sensitivity MRI: 0.50 (95% CI: 0.38 to 0.63)| Pooled specificity MRI: 0.91 (95% CI: 0.86 to 0.95)
Pooled sensitivity MRI DWI: 0.84 (95% CI: 0.62 to 0.94)| Pooled specificity MRI DWI : 0.85 (95% CI: 0.74 to 0.92)
|
Outcomes |
Impact |
№ of participants (studies) |
Certainty of the evidence (AMSTAR) |
Comments |
|
Tumor stage |
For restaging the tumor stage after chemoradiotherapy, MRI with diffusion-weighted imaging (DWI) showed higher sensitivity (0.84) and similar specificity (0.85) compared to the reference standard (histopathology). |
33 studies |
⨁◯◯◯ VERY LOWa, b |
The evidence is very uncertain about the value of staging with diagnostic MRI with DWI in patients with locally advanced rectal cancer after preoperative chemoradiotherapy |
|
GRADE Working Group grades of evidence
Explanations a. Risk of bias |
||||
CI: Confidence interval
Samenvatting literatuur
Samenvatting van internationale richtlijnen en consensusdocumenten. In de ESGAR-consensus guideline (Beets-Tan, 2018) wordt geadviseerd om MRI als standaard modaliteit te gebruiken voor stadiëring, eventueel aangevuld door endo-echografie voor oppervlakkige tumoren om cT1 van cT2 tumoren te onderscheiden. Een MRI-protocol dient tenminste te bestaan uit: 2D T2-gewogen series in 3 richtingen (coupedikte ≤ 3 mm) en een diffusie-gewogen serie (met b-waarde ≥ b800). In de ESGAR-guideline is een MRI template gepubliceerd met de items die in een verslag moeten worden gerapporteerd. Criteria voor MRF-invasie en N-stadiering zijn ook benoemd in deze guideline.
Een internationale, expert-based Delphi consensus is bereikt over de definitie van het rectum (D’Souza, 2019). Op CT of MRI wordt het rectum gedefinieerd vanaf de anorectale overgang tot aan de sigmoid takeoff. Deze kan worden geïdentificeerd op axiale en sagittale opnamen. Axiaal is de ventrale projectie van het sigmoïd, daar waar het bovenste mesorectum vasthangt aan het sacrum bij de rectosacrale/prefasciale fascie, de transitie naar het mesocolon. Sagittaal kan deze projectie worden geïdentificeerd als de horizontale knik in het colon (zie figuur 1 in de overwegingen).
Samenvatting van systematische reviews en meta-analyses
MRI en ERUS gaven in een meta-analyse van Li (2016) gelijke overall gepoolde sensitiviteit en specificiteit. Echter bij het gebruik van hoge resolutie MRI-techniek en 3.0T MRI was er een significant verschil met ERUS (respectievelijk, p=0.01 en 0.04) ten voordele van MRI (Li, 2016).
In een systematische review toonde van der Paardt et al. (2013) aan dat het toevoegen van DWI aan T2W-MRI in de restadiering setting een toename in de accuratesse voor het bepalen van de respons op chemoradiatie geeft. De sensitiviteit nam toe van 50% naar 84%.
Zoeken en selecteren
Uitkomstmaten
Sensitiviteit en specificiteit, PPV, NPV, accuratesse.
PICO(s)
Voor deelvraag 2, 3, 4, 5, 6, 7 en 9 werd geen PICO opgesteld.
PICO 1: Rol endo-echografie naast MRI
| P: | Patiënten met diagnose rectumcarcinoom |
| I: | Endo-echografie stadiering rectumcarcinoom |
| C: | MRI voor stadiering rectumcarcinoom |
| R: | pTN van het resectiepreparaat |
| O: | Sensitiviteit en specificiteit, PPV, NPV, accuratesse voor cT-stadiering |
PICO 2: Rol DWI bij MRI
| P: | Patiënten met diagnose rectumcarcinoom |
| I: | Diffusie-MRI voor stadiering rectumcarcinoom |
| C: | T2-gewogen MRI voor stadiering rectumcarcinoom |
| O: | Sensitiviteit en specificiteit, PPV, NPV, accuratesse |
Referenties
- Beets-Tan, R.G.H., Lambregts, D.M.J., Maas, M. et al. Magnetic resonance imaging for clinical management of rectal cancer: Updated recommendations from the 2016 European Society of Gastrointestinal and Abdominal Radiology (ESGAR) consensus meeting. Eur Radiol. 2018;28:1465–1475. https://doi.org/10.1007/s00330-017-5026-2.
- Chen S, Li N, Tang Y, Shi J, Zhao Y, Ma H, et al. The prognostic value of MRI-detected extramural vascular invasion (mrEMVI) for rectal cancer patients treated with neoadjuvant therapy: a meta-analysis. Eur Radiol. 2021 May 15. doi: 10.1007/s00330- 021-07981-z. Epub ahead of print. PMID: 33993333.
- DʼSouza N, de Neree Tot Babberich MPM, d'Hoore A, Tiret E, Xynos E, Beets-Tan RGH, etal. Definition of the Rectum: An International, Expert-based Delphi Consensus. Ann Surg. 2019 Dec;270(6):955-959. doi: 10.1097/SLA.0000000000003251. PMID: 30973385.
- Kim JH, Beets GL, Kim MJ, Kessels AG, Beets-Tan RG. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol. 2004 Oct;52(1):78-83. PubMed PMID: 15380850.
- Lambregts DMJ, Bogveradze N, Blomqvist LK, Fokas E, Garcia-Aguilar J, Glimelius B, et al. Current controversies in TNM for the radiological staging of rectal cancer and how to deal with them: results of a global online survey and multidisciplinary expert consensus. Eur Radiol. 2022 Mar 7. doi: 10.1007/s00330-022-08591-z. Epub ahead of print. PMID: 35254485.
- Li XT, Zhang XY, Sun YS, Tang L, Cao K. Evaluating rectal tumor staging with magnetic resonance imaging, computed tomography, and endoluminal ultrasound: A meta-analysis. Medicine (Baltimore). 2016 Nov;95(44):e5333. PubMed PMID: 27858916; PubMed Central PMCID: PMC5591164.
- Lord AC, Moran B, Abulafi M, et al. Can extranodal tumour deposits be diagnosed on MRI? Protocol for a multicentre clinical trial (the COMET trial)BMJ Open 2020;10:e033395. doi: 10.1136/bmjopen-2019-033395.
- Luglio, G., Pagano, G., Tropeano, F. P., Spina, E., Maione, R., Chini, A., Maione, F., Galloro, G., Giglio, M. C., & De Palma, G. D. (2022). Endorectal Ultrasonography and Pelvic Magnetic Resonance Imaging Show Similar Diagnostic Accuracy in Local Staging of Rectal Cancer: An Update Systematic Review and Meta-Analysis. Diagnostics, 12(1), 5. https://doi.org/10.3390/diagnostics12010005.
- Niu Y, Yu S, Chen P, Tang M, Wen L, Sun Y, Yang Y, Zhang Y, Fu Y, Lu Q, Luo T, Yu X. Diagnostic performance of Node-RADS score for mesorectal lymph node metastasis in rectal cancer. Abdom Radiol (NY). 2025 Jan;50(1):38-48. doi: 10.1007/s00261-024-04497-0. Epub 2024 Jul 24. PMID: 39046482.
- Ogura A, Konishi T, Beets GL, Cunningham C, Garcia-Aguilar J, Iversen H, et al. Lateral Nodal Features on Restaging Magnetic Resonance Imaging Associated With Lateral Local Recurrence in Low Rectal Cancer After Neoadjuvant Chemoradiotherapy or Radiotherapy. JAMA Surg. 2019 Sep 1;154(9):e192172. doi: 10.1001/jamasurg.2019.2172. Epub 2019 Sep 18. PMID: 31268504; PMCID: PMC6613303.
- Sluckin, Tania C. M.D.1,2,3; van Geffen, Eline G.M. M.D.1,2,3; Hazen, Sanne-Marije J.A. M.D.1,2,3; Horsthuis, Karin M.D., Ph.D.3,4; Beets-Tan, Regina G.H. M.D., Ph.D.5,6,7,8; Marijnen, Corrie A.M. M.D., Ph.D.9,10; Tanis, Pieter J. M.D., Ph.D.2,3,11,12; Kusters, Miranda M.D., Ph.D.1,2,3; On behalf of the Dutch Snapshot Research Group. Prognostic Implications of Lateral Lymph Nodes in Rectal Cancer: A Population-Based Cross-sectional Study With Standardized Radiological Evaluation After Dedicated Training. Diseases of the Colon & Rectum 67(1):p 42-53, January 2024. | DOI: 10.1097/DCR.0000000000002752.
- Taylor, Fiona & Quirke, Philip & Heald, Richard & Moran, Brendan & Blomqvist, Lennart & Swift, Robert & St Rose, Suzanne & Sebag-Montefiore, D & Tekkis, Paris & Brown, Gina. (2011). One millimetre is the safe cut-off for magnetic resonance imaging prediction of surgical margin status in rectal cancer. The British journal of surgery. 98. 872-9. 10.1002/bjs.7458.
- van der Paardt MP, Zagers MB, Beets-Tan RGH, Stoker J, Bipat S. Patients who undergo preoperative chemoradiotherapy for locally advanced rectal cancer restaged by using diagnostic MR imaging: a systematic review and meta-analysis. Radiology. 2013;266(2):444–454.
- van Geffen EG, Sluckin TC, Hazen SJ, et al. Value of Size and Malignant Features of Lateral Lymph Nodes in Risk Stratification at Lateral Local Recurrence of Rectal Cancer: A National Cohort Study. J Natl Compr Canc Netw. 2024;22(1):17-25. doi:10.6004/jnccn.2023.7081.
- Wang C, Zhou Z, Wang Z, Zheng Y, Zhao G, Yu Y, et al. Patterns of neoplastic foci and lymph node micrometastasis within the mesorectum. Langenbecks Arch Surg. 2005 Aug;390(4):312-8. Epub 2005 Jun 14. PubMed PMID: 16049726.
Evidence tabellen
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-09-2025
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodules werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodules.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom. Deze werkgroep is ingesteld in het kader van het cluster oncologie onderste tractus digestivus.
De huidige samenstelling van de werkgroep
- Prof. dr. P.J. (Pieter) Tanis, gastrointestinaal en oncologisch chirurg, Erasmus MC, Rotterdam, NVvH (voorzitter)
- Dr. T.S. (Tjeerd) Aukema, chirurg, HagaZiekenhuis, Den Haag, NVvH
- Dr. J.W.A. (Pim) Burger, chirurg, Catharina Ziekenhuis, Eindhoven, NVvH
- Dr. M. (Myriam) Chalabi, internist, Antoni van Leeuwenhoek, Amsterdam, NIV/NVMO
- S. (Silvie) Dronkers, stichting Darmkanker
- Dr. D.J.A. (Derk Jan) de Groot, internist-oncoloog, UMC Groningen, Groningen, NIV/NVMO
- Dr. E.C. (Elske) Gootjes, internist-oncoloog, Radboud UMC, Nijmegen, NIV/NVMO
- Prof. Dr. M.P.W. (Martijn) Intven, radiotherapeut, UMC Utrecht, Utrecht, NVRO
- Dr. M. (Miranda) Kusters, colorectaal chirurg, AmsterdamUMC, Amsterdam, NVvH
- Dr. M.M. (Miangela) Laclè, patholoog, UMC Utrecht, Utrecht, NVvP
- Dr. M.M. (Marilyne) Lange, patholoog, AmsterdamUMC, Amsterdam, NVvPathologie
- Dr. H.A.A.M. (Huub) Maas, klinisch geriater, Elisabeth-TweeSteden Ziekenhuis, Tilburg, NVKG
- Dr. M. (Monique) Maas, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR (vice-voorzitter)
- Dr. L. (Leon) Moons, MDL-arts, UMC Utrecht, Utrecht, NVMDL
- Prof. dr. I.D. (Iris) Nagtegaal, patholoog, Radboud UMC, Nijmegen, NVvP
- Dr. J.M.L. (Jeanine) Roodhart, internist-oncoloog, UMC Utrecht, Utrecht, NIV/NVMO
- Dr. M. (Mark) Roef, nucleair geneeskundige, Catharina Ziekenhuis, Eindhoven, NVNG
- Dr. M. (Maarten) Smits, radioloog, UMC Utrecht, Utrecht, NVvR
- I. (Iris) van der Veeken MSc., coloncare verpleegkundige, Flevoziekenhuis, Almere, V&VN
- Prof. dr. C. (Kees) Verhoef, oncologisch chirurg, Erasmus MC, Rotterdam, NVvH
- Dr. K.S. (Kathelijn) Versteeg, internist-oncoloog, AmsterdamUMC, Amsterdam, NIV/NVMO
- Dr. M. (Marianne) de Vries, abdominaal radioloog, Erasmus MC, Rotterdam, NVvR
- Dr. M.L. (Miriam) Wumkes, internist, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NIV/NVMO
Voormalig betrokken werkgroepleden
- Dr. M.E. (Marije) Hamaker, klinisch geriater, Diakonessenhuis, Utrecht, NVKG
- Dr. P. (Petur) Snaebjornsson, patholoog, Nederlands Kanker Instituut, Amsterdam, NVvP
- Dr. H.L. (Erik) van Westreenen, chirurg, Isala Zwolle/ Isala Diaconessenhuis, Zwolle/Meppel, NVvH
Met ondersteuning van
- Dr. D. (Dagmar) Nieboer, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R.J.S. (Rayna) Anijs, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- I. (Ingeborg) van Dusseldorp, medisch informatiespecialist, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
De werkgroep heeft bij aanvang van het richtlijnontwikkelingstraject geconstateerd dat sommige werkgroepleden betrokken zijn bij wetenschappelijk onderzoek dat wordt gefinancierd door overheid, onafhankelijke subsidieverstrekkers, of commerciële partijen (in het laatste geval: unrestricted scientific grants). Om te voorkomen dat indirecte belangen (waaronder reputatie en kennisvalorisatie) de richtlijnaanbevelingen onbedoeld zouden kunnen beïnvloeden, heeft de werkgroep besloten dat geen van de modules/aanbevelingen worden opgesteld door één werkgroeplid met dergelijke indirecte belangen. Tenminste één ander werkgroeplid met hetzelfde specialisme of tenminste één ander werkgroeplid met vergelijkbare inhoudelijke kennis van het betreffende onderwerp zijn verantwoordelijk voor de inhoud (vier-ogen-principe).
De werkgroep zag in de gemelde (on)betaalde nevenfuncties geen aannemelijke reden voor onbedoelde beïnvloeding door belangenverstrengeling ten aanzien van de onderwerpen die in de richtlijn aan bod komen.
|
Naam |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke Financiële Belangen |
Persoonlijke Relaties |
Extern gefinancierd onderzoek |
Intell. belangen en reputatie |
Overige belangen |
Ondernomen acties |
|
Prof. Dr. P.J. (Pieter) Tanis |
Chirurg, Erasmus MC |
Lid clinical audit board Dutch ColoRectal Audit, onbetaald Bestuurslid Stichting Opsporing Erfelijke Tumoren, onbetaald Lid medische adviesraad Lynch Polyposis vereniging, onbetaald Associate Editor Colorectal Disease, onbetaald |
Geen te vermelden. |
Geen |
Meerdere klinische multicenter trials: * KWF - COLOPEC-2: vroegdetectie peritoneale metastasen CRC - Projectleider * KWF - BIOPEX-2: transpositielap voor sluiting perineale wond APR voor rectumcarcinoom - Projectleider * KWF - IMARI: preventie en optimale behandeling naadlekkage na rectumcarcinoom resectie - Projectleider * KWF - Predicitiemodel longlaesies bij CRC - Projectleider * KWF - Snapshot complex coloncarcinoom - Geen projectleider KWF-COLOPEC-2: vroegdetectie peritoneale metastasen CRC-projectleider KWF-CAIRO-6: perioperatieve chemotherapie bij CRS-HIPEC voor peritoneale metastasen van CRC-geen projectleider KWF-BIOPEX-2: transpositielap voor sluiting perineale wond APR voor rectumcarcinoom- projectleider KWF- IMARI: preventie en optimale behandeling naadlekkage na rectumcarcinoom resectie-projectleider KWF-AI voor karakterisatie / predictie van longlaesies bij CRC-projectleider KWF-Snapshot complex coloncarcinoom-projectleider KWF-Snapshot rectumcarcinoom 2016-geen projectleider ZonMw CROSSROADS: behandelstrategie na lokale excisie pT1-2 coloncarcinoom, gestratificeerd voor lymfkliermetastase risico- geen projectleider Zorgverzekeraars (ZN)-DICA 2.0, pilot DCRA: verdiepingsmodules, videoregistratie-projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. T.S. (Tjeerd) Aukema Den Haag, NVvH
|
Chirurg, HagaZiekenhuis
|
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
dr. J.W.A. (Pim) Burger
|
Chirurg in het Catharina Ziekenuis Eindhoven, vrijgevestigd, full time |
Geen |
Geen |
Geen |
* ZonMW - Multidisiplinaire zorg - Geen Projectleider * KWF - Topspecialistische Zorg en onderzoek Pelvex2 - Geen projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M. (Myriam) Chalabi |
Internist-oncoloog, Antoni van Leeuwenhoek |
Geen |
Geen |
Geen |
* BMS - neoadjuvante immuuntherapie bij coloncarcinoom (Projectleider JA) * roche - neoadjuvante radiotherapie,immuuntherapie en bevacizumab bijrectumcarcinoom (Projectleider JA) * agenus - neoadjuvante immuuntherapie pan-cancer (Projectleider, ) * roche - neoadjuvante immuuntherapie bij slokdarm/maagcarcinoom (Projetleider JA) * MSD - neoadjuvante immuuntherapie bij lokaal irresectabele colorectale (Projectleider JA) carcinomen
|
Geen |
Geen actie |
Geen acties ondernomen |
|
S.Y.A. (Silvie) Dronkers MA
|
Stichting Darmkanker Coördinator Patiënten Participatie Onderzoek en Belangenbehartiging
onbetaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. D.J.A. (Derk-Jan) de Groot |
Internist oncoloog, UMC Groningen |
Geen |
Geen |
Geen |
zie onder: * Hoffman-La Roche - Fase 2 klinische geneesmiddelen studie - Projectleider * GE - Fase 2 klinische studie - Geen projectleider * Siemens - Beurs om PET onderzoek te doen |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. E.C. (Elske) Gootjes
|
Medisch oncoloog RadboudUMC |
Geen |
Geen |
Geen |
* KWF - ORCHESTRA, lokale behandeling bij mCRC - Geen projectleider * Roche - ORCHESTRA, lokale behandeling bij MCRC - Geen projectleider * Stichting Blokker Verwer - ORCHESTRA, lokale behandeling bij mCRC - Geen projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
Prof. Dr. M.P.W. (Martijn) Intven |
Radiotherapeut-Oncoloog UMC Utrecht |
- Voorzitter Nederlandse Vereniging voor radiotherapie en Oncologie, onbetaald - Lid redactieraad NTVO, onbetaald |
Geen |
Geen |
KWF - Pancreascarcinoom - Projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M. (Miranda) Kusters |
Colorectaal chirurg, Amsterdam UMC |
Geen |
Geen |
Geen |
KWF - Snapshot rectumcarcinoom - Projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. M.M. (Miangela) Laclè,
|
Patholoog, UMC Utrecht |
Geen |
Geen |
Geen |
KWF - PATCH (validatie studie predictiemodel gesteelde T1 CRCs) - Projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M.M. (Marilyne) Lange |
Patholoog Amsterdam UMC |
Geen betaalde nevenwerkzaamheden |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. H.A.A.M. (Huub) Maas |
klinisch geriater, Elisabeth-Tweesteden ziekenhuis |
Voorzitter special interest group geriatrische oncologie van Ned Ver v Klinische Geriatrie lid Kamer medisch specialisten Capaciteitsorgaan lid college medische specialismen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. M. (Monique) Maas |
Radioloog bij NKI-AVL |
Redacteur nascholingsblad 'Imago'; hiervoor ontvang ik een vergoeding 1x per jaar |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. L.M.G. (Leon Moons) |
MDL arts, UMC Utrecht |
Geen |
consultant voor Boston Scientific |
Geen persoonlijke relaties met een belang |
Alleen KWF, ZonMW en MLDS gesponsorde onderzoeken: * KWF - MATILDA-studie: EMR vs ESD voor grote linkszijdige poliepen - Projectleider * KWF - STAR-studie: cluster gerandomiseerde studie naar het effect van training in EMR in het verlagen - Projectleider * MLDS - STONE-studie: risicofactoen voor lymfkliermetastasen bij T1 CRCs * ZonMW - TRIASSIC-studie: ESD vs TAMIS voor rectum poliepenoor - Geen projectleider ZonMw CROSSROADS: behandelstrategie na lokale excisie pT1-2 coloncarcinoom, gestratificeerd voor lymfkliermetastase risico- projectleider |
Voorzitter T1 CRC werkgroep bestuurslid DCCG Voorzitter richtlijn Poliepectomie in het rectum en colon |
Geen |
Geen acties ondernomen |
|
Prof. Dr. I.D. (Iris) Nagtegaal |
Hoogleraar Pathologie, Radboudumc |
Voorzitter Stichting Palga (detachering) Expert patholoog BVO darmkanker (detachering) Onbetaalde functies: |
Geen |
Geen |
ja diverse wetenschappelijke projecten van verschillende fondsen: * KWF - Microbiome and metastases - Geen projectleider * Hanarth Foundation - Cancer of unknown primary - Projectleider * KWF - Implementation Al in pathology * ZonMW - Covid19 and cancer - Geen projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
dr. J.M.L. (Jeanine) Roodhart |
internist-oncoloog, UMC Utrecht |
ONCODE clinical advisory board KWF wetenschappelijke raad, exploratie kamer bestuurslid stichting Hubrecht Organoid Biobank
allen onbetaald. |
geen persoonlijke; geen betalingen aan mij als persoon voor deelname adviesraden, wel betalingen aan afdeling voor adviesraden/spreken door diverse farma en onderzoeksprojecten betaald door farma. |
nee |
ja: * KWF - ACTOR studie, organoids anuscarcinoom als predictieve biomarker en platform voor ontwikkelen nieuwe - Projectleider * GSK - MIRROR, analyse behandeling en uitkomsten MSI vs MSS rectumcarcinoom - Projectleider * HUB - OPTIC studie, voorspellende waarde organoids - Projectleider * Xilis - POSTED, MOS screeningsplatform als predictieve biomarker - Projectleider * Pierre Fabre - BRIDGE, real life treatment patterns en uitkomsten per moleculaire subgroep - Projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
Dr. M. (Mark) Roef |
Nucleair geneeskundige, Catharina Ziekenhuis Eindhoven |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M.L.K. (Maarten) Smits |
Interventieradioloog, UMC Utrecht |
- Voorzitter wetenschapscommissie Nederlandse Vereniging voor Interventieradiologie (onbetaald) - Lid kernwerkgroep Kwaliteitsnormen in de Interventieradiologie - Consultant voor Philips (begunstigde UMC Utrecht) - Consultant voor Terumo / Quirem Medical (begunstigde UMC Utrecht) - Consultant voor Medtronic (begunstigde UMC Utrecht) - Consultant voor Swedish Orphan Biovitrum (eenmalige zitting in advisory board in 2021, begunstigde UMC Utrecht) |
Geen |
Geen |
* Terumo / Quirem Medical - HEPAR primary study, radioembolization for patients with hepatocellular carcinoma - Geen projectleider * Zorginstituut Nederland - CAIRO7-studie: radioembolisation for frail or elderly patients with colorectal liver metastases - Geen projectleider |
Geen |
Geen |
Geen acties ondernomen |
|
I. (Iris) van Veeken |
verpleegkundige - Flevoziekenhuis |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
Prof. Dr. C. (Kees) Verhoef |
Hoofd Gastro-Intestinale en Oncologische Chirurgie, Erasmus MC |
Bestuur Familiehuis, onbetaald Bestuur DCCG, onbetaald Ass Editor Sarcoma, Cancers and Digestive Surgery, onbetaald Dagvoorzitter expertmeeting Johnson en Johnon, betaald |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
dr. K.S. (Kathelijn) Versteeg |
Internist-oncoloog en ouderengeneeskunde Amsterdam UMC |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M. (Marianne) de Vries |
Erasmus MC Radiologie Rotterdam: Radioloog (betaald) |
colorectale richtlijn meeschrijven en lezen (betaald) |
Geen |
Geen (niet dat ik weet) |
Alleen meewerken aan multicenter studies maar niet als hoofdonderzoeker en krijg daar geen geld voor (bijvoorbeeld SNAPshot studie AVL of PELVEX studie) |
Geen |
Geen |
Geen acties ondernomen |
|
dr. M.L. (Miriam) Wumkes
|
Internist-oncoloog Jeroen Bosch ziekenhuis (vrijgevestigd, betaald) |
Voorzitter oncologiecommissie JBZ, betaald LId netwerkoncologiecommissie EMBRAZE, betaald Lid Regiocommissie Onco-oost, betaald Lid wetenschappelijke commissie DPCG, niet betaald Lid werkgroep organisatie van zorg DRPC, niet betaald Moleculaire diagnostiek per augustus, Zorginstituut Nederland, niet betaald. |
Niet van toepassing |
Niet van toepassing |
Lokale PI van onderzoek in JBZ, geen projectleider. Overigens onderzoeken niet binnen de lower tract * Overheid (vergoeding vanuit basispakket) - Periscope 2, beperkt gemetastaseerd maagcarcinoom, chemo vs chemo met CRS/HIPEC - Geen projectleider * KWF - Preopanc 3, resectabel pancreascarcinoom - Geen projectleider |
niet van toepassing. |
2019 Advies raad maagcarcinoom, Servier 2019 Adviesraad pancreascarcinoom, Servier 2020 Consensus expert Groep NTRK genfusie gerelateerde kanker. 2021: Programmacommissie en voordracht indian Summerschool voor jonge klaren, Servier
Vanaf 2022: Wetenschappelijk comite Waddenworkshop MDL, sponsoring verschillende farma (beschreven op de site welke farma voor welk jaar, https://www.waddenworkshoponcologie.nl/mdl-tumoren )
Voordracht masterclass GE oncologie stichting oncowijs |
Geen acties ondernomen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiënten perspectief door het uitnodigen van Stichting Darmkanker en de Nederlandse Federatie van Kankerpatiëntenorganisaties (NFK) voor de invitational conferences in 2017 en 2023. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. Daarnaast zijn deze patiëntenorganisaties in de commentaarfase uitgenodigd om modules mee te lezen, te becommentariëren en de werkgroep van feedback vanuit het patiënten perspectief voorzien.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
|
Module |
Uitkomst raming |
Toelichting |
|
N.v.t. |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling niet breed toepasbaar is (<5.000 patiënten) en daarom naar verwachten geen substantiële financiële gevolgen zal hebben voor de collectieve uitgaven. |
|
Alle modules |
Geen financiële gevolgen |
Hoewel het niet duidelijk is of de aanbeveling breed toepasbaar is, volgt uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft, het geen toename in het aantal in te zetten voltijdsequivalenten aan zorgverleners betreft en het geen wijziging in het opleidingsniveau van zorgpersoneel betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodules zijn opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 3.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase in 2017 inventariseerde de werkgroep knelpunten en de werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVRO, 2014) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Medio 2023 is het grootste deel van de richtlijn herzien en worden nieuwe modules of herzieningen door de werkgroep besproken indien de werkgroep:
- Signalen krijgt van (nieuwe) knelpunten in de zorg voor patiënten met colorectaal carcinoom die geadresseerd dienen te worden in de richtlijn;
- Signaleert dat er nieuwe onderzoeksresultaten zijn die relevant zijn voor de richtlijn;
- Constateert dat er tekstuele verbeteringen of aanvullingen nodig zijn in de richtlijn om de bruikbaarheid of volledigheid van de richtlijn te verbeteren.
De werkgroep bespreekt welke aanvullingen of herzieningen geprioriteerd dienen te worden en stelt eventueel passende (nieuwe) uitgangsvragen op. De werkroep bepaalt de prioriteit van aanvullingen of herzieningen op basis van: (1) klinische relevantie, (2) de beschikbaarheid van nieuwe evidence, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitkomstmaten
De werkgroep inventariseerde per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij men zowel naar gewenste als ongewenste effecten keek. De werkgroep baseerde de keuze voor uitkomstmaten mede op basis van de “core outcome set” gepubliceerd door Zerillo (2017). De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Hiervoor sloot de werkgroep zich, waar mogelijk, aan bij de grenzen voor klinische besluitvorming volgens de PASKWIL criteria uit 2023. Wanneer er geen grenzen voor klinische besluitvorming conform de PASKWIL criteria geformuleerd konden worden (bijvoorbeeld bij non-inferioriteitsvraagstukken) werden de standaard GRADE grenzen gehanteerd, tenzij anders vermeld.
Strategie voor zoeken en selecteren van literatuur
De werkgroep raadpleegde voor de afzonderlijke uitgangsvragen reeds gepubliceerde systematische reviews (SRs). SRs kwamen in aanmerking indien: i) systematisch was gezocht in één of meerdere databases; ii) transparante in- en exclusiecriteria zijn toegepast en iii) idealiter de kwaliteit van de geïncludeerde literatuur was beoordeeld. De voor de uitgangsvragen relevante internationale richtlijnen en consensusdocumenten werden eveneens geraadpleegd. Overige literatuur, waar niet systematisch naar werd gezocht, is als bewijsvoering in de overwegingen opgenomen.
Relevante beschikbare populatiegegevens uit Nederland werden gebruikt voor het bepalen van knelpunten, praktijkvariatie en externe validiteit van internationale richtlijnen en gepubliceerde literatuur.
Kwaliteitsbeoordeling individuele studies
De (risk of bias) kwaliteitsbeoordelingen van de individuele studies uit de gebruikte SRs werden gebruikt, tenzij deze afwezig waren of onbruikbaar waren voor het beoordelen van de kracht van het wetenschappelijke bewijs. Indien afwezig of onbruikbaar werd aangenomen dat er een risico op bias aanwezig zou kunnen zijn. In enkele gevallen, wanneer studies informatie verschaften over de cruciale uitkomstma(a)t(en), werd er een nieuwe kwaliteitsbeoordeling van individuele studies uitgevoerd.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van de geselecteerde SRs werden weergegeven in ‘Summary of Findings’ tabellen. De belangrijkste bevindingen uit de literatuur werden kort beschreven onder “Samenvatting literatuur” (kopjes “Samenvatting van internationale richtlijnen en consensusdocumenten” en “Samenvatting van systematische reviews en meta-analyses”) en onder “Overwegingen”. Bestaande meta-analyses uit de gebruikte systematische reviews werden beschreven. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek (te vinden in de ‘Summary of Findings’ tabellen). De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling beargumenteerd hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Indicatorontwikkeling
De werkgroep ontwikkelde geen interne kwaliteitsindicatoren om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DCRA indicatoren.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule wordt aan de betrokken wetenschappelijke verenigingen en (patiënt)organisaties voorgelegd ter commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule wordt aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zerillo JA, Schouwenburg MG, van Bommel ACM, Stowell C, Lippa J, Bauer D, Berger AM, Boland G, Borras JM, Buss MK, Cima R, Van Cutsem E, van Duyn EB, Finlayson SRG, Hung-Chun Cheng S, Langelotz C, Lloyd J, Lynch AC, Mamon HJ, McAllister PK, Minsky BD, Ngeow J, Abu Hassan MR, Ryan K, Shankaran V, Upton MP, Zalcberg J, van de Velde CJ, Tollenaar R; Colorectal Cancer Working Group of the International Consortium for Health Outcomes Measurement (ICHOM). An International Collaborative Standardizing a Comprehensive Patient-Centered Outcomes Measurement Set for Colorectal Cancer. JAMA Oncol. 2017 May 1;3(5):686-694. doi: 10.1001/jamaoncol.2017.0417. PubMed PMID: 28384684.
