Locoregionale stadiëring coloncarcinoom
Uitgangsvraag
Welke beeldvorming dient gebruikt te worden voor locoregionale stadiëring van het coloncarcinoom?
Deze uitgangsvraag omvat de volgende deelvragen:
- Wat is de accuratesse van preoperatieve beeldvorming voor de differentiatie tussen wel of geen lokaal gevorderd (T3cd-T4) coloncarcinoom en de aanwezigheid van positieve lymfklieren in het algemeen en in het D3 gebied in het bijzonder?
- Met welke beeldvorming dient de aanwezigheid van positieve lymfklieren in het algemeen en in het D3 gebied in het bijzonder bepaald te worden?
- Wat dient gerapporteerd te worden in het radiologisch verslag?
Aanbeveling
Gebruik CT voor de locoregionale stadiëring van het coloncarcinoom, maar verricht geen CT scan na lokale excisie van een laag risico T1 carcinoom.
Wees bij sigmoïd carcinomen beducht op overstadiëring van meer centraal gelegen lymfeklieren.
Rapporteer de volgende items in een radiologisch verslag over een colontumor: locatie, lengte, morfologie ((semi)circulair, poliep), cT-stadium, cN-stadium (per regio D1/D2/D3), EMVI, tumor depositie, complicaties van tumor. Formuleer de conclusie volgens TNM.
Overwegingen
De gezamenlijke specificiteit van 70% voor het T3cd-4 stadium bij stadiëring met CT (Nerad, 2016) wil dus zeggen dat de kans op overstadiëring middels CT bij bijna 1/3 van de patiënten optreedt. Dit probleem van vals positieve resultaten wordt vermoedelijk veroorzaakt doordat minimale pericolische vet stranding door benigne desmoplastische reactie door radiologen wordt geïnterpreteerd als tumor doorgroei. Sommige (kleinere) studies die MRI gebruiken laten wel veelbelovende resultaten zien, al blijft het ook voor MRI uitdagend om desmoplastische reactie te onderscheiden van echte tumor doorgroei.
Pas op bij sigmoïd tumoren om klieren niet te snel als para-aortaal af te geven. Klieren bij de origo van de arteria mesenterica inferior zijn nog locoregionaal, en dus geen M1 ziekte (zie Figuur 1) (Storm, 2019).
Wees sowieso ook bij andere colontumoren voorzichtig om pathologische klieren para-aortaal te benoemen (dit is dan M1 ziekte met belangrijke klinische implicaties). Aangezien deze para-aortale pathologische klieren erg zeldzaam zijn: bij minder dan 2% van de patiënten komt dit voor (Kim, 2019 ). Hoewel in Nederland een D3 resectie niet als standaard chirurgische resectie wordt geadviseerd, kunnen duidelijke suspecte D3 lymfklieren een indicatie zijn om alsnog een D3 dissectie te verrichten. Dit wordt dan gedaan met het oog op locoregionale controle en een mogelijke impact op overleving, hoewel hierover door de zeldzaamheid geen goede data ter beschikking zijn.
In de literatuur is veel informatie beschikbaar over cTN status, echter er zijn weinig studies die hebben gekeken naar cT3cd-T4 status. Verder zijn er weinig studies die MRI met CT bij coloncarcinoom hebben vergeleken. De relatief grotere studie van 116 patiënten van Liu uit 2019 die MR met CT heeft vergeleken voor lokale stadiëring van sigmoïd en colon descendens carcinoom heeft gekeken naar cT3-4, EMVI+, N+. Zij laten wel zien dat MRI beter is dan CT om het cT-stadium te bepalen: sensitiviteit van 69,8 % voor MRI (bij 81 van 116 patiënten) versus 56,9 % voor CT. Zij hebben niet gekeken naar cT3cd-T4 status, ook hadden ze geen multi-planar reconstructies voor CT beschikbaar (dit laatste zou de kwaliteit voor CT verbeteren). Mogelijk kan het cT-stadium nauwkeuriger op een CT colonografie worden bepaald door betere distensie van het colon (Nerad, 2016; Horvat, 2019).
CT heeft een lage diagnostische accuratesse voor het bepalen van lymfklier metastasering op basis van diameter (cN+). De sensitiviteit, specificiteit en OR waren respectievelijk 71% (95% CI, 59 tot 81%), 67% (95% CI, 46 tot 83%), en 4,8 (95% CI, 2,5 tot 9,4) (Nerad 2016). Dit laat zien dat de diameter niet een betrouwbare indicator is om pathologische versus niet-pathologische klieren te onderscheiden (Nerad, 2016). Andere parameters kunnen worden meegenomen in de beoordeling (zoals vorm, begrenzing en heterogeniteit), maar zijn evenmin betrouwbaar voor klierdiagnostiek. Om te streven naar meer uniformiteit in de beoordeling van het cN stadium, heeft de werkgroep besloten om toch een afkapwaarde voor de korte as van zichtbare lymfklieren in het mesocolon in te voeren voor cT3-4 tumoren, waarbij suspect gedefinieerd is als ≥8mm. Wees voorzichtig bij de beoordeling van kliermetastasen bij T2 tumoren. Deze kliermetastasen komen in deze groep veel minder vaak voor. Ook is het belangrijk zich te realiseren dat zelfs bij gevorderde tumoren reactieve klieren van ≥8mm zichtbaar kunnen zijn, waarmee er een risico is van overbehandeling indien op basis hiervan bijvoorbeeld een indicatie voor neo-adjuvante chemotherapie zou worden gesteld.
Het is wellicht beter om in de toekomst naast de TNM-stadiering ook naar de extramurale veneuze invasie (EMVI) en tumor deposities te kijken. Dit blijkt onder andere bij een grote studie van 400 patiënten met sigmoïd carcinoom de sterkste prognostische voorspeller voor slechtere ziekte vrije overleving vergeleken met TNM stadium (D'Souza, 2019). Dit wordt ook gezien in een review van MRI bij het rectumcarcinoom (Lord, 2019).
In de literatuur is het nog niet eenduidig wat de beste radiologische criteria zijn om pathologische klieren op te sporen aangezien de meest gebruikte criteria vorm en diameter niet nauwkeurig genoeg zijn. Er zijn veel studies die verschillende criteria uitgeprobeerd hebben (heterogene aankleuring, ADC waarde op MRI, heterogene begrenzing, korte as, lengte as, clusters van klieren, radiomics). Daarbij zijn er ook geen diagnostische studies die gekeken hebben naar exacte locatie van de klieren (D1-D3). In het standaard verslag colon tumor is de definitie van pathologische klieren daarom niet exact bepaald. Opvallend is dat er ook in de literatuur/richtlijnen zeer weinig/geen radiologische gestructureerde standaardverslagen over colon tumoren zijn (Pedersen, 2020). Er zijn vooral gestructureerde verslagen van de MRI bij rectum tumoren gepubliceerd.
Stadiering bij T1 coloncarcinoom
Een CT-abdomen heeft geen meerwaarde bij het inschatten van de mogelijkheid tot een lokale excisie in het colon (Module Lokale excisie vroeg stadium CC). Bij de selectie van colon carcinomen voor een lokale excisie is optische diagnostiek leidend.
Gezien de lage kans op lymfkliermetastasen en synchrone afstandsmetastasen bij het T1 colon carcinoom zonder histologische risicofactoren (Dang, 2020), wordt geadviseerd alleen een CT-abdomen te verrichten ter stadiering bij een coloncarcinoom met een of meer histologische risicofactoren voor lymfkliermetastasen, of wanneer besloten wordt tot een primaire oncologische segment resectie. Na een lokale excisie is er bovendien kans op vergrote reactieve klieren die foutief voor pathologische klieren kunnen worden aangezien. Daarom wordt geadviseerd om geen CT abdomen te doen na lokale excisie van een laag risico T1 coloncarcinoom.
Samenvatting van nationale data en populatiestudies
Er zijn geen relevante populatiestudies gevonden die betrekking hebben op de PICO.
Onderbouwing
Achtergrond
Stadiëring van het coloncarcinoom wordt gedaan middels CT thorax/abdomen. Echter sommige lokaal gevorderde coloncarcinomen komen mede sinds de FOxTROT (Fluoropyrimidine, Oxaliplatin and Targeted-Receptor pre-Operative Therapy) studie steeds meer in aanmerking voor neoadjuvant chemo(radio)therapie. Met name tumoren die meer dan 5 mm doorgroei door de wand vertonen (T3cd-T4) zouden potentieel voor neoadjuvante therapie in aanmerking kunnen komen. Daarnaast speelt de discussie over uitgebreidheid van de verticale lymfklierdissectie bij het coloncarcinoom. Een complete mesocolische excisie (CME) met centrale vasculaire ligatie (CVL optimale D2 lymfklierdissectie) is de standaard, maar selectieve D3 (=centrale) lymfklierdissectie zou kunnen worden overwogen indien er klinisch verdachte centrale lymfklieren aanwezig zijn op de preoperatieve beeldvorming. Daarom wordt het steeds belangrijker om zo nauwkeurig mogelijk het exacte stadium pre-operatief te bepalen.
Samenvatting literatuur
Samenvatting van internationale richtlijnen en consensusdocumenten
SIGN, NICE, en EURECCA geven in het algemeen aan om coloncarcinoom pre-operatief te stadiëren middels CT. Zij maken geen onderscheid tussen lokaal gevorderd T3cd-T4 of niet.
De Japanse Society voor colon- en rectumcarcinoom (JSCCR) richtlijn 2016 raadt aan om de uitgebreidheid van lymfeklier resectie te bepalen op basis van de preoperatieve klinische gegevens, uitgebreidheid van lymfekliermetastase(n) en de tumor doorgroei die intra-operatief wordt bepaald. Als er lymfklier metastasering op beeldvorming/peroperatief is gezien, dan raden zij aan een D3 dissectie te doen (Watanabe, 2017).
Samenvatting van systematische reviews en meta-analyses
cT stadium
De meta-analyse over CT van Nerad (2016) toont een sensitiviteit, specificiteit en diagnostische Odds Ratio (OR) voor detectie van tumordoorgroei door de wand van 5 mm of meer (T3cd–T4) van, respectievelijk, 77% (95% CI, 66 tot 85%), 70% (95% CI, 53 tot 83%), en 7.8 (95% CI, 4.2 tot 14.2).
De review van Curvo-Semedo (2019) laat zien dat de rol van MRI bij stadiëring van het coloncarcinoom beperkt is. De diagnostische accuratesse voor identificatie van T3cd-T4 tumoren middels MRI varieert sterk (40 tot 93%: Curvo-Semedo, 2019).
cN stadium
CT heeft een lage diagnostische accuratesse voor het bepalen van lymfklier metastasering op basis van diameter (cN+). De sensitiviteit, specificiteiten OR waren, respectievelijk,71% (95% CI, 59 tot 81%), 67% (95% CI, 46 tot 83%) en 4.8 (95% CI, 2.5 tot 9.4), (Nerad 2016). Andere parameters kunnen worden meegenomen in de beoordeling (zoals vorm, begrenzing en heterogeniteit), maar zijn evenmin betrouwbaar voor klierdiagnostiek.
De review van Curvo-Semedo (2019) toont dat de diagnostische accuraatheid van MRI voor detectie van pathologische lymfeklieren (cN+) ongeveer 60 tot 82% bedraagt. Een studie van deze review toonde een sensitiviteit en specificiteit van 47 tot 68% en 64 tot 86 % . Criteria voor pathologische klieren varieerden tussen deze studies: korte as ≥ 8mm, en/of cluster van 3 of meer klieren met diameter van > 5 mm, anderen gebruikten 10 mm of irregulaire begrenzing of heterogeen signaal. Geen enkele van deze studies maakte onderscheid in de locatie van de klieren (D1-D3) (Figuur 1).
In de literatuur zijn er geen systematische review van studies die CT direct met MRI vergelijken.
Figuur 1 Classificatie van lymfeklierstations van het colon (Storm NTVO, 2019)
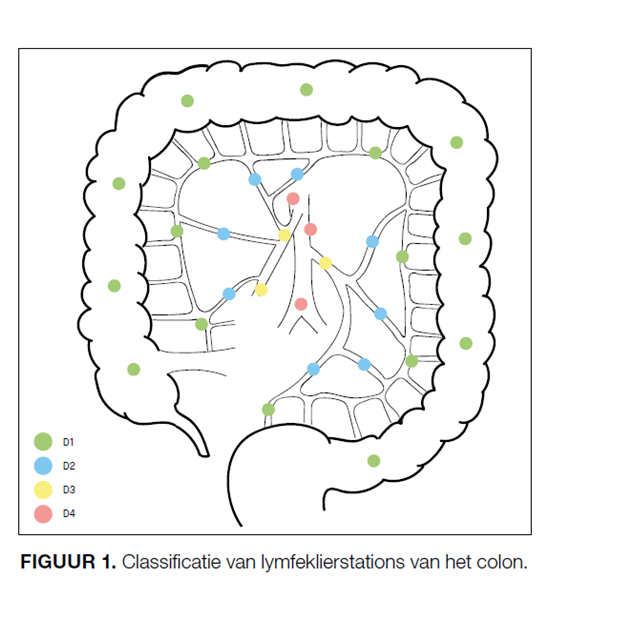
D1 lokaal vlak bij de tumor. D3 klieren liggen centraal langs de oorsprong van de vaatwortels (arteria mesenterica superior en inferior). D2 lymfeklieren liggen mesenteriaal dus tussen D1 en D3 in. D4 zijn para-aortale klieren en deze worden geclassificeerd als afstandsmetastasen (M1 ziekte). D3 voor linkszijdige tumoren zijn lymfeklieren centraal langs de origo van de a. mesenterica inferior/of a. colica sinistra. Voor rechtszijdige tumoren zijn dit lymfeklieren langs de a. en v. mesenterica superior. Let op: pathologische klieren van het sigmoïd die bij de inmonding van de arteria mesenterica inferior zijn gelegen moeten nog wel locoregionaal worden beschouwd en niet als para-aortale klieren worden benoemd (dus geen M1 ziekte)
Echter de review van Kim (2019) rapporteert dat deze Japanse criteria voor resectie van D1-D3 lymfeklieren nog niet wereldwijd zijn geaccepteerd in de dagelijkse kliniek, gezien wisselende uitkomsten van studies die deze methode al dan niet voor hun beleidsbeslissing hebben gebruikt.
Extramurale vene invasie (EMVI)
In de literatuur is er een trend dat EMVI iets beter op de MRI kan worden beoordeeld dan op CT: de diagnostische accuratesse voor MRI bedraagt 60 tot 77 % versus 54 tot 63 % voor CT. Gezien de relatief lage accuratesse blijft het dus lastig om het verschil te maken tussen daadwerkelijke veneuze invasie en desmoplastische of inflammatoire veranderingen (Curvo-Semedo, 2019). Impact van EMVI op de ziektevrije uitkomst en eventuele verandering in het behandelplan is nog niet bekend.
Standaard verslag colon tumor:
Voor het opstellen van het beste behandelplan is het belangrijk om tenminste het volgende in het verslag te zetten. (Dit is gedaan aan de hand van gestructureerde pathologie verslag AJCC Cancer Staging Manual 7th edition, 2016).
Verslag Colontumor:
- Locatie colontumor: (sigmoid, colon descendens, flexura lienalis, colon transversum, flexura hepatica, colon ascendens, ceacum).
- Lengte tumor: …… cm .
- Circulair/ semicirculair/ poliep:
- Tumor doorgroei door de wand:
- cT1/ T2:
- c T3a,b: < 5mm.
- cT3c,d: > 5mm.
- cT4a: ingroei in peritoneum.
- cT4b: ingroei in andere structuren/organen.
- Ingroei in peritoneum pariëtale (ventraal gelegen) of posterieur: anterieure renale fascie/ (mesocolische fascie (hierdoor ruimte tussen mesocolische compartiment en peritoneale compartiment ) zie figuur 2.
- Pathologische klieren: Peritumoraal: (D1).
- Mesenteriaal: (D2).
- Centraal: (D3).
- Para-aortaal (D4, M-status).
- cN0 = geen pathologische klieren cN=1 tot 3 verdachte klieren en cN2=4 of meer.
- Tumor depositie: ja/nee.
- EMVI (extra murale vene invasie): ja/nee.
- Complicatie: Obstructie dunne of dikke darm/abces/fisteling /perforatie.
- Conclusie: in TNM met toevoeging van extra aanwezige kenmerken.
Figuur 2a Anatomie retroperitoneale ruimte (referentie: Coffin, 2015)
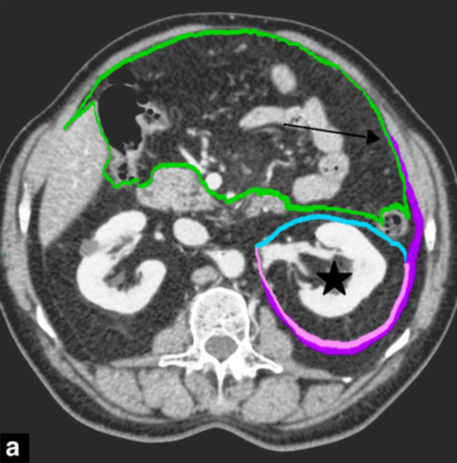
Groene lijn = peritoneum parietale
Posterieure peritoneum parietale met de anterieure renale fascie (licht blauw) en lateroconische fascie (paars ) loopt door in de posterieure renale fascie (roze)
Figuur 2b Sagitaal anatomie
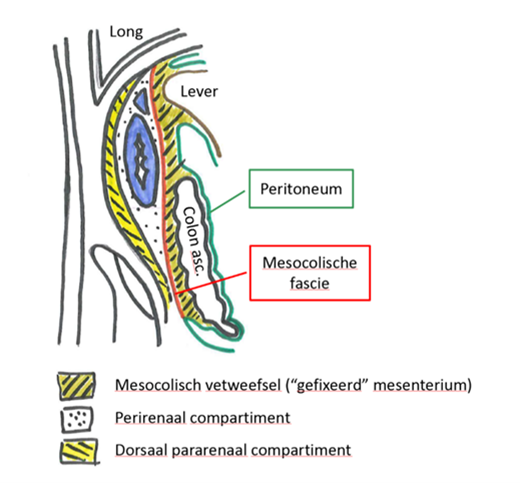
De anterieure renale fascie wordt ook wel de mesocolische fascie genoemd
Zoeken en selecteren
PICO (accuratesse stadiëring middels beeldvorming)
P: patiënt met coloncarcinoom;
I: MRI abdomen;
C: CT abdomen;
O: accuratesse cT stadium, accuratesse cN stadium, accuratesse D3 lymfklieren, EMVI, verandering in beleid.
Uitkomstmaten
Accuratesse cT stadium, accuratesse cN stadium, accuratesse D3 lymfklieren, EMVI, verandering in beleid.
Referenties
- Coffin A, Boulay-Coletta I, Sebbag-Sfez D, Zins M. Radioanatomy of the retroperitoneal space. Diagn Interv Imaging. 2015 Feb;96(2):171-86. doi: 10.1016/j.diii.2014.06.015. Epub 2014 Dec 26. PMID: 25547251.
- Curvo-Semedo, L. Colon Cancer Staging: When Does High Resolution MRI Have a Role?. Curr Colorectal Cancer Rep 15, 170–174 (2019). https://doi.org/10.1007/s11888-019-00444-0.
- Dang H, Dekkers N, le Cessie S, van Hooft JE, van Leerdam ME, Oldenburg PP, et al. Risk and Time Pattern of Recurrences After Local Endoscopic Resection of T1 Colorectal Cancer: A Meta-analysis. Clin Gastroenterol Hepatol. 2020 Dec 1:S1542-3565(20)31622-0. doi: 10.1016/j.cgh.2020.11.032. Epub ahead of print. PMID: 33271339.
- D'Souza N, Shaw A, Lord A, Balyasnikova S, Abulafi M, Tekkis P, et al. Assessment of a Staging System for Sigmoid Colon Cancer Based on Tumor Deposits and Extramural Venous Invasion on Computed Tomography. JAMA Netw Open. 2019 Dec 2;2(12):e1916987. doi: 10.1001/jamanetworkopen.2019.16987. PMID: 31808924; PMCID: PMC6902773.
- Horvat N, Raj A, Liu S, Matkowskyj KA, Knezevic A, Capanu M, et al. CT Colonography in Preoperative Staging of Colon Cancer: Evaluation of FOxTROT Inclusion Criteria for Neoadjuvant Therapy. AJR Am J Roentgenol. 2019 Jan;212(1):94-102. doi: 10.2214/AJR.18.19928. Epub 2018 Nov 13. PMID: 30422707; PMCID: PMC7959265.
- Kim HJ, Choi GS. Clinical Implications of Lymph Node Metastasis in Colorectal Cancer: Current Status and Future Perspectives. Ann Coloproctol. 2019 Jun;35(3):109-117. doi: 10.3393/ac.2019.06.12. Epub 2019 Jun 30. PMID: 31288500; PMCID: PMC6625771.
- Lord, A., D’Souza, N., Shaw, A. et al. The Current Status of Nodal Staging in Rectal Cancer. Curr Colorectal Cancer Rep 15, 143–148 (2019). https://doi.org/10.1007/s11888-019-00441-3
- Nerad E, Lahaye MJ, Maas M, Nelemans P, Bakers FC, Beets GL, Beets-Tan RG. Diagnostic Accuracy of CT for Local Staging of Colon Cancer: A Systematic Review and Meta-Analysis. AJR Am J Roentgenol. 2016 Nov;207(5):984-995. doi: 10.2214/AJR.15.15785. Epub 2016 Aug 4. PMID: 27490941.
- Pedersen MRV, Dam C, Loft M, Rafaelsen SR. Reporting colon cancer staging using a template. Eur J Radiol Open. 2020 Jan 29;7:100213. doi: 10.1016/j.ejro.2020.01.002. PMID: 32021880; PMCID: PMC6994830.
- Tudyka V, Blomqvist L, Beets-Tan RG, Boelens PG, Valentini V, van de Velde CJ, Dieguez A, Brown G. EURECCA consensus conference highlights about colon & rectal cancer multidisciplinary management: the radiology experts review. Eur J Surg Oncol. 2014 Apr;40(4):469-75. doi: 10.1016/j.ejso.2013.10.029. Epub 2013 Dec 14. PMID: 24439446.
- Watanabe T, Muro K, Ajioka Y, Hashiguchi Y, Ito Y, Saito Y, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR) guidelines 2016 for the treatment of colorectal cancer. Int J Clin Oncol. 2018 Feb;23(1):1-34. doi: 10.1007/s10147-017-1101-6. Epub 2017 Mar 27. PMID: 28349281; PMCID: PMC5809573.
- Storm SL, Boer FC. De waarde van D3 –lymfadenectomie en complete mesocolische excisie bij een colonresectie wegens coloncarcinoom. NTVO (Nederlands Tijdschrift voor Oncolgie). 2019 Juli; 16(5);176-185.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 05-08-2022
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep in stand gehouden voor een periode van 3 jaar, met optionele verlenging van 3 jaar. De werkgroep zal halfjaarlijks bijeenkomen voor een herbeoordeling van de geldigheid van de modules in deze richtlijn. De geldigheid van richtlijnmodules zal bij herbeoordeling komen te vervallen wanneer nieuwe ontwikkelingen aanleiding geven om een herzieningstraject te starten. De Nederlandse Vereniging voor Heelkunde (NVvH) is regiehouder van deze richtlijn en eindverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijnmodules. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied. Per module is aangegeven welke wetenschappelijke vereniging de eerstverantwoordelijke is voor de actualiteitsbeoordeling (zie de Algemene inleiding: Inhoud richtlijn colorectaal carcinoom en gepland modulair onderhoud).
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Het tot stand brengen van een modulaire herziening van de richtlijn “Colorectaal Carcinoom”, zodat het beleid bij patiënten met een colorectaal carcinoom gestandaardiseerd en op hun wensen is afgestemd in alle fasen van de ziekte.
Doelgroep
Patiënten met een colorectaal carcinoom in de tweede en derde lijn.
Samenstelling werkgroep
Huidige samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met colorectaal carcinoom te maken hebben. De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
De huidige samenstelling van de werkgroep is:
- Prof. dr. P.J. (Pieter) Tanis, gastrointestinaal en oncologisch chirurg, Erasmus MC, Rotterdam, NVvH (voorzitter)
- Prof. dr. G.L. (Geerard) Beets, gastrointestinaal en oncologisch chirurg, Antoni van Leeuwenhoek, Amsterdam, NVvH
- Mw. S. (Simone) Dokter MSc., verpleegkundig specialist, Antoni van Leeuwenhoek, Amsterdam, V&VN
- Dr. D.J.A. (Derk Jan) de Groot, internist-oncoloog, UMC Groningen, Groningen, NIV/NVMO
- Dr. M.E. (Marije) Hamaker, klinisch geriater, Diakonessenhuis, Utrecht, NVKG
- Dr. M.P.W. (Martijn) Intven, radiotherapeut, UMC Utrecht, Utrecht, NVRO
- Dr. O.J.L. (Olaf) Loosveld, internist-oncoloog, Amphia Ziekenhuis, Breda, NIV/NVMO
- Dr. M. (Monique) Maas, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- Prof. dr. C.A.M. (Corrie) Marijnen, radiotherapeut, Leids Universiteit Medisch Centrum, Leiden, NVRO
- Dr. M. (Martijn) Meijerink, interventieradioloog, Amsterdam UMC locatie VUmc, Amsterdam, NVvR
- Dr. L. (Leon) Moons, MDL-arts, UMC Utrecht, Utrecht, NVMDL
- Prof. dr. I.D. (Iris) Nagtegaal, patholoog, Radboud UMC, Nijmegen, NVvP
- Dr. M. (Mark) Roef, nucleair geneeskundige, Catharina Ziekenhuis, Eindhoven, NVNG
- Dr. P. (Petur) Snaebjornsson, patholoog, Nederlands Kanker Instituut, Amsterdam, NVvP
- Mw. I. (Iris) van der Veeken Msc., coloncare verpleegkundige, Flevoziekenhuis, Almere, V&VN
- Dr. H.M.W. (Henk) Verheul, internist-oncoloog, Radboudumc, Nijmegen, NIV/NVMO
- Prof. dr. C. (Kees) Verhoef, oncologisch chirurg, Erasmus MC, Rotterdam, NVvH
- Dr. M. (Marianne) de Vries, abdominaal radioloog, Erasmus MC, Rotterdam, NVvR
- Dr. H.L. (Erik) van Westreenen, chirurg, Isala Zwolle/ Isala Diaconessenhuis, Zwolle/Meppel, NVvH
Voormalig betrokken werkgroepleden
- Prof. dr. R.G.H. (Regina) Beets-Tan, radioloog, Nederlands Kanker Instituut, Amsterdam, NVvR
- C.M.J. (Christel) Gielen MSc., verpleegkundig specialist, Maastricht UMC+, Maastricht, V&VN
- Dr. C.J. (Corneline) Hoekstra, nucleair geneeskundige, Jeroen Bosch Ziekenhuis, ’s-Hertogenbosch, NVNG
- Prof. dr. C.J.A. (Kees) Punt, medisch oncoloog, NIV/NVMO
- Prof. dr. J. (Jaap) Stoker, abdominaal radioloog, NVvR
- Dr. A.J. (Albert Jan) ten Tije, internist oncoloog, NIV/NVMO
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
De werkgroep heeft geconstateerd dat sommige werkgroepleden betrokken zijn bij wetenschappelijk onderzoek dat wordt gefinancierd door overheid, onafhankelijke subsidieverstrekkers, of commerciële partijen (in het laatste geval: unrestricted scientific grants). Om te voorkomen dat indirecte belangen (waaronder reputatie en kennisvalorisatie) de richtlijnaanbevelingen onbedoeld zouden kunnen beïnvloeden, heeft de werkgroep besloten dat geen van de modules/aanbevelingen worden opgesteld door één werkgroeplid met dergelijke indirecte belangen. Tenminste één ander werkgroeplid met hetzelfde specialisme of tenminste één ander werkgroeplid met vergelijkbare inhoudelijke kennis van het betreffende onderwerp zijn verantwoordelijk voor de inhoud (vier-ogen-principe).
De werkgroep zag in de gemelde (on)betaalde nevenfuncties geen aannemelijke reden voor onbedoelde beïnvloeding door belangenverstrengeling ten aanzien van de onderwerpen die in de richtlijn aan bod komen.
Huidige werkgroepleden
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. Dr. P.J. (Pieter) Tanis
|
1. Hoogleraar chirurgie, in het bijzonder colorectale chirurgie, Amsterdam UMC, Universiteit van Amsterdam (0 fte) 2. Oncologische en gastrointestinaal chirurg, Erasmus MC, Rotterdam (1,0 fte) |
- Lid van de Clinical Audit Board van de Dutch ColoRectal Audit (onbetaald) - Lid Medische adviesraad Lynch Polyposis vereniging (onbetaald) - Bestuurslid Stichting Opsporing Erfelijke Tumoren (onbetaald) - Associate Editor Colorectal Disease (onbetaald) |
Financiële belangen: Geen financiële belangen te vermelden in het kader van de richtlijn Colorectaal carcinoom. Vergoeding ontvangen voor het geven van voordrachten op wetenschappelijke bijeenkomsten van Johnson & Johnson, Medtronic, Servier, maar op onderwerpen niet gerelateerd aan de richtlijn.
Extern gefinancierd onderzoek: * KWF/ B Braun: Preventie en behandeling van naadlekkage na resectie rectumcarcinoom. IMARI trial - Projectleider * KWF: Rol van adjuvantie HIPEC bij T4/geperforeerd coloncarcinoom. COLOPEC trial - Projectleider * KWF: Waarde van second/ third look laparoscopie voor vroege detectie peritoneonale metastasen coloncarcinoom. COLOPEC 2 trial - Projectleider * KWF: Toepassing van een gluteale transpositie voor perineale wondsluiting bij APR voor rectumcarcinoom. BIOPEX-2 trial - Projectleider * KWF: Waarde van perioperatieve chemotherapie bij CRS/HIPEC voor peritoneale metastasen van CRC. CAIRO-6 trial - Geen projectleider * KWF: Landelijke snapshot studies naar verschillende facetten van de behandeling van rectumcarcinoom en complex coloncarcinoom - geen projectleider |
Geen actie ondernomen.
Subsidies zijn van KWF, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Prof. dr. G.L. (Geerard) Beets
|
Chirurg / Afdelingshoofd AVL |
Medisch consultant bij Champalimaud Foundation, oncologisch ziekenhuis in Lissabon, Portugal (betaalde functie) |
Geen. |
Geen actie ondernomen. |
|
S. Dokter (Simone) MSc. |
Verpleegkundig specialist MDL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. Derk Jan de Groot
|
Internist-oncoloog |
Geen. |
Klinische studies: Ipsen (betaling aan het instituut) |
Geen actie ondernomen. |
|
Dr. M.E. (Marije) Hamaker
|
Klinisch geriater |
Geen |
Roche: lid van werkgroep e-learning colorectaal carcinoom (niet relevant voor de richtlijn)
Astra Zeneca: financiering van onderzoek over dialyse bij ouderen |
Geen actie ondernomen. |
|
Dr. M.P.W. (Martijn) Intven
|
Radiotherapeut |
Lid redactieraad van het Nederlands tijdschrift voor oncologie |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. C.A.M. (Corrie) Marijnen
|
Radiotherapeut / Afdelingshoofd radiotherapie LUMC |
Voorzitter wetenschapscommissie NVRO
Redactielid leerboek Oncologie |
Geen. |
Geen actie ondernomen. |
|
Dr. Martijn Meijerink
|
Interventieradioloog, Amsterdam UMC locatie VUmc |
Voorzitter WCIR (wetenschapscommissie interventieradiologie), onbetaald.
Voortzitter SIO (Soc. Interv. Oncol.) Research Committee, onbetaald.
Raad van advies SPKS (stichting voor patiënten met kanker aan het spijsverteringskanaal), onbetaald.
Ambassadeur SBBvK en OZS, onbetaald |
Consultant Angiodynamics B.V. (vergoeding voor presentaties, workshops, proctorships) op het gebied van irreversibele electroporatie.
Research grants: Collision Trial (Medtronic) Diverse trials (Angiodynamics B.V.)
|
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. L. (Leon) Moons
|
MDL-arts |
Consultant voor Boston Scientific, met vergoeding. In 2018 betrof dit € 3220, in 2019 € 1885. Daarnaast heeft Zambon in 2019 een bijdrage geleverd aan het bezoek van de Digestive Disease Week in San Diego, VS voor het bedrag van € 1996. Deze consultancy gaat over specifieke apparatuur voor MDL-artsen, niet relevant voor deze richtlijn. |
Voorzitter van T1 CRC werkgroep en voorzitter van een internationaal samenwerkingsverband op het gebied van T CRC's (CRIT1C constortium)
PI van een gerandomiseerde studie (piecemeal EMR vs. ESD), gefinancierd door KWF.
PI van een studie naar risicomodellen voor het voorspellen van lymfekliermetastasen en lokale recidieven van T1 CRCs, gefinancierd door de MLDS.
PI van een studie naar tumor seedings tijdens coloscopie, gefinancierd door de Sacha Swarttouw-Hijmans stichting. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Prof. dr. I.D. (Iris) Nagtegaal
|
Patholoog Radboudumc/ Hoogleraar Radboud Universiteit (1 fte), met detachering als Expert Pathologie ten behoeve van het bevolkingsonderzoek darmkanker bij de Nederlandse screeningsorganisatie (0,2 fte) |
Voorzitter PALGA (Nederlands Digitale Pathologie Archief), vacatiegeld naar afdeling Pathologie, Radboudumc
Voorzitter European Taskforce for synoptic reporting in pathology, onbetaald
Voorzitter Nederlands TNM committee, onbetaald
Member data steering committee International Collaboration on Cancer Reporting (onbetaald)
Member YNM Global Advisory Group (onbetaald)
Member expert panel AJCC lower gastrointestinal cancer (onbetaald) |
* KWF - Tumour deposits: the origin of distant metastases? - Projectleider * KWF - Into the light: guided visualization of high-risk cander precursor lesions - geen projectleider * ZonMw - The impact of COVID-19 epidemic on diagnosis and treatment of canver patients: lessons for the future - geen projectleider * KWF - Coexistence with metastases: influence of microbiome on CRC metastases - geen projectleider * Hanarth fonds - CUP fight: detecting the origin of metastatic disease - Projectleider |
Geen actie ondernomen.
Subsidies zijn van ZonMw/KWF, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
|
Dr. M. (Mark) Roef |
Nucleair geneeskundige |
Penningmeester NVNG Commissie Wetenschappelijke Ontmoetingen, onbetaald |
Geen. |
Geen actie ondernomen. |
|
Dr. P. (Petur) Snaebjornsson
|
Patholoog |
Bestuurslid Dutch Colorectal Cancer Group (onbetaald).
|
1. Op 1 oktober 2020: online Expert Input Forum, georganiseerd door MSD. Onderwerp: HSI-H colorectaalcarcinoom. Hiervoor betaling aan AVL. Hoofdstuk/module over MMR/MSI status en moleculaire pathologie is hiervoor al geschreven 2. Op 8 oktober 2020: deelname als expert aan nascholing Colorectaal carcinoom (talkshow). Onderwerp: gemetastaseerd colorectaalcarcinoom. Georganiseerd door MEDtalks. Hiervoor betaling aan ALV. Hoofdstuk/module over MMR/MSI status en moleculaire pathologie is hiervoor al geschreven
Andere: Betrokken bij COLOPEC trials en CAIRO6 trial. |
Geen actie ondernomen. |
|
I. (Iris) van der Veeken, Msc. |
Coloncare verpleegkundige |
Deelname V&VN tumorwerkgroep colorectaal - onbetaald |
Geen. |
Geen actie ondernomen. |
|
Prof. Dr. H. (Henk) Verheul |
Internist oncoloog Radboudumc Nijmegen, Professor Translation Cancer Research |
Geen. |
Externe financiering: Philips Diagnostics, Roche Pfizer, Frame Therapeutics |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Prof. dr. C. (Kees) Verhoef
|
Oncologisch chirurg |
Wetenschappelijke adviesraad KWF (onbetaald).
Wetenschappelijk raad Livermetsurvey (onbetaald).
Voorzitter Nederlandse Vereniging voor Chirurgische Oncologie (onbetaald).
Lid Algemeen Bestuur Nederlandse Vereniging van Heelkunde (onbetaald).
Voorzitter "Dutch chapter E-AHPBA" (onbetaald).
Nederlands TNM comite (onbetaald).
Adviesraad IKNL (onbetaald).
Nederlandse wetenschappelijke Sarcoom Werkgroep (onbetaald).
Bestuur Dutch Hepatocellular Carcinoma Group (onbetaald).
Bestuur Familiehuis, Daniel den Hoed Kliniek (onbetaald). |
Geen. |
Geen actie ondernomen. |
|
Dr. Marianne de Vries
|
Radioloog |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Dr. H.L. (Erik) Van Westreenen
|
Gastrointestinaal en oncologisch chirurg |
Penningmeester werkgroep Coloproctologie (onbetaald) |
PI Limeric study (endoscopisch geassisteerde laparoscopische wigresectie van het colon).
Locale PI en mede aanvrager FORCE study (Zon-MW) (Randomisatie tussen best-supportive care of bekkenfysiotherapie na low-anterior resectie)
Locale PI TESAR study
Locale PI StarTrec study
Locale PI FIT trial |
Geen actie ondernomen.
Mede-aanvrager van ZonMW subsidie, onwaarschijnlijk dat dit een belang oplevert. Daarom geen actie ondernomen. |
Voormalige werkgroepleden
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Prof. dr. R.G.H. (Regina) Beets-Tan
|
Radioloog / Hoofd radiologie NKI/AVL |
Geen. |
Geen. |
Geen actie ondernomen. |
|
C.M.J. (Christel) Gielen MSc.
|
Verpleegkundig specialist Coloncare |
Geen. |
Werkt mee aan de inclusie voor de ENCORE studie (energie voor het leven na colorectaalkanker). |
Geen actie ondernomen. |
|
Dr. C.J. (Corneline) Hoekstra
|
Nucleair geneeskundige |
Geen. |
Geen. |
Geen actie ondernomen. |
|
Prof. dr. C.J.A. (Kees) Punt
|
Medisch oncoloog |
Voorzitter werkgroep medische oncologie, Dutch Colorectal Cancer Group (DCCG) (onbetaald).
Voorzitter Dutch Oncology Research Platform (onbetaald). |
Lid raad van advies SPKS
Unrestricted scientific grants van Roche en Amgen voor DCCG CAIRO5 studie. |
Om mogelijk te maken dat geen van de modules/ aanbevelingen worden opgesteld door één werkgroeplid met indirecte belangen door sponsoring uit derde geldstroom van private instellingen, zijn extra werkgroepleden toegevoegd aan de werkgroep. |
|
Dr. A.J. (Bert Jan) ten Tije |
Internist-oncoloog |
Geen. |
Geen. |
Geen actie ondernomen. |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van de Stichting voor Patiënten met Kanker aan het Spijsverteringskanaal (SPKS) voor de invitational conference. Daarnaast hebben patiëntvertegenwoordigers (dr. L. Meerman, mw. M. v.d. Bosch-Scholts en tot 2021 mw. A. van Heijst; Stomavereniging, anno 2022 Stichting Darmkanker, Nederlandse Federatie van Kankerpatiëntenorganisaties, NFK) modules meegelezen en de werkgroep van feedback vanuit het patiëntenperspectief voorzien. De conceptrichtlijn is tevens ter commentaar voorgelegd aan Stichting Darmkanker en NFK.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de herziene richtlijnmodules en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. De werkgroep heeft geen interne kwaliteitsindicatoren ontwikkeld, omdat interne en externe kwaliteitsindicatoren al ontwikkeld worden binnen de Dutch Colorectal Audit (DCRA), de clinical audit board betreffend colorectaal carcinoom onder de Dutch Institute for Clinical Auditing (DICA).
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseurs de knelpunten. De werkgroep beoordeelde de aanbevelingen uit de eerdere richtlijn (NVRO, 2014) op noodzaak tot revisie. De werkgroep stelde vervolgens een long list met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van nieuwe evidence, (3) en de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten. Tevens zijn er knelpunten aangedragen door verschillende partijen via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en werkgroepleden concept-uitgangsvragen opgesteld. Gedurende het richtlijnherzieningstraject heeft de werkgroep de definitieve uitgangsvragen in een hernieuwd raamwerk (de inhoudsopgave, zie ook de algemene inleiding) van de richtlijn vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep baseerde de keuze voor uitkomstmaten mede op basis van de “core outcome set” gepubliceerd door Zerillo (2017). De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden. Hiervoor sloot de werkgroep zich, waar mogelijk, aan bij de grenzen voor klinische besluitvorming volgens de PASKWIL criteria uit 2016. Wanneer er geen grenzen voor klinische besluitvorming conform de PASKWIL criteria geformuleerd konden worden (bijvoorbeeld bij non-inferioriteitsvraagstukken) werden de standaard GRADE grenzen gehanteerd, tenzij anders vermeld.
Strategie voor zoeken en selecteren van literatuur
De werkgroep raadpleegde voor de afzonderlijke uitgangsvragen reeds gepubliceerde systematische reviews (SRs). SRs kwamen in aanmerking indien: i) systematisch was gezocht in één of meerdere databases; ii) transparante in- en exclusiecriteria zijn toegepast en iii) idealiter de kwaliteit van de geïncludeerde literatuur was beoordeeld. De voor de uitgangsvragen relevante internationale richtlijnen en consensusdocumenten werden eveneens geraadpleegd. Overige literatuur, waar niet systematisch naar werd gezocht, is als bewijsvoering in de overwegingen opgenomen.
Relevante beschikbare populatiegegevens uit Nederland werden gebruikt voor het bepalen van knelpunten, praktijkvariatie en externe validiteit van internationale richtlijnen en gepubliceerde literatuur.
Kwaliteitsbeoordeling individuele studies
De (risk of bias) kwaliteitsbeoordelingen van de individuele studies uit de gebruikte SRs werden gebruikt, tenzij deze afwezig waren of onbruikbaar waren voor het beoordelen van de kracht van het wetenschappelijke bewijs. Indien afwezig of onbruikbaar werd aangenomen dat er een risico op bias aanwezig zou kunnen zijn. In enkele gevallen, wanneer studies informatie verschaften over de cruciale uitkomstma(a)t(en), werd er een nieuwe kwaliteitsbeoordeling van individuele studies uitgevoerd.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van de geselecteerde SRs werden weergegeven in ‘Summary of Findings’ tabellen. De belangrijkste bevindingen uit de literatuur werden kort beschreven onder “Samenvatting literatuur” (kopjes “Samenvatting van internationale richtlijnen en consensusdocumenten” en “Samenvatting van systematische reviews en meta-analyses”) en onder “Overwegingen”. Bestaande meta-analyses uit de gebruikte systematische reviews werden beschreven. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013). Het resultaat van de gradering van het wetenschappelijk bewijs werd opgenomen in de ‘Summary of Findings’ tabellen.
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’.
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek (te vinden in de ‘Summary of Findings’ tabellen). De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Aanbevelingen uit de richtlijn Colorectaal carcinoom 2014
De werkgroep beoordeelde alle aanbevelingen in de richtlijn Colorectaal carcinoom uit 2014 op geldigheid. De werkgroep heeft aanbevelingen gehandhaafd die als nog steeds geldig werden beschouwd. De werkgroep heeft deze aanbevelingen tekstueel opgefrist met als doel de implementeerbaarheid te vergroten. De aanbevelingen zijn niet inhoudelijk veranderd. De werkgroep heeft in het modulair onderhoudsschema vastgesteld wanneer herziening van deze modules gepland is. De werkgroep verwacht dat eind 2020 de gehele richtlijn is herzien.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Er werden geen interne kwaliteitsindicatoren ontwikkeld om het toepassen van de richtlijn in de praktijk te volgen en te versterken. De werkgroep conformeert zich aan de SONCOS normen en de DICA-DCRA indicatoren.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in de bijlage Kennislacunes beschreven (onder aanverwante producten).
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en patiëntorganisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zerillo JA, Schouwenburg MG, van Bommel ACM, Stowell C, Lippa J, Bauer D, Berger AM, Boland G, Borras JM, Buss MK, Cima R, Van Cutsem E, van Duyn EB, Finlayson SRG, Hung-Chun Cheng S, Langelotz C, Lloyd J, Lynch AC, Mamon HJ, McAllister PK, Minsky BD, Ngeow J, Abu Hassan MR, Ryan K, Shankaran V, Upton MP, Zalcberg J, van de Velde CJ, Tollenaar R; Colorectal Cancer Working Group of the International Consortium for Health Outcomes Measurement (ICHOM). An International Collaborative Standardizing a Comprehensive Patient-Centered Outcomes Measurement Set for Colorectal Cancer. JAMA Oncol. 2017 May 1;3(5):686-694. doi: 10.1001/jamaoncol.2017.0417. PubMed PMID: 28384684.
