Zorg op Afstand bij Coeliakie
Uitgangsvraag
Wat is de plaats van Zorg op Afstand bij de zorg voor coeliakie?
Aanbeveling
Bespreek met de patiënt de beschikbare mogelijkheden van zorg op afstand in de verschillende fasen van hun ziekte. Beslis samen met de patiënt (of met de ouders/verzorgers) of, en welke mogelijkheden van zorg op afstand worden ingezet.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is een literatuuronderzoek uitgevoerd naar de mogelijkheden tot het inzetten van zorg op afstand bij de follow-up van coeliakiepatiënten. Hierbij was het uitgangspunt dat zorg op afstand minstens even goed dient te zijn als face-to-face zorg. Er werd één review geïncludeerd, waarin zes relevante gerandomiseerde trials waren beschreven die keken naar de effecten van de inzet van enige vorm van zorg op afstand bij de lange termijn zorg voor coeliakiepatiënten.
Voor de cruciale uitkomstmaat ‘compliance aan een glutenvrij dieet’ werden vijf studies gevonden, die allen lieten zien dat het inzetten van zorg op afstand leidt tot een compliance die vergelijkbaar was met, al dan niet beter dan, reguliere face-to-face zorg. Ook voor de belangrijke uitkomstmaten ‘kennis van coeliakie en een glutenvrij dieet’ en ‘kwaliteit van leven’ werd gevonden dat het inzetten van zorg op afstand leidt tot minstens vergelijkbare effecten wanneer vergeleken met reguliere face-to-face zorg. Er waren meerdere beperkingen in de geïncludeerde trials, waaronder gebreken in de randomisatie en gebrek aan blindering. Dit vermindert de betrouwbaarheid van het gevonden bewijs. Er lijken echter op basis van de gevonden literatuur geen sterke argumenten tegen het inzetten van zorg op afstand bij coeliakiepatiënten te zijn. Dit is in lijn met de resultaten uit een eerder uitgevoerde generieke search naar zorg op afstand waarin op basis van 15 systematisch reviews (minstens 21.971 patiënten geïncludeerd), geconcludeerd werd dat de kwaliteit en effectiviteit van zorg op afstand minstens vergelijkbaar is met face-to-face zorg (zie generieke module zorg op afstand – nog in ontwikkeling).
In de geïncludeerde studies werden zorg op afstand interventies veelal ingezet naast de reguliere zorg, met uitzondering van de studie van Vriezinga (2018) waarin gekeken werd naar online consulten als vervanging van fysieke consulten. De gevonden resultaten pleiten dus niet direct voor efficiëntere zorg, waarbij een deel van de fysieke zorg vervangen kan worden door zorg op afstand. Mogelijk bestaat ook de kans dat zorg op afstand zelfs leidt tot een verhoging van de zorgconsumptie, doordat klachten makkelijk gemonitord kunnen worden en er laagdrempelig contact met de zorgverlener kan worden gezocht. Over de daadwerkelijke effecten op de efficiëntie van zorg en zorgconsumptie bestaat een kennishiaat.
De literatuurstudie die is uitgevoerd heeft zich primair gericht op het inzetten van zorg op afstand in de follow-up van coeliakiepatiënten. Er zijn echter ook in andere fasen van het zorgpad mogelijkheden om zorg op afstand in te zetten, al is de effectiviteit hiervan niet onderzocht in de literatuur. In de eerste fase na diagnose kan zorg op afstand met name ingezet worden ter educatie van de ziekte en het dieet. Voorbeelden hiervan zijn digitale groepsconsulten, e-learnings en digitale platforms. Hiermee zou het aantal contacten met arts en/of diëtist beperkt kunnen worden en kennis bij patiënt (en naasten) vergroot kunnen worden. Op de lange termijn lijkt zorg op afstand bij uitstek geschikt als middel om de zelfbeschikking/-regie van patiënten te versterken. Het periodiek afnemen van gestandaardiseerde vragenlijsten, bijvoorbeeld voor het monitoren van klachten, dieettrouw en kwaliteit van leven of zelftests ter evaluatie van de dieettrouw (Costa, 2019), zouden groepen kunnen onderscheiden van patiënten die wel of geen consult bij een gespecialiseerd arts of diëtist nodig hebben. Dit zou kunnen bijdragen aan doelmatige zorg waarbij een selecte groep patiënten op indicatie frequenter gespecialiseerde hulp krijgt.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
In drie van de studies uit de review van Mansson (2022) werd tevredenheid van de patiënten met de zorg op afstand interventies geanalyseerd (Connan, 2019; Dowd, 2020; Vriezinga, 2018). Twee studies rapporteerden dat de patiënten tevreden waren met de zorg op afstand interventies (Connan, 2019; Dowd, 2020). De studie van Vriezinga (2018) liet wisselende resultaten zien. Een deel van de patiënten was minder tevreden met online consulten dan met de face-to-face consulten. De online consulten werden ervaren als minder persoonlijk. Daarentegen werden de flexibiliteit van timing en locatie als voordelen genoemd.
De Nederlandse Coeliakie Vereniging (NCV) heeft onder haar leden een uitvraag gedaan naar ervaringen met zorg op afstand (n = 130). De respondenten waren gemiddeld 51.5 jaar en het grootste deel ontving zorg voor coeliakie vanuit de tweede lijn (63%). Uit dit onderzoek blijkt dat 87% al ervaring heeft met een of andere vorm van zorg op afstand. Over die zorg is men gemiddeld gesproken tevreden, meer dan 50% geeft een 7 of 8 op een schaal van 1 tot 10. Van de respondenten is 50% het er (sterk) mee eens dat ze in de toekomst vaker zorg op afstand willen ontvangen, 36% is neutraal en een kleine 14% is het daar (sterk) mee oneens.
Als grootste voordeel wordt het gemak en de tijdswinst genoemd. Ook vindt een groot deel van de respondenten het prettig dat zij zich door zorg op afstand thuis voor kunnen bereiden op een consult, of de besproken zaken achteraf kunnen nalezen. Als groot nadeel noemen mensen het gebrek aan persoonlijk contact en mede daardoor het missen van de nuance in de communicatie. Ook spreekt een deel van de respondenten zorgen uit over (het gebrek aan) digitale vaardigheden bij patiënten. De respondenten vinden dat de patiënt altijd de keuze moet blijven houden voor fysieke zorg.
Een recente studie naar de inzet van zorg of afstand bij patiënten met Inflammatory Bowel Disease (IBD) identificeert vergelijkbare twijfels over het inzetten van zorg op afstand en de behoefte aan persoonlijk contact. In het eerste jaar na diagnose gaven patiënten aan een sterke behoefte te hebben aan persoonlijk contact met arts en verpleegkundige (Van Erp, 2022).
Het ligt voor de hand om met de voorliggende resultaten van het mogelijk gunstige effect van zorg op afstand op dieettrouw, kennis van ziekte en kwaliteit van leven, met patiënten te onderzoeken hoe de balans tussen zorg op afstand en regulier fysiek contact dient te zijn. Het zou kunnen zijn dat investeren in een combinatie van zorg op afstand en face-to-face zorg in de vroege fase van de chronische ziekte meer zelfstandigheid en controle bij de patiënt op lange termijn oplevert, al zal dat niet voor alle patiënten hetzelfde zijn. Aandacht voor individuele competenties en behoeftes bij patiënten en het betrekken van de patiënt bij de keuze voor het inzetten van zorg op afstand zou een meer persoonsgerichte zorg kunnen opleveren. Per fase van het zorgpad kan bekeken worden welke zorgactiviteit op afstand kan plaatsvinden. Een dergelijk uitwerkt zorgpad met daarin de noodzakelijke monitoringsparameters en persoonsgerichte competenties ontbreekt. Wanneer deze bekend is kan gericht gezocht worden naar digitale monitoringssystemen die in deze behoeftes voldoen. Het streven zal zijn naar een platform, gekoppeld of binnen het Elektronisch Patiënten Dossier (EPD), met toegang voor patiënten en zorgverleners, waarin voorlichting, monitoring en onderlinge communicatie en persoonlijk contact geregeld zijn. Dergelijk systeem is momenteel nog niet ontwikkeld.
Bij de inrichting van het zorgpad dient met meerdere factoren rekening te worden gehouden, zoals eventuele comorbiditeiten, de digitale vaardigheden van de zorgverlener en patiënt en beschikbaarheid van middelen. Ook moet er aandacht zijn voor de leeftijd van de patiënt. In de basis zal het zorgpad voor zowel kinderen als volwassenen hetzelfde zijn. Hierbij dient de kanttekening gemaakt te worden, dat bij kinderen zeker in de eerste fase na diagnose, maar ook daarna, de lengtegroei en gewicht en verschillende levensfasen inclusief zelfstandigheid en omgang met de ziekte en het glutenvrij dieet speciale aandacht behoeft. De betrouwbaarheid van thuismetingen voor zorg op afstand zijn niet onderzocht in de literatuur.
Kosten (middelenbeslag)
In de review van Mansson (2022) wordt beschreven dat kostenreductie een vaak genoemd argument is voor het inzetten van zorg op afstand. Resultaten hierover zijn echter tegenstrijdig. De Nederlandse studie van Vriezinga (2018) laat een kleine kostenreductie zien bij het inzetten van videoconsulten (totale kosten €143 voor een online consult versus. €236 voor een fysiek consult). In deze berekening worden de kosten voor het ontwikkelen, en onderhouden van de digitale systemen niet meegenomen. Dit is factor die in andere studies een groot deel van de kosten verklaren. Sterk bewijs voor de daadwerkelijke kosteneffectiviteit, met name op de langere termijn ontbreekt. In een generieke literatuurstudie naar zorg op afstand konden ook geen harde conclusies getrokken worden over de kosteneffectiviteit (verwijzen naar generieke module zorg op afstand - nog in ontwikkeling).
Uit het patiëntenonderzoek van de NCV werd een vermindering van reis- en parkeerkosten door een groot deel van de respondenten benoemd als voordeel van zorg op afstand. Daar staat tegenover dat de patiënt moet beschikken over digitale toepassingen (bijv. een telefoon of laptop). Daarnaast vond een deel van de respondenten dat er kritisch gekeken moet worden naar de kosten en declarabele vergoedingen voor online consulten versus fysiek consulten. Artsenfederatie KNMG heeft afspraken hierover in een handreiking vastgelegd.
Aanvaardbaarheid, haalbaarheid en implementatie
Er is onder zorgverleners die betrokken zijn bij de zorg voor coeliakiepatiënten een uitvraag gedaan naar het gebruik van zorg op afstand en de ervaringen hiermee (n = 107). De respondenten waren o.a. werkzaam als MDL-arts (24.2%), kinderarts (32.7%), diëtist (41.1%) of verpleegkundige (1.8%). Uit dit onderzoek blijkt dat meer dan de helft van de zorgverleners ervaring heeft met het inzetten van zorg op afstand bij coeliakiepatiënten. Tijdens de COVID-19 pandemie is 85% van de respondenten meer zorg op afstand gaan inzetten, waarvan 67.9% aangeeft ook zorg op afstand te willen blijven gebruiken in de dagelijkse werkzaamheden. Vormen van zorg op afstand die veel ingezet worden zijn videoconsulten en telefonische consulten. Ook zijn er zorgverleners die apps, mail of whatsapp inzetten in het contact met patiënten. Het inzetten van zorg op afstand is over het algemeen niet gekoppeld aan een specifiek contact moment. Zo worden telefonische- of videoconsulten ingezet bij het tweede- of derde contactmoment of bij lange termijn follow-up. Ook kunnen patiënten online hun dossiers inzien. Een groot deel van de zorgverleners geeft aan dat zij het eerste contact bij voorkeur fysiek laten plaatsvinden en daarbij benoemd een deel van de zorgverleners expliciet dat de zorg niet geheel op afstand zou moeten plaatsvinden. Minder persoonlijk contact en het ontbreken van non-verbale communicatie worden gezien als nadeel van zorg op afstand. Ook zijn er twijfels over het inzetten van lengte- en of gewicht metingen op afstand en de betrouwbaarheid hiervan. Technische tekortkomingen en beperkte digitale vaardigheden van de patiënt worden door zorgverleners benoemd als belemmeringen van zorg op afstand. De voordelen die de zorgverleners noemen zijn het gemak voor de patiënt, zoals verminderde reistijd, snellere en efficiëntere consulten en meer flexibiliteit wat betreft het inplannen van een afspraak. Een aantal zorgverleners geeft aan dat het uitdagend kan zijn grip te krijgen op de interactie tussen ouders en kind bij consulten op afstand. Het biedt echter ook mogelijkheden om kinderen los van hun ouders te spreken, bijvoorbeeld tijdens schooltijd, waardoor contact laagdrempeliger plaatsvindt. Uit de vragenlijst komt sterk naar voren dat de voorkeur voor de patiënt leidend moet zijn in de keuze voor het inzetten van zorg op afstand. Uit de vragenlijst komt niet naar voren welke effecten van het leveren van zorg op afstand kan hebben op het werkplezier van de zorgverleners.
Een aantal zorgverleners geeft aan op zoek te zijn naar veilige toepassingen die de privacy van zowel de patiënt als zorgverlener waarborgen. Hierover heeft de KNMG een standaard uitgebracht. Naast het waarborgen van de privacy zijn er andere randvoorwaarden waaraan voldaan moet worden voordat zorg op afstand effectief kan worden ingezet. Denk hierbij aan beschikbaarheid van veilige digitale toepassingen, facilitering en ondersteuning de vanuit de zorginstelling en voldoende digitale vaardigheden bij de patiënten zorgverleners. Deze worden beschreven in de generieke module (zie generieke module - in ontwikkeling).
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
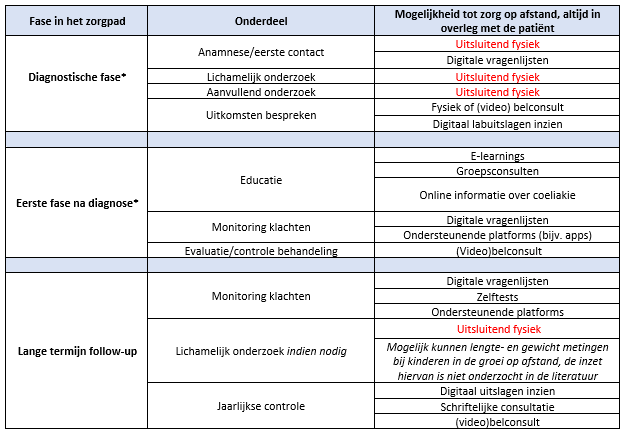
De gevonden literatuur laat geen zwaarwegende negatieve effecten zien van het inzetten van zorg op afstand bij de follow-up zorg voor coeliakiepatiënten. De meeste studies laten zien dat zorg op afstand een goede aanvulling kan zijn op standaard zorg. Deze bevindingen werden ook onderschreven in een studie waarin reguliere consulten werden vervangen door online consulten (Vriezinga, 2018). Uiteraard gelden hier ook beperkingen, zoals geletterdheid, digitale beschikbaarheid en vaardigheden en voorkeuren van patiënten en zorgverleners. Het al dan niet inzetten van zorg op afstand bij de zorg voor coeliakiepatiënten dient altijd overlegd te worden met de patiënt en niet het gehele zorgpad zou op afstand moeten plaatsvinden. Over het inzetten van zorg op afstand bij de diagnose en in de eerste fase na diagnose is geen literatuur beschikbaar. Het inzetten van zorg op afstand in deze fasen kan wel overwogen worden. Met name in de eerste fase diagnose moet er ook voldoende aandacht zijn voor fysieke contactmomenten. De benodigde kennis en ervaring over toepasbaarheid, kwaliteit en kosteneffectiviteit van zorg op afstand dienen samen met patiënten onderzocht te worden alvorens dit breed toe te gaan passen. Hiervoor is een bundeling van krachten essentieel, zodat samen met patiënten zorgpaden gedefinieerd en digitale monitoringssystemen ontwikkeld kunnen worden. Wanneer de patiënt voorkeur geeft aan het (deels) inzetten van zorg op afstand zijn er diverse mogelijkheden, zoals gepresenteerd in Tabel 5:
Tabel 5: Overzicht van de mogelijkheden voor het inzetten van zorg op afstand bij de zorg voor coeliakiepatiënten per fase van het zorgpad (na overleg met de patiënt)
*de inzet van zorg op afstand in deze fase van het zorgpad is niet onderzocht in de literatuur
Onderbouwing
Achtergrond
Coeliakie is een chronische aandoening waarbij patiënten, na het stellen van de diagnose, levenslang enige vorm van zorg nodig hebben. Het gebruik van verschillende zorg op afstand modaliteiten voor onder andere de begeleiding en monitoring van patiënten ligt voor de hand. Dit is ook een onderdeel van het Integraal Zorg Akkoord (IZA): daar waar het kan zorg op afstand leveren en daar waar het moet zorg fysiek leveren. Daarbij heeft de COVID-19 pandemie het zorgsysteem voor een aantal onverwachte uitdagingen gesteld, waaronder een snelle aanpassing naar het aanbieden van zorg op afstand. Deze aanpassing heeft geleid tot een toename in het aantal toepassingen van zorg op afstand, ook voor coeliakiepatiënten (Mansson, 2022). Het is onbekend of het inzetten van zorg op afstand binnen de zorg voor patiënten met coeliakie vergelijkbare effectiviteit en veiligheid heeft als reguliere fysieke zorg. Het uitgangspunt is hierbij dat zorg of afstand niet leidt slechtere uitkomsten, dus minstens even goed is als reguliere fysieke zorg.
Onder ‘Zorg op afstand’ verstaan we alle zorgactiviteiten tussen patiënt en zorgprofessionals die op afstand worden gegeven, dit gaat zowel om digitale zorg als bel- en/of teleconsulten. Deze ‘afstand’ duidt dus op het ontvangen van de zorgactiviteit terwijl zorgprofessional en patiënt zich niet in eenzelfde fysieke ruimte bevinden. Dit kan door de patiënt juist ervaren worden als ‘zorg dichtbij (huis)’. Deze zorgactiviteiten kunnen synchroon zijn (patiënt en zorgprofessional hebben gelijktijdig contact, bijv. in een videoconsult), ofwel asynchroon (zorgvraag en respons zijn niet gelijktijdig, bijv. online een vraag indienen die later door de zorgprofessional wordt behandeld).
Conclusies / Summary of Findings
|
Moderate GRADE |
Gluten free dietary adherence
Remote care likely has an at least similar effect to regular care on gluten free dietary adherence in the follow-up of patients with celiac disease.
Source: Mansson 2022 (Sainsbury, 2013; Dowd, 2020; Nikniaz, 2021; Haas 2017; Vriezinga 2018) |
|
Low GRADE |
Knowledge on gluten free diet and celiac disease
Remote care may have an at least similar effect to regular care on knowledge of gluten free disease and diet in the follow-up of patients with celiac disease.
Source: Mansson 2022 (Meyer, 2003; Nikniaz, 2021; Sainsbury, 2013) |
|
Moderate GRADE |
Quality of life
Remote care likely has an at least similar effect to regular care on quality of life in the follow-up of patients with celiac disease.
Source: Mansson 2022 (Dowd, 2020; Haas, 2017; Sainsbury, 2013; Vriezinga 2018) |
Samenvatting literatuur
Description of studies
In the systematic review of Mansson (2022) literature on the utilization and effectiveness of e-health in the management of patients with Celiac Disease (CD) was systematically reviewed. A literature search was conducted in the databases PubMed, Scopus, Cochrane Library, and Database of Abstracts of Reviews of Effectiveness for relevant articles published until February 2021. Studies of any design on the use of eHealth technologies in the follow-up of CD patients were selected. No age restrictions were used. Non-English studies and studies on telephone consultations, or non-interactive educational websites as primary e-health method were excluded. In total, eight studies were included in the review of which six were considered relevant for the purpose of this guideline (Dowd, 2020; Haas, 2017; Meyer, 2020; Nikniaz, 2019; Sainsbury, 2013; Vriezinga, 2018). The studies that were not considered relevant were both observational studies and were therefore excluded (Connan, 2019; Lasa, 2019). A description of the study population and interventions that were evaluated in the six included studies is presented in Table 1. In two studies, the study population consisted of children and/or adolescents (<25 years) with CD, in the other studies adults were included. Remote care interventions that were studied included smartphone interventions, web-based interventions, and online consultations. In all studies, the remote care interventions were compared to a control condition, mostly face-to-face care, or a wait-list condition (regular care). In five of the included studies, remote care interventions were used additional to the regular care that the patients received. In the trial from Vriezinga (2018), in-office consultations were replaced by online consultations. Five studies reported the outcome gluten-free diet (GFD) adherence. Three studies reported the outcome knowledge, and the outcome quality of life (QoL) was reported in four studies. Both outcome measures were measured with varying questionnaires. The lack of an exclusion table could introduce some bias regarding the systematic review in general. For all the individual studies, there were some concerns regarding the risk of bias, mostly arising from the randomization procedures and measurement of the outcome.
Table 1: overview of the study population and interventions that were evaluated in relevant RCTs included in Mansson (2022)
CD = celiac disease, GFD = gluten-free diet, HRQOL = health-related quality of life
|
|
Population |
Intervention |
Control |
|
Dowd (2020) |
Adults (>18 years) with CD of ‘gluten intolerance’ n = 115 |
MyHealthyGut app, additional to regular care; educational content about CD and gut health, (dietary) tips, recipes, diet and corresponding symptom-tracking functionality and the possibility to share with health care providers. |
Usual care |
|
Haas (2017) |
Adolescents (aged 12-24 years) with ≥ one year CD n = 61 |
TEACH intervention, additional to regular care; automated text messages 2/3 times per week with gluten free diet information, tips, websites, reminders |
Usual care |
|
Meyer (2003) |
Patients with CD (age not reported) n = 64 |
CBITP intervention, additional to regular care; computer-based interactive training program providing information and training in interactive exercises concerning GFD adherence |
Standard of care (conventional training) |
|
Nikniaz (2019) |
Adults (> 18 years) with CD for > 6 months, n = 60 |
“celiac application” app, additional to regular care; Designed for providing different information regarding celiac disease and GFD (in Persian language) |
Weekly routine education with help of leaflets in the clinic |
|
Sainsbury (2013) |
Adults (>16 years) with CD n = 189 |
Bread n’ Butter… Gluten Free of Course! Modules; additional to regular care; Six weekly online modules which included a combination of education, validated behavior change techniques, and strategies to treat anxiety and depression and improve coping behavior. |
Usual care |
|
Vriezinga (2018) |
Adolescents (<25 years) with CD for > 1 year n = 304 |
Online consultation, instead of an in-office consultation including symptom questionnaires, GFD questionnaires and CD-specific HRQOL, instructions to measure height and weight, and validated point-of-care test which should be sent by email. |
In-office consultation |
Results
Gluten-free dietary adherence
Five studies in the review from Mansson (2022) reported the effects of remote care interventions on GFD adherence (Sainsbury, 2013; Dowd, 2020; Nikniaz, 2021; Haas, 2017; Vriezinga, 2018). In four studies, the Celiac Dietary Adherence Test (CDAT) was used to measure GFD adherence (Sainsbury, 2013; Dowd, 2020; Nikniaz, 2021; Haas, 2017). The total scores on this test vary from a minimum score of 7 to a maximum of 35, with lower scores indicating a stricter adherence to a GFD. Due to heterogeneity in reporting, pooling was not possible. Dowd (2020), Haas (2017) and Nikniaz (2021) reported slightly lower scores (mean/median) for the CD patients receiving remote care, when compared to face-to-face care, indicating stricter adherence to a GFD. Also, in Sainsbury (2013) a small to moderate effect, favoring remote care was reported (Table 2). While it was not possible to determine whether the differences were clinically relevant, remote care appears to have at least a similar effect on GFD adherence as face-to-face care.
Vriezinga (2018) used a Dutch adaptation of a validated questionnaire to calculate the proportion of patients classified to have a ‘strict adherence’. Of the patients receiving remote care, 142/156 (91%) had strict adherence scores, compared to 128/148 (87%) of the patients in the control condition. The Risk Ratio (RR) was 1.05 (95% CI: 0.97 to 1.14), favoring remote care.
Table 2: results of the studies reporting the effect of remote care on gluten free dietary adherence
CDAT = Celiac Dietary Adherence Test, SD = standard deviation, MD = mean difference, IQR = interquartile range, CI = confidence interval
|
|
Measure |
Intervention |
Control |
Difference |
|
Dowd (2020) |
Post-intervention score, CDAT |
Mean ± SD 13.96 ± 5.03 |
Mean ± SD 14.78 ± 2.97 |
MD (95% CI) -0.82 (-2.32 to 0.68) |
|
Haas (2017) |
Post-intervention score, CDAT |
Median (IQR) 10 (8.3 to 12.8) |
Median (IQR) 11 (8 to 13) |
p-value: 0.16 |
|
Nikniaz (2021) |
Post-intervention score, CDAT |
Mean 13 |
Mean 15.88 |
p-value: 0.01 |
|
Sainsbury (2013) |
“Adherence scores” (t-scores, p-values and cohen’s d), CDAT |
“The intervention group had improved adherence scores from baseline to post” |
“The waitlist control group’s score remained unchanged” |
Cohen’s d: 0.35 (small-to-medium effect) |
|
Vriezinga (2018) |
Proportion of patients with ‘strict adherence scores’ |
142/156 (91%) |
128/148 (87%) |
RR (95% CI) 1.05 (0.97 to 1.14) |
Knowledge about celiac disease and gluten-free diet
Three studies in the review from Mansson (2022) reported the effects of remote care intervention on knowledge about CD and gluten-free diet (Meyer, 2003; Nikniaz, 2021; Sainsbury, 2013). In these studies, different questionnaires were used. For all questionnaires that were used applies that higher scores indicate greater knowledge. Due to heterogeneity in reporting, the results could not be pooled. Two studies reported higher knowledge scores for the patients receiving remote care, compared to the patients receiving face-to-face care (Meyer, 2003; Sainsbury, 2013). In the study of Nikniaz (2021) contradicting results were reported. Knowledge on disease and diet appeared to be slightly higher in patients receiving face-to-face care, while knowledge on gluten free foods appeared to be higher for the patients receiving remote care (Table 3). While it was not possible to determine whether the differences were clinically relevant, remote care appears to have at least a similar effect on knowledge as face-to-face care.
Table 3: results of the studies reporting the effect of remote care on knowledge about celiac disease and gluten-free diet.
SD = standard deviation, MD = mean difference, CI = confidence interval
|
|
Measure |
Intervention |
Control |
Difference |
|
Meyer (2003) |
Self-developed questionnaires: 1) theoretical knowledge 2) food selection 3) situation questionnaire |
Mean points 1) 11.7 2) 24.9 3) not reported |
Mean points 1) 11.1 2) 23.9 3) not reported
|
Points * 1) 0.6 2) 1.0 3) 1.25 *MD can’t be assessed since SD’s were not reported. |
|
Nikniaz (2021) |
Self-developed questionnaires: 1) disease and diet (0-14) 2) gluten-free foods (0-31) |
Mean ± SD 1) 12.48 ± 1.12 2) 26.44 ± 3.27 |
Mean ± SD 1) 13.68 ± 0.60 2) 25.22 ± 2.70
|
MD (95% CI) 1) -1.20 (-1.65, to -0.75) 2) 1.22 (-0.30, to 2.74)
|
|
Sainsbury (2013) |
14 ingredient lists: post-intervention scores |
Mean ± SD 84.09 ± 12.53 |
Mean ± SD 80.68 ±13.62 |
MD (95% CI) 3.41 (-0.34 to 7.16) |
Quality of life
Four studies in the review from Mansson (2022) reported the effects of remote care interventions for CD on QoL (Dowd, 2020; Haas, 2017; Sainsbury, 2013; Vriezinga, 2018). Different questionnaires were used to assess QoL. Due to heterogeneity in reporting, the results could not be pooled. Three studies reported better questionnaire scores for the patients receiving remote care when compared with patients receiving face-to-face care (Dowd, 2020; Sainsbury, 2013; Vriezinga, 2018). In the study of Haas (2017) two different questionnaires were used. For a questionnaire on mental health, comparable scores were found for the patients receiving remote care and the patients receiving face-to-face care. For a physical health questionnaire, better scores were found for the patients receiving remote care when compared to the patients receiving face-to-face care (Table 4). While it was not possible to determine whether the differences were clinically relevant, remote care appears to have at least a similar effect on QoL as face-to-face care.
Table 4: results of the studies reporting the effect of remote care on quality of life
CD = Celiac Disease SD = standard deviation, MD = mean difference, IQR = interquartile range, QoL = Quality of Life, HRQoL = health related quality of life, CI = confidence interval
|
|
Measure |
Intervention |
Control |
Difference |
|
Dowd (2020) |
CD-specific QoL – post-intervention score |
Mean ± SD 62.48 ± 25.87 |
Mean ± SD 47.56 ± 22.17 |
MD (95% CI) 14.92 (6.13 to 23.71) |
|
Haas (2017)
|
NIH PROMIS 1) global mental health 2) global physical health Post-intervention scores |
Median (IQR) 1) 53.3 (IQR: 48.3 to 57.7) 2) 57.7 (IQR: 48.5 to 57.7) |
Median (IQR) 1) 53.3 (IQR: 45.8 to 58.3) 2) 52.5 (IQR: 48.5 to 60.9) |
Can’t be assessed due to reporting of median values |
|
Sainsbury (2013) |
WHO QoL BREF 1) physical QoL 2) psychological QoL Post-intervention scores; median (IQR) |
“Significant positive time effects were observed for physical QoL (F= 4.43, P = 0.037), and psychological QoL (F = 28.95, P < 0.001)” |
|
|
|
Vriezinga (2018) |
CD-specific HRQoL CDDUX questionnaire / 5 point Likert Scale (1 = very good, 5 = very bad) |
Mean (min-max) 3.16 (1.25 to 4.83) |
Mean (min-max) 3.23 (1.33 to 4.50) |
Mean difference -0.07 *lower scores indicating better QoL |
Level of evidence of the literature
The level of evidence regarding the outcome measure GFD adherence was retrieved from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level because of study limitations including limitation in blinding and randomization procedures (-1 risk of bias). The final level of evidence was graded ‘moderate’.
The level of evidence regarding the outcome measure knowledge on gluten free diet and celiac disease was retrieved from randomized controlled trials and therefore started high. The level of evidence was downgraded by two levels because of study limitations including limitation in blinding and randomization procedures (-1 risk of bias) and heterogeneity in the results (-1 inconsistency). The final level of evidence was graded ‘low’.
The level of evidence regarding the outcome measure quality of life was retrieved from randomized controlled trials and therefore started high. The level of evidence was downgraded by one level because of study limitations including limitation in blinding and randomization procedures (-1 risk of bias). The final level of evidence was graded ‘moderate’.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What is the potential role of e-healthcare in the follow-up of patients with celiac disease
(CD), including its usage in facilitating adherence to the gluten-free diet (GFD)?
P: Individuals of all ages with a CD diagnosis made according to established diagnostic criteria.
I: Any type of e-healthcare intervention (i.e., a digital intervention) used in the follow-up of patients with CD, possibly aiming to increase the knowledge of disease and diet, disease control, quality of life (QoL) and self-care among patients with CD.
C: Regular care (face-to-face)
O: GFD adherence, knowledge, QoL
This question and the PICO were adapted from the research question and PICO used in the review by Mansson (2022), which was used as a basis for this guideline module.
Relevant outcome measures
The guideline development group considered GFD adherence as a critical outcome measure for decision making; and knowledge and QoL an important outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
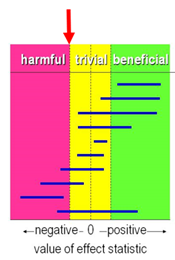
The guideline development group used the GRADE default limits as limits of clinical decision making (RR <0.80; RR > 1.25) for minimal clinically (patient) important difference. Since the objective was to determine whether remote care was at least as effective as face-to-face care, we did not compare the results against the threshold of ‘no effect’, but we compared towards the threshold of a ‘harmful effect’ (Figure 1). This means that we judged whether remote care performed at least similar to, or better than face-to-face care.
Figure 1: visual representation of the values of clinical decision making for any ‘harmful’.
Search and select (Methods)
The review of Mansson (2022) was used as a basis to answer this research question.
In this review, the databases PubMed, Scopus, Cochrane Library and Database of Abstracts of Reviews of Effectiveness were searched with relevant search terms until February 2021.
The systematic literature search resulted in 1320 hits (after excluding duplicates: 926 hits). Studies were selected based on the following criteria: studies of any design, describing any type of E-healthcare intervention (i.e., a digital intervention) used in the follow-up of patients with CD, possibly aiming to increase the knowledge, disease control, QoL and self-care among patients with CD in individuals of all ages with a CD diagnosis. Studies merely describing non-interactive webpages with an informational intention, or studies on telephone consultations were excluded. Twenty-six studies were initially selected based on title and abstract screening. After reading the full text, eighteen studies were excluded (see the table with reasons for exclusion under the tab Methods), and eight studies were included.
An update of this search was performed on the 13th of January 2023. The databases Embase and Ovid/Medline were searched for relevant articles published between this date and February 2021.The detailed search strategy is depicted under the tab ‘methods’. The update of the systematic literature search resulted in 85 hits. Studies were selected based on the aforementioned criteria and study design; only systematic reviews and RCTs were selected. Fifteen studies were initially selected based on title and abstract screening. After reading the full text, all fifteen studies were excluded (see the table with reasons for exclusion under the tab Methods) and no extra studies were included.
Results
One systematic review (including eight studies) was included in the analysis of the literature. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the table X.
Referenties
- Costa AF, Sugai E, Temprano MP, Niveloni SI, Vázquez H, Moreno ML, Domínguez-Flores MR, Muñoz-Suano A, Smecuol E, Stefanolo JP, González AF, Cebolla-Ramirez A, Mauriño E, Verdú EF, Bai JC. Gluten immunogenic peptide excretion detects dietary transgressions in treated celiac disease patients. World J Gastroenterol. 2019 Mar 21;25(11):1409-1420. doi: 10.3748/wjg.v25.i11.1409. PMID: 30918433; PMCID: PMC6429344.
- Månsson AL, Meijer-Boekel C, Mårild K. Utilization and Effectiveness of eHealth Technology in the Follow-up of Celiac Disease: A Systematic Review. J Pediatr Gastroenterol Nutr. 2022 Jun 1;74(6):812-818. doi: 10.1097/MPG.0000000000003423. Epub 2022 Feb 24. PMID: 35849504.
- Van Erp LW, Neijenhuis MK, Heida W, Derwig J, Geleijns CE, Groenen MJM, Wahab PJ. Improving Care for Recently Diagnosed Inflammatory Bowel Disease Patients: Lessons Learned From a Patient-Centred, Mixed-Method Study. J Crohns Colitis. 2022 Jun 24;16(5):737-745. doi: 10.1093/ecco-jcc/jjab196. PMID: 34758088.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Mansson 2022
Study characteristics and results are extracted from the SR (unless stated otherwise; indicated with *) |
SR and meta-analysis of RCTs and observational studies; only RCT’s were considered relevant
Literature search up to February 2021
A: Dowd, 2020 B: Haas, 2017 C: Meyer, 2003 D: Nikniaz, 2021 E: Sainsbury, 2013 F: Vriezinga, 2018
Study design: RCT
Setting and Country: A: Recruitment via Canadian Celiac Association, Canada "B: Recruitment via Stanford Children’s Health network, Children's hospital Hospital, USA" C: Recruitment via German Celiac Society, Germany D: Single-centre , Iran E: Recruitment via Celiac Society of South Wales Australia, Australia F: Multicentre, Netherlands
Source of funding and conflicts of interest: A: No financial conflict, first author is founder of the intervention B: None C: No information D: None E: None F: None
Of systematic review: none |
Inclusion criteria SR: -studies on e-health technologies used in CD care
Exclusion criteria SR: - studies on telephone consultations and non-interactive educational websites
Eight studies included, of which six were considered relevant.
Important patient characteristics at baseline:
N (total) A: 115 B: 61 C: 64 D: 60 E: 189 F: 304
Mean age: A: 42.72 (13.39) B: i: 15.8 ± 2.4 / c: 16.4 ± 3.4 C: no information D: 37.29 (9.71) E: 46.5 (14.7) F: i: 11.0/C: 11.4
% Male A: i: 7 / c: 2 B: i: 48 / c: 13 C: total: 33 D: i: 26.7 / c: 36.66 E: 12.7% F: i: 31.4 / c: 34.5
Groups comparable at baseline? A: Probably yes B: Probably yes C: Probably yes D: Probably yes E: Probably yes F: Probably yes |
Describe intervention:
A: MyHealthyGut app (smartphone application) B: TEACH (automated text-messaging intervention) C: CBITP; computer-based interactive training program D: “celiac application” smartphone app in Persian language) E: Bread n’ Butter… Gluten Free of Course! Online modules F: Online consultation |
Describe control:
A: wait-list control B: standard care C: standard care (conventional training) D: weekly routine education E: wait-list control F: in-office consultation |
End-point of follow-up:
A:1 month B:3 months C:3 weeks D:3 months E:3 months F:6 months
For how many participants were no complete outcome data available? A: i: 76% / c: 24% B: i: 3% / c: - C: no information D: i: - / c: 3.33% E: i: 30.7% / c: 27.3% F: +i: 2.4% / c: 3.6%
|
Outcome measure-1: gluten free dietary adherence
A: post-intervention, mean (se) i: 13.96 (0.65) c: 14.78 (0.40) B: post-intervention, median (IQR) i: 10 (IQR: 8.3 to 12.8) c: 11 (IQR: 8 to 13) D: post-intervention scores, mean sd not reported]) i: 13 c: 15.88 E: Cohen’s d: 0.35 (small-to-medium effect) F: proportion of patients with a ‘strict’ score i: 142/156 (91%) c: 128/148 (87%) –
Outcome measure-2: knowledge C: self-developed questionnaire Theoretical knowledge: i: 11.7. / c: 11.1 Food selection: i: 24.9 / c: 23.9 Situation questionnaire: difference: + 1.25
D: self-developed questionnaire Disease and diet (0-14): i: 12.48 ± 1.12 / c: 13.68 ± 0.60 MD: -1.20 (-1.65, to -0.75) Gluten-free foods (0-31): i: 26.44 ± 3.27 / c:25.22 ± 2.70 MD: 1.22 (-0.30, to 2.74)
E: 14-ingredient list i: 84.09 ± 12.53 / c: 80.68 ±13.62 MD: MD: 3.41 (95% CI:-0.34 to 7.16)
Quality of life A: disease-specific mean ± sd i: 62.48 ± 25.87 / c:47.56 ± 22.17 MD: 14.92 (95% CI: 6.13 to 23.71)
B: NIH PROMIS median (IQR) 1) global mental health I: 53.3 (IQR: 48.3 to 57.7) C: 57.7 (IQR: 48.5 to 57.7) 2) global physical health I: 53.3 (IQR: 45.8 to 58.3) C: 52.5 (IQR: 48.5 to 60.9)
F: disease-specific mean (min – max) I: 3.16 (1.25 to 4.83) / c: 3.23 (1.33 to 4.50)
|
Risk of Bias for individual studies: A: Some concerns B: Some concerns C: High D: Some concerns E: Some concerns F: Some concerns
|
Risk of Bias table
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Mansson 2022 |
Yes |
Yes |
No; exclusion table is missing |
Yes |
Not applicable |
Yes; Cochrane risk of bias |
Not applicable |
No |
No, not for included studies |
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Table of excluded studies
|
Reference |
Reason for exclusion |
|
Muhammad H, Reeves S, Ishaq S, Mayberry JF, Jeanes YM. Telephone clinic improves gluten-free dietary adherence in adults with coeliac disease: sustained at 6 months. Frontline Gastroenterol. 2020 Oct 27;12(7):586-592. doi: 10.1136/flgastro-2020-101643. PMID: 34917316; PMCID: PMC8640392. |
No randomisation |
|
Nikniaz Z, Namvar ZA, Shirmohammadi M, Maserat E. Smartphone Application for Celiac Patients: Assessing Its Effect on Gastrointestinal Symptoms in a Randomized Controlled Clinical Trial. Int J Telemed Appl. 2022 Jul 8;2022:8027532. doi: 10.1155/2022/8027532. PMID: 35846977; PMCID: PMC9286948. |
Wrong outcome; gastrointestinal symptoms |
|
Gianfrancesco C, Taylor C, Croot L. Self-completed online dietary recalls as an alternative method of dietary assessment for dietetic outpatient appointments: A feasibility study. J Hum Nutr Diet. 2023 Feb;36(1):126-138. doi: 10.1111/jhn.13047. Epub 2022 Jul 14. PMID: 35689467; PMCID: PMC10084435. |
Feasibility study |
|
Fung BM, Markarian E, Serper M, Tabibian JH. Current Applications of Telemedicine in Gastroenterology. Am J Gastroenterol. 2022 Jul 1;117(7):1072-1079. doi: 10.14309/ajg.0000000000001761. Epub 2022 Apr 1. PMID: 35385404. |
Narrative review |
|
Muhammad H, Reeves S, Ishaq S, Jeanes Y. Experiences of Outpatient Clinics and Opinions of Telehealth by Caucasian and South Asian Patients' With Celiac Disease. J Patient Exp. 2021 May 19;8:23743735211018083. doi: 10.1177/23743735211018083. PMID: 34179445; PMCID: PMC8205329. |
Wrong outcome; patient’ experiences |
|
Costantino A, Roncoroni L, Noviello D, Nandi N, Lombardo V, Scricciolo A, Scaramella L, Vecchi M, Elli L. Nutritional and Gastroenterological Monitoring of Patients With Celiac Disease During COVID-19 Pandemic: The Emerging Role of Telemedicine and Point-of-Care Gluten Detection Tests. Front Nutr. 2021 Apr 13;8:622514. doi: 10.3389/fnut.2021.622514. PMID: 33928109; PMCID: PMC8076748. |
No comparative study |
|
Jaime C, Samuel L, Fera J, Basch CH. Discussing health while seeking community: A descriptive study of celiac disease on TikTok. Nutr Health. 2023 Mar;29(1):37-41. doi: 10.1177/02601060221127505. Epub 2022 Sep 23. PMID: 36148909. |
Wrong outcome; content of videos |
|
Meyer S, Naveh G. Mobile Application for Promoting Gluten-Free Diet Self-Management in Adolescents with Celiac Disease: Proof-of-Concept Study. Nutrients. 2021 Apr 21;13(5):1401. doi: 10.3390/nu13051401. PMID: 33919430; PMCID: PMC8143340. |
Description of an application. |
|
Shamsabadi A, Pashaei Z, Karimi A, Mirzapour P, Qaderi K, Marhamati M, Barzegary A, Fakhfouri A, Mehraeen E, SeyedAlinaghi S, Dadras O. Internet of things in the management of chronic diseases during the COVID-19 pandemic: A systematic review. Health Sci Rep. 2022 Mar 14;5(2):e557. doi: 10.1002/hsr2.557. PMID: 35308419; PMCID: PMC8919365. |
Wrong population; chronic diseases |
|
Costantino A, Bortoluzzi F, Giuffrè M, Vassallo R, Montalbano LM, Monica F, Canova D, Checchin D, Fedeli P, Marmo R, Elli L. Correct use of telemedicine in gastroenterology, hepatology, and endoscopy during and after the COVID-19 pandemic: Recommendations from the Italian association of hospital gastroenterologists and endoscopists (AIGO). Dig Liver Dis. 2021 Oct;53(10):1221-1227. doi: 10.1016/j.dld.2021.06.032. Epub 2021 Jul 24. PMID: 34312103. |
Wrong population; gastro-intestinal patients |
|
Ciacci C, Gagliardi M, Siniscalchi M, Ruotolo M, Santonicola A, Hajji N, Zingone F. Gluten Immunogenic Peptides (GIP) Point-of-Care Urine Test in Coeliac Disease Follow-up before and during the COVID-19 Lockdown in Italy. Clin Exp Gastroenterol. 2021 Nov 16;14:451-456. doi: 10.2147/CEG.S326137. PMID: 34815686; PMCID: PMC8605791. |
No comparison with patients receiving usual care |
|
Meyer S. Promoting Effective Self-Management of the Gluten-Free Diet: Children's and Adolescents' Self-Generated Do's and Don'ts. Int J Environ Res Public Health. 2022 Oct 28;19(21):14051. doi: 10.3390/ijerph192114051. PMID: 36360929; PMCID: PMC9655541. |
Wrong outcome; self-management techniques |
|
Buseck A, Lebwohl B, Green PHR. Quality and Content of Online Patient Resources for Celiac Disease. Dig Dis Sci. 2021 Jul;66(7):2209-2215. doi: 10.1007/s10620-020-06537-3. Epub 2020 Aug 20. PMID: 32816213. |
Wrong outcome; quality of websites |
|
Rohde JA, Barker JO, Noar SM. Impact of eHealth technologies on patient outcomes: a meta-analysis of chronic gastrointestinal illness interventions. Transl Behav Med. 2021 Feb 11;11(1):1-10. doi: 10.1093/tbm/ibz166. PMID: 31731292. |
Wrong population; gastrointestinal patients |
|
Tyler CV, Wells MD. A Community-Health System Intervention to Improve the Primary Healthcare of Adults With Down Syndrome Through Electronic Consultations. Intellect Dev Disabil. 2021 Jun 1;59(3):256-264. doi: 10.1352/1934-9556-59.3.256. PMID: 34030182. |
Wrong population; patients with down syndrome |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 08-12-2023
Beoordeeld op geldigheid : 09-10-2023
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit ZonMW. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2023 de multidisciplinaire werkgroep van de eerdere richtlijnontwikkeling bijeengekomen, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met Coeliakie en glutengerelateerde aandoeningen.
Werkgroep
- Dr. P. Wahab, MDL-arts in Rijnstate Ziekenhuis Arnhem, NVMDL
- Dr. M.M.S. Wessels, kinderarts-MDL in Rijnstate Ziekenhuis Arnhem, NVK
- Prof. Dr. C.J.J. Mulder, MDL-arts in Amsterdam UMC, NVMDL
- Dr. T. van Gils, AIOS-MDL in Amsterdam UMC, NVMDL
- Prof. Dr. G. Bouma, MDL-arts in Amsterdam UMC, locatie VUmc, NVMDL
- Prof. Dr. M.L. Mearin-Manrique, kinderarts-MDL in LUMC, NVK
- Drs. C.R. Meijer-Boekel, kinderarts-MDL in LUMC, NVK
- G. Herweijer, MSc, diëtist in ‘Voeding + Advies’, ervaringsdeskundige, NCV
- F.W.P.C. van Overveld, MSc, directeur NCV
- Prof. Dr. J.W.M. Muris, huisarts, Universiteit Maastricht, NHG
- Drs. M. Beukema, internist-intensivist in Streekziekenhuis Koningin Beatrix, NIV
- L.J. Bosch, MSc, diëtist en eigenaar bij ‘Voeding voor jou,’ NVD
- Drs. S. Neve, dermatoloog in Dijklander Ziekenhuis, NVDV
- Prof. Dr. B. Horváth, dermatoloog in UMC Groningen, NVDV
Meelezers
- Drs. E.A. Neefjes - Borst, patholoog in Amsterdam UMC, NVVP
- Dr. H.J. Bontkes, laboratorium specialist medische Immunologie, Amsterdam UMC, NVVI
Met ondersteuning van:
- Dr. J.F. de Groot, senior adviseur, Kennisinstituut van Medisch Specialisten
- Drs. D.G. Ossendrijver, junior adviseur, Kennisinstituut van Medisch Specialisten
- Drs. I. van Dusseldorp, senior literatuurspecialist, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bouma |
MDL arts, Amsterdam UMC, hoogleraar inflammatoire aandoeningenvan de tractus digestivus Directeur research instituut Amsterdam Gastroenterology, Endocrinology and Metabolism, AMsterdam UMC Plaatsvervangend opleider MDL, AMsterdam UMC, locatie Vumc |
Nationale en internationale bestuurs- en werkgroepfucties: Voorzitter Stichting Gastrostart NVGE 2019-2022 (onbetaald) Voorzitter landelijke Werkgroep Autoimmuun Hepatitis 2017-2022 (onbetaald) Lid van het Scientific Committee, dr. Schär Nutrition (onbetaald) Lid van de wetenschappelijke adviesraad van de Nederlandse Coeliakie Vereniging (onbetaald) National representative in de Council van de United European Gastroenterology, 2013-2015 (onbetaald) Lid van de wetenschappelijke adviesraad van de Maag Lever Darmstichting (onbetaald)
Adviesraden: 2019 Advisory Board Takeda International (eenmalig, betaald) 2019 Nascholing IBD, financieel mogelijk gemaakt door Takeda (eenmalig, betaald) 2019 Advisory Board Roche International (eenmalig, betaald) 2020 Advisory Board Calypso Biotech (eenmalig, onbetaald) 2021 Advisory Board Alimentiv (eenmalig, onbetaald) 2022 Nascholing IBD, financieel mogelijk gemaakt door Janssen Pharmaceuticals (eenmalig, betaald) - Clinical trials op het gebied van coeliakie: S.I. Cellimmune-AMGEN clinical trial (NCT02633020) P.I. Provention clinical trial (NCT04424927) P.I. Calypso clinical trial (NCT04593251) P.I. Tofacitinib for refractory celiac disease (Eudract 2018-001678-10)
Daarnaast P.I. en S.I. op diverse klinische trials op het gebied van IBD (contract research); PI op investigator initiated studies op het gebied van IBD, autoimmuun hepatitis en coeliakie. |
Zie onder nevenwerkzaamheden: Financier: MLDS, inh onderzoek: onderzoek naar de lymfoomontwikkeling bij coeliakie, rol als PL: ja inh: onderzoek naar de verbetering van diagnostiek van coeliakie. Rol PL: nee. Inh: MLDS. Onderzoek naar de rol van MTX bij IBD. Rol PL: ja. MLDS: inh: onderzoek naar voorspellers van exacerbatie van IBD. Rol PL: nee. KWF/coeliakievereniging PFizer (in kind). Inh: Rol van tofacitinib in de behandeling van refractarie coeliakie. Rol PL: nee |
Geen |
|
Wahab* |
MDL arts, Rijnstate Ziekenhuis Rijstate |
Lid ZonMw commissie EEK; vacatiegeld Lid Regionaal Tuchtcollege Zwolle; vacatiegeld; Lid wetenschappelijke advies raad Nederlandse Coeliakie Vereniging, onbetaald |
Geen |
Geen |
|
Mearin-Manrique |
Kinderarts-MDL, afdeling Kindergeneeskunde Leids Universitair Mediach Centrum (LUMC) |
Lid Medisch Advies Raad Ned. Coeliakie Vereniging: onbetaald Lid Public Affair Committee European Society Pediatric Gastroenterology Hepatology and Nutrition (ESPGHAN): onbetaald Secretaris werkgroep Coeliakie ESPGHAN:onbetaald |
Financier: Thermo Fisher. Inh onderz: PreventCD (Prevention of Coeliac Disease) Rol PL: ja Fin: BioHit. Inh onderzoek: GLUTENSCREEN (Early detection of coeliac disease). Rol PL: ja |
Geen |
|
Van Gils |
(AIOS) maag-, darm- en leverziekten in het Amsterdam UMC. |
Geen |
Geen |
Geen |
|
Mulder |
Werkgroep HEG Stoolbanking 2018 -2020 (onbetaald) Consultant HLW voor Thiosix 2018 - 2020 4-8 uur per week Begeleider 4 Promovendi VU 2019 - 2020 (onbetaald) MCV de Veluwe 2 dagen poli/endoscopiie/week (betaald) |
Geen |
Geen |
Geen |
|
Wessels* |
Kinderarts MDL – Rijnstate Ziekenhuis Arnhem |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging - onbetaald |
Geen |
Geen |
|
Meijer |
Kinderarts MDL-LUMC 0,8 FTE lid Special Interest Group (SIG) ESPGHANon celiac disease |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging ‐ onbetaald |
Geen |
Geen |
|
Muris |
Hoofd vakgroep Huisartsgeneeskunde, Universiteit Maastricht |
Huisarts in Geulle, vergoeding |
Geen |
Geen |
|
Neefjes-Borst |
Patholoog, Amsterdam UMC |
Onbetaald: werkgroep protocollen van PALGA |
Geen |
Geen |
|
Bontkes |
Laboratorium specialist Medische Immunologie en hoofd laboratorium medische immunologie van het AmsterdamUMC, locatie VUmc |
Bestuurslid van de SKML sectie humorale immunologie (onbetaald) Coördinator SKML rondzending "coeliakie" (onbetaald, onkostenvergoeding voor het laboratorium). Lid van de Nederlandse sectie van het European Autoimmunity Standardisation Initiative (EASI) (onbetaald) |
Geen |
Geen |
|
Beukema |
lnternist-intensivist/acute geneeskunde, Santiz Streekziekenhuis Koningin Beatrix Winterswijk |
Adviescommissie GE (NIV) |
Geen |
Geen |
|
Horváth |
Dermatoloog, Afdelingshoofd Afdeling Dermatologie, Centrum voor Blaarziekten Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen |
|
Neve |
Dermatoloog bij Dijklanderziekenhuis te Hoorn voor 0,65 FTE |
Visiteur kwaliteitscommissie NVDV. Onkostenvergoeding Leo Pharma dermatologie adviesraad |
Geen |
Geen |
|
Holtackers |
GZ-psycholoog, kindergeneeskunde, St. Antonius Ziekenhuis (24 uur) medische psychologie; GZ-psycholoog, kinder- & jeugd & volwassenen, GGZ eigen praktijk (Psychologiepraktijk Samenspel Utrecht) |
Lesgeven (sociale vaardigheidstraining) aan beroepskrachten Rino Utrecht (aantal cursusdagen per jaar), betaald |
Geen |
Geen |
|
Bosch |
Diëtist en eigenaar bij 'Voeding voor jou' |
Op social media en online ben ik bekend als de glutenvrije diëtist en verkoop ik online programma’s om zelfverzekerd en gezond glutenvrij te leven. Daarnaast ben ik vrijwilliger bij de Nederlandse Coeliakie Vereniging en werk ik samen met de Vlaamse Coeliakie Vereniging.
|
Dienstverband bij een diëstistenbedrijf dat opereert op het gebied waar de richtlijn zich op richt. Eigendom van online informatieproducten over coeliakie en het glutenvrij dieet. |
Geen |
|
Herweijer |
Diëtist en praktijkeigenaar diëtistenpraktijk Voeding + Advies |
Vrijwilliger en waarneming bij afwezigheid van de diëtist voor de Nederlandse Coeliakie Vereniging |
Geen |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een raadpleging van de achterban via de Nederlandse Coeliakie Vereniging, het uitnodigen van Nederlandse Coeliakie Vereniging en Patiëntenfederatie Nederland voor de invitational conference, het houden van een focusgroep met patiënten, en een afgevaardigde patiëntenvereniging in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘Waarden en voorkeuren van patiënten en zorgverleners – focusgroep). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Nederlandse Coeliakie Vereniging en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de module is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodulesop verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module Zorg op afstand bij Coeliakie |
Geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten). Het is onduidelijk in hoeverre hoe zorg op afstand al door zorgverleners en zorgaanbieders wordt aangeboden (+/- 90%). Er wordt geen toename in het aantal in te zetten voltijdsequivalenten verwacht en het betreft geen wijziging in het opleidingsniveau van zorgpersoneel betreft.
Er worden geen substantiële investeringen voorzien op maatschappelijk niveau. Indien extra investeringen nodig zijn, komen er naar verwachting vanuit het IZA transformatiegelden beschikbaar waarop ziekenhuizen/ zorgorganisaties aanspraak kunnen doen; het kader “kosten” wordt verder uitgewerkt in een generieke module over zorg op afstand. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. Review Manager 5.4 werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’(zie www.gradeworkinggroup.org). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Literature search strategy bij module zorg op afstand bij coeliakie
Algemene informatie
|
Richtlijn: ZonMW Zorg op afstand coeliakie |
|
|
Uitgangsvraag: What is the potential role of e-healthcare in the follow-up of patients with CD, including its usage in facilitating adherence to the gluten-free diet? |
|
|
Database(s): Ovid/Medline, Embase |
Datum:13-1-2023 |
|
Periode: 2021- |
Talen: nvt |
|
Literatuurspecialist: Ingeborg van Dusseldorp |
|
|
BMI zoekblokken: voor verschillende opdrachten wordt (deels) gebruik gemaakt van de zoekblokken van BMI-Online https://blocks.bmi-online.nl/ Bij gebruikmaking van een volledig zoekblok zal naar de betreffende link op de website worden verwezen. |
|
|
Toelichting: Voor deze vraag is gezocht met de volgende concepten: E-health EN coeliakie Het sleutelartikel wordt gevonden. Het is te overwegen om ook te zoeken in Cinahl, omdat de vraag meer inhoudt dan alleen monitoring. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs |
9 |
5 |
11 |
|
RCTs |
7 |
3 |
9 |
|
Observationele studies |
26 |
10 |
31 |
|
Overig |
26 |
27 |
34 |
|
Totaal |
|
|
85 |
Zoekstrategie
Embase
|
No. |
Query |
Results |
|
#16 |
#4 NOT #13 NOT #12 NOT #11 overige |
26 |
|
#15 |
#13 NOT #12 NOT #11 OBS |
26 |
|
#14 |
#12 NOT #11 RCT |
7 |
|
#13 |
#4 AND (#9 OR #10) |
37 |
|
#12 |
#4 AND #8 |
12 |
|
#11 |
#4 AND #7 SR |
9 |
|
#10 |
'case control study'/de OR 'comparative study'/exp OR 'control group'/de OR 'controlled study'/de OR 'controlled clinical trial'/de OR 'crossover procedure'/de OR 'double blind procedure'/de OR 'phase 2 clinical trial'/de OR 'phase 3 clinical trial'/de OR 'phase 4 clinical trial'/de OR 'pretest posttest design'/de OR 'pretest posttest control group design'/de OR 'quasi experimental study'/de OR 'single blind procedure'/de OR 'triple blind procedure'/de OR (((control OR controlled) NEAR/6 trial):ti,ab,kw) OR (((control OR controlled) NEAR/6 (study OR studies)):ti,ab,kw) OR (((control OR controlled) NEAR/1 active):ti,ab,kw) OR 'open label*':ti,ab,kw OR (((double OR two OR three OR multi OR trial) NEAR/1 (arm OR arms)):ti,ab,kw) OR ((allocat* NEAR/10 (arm OR arms)):ti,ab,kw) OR placebo*:ti,ab,kw OR 'sham-control*':ti,ab,kw OR (((single OR double OR triple OR assessor) NEAR/1 (blind* OR masked)):ti,ab,kw) OR nonrandom*:ti,ab,kw OR 'non-random*':ti,ab,kw OR 'quasi-experiment*':ti,ab,kw OR crossover:ti,ab,kw OR 'cross over':ti,ab,kw OR 'parallel group*':ti,ab,kw OR 'factorial trial':ti,ab,kw OR ((phase NEAR/5 (study OR trial)):ti,ab,kw) OR ((case* NEAR/6 (matched OR control*)):ti,ab,kw) OR ((match* NEAR/6 (pair OR pairs OR cohort* OR control* OR group* OR healthy OR age OR sex OR gender OR patient* OR subject* OR participant*)):ti,ab,kw) OR ((propensity NEAR/6 (scor* OR match*)):ti,ab,kw) OR versus:ti OR vs:ti OR compar*:ti OR ((compar* NEAR/1 study):ti,ab,kw) OR (('major clinical study'/de OR 'clinical study'/de OR 'cohort analysis'/de OR 'observational study'/de OR 'cross-sectional study'/de OR 'multicenter study'/de OR 'correlational study'/de OR 'follow up'/de OR cohort*:ti,ab,kw OR 'follow up':ti,ab,kw OR followup:ti,ab,kw OR longitudinal*:ti,ab,kw OR prospective*:ti,ab,kw OR retrospective*:ti,ab,kw OR observational*:ti,ab,kw OR 'cross sectional*':ti,ab,kw OR cross?ectional*:ti,ab,kw OR multicent*:ti,ab,kw OR 'multi-cent*':ti,ab,kw OR consecutive*:ti,ab,kw) AND (group:ti,ab,kw OR groups:ti,ab,kw OR subgroup*:ti,ab,kw OR versus:ti,ab,kw OR vs:ti,ab,kw OR compar*:ti,ab,kw OR 'odds ratio*':ab OR 'relative odds':ab OR 'risk ratio*':ab OR 'relative risk*':ab OR 'rate ratio':ab OR aor:ab OR arr:ab OR rrr:ab OR ((('or' OR 'rr') NEAR/6 ci):ab))) |
13772969 |
|
#9 |
'major clinical study'/de OR 'clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR 'prospective study'/de OR 'comparative study'/de OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (('case control' NEAR/1 (study OR studies)):ab,ti) OR (('follow up' NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti) |
6767914 |
|
#8 |
'clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti |
3302394 |
|
#7 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#6 |
#4 AND #5 |
1 |
|
#5 |
utilization AND effectiveness AND ehealth AND technology AND in AND the AND 'follow up' AND of AND celiac AND disease AND a AND systematic AND review |
2 |
|
#4 |
#3 AND [1-1-2021]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
68 |
|
#3 |
#1 AND #2 |
454 |
|
#2 |
'telehealth'/exp OR 'telemedicine'/exp OR 'telemonitoring'/exp OR 'medical informatics'/exp OR 'web-based intervention'/exp OR 'wearable sensor'/exp OR 'personal digital assistant'/exp OR 'social media'/exp OR 'e-health':ti,ab,kw OR 'ehealth':ti,ab,kw OR telehealth:ti,ab,kw OR 'tele medicine':ti,ab,kw OR 'telemedicine':ti,ab,kw OR (((tele OR distance OR remote OR patient OR tight OR online OR 'on-line') NEAR/3 monitor*):ti,ab,kw) OR 'mobile app*':ti,ab,kw OR ((('clinical informat*' OR 'medical informat*' OR mobile) NEAR/2 technolog*):ti,ab,kw) OR econsult*:ti,ab,kw OR 'e-consult*':ti,ab,kw OR ediagnos*:ti,ab,kw OR 'e-diagnos*':ti,ab,kw OR 'mobile-health*':ti,ab,kw OR mhealth*:ti,ab,kw OR 'm-health*':ti,ab,kw OR telehealth*:ti,ab,kw OR 'tele-health':ti,ab,kw OR telerehabilitat*:ti,ab,kw OR 'remote-consult*':ti,ab,kw OR teleconsult*:ti,ab,kw OR 'tele-consult*':ti,ab,kw OR 'video-consult*':ti,ab,kw OR videoconsult*:ti,ab,kw OR telenursing:ti,ab,kw OR (((tele OR remote OR distan* OR online OR 'on-line') NEAR/2 (rehabilitat* OR nurs* OR diagnos* OR medic* OR monitor* OR care OR counsel* OR consult*)):ti,ab,kw) OR telediagnos*:ti,ab,kw OR telemedic*:ti,ab,kw OR telemonitor*:ti,ab,kw OR ehealth*:ti,ab,kw OR 'e-health*':ti,ab,kw OR telecare:ti,ab,kw OR 'digital-health*':ti,ab,kw OR 'digital-intervention*':ti,ab,kw OR 'health-app*':ti,ab,kw OR telecounsel*:ti,ab,kw OR 'e-coach*':ti,ab,kw OR ecoach*:ti,ab,kw OR app:ti,ab,kw OR zoom:ti,ab,kw OR 'face tim*':ti,ab,kw OR 'smart phon*':ti,ab,kw OR smartphon*:ti,ab,kw OR 'social media':ti,ab,kw OR android:ti,ab,kw OR ios:ti,ab,kw OR blog*:ti,ab,kw OR cellphone*:ti,ab,kw OR 'cell phone*':ti,ab,kw OR chat*:ti,ab,kw OR tiktok:ti,ab,kw OR instagram:ti,ab,kw OR gaming:ti,ab,kw OR 'e-therap*':ti,ab,kw OR etherap*:ti,ab,kw OR internet:ti,ab,kw OR 'mobile device*':ti,ab,kw OR iphone*:ti,ab,kw OR 'i-phone*':ti,ab,kw OR ipad*:ti,ab,kw OR 'i-pad*':ti,ab,kw OR email*:ti,ab,kw OR 'e-mail*':ti,ab,kw OR skype:ti,ab,kw OR sms:ti,ab,kw OR 'text messag*':ti,ab,kw OR 'information technolog*':ti,ab,kw |
477354 |
|
#1 |
'celiac disease'/exp OR celiac*:ti,ab,kw OR coelia*:ti,ab,kw OR ((gluten NEAR/3 enteropath*):ti,ab,kw) |
56975 |
Ovid/Medline
|
# |
Searches |
Results |
|
14 |
4 not 11 not 10 not 9 Overige |
27 |
|
13 |
11 not 10 not 9 OBS |
10 |
|
12 |
10 not 9 RCT |
3 |
|
11 |
4 and (7 or 8) |
17 |
|
10 |
4 and 6 |
6 |
|
9 |
4 and 5 SR |
5 |
|
8 |
Case-control Studies/ or clinical trial, phase ii/ or clinical trial, phase iii/ or clinical trial, phase iv/ or comparative study/ or control groups/ or controlled before-after studies/ or controlled clinical trial/ or double-blind method/ or historically controlled study/ or matched-pair analysis/ or single-blind method/ or (((control or controlled) adj6 (study or studies or trial)) or (compar* adj (study or studies)) or ((control or controlled) adj1 active) or "open label*" or ((double or two or three or multi or trial) adj (arm or arms)) or (allocat* adj10 (arm or arms)) or placebo* or "sham-control*" or ((single or double or triple or assessor) adj1 (blind* or masked)) or nonrandom* or "non-random*" or "quasi-experiment*" or "parallel group*" or "factorial trial" or "pretest posttest" or (phase adj5 (study or trial)) or (case* adj6 (matched or control*)) or (match* adj6 (pair or pairs or cohort* or control* or group* or healthy or age or sex or gender or patient* or subject* or participant*)) or (propensity adj6 (scor* or match*))).ti,ab,kf. or (confounding adj6 adjust*).ti,ab. or (versus or vs or compar*).ti. or ((exp cohort studies/ or epidemiologic studies/ or multicenter study/ or observational study/ or seroepidemiologic studies/ or (cohort* or 'follow up' or followup or longitudinal* or prospective* or retrospective* or observational* or multicent* or 'multi-cent*' or consecutive*).ti,ab,kf.) and ((group or groups or subgroup* or versus or vs or compar*).ti,ab,kf. or ('odds ratio*' or 'relative odds' or 'risk ratio*' or 'relative risk*' or aor or arr or rrr).ab. or (("OR" or "RR") adj6 CI).ab.)) |
5333638 |
|
7 |
Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or cohort.tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] |
4339994 |
|
6 |
exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw. |
2542392 |
|
5 |
meta-analysis/ or meta-analysis as topic/ or (metaanaly* or meta-analy* or metanaly*).ti,ab,kf. or systematic review/ or cochrane.jw. or (prisma or prospero).ti,ab,kf. or ((systemati* or scoping or umbrella or "structured literature") adj3 (review* or overview*)).ti,ab,kf. or (systemic* adj1 review*).ti,ab,kf. or ((systemati* or literature or database* or data-base*) adj10 search*).ti,ab,kf. or ((structured or comprehensive* or systemic*) adj3 search*).ti,ab,kf. or ((literature adj3 review*) and (search* or database* or data-base*)).ti,ab,kf. or (("data extraction" or "data source*") and "study selection").ti,ab,kf. or ("search strategy" and "selection criteria").ti,ab,kf. or ("data source*" and "data synthesis").ti,ab,kf. or (medline or pubmed or embase or cochrane).ab. or ((critical or rapid) adj2 (review* or overview* or synthes*)).ti. or (((critical* or rapid*) adj3 (review* or overview* or synthes*)) and (search* or database* or data-base*)).ab. or (metasynthes* or meta-synthes*).ti,ab,kf. |
642804 |
|
4 |
limit 3 to yr="2021 -Current" |
45 |
|
3 |
1 and 2 |
243 |
|
2 |
Celiac Disease/ or celiac*.ti,ab,kf. or coelia*.ti,ab,kf. or (gluten adj3 enteropath*).ti,ab,kf. |
37136 |
|
1 |
exp *Telemedicine/ or exp *Medical Informatics/ or *Internet-Based Intervention/ or "Internet of Things"/ or Social Media/ or exp *Wearable Electronic Devices/ or e-health.ti,ab,kf. or ehealth.ti,ab,kf. or telehealth.ti,ab,kf. or tele medicine.ti,ab,kf. or telemedicine.ti,ab,kf. or ((tele or distance or remote or patient) adj3 monitoring).ti,ab,kf. or mobile app*.ti,ab,kf. or ((clinical informat* or medical informat* or mobile or health) adj2 technolog*).ti,ab,kf. or econsult*.ti,ab,kf. or e-consult*.ti,ab,kf. or ediagnos*.ti,ab,kf. or e-diagnos*.ti,ab,kf. or mobile-health*.ti,ab,kf. or mhealth*.ti,ab,kf. or m-health*.ti,ab,kf. or telehealth*.ti,ab,kf. or tele-health.ti,ab,kf. or telerehabilitat*.ti,ab,kf. or remote-consult*.ti,ab,kf. or teleconsult*.ti,ab,kf. or tele-consult*.ti,ab,kf. or video-consult*.ti,ab,kf. or videoconsult*.ti,ab,kf. or telenursing.ti,ab,kf. or ((tele or remote or distan*) adj2 (rehabilitat* or nurs* or diagnos* or medic* or monitor* or care or counsel* or consult*)).ti,ab,kf. or telediagnos*.ti,ab,kf. or telemedic*.ti,ab,kf. or telemonitor*.ti,ab,kf. or ehealth*.ti,ab,kf. or e-health*.ti,ab,kf. or telecare.ti,ab,kf. or digital-health*.ti,ab,kf. or digital-intervention*.ti,ab,kf. or health-app*.ti,ab,kf. or telecounsel*.ti,ab,kf. or e-coach*.ti,ab,kf. or ecoach*.ti,ab,kf. or app.ti,ab,kf. or zoom.ti,ab,kf. or face tim*.ti,ab,kf. or smart phon*.ti,ab,kf. or smartphon*.ti,ab,kf. or social media.ti,ab,kf. or android.ti,ab,kf. or ios.ti,ab,kf. or blog*.ti,ab,kf. or cellphone*.ti,ab,kf. or cell phone*.ti,ab,kf. or chat*.ti,ab,kf. or tiktok.ti,ab,kf. or instagram.ti,ab,kf. or gaming.ti,ab,kf. or e-therap*.ti,ab,kf. or etherap*.ti,ab,kf. or internet.ti,ab,kf. or mobile device*.ti,ab,kf. or iphone*.ti,ab,kf. or i-phone*.ti,ab,kf. or ipad*.ti,ab,kf. or i-pad*.ti,ab,kf. or email*.ti,ab,kf. or e-mail*.ti,ab,kf. or skype.ti,ab,kf. or sms.ti,ab,kf. or text messag*.ti,ab,kf. or information technolog*.ti,ab,kf. |
535588 |