Glutenbelasting
Uitgangsvraag
Hoe dient een glutenbelasting te worden uitgevoerd om de diagnose coeliakie te stellen bij mensen die reeds een GVD volgen, zonder dat de diagnose gesteld is, maar daartoe wel de wens bestaat?
Aanbeveling
Bepaal als eerste stap coeliakie serologie indien een patiënt glutenvrij eet en de wens bestaat om coeliakie uit te sluiten dan wel aan te tonen. Indien dit positief is, stel dan de diagnose coeliakie volgens de elders in deze richtlijn aangegeven methoden.
Bepaal HLA-DQ2 en HLA-DQ8 bij patiënten die glutenvrij eten, negatieve coeliakieserologie hebben en bij wie de wens bestaat om coeliakie aan te tonen dan wel uit te sluiten. Indien deze genen afwezig zijn, is de diagnose coeliakie uitgesloten.
Start een glutenbelasting bij HLA-DQ2/DQ8 positieve patiënten die glutenvrij eten, negatieve coeliakie serologie hebben en bij wie de wens is om coeliakie aan te tonen dan wel uit te sluiten. Deze glutenbelasting dient onder begeleiding van een (kinder-) MDL-arts in samenwerking met een in coeliakie gespecialiseerde diëtist, te worden uitgevoerd.
Streef tijdens de glutenbelasting test naar 10-15 gram gluten per dag voor kinderen en 15-20 gram gluten per dag voor volwassenen.
Evalueer 1 maand na start van de glutenbelasting test en daarna iedere 3 maanden symptomen (bij kinderen tevens groei), coeliakieserologie en dieet. Indien de coeliakieserologie positief is, kan de diagnostiek worden ingezet conform de elders in deze richtlijn aangegeven methoden.
Het is onduidelijk wanneer de glutenbelasting test t.a.v. coeliakie als conclusief te beschouwen is. Overweeg om voorafgaand aan het staken van de glutenbelasting test duodenumbiopten te nemen om histopathologische analyse plaats te laten vinden.
Indien de patiënt klachten heeft probeer de glutenbelasting minimaal 1 maand vol te houden met evaluatie van serologie en eventueel histologie.
Bij asymptomatische patiënten evalueer na maximaal 1 jaar.
Adviseer de patiënt om voor het staken van de glutenbelasting test altijd contact op te nemen met de arts om de analyse af te ronden met serologisch en eventueel histopathologisch onderzoek.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar het effect van een glutenbelasting om de diagnose coeliakie te stellen bij patiënten die al zijn gestart met een glutenvrij dieet alvorens de diagnose coeliakie is gesteld.
Diagnostische accuratesse van de glutenbelasting was gedefinieerd als cruciale uitkomstmaat. Histologie (Vh:Cd ratio) en patiënt relevante uitkomstmaten (symptomen van coeliakie) waren gedefinieerd als belangrijke uitkomstmaten. Er zijn geen onderzoeken uit het literatuuronderzoek gekomen die voldoen aan de PICO.
De eerste aanbeveling is om ook onder een glutenvrij dieet coeliakieantistoffen te bepalen. Het is namelijk goed mogelijk dat de patiënt die reeds glutenvrij eet zich, bewust of onbewust, niet strikt aan het dieet houdt. Indien de patiënt voldoet aan de eerder in deze richtlijn genoemde diagnostische criteria voor coeliakie, dan hoeft geen verdere diagnostiek zoals een glutenbelasting plaats te vinden. Indien de diagnose coeliakie niet gesteld is of kon worden, wordt HLA-DQ analyse geadviseerd. Gezien de hoge negatief voorspellende waarde is HLA-DQ2- en DQ8-typering namelijk de meest betrouwbare test om patiënten te selecteren bij wie coeliakie uitgesloten is, onafhankelijk van het dieet. Bij een negatieve test (HLA-DQ2/8 niet aanwezig) is coeliakie uitgesloten. Gezien circa 40% van de algemene bevolking positief is voor minimaal één van deze genen, zegt de aanwezigheid van deze genen niets over het wel of niet hebben van coeliakie (Leonard, 2017). Indien deze test de diagnose coeliakie niet verwerpt, wordt een glutenbelasting test geadviseerd. Aangezien coeliakie een chronische ziekte betreft met de noodzaak voor een levenslang strikt aangepast, glutenvrij dieet, is het belangrijk om dit nauwkeurig uit te zoeken.
Bij HLA-DQ2/8 positieve patiënten die een verdenking op coeliakie hebben, maar reeds een glutenvrij dieet volgen en negatieve serologie hebben, is een glutenbelasting vooralsnog de enige mogelijkheid om de aanwezigheid van coeliakie te onderzoeken.
Aangezien er een gebrek is aan (gerandomiseerde) studies, is de hoeveelheid te gebruiken gluten en de duur van de glutenbelasting onderwerp van discussie. Het ligt voor de hand om een gestandaardiseerde hoeveelheid gluten toe te voegen aan het glutenvrij dieet.
Op de kinderleeftijd is het te overwegen om de glutenbelasting niet uit te voeren ten tijde van periode met groeiversnelling (peuterleeftijd/adolescenten). Een tweetal studies (Leonard, 2021; Leffler, 2013) laten zien dat na een 14-daagse glutenbelasting met wisselende hoeveelheden gluten (3-10 gram/dag), coeliakieserologie (tissue transglutaminase, tTG-IgA) 28-42 dagen na start gestegen is, met het meeste bewijs voor de hogere doseringen gluten.
De werkgroep concludeert dat in de huidige literatuur er onvoldoende data beschikbaar is om op basis daarvan een aanbeveling te doen over de duur van de glutenbelasting test en om een advies te geven over de hoeveelheid gluten die gebruikt dient te worden gedurende deze test. Ook is er te weinig data beschikbaar om te bepalen wat de beste parameter is om een reactie op gluten te beoordelen. Zodoende is het advies van de vormgeving van de glutenbelasting gebaseerd op expert opinion. In dit advies is meegenomen dat de normale glutenintake van volwassenen circa 10-15 gram gluten per dag bedraagt en dat bepaling van coeliakieserologie en histopathologische analyse overal beschikbaar is.
De werkgroep adviseert met inachtneming van de nodige onzekerheid de volgende werkwijze van een glutenbelasting test. De hoeveelheid gluten tijdens de test is voor kinderen is om te streven naar 10-15 gram gluten per dag en voor volwassenen 15-20 gram gluten per dag. Poliklinische follow-up wordt ten tijde van de glutenbelasting elke 3 maanden geadviseerd, waarbij symptomen, bij kinderen tevens groei, coeliakie-serologie (tTG-IgA en EMA, na uitsluiten van IgA-deficiëntie) en dieet worden geëvalueerd. Indien coeliakie-serologie positief is, zal de diagnose volgens de elders in deze richtlijn geldende criteria kunnen worden gesteld.
Het is onduidelijk wanneer de glutenbelasting daadwerkelijk als conclusief beschouwd kan worden. Het lijkt aannemelijk dat na enkele maanden glutenbelasting met negatieve serologie en histologie, de diagnose coeliakie zeer onwaarschijnlijk tot vrijwel uitgesloten is. De werkgroep is van mening dat het gerechtvaardigd is om dan ook de test periode van glutenbelasting na één jaar te staken, waarbij de diagnose coeliakie zo goed als zeker uitgesloten is. Alvorens een normaal glutenbevattend dieet te starten kan op dat moment overwogen worden om, ook bij negatieve serologie, duodenumbiopten af te nemen om meer zekerheid te krijgen over de aan- of afwezigheid van coeliakie.
Gezien de complexiteit van het proces is het advies om de glutenbelasting door een in coeliakie gespecialiseerde arts en diëtist te laten begeleiden. De diëtist kan samen met de patiënt inschatten of de glutenbelasting uitgevoerd wordt met voedingsmiddelen of met een gestandaardiseerde hoeveelheid glutenpoeder. Adviseer de patiënt om nooit op eigen initiatief de glutenbelasting te stoppen, maar bij te invaliderende klachten contact op te nemen met de arts en diagnostiek in te zetten alvorens de glutenbelasting te stoppen. Voordat de glutenbelasting wegens intolerantie gestaakt wordt dient zo mogelijk afname van dundarmbiopten overwogen te worden, liefst na tenminste 1 maand gluteninname.
De verwachting is dat in de nabije toekomst de glutenbelasting wellicht vervangen kan worden door andere minder invasieve testen zoals de analyse van gluten-reactieve T-cellen g in bloed (Sarna, 2017). Deze test is minder afhankelijk van het wel of niet volgen van een glutenvrij dieet om de diagnose coeliakie te kunnen stellen en is potentieel een aanvulling in een soms uitdagend diagnostisch traject naar de diagnose coeliakie.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Een subgroep van de bevolking eet glutenvrij om uiteenlopende redenen bijvoorbeeld door het ervaren van glutengerelateerde klachten of uit gezondheidsovertuiging. Bij een gedeelte van deze mensen zou sprake kunnen zijn van coeliakie. Zij zijn echter al gestart met de behandeling door glutenvrij te eten. Desalniettemin heeft het stellen of uitsluiten van de diagnose coeliakie consequenties voor de striktheid en duur van het glutenvrij dieet, de kosten, kwaliteit van leven en de (medische) follow-up. De wens is om de diagnostiek die nodig is voor het stellen van een accurate diagnose zo minimaal invasief mogelijk te doen, waarbij een glutenbelasting soms kan leiden tot klachten met vroegtijdig afbreken van de glutenbelasting als gevolg. Strikte follow-up en goede begeleiding door een diëtist is dan ook van essentieel belang voor een succesvolle glutenbelasting.
Kosten (middelenbeslag)
Er is voor zover bekend geen wetenschappelijke onderbouwing ten aanzien van het kostenaspect. Indien na een glutenbelasting de diagnose coeliakie gesteld wordt, brengt dit extra kosten mee in de (medische) follow-up, maar kunnen wellicht in de toekomst complicaties met dientengevolge gezondheidskosten en impact op de kwaliteit van leven tot gevolg vermeden worden. Indien coeliakie wordt uitgesloten, kan patiënt het geld van een glutenvrij dieet besparen, gezien de patiënt niet levenslang glutenvrij hoeft te eten.
Aanvaardbaarheid, haalbaarheid en implementatie
De diagnostiek is in alle ziekenhuizen en gedeeltelijk (coeliakie-serologie) via de huisarts beschikbaar. Wij raden echter aan de begeleiding van een glutenbelasting onder supervisie van een (kinder-) MDL-arts en in coeliakie gespecialiseerde diëtist te verrichten. De begeleiding en follow-up ten tijde van de glutenbelasting zijn van belang om tijdig symptomen te signaleren en diagnostiek naar coeliakie te verrichten alvorens de patiënt de glutenbelasting staakt.
De werkgroep concludeert dat in de huidige literatuur er onvoldoende data beschikbaar is om op basis daarvan een aanbeveling te doen over de duur van de glutenbelasting test en om een advies te geven over de hoeveelheid gluten die gebruikt dient te worden gedurende deze test. Ook is er te weinig data beschikbaar om te bepalen wat de beste parameter is om een reactie op gluten te beoordelen. Zodoende is het advies van de vormgeving van de glutenbelasting gebaseerd op expert opinion.
Rationale
Het allereerst bepalen van coeliakieserologie brengt lage kosten met zich mee en kan verdere diagnostische stappen met duurder bloedonderzoek (HLA-DQ bepaling) en met een invasieve glutenbelasting voorkomen, indien de serologie positief is. Hoe langer iemand glutenvrij eet, hoe kleiner de kans is dat de coeliakieserologie nog afwijkend is in het geval de patiënt coeliakie heeft.
Het bepalen van HLA-DQ 2.5, HLA-DQ8 en HLA-DQ2.2 kan verdere invasieve diagnostische stappen met glutenbelasting voorkomen, indien geen van deze genen bij de patiënt aanwezig zijn. Dit sluit de diagnose coeliakie uit.
Een glutenbelasting is vooralsnog de enige manier om de diagnose coeliakie te stellen, indien een patiënt glutenvrij eet en de diagnose kan niet op de onder aanbeveling 1 en 2 genoemde methoden worden uitgesloten of gesteld. Gezien de complexiteit van dit proces is het advies om dit te laten begeleiden door een arts en diëtist die beiden gespecialiseerd zijn in coeliakie.
Een volwassene nuttigt gemiddeld 10-15 gram gluten per dag. Om zeker te zijn dat de patiënt niet aan een te lage hoeveelheid gluten wordt blootgesteld, is het advies om een hoog-normale hoeveelheid gluten per dag te gebruiken. Er is overigens geen wetenschappelijk bewijs aangaande de hoeveelheid gluten die gebruikt dient te worden bij de glutenbelasting test te beargumenteren. De diëtist kan samen met de patiënt besluiten of deze gluten kunnen worden genuttigd met reguliere glutenbevattende producten of dat glutenpoeder gebruikt wordt. Dit hangt met name af van de verwachtte compliance van de patiënt.
Er is minimaal bewijs dat sommige patiënten na een maand een verhoging hebben in hun coeliakie-specifieke antistoffen. Verder is er geen wetenschappelijk bewijs aangaande het juiste interval om te bekijken de glutenbelasting test positief is. Daarnaast is de beste parameter om dit te monitoren ook niet bekend. Gezien de uitgebreide beschikbaarheid van serologisch onderzoek is ervoor gekozen om deze parameter te gebruiken. Bij kinderen dient men bedacht te zijn op groeiachterstand als een uiting van coeliakie.
Er is geen literatuur beschikbaar om een aanbeveling te doen over wanneer de glutenbelasting test als negatief beschouwd kan worden. De werkgroep is van mening dat, gezien het intensieve traject dat een patiënt doorloopt tijdens deze glutenbelasting test, er argumenten kunnen zijn om deze test af te sluiten met histopathologisch onderzoek van duodenumbiopten om de diagnostiek daarmee af te ronden. Er valt om pragmatische redenen iets voor te zeggen om de glutenbelastingtest maximaal 1 jaar te laten duren.
Onderbouwing
Achtergrond
Een glutenbelastingtest is een manier om de diagnose coeliakie vast te stellen bij patiënten die, al dan niet op eigen initiatief, gestart zijn met een glutenvrij dieet zonder dat de diagnose coeliakie gesteld is. De vraag is hoe een glutenbelasting uit te voeren. Dit komt omdat bij patiënten met coeliakie die reeds langere tijd glutenvrij eten geen of lage titers coeliakie-specifieke antistoffen aanwezig zijn en de histologie van de dunne darm mogelijk al (deels) genormaliseerd is. Hiermee kan het het onderscheid tussen de aan- en afwezigheid van coeliakie bemoeilijkt worden. Dit is relevant gezien het advies om bij de aanwezigheid van de diagnose coeliakie levenslang glutenvrij te eten. Hoe deze glutenbelastingtest vormgegeven dient te worden is onbekend. De vraag is hoelang deze belangtest moet duren en hoeveel gluten er per dag genuttigd dient te worden.
Conclusies / Summary of Findings
|
- GRADE |
Diagnostic accuracy Because of the absence of data no conclusions could be drawn about diagnostic accuracy of gluten challenge for coeliac disease with gluten challenge in patients with suspected celiac disease previously adhering to a gluten-free diet.
Sources: - |
|
- GRADE |
Histology – villous height to crypt depth (Vh:Cd) ratio Because of the absence of data no conclusions could be drawn about the effect of a gluten challenge on Vh:Cd ratio in patients with suspected celiac disease previously adhering to a gluten-free diet.
Sources: - |
|
- GRADE |
Symptoms of coeliac disease Because of the absence of data no conclusions could be drawn about the effect of gluten challenge on symptoms in patients with suspected coeliac disease previously adhering to a gluten-free diet.
Sources: - |
Samenvatting literatuur
Description of studies
None of the studies directly answered the PICO, however studies described below were deemed relevant for the clinical question.
Lähdeaho (2011) conducted a prospective cohort study challenging adult coeliac disease (CD) patients with gluten aiming to gain a clearer conception of the gluten amount needed to cause some mucosal deterioration but without inducing excessive ill health with a resultant dropout of trial subjects. Included were patients with biopsy-proven CD aged 18-75 years adhering to a strict GFD for at least two years and being in clinical remission as judged by an interview, clinical examination and on-site rapid celiac autoantibody testing. In total, 25 patients were included (mean age 49 years (21 to 68 years); mean duration of GFD 11 years (2 to 34 years); 81% female). Patients were challenged with low (1-3 g) or moderate (3-5g) doses of gluten daily for 12 weeks. Symptoms, small-bowel morphology and celiac serology (for tissue transglutaminase) were determined.
Leffler (2013) conducted a prospective study assessing the time course of serological and histological changes that occur in adults with biopsy proven CD undergoing a 14-day gluten challenge. Adults with biopsy proven CD in remission were included. Remission was defined as Immunoglobulin (IgA)-tissue transglutaminase levels under 10 ELISA units, on a strictly gluten-free diet (GFD) for at least 12 months with a Celiac Dietary Adherence Score of <18, and absence of both symptoms typical of CD and symptoms which prompted initial diagnosis in the participant. The study included two run-in visits followed by a 14-day gluten challenge at a randomly assigned dose of 3 or 7.5 g of gluten/day. Study visits occurred 3, 7, 14 and 28 days after starting gluten challenge. Duodenal biopsy was performed during the run-in and at days 3 and 14 of a gluten challenge. Villous height to crypt depth (Vh:Cd) ratio were measured by two pathologists. Antibodies to tissue transglutaminase and deamidated gliadin peptides at each visit. All visits included assessment of symptoms over the past 24 h using both the Celiac Symptom Index (CSI) and Gastrointestinal Symptom Rating Scale (GSRS).
Leonard (2021) conducted a double-blind randomized controlled trial assessing relative abilities of multiple biomarkers to assess disease activity induced by 2 gluten doses, and aimed to identify biomarkers to supplement or replace histology. Included were patients HLA-DQ2.5 and/or HLA-DQ8–positive adults with biopsy proven CD in clinical and histologic remission on a GFD for >12 months. Patients were randomized to 3 g or 10 g gluten/d for 14 days. The study included a 21-day screening period followed by a
7-day run-in period during which patients underwent endoscopy with duodenal biopsy, video capsule endoscopy, and blood collection. Run-in was followed by 14-day
gluten challenge at the assigned daily dose. A final visit occurred 28 days post-gluten challenge with video capsule endoscopy and blood assessment. Patients underwent serum testing for antibodies to IgA tissue transglutaminase and completed the
CD Symptom Diary (CDSD). The CDSD is a 6-item, daily symptom scale, including
diarrhea, bloating, nausea, abdominal pain, and tiredness. This study included the gastrointestinal domain items of abdominal pain, bloating, nausea, and diarrhea.
Results
Diagnostic accuracy
There is no evidence answering the PICO for the outcome diagnostic accuracy.
Histology – villous height to crypt depth (Vh:Cd) ratio
Leffler (2013) found that Vh:Cd deteriorated from a mean 2.21 (95% CI 1.82 to 2.60) at baseline to 1.12 (95% CI 0.68 to 1.56) at day 14 after gluten challenge. The mean difference in Vh:Cd ratio was -1.09 (95%CI -1.64 to -0.54).
Lähdeaho (2011) found that the Vh:Cd in the moderate-dose group deteriorated from a mean 3.0 (95% CI 2.8 to 3.2) to 1.7 (95% CI 1.0 to 2.4) after 12 weeks of gluten challenge. The mean difference in Vh:Cd ratio was -1.30 (95% CI -1.93 to -0.67). The Vh:Cd in the low-dose group deteriorated from a mean 2.9 (95% CI 2.5 to 3.4) to 1.9 (95% CI 1.2 to 2.6) after 12 weeks of gluten challenge. The mean difference in Vh:Cd ratio was -1.00 (95% CI -1.71 to -0.29).
Leonard (2021) found that patients in the 3g group had a median baseline Vh:Cd of 2.0 (95%CI 1.8 to 2.4) and 2.1 (95% CI 1.6 to 2.6) at day 15 after gluten challenge. The mean difference in Vh:Cd ratio was 0.10 (95% CI 0.33 to 0.53). Median baseline Vh:Cd ratio for the 10g group was 2.5 (95%CI 1.6 to 3.0) and 0.6 (95%CI 0.2 to 1.3) at day 15 after gluten challenge. The mean difference in Vh:Cd ratio was -1.90 (95%CI -2.69 to -1.11).
Overall there were three studies (five intervention groups) reported Vh:Cd ratio before and after gluten challenge as histological outcome. These studies were pooled. The pooled mean difference was -1.00 (95% CI -1.71 to -0.29; Figure 1) in favour of gluten challenge meaning that gluten challenge caused histological deterioration.
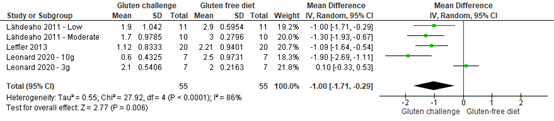
Figure 1. Forest plot showing the comparison between histological outcomes after a gluten-free period (baseline) relative to gluten challenge for Vh:Cd ratio. Pooled mean difference, random effects model.
Symptoms of coeliac disease
Leffler (2013) found that mean Celiac Symptom Index (CSI) score increased from 25.26 (95%CI 16.6 to 23.9) at baseline to 31.84 (95%CI 23.2 to 40.5) at day 14 of gluten challenge. The mean difference in CSI score was 11.61 (95%CI 3.48 to 19.74) compared to baseline. However, mean CSI score decreased again to 25.22 (95%CI 20.1 to 30.3) 14 days after gluten challenge. The mean difference in CSI score was -0.04 (95%CI -5.76 to 5.68) compared to baseline. A similar pattern was observed for mean GSRS score with the score increasing from 20.23 (95%CI 21.2 to 29.5) at baseline to 30.68 (95%CI 27.2 to 41.5) at day 14 of gluten challenge. The mean difference in GSRS score was 10.45 (95%CI 0.47 to 20.2) compared to baseline. GSRS score decreased again to 21.52 (95%CI 15.4 to 27.7) 14 days after gluten challenge. The mean difference in GSRS score was 1.29 (95% CI-4.92 to 7.50) compared to baseline.
Lähdeaho (2011) found that at baseline, all subjects were free of gastrointestinal symptoms. Altogether 15 (71%) out of the 21 CD patients experienced mild to moderate abdominal symptoms upon gluten challenge; eight of them from the moderate-dose and seven from the low-dose group.
Leonard (2020) The CDSD is a 6-item, daily symptom scale, including diarrhea, bloating, nausea, abdominal pain, and tiredness. This study included the gastrointestinal domain items of abdominal pain, bloating, nausea, and diarrhea. Gastrointestinal symptoms were low before gluten challenge and increased in both groups during challenge (n=14; P=0.0009), returning to near normal after the gluten challenge.
Level of evidence of the literature
The level of evidence of the included studies was not assessed using GRADE methodology, because none of the studies directly answered the PICO-question.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
P (patients) Children and adults with suspected coeliac disease on a gluten-free diet
I (intervention) Diagnostics for coeliac disease with gluten challenge
C (control) -
R (reference) Diagnostics for coeliac disease without gluten challenge
O (outcome) Diagnostic accuracy (sensitivity, specificity), coeliac disease specific serology, histology (villous height to crypt depth (Vh:Cd) ratio), symptoms after gluten challenge
Relevant outcome measures
The guideline development group considered diagnostic accuracy of gluten challenge as a critical outcome measure for decision making; and serology and histology (Vh:Cd ratio) and symptoms after gluten challenge as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group did not define minimally clinically important difference for the outcomes.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1 January 2000 until 11 December 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 333 hits. Studies were selected based on the following criteria: systematic reviews (with meta-analyses), randomized controlled trials (RCT) and observational studies answering the PICO question. Studies were initially selected based on title and abstract screening. Thirty-one studies were initially selected based on title and abstract screening. After reading the full text, 28 studies were excluded, because they did not fit the inclusion criteria (see the table with reasons for exclusion under the tab Methods). Three other studies (Leonard, 2021; Leffler, 2013; Lähdeaho, 2011) did not answer the PICO and were not assessed using GRADE methodology but were still relevant for the clinical question and recommendations. Description of these 3 studies can be found under Summary of literature.
Results
One RCT investigated relative abilities of multiple biomarkers to assess disease activity induced by 2 gluten doses (Leonard, 2021). Two observational studies assessed the course of serological and/or histological changes of gluten challenge in adults (Leffler, 2013; Lähdeaho, 2011). Study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Lähdeaho, M. L., Mäki, M., Laurila, K., Huhtala, H., & Kaukinen, K. (2011). Small-bowel mucosal changes and antibody responses after low-and moderate-dose gluten challenge in celiac disease. BMC gastroenterology, 11(1), 1-9.
- Leffler, D., Schuppan, D., Pallav, K., Najarian, R., Goldsmith, J. D., Hansen, J., ... & Kelly, C. P. (2013). Kinetics of the histological, serological and symptomatic responses to gluten challenge in adults with coeliac disease. Gut, 62(7), 996-1004.
- Leonard, M. M., Sapone, A., Catassi, C., & Fasano, A. (2017). Celiac Disease and Nonceliac Gluten Sensitivity: A Review. JAMA, 318(7), 647–656.
- Leonard, M. M., Silvester, J. A., Leffler, D., Fasano, A., Kelly, C. P., Lewis, S. K., ... & Smithson, G. (2021). Evaluating responses to gluten challenge: a randomized, double-blind, 2-dose gluten challenge trial. Gastroenterology, 160(3), 720-733.
- Mearin, M. L., Agardh, D., Antunes, H., Al-toma, A., Auricchio, R., Castillejo, G., ... & Whiting, P. (2022). ESPGHAN Position Paper on Management and Follow-up of Children and Adolescents With Celiac Disease. Journal of Pediatric Gastroenterology and Nutrition, 75(3), 369-386.
- Sarna, V. K., Lundin, K., Mørkrid, L., Qiao, S. W., Sollid, L. M., & Christophersen, A. (2018). HLA-DQ-Gluten Tetramer Blood Test Accurately Identifies Patients With and Without Celiac Disease in Absence of Gluten Consumption. Gastroenterology, 154(4), 886–896.e6.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-06-2023
Beoordeeld op geldigheid : 19-02-2023
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. P. Wahab, MDL-arts in Rijnstate Ziekenhuis Arnhem, NVMDL (voorzitter)
- Prof. Dr. G. Bouma, MDL-arts in Amsterdam UMC, locatie VUmc, NVMDL (voorzitter)
- Prof. Dr. M.L. Mearin-Manrique, kinderarts-MDL in het LUMC, NVK (voorzitter)
- Dr. Abdul Al-Toma, MDL-arts in St. Antonius Ziekenhuis Utrecht , NVMDL (voorzitter, afgetreden in mei 2020)
- Prof. Dr. C.J.J. Mulder, MDL-arts in Amsterdam UMC, NVMDL
- Dr. T. van Gils, AIOS-MDL in Amsterdam UMC, NVMDL
- Dr. M.M.S. Wessels, kinderarts-MDL in Rijnstate Ziekenhuis Arnhem, NVK
- Drs. C.R. Meijer-Boekel, kinderarts-MDL in LUMC, NVK
- Prof. Dr. J.W.M. Muris, huisarts, Universiteit Maastricht, NHG
- Drs. E.A. Neefjes - Borst, patholoog in Amsterdam UMC, NVVP
- Dr. H.J. Bontkes, laboratorium specialist medische Immunologie, Amsterdam UMC, NVVI
- Drs. M. Beukema, internist-intensivist in Streekziekenhuis Koningin Beatrix, NIV
- Prof. Dr. B. Horváth, dermatoloog in UMC Groningen, NVDV
- Drs. S. Neve, dermatoloog in Dijklander Ziekenhuis, NVDV
- Drs. T. Holtackers-Dumay, kinder- en jeugdpsycholoog in St. Anthonius ziekenhuis, NIP
- L.J. Bosch, MSc, diëtist en eigenaar bij ‘Voeding voor jou,’ NVD
- G. Herweijer, MSc, diëtist in ‘Voeding + Advies’, ervaringsdeskundige, NCV
- F.W.P.C. van Overveld, MSc, directeur NCV
Klankbordgroep
- Dr. R. de Jongh, internist in het Amsterdam UMC, NIV
- Dr. A.F.J.E. Vrancken, neuroloog in het UMC Utrecht, NVN
- Dr. B.P.C. van de Warrenburg, neuroloog in het Radboudumc, NVN
Met ondersteuning van:
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2020)
- Dr. A. Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. M. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2022)
- Dr. E.V. van Dorp-Baranova, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard dat zij in de laatste drie jaar geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bouma* |
MDL arts, Amsterdam UMC, hoogleraar inflammatoire aandoeningenvan de tractus digestivus Directeur research instituut Amsterdam Gastroenterology, Endocrinology and Metabolism, AMsterdam UMC Plaatsvervangend opleider MDL, AMsterdam UMC, locatie Vumc |
Nationale en internationale bestuurs- en werkgroepfucties: Voorzitter Stichting Gastrostart NVGE 2019-2022 (onbetaald) Voorzitter landelijke Werkgroep Autoimmuun Hepatitis 2017-2022 (onbetaald) Lid van het Scientific Committee, dr. Schär Nutrition (onbetaald) Lid van de wetenschappelijke adviesraad van de Nederlandse Coeliakie Vereniging (onbetaald) National representative in de Council van de United European Gastroenterology, 2013-2015 (onbetaald) Lid van de wetenschappelijke adviesraad van de Maag Lever Darmstichting (onbetaald)
Adviesraden: 2019 Advisory Board Takeda International (eenmalig, betaald) 2019 Nascholing IBD, financieel mogelijk gemaakt door Takeda (eenmalig, betaald) 2019 Advisory Board Roche International (eenmalig, betaald) 2020 Advisory Board Calypso Biotech (eenmalig, onbetaald) 2021 Advisory Board Alimentiv (eenmalig, onbetaald) 2022 Nascholing IBD, financieel mogelijk gemaakt door Janssen Pharmaceuticals (eenmalig, betaald) - Clinical trials op het gebied van coeliakie: S.I. Cellimmune-AMGEN clinical trial (NCT02633020) P.I. Provention clinical trial (NCT04424927) P.I. Calypso clinical trial (NCT04593251) P.I. Tofacitinib for refractory celiac disease (Eudract 2018-001678-10)
Daarnaast P.I. en S.I. op diverse klinische trials op het gebied van IBD (contract research); PI op investigator initiated studies op het gebied van IBD, autoimmuun hepatitis en coeliakie. |
Zie onder nevenwerkzaamheden: Financier: MLDS, inh onderzoek: onderzoek naar de lymfoomontwikkeling bij coeliakie, rol als PL: ja inh: onderzoek naar de verbetering van diagnostiek van coeliakie. Rol PL: nee. Inh: MLDS. Onderzoek naar de rol van MTX bij IBD. Rol PL: ja. MLDS: inh: onderzoek naar voorspellers van exacerbatie van IBD. Rol PL: nee. KWF/coeliakievereniging PFizer (in kind). Inh: Rol van tofacitinib in de behandeling van refractarie coeliakie. Rol PL: nee |
Geen |
|
Wahab* |
MDL arts, Rijnstate Ziekenhuis Rijstate |
Lid ZonMw commissie EEK; vacatiegeld Lid Regionaal Tuchtcollege Zwolle; vacatiegeld; Lid wetenschappelijke advies raad Nederlandse Coeliakie Vereniging, onbetaald |
Geen |
Geen |
|
Mearin-Manrique* |
Kinderarts-MDL, afdeling Kindergeneeskunde Leids Universitair Mediach Centrum (LUMC) |
Lid Medisch Advies Raad Ned. Coeliakie Vereniging: onbetaald Lid Public Affair Committee European Society Pediatric Gastroenterology Hepatology and Nutrition (ESPGHAN): onbetaald Secretaris werkgroep Coeliakie ESPGHAN:onbetaald |
Financier: Thermo Fisher. Inh onderz: PreventCD (Prevention of Coeliac Disease) Rol PL: ja Fin: BioHit. Inh onderzoek: GLUTENSCREEN (Early detection of coeliac disease). Rol PL: ja |
Geen |
|
Al-Toma* (afgetreden als voorzitter in 2020) |
MDL-arts in St. Antonius Ziekenhuis Utrecht |
Geen |
Geen |
Geen |
|
Van Gils |
(AIOS) maag-, darm- en leverziekten in het Amsterdam UMC. |
Geen |
Geen |
Geen |
|
Mulder |
Werkgroep HEG Stoolbanking 2018 -2020 (onbetaald) Consultant HLW voor Thiosix 2018 - 2020 4-8 uur per week Begeleider 4 Promovendi VU 2019 - 2020 (onbetaald) MCV de Veluwe 2 dagen poli/endoscopiie/week (betaald) |
Geen |
Geen |
Geen |
|
Wessels |
Kinderarts MDL – Rijnstate Ziekenhuis Arnhem |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging - onbetaald |
Geen |
Geen |
|
Meijer |
Kinderarts MDL-LUMC 0,8 FTE lid Special Interest Group (SIG) ESPGHANon celiac disease |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging ‐ onbetaald |
Geen |
Geen |
|
Muris |
Hoofd vakgroep Huisartsgeneeskunde, Universiteit Maastricht |
Huisarts in Geulle, vergoeding |
Geen |
Geen |
|
Neefjes-Borst |
Patholoog, Amsterdam UMC |
Onbetaald: werkgroep protocollen van PALGA |
Geen |
Geen |
|
Bontkes |
Laboratorium specialist Medische Immunologie en hoofd laboratorium medische immunologie van het AmsterdamUMC, locatie VUmc |
Bestuurslid van de SKML sectie humorale immunologie (onbetaald) Coördinator SKML rondzending "coeliakie" (onbetaald, onkostenvergoeding voor het laboratorium). Lid van de Nederlandse sectie van het European Autoimmunity Standardisation Initiative (EASI) (onbetaald) |
Geen |
Geen |
|
Beukema |
lnternist-intensivist/acute geneeskunde, Santiz Streekziekenhuis Koningin Beatrix Winterswijk |
Adviescommissie GE (NIV) |
Geen |
Geen |
|
Horváth |
Dermatoloog, Afdelingshoofd Afdeling Dermatologie, Centrum voor Blaarziekten Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen |
|
Neve |
Dermatoloog bij Dijklanderziekenhuis te Hoorn voor 0,65 FTE |
Visiteur kwaliteitscommissie NVDV. Onkostenvergoeding Leo Pharma dermatologie adviesraad |
Geen |
Geen |
|
Holtackers |
GZ-psycholoog, kindergeneeskunde, St. Antonius Ziekenhuis (24 uur) medische psychologie; GZ-psycholoog, kinder- & jeugd & volwassenen, GGZ eigen praktijk (Psychologiepraktijk Samenspel Utrecht) |
Lesgeven (sociale vaardigheidstraining) aan beroepskrachten Rino Utrecht (aantal cursusdagen per jaar), betaald |
Geen |
Geen |
|
Bosch |
Diëtist en eigenaar bij 'Voeding voor jou' |
Op social media en online ben ik bekend als de glutenvrije diëtist en verkoop ik online programma’s om zelfverzekerd en gezond glutenvrij te leven. Daarnaast ben ik vrijwilliger bij de Nederlandse Coeliakie Vereniging en werk ik samen met de Vlaamse Coeliakie Vereniging.
|
Dienstverband bij een diëstistenbedrijf dat opereert op het gebied waar de richtlijn zich op richt. Eigendom van online informatieproducten over coeliakie en het glutenvrij dieet. |
Geen |
|
Herweijer |
Diëtist en praktijkeigenaar diëtistenpraktijk Voeding + Advies |
Vrijwilliger en waarneming bij afwezigheid van de diëtist voor de Nederlandse Coeliakie Vereniging |
Geen |
Geen |
*voorzitter richtlijncommissie
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Nederlandse Coeliakie Vereniging (NCV) voor de invitational conference, afvaardiging van deze patiëntenvereniging in de werkgroep en betrekken van patiëntenvertegenwoordigers bij het ontwikkelen van Thuisarts-situaties. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘waarden en voorkeuren van patienten’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de NCV als ook aan de Patientenfederatie Nederland en de eventueel aangeleverde commentaren zijn verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module 1a Serologische diagnostiek bij volwassenen
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1b Positieve serologie bij een normaal biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1c Negatieve serologie bij een afwijkend biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1d Serologische diagnostiek bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1e Glutenbelasting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2a Gezondheidseffecten van GVD op lange termijn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2b GVD en kwaliteit van leven |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2c Vitaminen- en mineralendeficiënties tijdens GVD
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Glutensensitiviteit zonder coeliakie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4a Monitoring van coeliakie bij volwassenen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4b Monitoring van coeliakie bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 Randvoorwaarden (Organisatie van zorg) |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met coeliakie en glutengerelateerde aandoeningen. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van NVMDL, V&VN, NAPA, NVK, NCV, NHG en NIP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
