Glutenvrij dieet en kwaliteit van leven
Uitgangsvraag
Wat is het effect van glutenvrij dieet op de kwaliteit van leven bij kinderen en volwassenen met coeliakie? En hoe dient dit te worden beoordeeld?
Aanbeveling
Bespreek tijdens de follow-up het sociale aspect van het glutenvrije dieet en de kwaliteit van leven met de patiënt en gebruik eventueel een coeliakie-specifieke gevalideerde vragenlijst voor het beoordelen van de kwaliteit van leven.
Adviseer de patiënt om lidmaatschap bij een patiëntenvereniging te overwegen (NCV, zie www.glutenvrij.nl).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is literatuuronderzoek verricht naar de effecten van het volgen van een glutenvrij dieet bij patiënten met coeliakie op de kwaliteit van leven. Op basis van de beschikbare literatuur is dit bewijs als zeer laag gewaardeerd volgens de GRADE criteria. De beschikbare literatuur suggereert dat het glutenvrij dieet kwaliteit van leven lijkt te verbeteren bij coeliakiepatiënten na 6 tot 12 maanden glutenvrij dieet, maar het effect is klein.
Er zijn meerdere factoren die kunnen verklaren dat de gevonden effecten van het glutenvrij dieet op kwaliteit van leven klein zijn. (1) Lichamelijk gezien gaat een coeliakiepatiënt veelal vooruit met een glutenvrij dieet, maar sociaal gezien kan het dieet juist een beperking zijn (Grudeva, 2019). (2) Daarnaast kan juist het eerste jaar van het glutenvrije dieet als moeilijk worden beschouwd door de complexiteit van het dieet, terwijl het op langere termijn de patiënt makkelijker afgaat, waardoor de kwaliteit van leven mogelijk verder omhoog gaat. (3) Ten derde herstellen coeliakiepatiënten soms maar langzaam op het glutenvrije dieet, vooral op oudere leeftijd (Wahab, 2002). In de opgenomen studies wordt hierin geen onderscheid gemaakt. Naar verwachting zal de kwaliteit van leven verder verbeteren wanneer de coeliakie volledig in remissie is. (4) Ten vierde is bekend dat niet alle coeliakiepatiënten het glutenvrij dieet even goed opvolgen (bewust of onbewust), waardoor men klachten kan behouden (Hall, 2009). Daarnaast komen functionele buikklachten frequenter voor bij patiënten met coeliakie (Sainsbury, 2013). Het is onduidelijk of hiernaar is gekeken in bovenstaande studies. Bij dieetfouten blijven regelmatig klachten aanwezig en kunnen patiënten minder verbetering in kwaliteit van leven ervaren.
Het effect van het glutenvrij dieet op kwaliteit van leven op de langere termijn is door middel van de opgenomen studies niet goed te beoordelen. Zoals hierboven al deels is uitgelegd, is het mogelijk dat aanvankelijke verbetering van kwaliteit van leven na het starten van het dieet, teniet wordt gedaan door de last die patiënten ervaren door het dieet.
Kinderen
Bij kinderen en adolescenten zijn meerdere langere termijn studies gedaan, die laten zien dat hun kwaliteit van leven gemeten met een generieke QoL vragenlijst vergelijkbaar is met leeftijdsgenoten (Barrio, 2018; Mager, 2018; Myleus, 2014; Nordyke, 2013). Indien echter gebruik gemaakt wordt van coeliakie specifieke vragenlijsten, dan valt op dat hun kwaliteit van leven neutraal tot slecht is (Benelli, 2015; Vriezinga, 2017). Opvallend is daarbij dat ouders de neiging hebben de kwaliteit van leven van hun kinderen slechter in te schatten dan de kinderen zelf (Barrio, 2018). In de enige studie bij kinderen die naar de inschatting van kwaliteit van leven door artsen heeft gekeken, heeft laten zien dat medici deze stelselmatig hoger inschatten dan de kinderen zelf (Vriezinga, 2017). Deze neutraal tot slechte kwaliteit van leven is wellicht in lijn met de literatuur die meegenomen is in onze zoekstrategie, waarin het volgen van een glutenvrij dieet bij adolescenten voor slechtere scores in de dimensie angsten en depressies kan zorgen (Nordyke, 2013). Dit is mogelijk te verklaren door de striktheid van het dieet, waar in plaats van angst voor ziekte, nieuwe angsten voor bijvoorbeeld kruisbesmetting of glutenfouten en sociale dilemma’s kunnen ontstaan.
Volwassenen
Bij volwassenen zijn er voornamelijk studies bekend die kijken naar gezondheid-gerelateerde kwaliteit van leven (overall kwaliteit van leven) waarbij er gebruik is gemaakt van niet-coeliakie specifieke vragenlijsten. Uit de literatuur is op te maken dat deze overall kwaliteit van leven 1 jaar na start van een glutenvrij dieet verbetert ten opzichte van het moment van diagnose, al zijn er aanwijzingen dat de kwaliteit van leven dan nog steeds slechter is dan bij gezonde controles (Canova, 2021; Burger, 2017; Van de Water, 2009; Nachman, 2010; Johnston, 2004). Op lange termijn (>1 jaar na diagnose), lijkt de overall kwaliteit van leven nog steeds verbeterd te zijn ten opzichte van moment van diagnose (Canova, 2021). Wel zijn er aanwijzingen dat de kwaliteit van leven op het gebied van sociaal functioneren, vitaliteit, algemene gezondheid en op sociaal en emotioneel vlak 4 jaar na diagnose weer verslechteren ten opzichte van 1 jaar na diagnose (Nachman, 2010).
Kijkende naar coeliakie-specifieke kwaliteit van leven, is er weinig data beschikbaar. Kijkende naar de beschikbare literatuur lijkt het zo te zijn dat zowel op korte als op lange termijn met name dysforie verbetert bij patiënten die zich aan het glutenvrij dieet houden (Marsilio, 2020; Deepak, 2018).
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Patiënten (en in geval van kinderen hun ouders) willen na het stellen van de diagnose van hun klachten af en complicaties voorkomen. De meesten van hen zijn dan ook graag bereid het glutenvrij dieet te gaan volgen om zo hun kwaliteit van leven te vergroten.
Echter, het glutenvrij dieet kent ook nadelen, zoals grote beperking in keuzevrijheid van voedsel en sociale gevolgen (isolatie, uitzondering zijn, angst voor glutenfouten of kruisbesmetting, voor zichzelf op moeten komen, etc.). Afhankelijk van de ernst van de (lichamelijke) klachten die hier tegenover staan, kan de striktheid van een dergelijk dieet ook de kwaliteit van leven doen verslechteren.
Sommige coeliakiepatiënten hebben moeite met controleren van voedingsmiddelenetiketten of vergeten voedingsmiddelen te controleren waarbij het niet voor de hand ligt dat er gluten in kan zitten. Bij coeliakiepatiënten met een migratieachtergrond kan een taalbarrière een probleem zijn bij het lezen van etiketten, maar ook wanneer men het glutenvrij dieet uit moet leggen aan anderen die voor het eten zorgen. Ook moet er gedacht worden aan sociaal-culturele aspecten die mee kunnen spelen, zoals sociale dwang en het niet kunnen weigeren van voedsel.
Voor de individuele patiënt zullen voor- en nadelen van glutenvrij dieet dan ook enigszins in balans moeten zijn. Aan betrokken hulpverleners de taak hen hierin eventueel te ondersteunen.
Kosten (middelenbeslag)
Er zijn voor dit aspect geen noemenswaardige bezwaren vanuit het veld, die van invloed zijn op de besluitvorming.
Aanvaardbaarheid, haalbaarheid en implementatie
Navraag en aandacht voor kwaliteit van leven van patiënten met coeliakie zou standaard moeten zijn voor zorgverleners. Hierbij dient aandacht besteed te worden aan kwaliteit van leven in het algemeen en rondom coeliakie-specifieke zaken. Uit de enige literatuur die hierover bekend is, is gebleken dat artsen bij kinderen en adolescenten kwaliteit van leven stelselmatig te hoog inschatten (Vriezinga, 2017). Het gebruik van gestandaardiseerde (coeliakie-specifieke) vragenlijsten zou hierbij kunnen helpen. Inventarisatie door de patiëntenvereniging onder haar leden heeft opgeleverd, dat zij meer behoefte hebben aan een luisterend oor van iemand die hen begrijpt, ofwel een medepatiënt, dan aan begeleiding door een coach of psycholoog. De patiëntenvereniging is hiervoor bij uitstek het medium.
Rationale
Uit de literatuur blijkt dat de algehele kwaliteit van leven bij patiënten met coeliakie lijkt te verbeteren na het starten van een glutenvrij dieet. Ten aanzien van coeliakie-specifieke gezondheid is er weinig bewijs in de literatuur te vinden, maar lijkt het erop dat met name dysforie minder wordt na het starten van een glutenvrij dieet.
Uit de studies onder kinderen met coeliakie lijkt het zo te zijn dat de kwaliteit van leven slecht in te schatten is door medici. Hoe dit bij volwassenen zit, is onbekend. Om slechte inschattingen te voorkomen zou ervoor kunnen worden gekozen gevalideerde vragenlijsten te gebruiken om de kwaliteit van leven te monitoren. Hiervoor zouden verschillende gevalideerde coeliakie-specifieke vragenlijsten gebruikt kunnen worden, zoals de Nederlandse 27-delige vragenlijst CeliacQ-27 of de kortere versie CeliacQ7 (Burger, 2019). Engelstalig is de coeliakie-specifieke Quality of Life Scale (CD-QoL) beschikbaar (Dorn, 2010). Bij kinderen kan gebruik gemaakt worden van de gevalideerde, in Nederland ontwikkelde CDDUX (van Doorn, 2008).
Uit de praktijk blijkt dat patiënten die beter geïnformeerd zijn over coeliakie en het glutenvrij dieet vaak minder klachten en hiermee een hogere kwaliteit van leven ervaren. De praktijk en wetenschappelijke literatuur laat zien dat patiënten regelmatig klachten blijven houden door (onbewuste) gluteninname.
Onderbouwing
Achtergrond
Het glutenvrij dieet is de enige mogelijke behandelmethode voor patiënten met glutengerelateerde aandoeningen. Door behandeling van de ziekte verdwijnen klachten veelal of grotendeels, waardoor patiënten zich beter voelen en hun kwaliteit van leven toeneemt. Anderzijds wordt er in de praktijk gemerkt dat er veel patiënten zijn die, ondanks glutenvrij dieet, toch klachten blijven ervaren. Dit staat nog los van het feit dat het volgen van een glutenvrij dieet de nodige zorgen en beperkingen met zich meebrengt. Het is dan ook niet ongebruikelijk dat dit verlies van kwaliteit van leven met zich meebrengt.
Conclusies / Summary of Findings
|
very low GRADE |
Quality of life The evidence is very uncertain about the effect of following a gluten-free diet on quality of life in both pediatric and adult patients with celiac disease.
Sources: Chellan, 2019; Nordyke, 2013; Burger, 2017; Choung, 2018; Deepak, 2018 |
Samenvatting literatuur
Description of studies
Studies in children
Chellan (2019) performed a prospective follow-up study to evaluate the impact of coeliac disease (CD) on psychosocial parameters in children. A total of 60 pediatric patients were enrolled in this study (mean age 6.03 ± 0.42 years, 32% girls). Children with symptoms suggestive of CD and elevated tissue transglutaminase were included. CD was diagnosed on the basis of standard European Society for Paediatric Gastroenterology Hepatology and Nutrition (ESPGHAN) criteria. Follow-up was conducted after 6 months of gluten-free diet (GFD). Both the generic (PSC) and disease-specific questionnaires were used to assess the QoL in children with CD. Baseline assessment of a child’s psychosocial parameters was performed with the help of the PSC questionnaire. Each PSC item was rated never: 0, sometimes: 1, and often: 2. The total score was calculated and recorded as a dichotomous variable. PSC scores of 28 or higher for children aged >6 years and 24 or higher for children between 2 and 6 years of age were considered to be emotional and psychosocial impairment. The CD-specific questionnaire included questions on barriers to dietary compliance and parental behavior and perceptions. The effect of CD and GFD on the feelings of children with respect to friends, school, or teachers; feelings about following special GFD; and difficulty in determining if food available at various places like schools, supermarkets, or restaurants was gluten free were also included in the questionnaire. The feelings of the child and the difficulty faced by him or her to determine whether food available was free from gluten was expressed as all the time, most of the time, sometimes, or never, and children falling in each category were expressed numerically and by percentages. A total of 16 children were lost to follow-up, resulting in a sample of 44 children at 6 months follow-up.
Nordyke (2013) performed a nested case-referent study to investigate the health-related quality of life (HRQoL) of adolescents with screening detected CD. A total of 144 adolescents with screening-detected CD and 828 referents without CD who participated in the same screening were included in this study. Adolescents were about 12 years old at the time of the screening, and 54% of the patients were girls. The adolescents reported their HRQoL at the time of the screening and 1 year after the cases received their diagnosis. HRQoL was assessed with a Swedish child-friendly pilot version of the EQ-5D instrument (EQ-5D). The EQ-5D is a generic tool used to measure health status and report HRQoL. It is comprised of two parts, the EQ-5D descriptive system where respondents classify their health status in five dimensions: mobility, self-care, usual activities, pain/discomfort, and anxiety/depression and on level of severity (no problems, moderate problems, or severe problems). The second part of the EQ-5D is a thermometer like visual analogue scale (VAS) where respondents score their health today from worst to best imaginable (0–100). A total of 103 adolescents had data at baseline and follow-up.
Studies in adults
Burger (2017) performed a systematic review and meta-analysis to assess the effect of gluten free diet on HRQoL in CD patients. The databases PubMed, EMBASE, CINAHL, PsycINFO and The Cochrane Library were searched from January 1960 to 30 September 2015. Studies that met the following inclusion criteria were included: 1) assessed HRQoL using validated questionnaires; 2) participants were above 16 years of age; 3) coeliac disease was confirmed by biopsy; 4) compared HRQoL in patients and non-coeliac controls, before and after gluten-free diet initiation or between subgroups of treated patients (disease-specific questionnaires only). A total of 18 studies reporting on HRQoL in coeliac disease were included in the review and ultimately 16 articles were suitable for meta-analysis. We are only interested in studies comparing HRQoL before and after the introduction of GFD. A total of eight studies with 998 patients were included, providing prospective data on the effect of a gluten-free diet.
Choung (2018) performed a longitudinal study to compare quality of life before and after institution of a GFD. A total of 130 patients with CD were included in the study, 8 patients were lost to follow-up resulting in a sample of 122 patients (mean age 45.0 ± 14.9 years, 67% female). Of these patients, 62 had classical CD (mean age 44.7 ± 15.5 years, 69.4% female) and 60 had nonclassical CD (mean age 45.4 ± 14.4 years, 65.0% female). To classify the classical and nonclassical phenotypes of CD, clinical evaluations and the self-report bowel disease questionnaire were used. Classical phenotype was defined by patients who had watery diarrhea, steatorrhea, or weight loss at the time of diagnosis. Those who did not have these classical symptoms were categorized as having nonclassical CD. Confirming diagnosis of CD was based on the positive serology and intestinal mucosal histology —increased intraepithelial lymphocytes and/or mucosal villous atrophy in the proximal small intestine. Quality of life was assessed with the 36-item Short Form Survey Instrument at the time of diagnosis and after following a GFD. The mean duration of GFD was 6.7 ± 3.7 years.
Deepak (2018) performed a single center prospective follow-up study to assess quality of life in patients with CD. A total of 60 patients with CD were included in this study (mean age 28.85 ± 12.43 years, 44% female). CD was diagnosed according to the standard ESPGHAN Guidelines. Quality of life of the patients was assessed using SF-12 and CD-QOL questionnaires. The SF-12 questionnaire comprises composite scores in eight domains: general health, physical functioning, social functioning, physical and emotional role functioning, vitality, bodily pain and mental health, and yields a physical health composite score (PCS) and a mental health composite score (MCS). The scale scores were calculated by summing the responses and then transformed into a 0–100 scale, with a higher score indicating better health. The CD-QOL questionnaire consists of 20 items across four clinically relevant subscales that are to be answered using a Likert scale. These include the health-concern subscale, the inadequate treatment subscale, the dysphoria subscale, and the limitations subscale. The overall score is expressed on a scale of 0–100, with a higher score indicating poorer health. Quality of life was assessed before starting GFD and after 6 months of GFD. one patient was excluded as his endoscopic and histopathological features were not consistent with CD.
Results
Studies in children
Two studies described quality of life (QoL) in children with CD before and after following a GFD (Chellan, 2019; Nordyke, 2013). Chellan (2019) used both the generic (PSC) and disease-specific questionnaires to assess QoL and Nordyke (2013) used a child-friendly pilot version of the EQ-5D.
Chellan (2019) reported that median PSC scores improved from 11.5 (2 to 35) before starting GFD to 2.5 (0 to 34) after 6 months of GFD.
Nordyke (2013) reported that the cases for all dimensions of the EQ-5D were lower after 1 year GFD than at baseline, except for the anxiety/depression dimension. For the mobility dimension, 3/103 (2.9%) patients had problems at baseline, compared to 1/103 (1.0%) at follow up. For the self-care dimensions, there were no problems at both baseline and follow-up. A total of 3/103 (2.9%) had problems with activity at baseline, compared to 2/102 (1.9%) at follow-up. For the pain dimension, 21/102 (20.4%) patients had problems at baseline, compared to 13/103 (12.6%) patients at follow-up. Finally, 13/103 (12.6%) patients had problems with anxiety/depression at baseline, compared to 15 (14.6%) patients at follow-up. In total, 40/103 (38.8%) children had problems for one or more of the dimensions at baseline, compared to 31/103 (30.1%) at follow-up. The RR is 1.29 (95%CI 0.88 to 1.89). This is a clinically relevant difference.
Studies in adults
Three studies described QoL in adults with CD before and after following a GFD, of which one systematic review (Burger, 2017) and two additional studies (Choung, 2018; Deepak, 2019). The systematic review by Burger (2017) included eight studies, of which four studies used the Psychological General Well-Being (PGWB) questionnaire and four other studies used the 36-Item Short Form Survey (SF-36) to assess QoL. Choung (2018) also applied the SF-36 survey and Deepak (2019) used the 12-Item Short Form Survey (SF-12) and a CD-QOL questionnaire.
Burger (2017) reported that QoL improved after 1 year GFD. They reported a pooled effect from four studies (n=846) with a mean difference of 7.34 (95%CI 1.96 to 12.72) between baseline and 1 year follow-up for PGWB total. For SF-36 MCS (n=152), the mean difference was 7.37 (95%CI 1.84 to 12.90) and the mean difference for SF-36 PCS (n=152) was 5.72 (95%CI 1.50 to 9.95).
Choung (2018) reported that QoL improved after 1 year GFD in both patients with classical CD and non-classical CD. At baseline, mean SF-36 PSC was 43.5 ± 10.8 for the classical group of patients and 46.5 ± 11.1 for the nonclassical group, compared to 48.0 ± 9.8 and 48.0 ± 10.1 after 1 year GFD. Mean SF-36 MSC was 44.3 ± 11.2 for the classical group and 49.8 ± 9.4 for the nonclassical group at baseline, compared to 48.2 ± 12.1 (classical) and 53.3 ± 8.5 (nonclassical) after 1 year GFD.
Deepak (2018) reported a mean SF-12 PCS of 37.2 ± 11.1 at baseline, compared to 50.3 ± 9.9 after 6 months GFD. The mean difference in score before and after initiation of GFD was 8.30 (95%CI 5.16 to 11.44). Mean SF-12 MSC was 41.9 ± 8.4 at baseline, compared to 50.2 ± 9.0 after 6 months GFD. The mean difference was 13.10 (95%CI 9.30 to 16.90). These differences are clinically relevant.
Median QoL as measured by the CD-QoL was 54.5 (range 26 – 73) at baseline, compared to 48 (24 – 48) after 6 months GFD.
The pooled effect from four studies for QoL as assessed by the PGWB questionnaire before and after initiation of GFD was 7.34 (95%CI 1.96 to 12.72). QoL was better after initiation of GFD (Figure 1), this difference in not clinically relevant.
The pooled effect from five studies for QoL as assessed by the SF-36 questionnaire before and after initiation of GFD was 6.57 (95%CI 2.12 to 11.03) for the mental health composite score, and 5.09 (95%CI 1.72 to 8.45) for the physical health composite score. QoL was better after initiation of GFD (Figure 1). This difference is clinically relevant.
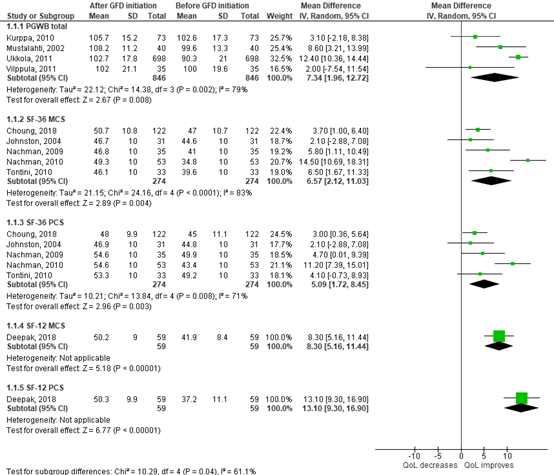
Figure 1. Pooled mean difference in health-related QoL before and after initiation of GFD.
Level of evidence of the literature
The evidence came from observational studies and starts at a low quality. The level of evidence was downgraded to very low because of risk of bias (loss-to-follow-up) and imprecision (crossing the border of clinical relevance).
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and harms of following a gluten-free diet on the quality of life in patients with coeliac disease, compared to no gluten-free diet?
P (patients) Children and adults with celiac disease
I (intervention) Gluten-free diet
C (control) No gluten-free diet
O (outcome) Quality of life
Relevant outcome measures
The guideline working group considered quality of life (QoL) as a critical outcome measure for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group defined the GRADE standard limit of 25% difference for dichotomous outcomes (RR <0.8 or >1.25) and 0.5 SD for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from 1 January, 2000 until 9 March, 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 297 hits. Studies assessing quality of life before and after initiation of a gluten-free diet within the same person were included. A total of 39 studies were initially selected based on title and abstract screening. After reading the full text, 11 studies were included, and 28 studies were excluded (see the table with reasons for exclusion under the tab Methods). Of the included studies, two studies were performed in children and nine studies in adults. One of the studies in adults was a systematic review (Burger, 2017), which included six of the studies that we initially included. Therefore, our final inclusion consisted of five studies: two studies in children and three studies in adults (one systematic review plus two additional studies).
Results
A total of five of studies were included in the analysis of the literature, of which one systematic review and three observational studies. Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Allen, B., & Orfila, C. (2018). The Availability and Nutritional Adequacy of Gluten-Free Bread and Pasta. Nutrients, 10(10), 1370.
- Barrio J, Cilleruelo ML, Román E, Fernández C. Health-related quality of life in Spanish coeliac children using the generic KIDSCREEN-52 questionnaire. Eur J Pediatr 2018;177(10):1515-22.
- Benelli E, Carrato V, Martelossi S, Ronfani L, Not T, Ventura A. Coeliac disease in the ERA of the new ESPGHAN and BSPGHAN guidelines: a prospective cohort study. Arch Dis Child 2016;101(2):172-6.
- Biagetti C, Gesuita R, Gatti S, Catassi C. Quality of life in children with celiac disease: A paediatric cross-sectional study. Dig Liver Dis. 2015 Nov;47(11):927-32.
- Burger, J. P., de Brouwer, B., IntHout, J., Wahab, P. J., Tummers, M., & Drenth, J. P. (2017). Systematic review with meta-analysis: Dietary adherence influences normalization of health-related quality of life in coeliac disease. Clinical nutrition, 36(2), 399-406.
- Burger, J. P., van Middendorp, H., Drenth, J. P., Wahab, P. J., & Evers, A. W. (2019). How to best measure quality of life in coeliac disease? A validation and comparison of disease-specific and generic quality of life measures. European Journal of Gastroenterology & Hepatology, 31(8), 941-947.
- Canova, C., Rosato, I., Marsilio, I., Valiante, F., Zorzetto, V., Cataudella, G., ... & Zingone, F. (2021). Quality of Life and Psychological Disorders in Coeliac Disease: A Prospective Multicentre Study. Nutrients, 13(9), 3233.
- Chellan, D., Muktesh, G., Vaiphei, K., Berry, N., Dhaka, N., Sinha, S. K., ... & Kochhar, R. (2019). Effect of gluten?free diet and compliance on quality of life in pediatric celiac disease patients. JGH Open, 3(5), 388-393.
- Choung, R. S., Lamba, A., Marietta, E. V., See, J. A., Larson, J. J., King, K. S., ... & Murray, J. A. (2020). Effect of a gluten-free diet on quality of life in patients with nonclassical versus classical presentations of celiac disease. Journal of clinical gastroenterology, 54(7), 620-625.
- Deepak, C., Berry, N., Vaiphei, K., Dhaka, N., Sinha, S. K., & Kochhar, R. (2018). Quality of life in celiac disease and the effect of gluten?free diet. JGH open: an open access journal of gastroenterology and hepatology, 2(4), 124.
- Dorn, S. D., Hernandez, L., Minaya, M. T., Morris, C. B., Hu, Y., Leserman, J., ... & Drossman, D. A. (2010). The development and validation of a new coeliac disease quality of life survey (CD?QOL). Alimentary pharmacology & therapeutics, 31(6), 666-675.
- Grudeva, L. (2019). Gluten-Free Diet-Social burden and impact on the quality of life in adult patients-cases from practice. Journal of IMABAnnual Proceeding Scientific Papers, 25(3), 2689-2691.
- Hall, N. J., Rubin, G., & Charnock, A. (2009). Systematic review: adherence to a gluten?free diet in adult patients with coeliac disease. Alimentary pharmacology & therapeutics, 30(4), 315-330.
- Johnston, S. D., Rodgers, C., & Watson, R. G. (2004). Quality of life in screen-detected and typical coeliac disease and the effect of excluding dietary gluten. European journal of gastroenterology & hepatology, 16(12), 1281-1286.
- Nachman, F., del Campo, M. P., González, A., Corzo, L., Vázquez, H., Sfoggia, C., ... & Bai, J. C. (2010). Long-term deterioration of quality of life in adult patients with celiac disease is associated with treatment noncompliance. Digestive and Liver Disease, 42(10), 685-691.
- Nordyke, K., Norström, F., Lindholm, L., Stenlund, H., Rosén, A., & Ivarsson, A. (2013). Health-related quality of life in adolescents with screening-detected celiac disease, before and one year after diagnosis and initiation of gluten-free diet, a prospective nested case-referent study. BMC public health, 13(1), 1-7.
- Mager DR, Marcon M, Brill H, Liu A, Radmanovich K, Mileski H, Nasser R, Alzaben A, Carroll MW, Yap J, Persad R, Turner JM. Adherence to the Gluten-free Diet and Health-related Quality of Life in an Ethnically Diverse Pediatric Population With Celiac Disease. JPGN 2018 Jun;66(6):941-8.
- Marsilio, I., Canova, C., DOdorico, A., Ghisa, M., Zingone, L., Lorenzon, G., ... & Zingone, F. (2020). Quality-of-life evaluation in coeliac patients on a gluten-free diet. Nutrients, 12(10), 2981.
- Myléus A, Petersen S, Carlsson A, Hammarroth S, Högberg L, Ivarsson A. Health-related quality of life is not impaired in children with undetected as well as diagnosed celiac disease: a large population based cross-sectional study. BMC Public Health. 2014 May 5;14-425.
- Sainsbury, A., Sanders, D. S., & Ford, A. C. (2013). Prevalence of irritable bowel syndrometype symptoms in patients with celiac disease: a meta-analysis. Clinical Gastroenterology and Hepatology, 11(4), 359-365.
- Vriezinga SL, Farih N, van der Meulen-de Jong AE, Putter H, Rings EHHM, Schaart MW, Schweizer JJ, Wessels MMS, Mearin ML. Comparison of Patients' and Doctors' Reports on Health-related Quality of Life in Celiac Disease. JPGN 2017;64(5):737-41.
- Van De Water, J. M., & Mulder, C. J. (2009). Assessment of quality of life. Nature Reviews Gastroenterology & Hepatology, 6(4), 204-205.
- van Doorn, R. K., Winkler, L. M., Zwinderman, K. H., Mearin, M. L., & Koopman, H. M. (2008). CDDUX: a disease-specific health-related quality-of-life questionnaire for children with celiac disease. Journal of pediatric gastroenterology and nutrition, 47(2), 147-152.
- Wahab, P. J., Meijer, J. W., & Mulder, C. J. (2002). Histologic follow-up of people with celiac disease on a gluten-free diet: slow and incomplete recovery. American journal of clinical pathology, 118(3), 459-463
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-06-2023
Beoordeeld op geldigheid : 19-02-2023
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. P. Wahab, MDL-arts in Rijnstate Ziekenhuis Arnhem, NVMDL (voorzitter)
- Prof. Dr. G. Bouma, MDL-arts in Amsterdam UMC, locatie VUmc, NVMDL (voorzitter)
- Prof. Dr. M.L. Mearin-Manrique, kinderarts-MDL in het LUMC, NVK (voorzitter)
- Dr. Abdul Al-Toma, MDL-arts in St. Antonius Ziekenhuis Utrecht , NVMDL (voorzitter, afgetreden in mei 2020)
- Prof. Dr. C.J.J. Mulder, MDL-arts in Amsterdam UMC, NVMDL
- Dr. T. van Gils, AIOS-MDL in Amsterdam UMC, NVMDL
- Dr. M.M.S. Wessels, kinderarts-MDL in Rijnstate Ziekenhuis Arnhem, NVK
- Drs. C.R. Meijer-Boekel, kinderarts-MDL in LUMC, NVK
- Prof. Dr. J.W.M. Muris, huisarts, Universiteit Maastricht, NHG
- Drs. E.A. Neefjes - Borst, patholoog in Amsterdam UMC, NVVP
- Dr. H.J. Bontkes, laboratorium specialist medische Immunologie, Amsterdam UMC, NVVI
- Drs. M. Beukema, internist-intensivist in Streekziekenhuis Koningin Beatrix, NIV
- Prof. Dr. B. Horváth, dermatoloog in UMC Groningen, NVDV
- Drs. S. Neve, dermatoloog in Dijklander Ziekenhuis, NVDV
- Drs. T. Holtackers-Dumay, kinder- en jeugdpsycholoog in St. Anthonius ziekenhuis, NIP
- L.J. Bosch, MSc, diëtist en eigenaar bij ‘Voeding voor jou,’ NVD
- G. Herweijer, MSc, diëtist in ‘Voeding + Advies’, ervaringsdeskundige, NCV
- F.W.P.C. van Overveld, MSc, directeur NCV
Klankbordgroep
- Dr. R. de Jongh, internist in het Amsterdam UMC, NIV
- Dr. A.F.J.E. Vrancken, neuroloog in het UMC Utrecht, NVN
- Dr. B.P.C. van de Warrenburg, neuroloog in het Radboudumc, NVN
Met ondersteuning van:
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2020)
- Dr. A. Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. M. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2022)
- Dr. E.V. van Dorp-Baranova, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard dat zij in de laatste drie jaar geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bouma* |
MDL arts, Amsterdam UMC, hoogleraar inflammatoire aandoeningenvan de tractus digestivus Directeur research instituut Amsterdam Gastroenterology, Endocrinology and Metabolism, AMsterdam UMC Plaatsvervangend opleider MDL, AMsterdam UMC, locatie Vumc |
Nationale en internationale bestuurs- en werkgroepfucties: Voorzitter Stichting Gastrostart NVGE 2019-2022 (onbetaald) Voorzitter landelijke Werkgroep Autoimmuun Hepatitis 2017-2022 (onbetaald) Lid van het Scientific Committee, dr. Schär Nutrition (onbetaald) Lid van de wetenschappelijke adviesraad van de Nederlandse Coeliakie Vereniging (onbetaald) National representative in de Council van de United European Gastroenterology, 2013-2015 (onbetaald) Lid van de wetenschappelijke adviesraad van de Maag Lever Darmstichting (onbetaald)
Adviesraden: 2019 Advisory Board Takeda International (eenmalig, betaald) 2019 Nascholing IBD, financieel mogelijk gemaakt door Takeda (eenmalig, betaald) 2019 Advisory Board Roche International (eenmalig, betaald) 2020 Advisory Board Calypso Biotech (eenmalig, onbetaald) 2021 Advisory Board Alimentiv (eenmalig, onbetaald) 2022 Nascholing IBD, financieel mogelijk gemaakt door Janssen Pharmaceuticals (eenmalig, betaald) - Clinical trials op het gebied van coeliakie: S.I. Cellimmune-AMGEN clinical trial (NCT02633020) P.I. Provention clinical trial (NCT04424927) P.I. Calypso clinical trial (NCT04593251) P.I. Tofacitinib for refractory celiac disease (Eudract 2018-001678-10)
Daarnaast P.I. en S.I. op diverse klinische trials op het gebied van IBD (contract research); PI op investigator initiated studies op het gebied van IBD, autoimmuun hepatitis en coeliakie. |
Zie onder nevenwerkzaamheden: Financier: MLDS, inh onderzoek: onderzoek naar de lymfoomontwikkeling bij coeliakie, rol als PL: ja inh: onderzoek naar de verbetering van diagnostiek van coeliakie. Rol PL: nee. Inh: MLDS. Onderzoek naar de rol van MTX bij IBD. Rol PL: ja. MLDS: inh: onderzoek naar voorspellers van exacerbatie van IBD. Rol PL: nee. KWF/coeliakievereniging PFizer (in kind). Inh: Rol van tofacitinib in de behandeling van refractarie coeliakie. Rol PL: nee |
Geen |
|
Wahab* |
MDL arts, Rijnstate Ziekenhuis Rijstate |
Lid ZonMw commissie EEK; vacatiegeld Lid Regionaal Tuchtcollege Zwolle; vacatiegeld; Lid wetenschappelijke advies raad Nederlandse Coeliakie Vereniging, onbetaald |
Geen |
Geen |
|
Mearin-Manrique* |
Kinderarts-MDL, afdeling Kindergeneeskunde Leids Universitair Mediach Centrum (LUMC) |
Lid Medisch Advies Raad Ned. Coeliakie Vereniging: onbetaald Lid Public Affair Committee European Society Pediatric Gastroenterology Hepatology and Nutrition (ESPGHAN): onbetaald Secretaris werkgroep Coeliakie ESPGHAN:onbetaald |
Financier: Thermo Fisher. Inh onderz: PreventCD (Prevention of Coeliac Disease) Rol PL: ja Fin: BioHit. Inh onderzoek: GLUTENSCREEN (Early detection of coeliac disease). Rol PL: ja |
Geen |
|
Al-Toma* (afgetreden als voorzitter in 2020) |
MDL-arts in St. Antonius Ziekenhuis Utrecht |
Geen |
Geen |
Geen |
|
Van Gils |
(AIOS) maag-, darm- en leverziekten in het Amsterdam UMC. |
Geen |
Geen |
Geen |
|
Mulder |
Werkgroep HEG Stoolbanking 2018 -2020 (onbetaald) Consultant HLW voor Thiosix 2018 - 2020 4-8 uur per week Begeleider 4 Promovendi VU 2019 - 2020 (onbetaald) MCV de Veluwe 2 dagen poli/endoscopiie/week (betaald) |
Geen |
Geen |
Geen |
|
Wessels |
Kinderarts MDL – Rijnstate Ziekenhuis Arnhem |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging - onbetaald |
Geen |
Geen |
|
Meijer |
Kinderarts MDL-LUMC 0,8 FTE lid Special Interest Group (SIG) ESPGHANon celiac disease |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging ‐ onbetaald |
Geen |
Geen |
|
Muris |
Hoofd vakgroep Huisartsgeneeskunde, Universiteit Maastricht |
Huisarts in Geulle, vergoeding |
Geen |
Geen |
|
Neefjes-Borst |
Patholoog, Amsterdam UMC |
Onbetaald: werkgroep protocollen van PALGA |
Geen |
Geen |
|
Bontkes |
Laboratorium specialist Medische Immunologie en hoofd laboratorium medische immunologie van het AmsterdamUMC, locatie VUmc |
Bestuurslid van de SKML sectie humorale immunologie (onbetaald) Coördinator SKML rondzending "coeliakie" (onbetaald, onkostenvergoeding voor het laboratorium). Lid van de Nederlandse sectie van het European Autoimmunity Standardisation Initiative (EASI) (onbetaald) |
Geen |
Geen |
|
Beukema |
lnternist-intensivist/acute geneeskunde, Santiz Streekziekenhuis Koningin Beatrix Winterswijk |
Adviescommissie GE (NIV) |
Geen |
Geen |
|
Horváth |
Dermatoloog, Afdelingshoofd Afdeling Dermatologie, Centrum voor Blaarziekten Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen |
|
Neve |
Dermatoloog bij Dijklanderziekenhuis te Hoorn voor 0,65 FTE |
Visiteur kwaliteitscommissie NVDV. Onkostenvergoeding Leo Pharma dermatologie adviesraad |
Geen |
Geen |
|
Holtackers |
GZ-psycholoog, kindergeneeskunde, St. Antonius Ziekenhuis (24 uur) medische psychologie; GZ-psycholoog, kinder- & jeugd & volwassenen, GGZ eigen praktijk (Psychologiepraktijk Samenspel Utrecht) |
Lesgeven (sociale vaardigheidstraining) aan beroepskrachten Rino Utrecht (aantal cursusdagen per jaar), betaald |
Geen |
Geen |
|
Bosch |
Diëtist en eigenaar bij 'Voeding voor jou' |
Op social media en online ben ik bekend als de glutenvrije diëtist en verkoop ik online programma’s om zelfverzekerd en gezond glutenvrij te leven. Daarnaast ben ik vrijwilliger bij de Nederlandse Coeliakie Vereniging en werk ik samen met de Vlaamse Coeliakie Vereniging.
|
Dienstverband bij een diëstistenbedrijf dat opereert op het gebied waar de richtlijn zich op richt. Eigendom van online informatieproducten over coeliakie en het glutenvrij dieet. |
Geen |
|
Herweijer |
Diëtist en praktijkeigenaar diëtistenpraktijk Voeding + Advies |
Vrijwilliger en waarneming bij afwezigheid van de diëtist voor de Nederlandse Coeliakie Vereniging |
Geen |
Geen |
*voorzitter richtlijncommissie
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Nederlandse Coeliakie Vereniging (NCV) voor de invitational conference, afvaardiging van deze patiëntenvereniging in de werkgroep en betrekken van patiëntenvertegenwoordigers bij het ontwikkelen van Thuisarts-situaties. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘waarden en voorkeuren van patienten’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de NCV als ook aan de Patientenfederatie Nederland en de eventueel aangeleverde commentaren zijn verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module 1a Serologische diagnostiek bij volwassenen
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1b Positieve serologie bij een normaal biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1c Negatieve serologie bij een afwijkend biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1d Serologische diagnostiek bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1e Glutenbelasting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2a Gezondheidseffecten van GVD op lange termijn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2b GVD en kwaliteit van leven |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2c Vitaminen- en mineralendeficiënties tijdens GVD
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Glutensensitiviteit zonder coeliakie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4a Monitoring van coeliakie bij volwassenen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4b Monitoring van coeliakie bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 Randvoorwaarden (Organisatie van zorg) |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met coeliakie en glutengerelateerde aandoeningen. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van NVMDL, V&VN, NAPA, NVK, NCV, NHG en NIP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
