Gezondheidseffecten van GVD op lange termijn
Uitgangsvraag
Wat zijn de gezondheidseffecten op lange termijn van het wel of niet aanhouden van een (strikt) glutenvrij dieet?
Aanbeveling
Adviseer een levenslang strikt glutenvrij dieet bij alle patiënten (kinderen en volwassenen) met coeliakie, gezien het positieve effect op de gezondheid.
Een glutenvrij dieet wordt ook bij asymptomatische coeliakie aanbevolen. Een periode van minimaal 6 maanden wordt aanbevolen voor alle ogenschijnlijk asymptomatische patiënten om het effect op (subklinische) symptomen en kwaliteit van leven te evalueren.
De mate van te verwachten gezondheidswinst dient afgewogen te worden tegen de belasting van een strikt levenslang glutenvrij dieet. Deze beslissing dient te worden genomen samen met de patiënt (en eventueel ouders/verzorgers) na goede uitleg van de overwegingen ten aanzien van risico’s op maligniteit, infertiliteit, effecten op botmetabolisme en deficiënties, en bij kinderen ook op groei en ontwikkeling.
Een glutenvrij dieet bij mensen zonder aangetoonde coeliakie wordt niet aanbevolen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Een levenslang glutenvrij dieet is momenteel de enige behandeling voor coeliakie. Strikte naleving van een glutenvrij dieet leidt tot de verbetering van symptomen en, indien aanwezig, tekenen van malabsorptie en daarnaast gedeeltelijke - zo niet volledige - genezing van de dunne darm mucosa. De voordelen van een glutenvrij dieet zijn evident bij patiënten met symptomatische coeliakie. Een deel van de patiënten wordt echter gediagnosticeerd zonder dat zij klachten hebben, bijvoorbeeld op basis van familiescreening of door manifestaties die zelf geen aanleiding geven tot klachten. Bij asymptomatische patiënten, en bij mensen met potentiële coeliakie (d.w.z. patiënten met positieve antistoffen maar (nog) geen mucosale schade) zijn deze voordelen minder duidelijk en vaak lastig te beargumenteren. Ten aanzien van de vraagstelling wat de gezondheidseffecten op lange termijn zijn van het wel of niet volgen van een glutenvrij dieet doet zich dan ook een aantal vragen voor die klinisch relevant zijn en frequent door patiënten worden gesteld:
- Heeft het volgen van een glutenvrij dieet gunstige effecten bij mensen met coeliakie zonder klachten?
- Heeft het niet volgen van een strikt glutenvrij dieet schadelijke lange termijn effecten?
- Heeft het volgen van een glutenvrij dieet bij mensen zonder coeliakie gunstige of schadelijke effecten?
Daar waar er veel onderzoek is gedaan naar de diagnostiek van coeliakie, zijn er weinig prospectieve studies van goede kwaliteit die deze vragen eenduidig beantwoorden. Hier is sprake van een duidelijk kennishiaat. De bovenstaande vragen kunnen dan ook veelal niet evidence-based beantwoord worden en alleen worden beargumenteerd op basis van grotendeels retrospectieve observaties en extrapolaties. In onderstaande is deze literatuur samengevat.
Alvorens bovenstaande vragen te beantwoorden is het belangrijk na te gaan wat volledig glutenvrij betekent. Veel producten, ook die met het label glutenvrij kunnen sporen van gluten bevatten. De term "glutenvrij" verwijst dus in het algemeen naar een hoeveelheid gluten waarvan wordt gedacht dat het onschadelijk is en impliceert dus niet totale afwezigheid van gluten. Twee systematische reviews hebbende onderzoeken samengevat met betrekking tot een veilige drempel voor dagelijkse gluteninname (Hischenhuber, 2006; Akobeng, 2008). De resultaten van deze systematische reviews laten zien dat er niet één definitieve drempel voor gluteninname is, maar dat het onwaarschijnlijk is dat een dagelijkse inname van <10 mg slijmvliesafwijkingen veroorzaakt, en dat de ondergrens voor veilige gluteninname ligt tussen de 10 en 20 mg/dag.
- Heeft het volgen van een glutenvrij dieet gunstige effecten bij mensen met coeliakie zonder klachten?
Effect op symptomen
Deze vraag is onderzocht in een prospectieve studie onder ruim 3000 familieleden met coeliakie (Vilppula, 2011). Vijf procent (n=148) had positieve antistoffen. Veertig hiervan werden gerandomiseerd tussen een glutenvrij dieet en continueren van het glutenbevattende dieet. In de groep op een glutenvrij dieet namen gastrointestinale klachten af, en ook het overall welbevinden, gebaseerd op een visueel analoge schaal, was beter dan in de groep die gluten bleef eten. Daar tegenover stond dat de sociale functiescores meer verbeterden in de groep die gluten bleef eten. Er waren geen verschillen tussen de groepen in laboratorium testresultaten, botmineraaldichtheid of lichaamssamenstelling.
Deze studie is in lijn met een niet gecontroleerde studie uit 2011 waar 35 patiënten die waren gediagnosticeerd in een screeningsprogramma startten met een glutenvrij dieet (Vilppula, 2011). Ook in deze studie werd een verbetering van gastro-intestinale symptomen waargenomen, hoewel de patiënten bij de diagnose geen of slechts subtiele symptomen meldden. Patiënten hadden aanvankelijk gemiddeld lagere serum-ferritinewaarden wat duidt op subklinische ijzerdeficiëntie, wat snel herstelde op een glutenvrij dieet. Vitamine B12, vitamine D en foliumzuur stegen ook significant na start van het dieet. De score voor kwaliteit van leven bleef onveranderd in deze studie.
Effect op vlokatrofie
Hoewel een glutenvrij dieet over het algemeen tot klinische en mucosale verbetering leidt, kunnen mucosale afwijkingen blijven bestaan, zonder dat zij aanleiding geven tot klinisch manifeste malabsorptie of andere symptomen. Dit gebeurt in een significant deel van de patiënten. Zo lieten Rubio-Tapia et al. (2010) zien dat twee jaar na het starten van een GVD mucosaal herstel was opgetreden in slechts 35% (Rubio-Tapia, 2010). Dit percentage steeg naar 66% na vijf jaar. Klinisch verbeterde echter 82%. Een meta-analyse onder kinderen (n=7 onderzoeken) en volwassenen (n=8 onderzoeken) toonde aan dat het percentage volledig mucosaal herstel bij kinderen (0,65; 95% BI 0,44 tot 0,85) hoger was dan bij volwassenen (0,24; 95 % CI 0,15 tot 0,33). Hieruit kan worden geconcludeerd dat mucosaal herstel bij lang niet alle patiënten optreedt ondanks een (anamnestisch) strikt glutenvrij dieet en dat symptomatologie niet noodzakelijkerwijs gerelateerd is aan de mate van herstel van vlokatrofie.
BMI
Een meta-analyse van 14 studies (onder 2,828 deelnemers) liet toename van de BMI zien na het starten van een glutenvrij dieet, waarbij de toename het sterkst was in de eerste 2 jaar na de start van het glutenvrij dieet, om daarna af te vlakken (Nikniaz, 2019). Stijging van de BMI heeft een gunstig effect bij patiënten met coeliakie en ondergewicht.
- Heeft het niet volgen van een strikt glutenvrij dieet schadelijke lange termijn effecten?
Effect op mortaliteit
Studies onder patiënten met gediagnosticeerde coeliakie laten een licht verhoogde mortaliteit en risico op sommige maligniteiten zien, met name gastro-intestinale maligniteiten en non-Hodgkin-lymfoom (Tio, 2012). Er bestaan echter weinig gegevens over niet gediagnosticeerde coeliakie.
De meeste studies vonden geen verhoogde overall mortaliteit bij niet gediagnosticeerde patiënten (Canavan, 2011; Lohi, 2009a; Choung, 2017; Godfrey, 2010; Lohi, 2009b). Ook de meest recente studie (Kårhus, 2020), in een Deens cohort van 16.776 personen in de periode 1976-2012, liet geen verhoogde overall mortaliteit zien. Andere studies daarentegen vonden wel een verhoogde overall mortaliteit (Rubio-Tapia, 2009; Metzger, 2006; Rubio-Tapia, 2016). De vraag ten aanzien van mortaliteit kan ook nog op een andere wijze benaderd worden, namelijk onder patiënten die geen volledig mucosaal herstel laten zien. Deze vraag is onderzocht in een Zweeds cohort van 7,648 patiënten. Van degenen die een follow-up biopsie ondergingen, was persisterende vlokatrofie aanwezig bij 3,317 (43%). Er waren 606 (8%) sterfgevallen en dit risico op overlijden was niet verhoogd in vergelijking met patiënten met volledig mucosaal herstel (HR 1,01; 95% BI: 0,86-1,19). Subgroep analyse liet zien dat de mortaliteit niet was verhoogd bij kinderen (HR 1,09 95% BI: 0,37-3,16) noch bij volwassenen (HR 1,00 95% BI: 0,85-1,18), of volwassenen ouder dan 50 jaar met persisterende vlokatrofie (HR 0,96 95% BI: 0,80-1,14).
Risico op het ontwikkelen van maligniteiten
De vraag of het risico op maligniteiten verhoogd is bij patiënten met coeliakie is al decennia onderwerp van onderzoek en controverse. Deze onderzoeken laten zien dat het risico op maligniteiten hoogstens marginaal verhoogd is. Zeer recent bevestigde een grote Zweedse studie onder 47.241 CD-patiënten deze conclusie. In dit cohort werd een zeer kleine toename van het kankerrisico aangetoond (HR = 1,11, 95% BI 1,07-1,15) in vergelijking met controles (Lebwohl, 2022). Dit verhoogde overall risico werd alleen gevonden bij patiënten gediagnosticeerd na de leeftijd van 40 jaar, en deze associatie was hoger in het eerste jaar na CD-diagnose (HR 2,47, 95% BI 2,22-2,74), en verdween wanneer het eerste jaar van follow-up niet werd meegenomen in de analyses. Voor hematologische en lymphoproliferatieve maligniteiten bleef het risico ook verhoogd na het eerste jaar. Ook een prospectieve studie in een cohort dat 24 jaar was vervolgd liet geen verhoogd kanker risico zien (Card, 2004).
De meest voorkomende maligniteiten die geassocieerd zijn met coeliakie zijn het non-Hodgkin lymfoom (om precies te zijn: het Enteropathy Associated T-cell lymfoom [EATL]) en het adenocarcinoom van de dunne darm. Belangrijk om de vermelden is dat de incidentie van deze tumoren extreem laag is; het EATL kent een incidentie van ongeveer 1 per miljoen (Verbeek, 2008), en die van het dunne darm adenocarcinoom nog lager (Pelizzaro, 2021). Of andere maligniteiten frequenter voorkomen bij coeliakie is nog steeds onderwerp van discussie.
De vraag is of het strikt naleven van een glutenvrij dieet het risico op het ontstaan van deze maligniteiten kan verminderen. Holmes et al. (1989) toonden in de jaren 80 van de vorige eeuw aan dat voor CD-patiënten die 5 jaar of langer een GVD hebben gebruikt, het risico op het ontwikkelen van kanker vergelijkbaar is met dat van de algemene bevolking (Holmes, 1989). Verschillende studies hebben sedertdien laten zien dat het risico op het ontwikkelen van lymfoproliferatieve maligniteiten hoger is bij non-adherente patiënten met vlokatrofie (Marsh-score 3) dan bij patiënten zonder vlokatrofie (Marsh-scores 1 en 2) (samengevat in Pelizzaro, 2021). Een glutenvrij dieet lijkt ook van invloed te zijn op het verminderen van het risico op dunne darm adenocarcinoom- en andere gastro-intestinale kankers. Elfström et al. (2012) toonden aan dat het risico op dunne darm carcinoom bij CD-patiënten afneemt, maar niet verdwijnt, na het eerste jaar van follow-up, waarschijnlijk omdat mucosale schade vermindert. Ook Emilsson et al. (2020) vonden een sterke maar niet-significante vermindering van het risico op dunne darm carcinoom bij patiënten met mucosaal herstel (HR 0,18, 95% BI 0,02-1,61).
Het effect van een GVD bij het voorkomen of verminderen van het risico op het ontwikkelen van maligniteiten is echter niet universeel bewezen. Slechte dieettrouw was niet significant geassocieerd met een verhoogd risico op maligne lymfoom in de studie van Olén (2011). Ook andere studies lieten geen overtuigend bewijs zien dat GFD het risico op maligne complicaties bij asymptomatische patiënten verder vermindert (Gao, 2009).
Samengevat kan op basis van de beschikbare literatuur geen een duidend antwoord gegeven worden op de vraag of non-adherentie aan het glutenvrij dieet het risico op maligniteiten, met name lymfomen en dunne darm carcinomen, verhoogt. Op theoretische gronden lijkt dit waarschijnlijk. Daarbij moet wel de zeer lage a priori kans op het ontwikkelen van deze maligniteiten meegenomen worden.
Cardiovasculair risico
Het cardiovasculair risico is onderzocht in enkele studies. In een serologische studie onder ruim 6000 personen met een leeftijd boven de 50 jaar testte 1,4% van de individuen postitief voor tTG antistoffen. Tijdens follow-up was de sterfte aan hart- en vaatziekten weliswaar de meest voorkomende doodsoorzaak bij patiënten, maar niet verhoogd ten opzichte van de achtergrondpopulatie (Rubio-Tapia, 2016). In de Deense studie van Kårhus (2020) was het risico wel significant verhoogd, met een Hazard Ratio van 1.37 (95% CI 1.01-1.86). Of de licht verhoogde BMI in deze groep, of andere factoren, hiervoor verantwoordelijk zijn is niet bekend.
Osteoporose
Osteoporose risico was significant verhoogd in een cohort van 47,557 personen, waarvan 408 met positieve antistoffen (Hujoel, 2018). Ook in een Australisch cohort onder personen van 55 tot 85 jaar kwam osteoporose significant vaker voor bij niet gediagnosticeerde coeliakie (odds ratio, OR 2.83, 95% BI 1.29 - 6.22) (Potter, 2018). De studie was niet voldoende gepowered om een uitspraak te kunnen doen of dit ook resulteerde in een verhoogd fractuurrisico tijdens een follow-up van gemiddeld 10 jaar.
Infertiliteit
Een meta-analyse naar het verband tussen niet-gediagnosticeerde CD bij personen met onvruchtbaarheid liet een significante associatie zien (OR 3,09; 95% BI: 1,74 tot 5.49) (Lasa, 2014). Dit is een klinisch relevant verschil. Vier case-control-onderzoeken (onder totaal 33,636 proefpersonen) lieten echter geen verschil zien in infertiliteit tussen CD-patiënten en controlepersonen (OR 0,99; 95% BI: 0,86 tot 1,13). Daarnaast hebben meerdere studies laten zien dat niet gediagnosticeerde coeliakie is geassocieerd met een verhoogd risico op spontane abortus en laag geboortegewicht (Ciacci, 1996; Martinelli, 2000).
Kwaliteit van leven
Een prospectieve Finse studie onder ruim 6oo patiënten liet zien dat patiënten die meer dan 3 jaar klachten hadden alvorens de diagnose werd gesteld een lagere kwaliteit van leven hadden (op basis van een gevalideerde vragenlijst) dan degenen die bij zie het interval korter was (Fuchs, 2018). Ook een Britse studie onder bijna 800 patiënten liet een sterke en significante verbetering van de kwaliteit van leven zien na het stellen van de diagnose (Gray, 2010). Een andere studie onder 483 adolescenten (waaronder 103 met niet-herkende coeliakie) daarentegen liet geen verschillen zien in Health Related Quality of Life (HR QoL) tussen degenen met niet gediagnosticeerde coeliakie en hun leeftijdsgenoten zonder CD. Dit gold zowel voor diagnose als een jaar na start van het glutenvrij dieet (Nordyke, 2013).
- Heeft het volgen van een glutenvrij dieet bij mensen zonder coeliakie gunstige of schadelijke effecten?
De meeste onderzoeken zijn van matige methodologische kwaliteit met lage aantallen patiënten. Een ongecontroleerde zeer kleine studie onder 47 Amerikaanse volwassenen met coeliakie die zich aan een glutenvrij dieet hielden, toonde aan dat de aanbevolen hoeveelheid calcium, ijzer en vezels werd geconsumeerd door 31%, 44% en 46% van de vrouwen en 63%, respectievelijk 100% en 88% van de mannen (Thompson, 2005). Twee aanvullende onderzoeken door dezelfde auteur lieten zien dat veel glutenvrije voedingsmiddelen niet verrijkt zijn en een tekort kunnen hebben aan verschillende voedingsstoffen, waaronder eiwit, voedingsvezels, foliumzuur, ijzer, niacine, riboflavine, en thiamine (Thompson, 2000; Thompson, 1999; Missbach, 2015). Andere onderzoeken naar de voedingssamenstelling van verwerkte glutenvrije producten laten hogere niveaus zien van lipiden, transvet, eiwit en zout in vergelijking met hun glutenbevattende tegenhangers (Mariani, 1998; Rea, 1996). Deze bevindingen laten zien dat een glutenvrij dieet niet per definitie gezond(er) is, zoals momenteel door velen wel wordt gedacht (zie ook de sectie over NCGS).
Of dit zich ook vertaalt naar klinisch relevante uitkomstparameters is slecht onderzocht. Een studie door Lebwohl en collega's (2017) onderzocht een grote groep mannen (n=45,303) en vrouwen (n=64,714) zonder coeliakie uit respectievelijk de Health Professionals Follow-Up Study en de Nurses' Health Study. Het doel was om vast te stellen of glutenconsumptie geassocieerd was met coronaire hartziekten. Gluteninname werd op basis van voedingsdagboeken gekwalificeerd als laag, middelmatig en hoog (Lebwohl, 2017). De auteurs vonden een omgekeerde relatie tussen gluteninname en het risico op coronaire hartziekte en fatale en niet-fatale hartinfarcten. Deze observatie leidde tot de hypothese dat dit veroorzaakt wordt door verminderde consumptie van volkorenproducten, waaronder een verminderde consumptie van vezels. Een recente systematische review evalueerde risicofactoren voor hart- en vaatziekten en hun mogelijke associatie met een glutenvrij dieet onder patiënten met coeliakie (Lebwohl, 2017). Hoewel deze onderzoekers consistente veranderingen vonden in 27 onderzoeken, waaronder verhogingen van totaalcholesterol, high-density lipoproteïne, nuchtere glycemie en lichaamsgewicht index werd geen aantoonbare toename gevonden in het risico op cardiovasculaire events. Het is belangrijk op te merken dat de meeste studies in dit review van lage methodologische kwaliteit waren die de conclusies van de analyse beperken.
Conclusie
Concluderend zijn er aanwijzingen dat start van een glutenvrij dieet ook zinvol is bij patiënten met coeliakie die geen duidelijke klachten hebben. Dit geldt met name voor verbetering van (subklinische) symptomen. Daarnaast zijn er aanwijzingen dat een glutenvrij dieet het risico op osteopenie/-porose vermindert, en is het percentage mensen met infertiliteit en gecompliceerde zwangerschappen hoger bij patiënten met niet behandelde coeliakie. Het risico op met name het non-Hodgkin lymfoom is verhoogd bij patiënten met coeliakie, maar of dat risico vermindert door behandeling met een dieet is nog niet duidelijk (Olén, 2011). Dit alles moet wel worden afgewogen ten opzichte de last dat het GVD voor de individuele patiënt met zich meebrengt. Er kan op basis van de huidige literatuur geen uitspraak worden gedaan of het volgen van een glutenvrij dieet bij mensen zonder coeliakie gezondheidswinst of-schade oplevert.
Waarden en voorkeuren van patiënten (en evt. hun verzorgers)
Een glutenvrij dieet leidt bij coeliakie bij de meeste patiënten tot verbetering van de symptomen. Er is dus weinig discussie over het nut van een glutenvrij dieet. Bovendien zijn er geen harde aanwijzingen dat een glutenvrij dieet, mits goed gevolgd, geen verantwoord alternatief is voor een gezond glutenbevattend dieet.
Bij veel patiënten leeft echter wel de angst wat de risico’s zijn indien het glutenvrij dieet niet strikt wordt gevolgd, of, indien er geen symptomen zijn, in het geheel niet wordt gevolgd. Deze zorg betreft met name lange termijn consequenties, waaronder het ontwikkelen van maligniteiten. Deze module tracht hierop een antwoord te geven. Zowel voor de lange termijn consequenties van het volgen van een strikt glutenvrij dieet, als het niet strikt volgen van een dieet zijn onvoldoende data van voldoende kwaliteit om deze vraag definitief te kunnen beantwoorden. Op basis van de beschikbare data zijn er echter geen aanwijzingen dat het glutenvrij dieet schadelijke effecten heeft die de overweging om het wel of niet starten ervan bij patiënten met coeliakie beïnvloedt. De vraag of het niet strikt volgen negatieve gezondheidsrisico’s heeft is minder eenduidig te beantwoorden. Op basis van de beschikbare data lijken deze echter minder uitgesproken dan vaak wordt aangenomen, met name ten aanzien van verhoogde mortaliteit en maligniteitontwikkeling.
Kosten (middelenbeslag)
Kosten van de GVD zijn hoog en kunnen de keuze om het wel of niet volgen van het GVD beïnvloeden.
Aanvaardbaarheid, haalbaarheid en implementatie
De werkgroep verwacht geen barrières voor de implementatie van de aanbevelingen.
Onderbouwing
Achtergrond
Het glutenvrij dieet (GVD) is de enige behandeling voor patiënten met glutengerelateerde aandoeningen. Bij patiënten leeft daarbij sterk de vraag of het schadelijk kan zijn als het GVD niet (strikt) gevolgd wordt. Omgekeerd is het ook de vraag of er, naast positieve, ook mogelijke negatieve lange termijn effecten van het GVD zijn, waar preventief op ingespeeld kan worden.
Conclusies / Summary of Findings
|
Low GRADE |
Mucosal recovery ratio
A proportion of coeliac patients may fail to achieve complete mucosal recovery even if a strict dietary regimen is followed.
Sources: Szakacs, 2017 |
|
Low GRADE |
Bone mineral density
Adherence to a gluten-free diet may improve bone mineral density in pediatric patients with coeliac disease over time.
Sources: Kalayci, 2001; Mora, 2001; Choudhary, 2017 |
|
Low GRADE |
Cardiovascular risk factors - BMI
Adherence to a gluten-free diet may increase BMI in patients with coeliac disease.
Sources: Nikniaz, 2019 |
|
Low GRADE |
Cardiovascular risk factors – lipid profile
Adherence to a gluten-free diet may increase HDL-C in patients with coeliac disease.
Sources: Nikniaz, 2019 |
|
- GRADE |
No conclusions could be drawn about the effect of a (strict) gluten free diet compared to no gluten free diet on infertility, pregnancy complications (stillbirth, small for gestational age), autoimmune thyroid disease, intestinal malignancies (enteropathy associated t-cell lymphoma, oesophageal squamous cell carcinoma), because of the absence of relevant comparative studies.
Sources: - |
Samenvatting literatuur
Description of studies
Mucosal recovery (histological improvement of villous atrophy)
Szakacs (2017) conducted a systematic review investigating whether celiac children on a gluten-free diet display higher mucosal recovery ratios than adults. They searched several databases, including PubMed, Embase, Cochrane Trials, and Web of Science until December 2016. both experimental (randomized or non-randomized, controlled or uncontrolled clinical trials) and observational studies (cohort, cross-sectional and case-control studies) carried out either in a prospective or a retrospective manner without respect to the primary objectives of the studies. Case reports and case series were excluded. A total of 61 studies were included in the systematic review and meta-analysis. The primary outcome was to produce a comprehensive analysis of complete mucosal recovery (Marsh 0 on follow up), and children's recovery ratios were compared to those of adults. The Newcastle-Ottawa Scale (NOS) tool, dedicated to assessing cohort studies, was adjusted to the design of celiac studies. Grading of Recommendations Assessment, Development and Evaluation (GRADE) methodology was used for rating the quality of evidence as very low, low, moderate, or high.
Bone mineral density
Studies in children
Kalayci (2001) conducted a case-control study investigating the effect of gluten free diet on bone mineral density (BMD) in children with celiac disease (CD). Children were eligible for the study if they were diagnosed for CD by intestinal biopsy. Children with other diseases known to affect BMD were excluded. The study included 32 patients with CD (group 1) and 82 healthy controls (group 2). The patients with CD were evaluated under 2 subgroups, 16 patients with recent diagnosis (group 1a) and 16 patients who follow their diet strictly (group 1b). Only data on group 1 was included in this analysis. BMD values were determined on entry to the study and at 12 months in celiac patients.
Mora (2001) conducted a prospective longitudinal cohort study investigating the impact of a long-term gluten free diet, initiated during childhood, on bone mineral density. Eligible for the study were patients who participated in a longitudinal survey (Mora, 1998). Of the original 25 patients, 19 (mean age, 14.2±2.6 years) agreed to participate in this study after 4.3±0.6 years of gluten-free diet. CD diagnosis was based on mucosal atrophy in small bowel biopsies. All patients have been on gluten-free diet since diagnosis was made. BMD was assessed by DEXA.
Choudhary (2017) conducted a cross-sectional observational study investigating BMD among newly diagnosed and already diagnosed cases of CD on gluten-free diet for at least one year. Thirty-six children (20 females) with untreated CD at diagnosis (Group A) and 36 age and sex matched children on gluten-free diet for at least one year (Group B) were studied. CD diagnosis was made by intestinal biopsy (demonstration of crypt hyperplasia and villous atrophy in the duodenal mucosa). Mean age of Group A patients was 7.25 ± 2.78 years (range, 4–15 years) and in Group B mean age was 7.83 ± 2.66 years (range, 4–15 years). BMD was assessed by DEXA.
Cardiovascular risk factors
Nikniaz (2019) conducted a systematic review on the changes in body mass index (BMI) and lipid profile during a gluten-free diet in celiac patients. They searched several databases, including Medline, Embase, Cochrane, Scopus and Web of Science until June 2018. Only cohort or case-control studies conducted in adults with CD that reported the outcomes BMI, total cholesterol (TC), high-density lipoprotein cholesterol (HDL-C), low-density lipoprotein cholesterol (LDL-C), and triglyceride were included. A total of 16 studies were included in the systematic review and meta-analysis. Methodological quality of selected studies using the Joanna Briggs Institute (JBI) tool for observational studies. The following domains were assessed: inclusion criteria; methods of outcome measurement; methods of identification of celiac; consecutive inclusion of participants; complete inclusion of participants; reporting of the demographic characteristics; reporting of clinical information of the participants; outcomes or follow-up results of cases; reporting of the presenting site(s)/clinic(s); demographic information; and appropriate statistical analysis.
Results
Results are presented by outcome measure, starting with critical outcomes.
Mucosal recovery (histological improvement of villous atrophy) (critical outcome)
Szakacs (2017) included 37 studies that reported mucosal recovery ratios. Pooled analyses showed an increase in mucosal recovery after adherence to a gluten-free diet during follow-up. The overall pooled complete mucosal recovery ratio in children and adults was 0.36 (95% CI 0.28 to 0.44; Figure 1). This is a clinically relevant difference.
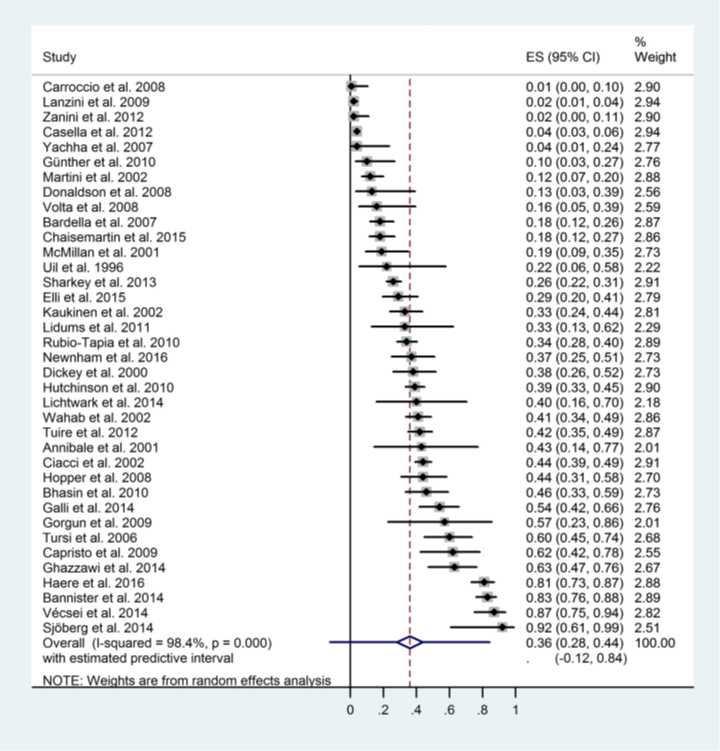
Figure 1. Forest plot showing the overall effect of gluten-free diet on complete mucosal recovery ratios in children and adults. Pooled mean difference, random effects model (Szakacs, 2017).
Szakacs (2017) included 15 studies into a subgroup analysis to assess the difference in mucosal recovery ratios between children (n=7 studies) and adults (n=8 studies). Pooled analyses showed that both children and adults had increased mucosal recovery after adherence to a gluten-free diet during follow-up, but children showed higher complete mucosal recovery ratios (0.65; 95% CI 0.44 to 0.85) compared to adults (0.24; 95% CI 0.15 to 0.33; p<0.01; Figure 2). Both the recovery ratio’s in children and adults are clinically relevant.
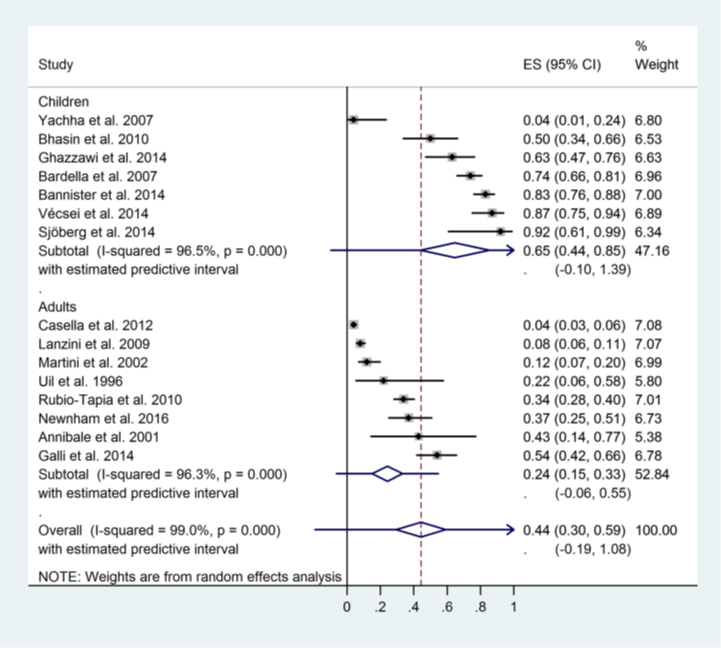
Figure 2. Forest plot showing the overall effect of gluten-free diet on complete mucosal recovery ratios of children-to-adults comparison (Szakacs, 2017).
Szakacs (2017) included a further seven studies into a subgroup analysis to assess the difference in mucosal recovery ratios after 12 months of gluten-free diet. At the 12th month of gluten-free diet, only 38% of patients achieved complete mucosal recovery. Pooled analyses showed an increase in complete mucosal recovery after 12 months on a gluten-free diet. The pooled complete mucosal recovery ratio after 12 months on a gluten-free diet was 0.38 (95% CI 0.28 to 0.48; Figure 3). This is also a clinically relevant difference.
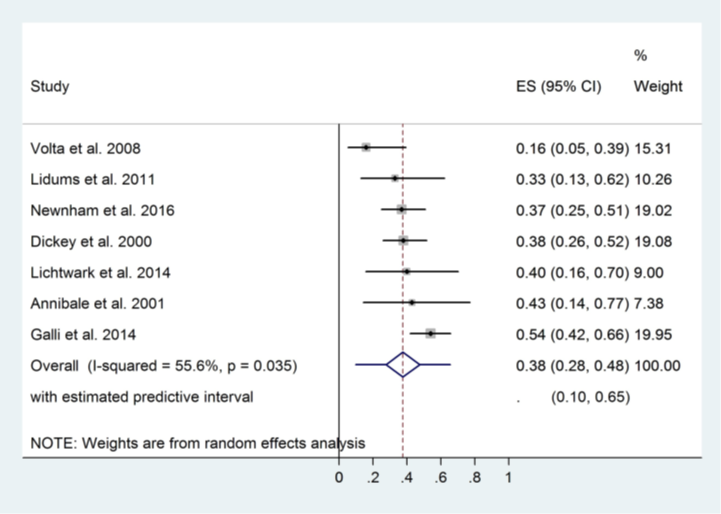
Figure 3. Forest plot showing the overall effect of 12 months on a gluten-free diet on complete mucosal recovery ratios in adults (Szakacs, 2017).
Bone mineral density (important outcome)
Kalayci (2001) found that age adjusted BMD Z-score (±SD) was significantly lower between subgroup group 1a (newly diagnosed) and group 1b (1 year on gluten free diet) at time of diagnosis (mean difference -0.88; 95% C:I -1.67 to -0.09). This is also a clinically relevant difference. Group 1a significantly improved age adjusted BMD Z-score after 1 year on gluten free diet compared to BMD Z-score at time of diagnosis (mean difference -0.30; 95%CI: -0.94 to 0.34). This is also a clinically relevant difference. Group 1b did not show a further improvement after another 12 months on gluten free diet (mean difference -0.30; 95%CI: -0.94 to 0.34), but it is a clinically relevant difference. Osteopenia (z-score lower than –1.0) was found in 62.5% of patients in subgroup 1a 62.5% and in 37.5% of patients in subgroup 1 b. 37.5%). A z-score lower than -2.5 was found in 50% of patients in subgroup 1a. None of the patients in subgroup 1b had a z-score lower than -2.5. Age-adjusted BMD increased during the first year of dietary recommendation. After 1 year of GFD, the percentage of patients who had osteopenia had decreased considerable. After treatment for 1 year with gluten free diet for a year 50% of patients in subgroups 1a and 33.3% of patients in subgroup 1b who had osteopenia at the beginning of the study showed normal z-score.
Mora (2001) found that spinal BMD did not differ between diagnosis and 1.1 years on gluten-free diet (mean difference -0.06 g/cm2; 95% CI: -0.08 to 0.03), but this is not a clinically relevant difference. There was however a significant improvement in total-body BMD (mean difference -0.04 g/cm2; 95% CI: -0.05 to -0.02) after 1.1 years on a gluten-free diet, but this is not a clinically relevant difference. After 4.3years on a gluten-free diet both spinal BMD (mean difference -0.19 g/cm2; 95%CI: -0.22 to -0.16) and total-body BMD (mean difference -0.13 g/cm2; 95%CI: -0.15 to -0.12) significant and clinically relevant improvement compared to BMD at time of diagnosis.
Choudhary (2017) found that age adjusted BMD Z-score was significantly lower in newly diagnosed patients (group A) compared to those on a gluten-free diet for at least one year (group B; mean difference -1.37; 95% CI: -1.82 to -0.92). This is also a clinically relevant difference.
Cardiovascular risk factors
BMI (important outcome)
Nikniaz (2019) included 14 studies (2828 participants) that reported on BMI. Two studies separated the results based on patient’s age (>65 years and younger patients < 64 years; Casella, 2012) and the duration of the follow-up (one year versus five years; Newnham, 2016). These studies were entered into the meta-analysis separately. The pooled results showed an increase in BMI after adherence to gluten-free diet during the follow-up period. The pooled mean difference was 0.265 kg/m2 (95% CI 0.177 to 0.352; Figure 6). The mean duration of follow-up in four studies was ≤2 years. In eight studies the mean follow-up duration was >2 years. A subgroup analysis based on the follow-up period showed that the increase in mean BMI in studies with follow-up period less than two years was more than studies with longer (>2 years) follow-up period. The pooled mean difference for studies with a follow-up period less than two years was 0.445 kg/m2 (95% CI 0.250 to 0.640) compared to a pooled mean difference of 0.181 (95% CI 0.105 to 0.258) for studies with a follow-up over 2 years (Figure 4 en 5).
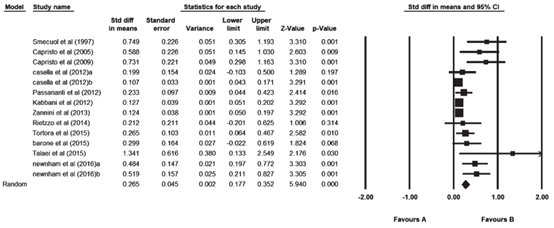
Figure 4. Forest plot showing the overall effect of gluten-free diet on BMI. Pooled mean difference, random effects model (Nikniaz, 2019).
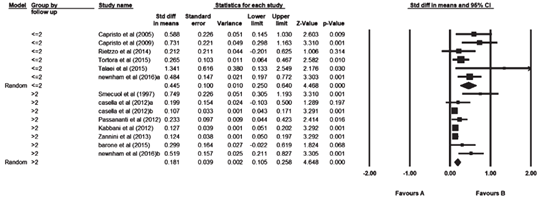
Figure 5. Forest plot showing the effect of gluten-free diet on BMI based on the duration of gluten-free diet. Pooled mean difference, random effects model (Nikniaz, 2019).
Lipid profile (important outcome)
Nikniaz (2019) included six studies that reported on total cholesterol (TC). The pooled results did not show an increase in TC after adherence to a gluten-free diet during follow-up. The pooled mean difference was 0.172 mg/dL (95% CI -0.068 to 0.412; Figure 6).
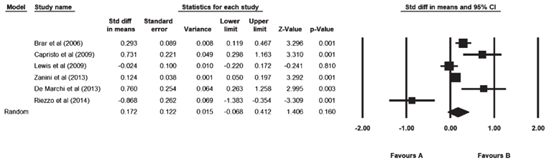
Figure 6. Forest plot showing the overall effect of gluten-free diet on total cholesterol. Pooled mean difference, random effects model (Nikniaz, 2019).
Nikniaz (2019) included six studies that reported on HDL-C. The pooled results showed an increase in HDL-C after adherence to a gluten-free diet during follow-up. The pooled mean difference was 0.367 mg/dL (95% CI 0.181 to 0.554; Figure 7).
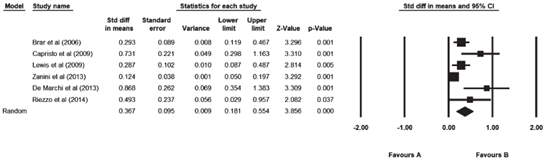
Figure 7. Forest plot showing the overall effect of gluten-free diet on HDL-C. Pooled mean difference, random effects model (Nikniaz, 2019).
Nikniaz (2019) included four studies that reported on LDL-C. The pooled results did not show a decrease in LDL-C after adherence to a gluten-free diet during follow-up. The pooled mean difference was -0.271 mg/dL (95% CI -0.540 to 0.107; Figure 8).
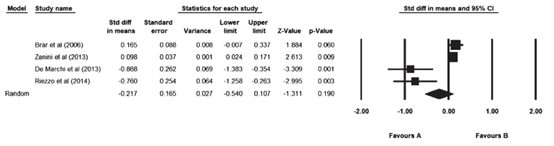
Figure 8. Forest plot showing the overall effect of gluten-free diet on LDL-C. Pooled mean difference, random effects model (Nikniaz, 2019).
Nikniaz (2019) included six studies that reported on triglyceride concentration. The pooled results did not show a decrease in triglycerides after adherence to a gluten-free diet during follow-up. The pooled mean difference was 0.367 mg/dL (95% CI 0.181 to 0.554; Figure 9).
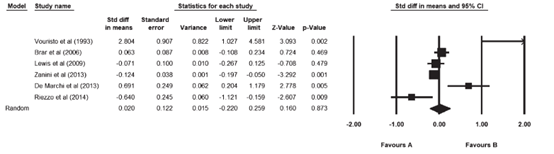
Figure 9. Forest plot showing the overall effect of gluten-free diet on triglycerides. Pooled mean difference, random effects model (Nikniaz, 2019).
There were no studies answering the PICO for the following outcomes: 'infertility’, ‘pregnancy complications (stillbirth, small for gestational age)’, ‘autoimmune thyroid disease’, ‘intestinal malignancies (enteropathy associated t-cell lymphoma, oesophageal squamous cell carcinoma)’
Level of evidence of the literature
The level of evidence for observational studies and meta-analyses of observational studies starts at ‘low’. The quality of evidence for the outcomes ‘mucosal recovery ratio’, ‘bone mineral density’ and ‘cardiovascular risk factors (BMI, lipid profile)’ was not downgraded and remained low. The assessment of the quality of evidence for outcomes ‘infertility’, ‘pregnancy complications (stillbirth, small for gestational age)’, ‘autoimmune thyroid disease’, ‘intestinal malignancies (enteropathy associated t-cell lymphoma, oesophageal squamous cell carcinoma)’ was not performed due to the absence of relevant studies fulfilling the PICO-criteria.
Zoeken en selecteren
A systematic review of the literature was performed to answer the following question:
What are the benefits and harms of following a gluten-free diet for mucosal recovery and long-term health outcomes in patients with coeliac disease, compared to no gluten-free diet?
P (patients) Children and adults with celiac disease
I (intervention) Gluten free diet
C (control) No (strict) gluten free diet
O (outcomes) Mucosal recovery (histological improvement of villous atrophy), long-term health outcomes: bone mineral density, osteopenia, osteoporosis, cardiovascular disease (hypertension, heart failure, coronary artery disease), cardiovascular risk factors (body mass index (BMI), obesity, lipid profile), infertility, pregnancy complications (stillbirth, small for gestational age), autoimmune thyroid disease, intestinal malignancies (enteropathy associated t-cell lymphoma, oesophageal squamous cell carcinoma)
Relevant outcome measures
The guideline development group considered mucosal recovery as a critical outcome measure for decision making; and long-term health outcomes as important outcome measures for decision making.
A priori, the working group did not define the outcome measures listed above but used the definitions used in the studies.
The working group used the GRADE standard limit of 25% difference for dichotomous outcomes (RR <0.8 or >1.25) and 10% for continuous outcomes as a minimal clinically (patient) important difference.
Search and select (Methods)
The databases Medline (via OVID) and Embase (via Embase.com) were searched with relevant search terms from the 1st of January 2000 until the 9th of March 2020. The detailed search strategy is depicted under the tab Methods. The systematic literature search resulted in 1202 hits. Studies were selected according to the following criteria: systematic reviews (with meta-analyses), randomized controlled trials (RCT’s) and comparative observational studies answering the PICO question. Based on initial title and abstract screening 52 studies were selected for further analysis. After reading full text articles, 46 studies were excluded and 6 studies were included (see the table with reasons for exclusion under the tab Methods).
Results
Three systematic reviews were included in the analysis of literature. One of them assessed the effect of a gluten-free diet on mucosal recovery in coeliac children compared to adults (Szakacs, 2017), one assessed the relationship between celiac disease (CD) and infertility (Lasa, 2014), and one - the changes in body mass index (BMI) and lipid profile during a gluten free diet in adult celiac patients (Nikniaz, 2019). Three additional observational studies were included, and all assessed the effect of gluten free diet on bone mineral density in children (Kalayci, 2001; Mora, 2001; Choudary, 2017).
Important study characteristics and results are summarized in the evidence tables. The assessment of the risk of bias is summarized in the risk of bias tables.
Referenties
- Akobeng, A. K., & Thomas, A. G. (2008). Systematic review: tolerable amount of gluten for people with coeliac disease. Alimentary pharmacology & therapeutics, 27(11), 10441052.
- Canavan, C., Logan, R. F., Khaw, K. T., & West, J. (2011). No difference in mortality in undetected coeliac disease compared with the general population: a UK cohort study. Alimentary pharmacology & therapeutics, 34(8), 10121019.
- Card, T. R., West, J., & Holmes, G. K. (2004). Risk of malignancy in diagnosed coeliac disease: a 24-year prospective, population-based, cohort study. Alimentary pharmacology & therapeutics, 20(7), 769775.
- Choung, R. S., Larson, S. A., Khaleghi, S., Rubio-Tapia, A., Ovsyannikova, I. G., King, K. S., Larson, J. J., Lahr, B. D., Poland, G. A., Camilleri, M. J., & Murray, J. A. (2017). Prevalence and Morbidity of Undiagnosed Celiac Disease From a Community-Based Study. Gastroenterology, 152(4), 830839.e5.
- Choudhary, G., Gupta, R. K., & Beniwal, J. (2017). Bone mineral density in celiac disease. The Indian Journal of Pediatrics, 84(5), 344-348.
- Ciacci, C., Cirillo, M., Auriemma, G., Di Dato, G., Sabbatini, F., & Mazzacca, G. (1996). Celiac disease and pregnancy outcome. The American journal of gastroenterology, 91(4), 718722.
- Elfström, P., Granath, F., Ye, W., & Ludvigsson, J. F. (2012). Low risk of gastrointestinal cancer among patients with celiac disease, inflammation, or latent celiac disease. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 10(1), 3036.
- Emilsson, L., Semrad, C., Lebwohl, B., Green, P., & Ludvigsson, J. F. (2020). Risk of Small Bowel Adenocarcinoma, Adenomas, and Carcinoids in a Nationwide Cohort of Individuals With Celiac Disease. Gastroenterology, 159(5), 16861694.e2.
- Fuchs, V., Kurppa, K., Huhtala, H., Mäki, M., Kekkonen, L., & Kaukinen, K. (2018). Delayed celiac disease diagnosis predisposes to reduced quality of life and incremental use of health care services and medicines: A prospective nationwide study. United European gastroenterology journal, 6(4), 567575.
- Gao, Y., Kristinsson, S. Y., Goldin, L. R., Björkholm, M., Caporaso, N. E., & Landgren, O. (2009). Increased risk for non-Hodgkin lymphoma in individuals with celiac disease and a potential familial association. Gastroenterology, 136(1), 9198.
- Godfrey, J. D., Brantner, T. L., Brinjikji, W., Christensen, K. N., Brogan, D. L., Van Dyke, C. T., Lahr, B. D., Larson, J. J., Rubio-Tapia, A., Melton, L. J., 3rd, Zinsmeister, A. R., Kyle, R. A., & Murray, J. A. (2010). Morbidity and mortality among older individuals with undiagnosed celiac disease. Gastroenterology, 139(3), 763769.
- Gray, A. M., & Papanicolas, I. N. (2010). Impact of symptoms on quality of life before and after diagnosis of coeliac disease: results from a UK population survey. BMC health services research, 10, 105.
- Hischenhuber, C., Crevel, R., Jarry, B., Mäki, M., Moneret-Vautrin, D. A., Romano, A., Troncone, R., & Ward, R. (2006). Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease. Alimentary pharmacology & therapeutics, 23(5), 559575.
- Holmes, G. K., Prior, P., Lane, M. R., Pope, D., & Allan, R. N. (1989). Malignancy in coeliac disease--effect of a gluten free diet. Gut, 30(3), 333338.
- Hujoel, I. A., Van Dyke, C. T., Brantner, T., Larson, J., King, K. S., Sharma, A., Murray, J. A., & Rubio-Tapia, A. (2018). Natural history and clinical detection of undiagnosed coeliac disease in a North American community. Alimentary pharmacology & therapeutics, 47(10), 13581366.
- Kalayci, A. G., Kansu, A., Girgin, N., Kucuk, O., & Aras, G. (2001). Bone mineral density and importance of a gluten-free diet in patients with celiac disease in childhood. Pediatrics, 108(5), e89-e89.
- Kårhus, L. L., Skaaby, T., Petersen, J., Madsen, A. L., Thuesen, B. H., Schwarz, P., Rumessen, J. J., & Linneberg, A. (2020). Long-term Consequences of Undiagnosed Celiac Seropositivity. The American journal of gastroenterology, 115(10), 16811688.
- Lasa, J. S., Zubiaurre, I., & Soifer, L. O. (2014). Risk of infertility in patients with celiac disease: a meta-analysis of observational studies. Arquivos de gastroenterologia, 51(2), 144150.
- Lebwohl, B., Green, P., Emilsson, L., Mårild, K., Söderling, J., Roelstraete, B., & Ludvigsson, J. F. (2022). Cancer Risk in 47,241 Individuals With Celiac Disease: A Nationwide Cohort Study. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 20(2), e111e131.
- Lebwohl, B., Cao, Y., Zong, G., Hu, F. B., Green, P., Neugut, A. I., Rimm, E. B., Sampson, L., Dougherty, L. W., Giovannucci, E., Willett, W. C., Sun, Q., & Chan, A. T. (2017). Long term gluten consumption in adults without celiac disease and risk of coronary heart disease: prospective cohort study. BMJ (Clinical research ed.), 357, j1892.
- Lohi, S., Mäki, M., Montonen, J., Knekt, P., Pukkala, E., Reunanen, A., & Kaukinen, K. (2009a). Malignancies in cases with screening-identified evidence of coeliac disease: a long-term population-based cohort study. Gut, 58(5), 643647.
- Lohi, S., Mäki, M., Rissanen, H., Knekt, P., Reunanen, A., & Kaukinen, K. (2009b). Prognosis of unrecognized coeliac disease as regards mortality: a population-based cohort study. Annals of medicine, 41(7), 508515.
- Mariani, P., Viti, M. G., Montuori, M., La Vecchia, A., Cipolletta, E., Calvani, L., & Bonamico, M. (1998). The gluten-free diet: a nutritional risk factor for adolescents with celiac disease?. Journal of pediatric gastroenterology and nutrition, 27(5), 519523.
- Martinelli, P., Troncone, R., Paparo, F., Torre, P., Trapanese, E., Fasano, C., Lamberti, A., Budillon, G., Nardone, G., & Greco, L. (2000). Coeliac disease and unfavourable outcome of pregnancy. Gut, 46(3), 332335.
- Metzger, M. H., Heier, M., Mäki, M., Bravi, E., Schneider, A., Löwel, H., Illig, T., Schuppan, D., & Wichmann, H. E. (2006). Mortality excess in individuals with elevated IgA anti-transglutaminase antibodies: the KORA/MONICA Augsburg cohort study 1989-1998. European journal of epidemiology, 21(5), 359365.
- Missbach, B., Schwingshackl, L., Billmann, A., Mystek, A., Hickelsberger, M., Bauer, G., & König, J. (2015). Gluten-free food database: the nutritional quality and cost of packaged gluten-free foods. PeerJ, 3, e1337.
- Mora, S., Barera, G., Beccio, S., Menni, L., Proverbio, M. C., Bianchi, C., & Chiumello, G. (2001). A prospective, longitudinal study of the long-term effect of treatment on bone density in children with celiac disease. The Journal of pediatrics, 139(4), 516-521.
- Nikniaz, Z., Farhangi, M. A., Hosseinifard, H., & Nikniaz, L. (2019). Does a gluten-free diet increase body mass index and lipid profile in celiac patients? A systematic review and meta-analysis. Mediterranean Journal of Nutrition and Metabolism, 12(4), 341-352.
- Nordyke, K., Norström, F., Lindholm, L., Stenlund, H., Rosén, A., & Ivarsson, A. (2013). Health-related quality of life in adolescents with screening-detected celiac disease, before and one year after diagnosis and initiation of gluten-free diet, a prospective nested case-referent study. BMC public health, 13, 142.
- Olén, O., Askling, J., Ludvigsson, J. F., Hildebrand, H., Ekbom, A., & Smedby, K. E. (2011). Coeliac disease characteristics, compliance to a gluten free diet and risk of lymphoma by subtype. Digestive and liver disease : official journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver, 43(11), 862868.
- Pelizzaro, F., Marsilio, I., Fassan, M., Piazza, F., Barberio, B., D'Odorico, A., Savarino, E. V., Farinati, F., & Zingone, F. (2021). The Risk of Malignancies in Celiac Disease-A Literature Review. Cancers, 13(21), 5288.
- Potter, M., Walker, M. M., Hancock, S., Holliday, E., Brogan, G., Jones, M., McEvoy, M., Boyle, M., Talley, N. J., & Attia, J. (2018). A Serological Diagnosis of Coeliac Disease Is Associated with Osteoporosis in Older Australian Adults. Nutrients, 10(7), 849.
- Rea, F., Polito, C., Marotta, A., Di Toro, A., Iovene, A., Collini, R., Rea, L., & Sessa, G. (1996). Restoration of body composition in celiac children after one year of gluten-free diet. Journal of pediatric gastroenterology and nutrition, 23(4), 408412.
- Rubio-Tapia, A., Ludvigsson, J. F., Choung, R. S., Brantner, T. L., Rajkumar, S. V., Landgren, O., & Murray, J. A. (2016). Increased mortality among men aged 50 years old or above with elevated IgA anti-transglutaminase antibodies: NHANES III. BMC gastroenterology, 16(1), 136.
- Rubio-Tapia, A., Kyle, R. A., Kaplan, E. L., Johnson, D. R., Page, W., Erdtmann, F., Brantner, T. L., Kim, W. R., Phelps, T. K., Lahr, B. D., Zinsmeister, A. R., Melton, L. J., 3rd, & Murray, J. A. (2009). Increased prevalence and mortality in undiagnosed celiac disease. Gastroenterology, 137(1), 8893.
- Rubio-Tapia, A., Rahim, M. W., See, J. A., Lahr, B. D., Wu, T. T., & Murray, J. A. (2010). Mucosal recovery and mortality in adults with celiac disease after treatment with a gluten-free diet. The American journal of gastroenterology, 105(6), 14121420.
- Szakacs, Z., Matrai, P., Hegyi, P., Szabo, I., Vincze, A., Balasko, M., ... & Bajor, J. (2017). Younger age at diagnosis predisposes to mucosal recovery in celiac disease on a gluten-free diet: A meta-analysis. PloS one, 12(11), e0187526.
- Tio, M., Cox, M. R., & Eslick, G. D. (2012). Meta-analysis: coeliac disease and the risk of all-cause mortality, any malignancy and lymphoid malignancy. Alimentary pharmacology & therapeutics, 35(5), 540551.
- Thompson T. (2000). Folate, iron, and dietary fiber contents of the gluten-free diet. Journal of the American Dietetic Association, 100(11), 13891396.
- Thompson, T., Dennis, M., Higgins, L. A., Lee, A. R., & Sharrett, M. K. (2005). Gluten-free diet survey: are Americans with coeliac disease consuming recommended amounts of fibre, iron, calcium and grain foods?. Journal of human nutrition and dietetics : the official journal of the British Dietetic Association, 18(3), 163169.
- Thompson T. (1999). Thiamin, riboflavin, and niacin contents of the gluten-free diet: is there cause for concern?. Journal of the American Dietetic Association, 99(7), 858862.
- Verbeek, W. H., Van De Water, J. M., Al-Toma, A., Oudejans, J. J., Mulder, C. J., & Coupé, V. M. (2008). Incidence of enteropathy--associated T-cell lymphoma: a nation-wide study of a population-based registry in The Netherlands. Scandinavian journal of gastroenterology, 43(11), 13221328.
- Vilppula, A., Kaukinen, K., Luostarinen, L., Krekelä, I., Patrikainen, H., Valve, R., Luostarinen, M., Laurila, K., Mäki, M., & Collin, P. (2011). Clinical benefit of gluten-free diet in screen-detected older celiac disease patients. BMC gastroenterology, 11, 136.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 27-06-2023
Beoordeeld op geldigheid : 19-02-2023
Algemene gegevens
De ontwikkeling van deze richtlijn werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Samenstelling werkgroep
Werkgroep
- Dr. P. Wahab, MDL-arts in Rijnstate Ziekenhuis Arnhem, NVMDL (voorzitter)
- Prof. Dr. G. Bouma, MDL-arts in Amsterdam UMC, locatie VUmc, NVMDL (voorzitter)
- Prof. Dr. M.L. Mearin-Manrique, kinderarts-MDL in het LUMC, NVK (voorzitter)
- Dr. Abdul Al-Toma, MDL-arts in St. Antonius Ziekenhuis Utrecht , NVMDL (voorzitter, afgetreden in mei 2020)
- Prof. Dr. C.J.J. Mulder, MDL-arts in Amsterdam UMC, NVMDL
- Dr. T. van Gils, AIOS-MDL in Amsterdam UMC, NVMDL
- Dr. M.M.S. Wessels, kinderarts-MDL in Rijnstate Ziekenhuis Arnhem, NVK
- Drs. C.R. Meijer-Boekel, kinderarts-MDL in LUMC, NVK
- Prof. Dr. J.W.M. Muris, huisarts, Universiteit Maastricht, NHG
- Drs. E.A. Neefjes - Borst, patholoog in Amsterdam UMC, NVVP
- Dr. H.J. Bontkes, laboratorium specialist medische Immunologie, Amsterdam UMC, NVVI
- Drs. M. Beukema, internist-intensivist in Streekziekenhuis Koningin Beatrix, NIV
- Prof. Dr. B. Horváth, dermatoloog in UMC Groningen, NVDV
- Drs. S. Neve, dermatoloog in Dijklander Ziekenhuis, NVDV
- Drs. T. Holtackers-Dumay, kinder- en jeugdpsycholoog in St. Anthonius ziekenhuis, NIP
- L.J. Bosch, MSc, diëtist en eigenaar bij ‘Voeding voor jou,’ NVD
- G. Herweijer, MSc, diëtist in ‘Voeding + Advies’, ervaringsdeskundige, NCV
- F.W.P.C. van Overveld, MSc, directeur NCV
Klankbordgroep
- Dr. R. de Jongh, internist in het Amsterdam UMC, NIV
- Dr. A.F.J.E. Vrancken, neuroloog in het UMC Utrecht, NVN
- Dr. B.P.C. van de Warrenburg, neuroloog in het Radboudumc, NVN
Met ondersteuning van:
- Dr. S. Persoon, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2020)
- Dr. A. Nguyen, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. M. Verhoeven, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2021)
- Dr. A.J. Versteeg, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot 2022)
- Dr. E.V. van Dorp-Baranova, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard dat zij in de laatste drie jaar geen directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad.
Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Bouma* |
MDL arts, Amsterdam UMC, hoogleraar inflammatoire aandoeningenvan de tractus digestivus Directeur research instituut Amsterdam Gastroenterology, Endocrinology and Metabolism, AMsterdam UMC Plaatsvervangend opleider MDL, AMsterdam UMC, locatie Vumc |
Nationale en internationale bestuurs- en werkgroepfucties: Voorzitter Stichting Gastrostart NVGE 2019-2022 (onbetaald) Voorzitter landelijke Werkgroep Autoimmuun Hepatitis 2017-2022 (onbetaald) Lid van het Scientific Committee, dr. Schär Nutrition (onbetaald) Lid van de wetenschappelijke adviesraad van de Nederlandse Coeliakie Vereniging (onbetaald) National representative in de Council van de United European Gastroenterology, 2013-2015 (onbetaald) Lid van de wetenschappelijke adviesraad van de Maag Lever Darmstichting (onbetaald)
Adviesraden: 2019 Advisory Board Takeda International (eenmalig, betaald) 2019 Nascholing IBD, financieel mogelijk gemaakt door Takeda (eenmalig, betaald) 2019 Advisory Board Roche International (eenmalig, betaald) 2020 Advisory Board Calypso Biotech (eenmalig, onbetaald) 2021 Advisory Board Alimentiv (eenmalig, onbetaald) 2022 Nascholing IBD, financieel mogelijk gemaakt door Janssen Pharmaceuticals (eenmalig, betaald) - Clinical trials op het gebied van coeliakie: S.I. Cellimmune-AMGEN clinical trial (NCT02633020) P.I. Provention clinical trial (NCT04424927) P.I. Calypso clinical trial (NCT04593251) P.I. Tofacitinib for refractory celiac disease (Eudract 2018-001678-10)
Daarnaast P.I. en S.I. op diverse klinische trials op het gebied van IBD (contract research); PI op investigator initiated studies op het gebied van IBD, autoimmuun hepatitis en coeliakie. |
Zie onder nevenwerkzaamheden: Financier: MLDS, inh onderzoek: onderzoek naar de lymfoomontwikkeling bij coeliakie, rol als PL: ja inh: onderzoek naar de verbetering van diagnostiek van coeliakie. Rol PL: nee. Inh: MLDS. Onderzoek naar de rol van MTX bij IBD. Rol PL: ja. MLDS: inh: onderzoek naar voorspellers van exacerbatie van IBD. Rol PL: nee. KWF/coeliakievereniging PFizer (in kind). Inh: Rol van tofacitinib in de behandeling van refractarie coeliakie. Rol PL: nee |
Geen |
|
Wahab* |
MDL arts, Rijnstate Ziekenhuis Rijstate |
Lid ZonMw commissie EEK; vacatiegeld Lid Regionaal Tuchtcollege Zwolle; vacatiegeld; Lid wetenschappelijke advies raad Nederlandse Coeliakie Vereniging, onbetaald |
Geen |
Geen |
|
Mearin-Manrique* |
Kinderarts-MDL, afdeling Kindergeneeskunde Leids Universitair Mediach Centrum (LUMC) |
Lid Medisch Advies Raad Ned. Coeliakie Vereniging: onbetaald Lid Public Affair Committee European Society Pediatric Gastroenterology Hepatology and Nutrition (ESPGHAN): onbetaald Secretaris werkgroep Coeliakie ESPGHAN:onbetaald |
Financier: Thermo Fisher. Inh onderz: PreventCD (Prevention of Coeliac Disease) Rol PL: ja Fin: BioHit. Inh onderzoek: GLUTENSCREEN (Early detection of coeliac disease). Rol PL: ja |
Geen |
|
Al-Toma* (afgetreden als voorzitter in 2020) |
MDL-arts in St. Antonius Ziekenhuis Utrecht |
Geen |
Geen |
Geen |
|
Van Gils |
(AIOS) maag-, darm- en leverziekten in het Amsterdam UMC. |
Geen |
Geen |
Geen |
|
Mulder |
Werkgroep HEG Stoolbanking 2018 -2020 (onbetaald) Consultant HLW voor Thiosix 2018 - 2020 4-8 uur per week Begeleider 4 Promovendi VU 2019 - 2020 (onbetaald) MCV de Veluwe 2 dagen poli/endoscopiie/week (betaald) |
Geen |
Geen |
Geen |
|
Wessels |
Kinderarts MDL – Rijnstate Ziekenhuis Arnhem |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging - onbetaald |
Geen |
Geen |
|
Meijer |
Kinderarts MDL-LUMC 0,8 FTE lid Special Interest Group (SIG) ESPGHANon celiac disease |
Lid wetenschappelijke adviesraad Nederlandse coeliakie vereniging ‐ onbetaald |
Geen |
Geen |
|
Muris |
Hoofd vakgroep Huisartsgeneeskunde, Universiteit Maastricht |
Huisarts in Geulle, vergoeding |
Geen |
Geen |
|
Neefjes-Borst |
Patholoog, Amsterdam UMC |
Onbetaald: werkgroep protocollen van PALGA |
Geen |
Geen |
|
Bontkes |
Laboratorium specialist Medische Immunologie en hoofd laboratorium medische immunologie van het AmsterdamUMC, locatie VUmc |
Bestuurslid van de SKML sectie humorale immunologie (onbetaald) Coördinator SKML rondzending "coeliakie" (onbetaald, onkostenvergoeding voor het laboratorium). Lid van de Nederlandse sectie van het European Autoimmunity Standardisation Initiative (EASI) (onbetaald) |
Geen |
Geen |
|
Beukema |
lnternist-intensivist/acute geneeskunde, Santiz Streekziekenhuis Koningin Beatrix Winterswijk |
Adviescommissie GE (NIV) |
Geen |
Geen |
|
Horváth |
Dermatoloog, Afdelingshoofd Afdeling Dermatologie, Centrum voor Blaarziekten Universitair Medisch Centrum Groningen |
Geen |
Geen |
Geen |
|
Neve |
Dermatoloog bij Dijklanderziekenhuis te Hoorn voor 0,65 FTE |
Visiteur kwaliteitscommissie NVDV. Onkostenvergoeding Leo Pharma dermatologie adviesraad |
Geen |
Geen |
|
Holtackers |
GZ-psycholoog, kindergeneeskunde, St. Antonius Ziekenhuis (24 uur) medische psychologie; GZ-psycholoog, kinder- & jeugd & volwassenen, GGZ eigen praktijk (Psychologiepraktijk Samenspel Utrecht) |
Lesgeven (sociale vaardigheidstraining) aan beroepskrachten Rino Utrecht (aantal cursusdagen per jaar), betaald |
Geen |
Geen |
|
Bosch |
Diëtist en eigenaar bij 'Voeding voor jou' |
Op social media en online ben ik bekend als de glutenvrije diëtist en verkoop ik online programma’s om zelfverzekerd en gezond glutenvrij te leven. Daarnaast ben ik vrijwilliger bij de Nederlandse Coeliakie Vereniging en werk ik samen met de Vlaamse Coeliakie Vereniging.
|
Dienstverband bij een diëstistenbedrijf dat opereert op het gebied waar de richtlijn zich op richt. Eigendom van online informatieproducten over coeliakie en het glutenvrij dieet. |
Geen |
|
Herweijer |
Diëtist en praktijkeigenaar diëtistenpraktijk Voeding + Advies |
Vrijwilliger en waarneming bij afwezigheid van de diëtist voor de Nederlandse Coeliakie Vereniging |
Geen |
Geen |
*voorzitter richtlijncommissie
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door het uitnodigen van Nederlandse Coeliakie Vereniging (NCV) voor de invitational conference, afvaardiging van deze patiëntenvereniging in de werkgroep en betrekken van patiëntenvertegenwoordigers bij het ontwikkelen van Thuisarts-situaties. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen (zie kop ‘waarden en voorkeuren van patienten’). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de NCV als ook aan de Patientenfederatie Nederland en de eventueel aangeleverde commentaren zijn verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Uit de kwalitatieve raming blijkt dat er waarschijnlijk geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst raming |
Toelichting |
|
Module 1a Serologische diagnostiek bij volwassenen
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1b Positieve serologie bij een normaal biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1c Negatieve serologie bij een afwijkend biopt |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1d Serologische diagnostiek bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 1e Glutenbelasting |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2a Gezondheidseffecten van GVD op lange termijn |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2b GVD en kwaliteit van leven |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 2c Vitaminen- en mineralendeficiënties tijdens GVD
|
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 3 Glutensensitiviteit zonder coeliakie |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4a Monitoring van coeliakie bij volwassenen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 4b Monitoring van coeliakie bij kinderen |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Module 6 Randvoorwaarden (Organisatie van zorg) |
geen financiële gevolgen |
Uit de toetsing volgt dat de aanbeveling(en) niet breed toepasbaar zijn (<5.000 patiënten) en zal daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met coeliakie en glutengerelateerde aandoeningen. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van NVMDL, V&VN, NAPA, NVK, NCV, NHG en NIP via een invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten. Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
