Renale anemie bij chronische nierschade
Uitgangsvraag
Is bij patiënten met chronische nierschade (zonder dialyse) en anemie behandeling met erythropoiesis stimulating agent (ESA) aangewezen teneinde het risico op cardiovasculaire en renale eindpunten en mortaliteit te verlagen?
Aanbeveling
Wanneer ijzersuppletie wordt voorgeschreven dienen de potentiële voordelen, te weten het vermijden van bloedtransfusies of behandeling met ESA en het verminderen van anemiegerelateerde symptomen, te worden afgewogen tegen potentiële bijwerkingen en risico’s, zoals bijvoorbeeld gastro-intestinale bijwerkingen, anafylactische reacties bij intraveneuze toediening en onbekende langetermijneffecten.
Voor patiënten met anemie en ijzergebrek wordt, na uitsluiten van andere oorzaken van ijzergebrek, een proefperiode met oraal of i.v. ijzer gesuggereerd. Tijdens ijzersuppletie wordt aanbevolen om het ferritine niet hoger dan 500 mg/l te laten stijgen.
Het wordt geadviseerd geen behandeling met ESA te starten bij een Hb gehalte ≥6,2 mmol/l, tenzij er individuele redenen zijn om dit wel te doen.
Bij het starten van ESA therapie dient een balans te worden gevonden tussen de potentiële voordelen (vermijden van bloedtransfusies en anemiegerelateerde symptomen) en risico’s (bv. beroerte en hypertensie).
ESA moet met grote voorzichtigheid worden gebruikt (of bij voorkeur vermeden) bij patiënten met een actieve maligniteit (in ieder geval indien er kans is op curatie), bij een voorgeschiedenis van CVA en bij een voorgeschiedenis met een maligniteit.
Een redelijke streef-range t.a.v. het Hb gehalte lijkt 6,2-7,4 mmol/l. Wanneer Hb > 8,0 mmol/l stijgt onder ESA therapie dient ESA te worden verminderd of gestaakt.
Er is sprake van ‘ESA hyporesponsiveness’ als na behandeling met een stabiele ESA dosis de dosis meer dan verdubbeld moet worden om het stabiele Hb gehalte te behouden.
Bij patiënten met ‘ESA hyporesponsiveness’ wordt gesuggereerd de dosis niet meer dan te verdubbelen t.o.v. een adequate op gewicht gebaseerde startdosis of een voorafgaande stabiele onderhoudsdosis.
Geadviseerde startdoseringen van verschillende ESA’s:
|
|
Startdosis (s.c.) |
Bij 70 kg |
|
Darbepoetine |
0,75 µg/kg per 2 wk |
50 µg/2 wk |
|
Epoetine alfa |
150 IE/kg in 3 doses |
10000 IE/wk |
|
Epoetine beta |
60 IE/week |
4000 IE/wk |
|
Epoetine theta |
60 IE/week |
4000 IE/wk |
|
Epoetine zeta |
150 IE/kg in 3 doses |
10000 IE/wk |
|
Methoxypolyethyleen glycol epoetine beta |
0,6 µg/kg per 2 wk |
50 µg/2 wk |
Stroomschema uit richtlijn Anemie bij chronische nierschade en dialyse (NfN 2015):
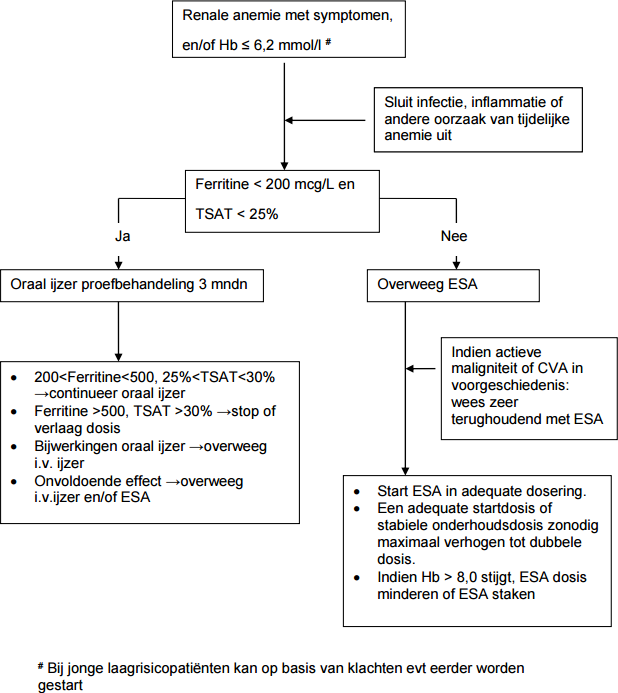
Belangrijkste veranderingen t.o.v. NfN richtlijn chronische nierschade 2009:
- Starten met ESA en/of ijzer niet afhankelijk van vast behandeltarget t.a.v. Hb gehalte, maar individueel behandeldoel afhankelijk van risicoprofiel en klachten van patiënt.
- Start met ijzersuppletie indien hoger Hb gewenst is en er geen sprake is van ferritine >500 mg/L en of een ijzersaturatie van >30%.
- Bij behandeling met ESA richten op Hb gehalte tussen de 6,2 en 7,4 mmol/l (lagere range dan voorheen).
- In geval van ‘ESA hyporesponsiveness’ ESA dosis maximaal één keer verdubbelen t.o.v. een adequate op gewicht gebaseerde startdosis of een voorafgaand stabiele onderhoudsdosis.
Overwegingen
Vanaf een eGFR <45 ml/min/1,73 m2 is renale anemie een frequent voorkomende complicatie bij patiënten met chronische nierschade [Inker, 2011]. Desondanks moeten andere oorzaken van anemie worden uitgesloten. De evaluatie van anemie bij patiënten met chronische nierschade moet in ieder geval uit de volgende onderdelen bestaan: compleet bloedbeeld, celindices, leukocytendifferentiatie, reticulocytenaantal, ijzerparameters (transferrinesaturatie [TSAT] en ferritine) en vitamine B12 en foliumzuur. Het routinematig bepalen van erytropoietine-spiegels wordt overigens niet geadviseerd, omdat dit doorgaans niet bijdraagt aan de diagnose ‘renale anemie’. Anemie bij CNS is geassocieerd met een verhoogd cardiovasculair risico en risico op hartfalen [Walker, 2006].
Er kan voor worden gekozen om anemie bij patiënten met chronische nierschade te behandelen met ijzer en zo nodig met aanvullende therapie met ESA voor de aan de anemie gerelateerde symptomen. M.b.t. de toediening van ijzerpreparaten dient het voordeel van behandeling afgewogen te worden tegen de eventuele nadelen, zoals (onbekende) langetermijneffecten en anafylactische reacties op de i.v. vorm van ijzer. Een proefbehandeling met ijzer bij patiënten met chronische nierschade en anemie (met of zonder ESA) kan overwogen worden indien een stijging van het Hb gehalte gewenst is, bijvoorbeeld om transfusie te voorkomen of i.v.m. aan anemie gerelateerde symptomen. De stijging is mede afhankelijk van de ijzervoorraad. Deze wordt bepaald door het meten van het serum ferritine en de TSAT, al zijn de specificiteit en sensitiviteit van beide tests beperkt [Stancu, 2010; Van Wyck, 2005]. In het algemeen wordt afgeraden om te starten met i.v. ijzer bij een actieve infectie of in een situatie van inflammatie, alhoewel data bij patiënten met chronische nierschade zonder dialyse hiervoor ontbreken. Indien er géén sprake is van een inflammatoire toestand kan als initiële therapie vooraf aan de start van een ESA gestart worden met orale ijzersuppletie als eerste behandeling voor renale anemie. Er is bij patiënten met chronische nierschade zonder dialyse geen voorkeur voor i.v. of orale ijzertoediening, alhoewel i.v. toediening effectiever is om het ferritine en Hb gehalte te verhogen [Macdougall, 2014].
Routinematig toedienen van ijzer bij ferritine >500 mg/L en of een ijzersaturatie van >30% wordt afgeraden, aangezien er geen studies zijn naar het voordeel van ijzersuppletie bij deze waarden en er mogelijk wel risico’s voor het optreden van toxiciteit zijn. In het algemeen geldt dat er geen targets voor Hb of ijzerwaarden te geven zijn, omdat dit niet gesteund wordt door studies. Voor elke patiënt dient derhalve afzonderlijk de reden en het doel van de behandeling te worden bepaald. Het nastreven van bepaalde Hb waarden dient te worden afgestemd op bv. de inspanningstolerantie van de patiënt of Hb-afhankelijke angina pectoris. Starten met ESA of onderhoudstherapie met ESA moet dan ook worden afgestemd op de situatie van de individuele patiënt op basis van criteria zoals de voorgeschiedenis (diabetes mellitus, status na CVA, maligniteit), aanwezigheid van ischemische hartziekte, de hoogte van het Hb en de snelheid van verandering in het Hb, de respons op ijzertherapie, de risico’s van een eventuele bloedtransfusie, de kwaliteit van leven, ESA gerelateerde risico’s (bijv. hypertensie, CVA), alsook de wens van de patiënt. De voorzichtigheid t.a.v. starten met ESA bij patiënten met een maligniteit in de voorgeschiedenis is gebaseerd op een post-hoc analyse van de TREAT studie waarbij bleek dat bij deze patiënten de kans om te overlijden aan een maligniteit hoger was bij hen die behandeld werden met darbepoëtine [Pfeffer, 2009].
Om toch enige leidraad te hebben kan over het algemeen worden geadviseerd het Hb gehalte niet routinematig te laten dalen tot ≤6,2 mmol/l. Dit getal is ontleend aan de resultaten uit de TREAT studie, een placebo gecontroleerde gerandomiseerde trial naar het effect van de ESA darbepoëtine bij patiënten met diabetes mellitus en een eGFR tussen de 20 en 60 ml/min/1,73m2 die nog geen dialyse behandeling ondergingen [Pfeffer, 2009]. Er werden geen significante verschillen aangetoond op cardiovasculaire en renale eindpunten, ondanks een verwachte toename van Hb in de groep die behandeld was met ESA. Omdat het bereikte Hb gehalte in de placebogroep zonder behandeling met ESA 6,2 mmol/l bedroeg is dit als ondergrens voor behandeling met ESA in richtlijnen overgenomen. Bij laagrisicopatiënten (jong, zonder veel comorbiditeit) of bij patiënten bij wie een duidelijke verbetering in kwaliteit van leven te verwachten is, kan al worden gestart met ESA therapie bij een hogere Hb waarde, echter niet bij een Hb >7,4 mmol/l [Locatelli, 2013].
Het lijkt redelijk om bij behandeling met ESA te streven naar een Hb gehalte tussen de 6,2 en 7,4 mmol/l. Bij hoogrisico patiënten, d.w.z. patiënten met diabetes mellitus, cardiovasculair lijden inclusief CVA of een maligniteit, dient men terughoudender te zijn en lagere waardes binnen de voorgestelde range na te streven. Deze ‘praktische target range’ is gebaseerd op de waardes in de controlegroep van studies waarbij partiële versus complete correctie van anemie werd onderzocht [Locatelli, 2013]. Het Hb gehalte dient in ieder geval niet routinematig te stijgen tot >8,0 mmol/l. In dat geval moet de ESA dosering worden verlaagd. Dit laatste heeft de voorkeur boven het (tijdelijk) stoppen van het middel i.v.m. het risico op zgn. ‘Hb cycling’ [Fishbane, 2007].
Men dient een restrictief beleid te voeren ten aanzien van de aanpassing van de dosering van ESA’s in het geval van ‘hyporesponsiveness’ (ook wel ESA-resistentie genoemd). Hier is sprake van indien er geen Hb stijging is na behandeling van 1-2 maand met adequate ESA dosering, aangepast aan het gewicht van de patiënt. In de TREAT studie had deze groep het hoogste risico op cardiovasculaire events [Solomon, 2010]. Of dit verhoogde risico het effect is van het onderliggend lijden waardoor er ‘hyporesponsiveness’ is, of door het toxisch effect van de ESA dosering is niet bekend [Szczech, 2008]. Het advies luidt dat een ESA dosis hoger dan verdubbeling van een adequate op gewicht gebaseerde startdosis (conform Farmacotherapeutisch Kompas of G-Standaard) of een voorafgaand stabiele onderhoudsdosis, dient te worden vermeden. In het geval van ESA resistentie moet onderzoek worden gedaan naar de oorzaak hiervan en moet rekening worden gehouden met de volgende oorzaken:
- Makkelijk te corrigeren: absolute ijzerdeficiëntie, vitamine B12 en/of foliumzuur deficiëntie, hypothyreoïdie, gebruik van ACEi/ARB, non-compliance. In het geval van anemie en ESA resistentie mogelijk a.g.v. gebruik van ACEi/ARB dient het voordeel van gebruik van deze middelen te worden afgewogen tegen de ernst van de anemie!
- Moeilijker te corrigeren: infectie/inflammatie, hemolyse, bloeding, hyperparathyreoïdie, maligniteit, ziektegerelateerde ondervoeding, slecht functionerend niertransplantaat in situ.
- Niet te corrigeren: hemoglobinopathie, beenmergziekte (bv. MDS), ‘pure red cell aplasia’.
Behandeling van renale anemie vindt na optimalisatie van de ijzervoorraad plaats met subcutane toediening van een ESA. De module geeft geen voorkeur voor een specifieke vorm van ESA.
Onderbouwing
Conclusies / Summary of Findings
|
LAAG |
Er is geen overtuigend bewijs voor een gunstig effect van ESA op mortaliteit, cardiovasculaire en renale eindpunten en kwaliteit van leven bij patiënten met chronische nierschade en anemie. Het gebruik van ESA kan leiden tot meer beroertes, maar laat het aantal bloedtransfusies dalen. Cody, 2016; Collister, 2016; Covic, 2014 |
Samenvatting literatuur
De studie van Gandra et al. werd bij lezing van de full tekst geëxcludeerd, omdat de RCT’s die in deze studie werden geïncludeerd, ook in nieuwere systematische reviews die onderstaand gerapporteerd zijn, zijn meegenomen [Gandra, 2010]. De studie van Tsuruya et al. werd bij lezing van de fulltekst geëxcludeerd, omdat hierbij geen sprake was van een systematische review [Tsuruya, 2016]. De systematische review van Palmer werd geëxcludeerd vanwege de aanwezigheid van een nieuwere Cochrane systematische review [Palmer, 2014; Cody, 2016].
Cody et al. publiceerden een Cochrane systematische review [Cody, 2016]. In deze studie werden 19 randomized controlled trials met in totaal 682 patiënten geïncludeerd, waarbij behandeling met recombinant humaan erythropoietine werd vergeleken met placebo of geen behandeling bij patiënten met chronische nierschade (geen dialyse) en anemie. De kwaliteit van de geïncludeerde studies was beperkt vanwege problemen met randomisatie, blindering, incomplete data, selectieve rapportage en sponsoring door de farmaceutische industrie. In deze meta-analyse werd geen statistisch significant effect gevonden voor de uitkomstmaten starten van nierfunctievervangende behandeling, mortaliteit en stoppen met behandeling vanwege bijwerkingen, waarbij opgemerkt moet worden dat er erg weinig events optraden (imprecisie). Wel werd een reductie van het aantal patiënten dat een bloedtransfusie nodig had gezien bij behandeling met recombinant humaan erythropoietine (RR: 0,32; 95%BI: 0,12-0,83; NNT: 5). Hierbij was echter ook sprake van erg weinig events (imprecisie). Ook was er een voordeel voor wat betreft het behoud van eGFR; het gemiddelde verschil was hierbij 2,11 ml/min/1,73 m2 (95%BI: 1,15-3,08) De duur van de geïncludeerde studies en dus ook de tijd tot bepaling van de eGFR varieerde van 8 weken tot 36 maanden.
Collister et al. bestudeerden het effect van ESA met een hoog versus laag streefdoel m.b.t. hemoglobinegehalte op de kwaliteit van leven bij patiënten met chronische nierschade en anemie [Collister, 2016]. In deze studie werden 17 studies geïncludeerd, waarvan 12 in populaties zonder dialyse. In deze literatuurreview zijn alleen de resultaten bij de patiënten zonder dialyse geïncludeerd. De kwaliteit van bewijs werd verlaagd door problemen met blindering van deelnemers en onderzoekers, en er was onzekerheid over adequate randomisatie in een deel van de studies. Een fors percentage van de studies kende bovendien incomplete outcome data. De kwaliteit van leven werd gerapporteerd middels de domeinen van de SF-36 (Short-Form Health Survey). Er werd geen statistisch significant verschil gevonden tussen een hoog versus laag hemoglobine target behalve met betrekking op fysiek functioneren.
Covic et al. publiceerden een meta-analyse van 19 randomized controlled trials met in totaal 8.129 patiënten over het effect van ESA op de progressie van chronische nierschade [Covic, 2014]. In deze systematische review werden patiënten geïncludeerd met chronische nierschade stadium 1 t/m 4; er werden geen subgroepanalyses voor patiënten zonder dialyse gerapporteerd. In deze literatuurreview zijn daarom alleen de geaggregeerde data gerapporteerd. De kwaliteit van de geïncludeerde studies was beperkt door beperkingen in randomisatie en blindering, en afwezigheid van intention-to-treat analyses. Er werd geen statistisch significant verschil gevonden tussen behandeling met ESA en controle voor de uitkomstmaten starten met nierfunctievervangende behandeling, mortaliteit, GFR, reductie van GFR en het risico op stoppen van de behandeling vanwege bijwerkingen.
Zoeken en selecteren
Voor een antwoord op deze uitgangsvraag is op 15 oktober 2016 naar literatuur gezocht in Medline (zie de zoekverantwoording). Dit leverde 266 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en research design (systematische reviews) geselecteerd, wat resulteerde in 6 artikelen, die fulltekst zijn beoordeeld.
Referenties
- Cody JD, Hodson EM. Recombinant human erythropoietin versus placebo or no treatment for the anaemia of chronic kidney disease in people not requiring dialysis. Cochrane Database of Systematic Reviews 2016, Issue 1. Art. No.: CD003266. DOI: 10.1002/14651858.CD003266.pub3.
- Collister D, Komenda P, Hiebert B, Gunasekara R, Xu Y, Eng F, et al. The effect of erythropoietin-stimulating agents on health-related quality of life in anemia of chronic kidney disease. Ann Inter Med 2016; 164: 472-8.
- Covic A, Nistor I, Donciu M-D, Dumea R, Bolignano D, Goldsmith D. Erytrhropoiesis-stimulating agents (ESA) for preventing the progression of chronic kidney disease: a meta-analysis of 19 studies. Am J Nephrol 2014; 40: 263-79.
- Fishbane S, Berns JS. Evidence and implications of haemoglobin cycling in anaemia management. Nephrol Dial Transplant 2007; 22: 2129-32.
- Gandra SR, Finkelstein FO, Bennett AV, Lewis EF, Brazg T, Martin ML. Impact of erythropoiesis-stimulating agents on energy and physical function in nondialysis CKD patients with anemia: a systematic review. Am J Kidney Dis 2010; 55: 519-34.
- Inker LA, Coresh J, Levey AS, Tonelli M, Muntner P. Estimated GFR, albuminuria, and complications of chronic kidney disease. J Am Soc Nephrol 2011; 22: 2322-31.
- Locatelli F, Barany P, Covic A et al. Kidney Disease: Improving Global Outcomes guidelines on anaemia management in chronic kidney disease: a European Renal Best Practice position statement. Nephrol Dial Transplant 2013; 28: 1346-59.
- MacDougall IC, Bock AH, Carrera F, Eckardt K-U, Gaillard C, Wyck D van, et al. FIND-CKD: a randomized trial of in-travenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anaemia. Neprhol Dial Transplant 2014; 29: 2075-84.
- Palmer SC, Saglimbene V,Mavridis D, SalantiG, Craig JC, TonelliM,WiebeN, StrippoliGFM. Erythropoiesis-stimulating agents for anaemia in adults with chronic kidney disease: a network meta-analysis. Cochrane Database of Systematic Reviews 2014, Issue 12. Art. No.: CD010590. DOI: 10.1002/14651858.CD010590.pub2.
- Pfeffer MA, Burdmann EA, Chen CYet al. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med 2009; 361: 2019-32.
- Solomon SD, Uno H, Lewis EF et al. Erythropoietic response and outcomes in kidney disease and type 2 diabetes. N Engl J Med 2010; 363: 1146-55.
- Stancu S, Barsan L, Stanciu A, Mircescu G. Can the response to iron therapy be predicted in anemic nondialysis patients with chronic kidney disease? Clin J Am Soc Nephrol 2010; 5: 409-16.
- Szczech LA, Barnhart HX, Inrig JK et al. Secondary analysis of the CHOIR trial epoetin-alpha dose and achieved hemo-globin outcomes. Kidney Int 2008; 74: 791-8.
- Tsuruya K, Uemara Y, Hirakata H, Kitazono T, Tsubakihara Y, Suzuki M, et al. Association between responsiveness to methoxy polyethylene glycol-epoetin beta and renal survival in patients with non-dialysis-dependent chronic kidney disease: a pooled analysis of individual patiënt-level data from clinical trials. Nepthol 2016; doi: 10.1002/NEP.12842.
- van Wyck DB, Roppolo M, Martinez CO, Mazey RM, McMurray S. A randomized, controlled trial comparing IV iron sucrose to oral iron in anemic patients with nondialysis-dependent CKD. Kidney Int 2005; 68: 2846-56.
- Walker AM, Schneider G, Yeaw J et al. Anemia as a predictor of cardiovascular events in patients with elevated serum creatinine. J Am Soc Nephrol 2006; 17: 2293-8.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 06-04-2018
Beoordeeld op geldigheid : 18-01-2018
De Nederlandse Federatie voor Nefrologie monitort de geldigheid van de aanbevelingen in deze modules. Indien nieuwe knelpunten of nieuwe evidence aanleiding zijn tot herziening van (delen van) deze modules, dan zal de NFN in overleg met de NIV hiertoe het initiatief nemen.
Algemene gegevens
De NIV-Modules zijn aanvullend op de multidisciplinaire richtlijn Chronische Nierschade. Voor verdere afbakening en verantwoording van de gevolgde procedures wordt verwezen naar de multidisciplinaire richtlijn Chronische Nierschade.
Deze richtlijn is ontwikkeld in samenwerking met:
- Nederlandse Federatie voor Nefrologie (NfN)
- PROVA
De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten.
Doel en doelgroep
De doelgroep van deze NIV-Modules zijn internisten-(nefrologen) en internisten in opleiding.
Samenstelling werkgroep
Aanvullend op de MDR Chronische Nierschade zijn 2e lijns knelpunten uitgewerkt door de drie internist-nefrologen uit de MDR werkgroep, te weten:
- Dhr. dr. Marc Hemmelder, internist-nefroloog, Nefrovisie, Utrecht, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie – voorzitter
- Dhr. prof. dr. Ron Gansevoort, internist-nefroloog, UMC Groningen, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
- Mw. dr. Neelke van der Weerd, internist-nefroloog, AMC, Amsterdam, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
Zij zijn daarbij ondersteund door. Mw. drs. Mariska Tuut, epidemioloog, PROVA, Varsseveld, in de rol van secretaris en methodoloog. Deze uitwerking heeft geresulteerd in 10 extra modules.
Bij het uitwerken van deze 2e lijns knelpunten is gebruik gemaakt van richtlijncommissie van de Nederlandse Federatie voor Nefrologie (NfN) en van de voorbereidende werkzaamheden van een reeds bestaande NfN werkgroep Chronische Nierschade, te weten prof.dr P.M. ter Wee (voorzitter), internist-nefroloog, VUmc, Amsterdam; prof.dr R.T. Gansevoort (secretaris), internist-nefroloog, UMC Groningen; dr E.C. Hagen, internist-nefroloog, Meander MC, Amersfoort; prof dr H.A.H. Kaasjager, internist-nefroloog, vasculair-geneeskundige, UMC Utrecht; dr C.J.A.M. Konings, internist-nefroloog, Catharina ziekenhuis, Eindhoven. (lid kwaliteitscommissie NfN); dr M.B. Rookmaaker, internist-nefroloog, UMC, Utrecht. (lid kwaliteitscommissie NfN); dr P.L. Rensma, internist-nefroloog, St Elisabeth ziekenhuis, Tilburg; dr N.C. van de Weerd, internist-nefroloog, AMC, Amsterdam; prof.dr J.F.M. Wetzels internist-nefroloog, Radboudumc, Nijmegen.
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde. De werkgroep heeft adviezen voor implementatie (implementatieplan) en indicatoren geformuleerd. Deze zijn opgenomen onder de aanverwante producten.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, aandacht aan de richtlijn te besteden op congressen, en nascholingsmateriaal en voorlichtingsmateriaal te ontwikkelen, om zo de implementatie van de richtlijn te bevorderen.
Een voor patiënten begrijpelijke samenvatting van de aanbevelingen uit deze richtlijn komt beschikbaar via www.thuisarts.nl. Een verdieping daarvan komt beschikbaar via de website van de Nierstichting/Nederlandse Vereniging van Nierpatiënten.
Zoekverantwoording
Database: MEDLINE <1946 to Present incl: Epub Ahead of Print, In-Process & Other Non-Indexed Citations, and MEDLINE Daily>
Search Strategy: med20161015 CKD ESA totaal"
--------------------------------------------------------------------------------
1 "chronische nierschade".ti. (0)
2 renal insufficiency, chronic/ (12255)
3 exp kidney failure, chronic/ (84678)
4 kidney diseases/ and chronic.ti,ab. (11221)
5 ((chronic or progressive) adj2 (renal or kidney)).ti,ab. (66999)
6 (chronic adj (kidney or renal) adj insufficienc*).ti,ab. (4792)
7 CKD.ti,ab. (18352)
8 ((chronic or progressive) adj2 (renal or kidney)).kf. (4570)
9 (chronic adj (kidney or renal) adj insufficienc*).kf. (78)
10 CKD.kf. (1012)
11 diabetic nephropathies/ (21817)
12 exp glomerulonephritis/ (43748)
13 exp proteinuria/ (35893)
14 acidosis, renal tubular/ (2655)
15 exp hypertension, renal/ (19567)
16 (diabetic adj (kidney or renal) adj (disease* or failure)).ti,ab. (1860)
17 ((renal or renovascular) adj2 hypertensi*).ti,ab. (13462)
18 (glomerulosclerosis or glomerulonephritis or nephropath* or proteinuria* or albuminuria or microalbuminuria).ti,ab. (104354)
19 (glomerular adj (sclerosis or nephritis)).ti,ab. (1948)
20 ((renal or distal or proximal or tubul*) adj2 acidos*).ti,ab. (2970)
21 hyperuricemia/ or hyperuric?emi*.ti,ab. (7101)
22 exp hyperparathyroidism, secondary/ (7679)
23 (renal adj2 (osteo* or hyperparathyroidism)).ti,ab. (3381)
24 or/2-23 (282755)
25 ureteral obstruction/ (12358)
26 exp urethral obstruction/ (10066)
27 ((uropath* or ureter* or urethra*) adj obstruct*).ti,ab. (6348)
28 (renal of kidney or chronic).ti,ab. (955408)
29 (25 or 26 or 27) and 28 (1345)
30 24 or 29 (283474)
31 (transplant* or donor* or graft* or allograft*).ti. (362951)
32 pregnan*.ti. (200208)
33 *renal dialysis/ not (predialysis or pre dialysis or ("not" adj4 dialysis)).ti. (55320)
34 30 not (31 or 32 or 33) (234584)
35 "P voor chronische nierschade".ti. (0)
36 glomerular filtration rate.tw. (33355)
37 gfr.kf. (291)
38 gfr.tw. (16581)
39 Glomerular Filtration Rate/ (37428)
40 (G3?? or moderat* or medium or decreas*).tw. (2739866)
41 (G4?? or G5?).tw. (12591)
42 (G4?? or G5?).ti. (1225)
43 or/36-42 (2785913)
44 34 and 43 (54684)
45 "filter systematic reviews".ti. (0)
46 meta analysis.pt. (74283)
47 (meta-anal$ or metaanal$).af. (131717)
48 (quantitativ$ adj10 (review$ or overview$)).tw. (6351)
49 (systematic$ adj10 (review$ or overview$)).tw. (105303)
50 (methodologic$ adj10 (review$ or overview$)).tw. (8490)
51 medline.tw. and review.pt. (60523)
52 (pooled adj3 analy*).tw. (12774)
53 or/46-52 (233674)
54 "filter systematic reviews".ti. (0)
55 "cochrane$".fc_jour. (16243)
56 53 or 55 (235307)
57 (dutch or english or french or german).la. (23931180)
58 "sensitief filter voor RCT's van Cochrane".ti. (0)
59 randomized controlled trial.pt. (432907)
60 controlled clinical trial.pt. (91818)
61 (randomized or randomised).ab. (448501)
62 placebo.ab. (180128)
63 drug therapy.fs. (1915943)
64 randomly.ab. (265223)
65 trial.ab. (388186)
66 groups.ab. (1647882)
67 or/59-66 (3932398)
68 67 not (exp animals/ not humans/) (3393853)
69 "filter rct cochrane sensitief".ti. (0)
70 "filter medline observationele studies".ti. (0)
71 epidemiologic studies/ (7301)
72 exp case-control studies/ (819134)
73 exp cohort studies/ (1600505)
74 cross-sectional studies/ (228847)
75 (case adj3 control).af. (266063)
76 (cohort adj5 (study or studies or analy$)).af. (310413)
77 (cohort adj5 (study or studies or analy$)).af. (310413)
78 (follow-up adj5 (study or studies)).af. (602254)
79 (longitudinal or retrospective or prospective or (cross adj5 sectional)).af. (1768588)
80 (observational adj5 (study or studies)).af. (104947)
81 or/71-80 (2492773)
82 "filter observationele studies einde".ti. (0)
83 (progre* adj5 kidney adj5 diseas*).ti. (859)
84 disease progression/ (126624)
85 disease progression.kf. (629)
86 disease progression.tw. (55214)
87 exp Arrhythmias, Cardiac/ (183655)
88 (Arrhythmia* or dysrhythmia*).tw. (75342)
89 (Arrhythmia* or dysrhythmia*).kf. (5805)
90 or/87-89 (214073)
91 erythropoietin/ or epoetin alfa/ (22246)
92 erythropoietin.kf. (1040)
93 erythropoietin.ti,ab. (23667)
94 (epoetin or epogen or ESA or darbopoetin or aranesp or mircera).tw. (4334)
95 (epoetin or epogen or ESA or darbopoetin or aranesp or mircera).rn. (1792)
96 (epoetin or epogen or ESA or darbopoetin or aranesp or mircera).kf. (132)
97 or/91-96 (31366)
98 83 or 84 or 85 or 86 or 87 or 88 or 89 (380704)
99 exp Cardiovascular Diseases/pc [Prevention & Control] (171737)
100 (cardiovascul* adj3 prevent*).tw. (12067)
101 (cardiovascul* adj3 prevent*).kf. (246)
102 ae.fs. (1510100)
103 erythropoietin/ae or epoetin alfa/ae (1697)
104 or/98-103 (1962685)
105 34 and 57 and 43 and 97 and 56 (29)= systrev
106 34 and 57 and 43 and 97 and 68 (522)
107 106 and 104 (160)
108 107 not 105 (144)= rct
109 (34 and 57 and 43 and 97 and 81) not (56 or 68) (93)= observat
