Dislipidemie bij chronische nierschade
Uitgangsvraag
Is bij patiënten met chronische nierschade behandeling met een statine (en/of ezetimibe) aangewezen teneinde het risico op cardiovasculaire en renale eindpunten en mortaliteit te verlagen?
Aanbeveling
Bij volwassenen met chronische nierschade wordt aangeraden eenmalig een lipidenprofiel (totaal cholesterol, LDL cholesterol, HDL cholesterol, triglyceriden) te bepalen.
Bij patiënten met chronische nierschade is routinematig meten van het lipidenprofiel tijdens medicamenteuze behandeling niet noodzakelijk.
Patiënten met chronische nierschade en matig of sterk verhoogd risico (oranje en rode risico categorieën in de tabel) hebben een (zeer) hoog cardiovasculair risico. Behandeling met een statine of combinatie statine/ezetimibe ter preventie van cardiovasculaire ziekte wordt aanbevolen.
Bij patiënten met chronische nierschade en mild verhoogd risico (gele risico categorie in de tabel) wordt behandeling met een statine overwogen afhankelijk van de schatting van het cardiovasculair risico, waarbij chronische nierschade als additionele risicofactor moet worden meegenomen.
Bij patiënten met chronische nierschade en eGFR < 30 ml/min/m2 met een BMI lager dan 28 kg/m2 en/of een totaal cholesterol lager dan 5,5 mmol/l, kan overwogen worden af te zien van medicamenteuze behandeling met een statine.
Overwegingen
Dislipidemie komt veel voor bij patiënten met een verminderde nierfunctie [Kasiske, 1998]. Bij nieuwe patiënten wordt het lipidenspectrum geëvalueerd om (secundaire) vormen van dislipidemie, die hun eigen behandeling kennen, te identificeren (nuchter LDL-C > 4,9 mmol/L of triglyceriden > 11,3 mmol/L). Echter, er wordt in het algemeen geen gebruik meer gemaakt van streefwaarden voor de lipiden.
Het standaard volgen van het lipidenprofiel wordt afgeraden omdat er onvoldoende bewijs is dat het nastreven van een bepaald LDL doel een gunstig effect heeft op het cardiovasculair risico bij chronische nierschade [Hayward, 2012]. Daarbij staat de grote variatie in de meting een betrouwbare follow-up in de weg [Glasziou, 2008; Takahashi, 2010]. Redenen om toch het lipidenprofiel te volgen kunnen zijn: 1) de verdenking op een (nieuwe) secundaire hyperlipidemie, 2) bevordering van de compliantie, 3) bepalen van het cardiovasculaire risico bij een patiënt die nog geen statine gebruikt.
Bij het maken van een kosten-effectiviteitsafweging ten aanzien van het voorschrijven van statines ter voorkoming van cardiovasculaire events, moeten de volgende factoren worden afgewogen: 1) het risico op een event, 2) het effect op mortaliteit en 3) de effectiviteit van de interventie. Een event-risico van meer dan 10% per 10 jaar wordt beschouwd als voldoende hoog om eventuele behandeling met een statine te rechtvaardigen [NCEP, 2001; Cooper, 2008; Graham, 2007]. Bijna alle patiënten met chronische nierschade hebben een risico op een cardiovasculair event van meer dan 10% per 10 jaar. Dat geldt in ieder geval voor patiënten uit de rode of oranje risicocategorie met een eGFR <30 ml/min/m2. Bij patiënten met een BMI < 28 kg/m2 en/of een totaal cholesterol lager dan 5,5 mmol/l kan overwogen worden om af te zien van medicamenteuze cholesterolverlaging. Gebleken is dat bij deze groepen patiënten met CNS er geen relatieve risicoreductie is op cardiovasculaire events [Baigent, 2011]. Na uitgebreide discussie wijkt de werkgroep hierin af van het advies in internationale richtlijnen zoals de KDIGO richtlijn. Tenslotte is het voor de behandelindicatie relevant om zich te realiseren dat de mortaliteit van een cardiovasculair event bij patiënten met chronische nierschade hoger is dan in de algemene populatie [Tonelli, 2012].
Bij het starten van een statine is te overwegen om eenmalig transaminasen te bepalen, omdat leverfunctiestoornissen een contra-indicatie voor statinebehandeling zijn. Het controleren van transaminasen en creatinine kinase hoeft alleen op indicatie te gebeuren, gezien de lage kans op afwijkingen ten gevolge van statinegebruik.
Systematische reviews bleken voor de behandeling van patiënten met chronische nierschade met ezetimibe niet voorhanden. Wel is er een grote placebogecontroleerde randomized controlled trial over de behandeling van patiënten met chronische nierschade met simvastatine in combinatie met ezetimibe als cholesterolverlager [Baigent, 2011]. Volgens de inhoudelijk experts in de werkgroep is dit de enige relevante studie op dit gebied. In deze SHARP studie werden 9270 patiënten met matige tot ernstige chronische nierschade (1/3 betrof patiënten met dialyse) zonder myocard infarct of coronaire revascularisatie in de voorgeschiedenis gerandomiseerd tussen simvastatine 20 mg in combinatie met ezetimibe 10 mg of placebo. De primaire uitkomstmaat was een major atherosclerotisch event. De mediane follow-up bedroeg 4,9 jaar, waarbij de gemiddelde LDL-cholesterol in de interventiegroep 0,85 mmol/L lager was dan in de placebogroep. In de simvastatine plus ezetimibegroep had 11,3% een atherosclerotisch event, in de placebogroep was dit 13,4%. Het relatieve risico was 0,83 (95%BI: 0,74-0,94). De NNT is 48.
T.a.v. de keuze voor een statine en de dosering wordt geadviseerd gebruik te maken van standaarddoseringen van statines waarvan positieve effecten in studies zijn aangetoond bij patiënten met een klaring <60 ml/min/1,73m2 met een acceptabel bijwerkingenprofiel (zie tabel 1).
Tabel 1. De aanbevolen dosis van de verschillende statines bij CNS
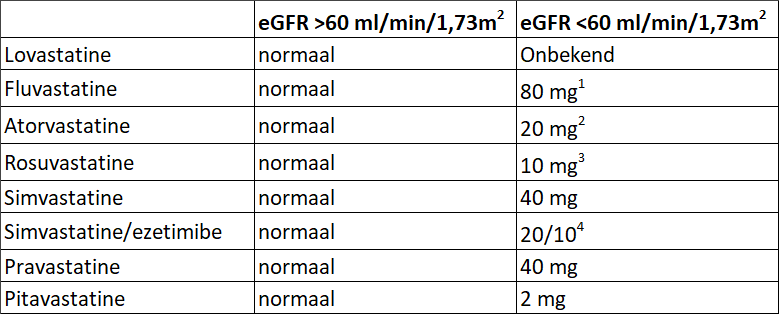
Toelichting: normaal betekent: dosis als in algemene bevolking. Data gebaseerd op 1: ALERT, 2: 4D, 3: AURORA, 4: SHARP. [Holdaas, 2003; Wanner, 2005; Fellstrom, 2009; Baigent, 2011].
Onderbouwing
Conclusies / Summary of Findings
|
MATIG |
Gebruik van statines door patiënten met chronische nierschade is geassocieerd met een verlaging van het risico op mortaliteit en cardiovasculaire aandoeningen, maar de absolute risicoreductie is beperkt. Er is geen eenduidig bewijs dat statinegebruik leidt tot betere renale uitkomsten, alhoewel kleine positieve effecten op afname eGFR en albuminurie zijn aangetoond. Er is geen bewijs dat behandeling met statines bij patiënten met chronische nierschade is geassocieerd met ernstige bijwerkingen. Er is geen bewijs in systematische reviews gevonden over de effecten van ezetimibe op cardiovasculaire of renale uitkomstmaten. Palmer, 2012; Sanguankeo, 2015; Su, 2016 |
Samenvatting literatuur
De studie van Athyros et al. bleek bij bestudering van de volledige tekst geen systematisch opgezet onderzoek te betreffen en is daarom geëxcludeerd [Athyros, 2015]. De studie van Erickson et al. bleek geen review naar de effectiviteit van statines te betreffen en viel daarom ook af [Erickson, 2013]. De overgebleven studies bleken systematische reviews en meta-analyses. Daarbij was er een grote overlap in de trials die in deze meta-analyses zijn geïncludeerd. Besloten is om een mix van artikelen te kiezen waarin alle geïncludeerde studies zijn opgenomen en deze full tekst te bestuderen. De overige systematische reviews vielen daarbij af, vanwege volledige overlap qua relevante geïncludeerde studies [Geng, 2014; Zhang, 2016; Barylski, 2013; Yan, 2015; Upadhyay, 2012; Zhang, 2014; Savarese, 2013; Hou, 2013; Galvao, 2014; Navaneethan, 2009; Nikolic, 2013]. Voor alle reviews geldt dat deze adequaat zijn uitgevoerd en dat er geen belangrijke inconsistentie of imprecisie is gedetecteerd. Ook zijn er geen aanwijzingen voor publicatiebias. Desalniettemin is de overall kwaliteit van de evidence beperkt. Dat heeft te maken met beperkingen in de studie-opzet van de in de systematische reviews geïncludeerde trials (risk of bias ten aanzien van bijvoorbeeld randomisatie, blindering, selectieve rapportage, en beperkte follow-up).
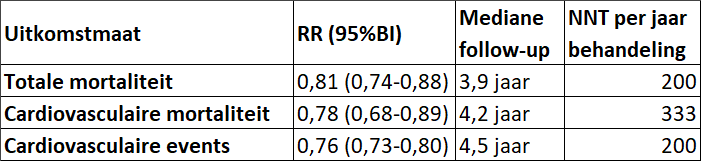
Palmer et al. publiceerden een systematische review over de voor- en nadelen van statines bij patiënten met chronische nierschade [Palmer, 2012]. Hierbij bestudeerden zij onder meer mortaliteit, cardiovasculaire mortaliteit en cardiovasculaire events, eindstadium nierfalen, nierfunctie en proteïnurie. In de studie werden 89 trials met in totaal 56.857 personen geïncludeerd. Voor deze richtlijn is alleen gekeken naar patiënten met chronische nierschade, die geen dialyse ondergingen (48 trials met in totaal 39.820 personen). De resultaten uit de meta-analyses van Palmer et al. staan in tabel 1 en 2.
Tabel 1. Resultaten meta-analyses mortaliteit en cardiovasculair
Tabel 2. Resultaten meta-analyses renale uitkomstmaten

Er werden geen significante verschillen gevonden in nadelige effecten zoals kanker, myalgie, verhoogde creatinine kinase, rhabdomyolyse, abnormale leverfunctie of voortijdig staken van behandeling.
Sanguankeo et al. publiceerden een systematische review met meta-analyse over de effecten van statines op renale uitkomsten bij patiënten met chronische nierschade [Sanguankeo, 2015]. In deze review werden 10 studies (9 clinical trials en één prospectief cohortonderzoek) geïncludeerd met in totaal 18.126 patiënten met chronische nierschade (eGFR 15-59 ml/min/1,73 m2). De studieduur varieerde van 12 tot 63 maanden. Wanneer gekeken werd naar de verandering van de eGFR per jaar werd er een significant gemiddeld verschil gevonden van 0,10 ml/min/1,73 m2 (95%BI: 0,09-0,12) in het voordeel van de groep die statines gebruikten, maar wanneer er gekeken werd naar de totale eGFR verandering na een follow-up variërend van 12 tot 58 maanden was dit niet significant (gemiddeld verschil 1,78 ml/min/1,73 m2; 95%BI: -0,26 tot 3,81). Bij deze laatste vergelijking was sprake van heterogeniteit. Er was eveneens geen statistisch significant verschil voor de uitkomst maten proteïnurie (gemiddeld verschil 0,19 g/dag; 95%BI: -0,02 tot 0,40), eindstadium nierfalen (RR: 0,97; 95%BI: 0,90-1,06) en 50% reductie van eGFR (RR: 0,93; 95%BI: 0,86-1,01). Een subanalyse voor groepen met hoog-intensieve statine behandeling (LDL-C reductie 34-40%) liet een groter verschil in eGFR verandering zien (gemiddeld verschil 3,35 ml/min/1,73 m2; 95%BI: 0,91-5,79). Bij matig intensieve en laag intensieve behandeling werd geen statistisch significant verschil gevonden tussen behandeling met statines en controles.
Su et al. publiceerden een systematische review met meta-analyses over het effect van statines op renale uitkomsten [Su, 2016]. In deze studie werden zowel trials bij patiënten met als bij patiënten zonder chronische nierschade geïncludeerd. In deze literatuur review worden alleen de resultaten bij patiënten met chronische nierschade gerapporteerd. In 27 studies met in totaal 17.230 patiënten met chronische nierschade werd gekeken naar de verandering van nierfunctie (eGFR). Dit gemiddelde verschil was 0,15 ml/min/1,73 m2 in het voordeel van statinegebruikers (95%BI: 0,08-0,22). De follow-up in deze studies varieerde van 6 maanden tot 6 jaar. Het gemiddelde verschil in albuminurie was bij patiënten met chronische nierschade -0,62 g/dag (95%BI: -1,10 tot -0,17). Er was geen statistisch significant verschil tussen statinegebruikers en controles qua risico op nierfalen (OR: 0,92; 95%BI: 0,83-1,02). Het risico op het krijgen van een major cardiovasculair event was lager in de groepen patiënten met chronische nierschade die statines gebruikten dan bij controles (OR: 0,70; 95%BI: 0,62-0,79) met een NNT van 25, hetgeen vergelijkbaar is met de vermindering van het risio in populaties met personen met coronaire hartziekten.
Over behandeling van patiënten met chronische nierschade met ezetimibe en het effect op cardiovasculaire of renale uitkomsten zijn geen systematische reviews beschikbaar. Wel is ezetimibe gebruikt naast simvastatine in de SHARP trial [Baigent, 2011]. Deze studie heeft bij patiënten met CNS getoond dat de combinatie simvastatine-ezetimibe (20/10mg) het risico op cardiovasculaire events vermindert, zonder toename van ernstige bijwerkingen.
Geen van de bovengenoemde studies gebruikte een streefwaarde voor cholesterol.
Zoeken en selecteren
Voor een antwoord op deze uitgangsvraag is op 14 oktober 2016 naar literatuur gezocht in Medline (zie de zoekverantwoording). Dit leverde 227 abstracts op. Deze abstracts zijn op onderwerp (sluit het artikel aan bij de uitgangsvraag?) en research design (systematische reviews) geselecteerd, wat resulteerde in 14 artikelen, die fulltekst zijn beoordeeld.
Referenties
- Athyros VG, Katsiki N, Karagiannis A, Mikhailidis DP. Statins can improve proteinuria and glomerular filtration rate loss in chronic kidney disease patients, further reducing cardiovascular risk. Fact or fiction? Expert Opin Pharm Ther 2015; 10: 1449-61.
- Baigent C, Landray MJ, Reith C et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011; 377: 2181-92.
- Barylski M, Nikfar S, Mikhailidis DP, Toth PP, Salari P, Ray KK, et al. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy A meta-analysis of 11 randomized controlled trials involving 21,295 participants. Pharmacol Res 2013; 72: 35-44.
- Cooper A, Nherera L, Calvert N et al. Clinical Guidelines and Evidence Review for Lipid Modification: Cardiovascular Risk Assessment and the Primary and Secondary Prevention of Cardiovascular Disease. Lipid Modification: Cardiovascular Risk Assessment and the Modification of Blood Lipids for the Primary and Secondary Prevention of Cardiovascular Disease. National Collaborating Centre for Primary Care and Royal College of General Practitioners, London, 2008.
- Erickson KF, Japa S, Owens DK, Chertow GM, Garber AM, Goldhaber-Fiebert JD. Cost-effectiveness of statins for primary cardiovascular prevention in chronic kidney disease. J Am Coll Cardiol 2013; 61: 1250-8.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486-97.
- Fellstrom BC, Jardine AG, Schmieder RE et al. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis. N Engl J Med 2009; 360: 1395-1407.
- Galvao TF, Araujo MEA, Penha AP, Silva MT. Statins for early stage chronic kidney disease: an overview of reviews. Cardio-vasc Haem Dis Drug Targ 2014; 14: 205-11.
- Geng Q, Ren J, Song J, Li S, Chen H. Meta-analysis of the effect of statins on renal function. Am J Cardiol 2014; 114: 562-70.
- Glasziou PP, Irwig L, Heritier S et al. Monitoring cholesterol levels: measurement error or true change? Ann Intern Med 2008; 148: 656-61.
- Graham I, Atar D, Borch-Johnsen K et al. European guidelines on cardiovascular disease prevention in clinical practice. Fourth Joint Task Force of the European Society of Cardiology and other societies on cardiovascular disease prevention in clinical practice. Eur J Cardiovasc Prev Rehabil 2007; 14(Suppl 2): S1-113.
- Hayward RA, Krumholz HM. Three reasons to abandon low-density lipoprotein targets: an open letter to the Adult Treat-ment Panel IV of the National Institutes of Health. Circ Cardiovasc Qual Outcomes 2012; 5: 2-5.
- Holdaas H, Fellstrom B, Jardine AG et al. Effect of fluvastatin on cardiac outcomes in renal transplant recipients: a multicentre, randomised, placebo-controlled trial. Lancet 2003; 361: 2024-31.
- Hou W, Lv J, Perkovic V, Yang L, Zhao N, Jardine MJ. Effect of statin therapy on cardiovascular and renal outcomes in pa-tients with chronic kidney disease: a systematic review and meta-analysis. Eur Heart J 2013; 34: 1807-17.
- Kasiske BL. Hyperlipidemia in patients with chronic renal disease. Am J Kidney Dis 1998; 32: S142-56.
- Lewington S, Whitlock G, Clarke R et al. Blood cholesterol and vascular mortality by age, sex, and blood pressure: a meta-analysis of individual data from 61 prospective studies with 55,000 vascular deaths. Lancet 2007; 370: 1829-39.
- Navaneethan SD, Pansini F, Perkovic V,Manno C, Pellegrini F, JohnsonDW, Craig JC, StrippoliGFM.HMGCoA reductase inhibi-tors (statins) for people with chronic kidney disease not requiring dialysis. Cochrane Database of Systematic Reviews 2009, Issue 2. Art. No.: CD007784. DOI: 10.1002/14651858.CD007784.
- Nikolic D, Banach M, Nikfar S, Salari P, Mikhailidis DP, Toth PP, et al. A meta-analysis of the role of statins on renal out-comes in patients with chronic kidney disease. Is the duration of therapy important? Int J Cardiol 2013; 168: 5437-47.
- Palmer SC, Craig JC, Navaneethan SD, Tonelli M, Pellegrini F, Strippoli GFM. Benefits and harms of statin therapy for persons with chronic kidney disease. A systematic review and meta-analysis. Ann Intern Med 2012; 157: 263-75.
- Sanguankeo A, Upala S, Cheungpasitpron W, Ungprasert P, Knight EL. Effects of statins on renal outcome in chronic kidney disease patients: a systematic review and meta-analysis. PLOS One 2015; 10: e0132970.
- Savarese G, Musella F, Volpe M, Paneni F, Perrone-Filardi P. Effects of atorvastatin and rosuvastatin on renal function: a meta-analysis. Int J Cardiol 2013; 167: 2482-9.
- Stone NJ, Robinson JG, Lichtenstein AH et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129(25 Suppl 2): S1-45.
- Su X, Zhang L, Lv J, Wang J, Hou W, Xie X, et al. Effects of statins on kidney disease outcomes: a systematic review and meta-analysis. Am J Kidney Dis 2016; 67: 881-92.
- Takahashi O, Glasziou PP, Perera R et al. Lipid re-screening: what is the best measure and interval? Heart 2010;96:448-52
- Tonelli M, Muntner P, Lloyd A et al. Association between LDL-C and Risk of Myocardial Infarction in CKD. J Am Soc Nephrol 2013; 24: 979-86.
- Tonelli M, Muntner P, Lloyd A et al. Risk of coronary events in people with chronic kidney disease compared with those with diabetes: a population-level cohort study. Lancet 2012; 380: 807-14.
- Upadhyay A, Earley A, Lamont JL, Haynes S, Wanner C, Balk EM. Lipid-lowering therapy in persons with chronic kidney disease. Ann Intern Med 2012; 157: 251-62.
- Wanner C, Krane V, Marz W et al. Atorvastatin in patients with type 2 diabetes mellitus undergoing hemodialysis. N Engl J Med 2005; 353: 238-48.
- Yan, Y-L, Qiu B, Wang J, Deng S-B, Wu L, Jing X-D, et al. High-intensity statin therapy in patients with chronic kidney disease: a systematic review and meta-analysis. BMJ Open 2015; 5: e006886.
- Zhang X, Xiang C, Zhou Y-H, Jiang A, Qin Y-J, He J. Effects of statins on cardiovascular events in patients with mild to moderate chronic kidney disease: a systematic review and meta-analysis of randomized clinical trials. BMC Cardiovasc Dis 2014; 14: 19.
- Zhang Z, Wu, P, Zhang J, Wang S, Zhang G. The effects of statins on microalbuminuria, proteinuria, progression of kidney function, and all-cause mortality in patients with nonend stage chronic kidney disease: a meta-analysis. Pharmacol Res 2016; 105: 74-83.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 18-01-2018
Jaarlijks wordt door de initiatiefnemers van de ontwikkeling van deze richtlijn bepaald of actualisatie van de richtlijn nodig is. Indien actualisatie gewenst is, spannen de initiatiefnemers zich in om de hiervoor noodzakelijke voorwaarden (bijvoorbeeld financiering, samenstelling werkgroep) te realiseren. Nieuwe of nog niet behandelde knelpunten kunnen aanleiding zijn tot actualisatie van de richtlijn.
Bij publicatie van de nieuwe multidisciplinaire richtlijn Cardiovasculair Risicomanagement (die in 2017 in herziening is genomen) zullen de aanbevelingen die raakvlak hebben met de richtlijn Cardiovasculair Risicomanagement zo nodig worden geactualiseerd.
Algemene gegevens
Deze richtlijn is ontwikkeld in samenwerking met:
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlandse Federatie voor Nefrologie
- Nederlandse Vereniging van Diëtisten / Diëtisten Nierziekten Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Nierpatiënten Vereniging Nederland
Met ondersteuning van:
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging
- PROVA
De ontwikkeling van deze richtlijn is gefinancierd vanuit een projectbudget door de Stichting Kwaliteitsgelden Medisch Specialisten en het Nederlands Huisartsen Genootschap.
Doel en doelgroep
Doel
Het doel van deze richtlijn is de kwaliteit van zorg en patiëntveiligheid van patiënten met CNS te waarborgen en waar mogelijk te verbeteren. In deze richtlijn zijn aanbevelingen geformuleerd die professionals in de zorg hiertoe handvaten geven. Daarbij is het doel bovendien de zorg in de eerste en tweede lijn zoveel mogelijk op elkaar af te stemmen en daarbij uitdrukkelijk het patiëntenperspectief een plaats te geven.
Doelgroep
De doelgroep van deze richtlijn zijn professionals die zich bezig houden met de zorg voor patiënten met CNS. Hieronder worden in ieder geval verstaan: huisartsen, internisten, internist-nefrologen, apothekers, laboratoriumspecialisten klinische chemie en diëtisten. Ook andere professionals, zoals andere medisch specialisten, verpleegkundigen en maatschappelijk werkenden, kunnen hun voordeel doen met deze richtlijn.
Samenstelling werkgroep
Voor de ontwikkeling van deze richtlijn is een multidisciplinaire werkgroep ingesteld, onder voorzitterschap van dhr. dr. Marc Hemmelder, internist-nefroloog, en mw. drs. Jacintha van Balen, huisarts. In de werkgroep hebben gemandateerde vertegenwoordigers van de volgende beroepsverenigingen zitting:
- Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Nederlands Huisartsen Genootschap
- Nederlandse Internisten Vereniging / Nederlandse Federatie voor Nefrologie
- Nederlandse Vereniging van Diëtisten / Diëtisten Nierziekten Nederland
- Nederlandse Vereniging van Ziekenhuisapothekers
- Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
Om het patiëntenperspectief in de werkgroep te waarborgen, hadden twee vertegenwoordigers van de Nierpatiënten Vereniging Nederland zitting in de werkgroep. De werkgroep werd procedureel en methodologisch ondersteund door PROVA. Logistieke ondersteuning is gegeven door de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap. Het secretariaat is gevoerd door het Nederlands Huisartsen Genootschap.
Synchroon aan de ontwikkeling van deze multidisciplinaire richtlijn zijn de NHG-Standaard Chronische Nierschade en aanvullende NIV-modules Chronische Nierschade ontwikkeld. De werkgroepleden van de Standaardwerkgroep en van de NIV-werkgroep maakten deel uit van de werkgroep van de multidisciplinaire richtlijn, om zo alle trajecten zo veel mogelijk op elkaar af te stemmen.
- Mw. drs. Jacintha van Balen, huisarts, Nederlands Huisartsen Genootschap, Utrecht, namens het Nederlands Huisartsen Genootschap – voorzitter
- Dhr. dr. Marc Hemmelder, internist-nefroloog, Nefrovisie, Utrecht, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie – voorzitter
- Mw. drs. Mariska Tuut, epidemioloog, PROVA, Varsseveld – secretaris
- Dhr. Peter van Cuijk, Apeldoorn, ervaringsdeskundige, namens de Nierpatiënten Vereniging Nederland
- Dhr. prof. dr. Ron Gansevoort, internist-nefroloog, UMC Groningen, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
- Dhr. dr. Wim de Grauw, huisarts te Berghem, Radboudumc, Nijmegen, namens het Nederlands Huisartsen Genootschap
- Mw. Inez Jans, diëtist, Ziekenhuis Gelderse Vallei, Ede, namens Nederlandse Vereniging van Diëtisten en Diëtisten Nierziekten Nederland
- Mw. dr. Birgit Koch, ziekenhuisapotheker-klinisch farmacoloog, Erasmus MC, Rotterdam, namens de Nederlandse Vereniging van Ziekenhuisapothekers
- Mw. drs. Karen de Leest, apotheker, Apotheek de Roerdomp, Nieuwegein, namens de Koninklijke Nederlandse Maatschappij ter Bevordering der Pharmacie
- Mw. drs. Karen Prantl, Bussum, coördinator kwaliteit & onderzoek, Nierpatiënten Vereniging Nederland, namens de Nierpatiënten Vereniging Nederland
- Dhr. dr. Paul Schenk, laboratoriumspecialist klinische chemie / klinisch chemicus, LUMC, Leiden, namens de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde
- Mw. dr. Nynke Scherpbier, huisarts, Radboudumc, Nijmegen, namens het Nederlands Huisartsen Genootschap
- Mw. drs. Judith Tjin-A-Ton, huisarts, Amstelveen, namens het Nederlands Huisartsen Genootschap
- Mw. dr. Neelke van der Weerd, internist-nefroloog, AMC, Amsterdam, namens de Nederlandse Internisten Vereniging en de Nederlandse Federatie voor Nefrologie
Belangenverklaringen
|
Naam |
Namens |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Reputatie-management |
Extern gefinancierd onderzoek |
Kennis-valorisatie |
Overige belangen |
|
Jacintha van Balen |
NHG |
Huisarts 0,6 FTE; Teamleider afdeling Richtlijnen en Wetenschap |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Marc Hemmelder |
NIV / NFN |
Internist-nefroloog Medisch Centrum Leeuwarden (0,6 FTE) Uitvoerend bestuurder Nefrovisie (0,4 FTE) |
Geen |
Geen |
Geen |
Geen |
Dolomites studie van Astellas |
Renine, registratie van patiënten met nierfunctievervaning in Nederland. Onderdeel van Nefrovisie |
Geen |
|
Mariska Tuut |
onafhankelijk |
Eigenaar PROVA, adviesbureau voor procesmatige en methodologische ondersteuning bij de ontwikkeling van evidence-based richtlijnen en andere kwaliteitsinstrumenten |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Peter van Cuijk |
NVN |
Ruim 35 jaar gewerkt in de Jeugdhulpverlening als orthopedagoog en manager. Ervaring in diverse settingen en diverse functie's, zowel inhoudelijk, uitvoerend en in de aansturing/management. |
bestuursfunctie (penningmeester) amateur-theatervereniging De Apeldoornse Komedie |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
|
Ron Gansevoort |
NIV / NFN |
Internist-nefroloog, UMCG |
Lid bestuur Nederlandse Federatie voor Nefrologie (sectie Wetenschap); Lid Wetenschappelijke Adviesraad Nierstichting; Lid redactie wetenschappelijke tijdschriften: American Journal of Kidney Diseases, Clinical Journal of the American Society of Neprology, European Medical Journal Nephrology, Journal of Nephrology, Nephrology Dialysis and Transplantation, Nephron Clinical Practice (alle functies onbetaald) |
Geen |
Geen |
Lid wetenschappelijke adviesraad Nierstichting |
Geen |
Geen |
Geen |
|
Wim de Grauw |
NHG |
Huisarts te Berghem (0,7 fte); Senior staflid huisarts-onderzoeker afdeling Eerstelijns Geneeskunde Radboudumc Nijmegen (0,3 fte) |
Herder bij diverse professionele begrazingsbedrijven |
Geen |
Geen |
Onderzoek op het gebied van Chronische Nierschade is een belangrijk onderdeel van de onderzoekslijn vaatschade van de afdeling Eerstelijnsgeneeskunde Radboudumc in samenwerking met de afdeling Nefrologie Radboudumc |
De afdeling Eerstelijns Geneeskunde ontvangt subsidie van de Nierstichting Nederland voor onderzoek op het gebied van Chronische Nierschade |
Afdeling Eerstelijnsgeneeskunde Radboudumc heeft samen met de afdeling Nefrologie Radboudumc en Zorgdomein Telenefrologie ontwikkeld, een e-health applicatie voor consultatie tussen huisarts en nefroloog |
Geen |
|
Inez Jans |
NVD / DNN |
Diëtist, aandachtsgebied nierziekten en voedingsteam, Ziekenhuis Gelderse Vallei (fulltime dienstverband) |
Extern assessor Hogeschool van Arnhem en Nijmegen, opleiding Voeding en Diëtetiek (flex contract); Actief lid Diëtisten Nierziekten Nederland (voorzitter DNN werkgroep kwaliteit; lid DNN werkgroep richtlijnen); vanuit die rol lid van de werkgroep multidisciplinaire richtlijn chronisch nierfalen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Birgit Koch |
NVZA |
Ziekenhuisapotheker-klinisch farmacoloog 0,85 FTE |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
ZonMw: PK/PD antipsychotica; Stichting Coolsingel: middelenmisbruik zwangerschap |
n.v.t. |
n.v.t. |
|
Karen de Leest |
KNMP |
Apotheker, Apotheek de Roerdomp, Nieuwegein, 24 uur/week |
Wetenschappelijk medewerker KNMP, 10 uur/week |
Geen |
Geen |
Redactielid Vascuzine, tijdschrift v.d. Vasculitis patiënten vereniging, vrijwilligerswerk, geen boegbeeldfunctie |
Geen |
Geen |
Nee |
|
Karen Prantl |
NVN |
Beleidsmedewerker kwaliteit |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Paul Schenk |
NVKC |
Klinisch chemicus/ laboratoriumspecialist Klinische chemie, LUMC Leiden (voltijds, loondienst) |
Geen nevenwerkzaamheden buiten LUMC |
Geen persoonlijke financiële belangen |
Geen relevante persoonlijke relaties als hier bedoeld |
Geen relevante posities als hier bedoeld |
Geen relevant extern gefinancierd onderzoek |
Geen relevante valorisatie |
Nee, geen relevante overige belangen |
|
Nynke Scherpbier |
NHG |
Opleidingsdirecteur extramurale vervolgopleidingen RadboudUMC 0,8 FTE; huisarts 0,2 FTE |
Council member EURACT, Europese organisatie voor opleiden in de huisartsgeneeskunde (onbetaald) |
Geen |
Geen |
Geen |
Ik ben co-promotor van een promotietraject dat wordt gefinancierd door de Nierstichting met als doel te onderzoeken: 1. wat belemmerende en bevorderende factoren zijn in het naleven van de LTA; 2. hoe patiënten de voorlichting over CNS ervaren; 3. of het mogelijk is om veilige wijze bepaalde patiënten terug te verwijzen vanuit de tweede naar de eerste lijn |
Afdeling Eerstelijnsge-neeskunde Radbou-dumc heeft samen met de afdeling Nefro-logie Radboudumc en Zorgdomein Telenefrologie ontwikkeld, een e-health applicatie voor consultatie tus-sen huisarts en nefroloog |
Geen |
|
Judith Tjin-A-Ton |
NHG |
Huisarts |
Kaderhuisarts hart- en vaatziekten: kwaliteitscommissie en werkgroep HVZ bij Amstellandzorg BV (betaald) |
Geen |
Geen |
Geen |
Geen |
Geen |
Geen |
|
Neelke van der Weerd |
NIV / NFN |
Internist-nefroloog AMC Amsterdam |
- |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
n.v.t. |
Methode ontwikkeling
Evidence based
Implementatie
Gedurende het hele proces van richtlijnontwikkeling is rekening gehouden met implementatie van de richtlijn in de praktijk, bijvoorbeeld bij de samenstelling van de werkgroep, de brede knelpunteninventarisatie en de uitgebreide commentaarronde. De werkgroep heeft adviezen voor implementatie (implementatieplan) en indicatoren geformuleerd. Deze zijn opgenomen onder de aanverwante producten.
Na autorisatie van de richtlijn wordt deze ten minste op de website van de Nederlandse Internisten Vereniging en het Nederlands Huisartsen Genootschap gepubliceerd. Ook andere deelnemende partijen zijn vrij de richtlijn op hun website te publiceren. De richtlijn wordt ter publicatie aangeboden aan www.richtlijnendatabase.nl. Daarnaast wordt getracht samenvattingen van de richtlijn in Nederlandse tijdschriften te publiceren, aandacht aan de richtlijn te besteden op congressen, en nascholingsmateriaal en voorlichtingsmateriaal te ontwikkelen, om zo de implementatie van de richtlijn te bevorderen.
Een voor patiënten begrijpelijke samenvatting van de aanbevelingen uit deze richtlijn komt beschikbaar via www.thuisarts.nl. Een verdieping daarvan komt beschikbaar via de website van de Nierstichting/Nederlandse Vereniging van Nierpatiënten.
Werkwijze
Knelpunteninventarisatie
De richtlijnwerkgroep heeft in de eerste werkgroepvergadering knelpunten benoemd in de zorg voor patiënten met CNS. Deze knelpunten zijn in een invitational conference voorgelegd aan belanghebbenden, waarbij ook is gediscussieerd over aanvullende knelpunten. Voor deze invitational conference zijn, naast vertegenwoordigers van verenigingen die in de werkgroep afgevaardigd zijn, de volgende partijen uitgenodigd:
- Federatie Medisch Coördinerende Centra
- Inspectie voor de Gezondheidszorg
- Nederlandse Federatie van Universitair Medische Centra
- Nederlandse Vereniging van Ziekenhuizen
- Nederlandse Zorgautoriteit
- Nierstichting Nederland
- Patiëntenfederatie Nederland
- Vereniging Innovatieve Geneesmiddelen
- Vereniging Maatschappelijk Werk Nefrologie
- Verpleegkundigen & Verzorgenden Nederland
- ZorgInstituut Nederland
- Zorgverzekeraars Nederland
De richtlijnwerkgroep heeft de input vanuit de knelpunteninventarisatie geanalyseerd en in de tweede werkgroepvergadering de knelpunten en uitgangsvragen vastgesteld.
Uitwerking knelpunten en uitgangsvragen in conceptrichtlijn
Per knelpunt werd door de werkgroep vooraf bepaald op welke wijze dit knelpunt zou worden behandeld: met behulp van systematisch literatuuronderzoek (evidence-based) of meer op basis van bestaande richtlijnen en professionele expertise in de werkgroep. Er was financiering voor de uitwerking van een beperkt aantal vragen met behulp van systematisch literatuuronderzoek. Om toch ook de andere belangrijke knelpunten een plaats te geven in deze richtlijn, is voor uitwerking van de resterende knelpunten voor een minder arbeidsintensieve wijze gekozen. De wijze van uitwerking van de knelpunten/uitgangsvragen staat per uitgangsvraag vermeld in de verschillende modules van deze richtlijn. De keuze van de knelpunten die met systematisch literatuuronderzoek zijn beantwoord is gemaakt door de gezamenlijke werkgroep, op basis van verwachting dat het literatuuronderzoek mogelijk tot nieuwe inzichten zou leiden en de afwezigheid van recente internationale richtlijnen over de specifieke uitgangsvraag.
De uitwerking van de knelpunten in conceptteksten werd voorbereid door de epidemioloog die bij de ontwikkeling van de richtlijn betrokken was. Per knelpunt werd deze inhoudelijk bijgestaan door een aantal werkgroepleden, afhankelijk van het onderwerp. De conceptteksten werden plenair tijdens de werkgroepvergaderingen besproken, en na discussie bijgesteld. De richtlijnwerkgroep is 9 maal bijeen geweest, alvorens de conceptrichtlijn is vastgesteld.
Bij veel uitgangsvragen is voor de onderbouwing gebruik gemaakt van internationale richtlijnen op het gebied van CNS. De KDIGO richtlijn en de NICE richtlijn over chronische nierschade zijn op kwaliteit beoordeeld bij aanvang van de ontwikkeling van deze multidisciplinaire richtlijn. De wijze van onderbouwing van deze internationale richtlijnen werd door de richtlijnwerkgroep als adequaat beoordeeld. Beide richtlijnen maakten gebruik van de GRADE methodiek.
Voor de uitgangsvragen die met behulp van systematisch literatuuronderzoek zijn uitgewerkt, is gebruik gemaakt van de principes van de GRADE Working Group. Voor achtergrondinformatie over deze methodiek wordt verwezen naar het Dutch GRADE Network (www.dutchgradenetwork.org). Vanwege de verschillende totstandkoming van de diverse aanbevelingen heeft de werkgroep ervoor gekozen om het graderen van aanbevelingen, zoals dit wordt gepropageerd in de GRADE-methodiek, niet door te voeren in deze richtlijn. Hiermee is eenheid in de formulering van aanbevelingen gecreëerd.
De module ‘Samenwerking bij CNS’ bevat samenwerkingsafspraken: aanbevelingen voor consultatie en verwijzing tussen eerste en tweede lijn, en aanbevelingen voor samenwerking met laboratoriumspecialisten klinische chemie, diëtisten en apothekers. Hierbij zijn geen specifieke uitgangsvragen genoemd, maar is uitgegaan van eerdere samenwerkingsafspraken en uitgangspunten en aanbevelingen uit de modules ‘Diagnostiek en stadiëring bij CNS’ en ‘Beleid en behandeling bij CNS’.
Daar waar in deze richtlijn ‘hij’ genoemd staat, kan ook ‘zij’ gelezen worden.
Commentaar en autorisatie
De conceptrichtlijn is ter commentaar aangeboden aan alle partijen die bij de knelpunteninventarisatie om input gevraagd zijn. Het binnengekomen commentaar is door de werkgroep beoordeeld en verwerkt in de richtlijn. Daarbij is beargumenteerd welke commentaren wel en welke niet zijn overgenomen.
Daarna is de richtlijn ter autorisatie voorgelegd aan de partijen die in de werkgroep vertegenwoordigd zijn. De richtlijn is geautoriseerd door de Nederlandse Internisten Vereniging, het Nederlands Huisartsen Genootschap, de Nederlandse Vereniging voor Diëtisten, de Nederlandse Vereniging voor Ziekenhuisapothekers en de Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde. Ook is de richtlijn goedgekeurd door de Nierpatiënten Vereniging Nederland.
Juridische betekenis van richtlijnen
Richtlijnen zijn geen wettelijke voorschriften, maar op ‘evidence' gebaseerde inzichten en aanbevelingen waaraan zorgverleners moeten voldoen om kwalitatief goede zorg te verlenen. Na autorisatie van de richtlijn door een beroepsvereniging, wordt de richtlijn gezien als deel van de ‘professionele standaard'. Aangezien de aanbevelingen hoofdzakelijk gebaseerd zijn op de ‘gemiddelde patiënt', kunnen zorgverleners op basis van hun professionele autonomie waar nodig afwijken van de richtlijn. Afwijken van richtlijnen kan in bepaalde situaties zelfs noodzakelijk zijn. Wanneer van de richtlijn wordt afgeweken, dient dit beargumenteerd en gedocumenteerd te worden.
