Tijd tussen operatie en zwangerschap bij chirurgische behandeling van obesitas
Uitgangsvraag
Hoeveel tijd dient er te zitten tussen metabole chirurgie en een zwangerschap zodat de uitkomsten voor moeder en kind zo optimaal mogelijk zijn?
Aanbeveling
Adviseer vrouwen om niet binnen 12 maanden na metabole chirurgie zwanger te worden.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de literatuur kunnen geen conclusies getrokken worden over of er een verschil is voor de cruciale en belangrijke uitkomstmaten tussen vrouwen die binnen 12 of 18 maanden na metabole chirurgie zwanger waren geworden, vergeleken met vrouwen die na meer dan 12 of 18 maanden na metabole chirurgie zwanger werden. Dit komt doordat de bewijskracht voor alle uitkomsten gegradeerd is als zeer laag. Daarnaast was er geen data beschikbaar voor de volgende uitkomstmaten:
- perinatale uitkomstmaten: asfyxie en geboortetrauma (humerus en/of claviculafractuur);
- maternale uitkomstmaten: Hemolysis Elevated Liver enzymes and Low Platelets (HELLP) syndroom, endometritis en trombo-embolische processen;
- reproductieve uitkomstmaten: doorgaande zwangerschap, levende geborenen en fertiliteitsbevorderende behandeling/spontane zwangerschap.
De overall bewijskracht voor alle cruciale uitkomstmaten is gegradeerd als zeer laag. Dit komt doordat er louter observationele studies werden gevonden. Daarnaast waren het hoofdzakelijk kleine studies met weinig events, waardoor de spreiding rondom het gepoolde effect groot was.
Het is onduidelijk op basis van de literatuuranalyse of het interval tussen de metabole ingreep en zwangerschap van invloed is op perinatale, maternale en reproductieve uitkomsten. Bij de meeste patiënten treedt de periode van zeer snel gewichtsverlies op in de eerste 6 tot 9 maanden na metabole chirurgie, het gewichtsverlies na 12 maanden is beperkter. Deze periode van zeer snel gewichtsverlies geeft risico op ondervoeding. Er zijn aanwijzingen dat ondergewicht en ondervoeding tijdens de zwangerschap kan samenhangen met lager geboortegewicht en vroeggeboorte (Han, 2011; Lumey, 1995). Het is belangrijk dat deze mogelijke risico’s worden besproken met de vrouw, hoewel het niet duidelijk is in hoeverre zij van toepassing zijn op zwangeren met obesitas na metabole chirurgie.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Voor vrouwen met kinderwens en subfertiliteit kan het uitstellen van zwangerschap na metabole chirurgie betekenen dat zij geen gebruik meer kunnen maken van geassisteerde voortplantingstechnieken. Een hard advies over een minimum interval, zou hen in het realiseren van hun kinderwens kunnen beperken.
Kosten (middelenbeslag)
Er is geen duidelijkheid over de kosten specifiek voor het interval tussen metabole ingreep en de zwangerschap.
Aanvaardbaarheid voor de overige relevante stakeholders
Er zijn geen bezwaren van overige relevante stakeholders bekend.
Haalbaarheid en implementatie
Er zijn geen bezwaren met betrekking tot de haalbaarheid en implementatie bekend.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de literatuur kunnen geen conclusies getrokken worden over of er een verschil is tussen vrouwen die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, vergeleken met vrouwen die na meer dan 12 of 18 maanden na metabole chirurgie zwanger werden. Doordat de grootste gewichtsafname in het eerste jaar na metabole chirurgie plaatsvindt, en ondergewicht en ondervoeding tijdens de zwangerschap mogelijk kan samenhangen met een lager geboortegewicht en vroeggeboorte, wordt geadviseerd om voorzichtig te zijn met een kort interval tussen chirurgie en zwangerschap.
Onderbouwing
Achtergrond
Vrouwen met ernstige obesitas hebben een hogere kans op complicaties tijdens de zwangerschap dan vrouwen met een gezond gewicht: de kans op diabetes gravidarum, hypertensieve zwangerschapsaandoeningen, vroeggeboorte en geboortetrauma zijn groter. Ook hebben kinderen van obese moeders later zelf meer kans op obesitas. Metabole chirurgie leidt tot gewichtsverlies, waarmee sommige zwangerschapscomplicaties (diabetes gravidarum, macrosomie) minder waarschijnlijk zijn. Er zijn ook complicaties die juist vaker op zouden kunnen treden (spontane vroeggeboorte, groeirestrictie). De lengte van het interval tussen de metabole ingreep en de zwangerschap zou van invloed kunnen zijn op de kans op complicaties .
Conclusies / Summary of Findings
Perinatale uitkomsten
Uitkomstmaat 1. Partus prematurus (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van partus prematurus.
Bronnen: (Bebber, 2011; Cursell, 2016; Dao, 2006; Ducarme, 2015; Gonzalez 2014; Kjaer, 2013; Patel, 2008; Rasteiro, 2018; Stentebjerg, 2016; Wax, 2008) |
Uitkomstmaat 2. Foetale groeirestrictie (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van foetale groeirestrictie.
Bronnen: (Basbug, 2018; Cursell, 2016; Ducarme, 2015; Gonzalez 2014; Kjaer, 2013; Patel, 2008; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008) |
Uitkomstmaat 3. Macrosomie (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van macrosomie.
Bronnen: (Basbug, 2018; Crusell, 2016; Ducarme, 2015; Kjaer, 2013; Rottenstreich, 2018; Stentebjerg, 2016) |
Uitkomstmaat 4. Neonatale intensive care unit (NICU) - opname (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van een NICU opname.
Bronnen: (Basbug, 2018; Ducarme, 2015; Kjaer, 2013; Rasteiro, 2018; Rottenstreich, 2018; Wax, 2008) |
Uitkomstmaat 5. Aangeboren afwijkingen (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van aangeboren afwijkingen.
Bronnen: (Basbug, 2018; Dao, 2006; Kjaer, 2013; Wax, 2008) |
Uitkomstmaat 6. pH arteria umbilicalis < 7 (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van pH arterira umbilicalis < 7.
Bronnen: (Ducarme, 2015)) |
Uitkomstmaat 6. Apgarscore < 7 na 5 minuten (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van Apgarscore < 7 na 5 minuten.
Bronnen: (Ducarme, 2015; Rottenstreich, 2018; Wax, 2008) |
Uitkomstmaat 7. Perinatale sterfte (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van perinatale sterfte.
Bronnen: (Basbug, 2018; Rottenstreich, 2018) |
Maternale uitkomsten
Uitkomstmaat 8. Sectio caesarea (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van een sectio caesarea.
Bronnen: (Basbug, 2018; Bebber, 2011; Crusell, 2016; Dao, 2006, Ducarme, 2015; Gonzalez, 2014; Rasteiro, 2018; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008) |
Uitkomstmaat 9. Diabetes gravidarum (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van diabetes gravidarum.
Bronnen: (Basbug, 2018; Ducarme, 2015; Kjaer, 2013; Patel, 2008; Rasteiro, 2018; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008) |
Uitkomstmaat 10. Zwangerschaps-gerelateerde hypertensieve aandoeningen (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van zwangerschaps-gerelateerde hypertensieve aandoeningen.
Bronnen: (Basbug, 2018; Crusell, 2016; Dao, 2006; Ducarme, 2015; Patel, 2008; Rasteiro, 2018; Rottenstreich, 2018; Wax, 2008) |
Uitkomstmaat 11. Pre-eclampsie (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van pre-eclampsie.
Bronnen: (Crusell, 2016; Dao, 2006; Ducarme, 2015; Patel, 2008; Stentebjerg, 2016) |
Uitkomstmaat 12. Wondinfecties (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van wondinfecties.
Bronnen: (Patel, 2008) |
Uitkomstmaat 13. Fluxus postpartum (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van fluxus postpartum.
Bronnen: (Ducarme, 2015; Kjaer, 2013; Rottenstreich, 2018; Stentebjerg, 2016) |
Uitkomstmaat 14. Miskraam (belangrijk)
|
Zeer laag GRADE |
Het is onduidelijk wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van miskramen.
Bronnen: (Bebber, 2011; Dao, 2006; Gonzalez, 2014) |
|
- GRADE |
Het is onbekend wat het effect is van de timing van de zwangerschap na metabole chirurgie op het vóórkomen van de volgende uitkomstmaten:
|
Samenvatting literatuur
In totaal werden 12 observationele cohortstudies geïncludeerd (Basbug, 2018; Bebber, 2011; Crusell, 2016; Dao, 2006; Ducarme, 2015; Gonzalez, 2014; Kjaer, 2013; Patel, 2008; Rasteiro, 2018; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008). In de meeste studies werd een Roux-en-Y gastric bypass uitgevoerd (Bebber, 2011; Crusell, 2016; Dao, 2006; Kjaer, 2013; Patel, 2008; Stentebjerg, 2016; Wax, 2008) of een laparoscopische sleeve gastrectomie (Basbug, 2018; Ducarme, 2015; Rottenstreich, 2018). Gonzalez (2014) beschreef een combinatie van verschillende chirurgische technieken (restrictieve procedures: laparoscopische sleeve gasterectomie (13%), vertical-banded gastroplasty (7%), laparoscopische gastric banding (2%); Roux en Y gastric bypass (48%; waarvan 36% laparoscopisch, 12% open chirurgie) en biliopancreatic diversion (33%)). Alle studies definieerden het interval als van operatie tot conceptie/ zwangerschap, met uitzondering van de studie van Basbug (2018) waarin het ging om het interval van operatie tot geboorte. Zes studies rapporteerden 18 maanden als afkappunt van het interval (Basbug, 2018; Crusell, 2016; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008), zes studies rapporteerden 12 maanden als afkappunt (Bebber, 2011; Dao, 2006; Ducarme, 2015; Gonzalez, 2014; Kjaer, 2013; Patel, 2008) en één studie rapporteerde allebei (Rasteiro, 2018).
Resultaten
In alle onderstaande meta-analyses worden ongecorrigeerde Odds Ratio’s (OR’s) gerapporteerd. In elke meta-analyse wordt middels subgroepanalyses onderscheid gemaakt tussen studies waarin het interval tussen metabole chirurgie en zwangerschap werd gerapporteerd voor < 12 versus > 12 maanden of < 18 versus > 18 maanden. Alle studies die per uitkomtmaat worden beschreven zijn opgenomen in de meta-analyses, tenzij anders gerapporteerd.
Perinatale uitkomsten
Uitkomstmaat 1. Partus prematurus (cruciaal)
Tien studies beschreven de uitkomst partus prematurus (Bebber, 2011; Cursell, 2016; Dao, 2006; Ducarme, 2015; Gonzalez 2014; Kjaer, 2013; Patel, 2008; Rasteiro, 2018; Stentebjerg, 2016; Wax, 2008). Negen studies hadden partus prematurus gedefinieerd als een geboorte na een zwangerschapsduur < 37 weken (Cursell, 2016; Ducarme, 2015; Gonzalez 2014; Kjaer, 2014; Rasteiro, 2018; Stentebjerg, 2016; Wax, 2008); drie studies rapporteerden geen definitie van partus prematurus (Bebber, 2011; Dao, 2006; Patel, 2008). In de studie van Dao (2006) betroffen alle gevallen van partus prematurus een tweelingzwangerschap. Ducarme (2015) en Wax (2008) rapporteerden de indicatie van de partus prematurus, wat hieronder beschrijvend zal worden gepresenteerd. Het was in alle andere studies onbekend of het om een spontane of iatrogene vroeggeboorte ging.
In totaal werd bij 43 van de 345 vrouwen (13%) die binnen 12 of 18 maanden na metabole chirurgie zwanger waren geworden een partus prematurus gerapporteerd, vergeleken bij 81 van de 589 vrouwen (14%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,07; 95%BI 0,69 tot 1,66) (Figuur 1).
Rasteiro (2018) rapporteerde het voorkomen van partus prematurus voor twee afkappunten van het interval (12 maanden, opgenomen in de meta-analyse, en 18 maanden). De resultaten bij 18 maanden laten een niet significant effect in de andere richting zien (< 18 maanden versus > 18 maanden: OR 0,87 (95%BI 0,27 tot 2,87)) vergeleken met 12 maanden (< 12 maanden versus > 12 maanden: OR 1,52 (95%BI 0,42 tot 5,53)).
Figuur 1 Meta-analyse uitkomstmaat ‘partus prematurus’ op basis van ongecorrigeerde data
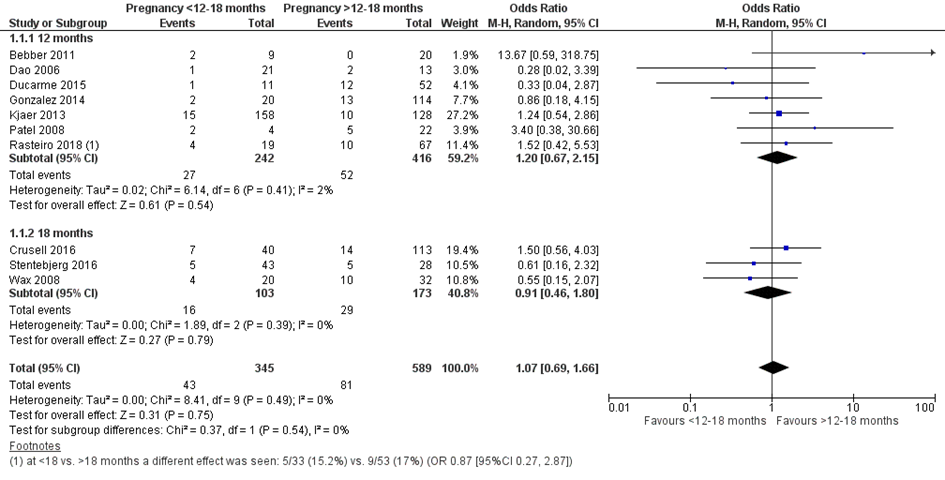
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
In de studie van Ducarme (2015) werd een partus prematurus gerapporteerd bij 1 (9%) van de 11 zwangerschappen die plaatsvond < 12 maanden na metabole chirurgie, dit betrof een spontane partus prematurus. Bij 12 van de 52 zwangerschappen (23%) die plaatsvonden >12 maanden na metabole chirurgie werd een partus prematurus gerapporteerd, waarvan 7 keer een spontane partus prematurus en 5 keer een geïnduceerde partus prematurus (indicatie inductie onbekend).
In de studie van Wax (2008) werd een partus prematurus gerapporteerd bij 4 (20%) van de 20 zwangerschappen die plaatsvonden < 18 maanden na metabole chirurgie, de indicatie hiervoor was abruptio placentae (1x), verdenking foetale nood (1x), placenta praevia (1x) en vermoede uterus ruptuur (1x). Bij 10 van de 32 zwangerschappen (31%) die plaatsvonden >18 maanden na metabole chirurgie werd een partus prematurus gerapporteerd, de indicatie hiervoor was hypertensie (n=5 (16%)), placenta praevia (n=1 (3%)), spontaan (n=3 (9%)) en electief (n=1 (3%)).
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst partus prematurus (gedefinieerd als geboorte bij < 37 weken) is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,07; 95%BI 0,69 tot 1,66). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 2. Foetale groeirestrictie (cruciaal)
Negen studies beschreven de uitkomstmaat foetale groeirestrictie (Basbug, 2018; Cursell, 2016; Ducarme, 2015; Gonzalez 2014; Kjaer, 2013; Patel, 2008; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008). Vijf studies definieerden foetale groeirestrictie als een geboortegewicht <10e percentiel (Basbug, 2018; Crusell, 2016; Ducarme, 2015; Rottenstreich, 2018; Wax, 2008); twee studies definieerden foetale groeirestrictie als een geboortegewicht dat 2 SDs onder het gemiddelde geboortegewicht zit (Kjaer, 2013; Stentebjerg, 2016); één studie definieerde foetale groeirestrictie als een geboortegewicht < 3e percentiel (Gonzalez, 2014); het was onbekend hoe de studie van Patel (2008) deze uitkomst definieerde.
Bij 40 van de 371 vrouwen (11%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd foetale groeirestrictie tijdens de zwangerschap gerapporteerd, vergeleken bij 73 van de 591 vrouwen (12%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,19; 95%BI 0,77 tot 1,83) (Figuur 2).
Figuur 2 Meta-analyse uitkomstmaat ‘foetale groeirestrictie’ op basis van ongecorrigeerde data
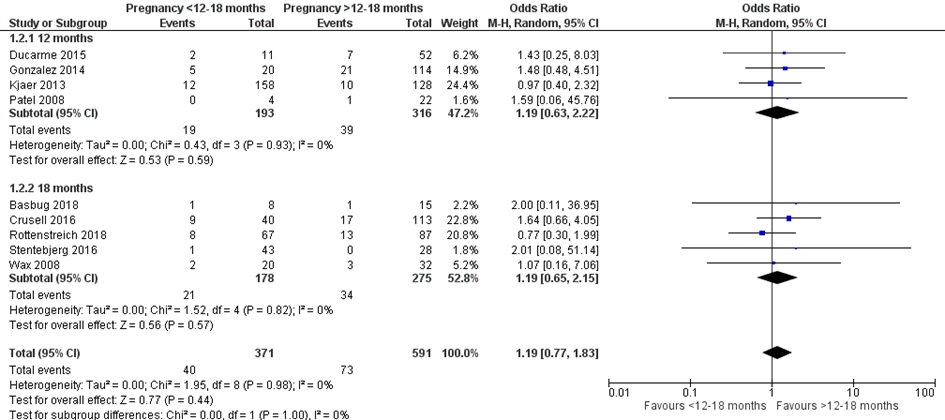
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst foetale groeirestrictie is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,19; 95%BI 0,77 tot 1,83). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 3. Macrosomie (belangrijk)
Zes studies beschreven de uitkomst macrosomie (Basbug, 2018; Crusell, 2016; Ducarme, 2015; Kjaer, 2013; Rottenstreich, 2018; Stentebjerg, 2016). Twee studies definieerden macrosomie als een geboortegewicht ≥ 4000 gram (Crusell, 2016; Ducarme, 2015); één studie definieerde macrosomie als een geboortegewicht > 4000 gram (Rottenstreich, 2018); één studie definieerde macrosomie als een geboortegewicht > 90e percentiel (Basbug, 2018); en twee studies definieerden macrosomie als een geboortegewicht dat 2 SDs boven het gemiddelde geboortegewicht zit (Kjaer, 2013; Stentebjerg, 2016). Rottenstreich (2018) rapporteerde daarnaast ook het aantal kinderen met een geboortegewicht > 90e percentiel.
Bij 7 van de 327 vrouwen (2%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd macrosomie van de neonaat gerapporteerd, vergeleken bij 17 van de 423 vrouwen (4%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 0,85; 95%BI 0,33 tot 2,18) (Figuur 3). Een sensitiviteitsanalyse waarin de data uit de studie van Rottenstreich (2018) werd geanalyseerd op basis van de definitie van een geboortegewicht > 90e percentiel, in plaats van een geboortegewicht > 4000 g, liet geen verschil zien (data niet getoond).
Figuur 3 Meta-analyse uitkomstmaat ‘macrosomie’ op basis van ongecorrigeerde data
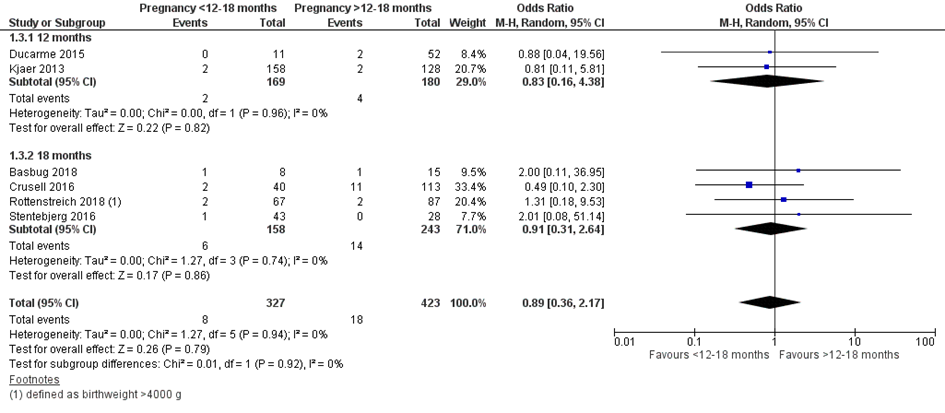
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst macrosomie is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 0,85; 95%BI 0,33 tot 2,18)). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 4. Neonatale intensive care unit (NICU) - opname (belangrijk)
Zes studies beschreven de uitkomst NICU opname (Basbug, 2018; Ducarme, 2015; Kjaer, 2013; Rasteiro, 2018; Rottenstreich, 2018; Wax, 2008). Deze uitkomstmaat werd in geen van de studies nader gedefinieerd.
Bij 32 van de 283 vrouwen (11%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd een NICU opname van de neonaat gerapporteerd, vergeleken bij 38 van de 381 vrouwen (10%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,45; 95%BI 0,80 tot 2,64) (Figuur 4).
Figuur 4 Meta-analyse uitkomstmaat ‘NICU opname’ op basis van ongecorrigeerde data
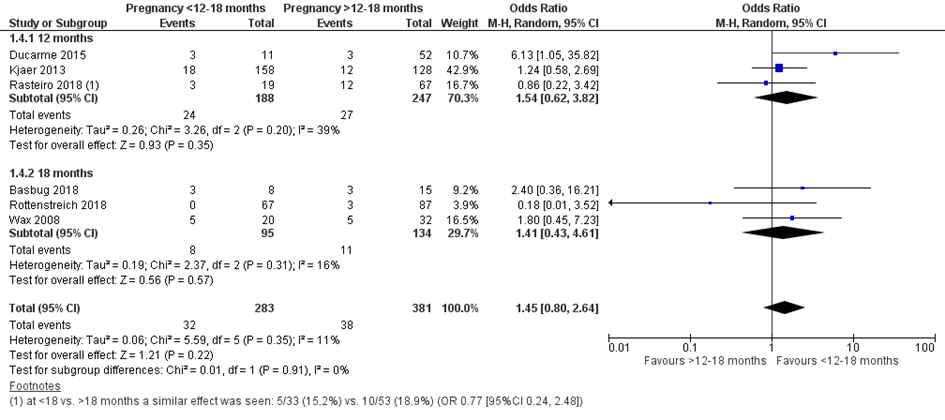
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst NICU opname is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,45; 95%BI 0,80 tot 2,64). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 5. Aangeboren afwijkingen (belangrijk)
Vier studies beschreven de uitkomst aangeboren afwijkingen (Basbug, 2018; Dao, 2006; Kjaer, 2013; Wax, 2008). Drie studies rapporteerden geen definities van aangeboren afwijkingen; definities zoals gerapporteerd door Kjaer (2013) worden hieronder beschrijvend gepresenteerd in Tabel 1. Doordat Basbug (2018) en Dao (2006) geen events rapporteerden konden deze studies niet worden meegenomen in de meta-analyse.
Bij 9 van de 207 vrouwen (4%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werden aangeboren afwijkingen van de neonaat gerapporteerd, vergeleken bij 14 van de 188 vrouwen (7%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 0,53; 95%BI 0,23 tot 1,25) (Figuur 5).
Tabel 1 Beschrijving van geïncludeerde aangeboren afwijkingen zoals gerapporteerd door Kjaer (2013)
|
Aangeboren afwijkingen |
<12 maanden N=158 |
>12 maanden N=128 |
|
Spina bifida DQ05.9 |
1 |
0 |
|
Heart malformations DQ21 |
1 |
3 |
|
Ankyloglossia (tongue tie) DQ38.1 |
1 |
0 |
|
Pyleric stenosis DQ40.0 |
1 |
1 |
|
Undescended testicle DQ53.1 or hypospadias DQ54 |
1 |
3 |
|
Hip dislocation DQ65 |
1 |
2 |
|
Metatarsus varus DQ66.2 |
0 |
1 |
|
Plagiocephaly (asymmetrical skull) DQ67.3 |
0 |
2 |
|
Deformity of sternocleidomastoid muscle DQ68.0 |
1 |
0 |
|
Omphalocele DQ79.2 |
0 |
1 |
|
Congenital malformation, unspecified DQ89.9 |
1 |
0 |
|
Down’s syndrome DQ90.9 |
1 |
0 |
|
Totaal |
9 |
13 |
Figuur 5 Meta-analyse uitkomstmaat ‘Aangeboren afwijkingen’ op basis van ongecorrigeerde data
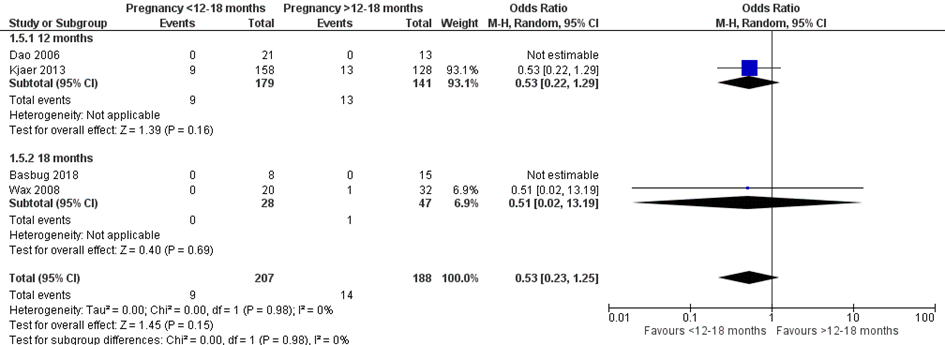
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst aangeboren afwijkingen is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 0,53; 95%BI 0,23 tot 1,25). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 6. pH arteria umbilicalis < 7 (belangrijk)
Eén studie beschreef de uitkomst pH arteria umbilicalis < 7 (Ducarme, 2015), deze uitkomst was niet nader gedefinieerd.
Ducarme (2015) rapporteerde dat bij 1 van de 11 vrouwen (9%) die binnen 12 maanden na metabole chirurgie zwanger werden een pH arteria umbilicalis < 7 werd gerapporteerd, vergeleken bij 0 van de 52 vrouwen (0%) die meer dan 12 maanden na metabole chirurgie zwanger werden (OR 15,0; 95%BI 0,57 tot 394,07).
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst pH arteria umbilicalis < 7 is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 15,0; 95%BI 0,57 tot 394,07). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 6. Apgarscore < 7 na 5 minuten (belangrijk)
Drie studies beschreven de uitkomst Apgarscore < 7 na 5 minuten (Ducarme, 2015; Rottenstreich, 2018; Wax, 2008). De studie van Ducarme (2015) rapporteerde geen events en kon daarom niet worden opgenomen in de meta-analyse.
Bij 1 van de 98 vrouwen (1%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd een Apgarscore < 7 na 5 minuten van de neonaat gerapporteerd, vergeleken bij 1 van de 171 vrouwen (0,5%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,44; 95%BI 0,13 tot 16,10) (Figuur 6).
Figuur 6 Meta-analyse uitkomstmaat ‘Apgarscore < 7 na 5 minuten’ op basis van ongecorrigeerde data
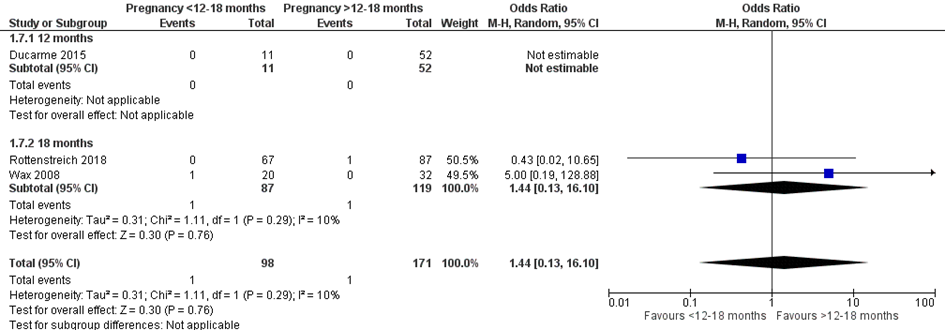
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst Apgarscore < 7 na 5 minuten is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,44; 95%BI 0,13 tot 16,10). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 7. Perinatale sterfte (belangrijk)
Drie studies beschreven de uitkomst perinatale sterfte (Basbug, 2018; Gonzalez, 2014; Rottenstreich, 2018). Basbug (2018) beschreef dit als ‘neonatale mortaliteit’ en Rottenstreich (2018) als ‘het totaal aantal doodgeboortes of neonatale mortaliteit’, in beide gevallen werd dit niet nader gespecificeerd. Gonzalez (2014) beschreef het aantal doodgeboortes na ≥28 weken zwangerschap (persoonlijke communicatie met auteur).
Bij 1 van de 106 vrouwen (0,9%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd perinatale sterfte gerapporteerd, vergeleken bij 2 van de 219 vrouwen (0,9%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,39; 95%BI 0,21 tot 9,10) (Figuur 7).
Figuur 7 Meta-analyse uitkomstmaat ‘perinatale sterfte’ op basis van ongecorrigeerde data
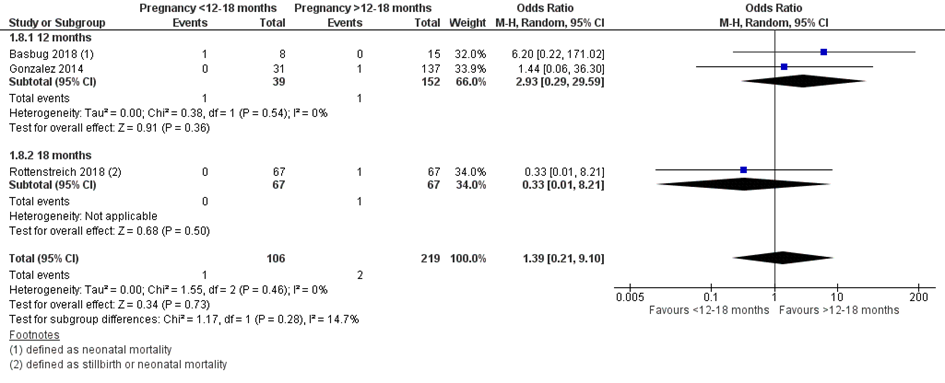
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst perinatale sterfte is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,39; 95%BI 0,21 tot 9,10). Hiermee kwam de bewijskracht uit op zeer laag.
De volgende perinatale uitkomstmaten werden niet gerapporteerd: asfyxie, geboortetrauma (humerus en/of claviculafractuur) en intra-uteriene vruchtdood.
Maternale uitkomsten
Uitkomstmaat 8. Sectio caesarea (belangrijk)
Tien studies beschreven de uitkomst sectio caesarea (Basbug, 2018; Bebber, 2011; Crusell, 2016; Dao, 2006, Ducarme, 2015; Gonzalez, 2014; Rasteiro, 2018; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008). Bij vijf van de tien studies was het onbekend wat de indicatie was voor de sectio caesarea; een beschrijving van de indicaties in de studies van Basbug (2018), Crusell (2016), Ducarme (2015) en Wax (2008) worden hieronder apart beschreven.
Bij 148 van de 416 vrouwen (36%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd een sectio caesarea uitgevoerd, vergeleken bij 219 van de 669 vrouwen (33%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,04; 95%BI 0,77 tot 1,40) (Figuur 8).
Figuur 8 Meta-analyse uitkomstmaat ‘sectio caesarea’ op basis van ongecorrigeerde data
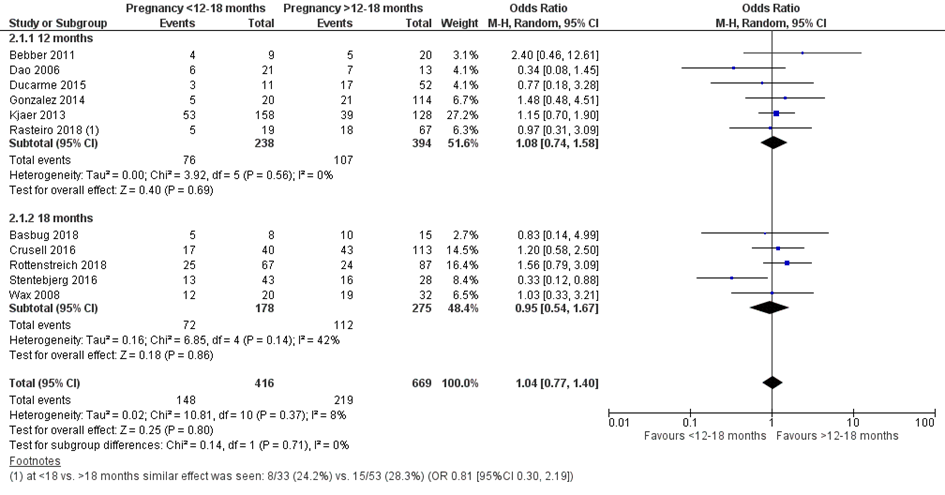
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
In de studie van Basbug (2018) werd bij 5 van de 8 vrouwen (63%) die zwanger werden < 18 maanden na metabole chirurgie een sectio caesarea gerapporteerd, vergeleken bij 19 van de 15 vrouwen (67%) die zwanger werden > 18 maanden na metabole chirurgie. De volgende indicaties voor de sectio caesarea werden gerapporteerd, vergeleken tussen geboortes die < 18 en > 18 maanden na metabole chirurgie plaatsvonden: op verzoek (38 versus 33%), cefalopelviene disproportie (0 versus 13%), stuitligging (13 versus 13%) en macrosomie (13 versus 7%).
In de studie van Crusell (2016) werd bij 17 van de 40 vrouwen (43%) die zwanger werden < 18 maanden na metabole chirurgie een sectio caesarea gerapporteerd, vergeleken bij 43 van 113 vrouwen (38%) die zwanger werden > 18 maanden na metabole chirurgie. De volgende indicaties voor de sectio caesarea werden gerapporteerd, vergeleken tussen zwangerschappen die < 18 en > 18 maanden na metabole chirurgie plaatsvonden: electief (53 versus 59%), op verzoek van de zwangere (35 versus 21%), onbekend (0 versus 23%).
In de studie van Ducarme (2015) werd bij 3 van de 11 vrouwen (27%) die zwanger werden < 12 maanden na metabole chirurgie een sectio caesarea gerapporteerd, vergeleken bij 17 van 52 vrouwen (33%) die zwanger werden > 12 maanden na metabole chirurgie. De volgende indicaties voor de sectio caesarea werden gerapporteerd, vergeleken tussen zwangerschappen die < 12 en > 12 maanden na metabole chirurgie plaatsvonden: vooraf geplande sectio caesarea (67 versus 41%) en sectio caesarea tijdens bevalling (33 versus 59%).
In de studie van Wax (2008) werd bij 12 van de 20 vrouwen (60%) die zwanger werden < 18 maanden na metabole chirurgie een sectio caesarea gerapporteerd, vergeleken bij 19 van 32 vrouwen (59%) die zwanger werden > 18 maanden na metabole chirurgie. De volgende indicaties voor de sectio caesarea werden gerapporteerd, vergeleken tussen zwangerschappen die < 18 en > 18 maanden na metabole chirurgie plaatsvonden: primaire sectio (17 versus 32%) en herhaalde sectio (83 versus 68%).
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst sectio caesarea is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,04; 95%BI 0,77 tot 1,40). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 9. Diabetes gravidarum (belangrijk)
Acht studies beschreven de uitkomst diabetes gravidarum (Basbug, 2018; Ducarme, 2015; Kjaer, 2013; Patel, 2008; Rasteiro, 2018; Rottenstreich, 2018; Stentebjerg, 2016; Wax, 2008). Doordat er geen events werden gerapporteerd door Basbug (2018) kon deze studie niet worden meengenomen in de meta-analyse. Stentebjerg (2016) rapporteerde het totaal aantal gevallen diabetes gravidarum niet los, maar alleen als onderdeel van het totaal aantal gevallen diabetes. In een sensitiviteitsanalyse werd nagenoeg hetzelfde gepoolde effect gevonden wanneer de studie van Stentebjerg (2016) niet werd meegenomen in de meta-analyse (data niet getoond).
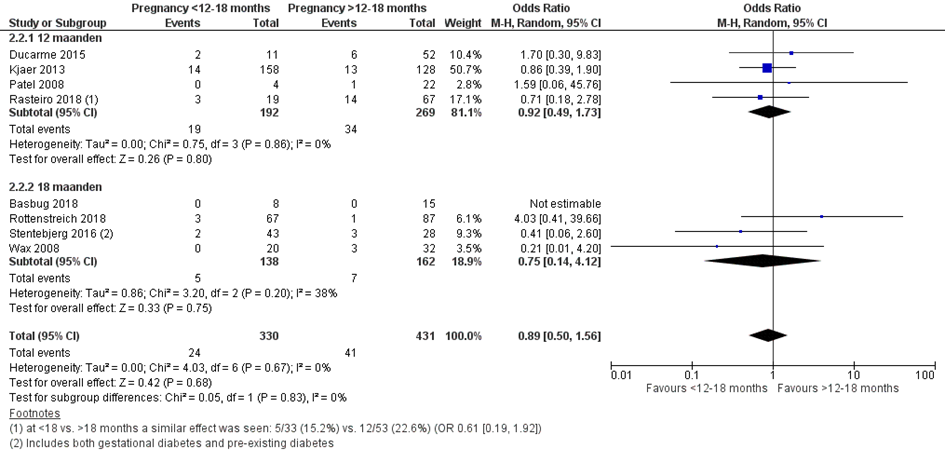
Bij 24 van de 330 vrouwen (7%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd diabetes gravidarum gerapporteerd, vergeleken bij 41 van de 431 vrouwen (10%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 0,89; 95%BI 0,50 tot 1,56) (Figuur 9).
Figuur 9 Meta-analyse uitkomstmaat ‘diabetes gravidarum’ op basis van ongecorrigeerde data
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst diabetes gravidarum is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 0,89; 95%BI 0,50 tot 1,56). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 10. Zwangerschaps-gerelateerde hypertensieve aandoeningen (cruciaal)
Acht studies beschreven de uitkomst zwangerschaps-gerelateerde hypertensieve aandoeningen (Basbug, 2018; Crusell, 2016; Dao, 2006; Ducarme, 2015; Patel, 2008; Rasteiro, 2018; Rottenstreich, 2018; Wax, 2008). Rottenstreich (2018) definieerde dit als een systolische bloeddruk > 140 mm Hg en diastolische bloeddruk > 90 mm Hg of het gebruik van antihypertensiva. Het was onbekend hoe deze uitkomstmaat was gedefinieerd in de andere studies. Doordat de studies van Basbug (2018), Crusell (2016) en Rasteiro (2018) het totaal aantal zwangerschaps-gerelateerde hypertensieve aandoeningen, pre-eclampsie en eclampsie tezamen rapporteerde, konden deze studies niet worden opgenomen in de meta-analyse. De resultaten worden daarom hieronder beschrijvend gepresenteerd.
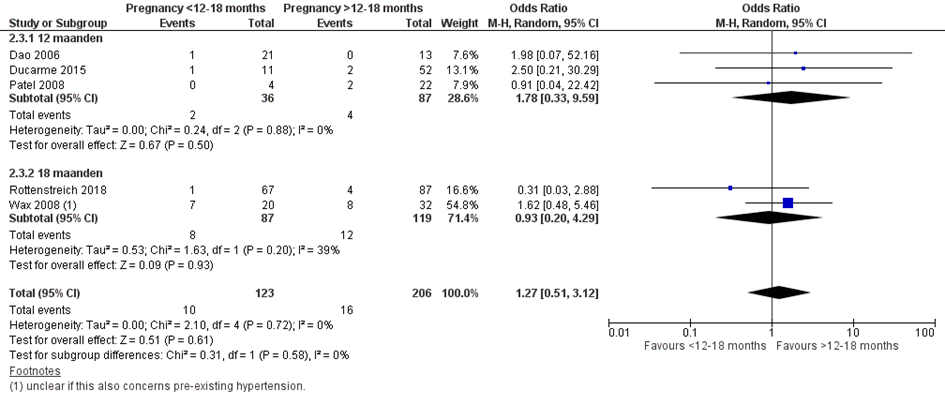
Bij 10 van de 123 vrouwen (8%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werden zwangerschapsgerelateerde hypertensieve aandoeningen gerapporteerd, vergeleken bij 16 van de 206 vrouwen (8%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,27; 95%BI 0,51 tot 3,12) (Figuur 10).
Basbug (2018) rapporteerde dat bij 1 van de 8 vrouwen (13%) die binnen 18 maanden na metabole chirurgie zwanger werden zwangerschaps-gerelateerde hypertensieve aandoeningen en pre-eclampsie voorkwamen (geen losse aantallen per aandoening bekend), vergeleken bij 1 van de 15 vrouwen (7%) die meer dan 18 maanden na metabole chirurgie zwanger werden (OR 2,0; 95%BI 0,11 tot 36,95).
Crusell (2016) rapporteerde dat bij 2 van 40 vrouwen (5%), die binnen 18 maanden na metabole chirurgie zwanger werden, zwangerschaps-gerelateerde hypertensieve aandoeningen en pre-eclampsie voorkwamen (geen losse aantallen per aandoening bekend), vergeleken bij 13 van de 113 vrouwen (12%) die meer dan 18 maanden na metabole chirurgie zwanger werden (OR 0,40; 95%BI 0,09 tot 1,88).
Rasteiro (2018) rapporteerde dat bij 0 van de 19 vrouwen (0%) die binnen 12 maanden na metabole chirurgie zwanger werden zwangerschaps-gerelateerde hypertensieve aandoeningen voorkwamen (geen losse aantallen per aandoening bekend), vergeleken bij 4 van de 67 vrouwen (6%) die meer dan 12 maanden na metabole chirurgie zwanger werden (OR 0,36; 95%BI 0,02 tot 7,02)). Hetzelfde effect werd gezien wanneer 18 maanden als afkappunt van het interval werd gekozen (OR 0,52; 95%BI 0,05 tot 5,23).
Figuur 10 Meta-analyse uitkomstmaat ‘zwangerschaps-gerelateerde hypertensieve aandoeningen’ op basis van ongecorrigeerde data
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst zwangerschaps-gerelateerde hypertensieve aandoeningen is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,27; 95%BI 0,51 tot 3,12). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 11. Pre-eclampsie (cruciaal)
Zes studies beschreven de uitkomst pre-eclampsie (Crusell, 2016; Dao, 2006; Ducarme, 2015; Kjaer, 2013; Patel, 2008; Stentebjerg, 2016). Het was onbekend hoe deze uitkomstmaat was gedefinieerd in de studies. Doordat de studie van Crusell (2016) het totaal aantal zwangerschaps-gerelateerde hypertensieve aandoeningen en pre-eclampsie tezamen rapporteerde, kon deze studie niet worden opgenomen in de meta-analyse, de resultaten worden daarom hieronder beschrijvend gepresenteerd.
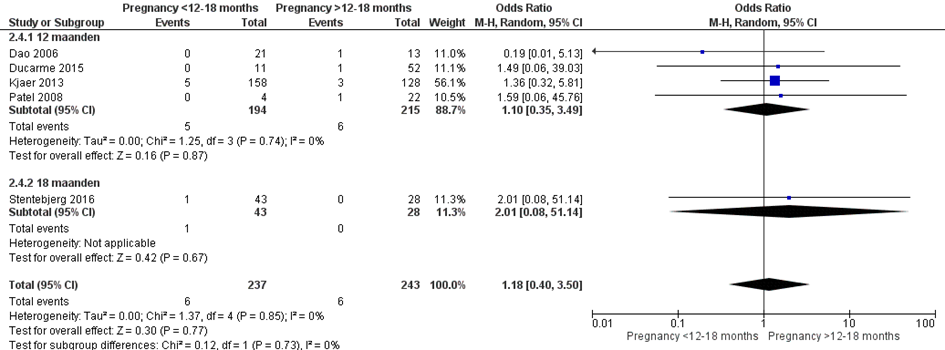
Bij 6 van de 237 vrouwen (3%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd pre-eclampsie gerapporteerd, vergeleken bij 6 van de 243 vrouwen (3%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,18; 95%BI 0,40 tot 3,50) (Figuur 11).
Crusell (2016) rapporteerde dat bij 2 van 40 vrouwen (5%) die binnen 18 maande na metabole chirurgie werden zwangerschaps-gerelateerde hypertensieve aandoeningen en pre-eclampsie voorkwamen (geen losse aantallen per aandoening bekend), vergeleken bij 13 van de 113 vrouwen (12%) die meer dan 18 maanden na metabole chirurgie zwanger werden (OR 0,40; 95%BI 0,09 tot 1,88).
Figuur 11 Meta-analyse uitkomstmaat ‘pre-eclampsie’ op basis van ongecorrigeerde data
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst pre-eclampsie is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,18; 95%BI 0,40 tot 3,50). Hiermee kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 12. Wondinfecties (belangrijk)
Eén studie beschreef de uitkomstmaat wondinfecties (Patel, 2008), er werd geen definitie van de uitkomstmaat beschreven.
Patel (2008) rapporteerde bij 0 van de 4 (0%) vrouwen die binnen 12 maanden na metabole chirurgie zwanger werden wondinfecties voorkwamen, vergeleken bij 1 van de 22 vrouwen (5%) die meer dan 12 maanden na metabole chirurgie zwanger werden (OR 1,59; 95%BI 0,06 tot 45,76).
Uitkomstmaat 13. Fluxus postpartum (belangrijk)
Vier studies beschreven de uitkomstmaat fluxus postpartum (Ducarme, 2015; Kjaer, 2013; Rottenstreich, 2018; Stentebjerg, 2016). Drie studies definieerden fluxus postpartum als > 500 ml bloedverlies bij een vaginale bevalling of > 1000 ml bloedverlies bij een bevalling middels sectio caesarea (tijdens de eerste 24 uur postpartum). Kjaer (2013) definieerde deze uitkomstmaat als een postpartum bloedverlies > 500 ml.
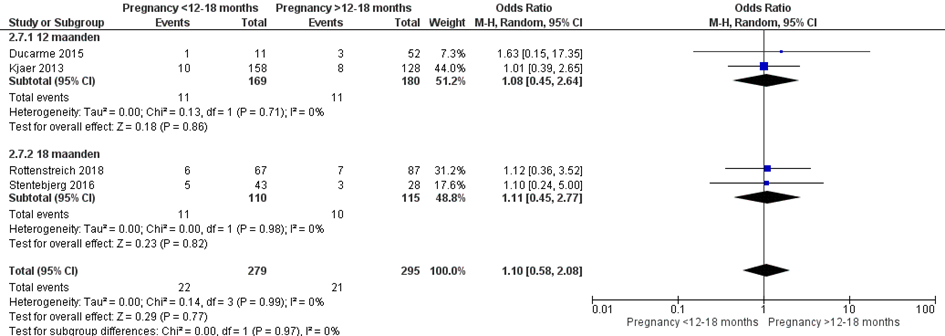
Bij 11 van de 279 vrouwen (4%) die binnen 12 of 18 maanden na metabole chirurgie zwanger werden, werd fluxus postpartum gerapporteerd, vergeleken bij 21 van de 295 vrouwen (7%) die meer dan 12 of 18 maanden na metabole chirurgie zwanger werden (OR 1,10; 95%BI 0,58 tot 2,08) (Figuur 12).
Figuur 12 Meta-analyse uitkomstmaat ‘fluxus postpartum’ op basis van ongecorrigeerde data
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst fluxus postpartum is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,10; 95%BI 0,58 tot 2,08). Hiermee kwam de bewijskracht uit op zeer laag.
De volgende maternale uitkomstmaten werden niet gerapporteerd: Hemolysis Elevated Liver enzymes and Low Platelets (HELLP) syndroom, endometritis en trombo-embolische processen.
Reproductieve uitkomsten
Uitkomstmaat 14. Miskraam (belangrijk)
Drie studies beschreven de uitkomst miskraam (Bebber, 2011; Dao, 2006; Gonzalez, 2014). Gonzalez (2014) beschreef ‘het aantal miskramen of verlies van de foetus bij < 20 weken zwangerschap’ (persoonlijke communicatie met auteur). Het was onbekend hoe deze uitkomstmaat was gedefinieerd in de andere studies. De resultaten werden niet los per uitkomst gerapporteerd.
Bij 14 van de 64 vrouwen (22%) die binnen 12 maanden na metabole chirurgie zwanger werden, werd een miskraam gerapporteerd, vergeleken bij 21 van de 137 vrouwen (15%) die meer dan 12 maanden na metabole chirurgie zwanger werden (OR 1,91; 95%BI 0,83 tot 4,40) (Figuur 13).
Figuur 13 Meta-analyse uitkomstmaat ‘miskraam’ op basis van ongecorrigeerde data
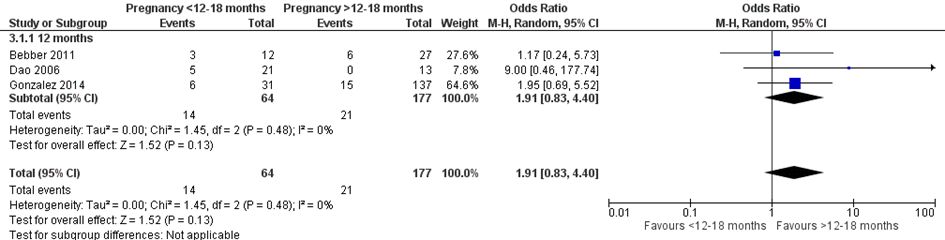
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
Observationele studies beginnen op een laag niveau van bewijskracht. De bewijskracht voor de uitkomst miskraam is met één niveau verlaagd vanwege imprecisie (het 95% betrouwbaarheidsinterval rondom het gepoolde effect omvat de waarde van geen (klinisch relevant) effect (OR 1,91; 95%BI 0,83 tot 4,40). Hiermee kwam de bewijskracht uit op zeer laag.
De volgende reproductieve uitkomstmaten werden niet gerapporteerd: doorgaande zwangerschap, levende geborenen en fertiliteit bevorderende behandeling/spontane zwangerschap.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van een zwangerschap binnen 12 tot 18 maanden na metabole chirurgie vergeleken met een zwangerschap na méér dan 12 tot 18 maanden na metabole chirurgie met betrekking tot de perinatale, maternale en reproductieve uitkomsten?
P (Patiënten): vrouwen in de vruchtbare leeftijd met een kinderwens die metabole chirurgie hebben ondergaan;
I (Interventie): zwangerschap binnen 12 tot 18 maanden;
C (Comparison): zwangerschap na > 12 tot 18 maanden;
O (Outcomes): perinatale uitkomsten: partus prematurus, foetale groeirestrictie, macrosomie, neonatal intensive care unit (NICU) opname, aangeboren afwijkingen, asfyxie, pH arteria umbilicalis, Apgarscore na 5 minuten, geboortetrauma (humerus en/-of claviculafractuur), perinatale sterfte en intra-utriene vruchtdood (IUVD);
Maternale uitkomsten: sectio caeserea, diabetes gravidarum, zwangerschaps-gerelateerde hypertensie, pre-eclampsie, Hemolysis Elevated Liver enzymes and Low Platelets (HELLP) syndroom, wondinfecties, endometritis, trombo-embolische processen, fluxus postpartum;
Reproductieve uitkomsten: miskraam, doorgaande zwangerschap, levend geborenen, fertiliteitsbevorderende behandeling/spontane zwangerschap.
Relevante uitkomstmaten
De werkgroep achtte IUVD, perinatale sterfte, foetale groeirestrictie, partus prematurus, zwangerschaps-gerelateerde hypertensieve aandoeningen, pre-eclampsie en HELLP-syndroom voor de besluitvorming cruciale uitkomstmaten; en sectio caesarea, macrosomie, NICU opname, aangeboren afwijkingen, asfyxie, pH arteria umbilicalis, Apgarscore na 5 minuten, geboortetrauma (humerus en/-of claviculafractuur), diabetes gravidarum, wondinfecties, endometritis, trombo-embolische processen, fluxus postpartum, miskraam, doorgaande zwangerschap, levende geboorte en fertiliteitsbevorderende behandeling/spontane zwangerschap voor de besluitvorming belangrijke uitkomstmaten.
Voor de uitkomstmaat foetale groeirestrictie werden de in de studies gebruikte definities overgenomen voor ‘small for gestational age’ (percentiel afkappunt voor een te laag geboortegewicht ten opzichte van het gemiddelde geboortegewicht, gecorrigeerd voor de duur van de zwangerschap) of een definitie op basis van 2 standaard deviaties onder het gemiddelde geboortegewicht. Voor de uitkomstmaat macrosomie werden de in de studies gebruikte definities overgenomen voor ‘large for gestational age’ (percentiel afkappunt voor een te hoog geboortegewicht ten opzichte van het gemiddelde geboortegewicht, gecorrigeerd voor de duur van de zwangerschap) of een definitie op basis van een geboortegewicht van > 4000 gram.
Voor de overige uitkomstmaten definieerde de werkgroep niet a priori de uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor de uitkomstmaten IUVD en perinatale sterfte elk statistisch significant verschil als een klinisch relevant verschil. De werkgroep hanteerde voor alle overige uitkomstmaten een klinisch relevant verschil volgens de default grenzen (25%) van de GRADE Working Group (Schünemann, 2013).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 15 maart 2019 met relevante zoektermen gezocht naar systematische reviews, randomized controlled trials (RCT’s) en observationele cohortstudies waarin werd gekeken naar de timing van de zwangerschap bij vrouwen die metabole chirurgie hadden ondergaan. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 258 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: 1) studie betrof vrouwen die een vorm van metabole chirurgie hadden ondergaan (sleeve gastrectomie of gastric bypass) en rapportage van minstens één van de uitkomstmaten. Studies waar verschillende vormen van metabole chirurgie werden toegepast werden geïncludeerd wanneer niet meer dan 10% met een maagband was behandeld.
Op basis van titel en abstract werden in eerste instantie 37 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 25 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 12 studies definitief geselecteerd.
Referenties
- Basbug A, Ellibeş Kaya A, Dogan S, Pehlivan M, Goynumer G. Does pregnancy interval after laparoscopic sleeve gastrectomy affect maternal and perinatal outcomes? J Matern Fetal Neonatal Med. 2018 May 17:1-7.
- Bebber FE, Rizzolli J, Casagrande DS, Rodrigues MT, Padoin AV, Mottin CC, Repetto G. Pregnancy after bariatric surgery: 39 pregnancies follow-up in a multidisciplinary team. Obes Surg. 2011 Oct;21(10):1546-51.
- Crusell M, Nilas L, Svare J, Lauenborg J. A Time Interval of More Than 18 Months Between a Pregnancy and a Roux-en-Y Gastric Bypass Increases the Risk of Iron Deficiency and Anaemia in Pregnancy. Obes Surg. 2016 Oct;26(10):2457-62.
- Dao T, Kuhn J, Ehmer D, Fisher T, McCarty T. Pregnancy outcomes after gastric-bypass surgery. Am J Surg. 2006 Dec;192(6):762-6.
- Ducarme G, Chesnoy V, Lemarié P, Koumaré S, Krawczykowski D. Pregnancy outcomes after laparoscopic sleeve gastrectomy among obese patients. Int J Gynaecol Obstet. 2015 Aug;130(2):127-31.
- González I, Rubio MA, Cordido F, Bretón I, Morales MJ, Vilarrasa N, Monereo S, Lecube A, Caixàs A, Vinagre I, Goday A, García-Luna PP. Maternal and perinatal outcomes after bariatric surgery: a Spanish multicenter study. Obes Surg. 2015 Mar;25(3):436-42.
- Han Z, Mulla S, Beyene J, Liao G, McDonald SD; Knowledge Synthesis Group. Maternal underweight and the risk of preterm birth and low birth weight: a systematic review and meta-analyses. Int J Epidemiol. 2011 Feb;40(1):65-101
- Kjær MM, Nilas L. Timing of pregnancy after gastric bypass-a national register-based cohort study. Obes Surg. 2013 Aug;23(8):1281-5. doi: 10.1007/s11695-013-0903-5.
- Lumey LH, Stein AD, Ravelli AC. Timing of prenatal starvation in women and birth weight in their first and second born offspring: the Dutch Famine Birth Cohort study. Eur J Obstet Gynecol Reprod Biol. 1995 Jul;61(1):23-30.
- Nørgaard LN, Gjerris AC, Kirkegaard I, Berlac JF, Tabor A; Danish Fetal Medicine Research Group. Fetal growth in pregnancies conceived after gastric bypass surgery in relation to surgery-to-conception interval: a Danish national cohort study. PLoS One. 2014 Mar 21;9(3):e90317.
- Patel JA, Patel NA, Thomas RL, Nelms JK, Colella JJ. Pregnancy outcomes after laparoscopic Roux-en-Y gastric bypass. Surg Obes Relat Dis. 2008 Jan-Feb;4(1):39-45.
- Rasteiro C, Araújo C, Cunha S, Caldas R, Mesquita J, Seixas A, Augusto N, Ramalho C. Influence of Time Interval from Bariatric Surgery to Conception on Pregnancy and Perinatal Outcomes. Obes Surg. 2018 Nov;28(11):3559-3566.
- Rottenstreich A, Levin G, Kleinstern G, Rottenstreich M, Elchalal U, Elazary R. The effect of surgery-to-conception interval on pregnancy outcomes after sleeve gastrectomy. Surg Obes Relat Dis. 2018 Dec;14(12):1795-1803.
- Stentebjerg LL, Andersen LLT, Renault K, Støving RK, Jensen DM. Pregnancy and perinatal outcomes according to surgery to conception interval and gestational weight gain in women with previous gastric bypass. J Matern Fetal Neonatal Med. 2017 May;30(10):1182-1188.
- Wax JR, Cartin A, Wolff R, Lepich S, Pinette MG, Blackstone J. Pregnancy following gastric bypass for morbid obesity: effect of surgery-to-conception interval on maternal and neonatal outcomes. Obes Surg. 2008 Dec;18(12):1517-21.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Research question:
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
||||||||||||||||||||||||||||||||||||||||||
|
Basbug, 2018 |
Type of study: retrospective cohort study
Setting and country: tertiary hospital, Turkey
Funding and conflicts of interest: No potential conflict of interest was reported by the authors. Funding not reported. |
Inclusion criteria: 18-45 year old women who underwent LSG for obesity and gave birth after LSG.
Exclusion criteria: multiple pregnancies, in utero fetal demise, and miscarriages.
N total at baseline: Intervention: 8 Control: 15
Important prognostic factors2: For example age ± SD: I: 33.75±2.7 C: 29.40±4.28
Sex: 100% F.
Groups comparable at baseline? Yes.
|
Describe intervention (treatment/procedure/test):
LSG
bariatric surgery to birth <18 months
|
Describe control (treatment/procedure/test):
LSG
bariatric surgery to birth <18 months
|
Length of follow-up: not reported
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Caesarean section: I: 5/8 (62.5%) C: 10/15 (66.7%)
Indication for caesarean section: Maternal request: I: 3 (37.5%) C: 5 (33.3%) Cephalopelvic disproportion: I: 0 C: 2 (13.3%) Breech presentation: I: 1 (12.5%) C: 2 (13.3%) Macrosomic baby: I: 1 (12.5%)
NICU transfer: Outcome not defined. I: 3 (37.5%) C: 3 (20%)
Apgar score 5 minutes: I: 10 (7–10) C: 10 (9–10
Neonatal mortality: Outcome not defined. I: 1 (12.5%) C: 0 (0%)
SGA: Defined as birthweight <10th percentile. I: 1 (12.5%) C: 1 (6.7%)
LGA: Defined as birthweight >90th percentile I: 1 (12.5%) C: 1 (6.7%)
Congenital malformations: Outcome was not defined. I: 0 C: 0
Gestational diabetes: I: 0 C: 0
Gestational hypertensive disorders: Defined as pregnancy induced hypertension and preeclampsia. I: 1 (13%) C: 1 (7%) |
NB: surgery to BIRTH (instead of conception). |
||||||||||||||||||||||||||||||||||||||||||
|
Bebber, 2011 |
Type of study: Retrospective cohort study
Setting and country: Medical records, Brazil
Funding and conflicts of interest: not reporte |
Inclusion criteria: Female patients who underwent bariatric surgery. All pregnancies started after the bariatric surgery and with estimates due date until June 2008 were eligible for the study. All patients had undergone to Roux-en-Y gastric bypass surgery (RYGB).
Exclusion criteria: none reported.
N total at baseline: Intervention: 12 Control: 27
Important prognostic factors2: For example age ± SD: overall: 30.9±4.1 I: not reported C: not reported
Sex: 100% F Groups comparable at baseline? No, Women who become pregnant before 1 year of postoperatory period lost an average of 1.7 kg, and women who become pregnant after 1 year of the procedure gain an average 9.5 kg (p=0.002). The bigger the interval between bariatric surgery and the beginning of the pregnancy, the higher the increase of the BMI during the pregnancy (p=0,002) |
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <18 months
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >18 months
|
Length of follow-up: not described, retrospective medical file
Loss-to-follow-up: n=1 excluded because incomplete data Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Descriptive statistics: Miscarriage: Outcome not defined. <1 year: 3/12 (25%) >1 year: 6/27 (22.2%) P=1.000
Pre-term births: Outcome not defined. <1 year: 2/9 (22.2%) >1 year: 0/20 (0%) P=0.089
Caesarean section: <1 year: 4/9 (44.4%) >1 year: 5/20 (25%) P=0.396
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Crusell. 2016 |
Type of study: retrospective cohort study.
Setting and country: tertiary care hospitals (2), Denmark
Funding and conflicts of interest: No funding reported. Authors declare no conflict of interest. |
Inclusion criteria: women’s last singleton pregnancy after the RYGB of at least 24 weeks of gestation was included in the study. Data were retrospectively collected from local medical records
Exclusion criteria: pregnancy <24 weeks. N total at baseline: Intervention: 40 Control: 113
Important prognostic factors2: For example age ± SD: Not reported. I: C:
Sex: 100% F.
Groups comparable at baseline? Yes, but borderline difference in BMI presurgery (43.7 versus 44.7; P=0.055) |
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >1 year
|
Length of follow-up: not reported, but one pregnancy occurred >4 years post-surgery.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: n=14 for hypertension/preeclampsia, n=2 for small for gestational age Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe) |
Outcome measures and effect size (include 95%CI and p-value if available):
SGA: Defined as birth weight <10th percentile. I: 9 (23.1) C: 17 (15.2
Birth weight ≥4000 g: I: 2 (5.1) C: 11 (9.8)
Caesarean section: I: 17 (42.5) C: 43 (38.1)
Indications for section: Elective CS: I: 9 (52.9) C: 24 (55.8) Maternal request CS: I: 6 (66.7) 9 (41.7)
Gestational hypertension: Defined as pregnancy-induced hypertension or preeclampsia I: 2 (5.4) C: 13 (12.7)
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Dao, 2006 |
Type of study: retrospective cohort study
Setting and country: single institution (secondary/tertiary care?), USA
Funding and conflicts of interest: none reported. |
Inclusion criteria: women who underwent RYGB with a 15 of 30 mL pouch. Advise was not to become pregnant <1 year.
Exclusion criteria: none reported.
N total at baseline: Intervention: 21 Control: 13
Important prognostic factors2: For example age ± SD: I: 32 ± SD? C: 34 ± SD?
Sex: 100% F.
Groups comparable at baseline? No, BMI at pregnancy (35 versus. 28) and gestational weight gain differed (4 lbs versus 34 lbs).
|
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >1 year
|
Length of follow-up: not reported.
Loss-to-follow-up: not reported Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm births I: 1/21 (1 set of twins) C: 2/13 (2 sets of twins)
Caesarean section: I: 6/21 (40%) C: 7/13 (59%)
Fetal complications: Outcome not defined. I: 1/21 (ectopic pregnancy) C: 0
Miscarriage:’ Outcome not defined. I: 5/21 C: 0/13
Pre-eclampsia: Outcome not defined. I: 0/21 C: 1/13
Gestational hypertensive disorders: ‘slight hypertension’ I: 1/21 C: 0/13
Congenital birth defects: “None observed” |
|
||||||||||||||||||||||||||||||||||||||||||
|
Ducarme, 2015 |
Type of study: retrospective cohort study
Setting and country: single centre (secondary/ tertiary care?), France
Funding and conflicts of interest: Funding not reported. Authors declare no conflicts of interest. |
Inclusion criteria: all women who became pregnant after LSG
Exclusion criteria: fetal loss <22 weeks were excluded
N total at baseline: Intervention: 11 Control: 52
Important prognostic factors2: For example age ± SD: I: 30.3 ± 6.0 C: 29.2 ± 5.8
Sex: 100% F
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
LSG
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
LSG
bariatric surgery to conception >1 year
|
Length of follow-up: not reported.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported/ Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm delivery <37 weeks C: 12 (23)
Spontaneous preterm birth: I: 1 (9) C: 7 (14) Induced preterm birth: I: 0 C: 5 (10)
SGA: Birth weight <10th percentile I: 2 (18) C: 7 (14)
Birth weight ≥4000 gram: I: 0 C: 2 (4)
Transfer to NICU: I: 3 (27) C: 3 (6)
Umbilical arterial blood pH <7.0: Outcome not defined. I: 1 (9)
Apgar score <7 at 5 min: C: 0
Caesarean section: I: 3 (27) C: 17 (33)
Planned cesarean delivery: C: 7 (14) Cesarean delivery during labor I: 1 (9)
Gestational diabetes: I: 2 (18) C: 6 (12)
Gestational hypertension: Outcome not defined. I: 1 (9) C: 2 (4)
Pre-eclampsia: Outcome not defined. I: 0 C: 1 (2)
Postpartum haemorrhage: Defined as blood loss >500 mL after vaginal delivery or >1000 mL after caesarean section, during the first 24 hours. I: 1 (9) |
|
||||||||||||||||||||||||||||||||||||||||||
|
Gonzalez, 2014 |
Type of study: retrospective cohort study.
Setting and country: 10 tertiary hospitals, Spain
Funding and conflicts of interest: Funding not reported. Authors declare no conflicts of interest. |
Inclusion criteria: all pregnancies, both singleton and multiple, in women who had previously undergone BS during the period of January 1998 through December 2012
Exclusion criteria: none reported.
N total at baseline: Intervention: 31 Control: 137
Important prognostic factors2: For example age ± SD: I: 32.8±4.7 C: 33.3±4.1
Sex: 100% F
Groups comparable at baseline? No, significantly higher BMI (34.6±7.7kg/ m2) and an increased rate of fetal loss (35.5 %).
|
Describe intervention (treatment/procedure/test):
Of cases, 19 % underwent restrictive techniques, 46.7 % RYGB, and 33.3 % underwent a malabsorptive procedure. Not specified per group.
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
Of cases, 19 % underwent restrictive techniques, 46.7 % RYGB, and 33.3 % underwent a malabsorptive procedure. Not specified per group.
bariatric surgery to conception >1 year
|
Length of follow-up: not reported
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm birth Defined as birth <37 weeks pregnancy I: 2/20 (10) C: 13/114 (11.4)
SGA: Defined as birth weight <3rd percentile. I: 5/20 (25) C: 21/114 (18.4)
Fetal loss: After personal communication with the author we clarified the reported outcome ‘fetal loss’ as follows: Time between bariatric surgery and pregnancy < 1 year (11 cases): 1 voluntary termination of pregnancy, 2 ectopic pregnancies, 6 early fetal loss/spontaneuos abortion, 1 intermediate fetal loss, 0 late fetal loss and 1 case unkown
Time between bariatric surgery and pregnancy > 1 year ( 23 cases): 3 voluntary termination of pregnancy, 0 ectopic pregnancy, 15 early fetal loss/ spontaneus abortion, 4 intermediate fetal loss, 1 late fetal loss
Fetal mortality is generally divided into three periods: early (less than 20 completed weeks of gestation), intermediate (20–27 weeks of gestation), and late (28 weeks of gestation or more). |
|
||||||||||||||||||||||||||||||||||||||||||
|
Kjear, 2013 |
Type of study: retrospective cohort study
Setting and country: medical registries, Denmark
Funding and conflicts of interest: Funding not reported. Authors declare no conflicts of interest. |
Inclusion criteria: women singleton post-operative birth after RYGB, only first birth was included. All live-born infants and stillbirths after gestational age 22 weeks.
Exclusion criteria: fetal demise < 22 weeks.
N total at baseline: Intervention: 158 Control: 128
Important prognostic factors2: For example age ± SD: I: 30.2 (SD unknown) C: 32.8 (SD unknown)
Sex: 100% F
Groups comparable at baseline? No, women in the early group were younger (30.2 versus. 32.8 years; p<0.001) and had a larger BMI (32.6 versus. 30.3 kg/m2; p<0.01) than the women in the late group. Only 8.7 % (25) of all the women (8.2 % in the early group and 9.4 % in the late group) had a pre-pregnancy BMI below 25 kg/m2. No difference in parity or smoking between the groups was found.
|
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >1 year
|
Length of follow-up: 7 year inclusion period.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Gestational diabetes: I: 8.9 % (14) C: 10.2 % (13)
Pre-eclampsia: Outcome not defined. I: 3.2 % (5) C: 2.3 % (3)
Caesarean section: I: 33.5 % (53) C: 30.5 % (39)
Postpartum haemorrhage: Defined >500 ml blood loss postpartum I: 6.3 % (10) C: 6.3 % (8)
Pre-term birth <37 weeks I: 9.5 % (15) C: 7.8 % (10)
SGA: Defined as birth weight −2SD: I: 7.6 % (12) C: 7.8 % (10)
LGA: Defined as birth weight +2SD I: 1.2 % (2) C: 1.6 % (2)
NICU admission: Outcome not defined I: 11.4 % (18) C: 9.4 % (12)
Birth defects I: 5.7 % (9) C: 10.2 % (13)
|
|
||||||||||||||||||||||||||||||||||||||||||
|
Patel, 2008 |
Type of study: retrospective cohort
Setting and country: single, tertriary care centre, USA
Funding and conflicts of interest: Funding not reported. Disclosures: Patel and Colella have functioned as consultants for Autosuture and have been compensated by them for their role as teachers/ educators. |
Inclusion criteria: patients who delivered infants after laparoscopic RYGB.
Exclusion criteria: none.
N total at baseline: Intervention: 4 Control: 22
Important prognostic factors2: For example age ± SD: not reported. I: C:
Sex: 100%
Groups comparable at baseline? Unclear. Mean BMI at conception appeared to differ between interval of timing, not tested for differences.
|
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <1 year
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >1 year
Calculated as the total number of pregnancies for women conceiving within 13-24 months, 25-36 months and >36 months.
|
Length of follow-up: not reported, mean interval was 25.4 (SD 13.0) months.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
IUGR: Outcome not defined. I: 0/4 C: 1/22
Pre-term delivery: Outcome not defined. I: 2/4 C: 5/22
GDM: Outcome not defined. I: 0/4 C: 1/22
Pregnancy induced hypertension: Outcome not defined. I: 0/4 C: 2/22
Preeclampsia: Outcome not defined. I: 0/4 C: 1/22
Wound infection: Outcome not defined. I: 0/4 C: 1/22 |
NB: The primary aim of this study is to compare women who underwent RYGB with women who did not. However, the information in this table only refers to study characteristics of subgroup analysis of timing of pregnancy in women who underwent RYGB, relevant to the research question.
Patients were counselled, and advised to delay pregnancy until 24 months after RYGB. |
||||||||||||||||||||||||||||||||||||||||||
|
Rasteiro, 2018 |
Type of study: retrospective cohort study.
Setting and country: Single tertiary care centre, Spain.
Funding and conflicts of interest: This research did not receive any specific grant from funding agencies in the public, commercial or not-for-profit sectors. The authors declare that they have no conflicts of interest. |
Inclusion criteria: patients with pregnancies after bariatric surgery with follow-up and delivery in a level III perinatal health care centre.
Exclusion criteria:
N total at baseline: 12 month interval: Intervention: 19 Control: 67
18 month interval: Intervention: 33 Control: 53
Important prognostic factors2: For example age ± SD: 12 month interval: I: 31.05 ±3.37 C: 31.64±4.11
18 month interval: I: 30.97±3.77
Sex: 100% F
Groups comparable at baseline? 12 months: No, weight gain was higher in late group (10 versus 12 kg); more cases of anaemia in late group (p=0.06; 5 versus. 25%) 18 months: Yes. |
Describe intervention (treatment/procedure/test):
Bariatric surgical procedure was both restrictive and malabsorptive (gastric bypass) (n=81) or only restrictive procedures (gastric banding; n=5).
Rasteiro (2018) reported results for both 12 and 18 months pregnancy.
bariatric surgery to conception <1 year
bariatric surgery to conception <18 months
|
Describe control (treatment/procedure/test):
Bariatric surgical procedure was both restrictive and malabsorptive (gastric bypass) (n=81) or only restrictive procedures (gastric banding; n=5).
Rasteiro (2018) reported results for both 12 and 18 months pregnancy.
bariatric surgery to conception >1 year
bariatric surgery to conception >18 months
|
Length of follow-up: not reported.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm delivery: Birth <37 weeks of pregnancy. 12 months interval I: 4/19 C: 10/67
18 months interval I: 5/33 C: 9/53
NICU admission: Outcome not defined. 12 months interval I: 3/19 C: 12/67
18 months interval I: 5/33 C: 10/53
Caesarean section: Outcome not defined. 12 months interval I: 5/19 C: 18/67
18 months interval I: 8/33 C: 15/53
Gestational diabetes: Defined as when starving glucose was ≥92 g/dl or accessing home capillary blood glucose profile or with an oral glucose tolerancetest. 12 months interval I: 3/19 C: 14/67
18 months interval I: 5/33 C: 12/53
Hypertensive disease: Pregnancy hypertensive complications included diagnosis of gestational hypertension, pre-eclampsia and eclampsia. 12 months interval I: 0/19 C: 4/67
18 months interval I: 1/33 C: 3/53 |
|
||||||||||||||||||||||||||||||||||||||||||
|
Rottenstreich, 2018 |
Type of study: retrospective observational cohort.
Setting and country: single university (tertiary care) hospital.
Funding and conflicts of interest: Information on funding not reported. No conflicts of interests reported by authors. |
Inclusion criteria: all singleton pregnancies of women with prior LSG who were referred to university hospital.
Exclusion criteria: -
N total at baseline: Intervention: 67 Control: 87
Important prognostic factors2: For example age (IQR): Preoperative age I: 31 (28-35) C: 29 (25 -33)
Age at conception: I: 32 (29-36) C: 32 (28 -36)
Sex: 100% F
Groups comparable at baseline? Yes, except that early group was younger (31 versus. 29). Age at conception was the same (32 versus 32).
|
Describe intervention (treatment/procedure/test):
Laparoscopic sleeve gastrectomy
bariatric surgery to conception <18 months
|
Describe control (treatment/procedure/test):
Laparoscopic sleeve gastrectomy
bariatric surgery to conception >18 months
|
Length of follow-up: not reported, median time from surgery to conception was 699 days (IQR 423-1188).
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Gestational hypertension: Systolic blood pressure >140 mm Hg and/or diastolic pressure >90 mm Hg, or the use of antihypertensive medications. I: 1/67 C: 4/87
GDM: I: 3/67 C: 1/87
Caesarean delivery: I: 25/67 C: 24/87
Of which I: 6/67 C: 11/87
Caesarean section before labor: I: 19/67 C: 13/67
Preterm delivery: Birth <37 weeks of pregnancy I: 2/67 C: 7/87
SGA: Birthweight <10th percentile I: 8/67 C: 13/87
LGA: Birthweight >90th percentile I: 2/67 C: 3/87
Macrosomia: Birth weight >4000 gram I: 1/67 C: 1/87
Postpartum haemorrhage: Defined as blood loss >500 mL after vaginal delivery or >1000 mL after caesarean section I: 6/67 C: 7/87
Apgar score <7 at 5 minutes: I: 0/67 C: 1/87
Transfer to NICU: Outcome not defined. I: 0/67 C: 3/87
Stillbirth or neonatal mortality: Outcome not defined. I: 0/67 C: 1/87 |
|
||||||||||||||||||||||||||||||||||||||||||
|
Stentjeberg, 2016 |
Type of study: retrospective observational cohort study.
Setting and country: single university (tertiary care?) hospital.
Funding and conflicts of interest: Information on funding was not reported by the authors. RKS has received consultant and lecture fees from Novo Nordisk. The authors report no conflicts of interest |
Inclusion criteria: women with singleton pregnancies and previous RYGB.
Exclusion criteria: -
N total at baseline: Intervention: 43 Control: 28
Important prognostic factors2: For example Median age (IQR): I: 30 (27-32) C: 34.5 (31-37)
Sex: 100%
Groups comparable at baseline? No, late group was older (30 versus. 34.5 years), gestational weight gain was larger in late group (5 versus. 10 kg).
|
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <18 months
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >18 months |
Length of follow-up: not reported, median duration surgery to conception was 14 months (IQR 7-22).
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm delivery: Defined as birth <37 weeks. I: 5/43 C: 5/28
Caesarean delivery: I: 13/43 C: 16/28
Diabetes: Including gestational and pre-existing diabetes. I: 2/43 C: 3/28
SGA: Defined as birth weight 2 SDs below the mean (<22% weight deviation from the mean). I: 1/43 C: 0/28
LGA: Defined as birth weight 2 SDs above the mean (>22% weight deviation from the mean). I: 1/43 C: 0/28
Postpartum haemorrhage: I: 5/43 C: 3/28
Preeclampsia: Outcome not defined. I: 1/43 C: 0/28 |
2 women with twin pregnancies were excluded 3 women with missing data were excluded. |
||||||||||||||||||||||||||||||||||||||||||
|
Wax, 2008 |
Type of study: retrospective observational cohort study.
Setting and country: single centre secondary/tertiary care?.
Funding and conflicts of interest: not reported. |
Inclusion criteria: all women receiving care in our maternal– fetal medicine practice who delivered following RYGB. Only first delivery was included in case more than 1 pregnancy was reported.
Exclusion criteria: -
N total at baseline: Intervention: 20 Control: 32
Important prognostic factors2: For example age ± SD: I: 30.7±4.9 C: 33.2±5.0
Sex: 100% F
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
RYGB
bariatric surgery to conception <18 months
|
Describe control (treatment/procedure/test):
RYGB
bariatric surgery to conception >18 months |
Length of follow-up: not reported.
Loss-to-follow-up: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: not reported. Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Preterm delivery Birth <37 weeks pregnancy. I: 4/20 C: 10/32
Indication preterm delivery: I: 1 abruption; 1 non-reassuring fetal status; 1 placenta previa; 1 suspected uterine rupture C: 5 hypertension 1 placenta previa
Birthweight <10th percentile: I: 2/20 C: 3/32
NICU admission: Outcome not defined. I: 5/20 C: 5/32
Birth defect: Outcome not defined. I: 0/20 C: 1/32
Apgar score <7 at 5 minutes: I: 1/20 C: 0/32
Caesarean section: I: 12/20 C: 19/32
Indications caesarean section: I: primary 2; repeat 10 C: primary 10; repeat 13
Gestational diabetes: I: 0/20 C: 3/32
Hypertension: Outcome was not defined. I: 7/20 C: 8/32 |
|
Abbreviations: LGA: large for gestational age; LSG: laparscopic sleeve gastrectomy; RYGB: roux-y-gastric bypass; SGA: small for gestational age.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias assessment
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
Research question:
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Basbug, 2018 |
Unclear, presumably only patients with complete data were selected, which could introduce selection bias. |
Unclear |
Unclear, congenital malformations was not defined. |
Likely, only uncorrected, descriptive data were extracted. |
|
Bebber, 2011 |
Unlikely |
Unclear |
Unclear, all outcomes were undefined. |
Likely, only uncorrected, descriptive data were extracted. |
|
Crusell. 2016 |
Unlikely |
Unclear |
Unlikely |
Likely, only uncorrected, descriptive data were extracted. |
|
Dao, 2006 |
Unclear, presumably only patients with complete data were selected, which could introduce selection bias. |
Unclear |
Unclear, all outcomes were undefined. |
Likely, only uncorrected, descriptive data were extracted. |
|
Ducarme, 2015 |
Unclear, presumably only patients with complete data were selected, which could introduce selection bias. |
Unclear |
Unclear, multiple outcomes were not defined. |
Likely, only uncorrected, descriptive data were extracted. |
|
Gonzalez, 2014 |
Unlikely |
Unclear |
Unlikely, after correspondence with author outcome definition became clear. |
Likely, only uncorrected, descriptive data were extracted. |
|
Kjear, 2013 |
Unlikely |
Unclear |
Unlikely |
Likely, only uncorrected, descriptive data were extracted. |
|
Patel, 2008 |
Likely, only patients with complete data were selected and unclear whether patients differed by timing interval based on patients characteristics. |
Unclear |
Unlikely |
Likely, only uncorrected, descriptive data were extracted. |
|
Rasteiro, 2018 |
Unlikely |
Unclear |
Unlikely |
Likely, only uncorrected, descriptive data were extracted. |
|
Rottenstreich, 2018 |
Unlikely |
Unclear |
Unclear, neonatal mortality was not defined. |
Likely, only uncorrected, descriptive data were extracted. |
|
Stentjeberg, 2016 |
Unclear, only patients with complete data were selected, not tested for differences. |
Unclear |
Unlikely |
Likely, only uncorrected, descriptive data were extracted. |
|
Wax, 2008 |
Unclear, presumably only patients with complete data were selected, which could introduce selection bias. |
Unclear |
Unclear, multiple outcomes were not defined. |
Likely, only uncorrected, descriptive data were extracted. |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Alatishe 2013 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Chagas 2017 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Costa 2018 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Dabi 2017 |
Geen origineel artikel (letter to the editor) |
|
Dalcanal 2010 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Dell'Agnolo 2011 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Dell'Agnolo 2015 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Devlieger 2010 |
Geen origineel artikel (letter to the editor) |
|
Dias 2009 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Ducarme 2013 |
Voldoet niet aan PICO (80% gastric banding) |
|
Edwards 2005 |
Geen origineel artikel (guideline) |
|
Gimenes 2017 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Han 2013 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Jans 2016 |
Geen origineel artikel (protocol paper) |
|
Jin 2013 |
Geen origineel artikel (letter to the editor) |
|
Macones 2011 |
Geen origineel artikel (letter to the editor) |
|
Nomura 2011 |
Voldoet niet aan PICO (timing interval 4 jaar) |
|
Norgaard 2014 |
Bestudeert zelfde populatie als geïncludeerde studie van Kjaer (2013). Norgaard (2014) beschrijft echter maar één uitkomst van onze interesse, vergeleken met 9 uitkomsten door Kjaer (2013). |
|
Parent 2017 |
Voldoet niet aan PICO (timing interval 2/4 jaar) |
|
Rottenstreich 2018 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Sheiner 2011 |
Voldoet niet aan PICO (>50% gastric banding) |
|
SOARD category 1 2015 |
Geen origineel artikel |
|
Stephansson 2018 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Stone 2011 |
Voldoet niet aan PICO (geen vergelijking met betrekking tot timing) |
|
Yau 2017 |
Voldoet niet aan PICO (timing interval 2 jaar) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 28-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Tijd tussen operatie en zwangerschap |
NVvH |
2020 |
2025 |
1x per 5 jaar |
NVvH |
- |
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
