Operatietechniek bij revisie chirurgie bij behandeling van obesitas
Uitgangsvraag
Welke operatietechniek heeft de voorkeur bij revisie chirurgie?
Aanbeveling
Revisie chirurgie na een eerdere Laparoscopic Adjustable Gastric Band
Overweeg bij een eerdere Laparoscopic Adjustable Gastric Band bij revisie te kiezen voor een gastric bypass.
Revisie chirurgie na een eerdere sleeve
Overweeg bij een sleeve gastrectomie met insufficiënt gewichtsverlies of gewichtstoename bij revisie te kiezen voor een meer hypo-absorptieve ingreep.
Revisie chirurgie na een eerdere gastric bypass
Overweeg bij een falende gastric bypass de volgende revisieoperaties: verlengen van de BP lis, plaatsen van een niet aanpasbare band en distaliseren van de bypass.
Een distale bypass is geassocieerd met een aanzienlijk risico op ondervoeding en diarree.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de huidige literatuur is het onduidelijk welke van de verschillende beschreven technieken voor metabole revisie chirurgie beter is dan de andere. Het is afhankelijk van het type primaire ingreep welke technische mogelijkheden daarvoor bestaan.
PICO 1: revisie chirurgie van laparoscopic Adjustable Gastric Band (LAGB) naar sleeve of gastric bypass.
De literatuur toont geen duidelijke verschillen in uitkomsten van conversie van een LAGB naar een sleeve of gastric bypass. Zowel uitkomsten voor veiligheid (complicaties, heropnames, reoperaties en mortaliteit) als voor gewicht tonen geen evidente verschillen. De follow-up in de genoemde studies is echter kort. Het is denkbaar dat er op langere termijn wel verschillen zijn.
Opgemerkt wordt dat het complicatierisico bij een sleeve onder andere bestaat uit het optreden van een lekkage van de nietjesrij. De meest lekkages treden op in het bovenste gedeelte van de sleeve, in het gebied van de Hoek van His. Indien eerder een maagband in dit gebied aanwezig was, bevindt er zich hier altijd littekenweefsel dat de kans op loslaten van de nietjesrij vergroot. De à priori kans op een lekkage van een sleeve is dan ook bij een re-operatie groter dan bij een primaire ingreep. Hoewel er in de vergelijkende studies geen duidelijk verschil naar voren komt in lekkage percentages zijn er ook studies voorhanden die hoge lekkage percentages laten zien bij conversie van band naar sleeve. Zo beschrijft bijvoorbeeld de studie van Berende (2012) een lekkage percentage van 7% na conversie van VBG en maagband naar sleeve. In een vergelijking tussen sleeve als primaire of als revisie procedure na een maagband werd geen verschil gevonden in het aantal complicaties (Noel, 2014). Het lekkagepercentage in beide groepen was respectievelijk 1,6 en 1%, hetgeen niet significant verschillend is maar wel veel hoger dan wat voor revisie van band nar gastric bypass gebruikelijk is (0,5% in veel studies).
Lekkages in de Hoek van His zijn vaak lastig te behandelen en zijn regelmatig aanleiding voor het ontstaan van een langdurige fistel. Het risico op een lekkage bestaat ook bij een gastric bypass maar treedt minder vaak op in de hoek van His, mogelijk omdat de druk in het lumen bij een gastric bypass lager is dan bij een sleeve. Indien daarom bij de conversie van een LAGB toch gekozen wordt voor een sleeve moet men rekening houden met bovenstaande.
Een deel van de patiënten met een LAGB boekt primair een slecht gewichtsverlies hetgeen onderscheiden moet worden van patiënten die primair wel goed afvallen maar later weer in gewicht aankomen. Uit onderzoek blijkt dat deze primair slecht presterende patiënten ook minder gewicht verlies hebben bij conversie naar een gastric bypass of een sleeve. Om toch tot sufficiënt gewichtsverlies te komen kan bij die patiënten worden overwogen om een meer malabsorptieve (hypo-absorptieve) ingreep te doen zoals een distale bypass, een SADI-S of een duodenal switch (Elnahas, 2013). In dat geval is het verstandig hier bij de keuze voor een revisie operatie al rekening mee te houden. Een sleeve als revisie stap geeft meer mogelijkheden voor aanvullende behandelingen (SADI, DS, et cetera) dan een gastric bypass procedure. Maar deze ingrepen zijn lastiger uit te voeren en zijn geassocieerd met een hoger aantal complicaties, waaronder ondervoeding, vitaminedeficiënties en diarree. In de regel zal daarom gekozen worden voor een gastric bypass na een eerdere maagband.
PICO 2: Roux-en-Y gastric bypass versus andere chirurgische technieken (minibypass (OAGB), SADI, duodenal switch) na een sleeve gastrectomie
Uit vergelijkende studies tussen primaire SG en primaire RYGB blijken meestal geen grote verschillen in gewichtsresultaten. Het is dan ook niet zeker om bij een sleeve die faalt vanwege onvoldoende gewicht verlies aan te nemen dat een gastric bypass dat beter zal doen. Een probleem bij de meeste studies naar conversie van een sleeve naar een RYGB is de korte follow up. Hoewel gerandomiseerd onderzoek hierover ontbreekt tonen vergelijkende studies wel dat een meer hypo-absorptieve ingreep zoals een BPD-DS of een SADI-S na een sleeve beter gewichtsverlies geeft dan een gastric bypass (Cameli, 2014; Dijkhorst, 2018; Homan, 2015; Shimon 2018). Onduidelijk is nog of de OAGB en de long-limb gastric bypass (met een biliopancreatische lis van ten minste 150 cm) het wellicht net zo goed doen als de meer hypo-absorptieve ingrepen, die wel meer risico’s met zich meebrengen.
Voor passageklachten en GERD na een sleeve gastrectomie is een gastric bypass wel een goede revisie ingreep. Conversie van een sleeve naar een gastric bypass is soms ook onderdeel van de behandeling van een chronische hoge fistel, me als doel de druk in het systeem te verlagen m daarmee de fistel tot sluiting te krijgen.
PICO3: Conversie naar een banded bypass versus conversie naar een resleeve of distaliseren na een gastric bypass
Er is wel literatuur over de vergelijking van gastric bypass en banded gastric bypass, re-sleeving of distaliseren van een bypass als primaire ingreep, maar literatuur die deze technieken vergelijkt in het kader van revisie chirurgie ontbreekt. Beschrijvende, niet vergelijkende literatuur van de genoemde technieken voor toepassing als revisie operatie is er wel (Re-sleeve: Cesana, 2014; Saliba, 2018; Catheline, 2011. Banding Bypass revisie: Lecot, 2019; Dapri, 2009; Maleckas, 2016; Bessler, 2005; Chin, 2009; Moon, 2014. Distaliseren Gastric Bypass: Fobi, 2001; Ghiassi, 2018; Tran, 2016). Na een gastric bypass met onvoldoende gewichtsverlies bestaat de mogelijkheid van het aanvullend plaatsen van een siliconen ring om de pouch of het verlengen van de lissen van de bypass (lange BP lis of korte common channel) of een combinatie van deze technieken. Aanvullend plaatsen van een siliconen band kan verder gewichtstoename voorkomen maar kan ook aanleiding zijn voor nieuwe klachten, met name dysfagie. Een verlengde of distale bypass geeft vaak goed aanvullend gewichtsverlies (Van der Burgh, 2020), maar kent soms ernstige complicaties zoals ondervoeding vitamine deficiënties en diarree.
Bij onvoldoende gewichtsverlies na een sleeve kan aanvullend een hypo-absorptieve operatie worden toegevoegd (SADI, DS, SAGI, DJB) vaak met goede resultaten.
Voor revisiechirurgie zijn er weinig vergelijkende studies voorhanden. De bewijskracht van de literatuur is daardoor laag en op punten afwezig. Bovendien zijn revisieoperaties divers en de reden voor een revisie kan sterk wisselen, hetgeen mede bepalend is voor de vervolgbehandeling. Het is daarom lastig een eensluidend advies te geven. Niettemin komen revisie operaties veel voor en bestaat er ook in veel centra behoorlijke expertise op dit terrein.
Bij ‘ te weinig gewichtsverlies’ kunnen twee groepen patiënten worden onderscheiden met een ander profiel, namelijk mensen die primair onvoldoende afgevallen zijn na operatie (insufficient weight loss) en mensen die goed afgevallen zijn maar weer aangekomen (weight regain). Het verdient aandacht en onderzoek om in de toekomst uit te maken of voor deze beide groepen een andere behandel indicatie en strategie van belang is. Insufficient weightloss heeft een ongunstiger profiel met gemiddeld gesproken slechtere resultaten. Dit rechtvaardigt bij deze groep patiënten vaker een meer hypo-absorptieve ingreep om toch tot acceptabel gewichtsverlies te komen. Hierbij wordt aangetekend dat deze hypo-absorptieve ingrepen (distale gastric bypass, SADI-S, BPD-DS) een verhoogd risico geven op chronische diarree en malnutritie, soms met ernstige gevolgen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten met zeer ernstig overgewicht zijn vaak erg gemotiveerd voor metabole chirurgie, die zij (vaak terecht) beschouwen als een last resort behandeling van hun overgewicht. De soms dringende wens voor maximaal gewichtsverlies maakt dat patiënten regelmatig bereid zijn ook potentiële risico’s en nadelige bijwerkingen te accepteren. Patiënten die extremere vormen van metabole revisie chirurgie met sterk hypo-absorptieve component ondergaan, hebben belang bij goede voorlichting en verscherpte en blijvende postoperatieve controle. Het hoge percentage uitval bij follow-up onder post-bariatrische zoals dat kan worden opgemaakt uit de nationale audit (DATO/DICA) is in dit verband wel zorgwekkend. Het risico van het niet verschijnen bij follow up moet worden meegewogen bij de beslissing voor een revisie operatie.
Kosten (middelenbeslag)
De kosteneffectiviteit van primaire metabole chirurgie is moeilijk aantoonbaar omdat in de verschillende analyses naar dit onderwerp vooral gekeken wordt naar zorgkosten. Indirecte kosten, waaronder ziekteverzuim en arbeidsongeschiktheid worden meestal niet meegenomen. In de zin van zorgkosten is metabole chirurgie wellicht niet kostenbesparend, maar dat is de behandeling van ziekte zelden. De kosten van metabole chirurgie moeten worden afgewogen tegen de enorme gezondheidswinst die er voor patiënten te bereiken valt. Overigens zijn er meerdere studies die aantonen dat metabole chirurgie wel kosteneffectief is.
Voor revisie chirurgie zijn de opgetelde kosten vanzelfsprekend hoger dan voor primaire metabole chirurgie, maar ook voor revisie is het gunstige effect op gezondheid wel aangetoond. Er zijn geen noemenswaardige kostenverschillen tussen de verschillende revisies.
Aanvaardbaarheid voor de overige relevante stakeholders
Mits aan de criteria voor revisie wordt voldaan zijn er geen bezwaren om een revisie operatie aan te bevelen in geval een primaire metabole ingreep faalt of complicaties geeft.
Haalbaarheid en implementatie
Revisie chirurgische ingrepen horen bij de huidige werkzaamheden van de metabole chirurgie. De 18 bariatrische centra in Nederland leveren voldoende capaciteit en er zijn geen wachtlijsten. Er lijken op dit punt dan ook geen belemmerende factoren te bestaan.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Op basis van de huidige literatuur is het niet eenduidig te zeggen welke revisie operatie de voorkeur verdient. Deze keuze van de techniek zal daarom mede afhangen van de primaire ingreep en de voorkeur en ervaring van de chirurg. De indicatiestelling voor de revisie chirurgische techniek wordt hierbij wel meegewogen. In zijn algemeenheid kan worden gezegd dat de resultaten voor revisie na een eerdere LAGB operatie niet erg verschillen. Op basis van expert opinion is er een lichte voorkeur voor een gastric bypass, vanwege de hogere kans op lekkage als naar verwachting het lagere additionele gewichtsverlies bij een sleeve.
Onderbouwing
Achtergrond
Metabole chirurgie is de enige evidence-based behandeling voor ernstige obesitas die langdurig en significant gewichtsverlies en resolutie van co-morbiditeiten bewerkstelligt. Dat geldt voor ieder type metabole chirurgie, alhoewel het risico op complicaties en de kans op succes van de verschillende operaties sterk verschilt.
Voor alle metabole interventies geldt dat er ook een kans is op falen. Met falen wordt een ongewenste uitkomst aangeduid: enerzijds gaat het daarbij om tegenvallende gewichtsuitkomsten (metabool falen), anderzijds wordt er ongewenste mechanische klachten en complicaties mee bedoeld (mechanisch falen).
Bij metabool falen is er onvoldoende initieel gewichtsverlies en/of onvoldoende verbetering van co-morbiditeiten volgend op de operatie, of terugval op termijn van gewicht en/of co-morbiditeiten na initieel goede respons op de operatie. Oorzaken voor falen na metabole operaties zijn niet eenduidig aan te wijzen. Gedrag en leefstijl van de patiënt, de individuele lichamelijke respons en de uitvoering van de operatie zijn belangrijke denkbare contribuanten. Conservatieve maatregelen, zoals psychologische begeleiding en begeleiding op het gebied van leefstijl, kunnen met enig succes worden ingezet. Bij uitblijven van voldoende verbetering is, behalve inzet van conservatieve therapieën, ook een nieuwe chirurgische interventie denkbaar. Het is afhankelijk van het type primaire ingreep welke technische mogelijkheden daarvoor bestaan. Bij patiënten met een Laparoscopic Adjustable Gastric Band (LAGB kan bij falen de oorspronkelijke anatomie worden hersteld en kan voor iedere alternatieve operatie worden gekozen. Ingrepen waarbij de structuur van de anatomie wordt veranderd, laten minder mogelijkheden voor revisie open. Het is onduidelijk welke revisie ingreep het beste resultaat voor falen heeft.
Bij mechanisch falen kan ook revisie chirurgie geïndiceerd zijn. De reden is dan een klacht of een (lange termijn) complicatie van de primaire ingreep. Voorbeelden daarvan zijn pouch dilatatie, erosie en slippage na een LAGB, GERD en gallige reflux na sleeve en OAGB en dysfagie, dumping of chronische pijn. Voor mechanische klachten volstaat het vaak de primaire procedure om te zeten naar een alternatieve metabole ingreep.
Bij het beoordelen van resultaten van metabole revisie chirurgie, gelden dezelfde criteria als bij primaire chirurgie. De relevante uitkomstmaten zijn gewichtsverlies en reductie van co-morbiditeiten aan de ene kant en risico op acute chirurgische complicaties en op lange termijn complicaties aan de andere kant.
Conclusies / Summary of Findings
PICO 1: conversie naar Roux-en-Y gastric bypass (RYGB) versus conversie naar sleeve gastrectomie na een laparoscopic adjustable gastric band (LAGB)
Uitkomstmaat 1.1. Operatie gerelateerde morbiditeit (cruciaal)
|
Zeer laag GRADE |
Van LAGB naar RYGB of SG: Het is onduidelijk of er een verschil tussen Roux-en-Y gastric bypass of gastric sleeve na een laparoscopic adjustable gastric band op de overall morbiditeit.
Bronnen: (Abu-Gazala, 2012; Carandina, 2014; Gonzalez-Heredia, 2015; Khoursheed, 2013; Marin-Perez, 2014; Yeung, 2016) |
Uitkomstmaat 1.2. Naadlekkages (cruciaal)
|
Zeer laag GRADE |
Van LAGB naar RYGB of SG: Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass of gastric sleeve na een laparoscopic adjustable gastric band op het risico op naadlekkage.
Bronnen: (Abu-Gazala, Carandina, 2014; Carr, 2015; Gonzalez-Heredia, 2015; Khoursheed, 2013; Marin-Perez, 2014; Yeung, 2016; Janik, 2017) |
Uitkomstmaat 1.3. Chirurgische re-interventie (cruciaal)
|
Zeer laag GRADE |
Van LAGB naar RYGB of SG: Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass of gastric sleeve na een laparoscopic adjustable gastric band op de kans dat een chirurgische re-interventie noodzakelijk is.
Bronnen: (Abu-Gazala, 2012; Carr, 2015; Khoursheed, 2013; Yeung, 2016) |
Uitkomstmaat 1.4 Ernstige complicaties (cruciaal)
|
Zeer laag GRADE |
Van LAGB naar RYGB of SG: Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass of gastric sleeve na een laparoscopic adjustable gastric band op ernstige complicaties.
Bronnen: (Altieri, 2016) |
Uitkomstmaat 2. Excess weight loss (%EWL) na één tot 2 jaar en vijf jaar (cruciaal)
|
Zeer laag GRADE |
Van LAGB naar RYGB of SG: Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass of gastric sleeve na een laparoscopic adjustable gastric band op de excess weight loss (%EWL) na één tot twee jaar.
Geen van de studies rapporteerde %EWL na vijf jaar.
Bronnen: (Carandina, 2014; Carr, 2015; Main-Perez, 2014; Moon, 2013; Mendez-Castro, 2015) |
Uitkomstmaat 3. Pijnklachten (belangrijk) & Uitkomstmaat 4. Reflux/GERD (belangrijk)
|
- GRADE |
Van LAGB naar RYGB of SG: Er werden geen studies geïncludeerd die de uitkomstmaten pijn en GERD beschreven voor de vergelijking van een RYGB versus een SG na een LAGB. |
PICO 2: Conversie naar een Roux en Y gastric bypass versus conversie naar andere chirurgische technieken (minibypass, SADI, duodenal switch) na een sleeve gastrectomie
Uitkomstmaat 1. Complicaties (cruciaal)
|
Zeer laag GRADE |
Van sleeve gastrectomie naar RYGB of anders Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass of duodenal switch na een sleeve gastrectomie op de complicaties.
Bronnen: (Homan, 2015; Shimon, 2018) |
Uitkomstmaat 2. Excess weight loss (%EWL) (cruciaal)
|
Zeer laag GRADE |
Van sleeve gastrectomie naar RYGB of anders (BPD-DS) Het is onduidelijk of er een verschil is tussen Roux-en-Y gastric bypass versus een duodenal switch na een sleeve gastrectomie op de excess weight loss (%EWL).
Bronnen: (Homan, 2015; Shimon, 2018) |
Uitkomstmaat 3. Pijnklachten (belangrijk) & Uitkomstmaat 4. Reflux/GERD (belangrijk)
|
- GRADE |
Van sleeve gastrectomie naar RYGB of anders Er waren geen studies die pijnklachten of reflux/GERD klachten beschreven voor de vergelijking van een RYGB versus een duodenal switch/andere operatie techniek na een sleeve gastrectomie. |
PICO 3: Conversie naar een banded bypass versus conversie naar een resleeve of distaliseren na een gastric bypass
|
- GRADE |
Van bypass naar banded bypass, re-sleeving of distaliseren Er werden geen studies geïncludeerd die deze soorten revisie chirurgie met elkaar vergeleken na een gastric bypass. |
Samenvatting literatuur
Beschrijving studies
PICO 1. Roux-en-Y gastric bypass (RYGB) versus sleeve gastrectomie na een laparoscopic adjustable gastric band (LAGB)
De systematische review van Sharples (2017) beschreef de effectiviteit van een gastric sleeve (n=1034) (GS) en een Roux-en-Y gastric bypass (n=1583) (RYGB) na een Laparoscopic Adjustable Gastric Band (LAGB). Er werden zesendertig observationele studies (retrospectieve cohortstudies en prospectieave cohortstudies) geïncludeerd (n = 2617 patiënten). Engelstalige, prospectieve en retrospectieve observationele en interventie studies over (1) patiënten die een gastric sleeve of een Roux-en-Y gastric bypass ondergingen na een falende LAGB, (2) data weergaven over gewichtsverandering (na minimaal 6 maanden), obesitas gerelateerde co-morbiditeiten (op elk tijdstip) of data over de kwaliteit van leven (op elk tijdstip) en (3) minstens tien patiënten beschreven, werden geïncludeerd. Studies over patiënten die een andere vorm van revisie chirurgie ondergingen na een LAGB werden geëxcludeerd, behalve als de uitkomsten voor een GS en RYGB apart werden beschreven. Studies die minder dan tien patiënten beschreven of data weergaven van open revisie procedures werden tevens geëxcludeerd (Sharples, 2017).
In sommige geïncludeerde studies werd het percentage excess weight loss (%EWL) niet genoteerd. Indien mogelijk werd dit berekend met de volgende formule: (postoperative weight loss)/(preoperative excess weight) × 100. Het ideale lichaamsgewicht werd gedefinieerd als het lichaamsgewicht waarmee een BMI van 25 kg/m2 wordt behaald. In veel artikelen is het niet duidelijk of het %EWL berekend is ten opzichte van het uitgangsgewicht voor de primaire metabole ingreep of ten opzichte van het gewicht bij de revisie operatie.
In achtentwintig van de 36 geïncludeerde studies in het review werd de indicatie voor revisie gegeven. De meest genoteerde indicatie voor revisie was te weinig gewichtsverlies.
In deze module zijn alleen de studies beschreven door Sharples (2017) geïncludeerd die een GS vergeleken met een RYGB, na een LAGB. Het is onduidelijk of de groepen in de geïncludeerde studies vergelijkbaar waren qua patiënt karakteristieken bij start van de studie (baseline) (Sharples, 2017).
De observationele studie van Altieri (2016) includeerde tussen 2004 en 2010 19.221 patiënten die een laparoscopic adjustable gastric band (LAGB) procedure hadden ondergaan, waarvan 3158 patiënten een revisie procedure nodig hadden, zoals band-revisie, band-verwijdering of een nieuwe metabole operatie (RYGB of sleeve gastrectomie). Voor onderstaande literatuuranalyse werd voor één uitkomstmaat (ernstige complicaties) relevante data gevonden, aangezien Altieri (2016) voornamelijk de groepen met revisie vergeleek met de grote groep zonder revisies. Er werden in totaal 378 patiënten geopereerd met een RYGB en 178 met een sleeve gastrectomie na LAGB. De andere patiënten ondergingen verwijdering of revisie van de maagband of behoorden tot de groep zonder revisies en waren niet relevant voor deze literatuuranalyse.
De observationele studie van Janik (2017) onderzocht door middel van een case-control design het effect van een conversie naar een RYGB versus een conversie naar een SG na een laparoscopic adjustabel gastric band. In totaal werden 4855 patiënten uit 2015 geïncludeerd en gematcht op basis van leeftijd (± jaar), BMI (±1 kg/m2), geslacht, co-morbiditeiten (diabetes, hypertensie, hyperlipidemie, veneuze stasis, slaapapneu) om te corrigeren voor eventuele verstorende variabelen. In zowel de conversie RYGB groep als de conversie-SG groep zaten 1354 patiënten. Bij alle patiënten werden het verwijderen van de maagband en de conversie naar de betreffende techniek in 1 ingreep uitgevoerd. De data uit de studie was afkomstig uit het jaar 2015.
Mendez-Castro (2015): zeer incomplete dataset; In de retrospectieve cohortstudie van Mendez-Castro (2015) werd de excess weightloss onderzocht bij patiënten met een falende maagband die door middel van een 2-staps procedure een conversie ondergingen naar een RGYB (n=71) of een SG (n=17). De data in de studie was afkomstig uit de periode van maart 2007 tot september 2014.
PICO 2: Roux-en-Y gastric bypass versus andere chirurgische technieken (minibypass (OAGB), SADI, duodenal switch) na een sleeve gastrectomie
De retrospectieve observationele studie van Homan (2015) includeerde patiënten die tussen januari 2008 en januari 2013 een BPD/DS (biliopancreatic diversion with duodenal switch) (n=25) of een RYGB (laparoscopisch) (n=18) ondergingen als revisie chirurgie na een laparoscopsiche sleeve gastrectomie. Patiënten werden geïncludeerd als er tenminste 12 maanden na de revisie chirurgie follow-up informatie beschikbaar was.
Vroege complicaties (binnen 30 dagen) werd gedefinieerd als: heroperatie, naadlekkage (op CT of bij heroperatie), bloeding (waarbij bloedtransfusie of heroperatie nodig is), wondinfectie (waarbij antibioticabehandeling of chirurgische drainage nodig is), heropname of andere onverwachte gebeurtenissen binnen 30 dagen na de operatie. Late complicaties (> 30 dagen na de operatie) werd gedefinieerd als een heropname of heroperatie voor een littekenbreuk, cholecystecomie of een inwendige herniatie. De twee groepen leken niet goed vergelijkbaar op basis van leeftijd, BMI/gewicht voor de eerste en tweede operatie en de follow-up tijd na de revisiechirurgie. Tevens werd er geen correctie gedaan voor eventuele verstorende variabelen.
De retrospectieve observationele studie van Shimon (2018) includeerde in de periode van november 2006 tot mei 2016 18 patiënten in de RYGB groep en 21 patiënten in de duodenal switch groep die als primaire chirurgie een sleeve gastrectomie hadden ondergaan. Patiënten werden geïncludeerd als er tenminste 12 maanden na de revisie chirurgie follow-up informatie beschikbaar was. De groepen leken te verschillen op basis van BMI voor de eerste en voor de tweede operatie. Tevens werd er geen correctie gedaan voor eventuele verstorende variabelen. Complicaties werden niet van tevoren gedefinieerd.
PICO 3: Conversie naar een banded bypass versus conversie naar een resleeve of distaliseren na een gastric bypass
Er werden geen studies geïncludeerd die deze soorten revisie chirurgie met elkaar vergeleken.
Resultaten
PICO 1: conversie naar Roux-en-Y gastric bypass (RYGB) versus conversie naar sleeve gastrectomie na een laparoscopic adjustable gastric band (LAGB)
Uitkomstmaat 1. Operatie-complicaties
Uitkomstmaat 1.1. Operatie gerelateerde morbiditeit (cruciaal)
De systematische review van Sharples (2017) includeerde enkele studies die morbiditeit in de RYGB groep vergeleek met SG-groep. De incidentie van mortaliteit was met 1 overleden patiënt in 34 studies te laag om een verschil te bepalen. Meta-analyse van deze studies rapporteerde een gepoolde risk ratio in overall postoperatieve morbiditeit van 1,69 (95%BI 0,95 - 3,01, p = 0,07, I2 = niet gerapporteerd) in het voordeel van de SG-groep (Abu-Gazala, 2012; Carandina, 2014; Gonzalez-Heredia, 2015; Khoursheed, 2013; Marin-Perez, 2014; Yeung, 2016).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat morbiditeit was afkomstig uit een systematische review van observationele studies en begint zodoende laag. De bewijskracht voor de uitkomstmaat morbiditeit is met één niveau verlaagd naar zeer laag gezien onduidelijkheden in de onderzoeksopzet van de geïncludeerde studies (risk of bias: ontbreken van risk of bias van de individuele studies, geen informatie over correctie voor verstorende variabelen).
Uitkomstmaat 1.2. Naadlekkages (cruciaal)
De systematische review van Sharples (2017) includeerde enkele studies die het voorkomen van naadlekkage vergeleken tussen de RYGB-groep en de SG-groep. Een meta-analyse van deze studies rapporteerde een gepoolde risk ratio voor het hebben van naadlekkages van 1,43 (95%BI 0,46 - 4,46, p = 0,54, I2 = niet gerapporteerd), in het voordeel van de SG-groep. (Abu-Gazala, Carandina, 2014; Carr, 2015; Khoursheed, 2013; Marin-Perez, 2014; Yeung, 2016).
De studie van Janik (2017) definieerde naadlekkage als volgt: nog steeds een drain na 30 dagen, chirurgische infectie: organ space surgical site infection, naadlekkage gerelateerde heropname binnen 30 dagen, leak-rate gerelateerde heroperatie/interventie binnen 30 dagen.
In de conversie-RYGB-groep onderging 2,07%% een heropname binnen 30 dagen en in de conversie-SG-groep 1,18%. Dit verschil was niet significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat leak rate was afkomstig uit een systematische review van observationele studies en begint zodoende laag. De bewijskracht voor de uitkomstmaat morbiditeit is met één niveau verlaagd naar zeer laag gezien onduidelijkheden in de onderzoeksopzet van de geïncludeerde studies (risk of bias: ontbreken van risk of bias van de individuele studies, geen informatie over correctie voor verstorende variabelen).
Uitkomstmaat 1.3. Chirurgische re-interventie (cruciaal)
De systematische review van Sharples (2017) includeerde enkele studies die het aantal patiënten die een chirurgische re-interventie ondergingen vergeleek tussen de RYGB-groep en de SG-groep. Een meta-analyse van deze studies toonde aan dat patiënten in de RYGB-groep een lagere kans hadden op acute heroperaties (RR 2,79, 95% BI 0,80 tot 9,80, p = 0,11, I2 = niet gerapporteerd)(Abu-Gazala, 2012; Carr, 2015; Khoursheed, 2013; Yeung, 2016).
Heroperatie (Janik, 2017) binnen 30 dagen (terugkeer naar de operatiekamer binnen 30 dagen na de operatie vanwege de metabole operatieprocedure).
In de conversie-RYGB-groep onderging 3,25% een heroperatie binnen 30 dagen en in de conversie-SG-groep 1,26%. Dit verschil was significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat heroperatie was afkomstig uit een systematische review van observationele studies en begint zodoende laag. De bewijskracht voor de uitkomstmaat morbiditeit is met één niveau verlaagd naar zeer laag gezien onduidelijkheden in de onderzoeksopzet van de geïncludeerde studies (risk of bias: ontbreken van risk of bias van de individuele studies, geen informatie over correctie voor verstorende variabelen).
Uitkomstmaat 1.4 Ernstige complicaties (cruciaal)
De studie van Altieri (2016) rapporteerde ernstige complicaties. De top-3 ernstige complicaties waren digestieve/intestinale complicaties, operatieve fouten (niet nader toegelicht) en pneumonie. Deze werden niet gespecificeerd over de subgroepen. In de bypass groep waren er 57/378 (15,1%) met ernstige complicaties; in de sleeve groep waren er 32/178 ernstige complicaties (18%), met een odds ratio van 0,81 (95%BI: 0,5 tot, 1,3) in het voordeel van de gastric bypass, maar dit was geen klinisch relevant verschil.
De studie van Janik (2017) definieerde een heropname binnen 30 dagen als volgt: elke heropname of 23-uurs observatie binnen 30 dagen na de metabole operatie. In de conversie-RYGB-groep onderging 7,46% een heropname binnen 30 dagen en in de conversie-SG-groep 3,69%.
De studie van Janik (2017) definieerde bloedingen als volgt: bloedingsgerelateerde heropname binnen 30 dagen, bloedingsgerelateerde heroperatie binnen 30 dagen of een transfusie binnen 72u na de operatie. In de conversie-RYGB groep had 2,66% een bloeding en in de conversie-SG-groep 0,44%. Dit is een klinisch relevant verschil.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ernstige complicaties was afkomstig uit een observationele studie en begint zodoende laag. De bewijskracht is met één niveau verlaagd vanwege risk of bias: geen informatie over correctie voor verstorende variabelen. Zodoende kwam de bewijskracht uit op zeer laag.
Uitkomstmaat 2. Excess weight loss (%EWL) na één tot 2 jaar en vijf jaar (cruciaal)
De systematische review van Sharples (2011) includeerde vier studies die het percentage excess weight loss (%EWL) na 24 maanden vergeleken tussen de RYGB-groep en de SG-groep (Carandina, 2014; Carr, 2015; Marin-Perez, 2014; Moon, 2013). Een meta-analyse van deze resultaten toonde een niet-significant verschil tussen beide groepen aan (d = 0,37, p = 0,24). Het verschil in percentage excess weight loss leek niet significant groter in de RYGB groep vergeleken met de SG-groep.
Figuur 1
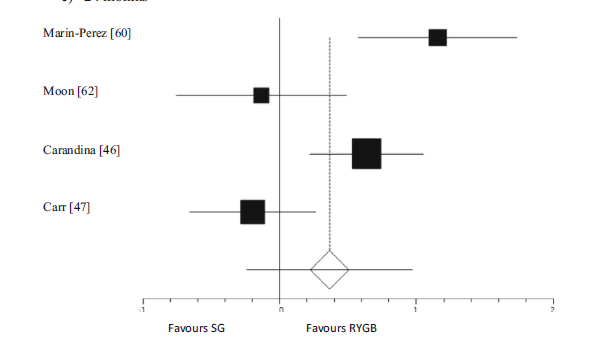
Meta-analyse van de studies die de percentage excess weight loss (%EWL) na 24 maanden in de RYGB groep vergeleek met de SG groep (Carandina, 2014; Carr, 2015; Marin-Perez, 2014; Moon, 2013)
Het percentage EWL werd op verschillende tijdstippen berekend in de studie van Mendez-Castro (2015) maar er was sprake van een zeer hoge loss-to-follow-up.
Na 3 maanden werden er in de conversie-RYGB-groep 24/71 patiënten meegenomen in de analyse en in de conversie-SG-groep 8/17 patiënten. In de conversie-RYGB-groep was het percentage EWL gemiddeld 44,8% ± 19,7 en in de conversie-SG-groep was dit gemiddeld 48% ± 20,1. Dit verschil was niet significant (p=0,691).
Na 12 maanden werden er in de conversie-RYGB-groep 6/71 patiënten meegenomen in analyse en in de conversie-SG-groep 1/17 patiënten. In de conversie-RYGB groep was het percentage EWL gemiddeld 49,8% ± 13,7 en in de conversie-LSG groep was de EWL-score 46,1% (n=1).
Geen van de studies rapporteerde %EWL na vijf jaar.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat excess weight loss (%EWL) was afkomstig uit een systematische review van observationele studies en begint zo laag. De bewijskracht voor de uitkomstmaat morbiditeit is met één niveau verlaagd naar zeer laag gezien onduidelijkheden in de onderzoeksopzet van de geïncludeerde studies (risk of bias: ontbreken van risk of bias van de individuele studies, geen informatie over correctie voor verstorende variabelen) en tegenstrijdige resultaten (inconsistentie: de puntschatters variëren sterk tussen de individuele studies.
Uitkomstmaat 3. Pijnklachten (belangrijk)
Er werden geen studies geïncludeerd waarin de uitkomstmaat pijnklachten werd vergeleken tussen de RYGB-groep en de SG-groep.
Uitkomstmaat 4. Reflux/GERD (belangrijk)
Er werden geen studies geïncludeerd waarin de uitkomstmaat deze klachten werden vergeleken tussen de RYGB-groep en de SG-groep.
PICO 2: Conversie naar een Roux en Y gastric bypass versus conversie naar andere chirurgische technieken (minibypass, SADI, duodenal switch) na een sleeve gastrectomie
Uitkomstmaat 1. Complicaties (cruciaal)
De studie van Homan (2015) rapporteerde de volgende korte termijncomplicaties (heropname of heroperatie binnen 30 dagen): 4/25 patiënten in de BPD/DS groep; 2/18 patiënten in de LRYGB-roep. Odds ratio: 1,44 (95%BI: 0,29, 7,03), in het voordeel van de LRYGB-groep.
De studie van Homan (2015) rapporteerde de volgende lange termijn complicaties (heropname of heroperatie na 30 dagen): 6/22 patiënten in de BPD/DS groep; 4/14 patiënten inde RYGB-groep (er waren minder patiënten geïncludeerd vanwege loss-to-follow-up). Odds ratio: 0,94 (95%BI: 0,21 tot 4,17) in het voordeel van de BPD/DS-groep.
Mortaliteit: geen sterfte in beide groepen.
De retrospectieve studie van Shimon (2018) beschreef de volgende complicaties (er werd niet van tevoren vastgelegd welke complicaties zouden worden gemeten): geen mortaliteit; één patiënt uit de RYGB-groep had een postoperatieve naadlekkage.
Tevens werd een aantal late complicaties beschreven:
RYGB groep:
- één patiënt met een ernstig ulcus pepticum in de pouch;
- twee patiënten met een episode van dunne darm obstructie ileus waarbij een chirurgische interventie nodig was om dit te verhelpen.
DS groep:
- drie patiënten met voedingscomplicaties (vitamine A deficiëntie en ernstige ondervoeding).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties (voor de PICO RYGB versus DS na SG) was afkomstig uit observationele studies en begint op laag. De bewijskracht werd met één niveau verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: verschil tussen de groepen, geen correctie voor verstorende variabelen) en voor het geringe aantal patiënten (imprecisie); publicatiebias.
Uitkomstmaat 2. Excess weight loss (%EWL) (cruciaal)
De studie van Homan (2015) rapporteerde het mediane %EWL na een mediane follow-up van 34 maanden. Dit was 59% (range 15 tot 113) in de BPD/DS-groep versus 23% (range -49 tot 84) in de LRYGB-groep.
Shimon (2018) rapporteerde % total weight loss (TWL). Bij de laatste follow-up na 49 maanden bereikten patiënten in de DS groep een %TWL van 28,5 ± 10% versus 21 ± 14% in de RYGB-groep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat excess weigth loss (voor de PICO RYGB versus DS na SG) was afkomstig uit observationele studies en begint op laag. De bewijskracht werd met één niveau verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet (risk of bias: verschil tussen de groepen, geen correctie voor verstorende variabelen) en voor het geringe aantal patiënten (imprecisie); publicatiebias.
3. Pijnklachten
Deze uitkomstmaat werd niet beschreven in de geïncludeerde studies.
4. Reflux/GERD klachten
Deze uitkomstmaat werd niet beschreven in de geïncludeerde studies.
PICO 3: Conversie naar een banded bypass versus conversie naar een resleeve of distaliseren na een gastric bypass
Primair: gastric bypass; revisie chirurgie: banded bypass versus resleeve of distaliseren.
Er werden geen studies gevonden die deze soorten revisie chirurgie met elkaar vergeleken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
PICO1: Wat zijn de (on)gunstige effecten van een Roux-en-Y gastric bypass, vergeleken met een gastric sleeve, na een laparoscopic adjustable gastric band (LAGB)?
P (Patiënten): patiënten die revisiechirurgie ondergingen na een laparoscopic adjustable gastric band (LAGB);
I (Interventie): roux-en-Y gastric bypass;
C (Comparison): gastric sleeve;
O (Outcome): complicaties, excess weight loss (%EWL), pijnklachten, reflux/GERD klachten.
PICO2: Wat zijn de (on)gunstige effecten van een Roux-en-Y gastric bypass, vergeleken met andere chirurgische technieken (mini bypass, SADI, duodenal switch), na een sleeve gastrectomie?
P (Patiënten): patiënten die revisiechirurgie ondergingen na een sleeve gastrectomie;
I (Interventie): roux-en-Y gastric bypass;
C (Comparison): andere revisie chirurgische technieken (mini bypass, SADI, duodenal switch);
O (Outcome): complicaties, excess weight loss (%EWL), pijnklachten, reflux/GERD klachten.
PICO3: Wat zijn de (on)gunstige effecten van banded bypass, vergeleken met een resleeve of distaliseren, na een gastric bypass?
P (Patiënten): patiënten die revisiechirurgie ondergingen na een na gastric bypass;
I (Interventie): banded bypass;
C (Comparison): resleeve of distaliseren;
O (Outcome): complicaties, excess weight loss (%EWL), pijnklachten, reflux/GERD klachten.
Relevante uitkomstmaten
De werkgroep achtte ernstige complicaties en excess weight loss voor de besluitvorming cruciale uitkomstmaten; en pijnklachten, reflux/GERD klachten een voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep hanteerde de onderstaande grenzen voor klinische relevantie en vergeleken de resultaten met deze grenzen: RR < 0,75 of > 1,25) (GRADE recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevantie benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerd onderzoek en vergelijkende studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Er is een overkoepelend search gedaan naar verschillende operatietechnieken. Deze literatuurzoekactie leverde 1945 treffers op. Voor de subgroep patiënten die revisie chirurgie ondergingen, werden studies geselecteerd op grond van de volgende selectiecriteria:
- patiënten die revisie chirurgie ondergingen;
- primair vergelijkend onderzoek in het Engels of in het Nederlands;
- Ten minste 10 patiënten per studie-arm waarin één van de PICO’s werd onderzocht.
Voor systematische reviews werd als aanvullende criteria aangehouden dat de zoekactie in tenminste twee databases was uitgevoerd, dat er een objectieve en transparante selectieprocedure en een heldere synthese van de resultaten die aansluiten bij de PICO van deze uitgangsvraag werd gepresenteerd.
Op basis van titel en abstract werden in eerste instantie 20 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 6 studies definitief geselecteerd.
Zeven onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Altieri MS, Yang J, Telem DA, Meng Z, Frenkel C, Halbert C, Talamini M, Pryor AD. Lap band outcomes from 19,221 patients across centers and over a decade within the state of New York. Surg Endosc. 2016 May;30(5):1725-32. doi: 10.1007/s00464-015-4402-8. Epub 2015 Jul 23. PubMed PMID: 26201412.
- Berende CA, de Zoete JP, Smulders JF, Nienhuijs SW. Laparoscopic sleeve gastrectomy feasible for bariatric revision surgery. Obes Surg. 2012 Feb;22(2):330-4. doi: 10.1007/s11695-011-0501-3. Review. PubMed PMID: 21866377; PubMed Central PMCID: PMC3266499.
- Bessler M, Daud A, DiGiorgi MF, Olivero-Rivera L, Davis D. Adjustable gastric banding as a revisional bariatric procedure after failed gastric bypass. Obes Surg. 2005 Nov-Dec;15(10):1443-8. PubMed PMID: 16354525.
- Carmeli I, Golomb I, Sadot E, Kashtan H, Keidar A. Laparoscopic conversion of sleeve gastrectomy to a biliopancreatic diversion with duodenal switch or a Roux-en-Y gastric bypass due to weight loss failure: our algorithm. Surg Obes Relat Dis. 2015 Jan-Feb;11(1):79-85. doi: 10.1016/j.soard.2014.04.012. Epub 2014 Apr 24. PubMed PMID: 25304833.
- Catheline, J.M., Dbouk, R., Helmy, N. et al. Obes (2011) 6: 123. https://doi.org/10.1007/s11690-011-0260-2.
- Cesana G, Uccelli M, Ciccarese F, Carrieri D, Castello G, Olmi S. Laparoscopic re-sleeve gastrectomy as a treatment of weight regain after sleeve gastrectomy. World J Gastrointest Surg. 2014 Jun 27;6(6):101-6. doi: 10.4240/wjgs.v6.i6.101. PubMed PMID: 24976903; PubMed Central PMCID: PMC4073220.
- Chin PL, Ali M, Francis K, LePort PC. Adjustable gastric band placed around gastric bypass pouch as revision operation for failed gastric bypass. Surg Obes Relat Dis. 2009 Jan-Feb;5(1):38-42. doi: 10.1016/j.soard.2008.08.012. Epub 2008 Aug 22. PubMed PMID: 18996754.
- Dapri G, Cadière GB, Himpens J. Laparoscopic placement of non-adjustable silicone ring for weight regain after Roux-en-Y gastric bypass. Obes Surg. 2009 May;19(5):650-4. doi: 10.1007/s11695-009-9807-9. Epub 2009 Mar 5. PubMed PMID: 19263180.
- Dijkhorst PJ, Boerboom AB, Janssen IMC, Swank DJ, Wiezer RMJ, Hazebroek EJ, Berends FJ, Aarts EO. Failed Sleeve Gastrectomy: Single Anastomosis Duodenoileal Bypass or Roux-en-Y Gastric Bypass? A Multicenter Cohort Study. Obes Surg. 2018 Dec;28(12):3834-3842. doi: 10.1007/s11695-018-3429-z. PubMed PMID: 30066245; PubMed Central PMCID: PMC6223754.
- Elnahas A, Graybiel K, Farrokhyar F, Gmora S, Anvari M, Hong D. Revisional surgery after failed laparoscopic adjustable gastric banding: a systematic review. Surg Endosc. 2013 Mar;27(3):740-5. doi: 10.1007/s00464-012-2510-2. Epub 2012 Aug 31. Review. PubMed PMID: 22936440.
- Fobi MA, Lee H, Igwe D Jr, Felahy B, James E, Stanczyk M, Tambi J, Eyong P. Revision of failed gastric bypass to distal Roux-en-Y gastric bypass: a review of 65 cases. Obes Surg. 2001 Apr;11(2):190-5. PubMed PMID: 11355025
- Ghiassi S, Higa K, Chang S, Ma P, Lloyd A, Boone K, DeMaria EJ. Conversion of standard Roux-en-Y gastric bypass to distal bypass for weight loss failure and metabolic syndrome: 3-year follow-up and evolution of technique to reduce nutritional complications. Surg Obes Relat Dis. 2018 May;14(5):554-561. doi: 10.1016/j.soard.2018.01.004. Epub 2018 Jan 31. PubMed PMID: 29567059.
- Homan J, Betzel B, Aarts EO, van Laarhoven KJ, Janssen IM, Berends FJ. Secondary surgery after sleeve gastrectomy: Roux-en-Y gastric bypass or biliopancreatic diversion with duodenal switch. Surg Obes Relat Dis. 2015 Jul-Aug;11(4):771-7. doi: 10.1016/j.soard.2014.09.029. Epub 2014 Oct 14. PubMed PMID: 25769402.
- Janik MR, Rogula TG, Mustafa RR, Alhaj Saleh A, Khaitan L. Safety of Revision Sleeve Gastrectomy Compared to Roux-Y Gastric Bypass After Failed Gastric Banding: Analysis of the MBSAQIP. Ann Surg. 2019 Feb;269(2):299-303. doi: 10.1097/SLA.0000000000002559. PubMed PMID: 29095195.
- Lecot FP, Boerma EG, Sigterman-Nelissen R, Meesters B, Fransen S, Greve JW. Conversion of Adjustable Gastric Banding to Adjustable Banded Roux-en-Y Gastric Bypass: Should We Leave the Band in Place? Obes Surg. 2019 Aug 1. doi: 10.1007/s11695-019-04106-w. (Epub ahead of print) PubMed PMID: 31372872.
- Maleckas A, Gudaitytė R, Petereit R, Venclauskas L, Veličkienė D. Weight regain after gastric bypass: etiology and treatment options. Gland Surg. 2016 Dec;5(6):617-624. doi: 10.21037/gs.2016.12.02. Review. PubMed PMID: 28149808; PubMed Central PMCID: PMC5233838.
- Mendes-Castro A, Montenegro J, Cardoso JF, Simões G, Ferreira C, Preto J, Carneiro S. Laparoscopic Adjustable Gastric Band: Complications, Removal and Revision in a Portuguese Highly Differentiated Obesity Treatment Center. Acta Med Port. 2015 Nov-Dec;28(6):735-40. Epub 2015 Dec 31. PubMed PMID: 26849758.
- Moon RC, Teixeira AF, Jawad MA. Treatment of weight regain following roux-en-Y gastric bypass: revision of pouch, creation of new gastrojejunostomy and placement of proximal pericardial patch ring. Obes Surg. 2014 Jun;24(6):829-34. doi: 10.1007/s11695-014-1188-z. PubMed PMID: 24446076.
- Noel P, Schneck AS, Nedelcu M, Lee JW, Gugenheim J, Gagner M, Iannelli A. Laparoscopic sleeve gastrectomy as a revisional procedure for failed gastric banding: lessons from 300 consecutive cases. Surg Obes Relat Dis. 2014 Nov-Dec;10(6):1116-22. doi: 10.1016/j.soard.2014.02.045. Epub 2014 Mar 15. PubMed PMID: 25002328.
- Saliba C, El Rayes J, Diab S, Nicolas G, Wakim R. Weight Regain After Sleeve Gastrectomy: A Look at the Benefits of Re-sleeve. Cureus. 2018 Oct 14;10(10):e3450. doi: 10.7759/cureus.3450. PubMed PMID: 30564529; PubMed Central PMCID: PMC6298623.
- Sharples AJ, Charalampakis V, Daskalakis M, Tahrani AA, Singhal R. Systematic Review and Meta-Analysis of Outcomes After Revisional Bariatric Surgery Following a Failed Adjustable Gastric Band. Obes Surg. 2017 Oct;27(10):2522-2536. doi: 10.1007/s11695-017-2677-7. Review. PubMed PMID: 28477245.
- Shimon O, Keidar A, Orgad R, Yemini R, Carmeli I. Long-Term Effectiveness of Laparoscopic Conversion of Sleeve Gastrectomy to a Biliopancreatic Diversion with a Duodenal Switch or a Roux-en-Y Gastric Bypass due to Weight Loss Failure. Obes Surg. 2018 Jun;28(6):1724-1730. doi: 10.1007/s11695-017-3086-7. PubMed PMID: 29374818.
- Tran DD, Nwokeabia ID, Purnell S, Zafar SN, Ortega G, Hughes K, Fullum TM. Revision of Roux-En-Y Gastric Bypass for Weight Regain: a Systematic Review of Techniques and Outcomes. Obes Surg. 2016 Jul;26(7):1627-34. doi: 10.1007/s11695-016-2201-5. Review. PubMed PMID: 27138603.
- van der Burgh Y, Boerboom A, de Boer H, Witteman B, Berends F, Hazebroek E. Weight loss and malnutrition after conversion of the primary Roux-en-Y gastric bypass to distal gastric bypass in patients with morbid obesity. Surg Obes Relat Dis. 2020;16(3):381-388. doi:10.1016/j.soard.2019.12.009
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Sharples, 2017
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of cohort studies (prospective and retrospective)
Literature search up to November 2015
A1: Weber, 2003 B1: Mognol, 2004 C1: Muller, 2007 D1: Spivak, 2007 E1: Topart, 2007 F1: Langer, 2008 G1: Acholonu, 2009 H1: Frezza, 2009 I1: Moore, 2009 J1: Topart, 2009 K1: Goitein, 2011 L1: Abu-Gazala, 2012 M1: Jacobs, 2011 N1: Robert, 2011 O1: Hii, 2012 Q1: Rebibo, 2012 S1: Jennings, 2013 T1: Khoursheed, 2013 U1: Liu, 2013 W1: Perathoner, 2013 X1: Slegtenhorst, 2013 Y1: Tran, 2013 A2: Aarts, 2014 B2: Carandina, 2014 C2: Delko, 2014 D2: Gonzalez – Heredia, 2015 E2: Marin-Perez, 2014 F2: Noel, 2014 G2: Silecchia, 2014 H2: Carr, 2015 I2: Emous, 2015 J2: Yeung, 2016
Prospective: A1, C1, D1, O1, P1, S1, C2, E2, H2, I2 Retrospective: all other studies
Setting and Country:
A1: Switzerland B1: France C1: Switzerland D1: USA E1: France F1: Austria G1: USA H1: USA I1: USA J1: France K1: Israel L1: Israel M1: USA N1: France O1: Australia Q1: France Arabia S1: UK T1: Kuwait U1: France W1: Australia X1: Netherlands Y1: USA
A2: Netherlands B2: France C2: Switzerland D2: USA E2: USA F2: France G2: Italy H2: UK I2: Netherlands J2: USA
Source of funding: One of the authors of the review was supported by the National Institute for Health Research (NIHR). It is stated in the review that the views expressed in this publication are those of the author(s) and not necessarily those of the National Health Service, the NIHR or the Department of Health. |
Inclusion criteria SR: 1. English language, prospective and retrospective, observational and interventional studies; 2. included patients who had undergone a laparoscopic adjustable gastric band and who subsequently underwent a Roux-en-Y bypass (B-RYGB) or sleeve gastrectomy; 3. presented data on one or more of the following postoperatively: weight change at a minimum of 6 months, obesity-related comorbidities at any time point or quality of life data at any time point; 4. and included more than 10 patients.
Exclusion criteria SR: 1. Studies including patients undergoing other types of revisional procedure unless the data regarding gastric bypass and gastric sleeve were clearly separable. 2. Studies reporting data from less than 10 patients. 3. Studies reporting data from open revisional procedures.
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi, ...
N, mean age A1: RYGB = 46.0 B1: RYGB = 41.0 C1: RYGB / D1: RYGB = 43.8 E1: RYGB = 40.9 F1: RYGB = 38.0 G1: SG = 46.6 H1: SG = 50b I1: RYGB = 46.0 J1: RYGB = 42.5 K1: SG = 40 L1: RYGB = 43.7; SG = 38,6 M1: SG = 45.4 N1: RYGB = 39.3 O1: RYGB = 49b Q1: SG = 42.0 S1: RYGB = 46.3 T1: SG = 35.6; RYGB = 39.0 U1: RYGB/SG = 42.8 W1: RYGB = 46.0 X1: RYGB = 42.0 Y1: RYGB/SG = 43.7
A2: RYGB = 43.0 B2: RYGB = 42.1; SG = 42.4 C2: RYGB = 43.5 D2: SG = 38.6; RYGB = 33.9 E2: RYGB = 49.0; SG = 44.0 F2: SG = 43.3 G2: SG = 45.5 H2: RYGB = 47.7; SG = 49.8 I2: RYGB = 43 J2: RYGB = 51.0; SG = 45.0
Sex (%female): A1: RYGB = 71.9 B1: RYGB = 72.5 C1: RYGB / D1: RYGB = 90.9 E1: RYGB = 90.6 F1: RYGB = 96.0 G1: SG = 80.0 H1: SG =60.0 I1: RYGB = 88.5 J1: RYGB = 91.4 K1: SG = 73.9 L1: RYGB = 55.6; SG = 77.8
M1: SG = 78.1 N1: RYGB = 84.7 O1: RYGB = 85.4 Q1: SG = 93.5 S1: RYGB = 81.8 T1: SG = 85.7; RYGB = 86.8 U1: RYGB/SG = 84.1 W1: RYGB = 85.2 X1: RYGB = 87.9 Y1: RYGB/SG = 91.8
A2: RYGB = 82.1 B2: RYGB = 93.2; SG = 91.2 C2: RYGB = 75.0 D2: SG = /; RYGB = / E2: RYGB = 84.6; SG = 75.0 F2: SG = 87.0 G2: SG = 78.9 H2: RYGB = 79.7; SG = 68.0 I2: RYGB = 82.9 J2: RYGB = 81.3; SG = 84.7
Preoperative BMI A1: RYGB = 42.0 B1: RYGB = 44.9 C1: RYGB = 41.9 D1: RYGB = 42.8 E1: RYGB = 43.1 F1: RYGB = 47.6 G1: SG = 38.7 H1: SG = / I1: RYGB = 40.0 J1: RYGB = 43.2 K1: SG = 43.1 L1: RYGB = 41.6; SG = 40
M1: SG = 42.7 N1: RYGB = 42.9 O1: RYGB = 43.0 Q1: SG = 44.0 S1: RYGB = 49.7 T1: SG = 38.5; RYGB = 43.2 U1: RYGB/SG = 44.7 W1: RYGB = 37.9 X1: RYGB = 46.2 Y1: RYGB/SG = 42.9
A2: RYGB = 41.0 B2: RYGB = 45.6; SG = 47.5 C2: RYGB = 41.9 D2: SG = 48.6; RYGB = 44.6 E2: RYGB = 42.0; SG = 39.0 F2: SG = 43.0 G2: SG = 43.9 H2: RYGB = 49.5; SG = 52.7 I2: RYGB = / J2: RYGB = 41.4; SG = 39.6
Groups comparable at baseline? |
Describe intervention:
A1: RYGB B1: RYGB C1: RYGB D1: RYGB E1: RYGB F1: RYGB G1: SG H1: SG I1: RYGB J1: RYGB K1: SG L1: RYGB M1: SG N1: RYGB O1: RYGB Q1: SG S1: RYGB T1: SG U1: RYGB V1: RYGB W1: RYGB X1: RYGB Y1: RYGB
B2: RYGB C2: RYGB D2: SG E2: RYGB F2: SG G2: SG H2: RYGB I2: RYGB J2: RYGB
|
Describe control:
A1: no control group B1: no control group C1: no control group D1: no control group E1: no control group F1: no control group G1: no control group H1: no control group I1: no control group J1: no control group K1: no control group L1: SG M1: no control group N1: no control group O1: no control group Q1: no control group S1: no control group T1: RYGB U1: SG V1: SG W1: no control group X1: no control group Y1: SG
A2: no control group B2: SG C2: no control group D2: RYGB E2: SG F2: no control group G2: no control group H2: SG I2: no control group J2: SG
|
Follow-up (in months):
A1: RYGB = 10.5 B1: RYGB = 7.3 C1: RYGB = / D1: RYGB = 15.7 E1: RYGB = / F1: RYGB = / G1: SG = 6.0 H1: SG = 19.0 I1: RYGB = 18.0 J1: RYGB = / K1: SG = 17.0 L1: RYGB = 14.6; SG = 14.0 M1: SG = 26.0 N1: RYGB = 22.0 O1: RYGB = / Q1: SG = / S1: RYGB = 24.0 T1: SG = 9.8; RYGB = 29.3 U1: RYGB/SG = 35.6 W1: RYGB = 40.8 X1: RYGB = 12.0 Y1: RYGB/SG = 12.4
A2: RYGB = 40.0 B2: RYGB = 29.1; SG = 24.2 C2: RYGB = / D2: SG = /; RYGB = / E2: RYGB = 22.0; SG = 33.0 F2: SG = 35.0 G2: SG = / H2: RYGB = /; SG = / I2: RYGB = 29.0 J2: RYGB = /; SG = /
For how many participants were no complete outcome data available? (intervention/control) Not mentioned in the systematic review
|
Outcome measure-1 Defined as morbidity
Effect measure: L1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) T1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) B2: L1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) D2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) E2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) J2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017)
Pooled effect (Dersimonian-Laird random effects model): RR 1.69 (95% CI 0.95 to 3.01) favoring SG. Heterogeneity (I2): not described
Outcome measure-2 Defined as leak rate
Effect measure: L1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) T1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) B2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) E2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) H2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) J2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017)
Pooled effect (Dersimonian-Laird random effects model): RR 1.43 (95% CI 0.46 to 4.46) favoring SG. Heterogeneity (I2): not described
Outcome measure-3 Return to theatre
Effect measure: L1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) T1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) H2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) J2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017)
Pooled effect (Dersimonian-Laird random effects model): RR 2.79 (95% CI 0.80 to 9.80) favoring SG. Heterogeneity (I2): not described
Outcome measure-4 Excess weight loss (%EWL)
Effect measure: V1: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) B2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) E2: : not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017) H2: not described in systematic review (SR) and meta-analysis (MA) of Sharples (2017)
Pooled effect (Dersimonian-Laird random effects model): D = 0.27, p = 0.24 favoring RYGB. Heterogeneity (I2): not described
|
Facultative: /
|
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of Bias assessment
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Sharples (2017) |
Yes |
Yes |
Yes |
Yes |
Unclear |
No |
Unclear |
No |
No (source of funding or support only reported for the systematic review) |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, risk of bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Altieri, 2016 |
Unlikely |
Unclear, not specified for re-do surgery types |
Unlikely, clear outcome measures |
Likely, no adjustment for important prognostic factors |
|
Janik, 2017 |
Likely, overmatching might have occurred |
Unclear |
Unlikely |
Likely, no adjustment for important prognostic factors (however, groups were matched) |
|
Mendez-Castro, 2015 |
Unlikely, clearly defined sample |
Likely, incomplete follow-up |
Unlikely (%EWL is clear outcome measure) |
Likely, no adjustment for important prognostic factors |
|
Homan ,2015 |
Likely, patients with insufficient weight loss/weight regain were advised to undergo BPD/DS |
Unclear, reasons why were not reported |
Unlikely |
Likely, no adjustment for important prognostic factors |
|
Shimon, 2018 |
Unlikely |
Unlikely, follow-up was part of the inclusion criteria |
Likely, complications were not pre-defined as outcome measures. |
Likely, no adjustment for important prognostic factors |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The risk of bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Abdemur, 2016 |
Revisie chirurgie valt niet binnen de PICO: re-do van Roux-en-Y-esophagojejustonomie versus RYGB |
|
Bruzzi, 2016 |
Vergelijkt met een groep die primaire procedure onderging, voldoet niet aan PICO |
|
Cobijn, 2013 |
Sharples, 2017 is recentere systematische review met dezelfde PICO |
|
Ibrahim, 2017 |
Geen uitkomstmaten voor de verschillende re-do technieken gerapporteerd. |
|
Khoursheed, 2013 |
Geïncludeerd in Sharples, 2017 |
|
Liu, 2013 |
Geïncludeerd in Sharples, 2017 |
|
Marin-Perez, 2014 |
Geïncludeerd in Sharples, 2017 |
|
Moon, 2013 |
Geïncludeerd in Sharples, 2017 |
|
Stefandis, 2013 |
Vergelijkt uitkomsten t.o.v. primaire chirurgie, voldoet niet aan PICO. |
|
Stroh, 2015 |
Fulltekst alleen in het Duits beschikbaar |
|
Van Wezenbeek, 2016 |
Voldoet niet aan PICO, primaire ingreep is verticale banded gastroplasty |
|
Van Wezenbeek, 2017 |
Voldoet niet aan PICO, vergelijkt conversie na Gastric Bypass na falende gastric band of na falende sleeve gastrectomy |
|
Weiner, 2011 |
Geen uitkomstmaten gespecificeerd per soort re-do chirurgie |
|
Yan, 2017 |
Geen systematische review; review beschrijft effect re-do met betrekking tot diabetesbehandeling en voldoet niet aan PICO |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 28-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Techniek revisie chirurgie |
NVvH |
2020 |
2025 |
1x per 5 jaar |
NVvH |
|
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Uitgangsvraag: Welke operatietechniek is voor welke indicatie geïndiceerd?
Algemeen: P: mensen die in aanmerking komen voor metabole chirurgie I: gastric bypass C: gastric sleeve O: beter resultaat, etc.
Subgroepen: P: vrouwen met een kinderwens P: kinderen P: ouderen P: reflux P: diabetes P: overige |
|
|
Database(s): PubMed |
Datum: 25-6-2018 |
|
Periode: geen restrictie, voor 2000 slechts 10 referenties meer in PubMed, zie #16 en #29 |
Talen: geen restrictie |
|
Opmerking: Op verzoek is deze vraag behandeld als 1 uitgangsvraag met een aantal subgroepen. In de uitwerking is onderscheid gemaakt tussen de verschillende subgroepen en zijn de resultaten van de verschillende groepen ontdubbeld. NB. Als gevolg van het ontdubbelen worden studies waarin meerdere groepen met elkaar worden vergeleken, slechts bij 1 subgroep getoond. Dus, een studie waarin zowel diabetes als reflux wordt genoemd wordt alleen zichtbaar in 1 van de 2 subgroepen en niet bij beide. Daarom zijn bij elke subgroep alle abstracts doorlopen. |
|
PubMed
|
Search |
Query |
Items found |
|
#62 |
#41 AND #44 overig epidemiologisch |
626 |
|
#61 |
#41 AND #43 overig RCT |
223 |
|
#60 |
#41 AND #42 overig SR |
248 |
|
#47 |
#35 AND #44 diabetes epidemiologisch |
514 |
|
#46 |
#35 AND #43 diabetes RCT |
215 |
|
#45 |
#35 AND #42 diabetes SR |
201 |
|
#59 |
#39 AND #44 ouderen epidemiologisch |
229 |
|
#58 |
#39 AND #43 ouderen RCT |
61 |
|
#57 |
#39 AND #42 ouderen SR |
53 |
|
#53 |
#37 AND #44 kinderen epidemiologisch |
168 |
|
#52 |
#37 AND #43 kinderen RCT |
51 |
|
#51 |
#37 AND #42 kinderen SR |
59 |
|
#50 |
#36 AND #44 reflux epidemiologisch |
155 |
|
#49 |
#36 AND #43 reflux RCT |
46 |
|
#48 |
#36 AND #42 reflux SR |
73 |
|
#56 |
#38 AND #44 vrouwen met een kinderwens epidemiologisch |
15 |
|
#55 |
#38 AND #43 vrouwen met een kinderwens RCT |
2 |
|
#54 |
#38 AND #42 vrouwen met een kinderwens SR |
6 |
|
#44 |
(("Epidemiologic Studies"(Mesh) OR "Prognosis"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) OR follow up(tiab) OR followup(tiab) OR prognos*(tiab))) |
6426112 |
|
#43 |
(("Randomized Controlled Trial"(Publication Type) OR "Controlled Clinical Trial"(Publication Type) OR random*(tiab) OR placebo(tiab) OR "Drug Therapy"(Subheading) OR trial(tiab) OR groups(tiab))) |
4468366 |
|
#42 |
(((review(tiab) OR "Review"(Publication Type) OR "Meta-Analysis as Topic"(Mesh) OR meta-analysis(tiab) OR "Meta-Analysis "(Publication Type)) NOT ("Letter"(Publication Type) OR "Editorial"(Publication Type) OR "Comment"(Publication Type)))) |
2921053 |
|
#41 |
#16 NOT #40 |
886 |
|
#40 |
#35 OR #36 OR #37 OR #38 OR #39 |
1011 |
|
#39 |
#16 AND #34 |
245 |
|
#38 |
#16 AND #31 |
18 |
|
#37 |
#16 AND #30 |
199 |
|
#36 |
#16 AND #28 |
189 |
|
#35 |
#16 AND #17 |
645 |
|
#34 |
("Aged"(Mesh) OR "Aged, 80 and over"(Mesh) OR "Frail Elderly"(Mesh) OR "Geriatrics"(Mesh) OR "Geriatric Psychiatry"(Mesh) OR "Geriatric Nursing"(Mesh) OR "Geriatric Dentistry"(Mesh) OR "Dental Care for Aged"(Mesh) OR "Health Services for the Aged"(Mesh)) OR (elder*(tw) OR eldest(tw) OR frail*(tw) OR geriatri*(tw) OR old age*(tw) OR oldest old*(tw) OR senior*(tw) OR senium(tw) OR very old*(tw) OR septuagenarian*(tw) OR octagenarian*(tw) OR octogenarian*(tw) OR nonagenarian*(tw) OR centarian*(tw) OR centenarian*(tw) OR supercentenarian*(tw) OR older people(tw) OR older subject*(tw) OR older patient*(tw) OR older age*(tw) OR older adult*(tw) OR older man(tw) OR older men(tw) OR older male*(tw) OR older woman(tw) OR older women(tw) OR older female*(tw) OR older population*(tw) OR older person*(tw)) |
3004680 |
|
#31 |
"Pregnancy"(Mesh) OR "Pregnant Women"(Mesh) OR "Preconception Care"(Mesh) OR pregnan*(tiab) OR gravidit*(tiab) OR gestation*(tiab) OR placentat*(tiab) OR prepregnan*(tiab) OR conception*(tiab) OR preconception*(tiab) |
1006196 |
|
#30 |
child*(tw) OR schoolchild*(tw) OR infan*(tw) OR adolescen*(tw) OR pediatri*(tw) OR paediatr*(tw) OR neonat*(tw) OR boy(tw) OR boys(tw) OR boyhood(tw) OR girl(tw) OR girls(tw) OR girlhood(tw) OR youth(tw) OR youths(tw) OR baby(tw) OR babies(tw) OR toddler*(tw) OR "Mental Disorders Diagnosed in Childhood"(MeSH) OR teen(tw) OR teens(tw) OR teenager*(tw) OR newborn*(tw) OR postneonat*(tw) OR postnat*(tw) OR perinat*(tw) OR puberty(tw) OR preschool*(tw) OR suckling*(tw) OR picu(tw) OR nicu(tw) OR "Arthritis, Juvenile"(Mesh) OR "Myoclonic Epilepsy, Juvenile"(Mesh) OR "Leukemia, Myelomonocytic, Juvenile"(Mesh) OR "Xanthogranuloma, Juvenile"(Mesh) OR "Juvenile Delinquency"(Mesh) OR "Corneal Dystrophy, Juvenile Epithelial of Meesmann"(Mesh) |
4049936 |
|
#28 |
(("Gastroesophageal Reflux"(Mesh)) OR "Bile Reflux"(Mesh)) OR "Duodenogastric Reflux"(Mesh) OR reflux*(tiab) |
58129 |
|
#17 |
"Diabetes Mellitus"(Mesh) OR "Hypoglycemic Agents"(Mesh) OR "Hypoglycemic Agents" (Pharmacological Action) OR diabetes(tiab) OR diabetic*(tiab) OR insulin*(tiab) OR metformin*(tiab) OR rosiglitazon*(tiab) OR troglitazon*(tiab) OR pioglitazon*(tiab) OR hypoglycem*(tiab) OR hypoglycaem*(tiab) |
857247 |
|
#29 |
#14 AND #15 Filters: Publication date from 2000/01/01 |
1887 |
|
#16 |
#14 AND #15 |
1897 |
|
#15 |
"Gastric Balloon"(Mesh) OR gastric sleev*(tiab) OR sleeve gastrectom*(tiab) OR stomach stapl*(tiab) OR gastric balloon*(tiab) |
4643 |
|
#14 |
"Gastric Bypass"(Mesh) OR gastric bypass*(tiab) OR roux en y*(tiab) OR gastroileal bypass*(tiab) OR gastrojejunostom*(tiab) OR jejunoileal bypass*(tiab) OR jejuno ileal bypass*(tiab) OR ileojejunal bypass*(tiab) OR intestinal bypass*(tiab)OR omega loop*(tiab) |
17611 |
Embase.com
|
No. |
Query |
Results |
|
#68 |
#48 AND ((cohort:ti,ab,kw OR (case:ti,ab,kw AND (control:ti,ab,kw OR controll*:ti,ab,kw OR comparison:ti,ab,kw OR referent:ti,ab,kw)) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'epidemiology'/de OR follow) AND up:ti,ab,kw OR followup:ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw) Overig, Epidemiologisch, |
325 |
|
#67 |
#48 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Overig RCT |
200 |
|
#66 |
#48 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de), Overig SR |
86 |
|
#48 |
(#23 OR #24 OR #25 OR #26 OR #43) NOT (#30 OR #31 OR #32 OR #33 OR #34 OR #35 OR #36 OR #37 OR #38 OR #39 OR #40 OR #41 OR #42) |
493 |
|
#47 |
#23 OR #24 OR #25 OR #26 OR #43 |
891 |
|
#46 |
#43 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti Kinderwens, epidemiologisch |
12 |
|
#45 |
#43 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti Kinderwens, RCT |
1 |
|
#44 |
#43 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Kinderwens, SR |
0 |
|
#43 |
(((('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab)) AND (1-1-2000)/sd) NOT 'conference abstract'/it) AND ('pregnancy'/exp OR 'pregnant woman'/exp OR 'female infertility'/exp OR 'pregnancy disorder'/exp OR 'reproductive health'/exp OR 'female fertility'/exp OR pregnan*:ti,ab,kw OR gravidit*:ti,ab,kw OR gestation*:ti,ab,kw OR placentat*:ti,ab,kw OR prepregnan*:ti,ab,kw OR conception*:ti,ab,kw OR preconception*:ti,ab,kw OR (('fertility'/de OR 'infertility'/de OR fertil*:ti,ab,kw OR infertil*:ti,ab,kw) AND ('female'/exp OR woman:ti,ab,kw OR women:ti,ab,kw OR female*:ti,ab,kw))) |
19 |
|
#42 |
'pregnancy'/exp OR 'pregnant woman'/exp OR 'female infertility'/exp OR 'pregnancy disorder'/exp OR 'reproductive health'/exp OR 'female fertility'/exp OR pregnan*:ti,ab,kw OR gravidit*:ti,ab,kw OR gestation*:ti,ab,kw OR placentat*:ti,ab,kw OR prepregnan*:ti,ab,kw OR conception*:ti,ab,kw OR preconception*:ti,ab,kw OR (('fertility'/de OR 'infertility'/de OR fertil*:ti,ab,kw OR infertil*:ti,ab,kw) AND ('female'/exp OR woman:ti,ab,kw OR women:ti,ab,kw OR female*:ti,ab,kw)) |
1288988 |
|
#41 |
#26 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Ouderen, epidemiologisch |
132 |
|
#40 |
#26 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Ouderen, RCT |
41 |
|
#39 |
#26 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Ouderen SR |
3 |
|
#38 |
#25 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Kinderen, epidemiologisch |
98 |
|
#37 |
#25 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Kinderen, RCT |
46 |
|
#36 |
#25 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Kinderen, SR |
18 |
|
#35 |
#24 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Reflux epidemiologsch |
102 |
|
#34 |
#24 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Reflux, RCT |
47 |
|
#33 |
#24 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Reflux, SR |
21 |
|
#32 |
#23 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Diabetes epidemiologisch |
149 |
|
#31 |
#23 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Diabetes RCT |
119 |
|
#30 |
#23 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Diabetes SR |
43 |
|
#26 |
#22 AND ('aged'/exp OR 'geriatrics'/exp OR 'elderly care'/exp OR elder*:de,ab,ti OR eldest:de,ab,ti OR frail*:de,ab,ti OR geriatri*:de,ab,ti OR ((old NEXT/1 age*):de,ab,ti) OR ((oldest NEXT/1 old*):de,ab,ti) OR senior*:de,ab,ti OR senium:de,ab,ti OR ((very NEXT/1 old*):de,ab,ti) OR septuagenarian*:de,ab,ti OR octagenarian*:de,ab,ti OR octogenarian*:de,ab,ti OR nonagenarian*:de,ab,ti OR centarian*:de,ab,ti OR centenarian*:de,ab,ti OR supercentenarian*:de,ab,ti OR 'older people':de,ab,ti OR ((older NEXT/1 subject*):de,ab,ti) OR ((older NEXT/1 patient*):de,ab,ti) OR ((older NEXT/1 age*):de,ab,ti) OR ((older NEXT/1 adult*):de,ab,ti) OR 'older man':de,ab,ti OR 'older men':de,ab,ti OR 'older male*':de,ab,ti OR 'older woman':de,ab,ti OR 'older women':de,ab,ti OR 'older female*':de,ab,ti OR ((older NEXT/1 population*):de,ab,ti) OR ((older NEXT/1 person*):de,ab,ti)) |
234 |
|
#25 |
#22 AND (adolescen*:ab,ti OR 'adolescence'/exp OR 'adolescent coping orientation for problem experiences'/exp OR 'adolescent development'/exp OR 'adolescent disease'/exp OR 'adolescent health'/exp OR 'adolescent parent'/exp OR 'adolescent pregnancy'/exp OR 'adolescent smoking'/exp OR 'adolescent'/exp OR 'adolescent-family inventory of life events and changes'/exp OR babies:ab,ti OR baby:ab,ti OR 'birth weight'/exp OR boy:ab,ti OR boyhood:ab,ti OR boys:ab,ti OR 'brazelton neonatal behavioral assessment scale'/exp OR 'child abuse'/exp OR 'child advocacy'/exp OR 'child behavior checklist'/exp OR 'child behavior'/exp OR 'child care'/exp OR 'child death'/exp OR 'child health care'/exp OR 'child health'/exp OR 'child nutrition'/exp OR 'child parent relation'/exp OR 'child psychology'/exp OR 'child restraint system'/exp OR 'child safety'/exp OR 'child welfare'/exp OR child*:ab,ti OR 'child'/exp OR 'childhood disease'/exp OR 'childhood mortality'/exp OR 'childhood'/exp OR girl:ab,ti OR girlhood:ab,ti OR girls:ab,ti OR 'high risk infant'/exp OR infan*:ab,ti OR 'infant disease'/exp OR 'infant mortality'/exp OR 'infant nutrition'/exp OR 'infant welfare'/exp OR 'infanticide'/exp OR 'infantile diarrhea'/exp OR 'infantile hypotonia'/exp OR 'juvenile delinquency'/exp OR neonat*:ab,ti OR 'neonatal weight loss'/exp OR 'newborn disease'/exp OR 'newborn morbidity'/exp OR 'newborn period'/exp OR newborn*:ab,ti OR 'newborn'/exp OR nicu:ab,ti OR 'only child'/exp OR paediatr*:ab,ti OR pediatri*:de,ab,ti OR 'pediatric advanced life support'/exp OR 'pediatric anesthesia'/exp OR 'pediatric cardiology'/exp OR 'pediatric hospital'/exp OR 'pediatric intensive care nursing'/exp OR 'pediatric nurse practitioner'/exp OR 'pediatric nursing'/exp OR 'pediatric rehabilitation'/exp OR 'pediatric surgery'/exp OR 'newborn hypoxia'/exp OR 'pediatric ward'/exp OR 'pediatrics'/exp OR perinat*:ab,ti OR 'perinatal development'/exp OR 'perinatal period'/exp OR 'persistent hyperinsulinemic hypoglycemia of infancy'/exp OR picu:ab,ti OR postnat*:ab,ti OR 'postnatal care'/exp OR 'postnatal development'/exp OR 'postnatal growth'/exp OR postneonat*:ab,ti OR preschool*:ab,ti OR puberty:ab,ti OR 'runaway behavior'/exp OR 'school child':ab,ti OR schoolchild*:ab,ti OR 'severe myoclonic epilepsy in infancy'/exp OR suckling*:ab,ti OR teen:ab,ti OR teenager*:ab,ti OR teens:ab,ti OR toddler*:ab,ti OR 'transient hypogammaglobulinemia of infancy'/exp OR youth:ab,ti OR youths:ab,ti) |
205 |
|
#24 |
#22 AND ('gastroesophageal reflux'/exp OR 'duodenogastric reflux'/exp OR reflux:ti,ab) |
252 |
|
#23 |
#22 AND ('non insulin dependent diabetes mellitus'/exp OR (((diabetes OR diabetic*) NEAR/3 ('non insulin depend*' OR 'noninsulin depend*' OR noninsulindepend* OR 'non insulindepend*' OR 'maturity onset*' OR 'adult onset*' OR 'slow onset*')):ti,ab) OR dm2:ti,ab OR niddm:ti,ab OR 'dm 2':ti,ab OR t2d*:ti,ab OR 'dm type 2':ti,ab OR 'type 2 diabet*':ti,ab OR 'type two diabet*':ti,ab OR 'type ii diabet*':ti,ab OR 'dm type ii':ti,ab) |
424 |
|
#22 |
((('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab)) AND (1-1-2000)/sd) NOT 'conference abstract'/it |
1863 |
|
#16 |
('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab) |
4785 |
|
#15 |
'gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab |
10979 |
|
#10 |
'gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab |
29409 |
Wiley/Cochrane Library
|
Search |
Query |
Items found |
|
#1 |
("gastric balloon*" or "gastric sleev*" or "sleeve gastrectom*" or "stomach stapl*" or "gastric balloon"):ti,ab,kw AND ("gastric bypass*" or "roux en y" or "roux en ys" or "gastroileal bypass*" or "gastrojejunostom*" or "jejunoileal bypass*" or "jejuno ileal bypass*" or "intestinal bypass*" or "omega loop"):ti,ab,kw |
298 |
|
#2 |
#1 and (pregnan* or gravidit* or gestation* or placentat* or prepregnan* or conception* or preconception* or ((fertil* or infertil*) and (woman or women or female*))):ti,ab,kw |
0 |
|
#3 |
#1 and (elder* or eldest or frail* or geriatri* or "old age*" or "oldest old*" or senior* or senium or "very old*" or septuagenarian* or octagenarian* or octogenarian* or nonagenarian* or centarian* or centenarian* or supercentenarian* or "older people" or "older subject*" or "older patient*" or "older age*" or "older adult*" or "older man" or "older men" or "older male" or "older woman" or "older women" or "older female" or "older population*" or "older person*"):ti,ab,kw |
5 |
|
#4 |
#1 and (infan* or child* or adolescen* or pediatric* or paediatric* or pube* or juvenil* or school* or newborn* or "new-born*" or "neo-nat*" or neonat* or premature* or postmature* or "pre-mature*" or "post-mature*" or preterm* or "pre-term*" or baby or babies or toddler* or youngster* or preschool* or kindergart* or kid or kids or playgroup* or "play-group*" or playschool* or prepube* or preadolescen* or "junior high*" or highschool* or "senior high" or "young people*" or minors):ti,ab,kw |
37 |
|
#5 |
#1 and (diabetes or "diabetic*" or "insulin*" or "metformin*" or "rosiglitazon*" or "troglitazon*" or "pioglitazon*" or "hypoglycem*" or "hypoglycaem*"):ti,ab,kw |
132 |
|
#6 |
#1 and reflux* |
35 |
|
#7 |
#1 not (#2 or #3 or #4 or #5 or #6) |
122 |
