Operatietechniek bij patiënten met diabetes mellitus type 2 bij chirurgische behandeling van obesitas
Uitgangsvraag
Wat is de meest geschikte chirurgische techniek bij patiënten met diabetes mellitus type 2?
Aanbeveling
Verricht bij voorkeur een gastric bypass operatie bij patiënten met diabetes mellitus type 2 en obesitas.
Bespreek met de patiënt ook de mogelijke alternatieve technieken, zoals de sleeve gastrectomie en maak samen met de patiënt de uiteindelijke keuze voor de operatietechniek.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft, namelijk patiënten met diabetes type 2.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
De gevonden studies vergeleken bijna allemaal gastric bypass met sleeve gastrectomie, waarvan één studie de (mini-)gastric bypass vergeleek met sleeve gastrectomie (Lee, 2014). Het was echter onduidelijk hoeveel patiënten een mini-gastric bypass en hoeveel patiënten een gastric bypass kregen. Eén studie (Casajoana) keek naar het effect van greater curvature plication als metabole chirurgische techniek ten opzichte van de gastric bypass of sleeve gastrectomie, maar het bewijs was onvoldoende om hier conclusies uit te trekken. Greater curvature plication is bovendien een techniek die in Nederland niet wordt toegepast. Er kunnen dus alleen conclusies getrokken worden voor de vergelijking gastric bypass met sleeve gastrectomie.
Diabetes gerelateerde uitkomsten
Patiënten met een gastric bypass hebben mogelijk betere HbA1c% waarden vergeleken met een patiënten met een sleeve gastrectomie. Deze verbetering is klinisch relevant (≥ 0,5% verlaging) na 3 tot 5 jaar voor patiënten met een BMI van 25 tot 35 kg/m2, maar niet klinisch relevant na 1 jaar, voor patiënten met een BMI van > 35 kg/m2. Hetzelfde patroon geldt voor remissie van diabetes (HbA1c% < 6,0% zonder medicatiegebruik).
Gewichtsverlies
Patiënten met een gastric bypass hebben mogelijk ook een hoger percentage excess weight loss. Dit verschil is klinisch relevant (> 10%) in zowel in de groep met een BMI van 25 tot 35 kg/m2 als de groep met een BMI >35 kg/m2.
Medicijngebruik
Minder patiënten gebruikten nog insuline na een gastric bypass vergeleken met een sleeve gastrectomie. Deze verbetering is klinisch relevant na 3 tot 5 jaar voor patiënten met een BMI van 25 tot 35 kg/m2, maar niet klinisch relevant na 1 jaar voor patiënten met een BMI van > 35 kg/m2. Voor het gebruik van orale glucose verlagende medicijnen door patiënten waren de resultaten tegenstrijdig. In de groep met een BMI van 25 en 35 kg/m2 gebruikten de gastric bypass minder orale glucose verlagende medicijnen na 3 tot 5 jaar follow-up, terwijl in de BMI-groep > 35 kg/m2 dit voordeel werd gerapporteerd bij patiënten met sleeve gastrectomie.
De overall bewijskracht is laag. Dit komt doordat de studies heterogeen waren. De geïncludeerde populatie verschilde in BMI en de follow-up duren varieerden van één tot vijf jaar. Daarom is ervoor gekozen op subgroep analyses te presenteren, waarvan de resultaten soms inconsistent waren. Ook was de omvang van de studiepopulatie in de studies klein of was de diabetespopulatie een kleine subgroep in een grotere RCT (bijvoorbeeld Salminen, 2018). Hierdoor waren er maar weinig patiënten die uiteindelijk nog medicatie gebruikten, waardoor de resultaten voor bijvoorbeeld de uitkomstmaat medicijngebruik gebaseerd is op enkele patiënten.
Op basis van de literatuur lijkt er een voorkeur te zijn voor de gastric bypass ten opzichte van de sleeve gastrectomie bij patiënten met diabetes type 2. Met name op de langere termijn (3 tot 5 jaar) is er een voordeel van de gastric bypass ten opzichte van sleeve gastrectomie op diabetesremissie en medicijngebruik. Daarbij wordt opgemerkt dat de configuratie van de gastric bypass met langere biliopancreatische lis, zoals in Nederland veel wordt uitgevoerd, gemiddeld gesproken nog betere uitkomsten geeft voor wat betreft %EWL (72% na 4 jaar) en diabetesremissie (78% na 4 jaar) (Homan, 2018). Een vergelijking van deze ‘lange BP gastric bypass’ met sleeve gastrectomie is echter niet uitgevoerd.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Gastric bypass en sleeve gastrectomie zijn beide geaccepteerde en gangbare metabole chirurgische technieken in Nederland. Patiënten zijn vaak bekend met deze technieken. De beslissing welke operatie gedaan gaat worden is gebaseerd op de voor- en nadelen en komt tot stand door “shared decision making” tussen chirurg en patiënt. Overige resultaten en complicaties zijn redelijk vergelijkbaar tussen deze twee ingrepen. Echter kan bij een patiënt met diabetes mellitus type 2 op basis van de literatuur wel worden aangegeven dat de voorkeur voor een gastric bypass bestaat. De resultaten voor remissie van diabetes mellitus na sleeve gastrectomie zijn niet veel slechter. Sleeve gastrectomie is daarom een redelijk alternatief.
Kosten (middelenbeslag)
De kosten van een gastric bypass en sleeve gastrectomie operatie zijn qua middelen, personeel en materialen vergelijkbaar en spelen in de keuze voor de behandeling geen rol van betekenis.
Aanvaardbaarheid voor de overige relevante stakeholders
De beslissing welke operatie gedaan gaat worden is gebaseerd op de voor- en nadelen en komt tot stand door “shared decision making” tussen chirurg en patiënt. Overige stakeholders komen alleen in beeld bij bepaalde patiënten categorieën als kinderen, ouderen en vrouwen in de vruchtbare levensfase. In deze richtlijn wordt in aparte (sub) vragen aandacht besteed aan deze groepen.
Haalbaarheid en implementatie
Gastric bypass en sleeve gastrectomie zijn beide geaccepteerde en gangbare metabole chirurgische technieken in Nederland. Naar aanleiding van deze richtlijn zullen er vermoedelijk niet meer of minder procedures plaats gaan vinden. Wellicht dat de verhouding tussen de twee beschreven technieken (iets) verschuift doch vermoedelijk kiest de chirurg in Nederland in het geval van diabetes mellitus type 2 al vaker voor de gastric bypass.
Rationale/ balans tussen de argumenten voor en tegen de interventie
De aanbeveling om bij een patiënt met diabetes mellitus type 2 de gastric bypass toe te passen is ondanks de lage bewijskracht gerechtvaardigd, aangezien het een gebruikelijke techniek is en het de dagelijkse praktijk niet danig zal veranderen maar meer zal volgen. Bovendien is het alternatief, de sleeve gastrectomie, ook zeer effectief in de behandeling van ernstige obesitas en diabetes mellitus type 2 blijkend uit de genoemde literatuur. Dit blijft dus altijd een overweging en beslissing van chirurg en patiënt.
Onderbouwing
Achtergrond
Metabole chirurgie is de enige evidence-based behandeling voor ernstige obesitas die langdurig en significant gewichtsverlies en resolutie van co-morbiditeiten bewerkstelligt, waaronder diabetes mellitus. Dat geldt voor ieder type bariatrische interventie, hoewel de kans op succes van de verschillende operaties sterk verschilt en het effect op diabetes mellitus is geen uitzondering hierop. Puur restrictieve ingrepen als de maagband leiden tot een significante verbetering van diabetes mellitus doch dit is het gevolg van gewichtsverlies. Sterk malabsorptieve ingrepen als de biliopancreatische diversie kunnen tot wel 100% verbetering dan wel genezing van diabetes mellitus type 2 bewerkstelligen als gevolg van het omleidingseffect en de positieve beïnvloeding op bepaalde darmhormonen (incretines). Omdat diabetes mellitus type 2 een sterke indicatie is om metabole chirurgie te verrichten bij patiënten met een BMI > 35 kg/m2, doch ook in bepaalde mate bij patiënten met een BMI > 30 kg/m2 (zie hiervoor elders in deze richtlijn), heeft de richtlijn commissie zich de vraag gesteld welke metabole ingreep het meest geschikt is om diabetes mellitus patiënten mee te behandelen, afgewogen tegen de risico’s en complicaties. Omdat in Nederland de (mini) gastric bypass en sleeve operatie de meest gebruikelijke technieken zijn, en de maagband en sterke malabsorptieve ingrepen als de BPD en SADI slechts op kleine schaal worden toegepast, is de zoekstrategie gebaseerd op de meest toegepaste technieken.
Conclusies / Summary of Findings
Uitkomstmaat 1. Diabetes remissie: < 6,0% HbA1c zonder medicatiegebruik (cruciaal)
|
Laag GRADE |
De (mini) gastric bypass resulteert mogelijk in een klinisch relevante hogere diabetesremissie (HbA1c% < 6,0% zonder medicatiegebruik) ten opzichte van de sleeve gastrectomie na 3 tot 5 jaar, voor patiënten met een BMI van 25 tot 35 kg/m2. De gastric bypass resulteert mogelijk in meer diabetesremissie (HbA1c% < 6,0% zonder medicatiegebruik) ten opzichte van de sleeve gastrectomie na 1 jaar, voor patiënten met een BMI van > 35 kg/m2 en diabetes mellitus type 2, maar dit verschil is niet klinisch relevant.
Bronnen: (Casajoana, 2017; Lee, 2014; Murphy, 2018; Salminen, 2018; Schauer, 2017; Tang, 2016; Yang, 2015) |
Uitkomstmaat 2. HbA1c waarden (%) (glycated hemoglobin) (cruciaal)
|
Laag GRADE |
De gastric bypass resulteert mogelijk in klinisch relevante betere HbA1c waarden ten opzichte van de sleeve gastrectomie na 3 tot 5 jaar, voor patiënten met een BMI van 25 tot 35 kg/m2 en diabetes mellitus type 2.
De gastric bypass resulteert mogelijk in betere HbA1c waarden ten opzichte van de sleeve gastrectomie na 1 jaar, voor patiënten met een BMI van > 35 kg/m2 en diabetes mellitus type 2, maar dit verschil is niet klinisch relevant.
Bronnen: (Casajoana, 2017; Keidar, 2013; Lee, 2014; Salminen, 2018; Schauer, 2017; Tang, 2016; Yang, 2015) |
Uitkomstmaat 3. Excess weight loss (belangrijk)
|
Laag GRADE |
Patiënten met diabetes mellitus type 2 hebben na een gastric bypass mogelijk een hoger percentage excess weight loss na één tot vijf jaar ten opzichte van patiënten met een sleeve gastrectomie, zowel in de groep met een BMI van 25 tot 35 kg/m2 als de groep met een BMI >35 kg/m2.
Bronnen: (Murphy, 2018; Salminen, 2018; Tang, 2016; Yang, 2015) |
Uitkomstmaat 4. Medicijngebruik - Orale glucose verlagende medicijnen (belangrijk)
|
Laag GRADE |
Het is onduidelijk welke metabole chirurgische techniek (gastric bypass of sleeve gastrectomie) het beste effect heeft op het gebruik van orale glucoseverlagende medicijnen:
In de groep patiënten met diabetes mellitus type 2 met een BMI van 25 en 35 kg/m2 resulteert de gastric bypass mogelijk in een verlaging van de orale glucoseverlagende medicijnen ten opzichte van patiënten met een sleeve gastrectomie na 3 tot 5 jaar follow-up.
In de groep patiënten met diabetes mellitus type 2 met een BM > 35 kg/m2 resulteert de sleeve gastrectomie mogelijk in een verlaging van de orale glucoseverlagende medicijnen ten opzichte van patiënten met een gastric bypass na 1 jaar follow-up.
Bronnen: (Keidar, 2013, Lee, 2014; Yang, 2015) |
Uitkomstmaat 5. Medicijngebruik - Insulinegebruik (belangrijk)
|
Laag GRADE |
De gastric bypass resulteert mogelijk in een klinisch relevante verlaging van insulinegebruik ten opzichte van de sleeve gastrectomie na 3 tot 5 jaar, bij patiënten met diabetes mellitus type 2 met een BMI van 25 en 35 kg/m2.
De gastric bypass resulteert mogelijk in een verlaging van insulinegebruik ten opzichte van de sleeve gastrectomie na 1 jaar bij patiënten met diabetes mellitus type 2, maar dit verschil is niet klinisch relevant.
Bronnen: (Keidar, 2013; Lee, 2014; Murphy, 2018Schauer, 2017; Yang, 2015) |
Uitkomstmaat 6. Cardiovasculaire events (belangrijk)
|
Laag GRADE |
Het is onbekend wat het effect is van metabole chirurgie (sleeve gastrectomie of gastric bypass) op cardiovasculaire events bij patiënten met diabetes mellitus type 2 aangezien deze zich niet hebben voorgedaan of niet gerapporteerd werden in de beschikbare studies
Bronnen: (Schauer, 2017) |
Samenvatting literatuur
Beschrijving studies
De studie van Lee (2014) en Murphy (2018) betreffen een dubbel blinde RCT. De andere RCT’s zijn niet geblindeerd.
Casajoana (2017) vergeleek een metabolic Roux-en-Y gastric bypass (GB) (n=15) met een sleeve gastrectomie (SG) en een greater curvature plication (GCP); er werden 15 patiënten per groep geïncludeerd (criteria: leeftijd 18 tot 60; BMI van 35 tot 43 kg/m2; diabetes type 2 op basis van glucose verlagende medicijnen of insulinegebruik). De groepen waren vergelijkbaar qua patiëntkarakteristieken.
De studie van Keidar (2013) vergeleek een Roux-en-Y gastric bypass (n=19) met een sleeve gastrectomie (n=18). Patiënten met diabetes type 2 (gediagnosticeerd door middel van een orale glucose tolerantie test), een BMI groter dan 35 kg/m2 en in de leeftijd van 18 tot 65 jaar werden geïncludeerd. Patiënten met een geschiedenis van gastro-intestinale chirurgie werden geëxcludeerd. De groepen waren vergelijkbaar qua patiëntkarakteristieken.
De studie van Lee (2014) vergeleek een laparoscopische one anastomosis (mini-)gastric bypass (OAGB)(n=30) met een laparoscopische sleeve gastrectomie (LSG) (n=30). Patiënten tussen de 30 tot 60 jaar oud werden geïncludeerd als ze ten minste zes maanden behandeling hadden gehad voor hun diabetes type 2, met een HbA1c level hoger dan 7,5% en een C-peptide serium level hoger dan 1,0ng/mL. Ze hadden een BMI tussen de 25 en 34,9 kg/m2. De groepen waren vergelijkbaar qua patiëntkarakteristieken.
Murphy (2018) vergeleek de laparoscopsche Roux-en-Y gastric bypass met silastic ring (n=58) versus een laparoscopische sleeve gastrectomie (n=56). Patiënten in de leeftijd van 20 tot 55 jaar met een BMI tussen de 35 en 65 kg/m2 en een diagnose van diabetes type 2 (minstens een half jaar aanwezig) werden geïncludeerd. Patiënten met postprandiale C-peptide < 350 pmol/L, diabetes type 1 of secundaire diabetes, chronische pancreatitis, onder behandeling met orale steroïden, rokers of niet geschikt om anesthesie te ondergaan, werden geëxcludeerd. De groepen waren vergelijkbaar qua patiëntkarakteristieken.
Yang (2015) vergeleek Roux-en-Y gastric bypass (n=32) met sleeve gastrectomie (n=32). Patiënten met een diagnose van slecht gecontroleerde diabetes type 2 (> 6 maanden medicijn gebruik, HbA1c > 7,0%, minder dan 10 jaar aanwezig) in de leeftijd van 25 tot 60 jaar met een BMI van 28 tot en met 35 kg/m2 werden geïncludeerd. Patiënten die eerder metabole of complexe abdominale chirurgie hadden ondergaan, werden geëxcludeerd, even als patiënten met niet goed onder controle zijnde medische problemen of een C-peptide < 0,8 ng/mL. De groepen waren vergelijkbaar qua patiëntkarakteristieken.
De studie van Tang (2016) vergeleek Roux-en-Y gastric bypass (n=38) met sleeve gastrectomie (n=34) met een follow-up van 2 jaar. Patiënten van 65 en jonger werden geïncludeerd als een BMI van 28 kg/m2 of hoger hadden, 15 jaar of korter gediagnosticeerd waren met diabetes mellitus type 2. De gemiddelde BMI was 37,8 kg/m2 in de Roux-en-Y gastric bypass-groep en 38,4 kg/m2 in de laparoscopische sleeve gastrectomie groep.
De studie van Schauer (2017) vergeleek drie groepen met elkaar: laparoscopische Roux-en-Y gastric bypass (n=50) met intensieve medische therapie versus. een laparoscopische sleeve gastrectomie (n=50) met intensieve medische therapie versus. alleen intensieve medische therapie (IMT) (n=50) (lifestyle counseling, gewichtsmanagement, frequente thuismeting van glucose, gebruik van nieuwe beschikbare medicijnen). Patiënten in de leeftijd van 20 tot 60 jaar met een BMI van 27 tot 43 kg/m2 en een HbA1c waarde van > 7,0% werden geïncludeerd. Patiënten met een geschiedenis van metabole of complexe abdominale chirurgie of met niet goed gecontroleerde medische of psychiatrische aandoeningen werden geëxcludeerd. De groepen waren vergelijkbaar qua patiëntkarakteristieken.
De studie van Salminen (2018) vergeleek laparoscopische Roux-en-Y gastric bypass (n=119) met een laparoscopische sleeve gastrectomie (n=121). Patiënten tussen de 18 en 60 jaar oud werden geïncludeerd als ze een BMI > 40 kg/m2 hadden of > 35 kg/m2 met een aan obesitas gerelateerde co-morbiditeit en conservatieve behandeling niet had geholpen. Er werden subgroepanalyses gedaan bij patiënten met type 2-diabetes, van deze patiënten kregen 49 patiënten een Roux-en-Y gastric bypass en 52 patiënten een sleeve gastrectomie. De patiëntkarakteristieken werden niet apart gerapporteerd voor patiënten met type 2-diabetes.
In de forest plots zijn studies met een BMI van 25 tot 35 kg/m2 samengevoegd, met een follow-up van 3 tot 5 jaar (Lee, 2014: 5 jaar follow-up; Yang, 2015: 3 jaar follow-up). De andere subgroep betreft de studies met een BMI > 35 kg/m2 en uitkomsten na één jaar (Casajoana, 2017; Keidar, 2013, Murphy, 2018 en Salinen, 2018). De gastric bypass techniek werd vergeleken met de sleeve gastrectomie. De studie van Schauer (2017) (follow-up van 5 jaar) werd apart beschreven omdat deze niet binnen de BMI-subgroepen pasten (BMI 27 tot 43 kg/m2). Ook de resultaten van Tang (2016) zijn niet samengevoegd, omdat deze studie een follow-up van 2 jaar had en patiënten met een BMI vanaf 28 kg/m2 includeerde. De resultaten van de GCP-chirurgie van de studie van Casajoana (2018) werden ook apart beschreven.
Resultaten
Uitkomstmaat 1. Diabetes remissie: < 6,0% HbA1c zonder medicatiegebruik (belangrijk)
De subgroepen lieten beide een verschil zien in het voordeel van de gastric bypass, waar meer remissie van diabetes werd gevonden (figuur 1). Gastric bypass gaf 83% meer kans op diabetesremissie in de BMI 25 tot 35 kg/m2 groep (RR: 1,83; 95%BI 0,37 tot 8,98) ten opzichte van sleeve gastrectomy (resultaten na 3 tot 5 jaar). De subgroep BMI> 35 kg/m2 liet zien dat de gastric bypass een effect gaf op diabetesremissie zien van 18% vergeleken met sleeve gastrectomy (RR: 1,18; 95%BI van 0,89 tot 1,56, resultaten na één jaar).
Salminen (2018) rapporteerde ook de uitkomsten na een follow-up van 5 jaar. In de gastric bypass groep hadden 10 van de 40 (25%) patiënten remissie van diabetes versus 5 van de 41 (12%) patiënten in de sleeve gastrectomy groep.
De studie van Schauer (2017) rapporteerde bij patiënten met een BMI van 27 tot 43 kg/m2 de volgende uitkomsten met een follow-up van vijf jaar: de gastric bypass gaf een risico van 27% (RR 1,27, 95% BI: 0,64 tot 2,56) op diabetesremissie ten opzichte van de sleeve gastrectomy. Deze resultaten zijn in lijn met de resultaten in de forest plot.
In de studie van Tang (2016) hadden 14 patiënten (36,8%) volledige remissie van diabetes in de Roux-en-Y gastric bypass versus 17 patiënten (53,1%) in de laparoscopische sleeve gastrectomie groep (RR: 0,69; 95%BI 0,41 tot 1,18) in het voordeel van laparoscopische sleeve gastrectomie.
De studie van Casajoana (2017) rapporteerde ook de uitkomsten voor de GCP-groep (greater curvature plication): diabetes remissie werd gezien bij 3 van de 15 patiënten in de GCP-groep. Dit was een lager aantal dan de patiënten die een Roux-en-Y gastric bypass of een sleeve gastrectomy hadden.
Figuur 1 Diabetes remissie gebaseerd op het aantal patiënten met een HbA1c van < 6,0% zonder medicatiegebruik. De twee subgroepen werden niet gepoold aangezien de duur van de follow-up verschilde
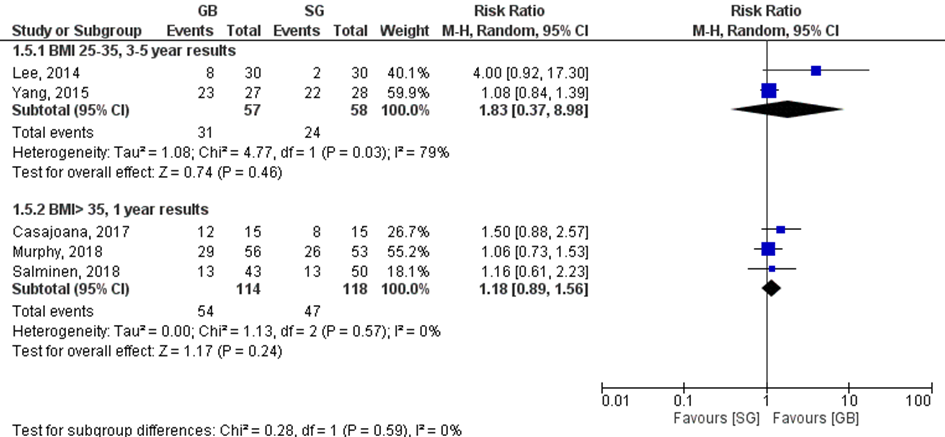
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘diabetesremissie’ was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht is niet verlaagd voor risk of bias ondanks dat niet alle studies geblindeerd zijn (het niet blinderen kan een bias geven vanwege afwijkend beleid in de follow-up, echter achtten wij dit effect te klein om de bewijskracht te verlagen). De bewijskracht werd met één niveau verlaagd voor imprecisie (omdat het betrouwbaarheidsinterval rondom de gepoolde effecten een effect omsluit in beide richtingen; weinig patiënten) en met één niveau vanwege inconsistentie (de resultaten van individuele tonen laten verschillende richtingen zien). Zodoende kwam de bewijskracht uit op laag.
Uitkomstmaat 2. HbA1c waarden (%) (glycated hemoglobin) (cruciaal)
De twee subgroepen (BMI 25 en 35 kg/m2, 3 tot 5 jaar resultaten en BMI > 35 kg/m2 jaar 1-jaars resultaten) lieten beide een effect in het voordeel van de gastric bypass zien (niet significant): een gemiddeld verschil van -0,58% in de lage groep en een verschil van -0,43% in de hoge BMI-groep (figuur 2).
Salminen (2018) berekende de gemiddelde HbA1c-waarden over vijf jaar door middel van repeated measurements ANOVA. Resultaten waren gecorrigeerd voor centrum en preoperatief gebruik van insuline. In beide groepen waren de gemiddelde HbA1c-waarden hetzelfde, namelijk 6,6% (95% BI 6,4 tot 6,8).
Schauer (2017) rapporteerde HbA1c-waarden na vijf jaar in een groep patiënten met een BMI van 27 tot 43 kg/m2: in de gastric bypass-groep: 7,3 ± 1,5; in de sleeve gastrectomy groep: 7,4 ± 1,6 met een gemiddeld verschil van -0,1 (95%BI: -0,72 tot 0,52). Deze uitkomst is in lijn met de uitkomsten in de forest plot.
Tang (2016) rapporteerde HbA1c-waarden na twee jaar in een groep patiënten met een BMI vanaf 28 kg/m2. In de Roux-en-Y gastric bypass waren de gemiddelde HbA1c-waarden 6,4 ± 1,6, in de laparoscopische sleeve gastrectomie groep was dit 6,0 ± 0,6. Dit was een gemiddeld verschil van 0,40 (95% BI -0,15 tot 0,95) in het voordeel van de SG-groep.
De studie van Casajoana (2017) rapporteerde ook de uitkomsten voor de GCP-groep (greater curvature plication): een gemiddelde van 6,61% HbA1c ± 1,3% (SD). Deze uitkomst toont wel overlap met de uitkomsten in de SG-groep en geen overlap met de RYGB-groep van Casajoana (2017).
Figuur 2 Gemiddelde HbA1c waarden in percentages. De twee subgroepen werden niet gepoold aangezien de duur van de follow-up verschilde
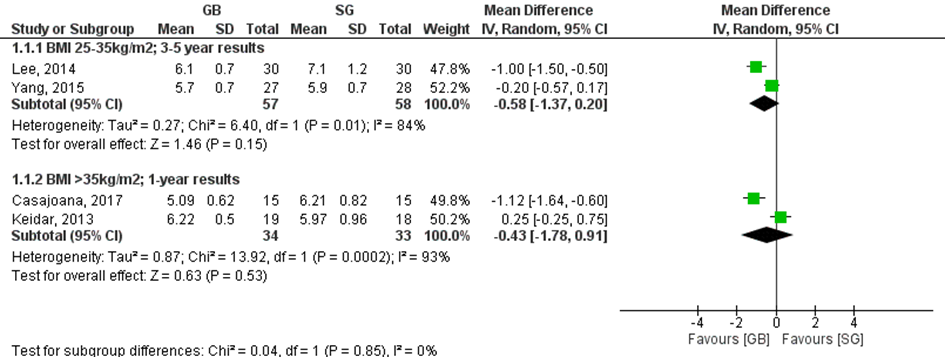
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat HbA1c-waarde was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht voor de uitkomstmaat HbA1c is niet verlaagd voor risk of bias ondanks dat niet alle studies geblindeerd zijn (het niet blinderen kan een bias geven vanwege afwijkend beleid in de follow-up, echter achtten wij dit effect te klein om de bewijskracht te verlagen). De bewijskracht werd met één niveau verlaagd vanwege inconsistentie (tegenstrijdige resultaten en betrouwbaarheidsintervallen van de individuele tonen weinig overlap) en één niveau voor imprecisie (omdat het betrouwbaarheidsinterval rondom de gepoolde effecten een effect omsluit in beide richtingen). Zodoende kwam de bewijskracht uit op laag.
Uitkomstmaat 3. Excess weight loss (belangrijk)
Het verschil in percentage excess weight loss was 10,4% in de lage BMI-groep (3-jaars resultaat: gastric bypass-patiënten hadden een hogere excess weight loss) en 10,9% in de hoge BMI-groep (1-jaar follow-up: gastric bypass-patiënten hadden een hogere excess weight loss) (figuur 3). Salminen (2018) rapporteerde ook het verschil in % excess weight loss na 5 jaar. Dit was 11,7% (95% BI 3,7 tot 19,7) in het voordeel van de gastric bypass.
Tang (2016) rapporteerde een percentage excess weight loss van 53,7% ± 30,1% in de Roux-en-Y gastric bypass groep versus 69,4% ± 36,9% in de laparoscopische sleeve gastrectomie groep. Dit is een gemiddeld verschil van -15,70% (95%BI -31,67 tot 0,27) in het voordeel van de sleeve gastrectomie.
Figuur 3 Percentage excess weight loss. De twee subgroepen werden niet gepoold aangezien de duur van de follow-up verschilde
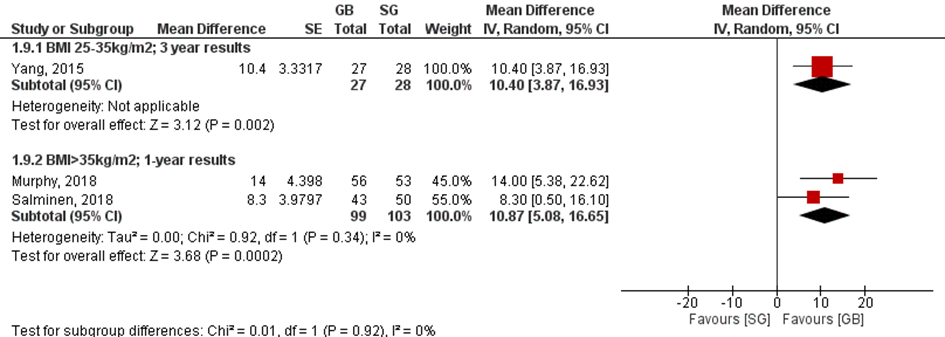
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘excess weight loss’ was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht voor de uitkomstmaat excess weight loss werd verlaagd met één niveau vanwege imprecisie (het geringe aantal patiënten) en met één niveau vanwege inconsistentie (de resultaten van individuele tonen laten verschillende richtingen zien). Zodoende kwam de bewijskracht uit op laag.
Uitkomstmaat 4. Medicijngebruik (belangrijk)
Salminen (2018) rapporteerde afname in medicijngebruik, maar maakt hierbij geen onderscheid tussen orale medicijnen en insuline. Na 1 jaar hadden 16 van de 43 (37,2%) van de patiënten in de gastric bypass-groep een afname van medicatie versus 28 van de 50 (56%) in de sleeve gastrectomy groep. Na 5 jaar was dit respectievelijk 20 van de 40 (50%) en 21 van de 41 (51,2%).
Uitkomstmaat 4. Medicijngebruik - Orale glucose verlagende medicijnen
De lage BMI-groep gaf een RR van 0,32 (95%BI: 0,14 tot 0,74), dit was een klinisch relevant effect in het voordeel van de gastric bypass. De hoge BMI-groep gaf een tegengesteld effect: RR van 2,53 (95%BI van 0,79 tot 8,06) in het voordeel van de sleeve gastrectomie (figuur 4).
De lage BMI-groep gaf een RR van 0,32 (95%BI: 0,14 tot 0,74), dit was een klinisch relevant effect in het voordeel van de gastric bypass.
De hoge BMI-groep gaf een tegengesteld effect: RR van 2,53 (95% BI van 0,79 tot 8,06) in het voordeel van de sleeve gastrectomie.
Figuur 4 Aantal patiënten met orale medicatie ten behoeve van glucoseverlaging. De twee subgroepen werden niet gepoold aangezien de duur van de follow-up verschilde
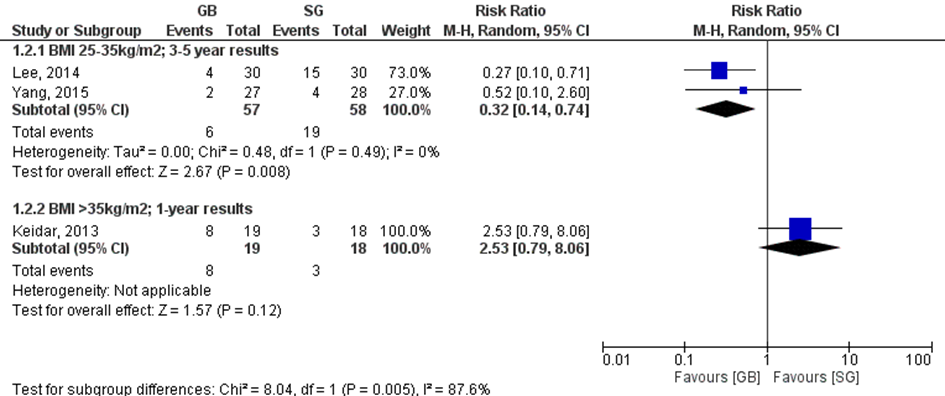
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘orale glucose verlagende medicijnen’ was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht is niet verlaagd voor risk of bias ondanks dat niet alle studies geblindeerd zijn (het niet blinderen kan een bias geven vanwege afwijkend beleid in de follow-up, echter achtten wij dit effect te klein om de bewijskracht te verlagen). De bewijskracht werd met twee niveaus verlaagd voor inconsistentie (gepoolde resultaten geven een tegengesteld effect) en imprecisie (geringe aantal patiënten). Zodoende kwam de bewijskracht uit op laag.
Uitkomstmaat 5. Medicijngebruik - Insulinegebruik (belangrijk)
In de BMI-groep 25 en 35 kg/m2 werd een risicoverschil van 7% (95% BI -17% tot 4%) gevonden in het voordeel van de gastric bypass groep (figuur 5). Dit betekent dat er 7 patiënten minder gebruik van insuline maakten per 100 patiënten na 3 tot 5 jaar follow-up in de gastric bypass-groep vergeleken met de sleeve gastrectomy groep. In de BMI-groep > 35 kg/m2 was het beschermend effect van de gastric bypass 1 % (95% BI -7% tot 5%) ten opzichte van de sleeve gastrectomy. Dit betekent dat er 1 patiënt minder gebruik van insuline maakte per 100 patiënten na 1 jaar follow-up in de gastric bypass-groep vergeleken met de sleeve gastrectomy-groep.
De studie van Schauer (2017) rapporteerde bij patiënten met een BMI van 27 tot 43 kg/m2 de volgende uitkomsten met een follow-up van vijf jaar: RR 1,15 (95% BI 0,38 tot 3,5) in het voordeel van de sleeve gastrectomy groep op het gebruik van insuline (gastric bypass geeft een licht risico op het gebruik van insuline). Dit is tegengesteld aan de forest plot, maar ligt in lijn met de studie van Keida (2013).
Figuur 5 Aantal patiënten die insuline gebruiken. De twee subgroepen werden niet gepoold aangezien de duur van de follow-up verschilde
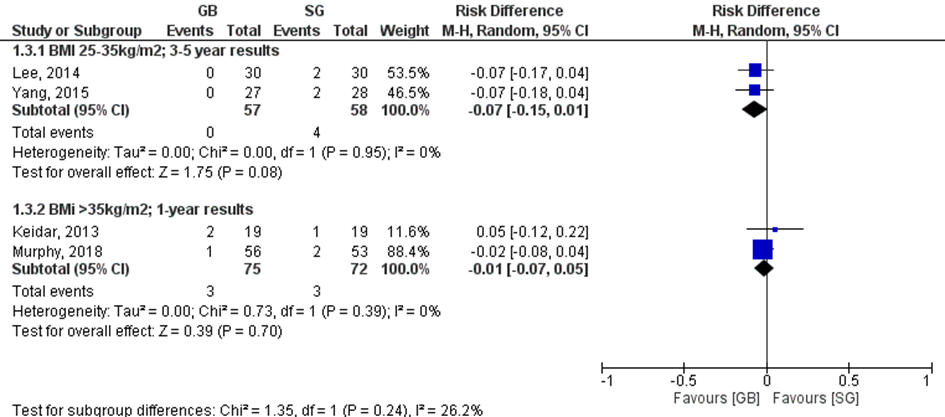
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘insulinegebruik’ was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht is niet verlaagd voor risk of bias ondanks dat niet alle studies geblindeerd zijn (het niet blinderen kan een bias geven vanwege afwijkend beleid in de follow-up, echter achtten wij dit effect te klein om de bewijskracht te verlagen). De bewijskracht werd met één niveau verlaagd voor inconsistentie (puntschatters tegengesteld tussen Keidar (2013) en Schauer (2017) ten opzichte van de andere drie studies) en één niveau voor imprecisie (het betrouwbaarheidsinterval rondom de gepoolde effecten een effect omsluit in beide richtingen). Zodoende kwam de bewijskracht uit op laag.
Uitkomstmaat 6. Cardiovasculaire events (belangrijk)
De studie van Schauer (2017) rapporteerde cardiovasculaire events tot vijf jaar: in de chirurgische groepen werden geen gevallen gerapporteerd. In de SG-groep kwam één geval voor met een beroerte (1/49; 2%).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘cardiovasculaire events’ was afkomstig uit RCT’s en begint zodoende op hoog. De bewijskracht werd verlaagd met twee niveaus voor imprecisie (lage aantal patiënten, lage aantal events). Zodoende kwam de bewijskracht uit op laag.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gewenste effecten van verschillende metabole operatietechnieken bij patiënten met diabetes mellitus type 2 en obesitas?
P: patiënten met diabetes mellitus type 2;
I: metabole chirurgie ((mini) gastric bypass);
C: metabole chirurgie (sleeve gastrectomy, andere varianten behalve gastric banding);
O: HbA1c waarden (glycated haemoglobin); excess weight loss; diabetes remissie (< 6,0% HbAc1 zonder medicatiegebruik); cardiovasculaire risico events; medicijngebruik ten behoeve van diabetes.
Relevante uitkomstmaten
De werkgroep achtte diabetes remissie (< 6,0% HbAc1 zonder medicatiegebruik) voor de besluitvorming een cruciale uitkomstmaat; en HbA1c waarden (glycated haemoglobin), excess weight loss, cardiovasculaire risico events en medicijngebruik ten behoeve van diabetes voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Tenzij anders vermeld (zie hieronder) werden de door de internationale GRADE working group voorgestelde default grenzen gehanteerd voor klinische relevantie: een verschil in relatief risico van 25% bij dichotome uitkomstmaten (RR < 0,75 of > 1,25), een verschil van een halve standaarddeviatie voor continue uitkomstmaten en bij Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). Conform de NICE-richtlijn Type 2-diabetes in adults: management (NICE, 2015) definieerde de werkgroep 5 mmol/mol (0,5%) als een minimaal klinisch relevante verandering in HbA1c.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerd onderzoek en vergelijkende studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. Er is een overkoepelend search gedaan naar verschillende operatietechnieken. Deze literatuurzoekactie leverde 1945 treffers op. Voor de subgroep patiënten met diabetes type 2 werden studies geselecteerd op grond van de volgende selectiecriteria:
- patiënten met diabetes mellitus type 2 als studie-populatie;
- gerandomiseerd onderzoek in het Engels of in het Nederlands;
- minstens een follow-up van één jaar.
Op basis van titel en abstract werden in eerste instantie 28 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 20 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en acht geïncludeerd.
Acht onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Casajoana A, Pujol J, Garcia A, Elvira J, Virgili N, de Oca FJ, Duran X, Fernández-Veledo S, Vendrell J, Vilarrasa N. Predictive Value of Gut Peptides in T2D Remission: Randomized Controlled Trial Comparing Metabolic Gastric Bypass, Sleeve Gastrectomy and Greater Curvature Plication. Obes Surg. 2017 Sep;27(9):2235-2245. doi: 10.1007/s11695-017-2669-7. PubMed PMID: 28451931.
- Homan J, Boerboom A, Aarts E, Dogan K, van Laarhoven C, Janssen I, Berends F. A Longer Biliopancreatic Limb in Roux-en-Y Gastric Bypass Improves Weight Loss in the First Years After Surgery: Results of a Randomized Controlled Trial. Obes Surg. 2018 Dec;28(12):3744-3755. doi: 10.1007/s11695-018-3421-7. PubMed PMID: 30073496.
- Keidar A, Hershkop KJ, Marko L, Schweiger C, Hecht L, Bartov N, Kedar A, Weiss R. Roux-en-Y gastric bypass versus sleeve gastrectomy for obese patients with type 2 diabetes: a randomised trial. Diabetologia. 2013 Sep;56(9):1914-8. doi: 10.1007/s00125-013-2965-2. Epub 2013 Jun 14. PubMed PMID: 23765186.
- Lee WJ, Chong K, Lin YH, Wei JH, Chen SC. Laparoscopic sleeve gastrectomy versus single anastomosis (mini-) gastric bypass for the treatment of type 2 diabetes mellitus: 5-year results of a randomized trial and study of incretin effect. Obes Surg. 2014 Sep;24(9):1552-62. doi: 10.1007/s11695-014-1344-5. PubMed PMID: 24965545.
- Murphy R, Clarke MG, Evennett NJ, John Robinson S, Lee Humphreys M, Hammodat H, Jones B, Kim DD, Cutfield R, Johnson MH, Plank LD, Booth MWC. Laparoscopic Sleeve Gastrectomy Versus Banded Roux-en-Y Gastric Bypass for Diabetes and Obesity: a Prospective Randomised Double-Blind Trial. Obes Surg. 2018 Feb;28(2):293-302. doi: 10.1007/s11695-017-2872-6. PubMed PMID: 28840525.
- NICE. National Institute for Health and Care Excellence. NICE guidelines (NG28). Type 2 diabetes in adults: management. 2015. Link: https://www.nice.org.uk/guidance/ng28.
- Salminen P, Helmiö M, Ovaska J, Juuti A, Leivonen M, Peromaa-Haavisto P, Hurme S, Soinio M, Nuutila P, Victorzon M. Effect of Laparoscopic Sleeve Gastrectomy versus Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss at 5 Years Among Patients With Morbid Obesity: The SLEEVEPASS Randomized Clinical Trial. JAMA. 2018 Jan 16;319(3):241-254. doi: 10.1001/jama.2017.20313. PubMed PMID: 29340676; PubMed Central PMCID: PMC5833550.
- Schauer PR, Bhatt DL, Kirwan JP, Wolski K, Aminian A, Brethauer SA, Navaneethan SD, Singh RP, Pothier CE, Nissen SE, Kashyap SR; STAMPEDE Investigators. Bariatric Surgery versus Intensive Medical Therapy for Diabetes - 5-Year Outcomes. N Engl J Med. 2017 Feb 16;376(7):641-651. doi: 10.1056/NEJMoa1600869. PubMed PMID: 28199805; PubMed Central PMCID: PMC5451258.
- Yang J, Wang C, Cao G, Yang W, Yu S, Zhai H, Pan Y. Long-term effects of laparoscopic sleeve gastrectomy versus roux-en-Y gastric bypass for the treatment of Chinese type 2 diabetes mellitus patients with body mass index 28-35 kg/m(2). BMC Surg. 2015 Jul 22;15:88. doi: 10.1186/s12893-015-0074-5. PubMed PMID: 26198306; PubMed Central PMCID: PMC4509558.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy – otherwise the evidence table for studies of diagnostic test accuracy should be used.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Casajoana, 2017 |
Type of study: Non-blinded RCT
Setting: Single Centre, university hospital
Country: Spain
Source of funding: non-commercial funding |
Inclusion criteria: age between 18 and 60 years, BMI 35–43 kg/m2, T2D on hypoglycemic agents alone, insulin or both. Exclusion criteria: type 1 diabetes or positivity for GAD autoantibodies, secondary forms of diabetes, acute metabolic complications, liver disease, renal dysfunction or patients under anticoagulant treatment, previous bariatric surgery, congenital or acquired abnormalities of the digestive tract, pregnancy, nursing or desired pregnancy in the 12 months following inclusion, and corticoid use by oral or intravenous route for more than 14 consecutive days in the last 3 months.
N total at baseline: GB: 15 SG: 15 GCP: 15
Important prognostic factors2: age ± SD: GB: 51.10 (7.7) SG: 49.2 (9.16) GCP: 49.7 (8.12)
Sex (male/female) GB: 7/8 SG: 5/10 GCP: 3/12
See table 1 of Casajoana, 2017
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Metabolic Roux-en-Y gastric bypass (mRYGB): a 100-mL gastric pouch is created along with a 200-cm biliopancreatic limb and an alimentary limb of 100 cm.
|
Describe control (treatment/procedure/test):
Sleeve gastrectomy (SG) SG is a restrictive technique consisting of a gastric volume reduction of 75–80% by resecting the stomach over a 36-French catheter beginning 4 cm from the pylorus and ending at the angle of His.
Greater curvature plication (GCP): GCP is a reversible restrictive technique with no stomach resection, in which an invagination of the greater gastric curvature is performed with two running non-absorbable sutures, calibrated over a 36-French catheter. |
Length of follow-up: 1 year
Loss-to-follow-up: mRYGB-group: none
SG-group N (%) 1 (6,7%) Reasons (describe): withdrew after 10 months
GCP: none
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Glycated haemoglobin: HbA1c mean % (SD) (1-year results) I: 5.09 (0.63); n=15 C: 6.21 (0.82) n=15 Mean difference: -1.12 (95%CI: -1.64 to-0.6) favouring gastric bypass (significant)
GCP: 6.61% (1.3%); n=15
Diabetic remission: <6.0% HbA1c without medication use (1-year results) I: 12/15 C: 8/15 RR: 1.5 (95%CI: 0.88 to 2.57) favouring gastric bypass (not significant)
GCP: 3/15 patients
|
Recruitment period: May 2012 to February 2014
BMI 35-43
Allocation of patients was assigned by simple randomization with stratification according to baseline levels of HbA1c (greater or lower/ equal to 7%)
|
|
Keidar, 2013 |
Type of study: Non-blinded RCT
Setting: Single centre
Country: Israel
Source of funding: This study was partly funded by research grants from the Israel Ministry of Health Chief Scientist, the Stephen Morse Diabetes Research Foundation and Johnson & Johnson |
Inclusion criteria: patients with diabetes included BMI greater than 35 kg/m2, age 18 to 65 years and diagnosis of type 2 diabetes based on an OGTT performed at baseline with medication discontinued
Exclusion criteria: prior gastrointestinal surgery
N total at baseline: Intervention: 19 Control: 18
Important prognostic factors2: For example age ± SD: I:51.45 (8.3) C:47.7 )11.7)
Sex: I: % M C: % M
See table 1 of Keidar, 2013
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
RYGB
|
Describe control (treatment/procedure/test):
Sleeve gastrectomy |
Length of follow-up: 1 year
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Glycated haemoglobin: HbA1c mean % (SD) at 12 months I: 6.22 (0.5); n=19 C: 5,97 (0.96); n=18 Mean difference: 0.25 (95%CI -0.25 to 0.75) favouring sleeve gastrectomy (not significant)
Medication (number of patients) – 1-year results Oral I: 8/19 C: 3/18 RR: 2.53 (95%CI 0.79 to 8.06) favouring sleeve gastrectomy (not significant)
Insulin I: 2/19 C: 1/19 RR: 2.0 (95%CI: 0.2 to 20.24) Favouring sleeve gastrectomy (not significant)
Diet |
Recruitment period: June 2008 to February 2010
BMI > 35kg/m2
For pooled data, check the ‘onderbouwing literatuur’
‘’ Performance of the OGTT at 3 and 12 months of follow-up was a significant challenge for participants due to the need to drink a 250 ml glucose solution. Of the patients undergoing RYGB, 12 experienced vomiting within minutes of ingestion (eight at 3 months, four at 12 months); ten of the participants who underwent SG experienced the same problem (seven at 3 months, three at 12 months). Thus the analyses presented at each follow-up point are only for participants who consumed the whole glucose load (at 3 months 12 and 11 for RYGB and SG, respectively; at 12 months 16 and 15 for RYGB and SG, respectively).’’ |
|
Lee, 2014 |
Type of study: Double blind RCT
Setting: Single centre, general hospital
Country: Taiwan
Source of funding: research grants |
Inclusion criteria: 30 to 60 years old, had been receiving treatment for T2DM for at least 6 months before recruitment, had a haemoglobin A1c (HbA1c) level higher than 7.5 %, and had a serum C-peptide level higher than 1.0 ng/mL. The participants had a BMI of 25.1 to 34.9 Kg/m2 and were willing to accept randomization to either surgical group and follow the full treatment Exclusion criteria:
N total at baseline: Intervention: 30 Control: 30
Important prognostic factors2: For example age ± SD: I:44.6 (8.6) C: 46.4 (8.1)
Sex: I: 73.3% F C: 68.8% F
See table 1 of Lee, 2014
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Laparoscopic single anastomosis (mini-) gastric bypass (SAGB)
Through a standard 5-port laparoscopic technique, a long-sleeved gastric tube was created by the EndoGIA stapler (Tyco, United States Surgical Corporation, Norwalk, CT, USA) approximately 2.0-cm wide along the lesser curvature from the antrum to the angle of His. A Billroth II type loop single gastroenterostomy was created with the small bowel about 120 cm distal to the ligament of Treitz, using the EndoGIA stapler. |
Describe control (treatment/procedure/test):
Laparoscopic sleeve gastrectomy
A vertical gastrectomy was performed by resecting the greater curvature from the distal antrum (4 cm proximal to the pylorus) to the angle of His including the complete fundus, using a 28 Fr size gastroendoscopy as a calibration tube. The remnant stomach tube was approximately 2-cm wide along the lesser curvature. The resected portion of the stomach was extracted from the extended periumbilical trocar site. A running absorbable seromuscular suture was applied to the staple line with calibration tube in the side to prevent hemorrhage and leakage. |
Length of follow-up: 5 years
Loss-to-follow-up: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Glycated haemoglobin: HbA1c mean % (SD) at 5 years I: 6,1 (0,7) n=30 C: 7,1 (1,2) n=30 Mean difference: -1.00 (95%CI: -1.5 to -0.5) favouring gastric bypass (significant)
Diabetic remission: <6.0% HbA1c without medication use (5-year results) I: 8/30 C: 2/30 Risk ratio: 4.00 (95%CI: 0.92 to 17.30) favouring gastric bypass (significant)
Medication (number of patients) – 5-year results Oral I: 4/30 C: 15/30 RR: 0.27 (95%CI: 0.10 to 0.71) favouring gastric bypass (significant) Insulin I: 0/30 C: 2/30 RR: 0.2 (95%CI: 0.01 to 4.00) favouring gastric bypass (not significant)
Anithypertensive agents I: 4/30 C: 11/30 RR: 0.36 ( 0.13 to 1.01) favouring gastric bypass, not significant
Lipid lowering agents: I: 2/30 C: 11/30 RR: 0.18 (0.04 to 0.75) favouring gastric bypass, significant |
Recruitment between September 2007 and June, 2008
BMI 25-35 |
|
Murphy, 2018 |
Type of study: Double blind randomised trial
Setting: Single centre
Country: New Zealand
Source of funding: partly non-commercial, partly commercial (Johnson and Johnson; Covidien; Obex). ‘’The study sponsors had no role in the study design, analysis or interpretation of the data, or the manuscript preparation.
|
Inclusion criteria: participants aged 20–55 years, BMI of 35 to 65 kg/m2, T2D diagnosed for at least 6 months, suitable for either surgical procedure and committed to follow up
Exclusion criteria: postprandial C peptide < 350 pmol/L, pregnancy, type 1 diabetes or secondary diabetes, chronic pancreatitis, oral steroid therapy, current smokers and those not suitable for general anaesthesia.
N total at baseline: Intervention: 58 Control: 56
Important prognostic factors2: For example Mean age ± SD: I:46.6 ± 6.7 C:45.5 ± 6.4
Sex: I: 59% F C: 45% F
See table 1 of Murphy, 2018
Groups comparable at baseline? Yes
|
Describe intervention:
Silastic ring laparoscopic Roux-en-Y gastric bypass (SR-LRYGB) SR-LRYGB consisted of a vertical lesser curvebased 20–30 ml gastric pouch, a 100-cm antecolic antegastric Roux limb, a 50-cm biliopancreatic limb, with a 6.5- or 7-cm silastic ring placed around the gastric pouch, approximately 2 cm above the gastrojejunal anastomosis. Mesenteric defects were closed routinely
|
Describe control:
Laparoscopic sleeve gastrectomy (LSG) LSG consisted of gastric resection using an Echelon flex 45 stapler (Ethicon) alongside a 36Fr orogastric bougie, commencing 2 cm from the pylorus. Methylene blue dye leak test was performed irrespective of procedure and port placements were identical for both procedures |
Length of follow-up: 1-year (5-year follow-up not yet available).
Loss-to-follow-up: Intervention: 5 N (%): 8.6% Reasons (describe) – unable to contact
Control: 0 N (%) - Reasons (describe) -
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Diabetic remission: <6.0% HbA1c without medication use, 1-year results GB: 29.56 SG: 26/53 RR: 1.06 (95%CI: 0.73 to 1.53) favouring gastric bypass (not significant)
% Excess weight loss (mean difference ± SD) GB: 84.2 ± 26.2 (n=56) SG: 70.2 ± 19.4 (n=53) Mean difference: 14.00 (5.38 to 22.62) favouring gastric bypass (significant)
Insulin usage (no/total) – 1 year GB: 1/56 SG: 2/53 RR: 0.47 (0.04 to 5.07) favouring gastric bypass (not significant)
Antihypertensive agents – 1 year GB: 10/56 SG: 12/53 RR: 0.79 (95%CI: 0.37 to 1.67) favouring gastric bypass (not significant)
Lipid lowering agents – 1 year I: 5/56 C: 9/53 RR: 0.53 (0.19 to 1.47) favouring gastric bypass (not significant) |
Recruitment period: Octoboer 2011 to October 2015
BMI 35 – 65
|
|
Schauer, 2017 |
Type of study: Non-blinded RCT
Setting: Single centre
Country: USA
Source of funding: partly commercial (Ethicon Endo surgery); partly non commercial |
Inclusion criteria: age 20 to 60 years, a diagnosis of type 2 diabetes (glycated hemoglobin level, >7.0%), and a BMI of 27 to 43
Exclusion criteria: undergone previous bariatric surgery or other complex abdominal surgery or had poorly controlled medical or psychiatric disorders
N total at baseline: Medical therapy: 38 Gastric bypass: 49 Sleeve gastrectomy: 47
Important prognostic factors2: For example age ± SD: GB: 48.2 ± 8.5 SG: 48.1 ± 8.1 IMT: 50.2 ± 7.7 P=0.41
Duration of diabetes – years ±SD GB: 8.2 ± 5.6 SG: 8.3 ± 4.6 IMT: 8.8 ± 5.5 P=0.41
Sex, no (%) Female GB: 28 (57.1) SG: 36 (76.6) IMT: 25 (65.8) P=0.13
Smoker – no (%) GB: 19 (38.8%) SG; 10 (21.3%) IMT: 12 (31.6) P=0.17
BMI – kg/m2 ± SD; GB: 37 ± 3.4 SG: 36 ± 3.9 IMT: 36.4 ± 3.0 P=0.33
Groups comparable at baseline? Yes |
Describe intervention
Laparoscopic gastric bypass (GB): Bariatric procedures were performed laparoscopically by a single surgeon with the use of instruments provided by Ethicon Endo-Surgery. Gastric bypass consisted of the creation of a 15-to-20-ml gastric pouch, a 150-cm Roux limb, and a 50-cm biliopancreatic limb.
|
Describe control (treatment/procedure/test):
Laparoscopic sleeve gastrectomy (SG) involved a gastric-volume reduction of 75 to 80% by resecting the stomach alongside a 30-French endoscope beginning 3 cm from the pylorus and ending at the angle of His
All patients received intensive medical therapy (IMT), as defined by American Diabetes Association (ADA) guidelines, including lifestyle counseling, weight management, frequent home glucose monitoring, and the use of newer drug therapies (e.g., incretin analogues) approved by the Food and Drug Administration (FDA). |
Length of follow-up: 5 year
Loss-to-follow-up: 6 patients (4%) (not specified per intervention)
Incomplete outcome data: 11 % (n=16) incomplete. Multiple imputation procedure was used to impute the missing data.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Mortality: 1 patient died in the medical-therapy group
HbA1c of <6.0% without medication based on mean value imputation (5-year results) GB: 14/50 SG: 11/50 RR: 1.27 (95%CI 0.64 to 2.56) IMT: 3/50
Glycated hemoglobin level - % Mean ± SD GB: 7,3 ± 1,5 SG: 7,4 ± 1,6 Mean difference: -0,1 (95%CI: -0,72 to 0,52).
IMT: 8.5 ± 2.2
Insulin use no/total (5-year results) GB: 6/49 SG: 5/47 RR: 1.15 (95%CI: 0.38 to 3.5) IMT: 20/38 patients (significant higher than GG/SG)
Use of lipid lowering agents no/total (5-year results) GB: 19/49 SG: 26/47 RR: 0.7 (95%CI: 0.45 to 1.08) IMT: 27/38 (significant higher than GB/SG)
|
BMI 27-43
Recruitment period: March 2007 through January 2011
|
|
Yang, 2015 |
Type of study: RCT
Setting: Single centre
Country: China
Source of funding: none reported |
Inclusion criteria: diagnosis of poorly controlled T2DM after 6 months medicine therapy (glycated hemoglobin A1c (HbA1c) level ≥7.0 %); measured BMI of ≥28 and ≤ 35 kg/m2; aged 25 to 60 years old; diabetes duration of less than ten years
Exclusion criteria: patients were excluded if they had undergone previous bariatric surgery or other complex abdominal surgery or if they had poorly controlled medical problems. Patients were also excluded if they had C-peptide levels below 0.8 ng/ml
N total at baseline: Intervention: 32 Control: 32
Important prognostic factors2: For example age ± SD: I: 41.4 ± 9.3 C: 40.4 ± 9.4
Sex: I: 19 (59.4%) female C: 23 (71.9%) female
Groups comparable at baseline? Yes |
Describe intervention:
RYGB
5 trocars were used. The volume of gastric pouch was approximate 10-20 ml. The length of the biliopancreatic limb was 25 cm, and the Roux limb was 125 cm. The anastomotic stoma between stomach and jejunum was 1.5 cm and 6 cm between jejuna
|
Describe control:
Sleeve Gastrectomy (SG)
Four trocars were placed and 38 Fr. Bougie was used to calibrate the sleeve. The greater curvature was cut out 4 cm from the pylorus using a linear stapler towards His angle to completely remove the fundus of the stomach. The remnant gastric cutting edge was 2 cm from the lesser curvature of stomach. Then, the cutting edge was continuously sutured with 3-0 absorbable sutures, which are good for hemostasis
|
Length of follow-up: 3 years
Loss-to-follow-up: Intervention: N (%) 5 (15.5%) Reasons not described
Control: N (%) 4 (12.5%) Reasons not described
Incomplete outcome data: Intervention: N (%) Reasons (describe)
Control: N (%) Reasons (describe)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Glycated haemoglobin: HbA1c mean % (SD) at 3 years: I: 5.7 (0.7) n=27 C: 5.9 (0.7) n=28 Mean difference: -0.2 (95%CI: -0.57 to 0.17) favouring gastric bypass (not significant)
Diabetic remission: <6.0% HbA1c without medication use, 3-year results I: 23/27 C: 22/28 RR: 1.08 (0.94 to 1.39) favouring gastric bypass, not significant
%EWL – 3-year results, mean (SD) I:92.3 ± 10.5 (n=27) C: 81.9 ± 14 (n=28) Mean difference: 10.4 (95%CI: 3.87 to 16.93) favouring gastric bypass (significant)
Medication (number of patients) – 3-year results Oral I: 2/27 C: 4/28 RR: 0.52 (95%CI: 0.10 to 2.6) favouring gastric bypass (not significant)
Insulin I: 0/27 C: 2/28 RR: 0.21 (95%CI: 0.01 to 4.13) favouring gastric bypass (not significant)
Antihypertensive agents I: 3/27 C; 5/28 RR: 0.62 (95%CI: 0.16 to 2.35) favouring gastric bypass, not significant
Lipid lowering agents I: 1/27 C: 3/28 RR; 0.22 (95%CI: 0.04 to 3.12) favouring gastric bypass (not significant) |
BMI 28-35 kg/m2
Trial period: July 1, 2009 through July 30, 2014 |
|
Tang, 2016 |
Type of study: RCT
Setting: Single centre
Country: China
Source of funding: Beijing Municipal Administration of Hospitals Special Fund to Support the Development of Clinical Medicine (grant no.Z131107002213168)
|
Inclusion criteria: the patients ages ≤65 years; BMI≥28 kg/m2; duration of T2D2≤15 years, in accordance with the ADA definition for T2DM: fasting plasma glucose (FPG) 7.0 mmol/L or greater, diagnosis, or use of a glucose lowering drug; and ability to understand and comply with the study protocol.
Exclusion criteria: -
N total at baseline: Intervention: 40 Control: 40
Important prognostic factors2: age ± SD: I: 40.4 (12.3) C: 36.6 (8.0)
Sex: I: 52.6 % M C: 35.3% M
Groups comparable at baseline? Yes |
Describe intervention:
laparoscopic Roux-en-Y gastric bypass |
Describe control:
laparoscopic sleeve gastrectomy |
Length of follow-up: 2 years
Loss-to-follow-up: Intervention: 2 (5%)
Control: 6 (15%)
Reasons: Patients did not have time to complete a follow-up Follow-up examination was too expensive Some patients considered bariatric surgery to be plastic surgery, so they were less amenable to the procedure.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Glycated haemoglobin: HbA1c mean % (SD) at 2 years: I: 6.4 (1.6) C: 6.0 (0.6)
Complete remission defined as the standard of HbA1c<6.0% and FPG<5.6 mmol/L without glucose-lowering drugs: I: 14 (36.8%) C: 17 (50%)
%EWL – 2-year results, mean (SD) I: 53.7 (30.1) C: 69.4 (36.9) |
|
|
Salminen, 2018 |
Type of study: RCT
Setting: Multicentre
Country: Finland
Source of funding: The SLEEVEPASS trial was supported by the Mary and Georg C. Ehrnrooth Foundation (Dr Salminen), by a government research grant from the EVO Foundation awarded to Turku University Hospital (Dr Salminen, Dr Helmiö), and by the Gastroenterological Research Foundation (Dr Helmiö).
Dr Salminen reported receiving personal fees for lectures from Merck and Lilly. No other authors reported disclosures.
|
Inclusion criteria: Age 18 to 60 years, BMI greater than 40 or greater than 35 with a significant obesity-associated comorbidity, and previous failed adequate conservative treatment.
Exclusion criteria: BMI greater than 60, significant psychiatric or eating disorder, active alcohol or substance abuse, active gastric ulcer disease, severe gastroesophageal reflux with a large hiatal hernia, and previous bariatric surgery.
N total at baseline: (subgroup diabetes) Intervention: 52 Control: 49
Important prognostic factors2: Not described for subgroup diabetes, overall characteristics are reported.
age ± SD: I: 48.4 (9.3) C: 48.5 (9.6)
Sex: I: 32.8 % M C: 28.1% M
Groups comparable at baseline? Yes
|
Describe intervention:
laparoscopic Roux-en-Y gastric bypass |
Describe control:
laparoscopic sleeve gastrectomy |
Length of follow-up: 5 years
Loss-to-follow-up: Not described for subgroup diabetes, overall loss-to-follow-up reported. Intervention: 24 (20%) 4 Lost to follow-up 1 Death unrelated to intervention
Control: 23 (19%) 3 Converted to SADI (inadequate weight loss)b 2 Converted to laparoscopic Roux-en-Y gastric bypass (developed GERD) 9 Lost to follow-up 1 Death unrelated to intervention
|
Outcome measures and effect size (include 95%CI and p-value if available):
%EWL 1-year results, mean difference between procedures (95% CI): 8.3 (0.5 to 16.1) Favouring gastric bypass
5-year results, mean difference between procedures (95% CI): 11.7 (3.7 to 19.7) Favouring gastric bypass
Fasting glucose, mmol/L, mean (95% CI)1 1 year I: 5.9 (5.6 to 6.3) C: 6.4 (6.0 to 6.7)
5 year I: 6.7 (6.1 to 7.3) C: 7.5 (6.9 to 8.2)
Complete diabetes remission 1 year2 I: 10 of the 43 (23.3%) C: 9 of the 50 (18%)
5 years I: 10 of the 40 (25%) C: 5 of the 41 (12.2%)
HbA1c, mean I: 6.6% (95%CI, 6.4%-6.8%) C: 6.6% (95%CI, 6.4%-6.8%)
Reduction in medication 1 year I: 16/43 (37.2) C: 28/50 (56.0)
5 years I: 20/40 (50.0) C: 21/41 (51.2)
1Repeated-measurements ANOVA; logarithmic transformation was used in the analyses, and results are transformed back to original scale. Results are adjusted for center and preoperative use of insulin.
2Glycated hemoglobin value less than 6.0% 42 mmol/mol) and fasting plasma glucose level less than 100mg/dL (5.6 mmol/L) for at least 1 year’s duration in the absence of active pharmacologic therapy or ongoing procedures. |
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias assessment
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/ unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/ unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/ unclear) |
|
Murphy, 2018 |
Computer-generated random number codes (Minim, London) managed by an independent study member were used to randomise participants 1:1 to either LSG or SR-LRYGB, stratified by age category (20–29, 30–39 or 40–55), BMI category (35–44.9, 45–54.9 and 55–65 kg/m2), ethnicity (Maori, Pacific, NZ European/other), duration of diabetes diagnosis (<5, 5–10 and >10 years) and the presence of insulin therapy. |
Unlikely |
Unlikely |
Only operating surgical team was not blinded |
Unlikely |
Unlikely (all outcomes in protocol were reported) |
Likely |
Unlikely |
|
Casajoana, 2017 |
The randomization process was performed by the statistics department of our hospital using a computer software program that generated the random sequence. Allocation of patients was assigned by simple randomization with stratification according to baseline levels of HbA1c (greater or lower/equal to 7%). |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Lee, 2014 |
The randomization assignment was double-blinded until 1 month after surgery. The randomization schedule used permuted blocks for every ten patients. |
Unlikely |
Likely, blinding until 1 month after surgery |
Likely, blinding until 1 month after surgery |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Keidar, 2013 |
Randomisation was performed using online randomisation software (www.researchrandomizer.com, last accessed on 18 Feb 2010). |
Likely |
Likely, patients knew which procedure they were to undergo |
Likely, no blinding |
Likely, no blinding |
Unlikely |
Unlikely |
Unlikely |
|
Yang, 2015 |
Computer generated block schedule |
Likely, no blinding |
Likely, patients knew which procedure they were to undergo |
Likely, no blinding |
Likely, no blinding |
Unlikely |
Unclear, no reasons described |
Unlikely |
|
Schauer, 2017 |
block-randomization method with a 1:1:1 ratio with straticification according to baseline use of insulin. |
Likely, no blinding |
Likely, no blinding |
Likely, no blinding |
Likely, no blinding |
Unlikely |
Unlikely |
Unlikely |
|
Tang, 2016 |
Not described |
Unclear |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Salminen 2018 |
Patients were randomized by a closed-envelope method to undergo either laparoscopic sleeve gastrectomy or laparoscopic Roux-en-Y gastric bypass. Randomization was performed with a 1:1 equal allocation ratio. The opaque, sealed, and sequentially numbered randomization envelopes were shuffled and then distributed to each participating hospital. To randomize an eligible patient after the clinical decision of proceeding to bariatric surgery for treating morbid obesity, the surgeon opened a sealed envelope containing the information of the assigned randomization group. All of the treating surgeons were part of the study team. |
Unlikely |
Likely, open label |
Likely, open label |
Likely, open label |
Unlikely |
Unlikely |
Unlikely, sensitivity analyses performed with multivariate imputation |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Maghrabi, 2013 |
Abstract |
|
Acquafresca, 2015 |
Artikel in Spaans |
|
Campos, 2013 |
Artikel in Spaans |
|
Cho, 2015 |
geen systematische search verricht |
|
Li JF, 2013 |
Geen systematische search verricht |
|
Li, P, 2013 |
Niet 100% diabetespatiënten in studiepopulatie |
|
Osland, 2017 |
Includeert niet 100% diabetespatiënten bij studieselectie |
|
Panunzi, 2015 |
Voldoet niet aan PICO: vergelijking tussen twee BMI-groepen in plaats van chirurgie |
|
Kashayp, 2013 |
Gebruikt een dataset van de populatie Schauer, 2017 |
|
Wang, 2013 |
Studies uit deze review geïncludeerd als losse studies m.u.v. Li, 2018 (want uitkomstmaat van max. 6 maanden) |
|
Yip, 2013 |
Search tot 2012, niet recent |
|
Yu, 2015 |
Losse RCT’s uit deze review geïncludeerd |
|
Lee, 2011 |
Trial, waarvan Lee, 2014 langere termijn uitkomsten rapporteert |
|
Maghrabi, 2015 |
2-jaars resultaten STAMPEDE trial, waarvan Schauer, 2017 langere termijn uitkomsten rapporteert |
|
Schauer, 2014 |
3-jaars resultaten STAMPEDE trial, waarvan Schauer, 2017 langere termijn uitkomsten rapporteert |
|
Schauer, 2012 |
1-jaar resultaten STAMPEDE trial waarvan Schauer, 2017 langere termijn uitkomsten rapporteert |
|
Maleckas, 2016 |
Conference abstract |
|
Malin, 2014a |
Secundaire analyse van rct-resultaat, niet de juiste uitkomsten |
|
Malin, 2014b |
Niet de juiste uitkomsten |
|
Rao, 2015 |
Systematische review waarbij ook niet-vergelijkende studies zijn meegenomen, individuele RCT’s zijn geïncludeerd |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2020
Beoordeeld op geldigheid : 28-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Operatietechniek bij patiënten met diabetes mellitus type 2 |
NVvH |
2020 |
2025 |
1x per 5 jaar |
NVvH |
Publicatie van nieuwe studies over dit onderwerp. |
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
|
Uitgangsvraag: Welke operatietechniek is voor welke indicatie geïndiceerd?
Algemeen: P: mensen die in aanmerking komen voor metabole chirurgie I: gastric bypass C: gastric sleeve O: beter resultaat, etc.
Subgroepen: P: vrouwen met een kinderwens P: kinderen P: ouderen P: reflux P: diabetes P: overige |
|
|
Database(s): PubMed |
Datum: 25-6-2018 |
|
Periode: geen restrictie, voor 2000 slechts 10 referenties meer in PubMed, zie #16 en #29 |
Talen: geen restrictie |
|
Opmerking: Op verzoek is deze vraag behandeld als 1 uitgangsvraag met een aantal subgroepen. In de uitwerking is onderscheid gemaakt tussen de verschillende subgroepen en zijn de resultaten van de verschillende groepen ontdubbeld. NB. Als gevolg van het ontdubbelen worden studies waarin meerdere groepen met elkaar worden vergeleken, slechts bij 1 subgroep getoond. Dus, een studie waarin zowel diabetes als reflux wordt genoemd wordt alleen zichtbaar in 1 van de 2 subgroepen en niet bij beide. Daarom zijn bij elke subgroep alle abstracts doorlopen. |
|
PubMed
|
Search |
Query |
Items found |
|
#62 |
#41 AND #44 overig epidemiologisch |
626 |
|
#61 |
#41 AND #43 overig RCT |
223 |
|
#60 |
#41 AND #42 overig SR |
248 |
|
#47 |
#35 AND #44 diabetes epidemiologisch |
514 |
|
#46 |
#35 AND #43 diabetes RCT |
215 |
|
#45 |
#35 AND #42 diabetes SR |
201 |
|
#59 |
#39 AND #44 ouderen epidemiologisch |
229 |
|
#58 |
#39 AND #43 ouderen RCT |
61 |
|
#57 |
#39 AND #42 ouderen SR |
53 |
|
#53 |
#37 AND #44 kinderen epidemiologisch |
168 |
|
#52 |
#37 AND #43 kinderen RCT |
51 |
|
#51 |
#37 AND #42 kinderen SR |
59 |
|
#50 |
#36 AND #44 reflux epidemiologisch |
155 |
|
#49 |
#36 AND #43 reflux RCT |
46 |
|
#48 |
#36 AND #42 reflux SR |
73 |
|
#56 |
#38 AND #44 vrouwen met een kinderwens epidemiologisch |
15 |
|
#55 |
#38 AND #43 vrouwen met een kinderwens RCT |
2 |
|
#54 |
#38 AND #42 vrouwen met een kinderwens SR |
6 |
|
#44 |
(("Epidemiologic Studies"(Mesh) OR "Prognosis"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) OR follow up(tiab) OR followup(tiab) OR prognos*(tiab))) |
6426112 |
|
#43 |
(("Randomized Controlled Trial"(Publication Type) OR "Controlled Clinical Trial"(Publication Type) OR random*(tiab) OR placebo(tiab) OR "Drug Therapy"(Subheading) OR trial(tiab) OR groups(tiab))) |
4468366 |
|
#42 |
(((review(tiab) OR "Review"(Publication Type) OR "Meta-Analysis as Topic"(Mesh) OR meta-analysis(tiab) OR "Meta-Analysis "(Publication Type)) NOT ("Letter"(Publication Type) OR "Editorial"(Publication Type) OR "Comment"(Publication Type)))) |
2921053 |
|
#41 |
#16 NOT #40 |
886 |
|
#40 |
#35 OR #36 OR #37 OR #38 OR #39 |
1011 |
|
#39 |
#16 AND #34 |
245 |
|
#38 |
#16 AND #31 |
18 |
|
#37 |
#16 AND #30 |
199 |
|
#36 |
#16 AND #28 |
189 |
|
#35 |
#16 AND #17 |
645 |
|
#34 |
("Aged"(Mesh) OR "Aged, 80 and over"(Mesh) OR "Frail Elderly"(Mesh) OR "Geriatrics"(Mesh) OR "Geriatric Psychiatry"(Mesh) OR "Geriatric Nursing"(Mesh) OR "Geriatric Dentistry"(Mesh) OR "Dental Care for Aged"(Mesh) OR "Health Services for the Aged"(Mesh)) OR (elder*(tw) OR eldest(tw) OR frail*(tw) OR geriatri*(tw) OR old age*(tw) OR oldest old*(tw) OR senior*(tw) OR senium(tw) OR very old*(tw) OR septuagenarian*(tw) OR octagenarian*(tw) OR octogenarian*(tw) OR nonagenarian*(tw) OR centarian*(tw) OR centenarian*(tw) OR supercentenarian*(tw) OR older people(tw) OR older subject*(tw) OR older patient*(tw) OR older age*(tw) OR older adult*(tw) OR older man(tw) OR older men(tw) OR older male*(tw) OR older woman(tw) OR older women(tw) OR older female*(tw) OR older population*(tw) OR older person*(tw)) |
3004680 |
|
#31 |
"Pregnancy"(Mesh) OR "Pregnant Women"(Mesh) OR "Preconception Care"(Mesh) OR pregnan*(tiab) OR gravidit*(tiab) OR gestation*(tiab) OR placentat*(tiab) OR prepregnan*(tiab) OR conception*(tiab) OR preconception*(tiab) |
1006196 |
|
#30 |
child*(tw) OR schoolchild*(tw) OR infan*(tw) OR adolescen*(tw) OR pediatri*(tw) OR paediatr*(tw) OR neonat*(tw) OR boy(tw) OR boys(tw) OR boyhood(tw) OR girl(tw) OR girls(tw) OR girlhood(tw) OR youth(tw) OR youths(tw) OR baby(tw) OR babies(tw) OR toddler*(tw) OR "Mental Disorders Diagnosed in Childhood"(MeSH) OR teen(tw) OR teens(tw) OR teenager*(tw) OR newborn*(tw) OR postneonat*(tw) OR postnat*(tw) OR perinat*(tw) OR puberty(tw) OR preschool*(tw) OR suckling*(tw) OR picu(tw) OR nicu(tw) OR "Arthritis, Juvenile"(Mesh) OR "Myoclonic Epilepsy, Juvenile"(Mesh) OR "Leukemia, Myelomonocytic, Juvenile"(Mesh) OR "Xanthogranuloma, Juvenile"(Mesh) OR "Juvenile Delinquency"(Mesh) OR "Corneal Dystrophy, Juvenile Epithelial of Meesmann"(Mesh) |
4049936 |
|
#28 |
(("Gastroesophageal Reflux"(Mesh)) OR "Bile Reflux"(Mesh)) OR "Duodenogastric Reflux"(Mesh) OR reflux*(tiab) |
58129 |
|
#17 |
"Diabetes Mellitus"(Mesh) OR "Hypoglycemic Agents"(Mesh) OR "Hypoglycemic Agents" (Pharmacological Action) OR diabetes(tiab) OR diabetic*(tiab) OR insulin*(tiab) OR metformin*(tiab) OR rosiglitazon*(tiab) OR troglitazon*(tiab) OR pioglitazon*(tiab) OR hypoglycem*(tiab) OR hypoglycaem*(tiab) |
857247 |
|
#29 |
#14 AND #15 Filters: Publication date from 2000/01/01 |
1887 |
|
#16 |
#14 AND #15 |
1897 |
|
#15 |
"Gastric Balloon"(Mesh) OR gastric sleev*(tiab) OR sleeve gastrectom*(tiab) OR stomach stapl*(tiab) OR gastric balloon*(tiab) |
4643 |
|
#14 |
"Gastric Bypass"(Mesh) OR gastric bypass*(tiab) OR roux en y*(tiab) OR gastroileal bypass*(tiab) OR gastrojejunostom*(tiab) OR jejunoileal bypass*(tiab) OR jejuno ileal bypass*(tiab) OR ileojejunal bypass*(tiab) OR intestinal bypass*(tiab)OR omega loop*(tiab) |
17611 |
Embase.com
|
No. |
Query |
Results |
|
#68 |
#48 AND ((cohort:ti,ab,kw OR (case:ti,ab,kw AND (control:ti,ab,kw OR controll*:ti,ab,kw OR comparison:ti,ab,kw OR referent:ti,ab,kw)) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'epidemiology'/de OR follow) AND up:ti,ab,kw OR followup:ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw) Overig, Epidemiologisch, |
325 |
|
#67 |
#48 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Overig RCT |
200 |
|
#66 |
#48 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de), Overig SR |
86 |
|
#48 |
(#23 OR #24 OR #25 OR #26 OR #43) NOT (#30 OR #31 OR #32 OR #33 OR #34 OR #35 OR #36 OR #37 OR #38 OR #39 OR #40 OR #41 OR #42) |
493 |
|
#47 |
#23 OR #24 OR #25 OR #26 OR #43 |
891 |
|
#46 |
#43 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti Kinderwens, epidemiologisch |
12 |
|
#45 |
#43 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti Kinderwens, RCT |
1 |
|
#44 |
#43 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Kinderwens, SR |
0 |
|
#43 |
(((('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab)) AND (1-1-2000)/sd) NOT 'conference abstract'/it) AND ('pregnancy'/exp OR 'pregnant woman'/exp OR 'female infertility'/exp OR 'pregnancy disorder'/exp OR 'reproductive health'/exp OR 'female fertility'/exp OR pregnan*:ti,ab,kw OR gravidit*:ti,ab,kw OR gestation*:ti,ab,kw OR placentat*:ti,ab,kw OR prepregnan*:ti,ab,kw OR conception*:ti,ab,kw OR preconception*:ti,ab,kw OR (('fertility'/de OR 'infertility'/de OR fertil*:ti,ab,kw OR infertil*:ti,ab,kw) AND ('female'/exp OR woman:ti,ab,kw OR women:ti,ab,kw OR female*:ti,ab,kw))) |
19 |
|
#42 |
'pregnancy'/exp OR 'pregnant woman'/exp OR 'female infertility'/exp OR 'pregnancy disorder'/exp OR 'reproductive health'/exp OR 'female fertility'/exp OR pregnan*:ti,ab,kw OR gravidit*:ti,ab,kw OR gestation*:ti,ab,kw OR placentat*:ti,ab,kw OR prepregnan*:ti,ab,kw OR conception*:ti,ab,kw OR preconception*:ti,ab,kw OR (('fertility'/de OR 'infertility'/de OR fertil*:ti,ab,kw OR infertil*:ti,ab,kw) AND ('female'/exp OR woman:ti,ab,kw OR women:ti,ab,kw OR female*:ti,ab,kw)) |
1288988 |
|
#41 |
#26 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Ouderen, epidemiologisch |
132 |
|
#40 |
#26 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Ouderen, RCT |
41 |
|
#39 |
#26 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Ouderen SR |
3 |
|
#38 |
#25 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Kinderen, epidemiologisch |
98 |
|
#37 |
#25 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Kinderen, RCT |
46 |
|
#36 |
#25 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Kinderen, SR |
18 |
|
#35 |
#24 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Reflux epidemiologsch |
102 |
|
#34 |
#24 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Reflux, RCT |
47 |
|
#33 |
#24 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Reflux, SR |
21 |
|
#32 |
#23 AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR ((cohort NEAR/1 (study OR studies)):ab,ti) OR (case:ab,ti AND ((control NEAR/1 (study OR studies)):ab,ti)) OR (follow:ab,ti AND ((up NEAR/1 (study OR studies)):ab,ti)) OR ((observational NEAR/1 (study OR studies)):ab,ti) OR ((epidemiologic NEAR/1 (study OR studies)):ab,ti) OR (('cross sectional' NEAR/1 (study OR studies)):ab,ti)) Diabetes epidemiologisch |
149 |
|
#31 |
#23 AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) Diabetes RCT |
119 |
|
#30 |
#23 AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp)) Diabetes SR |
43 |
|
#26 |
#22 AND ('aged'/exp OR 'geriatrics'/exp OR 'elderly care'/exp OR elder*:de,ab,ti OR eldest:de,ab,ti OR frail*:de,ab,ti OR geriatri*:de,ab,ti OR ((old NEXT/1 age*):de,ab,ti) OR ((oldest NEXT/1 old*):de,ab,ti) OR senior*:de,ab,ti OR senium:de,ab,ti OR ((very NEXT/1 old*):de,ab,ti) OR septuagenarian*:de,ab,ti OR octagenarian*:de,ab,ti OR octogenarian*:de,ab,ti OR nonagenarian*:de,ab,ti OR centarian*:de,ab,ti OR centenarian*:de,ab,ti OR supercentenarian*:de,ab,ti OR 'older people':de,ab,ti OR ((older NEXT/1 subject*):de,ab,ti) OR ((older NEXT/1 patient*):de,ab,ti) OR ((older NEXT/1 age*):de,ab,ti) OR ((older NEXT/1 adult*):de,ab,ti) OR 'older man':de,ab,ti OR 'older men':de,ab,ti OR 'older male*':de,ab,ti OR 'older woman':de,ab,ti OR 'older women':de,ab,ti OR 'older female*':de,ab,ti OR ((older NEXT/1 population*):de,ab,ti) OR ((older NEXT/1 person*):de,ab,ti)) |
234 |
|
#25 |
#22 AND (adolescen*:ab,ti OR 'adolescence'/exp OR 'adolescent coping orientation for problem experiences'/exp OR 'adolescent development'/exp OR 'adolescent disease'/exp OR 'adolescent health'/exp OR 'adolescent parent'/exp OR 'adolescent pregnancy'/exp OR 'adolescent smoking'/exp OR 'adolescent'/exp OR 'adolescent-family inventory of life events and changes'/exp OR babies:ab,ti OR baby:ab,ti OR 'birth weight'/exp OR boy:ab,ti OR boyhood:ab,ti OR boys:ab,ti OR 'brazelton neonatal behavioral assessment scale'/exp OR 'child abuse'/exp OR 'child advocacy'/exp OR 'child behavior checklist'/exp OR 'child behavior'/exp OR 'child care'/exp OR 'child death'/exp OR 'child health care'/exp OR 'child health'/exp OR 'child nutrition'/exp OR 'child parent relation'/exp OR 'child psychology'/exp OR 'child restraint system'/exp OR 'child safety'/exp OR 'child welfare'/exp OR child*:ab,ti OR 'child'/exp OR 'childhood disease'/exp OR 'childhood mortality'/exp OR 'childhood'/exp OR girl:ab,ti OR girlhood:ab,ti OR girls:ab,ti OR 'high risk infant'/exp OR infan*:ab,ti OR 'infant disease'/exp OR 'infant mortality'/exp OR 'infant nutrition'/exp OR 'infant welfare'/exp OR 'infanticide'/exp OR 'infantile diarrhea'/exp OR 'infantile hypotonia'/exp OR 'juvenile delinquency'/exp OR neonat*:ab,ti OR 'neonatal weight loss'/exp OR 'newborn disease'/exp OR 'newborn morbidity'/exp OR 'newborn period'/exp OR newborn*:ab,ti OR 'newborn'/exp OR nicu:ab,ti OR 'only child'/exp OR paediatr*:ab,ti OR pediatri*:de,ab,ti OR 'pediatric advanced life support'/exp OR 'pediatric anesthesia'/exp OR 'pediatric cardiology'/exp OR 'pediatric hospital'/exp OR 'pediatric intensive care nursing'/exp OR 'pediatric nurse practitioner'/exp OR 'pediatric nursing'/exp OR 'pediatric rehabilitation'/exp OR 'pediatric surgery'/exp OR 'newborn hypoxia'/exp OR 'pediatric ward'/exp OR 'pediatrics'/exp OR perinat*:ab,ti OR 'perinatal development'/exp OR 'perinatal period'/exp OR 'persistent hyperinsulinemic hypoglycemia of infancy'/exp OR picu:ab,ti OR postnat*:ab,ti OR 'postnatal care'/exp OR 'postnatal development'/exp OR 'postnatal growth'/exp OR postneonat*:ab,ti OR preschool*:ab,ti OR puberty:ab,ti OR 'runaway behavior'/exp OR 'school child':ab,ti OR schoolchild*:ab,ti OR 'severe myoclonic epilepsy in infancy'/exp OR suckling*:ab,ti OR teen:ab,ti OR teenager*:ab,ti OR teens:ab,ti OR toddler*:ab,ti OR 'transient hypogammaglobulinemia of infancy'/exp OR youth:ab,ti OR youths:ab,ti) |
205 |
|
#24 |
#22 AND ('gastroesophageal reflux'/exp OR 'duodenogastric reflux'/exp OR reflux:ti,ab) |
252 |
|
#23 |
#22 AND ('non insulin dependent diabetes mellitus'/exp OR (((diabetes OR diabetic*) NEAR/3 ('non insulin depend*' OR 'noninsulin depend*' OR noninsulindepend* OR 'non insulindepend*' OR 'maturity onset*' OR 'adult onset*' OR 'slow onset*')):ti,ab) OR dm2:ti,ab OR niddm:ti,ab OR 'dm 2':ti,ab OR t2d*:ti,ab OR 'dm type 2':ti,ab OR 'type 2 diabet*':ti,ab OR 'type two diabet*':ti,ab OR 'type ii diabet*':ti,ab OR 'dm type ii':ti,ab) |
424 |
|
#22 |
((('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab)) AND (1-1-2000)/sd) NOT 'conference abstract'/it |
1863 |
|
#16 |
('gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab) AND ('gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab) |
4785 |
|
#15 |
'gastric balloon'/exp OR 'gastric sleev*':ti,ab OR 'sleeve gastrectom*':ti,ab OR 'gastric balloon*':ti,ab |
10979 |
|
#10 |
'gastric bypass surgery' OR 'gastric bypass*':ti,ab OR 'roux en y':ti,ab OR 'gastroileal bypass*':ti,ab OR 'gastrojejunostom*':ti,ab OR 'jejunoileal bypass*':ti,ab OR 'jejuno ileal bypass*':ti,ab OR 'ileojejunal bypass*':ti,ab OR 'intestinal bypass*':ti,ab |
29409 |
Wiley/Cochrane Library
|
Search |
Query |
Items found |
|
#1 |
("gastric balloon*" or "gastric sleev*" or "sleeve gastrectom*" or "stomach stapl*" or "gastric balloon"):ti,ab,kw AND ("gastric bypass*" or "roux en y" or "roux en ys" or "gastroileal bypass*" or "gastrojejunostom*" or "jejunoileal bypass*" or "jejuno ileal bypass*" or "intestinal bypass*" or "omega loop"):ti,ab,kw |
298 |
|
#2 |
#1 and (pregnan* or gravidit* or gestation* or placentat* or prepregnan* or conception* or preconception* or ((fertil* or infertil*) and (woman or women or female*))):ti,ab,kw |
0 |
|
#3 |
#1 and (elder* or eldest or frail* or geriatri* or "old age*" or "oldest old*" or senior* or senium or "very old*" or septuagenarian* or octagenarian* or octogenarian* or nonagenarian* or centarian* or centenarian* or supercentenarian* or "older people" or "older subject*" or "older patient*" or "older age*" or "older adult*" or "older man" or "older men" or "older male" or "older woman" or "older women" or "older female" or "older population*" or "older person*"):ti,ab,kw |
5 |
|
#4 |
#1 and (infan* or child* or adolescen* or pediatric* or paediatric* or pube* or juvenil* or school* or newborn* or "new-born*" or "neo-nat*" or neonat* or premature* or postmature* or "pre-mature*" or "post-mature*" or preterm* or "pre-term*" or baby or babies or toddler* or youngster* or preschool* or kindergart* or kid or kids or playgroup* or "play-group*" or playschool* or prepube* or preadolescen* or "junior high*" or highschool* or "senior high" or "young people*" or minors):ti,ab,kw |
37 |
|
#5 |
#1 and (diabetes or "diabetic*" or "insulin*" or "metformin*" or "rosiglitazon*" or "troglitazon*" or "pioglitazon*" or "hypoglycem*" or "hypoglycaem*"):ti,ab,kw |
132 |
|
#6 |
#1 and reflux* |
35 |
|
#7 |
#1 not (#2 or #3 or #4 or #5 or #6) |
122 |
