Indicatiestelling patiënten > 65 jaar bij chirurgische behandeling van obesitas
Uitgangsvraag
Is metabole chirurgie een goede en veilige behandeling bij patiënten met zeer ernstig overgewicht ouder dan 65 jaar?
Aanbeveling
Aanbeveling 1
Laat de indicatiestelling voor metabole chirurgie niet afhangen van de leeftijd van de patiënt.
Aanbeveling 2
Houd bij de indicatiestelling voor metabole chirurgie bij oudere patiënten rekening met een mogelijk verhoogd risico op complicaties of overlijden.
Overwegingen
Op zichzelf is het opmerkelijk dat er voor een ziekte een leeftijdscriterium voor behandeling bestaat. Als immers is aangetoond dat een behandeling effectief is en kwaliteitsverbetering geeft dan wordt de leeftijdskwestie al snel minder relevant. Toch is het begrijpelijk dat bij behandeling van chronische aandoeningen, die niet een acute bedreiging van de gezondheid betekenen ook wordt gekeken naar de lange termijn effecten van die behandeling. Bij de beschouwing van behandeling van obesitas in relatie tot de leeftijd is het daarom van belang naast effectiviteit en veiligheid van de behandeling ook in de overweging mee te nemen de effecten op kwaliteit van leven en levensverwachting.
Ook boven de 65 jaar komt obesitas in toenemende mate voor en leidt evenzeer tot bijkomende morbiditeit en vermindering van kwaliteit van leven als op jongere leeftijd. Daarbij wordt opgemerkt dat met de vergrijzing en tegelijkertijd toenemende levensverwachting ook de vraag om chirurgische behandeling bij patiënten boven de 65 jaar steeds vaker gesteld wordt. In de overweging of oudere patiënten wel of niet voor een operatie in aanmerking komen speelt mee de vraag wat beschouwd moet worden als (te) oud. Al bij de vorige richtlijn ‘Morbide Obesitas’ (2011) werd om die reden bepleit de in Nederland geldende bovengrens van 65 jaar (op indicatie) los te laten. Met betrekking tot leeftijd is het niet het doel van deze richtlijn aan te tonen dan wel te ontkrachten dat het operatierisico in zijn algemeenheid hoger wordt boven de 60 jaar. Niet alleen hebben oudere patiënten gemiddeld meer bijkomende ziekten, ook zijn de fysieke reserves om adequaat te reageren op een complicatie in het algemeen afgenomen ten opzichte van jongere patiënten. Centraal staat evenwel de vraag in hoeverre ook een patiënt boven de 65 jaar zal profiteren van een behandeling en of dat opweegt tegen de risico’s.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Voor de effectiviteit van metabole chirurgie bij patiënten > 65 jaar werden gewichtsverlies (uitgedrukt in % EWL) en verbetering van co-morbiditeit (diabetes, dyslipidemie, hypertensie en slaapapnoe) als cruciale uitkomstmaten beschouwd. Op basis van de huidige literatuur was het onduidelijk of er een verschil bestaat in gewichtsverlies en vermindering van co-morbiditeit bij patiënten boven de 65 jaar in vergelijking met patiënten onder de 65 jaar. Daarnaast waren er geen studies gevonden die met betrekking tot metabole chirurgie de (on)gunstige effecten bij ouderen ten opzichte van standaard zorg onderzochten. Theoretisch is een groot verschil in werking van de operatie tussen jongere en oudere patiënten niet te verwachten, maar de mate van effectiviteit zou kunnen verschillen.
Voor de veiligheid van metabole chirurgie is gekeken naar het risico op complicaties en naar de mortaliteit. Voor beide cruciale uitkomstmaten is een verschil onduidelijk op basis van de geïncludeerde vergelijkende studies. Toch is bekend dat het risico van operaties in het algemeen toeneemt met stijgende leeftijd. Het á priori risico om te overlijden aan een metabole operatieve ingreep is echter zo afgenomen dat zelfs een toename daarvan op hogere leeftijd per saldo nog steeds een laag risico betreft en in de afweging tegen de voordelen van een operatie nog steeds aanvaardbaar zou kunnen worden geacht. Illustratief is in dat verband de jaarrapportage van DICA over 2017 bij 29.427 patiënten in Nederland, waarbij gekeken werd naar complicatiescore bij een leeftijd boven of onder 60 jaar (DICA, 2018). De ernstigste complicaties (Clavin Dindo (CD) score 4) en overlijden (CD score 5) kwamen bij patiënten onder de 60 jaar bij respectievelijk 0,6% en < 0,1% voor. Boven de 60 jaar waren die percentages 1,4% (CD-4) en 0,3% (CD-5). Hoewel dus sprake is van een verdrievoudiging van het overlijdensrisico boven de 60 jaar, is het percentage nog steeds zeer laag. Het is te verwachten dat het percentage toeneemt met stijgende leeftijd boven de 65 jaar, maar hoeveel is niet bekend. Omdat het operatierisico afhangt van veel meer factoren dan kalender leeftijd alleen, maar evenzeer van gezondheidssituatie, co-morbiditeiten en duur en mate van overgewicht is het niet rationeel om een algemene leeftijdsgrens aan te houden. Het besluit wel of niet te opereren moet zowel boven als onder de 65 jaar op individuele basis worden genomen.
Voor de cruciale uitkomstmaten gewichtsverlies, verbetering van co-morbiditeit en veiligheid waren er geen gerandomiseerde studies beschikbaar. De geïncludeerde observationele cohort studies corrigeerden vaak niet voor mogelijke confounders, terwijl de case-control studies vaak overmatchen. Daarnaast hadden de studies relatief lage aantallen en was er klinische heterogeniteit tussen de studies, zoals verschillende follow-up momenten, verschillende leeftijdsgrenzen als afkapwaardes en verschillende chirurgische technieken. Bij de remissie van co-morbiditeiten rapporteerden de cohort studies en case-control studies vaak tegenstrijdige resultaten. De bewijskracht voor uitkomsten gewichtsverlies, morbiditeit/ complicaties en mortaliteit, is daarom als zeer laag beoordeeld. Voor de uitkomstmaten kwaliteit van leven en levensverwachting werden geen studies gevonden. Er zijn een groter aantal studies die de effectiviteit van metabole chirurgie ook bij hogere leeftijd beschrijven, maar hierbij gaat het niet om vergelijkende studies. Om die reden zijn ze dan ook niet in de GRADE-systematiek meegenomen. Hoewel er wereldwijd ook bij ouderen meer metabole chirurgie gebeurt zullen er naar verwachting in de komende jaren meer studies verschijnen over metabole chirurgie op hogere leeftijd. RCT’s waarbij metabole chirurgie bij patiënten van 65 jaar en ouder wordt vergeleken met conservatieve therapie zijn wenselijk.
Hoewel de literatuur van onvoldoende kwaliteit is om een duidelijk verschil aan te tonen in uitkomstmaten bij patiënten jonger of ouder dan 65 jaar, staat niet ter discussie dat ook bij ouderen er een duidelijk effect is van metabole chirurgie in de zin van blijvend gewichtsverlies en verbetering van bijkomende ziektes. De ziektelast van zeer ernstig overgewicht wordt ook op oudere leeftijd duidelijk gevoeld. Het is opmerkelijk dat hoewel complicatierisico’s van metabole chirurgie vergelijkbaar zijn met bijvoorbeeld galblaaschirurgie of zelfs lager zijn dan bij (benigne) colonchirurgie er daar in het algemeen niet over een leeftijdsgrens wordt gesproken met betrekking tot de risico’s maar eigenlijk uitsluitend gekeken wordt naar risk/ benefit ratio en te verwachten kwaliteit van leven winst. Er is geen reden waarom (ernstige) obesitas ook niet op die criteria beoordeeld zou moeten worden. Niet in de huidige search meegenomen maar wel illustratief in dat verband is het artikel van Choulliard (2018) die in een vergelijkende studie inderdaad een toename in kwaliteit van leven aantoonde bij metabole patiënten ouder dan 60 jaar vergelijkbaar met jongere patiënten.
Bij chronische aandoeningen die niet acuut levensbedreigend en weinig klachten geven (bijvoorbeeld hypertensie of hypercholesterolaemie) wordt soms leeftijd in relatie tot levensverwachting gebruikt als argument om wel of niet te behandelen. Ook bij zeer ernstig overgewicht wordt dat argument wel gehoord.
Er is geen literatuur voorhanden in de zoekperiode die beschrijft of metabole chirurgie boven de 65 jaar leidt tot verlengde levensverwachting. Daar staat tegenover dat die relatie wel wordt aangetoond voor jongere patiënten en al optreedt vanaf twee jaar na de operatie (Sjögren, 2013). Een recenter artikel van Prasad (2018) toont in een vergelijkende studie met een follow up van bijna 5 jaar bij patiënten van gemiddeld 65 jaar wel een afname aan in mortaliteit ten opzichte van patiënten die alleen conservatieve behandeling kregen.
De criteria die tot op heden bepaalden of een patiënt met zeer ernstig overgewicht voor een operatie in aanmerking kwam stamden uit 1992 (Consensus N.I.H., 1992). Eén van die criteria was de leeftijdsgrens tot 65 jaar. In 1992 was de gemiddelde leeftijdsverwachting 77,4 jaar. De leeftijdsverwachting is in 2017 gestegen tot 81,7 jaar en is nog steeds stijgende (CBS, 2017). Niettemin is levensverwachting in de geneeskunde een zeer betrekkelijk argument, zeker als het aandoeningen betreft met een hoge ziektelast, zoals bij zeer ernstig overgewicht. Te verwachten vermindering van psychologische en fysieke ziektelast en verbetering van kwaliteit van leven zouden in die beoordeling leidend moeten zijn.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De prevalentie van (ernstige) obesitas neemt toe met leeftijd en bereikt een plateau tussen de 55 en 75 jaar. Ook boven de 65 jaar zijn er dus veel patiënten die last hebben van (de gevolgen van) hun overgewicht. Patiënten met zeer ernstig overgewicht hebben een aantoonbaar lagere kwaliteit van leven in alle domeinen. Veel studies tonen verbetering aan van kwaliteit van leven scores na een metabole operatieve ingreep. Of dat in een oudere populatie anders ligt is niet wetenschappelijk aangetoond maar het is niet aannemelijk. Voor veel patiënten wegen de voordelen van een operatie ook boven de 65 jaar dan ook ruimschoots op tegen de nadelen van een complicatie of overlijden.
Voor wat betreft de veiligheid is het belangrijk vast te stellen dat er sinds 1992 een enorme ontwikkeling is geweest in de metabole chirurgie. Niet alleen zijn procedures veranderd maar ook de risico’s samenhangend met een operatie zijn enorm naar beneden gegaan. Waar vroeger een mortaliteitsrisico van 1% nog een acceptabel mortaliteitsrisico was, ligt tegenwoordig dat risico onder de 0,1% (1 op 1000 patiënten) (DICA, 2018).
Kosten (middelenbeslag)
Een verruiming van de leeftijdsgrens voor metabole chirurgie naar boven de 65 jaar zou een (geringe) toename kunnen betekenen van het aantal patiënten dat voor een operatie in aanmerking komt. Toch is dat aantal relatief gezien laag. De piek van metabole operaties ligt rond de 40 tot 45 jaar en neemt af met toenemende leeftijd. Of een metabole operatie ook extra kosten genereert is de vraag. Een operatie geeft financiële druk op het budget, maar leidt ook tot gewichtsverlies en vermindering van co-morbiditeit en medicijngebruik. Op termijn worden door dit laatste mogelijk juist kosten bespaard. Bij de beroepsbevolking leidt succesvol gewichtsverlies tot minder ziekteverzuim en meer productiviteit en daardoor tot lagere indirecte kosten. Maar bij een leeftijd boven de 65 jaar gaat dit laatste waarschijnlijk niet op.
Aanvaardbaarheid voor de overige relevante stakeholders
Vanwege de operatieve kosten zijn sommige zorgverzekeraars in het verleden terughoudend geweest met het vergoeden van metabole operaties bij patiënten boven de 65 jaar. Gezien het voorafgaande lijkt die opstelling medisch gezien maar ook moreel en ethisch niet verdedigbaar. Toch moet benadrukt worden dat het stellen van de indicatie voor een metabole operatie altijd op individuele basis gebeurt waarbij naast leeftijd ook operatierisico, BMI, co-morbiditeit en levensverwachting moeten worden meegewogen.
Haalbaarheid en implementatie
Metabole operaties bij patiënten ouder dan 65 jaar zijn niet anders dan bij jongere patiënten. Er zijn dan ook geen implicaties voor wat betreft haalbaarheid en implementatie. Van een verruiming van leeftijdsgrens is in deze richtlijn geen sprake in engere zin, omdat ook de eerdere Richtlijn ‘Morbide Obesitas’ dit reeds toestond. Toch is het denkbaar dat het vaker stellen van een indicatie voor metabole chirurgie boven de 65 jaar het totaal aantal patiënten zal laten toenemen.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Aanbeveling-1
De gunstige effecten van metabole chirurgie voor wat betreft blijvend gewichtsverlies en verbetering van co-morbiditeit zijn ook aanwezig bij patiënten ouder dan 65 jaar. Hoewel het risico op complicaties en mortaliteit in deze groep relatief hoger is dan bij jongere patiënten gaat het per saldo om zeer kleine percentages.
Op basis van de gunstige behandeleffecten van metabole chirurgie is het niet ethisch om patiënten van 65 jaar of ouder een behandeling te onthouden. De gunstige effecten van een metabole operatie mogen oudere patiënten niet worden ontzegd mits het verhoogde operatierisico voldoende wordt meegewogen.
Aanbeveling-2
Hoewel de literatuur niet eenduidig is over het risico van metabole operaties bij patiënten ouder dan 65 jaar lijkt het aannemelijk dat het risico op complicaties en overlijden hoger ligt dan op lagere leeftijd. Op iedere leeftijd is een juiste inschatting van voordelen van de operatie versus de risico’s van belang, maar bij oudere patiënten zijn de implicaties van een complicatie vaak ernstiger. Deze overwegingen moeten in de indicatiestelling voor een metabole operatieve ingreep nadrukkelijk worden meegenomen.
Onderbouwing
Achtergrond
In de huidige praktijk wordt metabole chirurgie boven de 65 jaar weinig gedaan en door de meeste verzekeraars niet vergoed. Metabole chirurgie leidt tot significante gewichtsreductie op alle leeftijden met verbetering van co-morbiditeiten en tot verbetering van de kwaliteit van leven en langere levensverwachting. De rol van metabole chirurgie op oudere leeftijd is minder goed beschreven. De vraag is of de gunstige effecten van metabole chirurgie of blijvend significant gewichtsverlies en vermindering van co-morbiditeiten ook gelden voor patiënten ouder dan 65 jaar. Het risico van een operatie neemt boven de 60 jaar toe en mogelijk boven de 65 nog meer. De vraag is of de voordelen van een operatie in termen van kwaliteit van leven opwegen tegen het verhoogde operatierisico. Op lagere leeftijd geeft metabole chirurgie al na twee jaar verbeterde overleving maar het is onduidelijk of metabole chirurgie boven de 65 jaar ook leidt tot een betere levensverwachting.
Conclusies / Summary of Findings
1.1 Uitkomstmaat Gewichtsverlies (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in gewichtsverlies tussen patiënten ≥ 60 jaar versus patiënten < 60 jaar na metabole chirurgie.
Bronnen: (Montastier, 2016; Navarette, 2017; Parmar, 2017; Thereaux, 2015; Wang, 2016; Willkomm, 2010; Yoon, 2016) |
1.2 Uitkomstmaat Remissie van co-morbiditeiten (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in remissie van co-morbiditeiten tussen patiënten ≥ 60 jaar versus patiënten < 60 jaar na metabole chirurgie.
Bronnen: (Montastier, 2016; Navarette, 2017; Parmar, 2017; Thereaux, 2015; Wang, 2016) |
1.3 Uitkomstmaat Complicaties (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in complicaties tussen patiënten ≥ 60 jaar versus patiënten < 60 jaar na metabole chirurgie.
Bronnen: (Dorman, 2011; Gerber, 2018; Montastier, 2016; Navarette, 2017; Parmar, 2017; Thereaux, 2015; Qin, 2015; Wang, 2016; Yoon, 2016) |
1.4 Uitkomstmaat Mortaliteit (cruciaal)
|
Zeer laag GRADE |
Het is onduidelijk of er een verschil is in mortaliteit tussen patiënten ≥ 60 jaar versus patiënten < 60 jaar na metabole chirurgie.
Bronnen: (Dorman, 2011; Gerber, 2018; Montastier, 2016; Navarette, 2017; Parmar, 2017; Thereaux, 2015; Qin, 2015; Wang, 2016; Willkomm, 2010) |
1.5 Uitkomstmaat Kwaliteit van leven (Belangrijk)
|
- GRADE |
Er werden geen studies gevonden die deze uitkomstmaat beschreven.
Bronnen: - |
1.6. Uitkomstmaat Levensverwachting (Belangrijk)
|
- GRADE |
Er werden geen studies gevonden die deze uitkomstmaat beschreven.
Bronnen: - |
PICO 2 - Alle uitkomstmaten
|
- GRADE |
Er werden geen studies gevonden die deze PICO beschreven.
Bronnen: (Felix, 2013) |
Samenvatting literatuur
Beschrijving studies
PICO 1
De systematische review van Wang (2016) includeerde elf studies die resultaten van oudere patiënten met jongere patiënten vergeleken na een sleeve gastrectomie. Deze studies vergelijken zeven studies met 278 patiënten ouder dan 60 jaar met 1.244 jongere patiënten met sleeve gastrectomie. De vier andere studies namen leeftijdsgrenzen onder de 60 jaar en zijn niet meegenomen in deze literatuursamenvatting. Twee van de zeven studies (Abbas, 2015; Ritz, 2014) rapporteerde ook resultaten van patiënten met een Roux-en-Y gastric bypass (RYGB) (totaal 110 ouderen versus 1.281 jongeren). Deze resultaten zijn uit de losse studies geëxtraheerd. Daarnaast werden er negen individuele studies geselecteerd. De follow-up duur varieerde van 30 dagen tot 5 jaar. In tabel 1 staan de belangrijkste kenmerken van de studies.
Er werden zowel case-control als cohort studies geïncludeerd. De meeste studies corrigeerden niet voor confounders. De case-control studies matchten patiënten op basis van verschillende variabelen (zie evidencetabel), waarbij er bij een aantal studies risico was van overmatching, door het matchen op colliders. De standaarddeviaties werden vaak niet gerapporteerd in de studies. Om deze data toch te kunnen poolen zijn de standaarddeviaties berekend met behulp van de p-waarde, 95% betrouwbaarheidsintervallen of imputatie vanuit een studie met een vergelijkbare studiepopulatie.
Tabel 1 Geïncludeerde studies
|
Studie, jaartal |
Studie design |
Leeftijd (gemiddelde of afkapwaarde) |
Follow-up |
Type bariatrie |
|
In Wang, 2016 |
||||
|
Pequinot, 2015 |
Case-control |
62 versus 41,3 |
2 jaar |
Sleeve gastrectomy |
|
Burchett, 2015 |
Cohort |
≥62 versus <62 |
1 jaar |
Sleeve gastrectomy |
|
Luppi, 2015 |
Cohort |
63,2 versus 45,2 |
2 jaar |
Sleeve gastrectomy |
|
Mizrahi, 2014 |
Case-control |
62,9 versus 35,7 |
22 maanden |
Sleeve gastrectomy |
|
Ritz, 2014 |
Cohort |
>60 versus <59 |
1 jaar |
Sleeve gastrectomy of gastric bypass |
|
Van Rutte, 2013 |
Cohort |
62 versus 57 |
14,6 maanden |
Sleeve gastrectomy |
|
Abbas, 2015 |
Cohort |
63,4 versus 22-59 |
1 jaar |
Sleeve gastrectomy of gastric bypass |
|
Individuele studies |
||||
|
Navarette, 2017 |
Case-control |
>60 versus <60 |
3 jaar |
Sleeve gastrectomy |
|
Gerber, 2018 |
Cohort |
≥60 versus <60 |
5 jaar |
Gastric bypass |
|
Montastier, 2016 |
Case-control |
≥60 versus 40-59 |
2 jaar |
Gastric bypass |
|
Thereaux, 2015 |
Case-control |
≥60 versus <60 |
3 jaar |
Gastric bypass |
|
Willkomm, 2010 |
Cohort |
≥65 versus <65 |
2 jaar |
Gastric bypass |
|
Yoon, 2016 |
Case-control |
≥60 versus <60 |
1 jaar |
Sleeve gastrectomy of gastric bypass |
|
Qin, 2015 |
Cohort |
65+ versus <65 |
30 dagen |
Sleeve gastrectomy of gastric bypass |
|
Dorman, 2011 |
Cohort |
≥65 versus <65 |
30 dagen |
>90% Sleeve gastrectomy of gastric bypass |
|
Parmar, 2017 |
Case-control |
≥70 versus <60 |
2 jaar |
>90% Sleeve gastrectomy of gastric bypass |
PICO 2
De systematische review van Felix (2013) zocht naar RCT’s of studies met een quasi-experimenteel design die metabole interventies vergeleek met niet-chirurgische interventies bij patiënten ≥ 60 jaar. De auteurs concludeerden dat er geen studies waren die deze vergelijking onderzochten.
Resultaten
PICO 1
1.1. Uitkomstmaat Gewichtsverlies (cruciaal)
Gewichtsverlies werd gerapporteerd als percentage Excess Weight Loss (%EWL) en gerapporteerd in twaalf studies, waarvan zes cohort studies met 278 patiënten ≥ 60 jaar en 1993 patiënten < 60 jaar en zes case-control studies met 240 patiënten ≥ 60 jaar en 417 patiënten < 60 jaar.
Het gemiddelde verschil in %EWL tussen patiënten ≥ 60 jaar en < 60 jaar in de cohort studies was 0,28% (95% BI -5,83 tot 5,28). In de case-controle studies hadden de patiënten < 60 jaar gemiddeld 8,51% meer EWL (95% BI -14,50 tot -2,52%) vergeleken met de patiënten ≥ 60 jaar (figuur 1).
Subgroep-analyses lieten geen verschillen in gewichtsverlies zien tussen de verschillende operatietechnieken of alleen bij studies met een follow-up van 2 jaar of langer.
Figuur 1 Uitkomstmaat gewichtsverlies vergelijking ≥ 60 jaar versus < 60 jaar
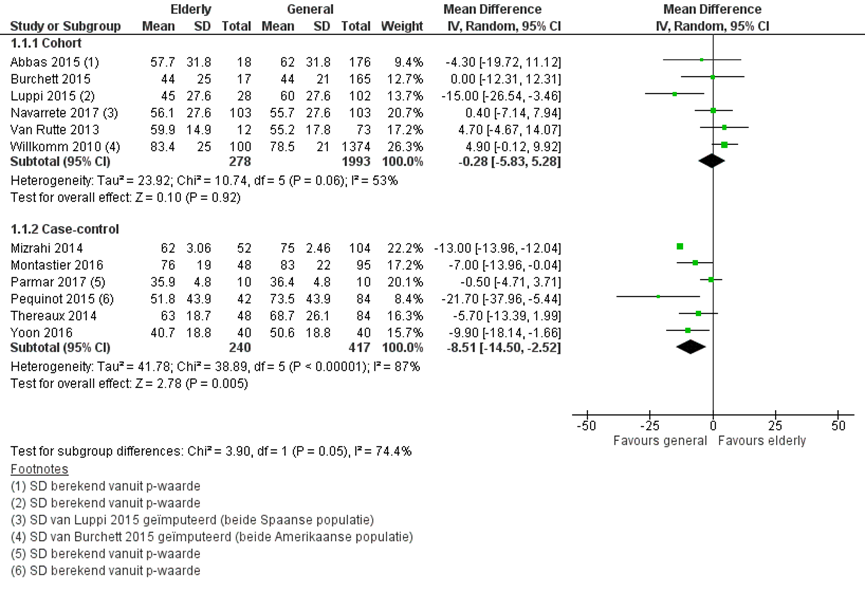
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat gewichtsverlies is gebaseerd op niet-gerandomiseerd vergelijkend onderzoek en start derhalve laag. De bewijskracht verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet zoals het niet corrigeren voor mogelijke confounding of overmatchen (risk of bias) en zowel klinische (verschillende follow-up, verschillende leeftijdsgrenzen als afkapwaardes en verschillende chirurgische technieken) als statistische heterogeniteit tussen de studies (inconsistentie).
1.2. Uitkomstmaat Remissie van co-morbiditeiten (cruciaal)
Studies rapporteerden de remissie van diabetes mellitus type 2, hypertensie, dyslipidemie en OSAS. Alleen resultaten van studies waarbij de preoperatieve status van de co-morbiditeiten waren weergegeven zijn meegenomen.
De remissie van diabetes mellitus type 2 werd gerapporteerd in acht studies, waarvan twee cohort studies met 18 patiënten ≥ 60 jaar met preoperatieve diabetes mellitus type 2 en 80 patiënten < 60 jaar en zes case-control studies met 182 patiënten ≥ 60 jaar en 235 patiënten < 60 jaar. Totaal hadden 112 patiënten (56%) in de ≥ 60 jaar groep versus 204 in de < 60 jaar groep (65%) remissie van diabetes. De odds ratio in de cohort studies was is het voordeel van de ≥ 60 jaar (OR 1,79 (95% BI 0,39 tot 8,27)), terwijl de odds ratio van de case-control studies een voordeel lieten zien voor de < 60 jaar groep (OR 0,64 (95% BI 0,42 tot 0,98) (figuur 2a).
Figuur 2a Uitkomstmaat remissie diabetes vergelijking ≥ 60 jaar versus < 60 jaar
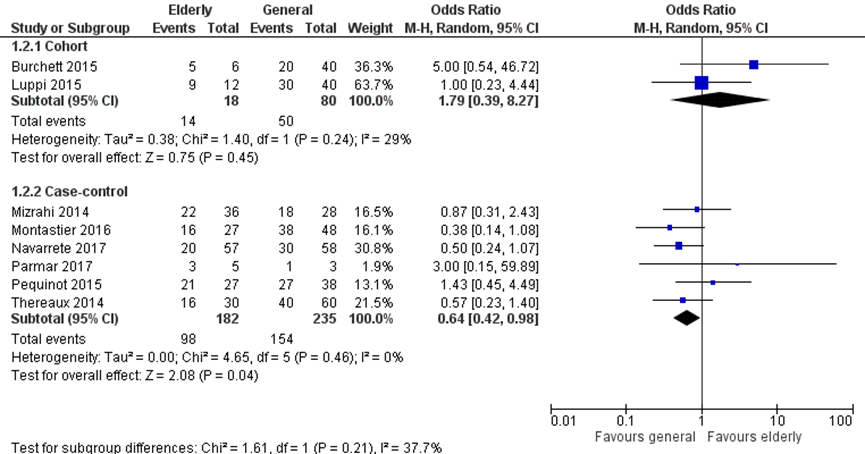
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
De remissie van hypertensie werd gerapporteerd in acht studies, waarvan twee cohort studies met 43 patiënten ≥ 60 jaar met preoperatieve hypertensie en 129 patiënten < 60 jaar en zes case-control studies met 212 patiënten ≥ 60 jaar en 262 patiënten < 60 jaar. Totaal hadden 118 patiënten (46%) in de ≥ 60 jaar groep versus 205 in de < 60 jaar groep (52%) remissie van hypertensie. De odds ratio in de cohort studies was is het voordeel van de ≥ 60 jaar (OR 2,19 (95% BI 1,00 tot 4,80)), terwijl de odds ratio van de case-control studies een voordeel lieten zien voor de < 60 jaar groep (OR 0,65 (95% BI 0,30 tot 1,40)(figuur 2b).
Figuur 2b Uitkomstmaat remissie hypertensie vergelijking ≥ 60 jaar versus < 60 jaar
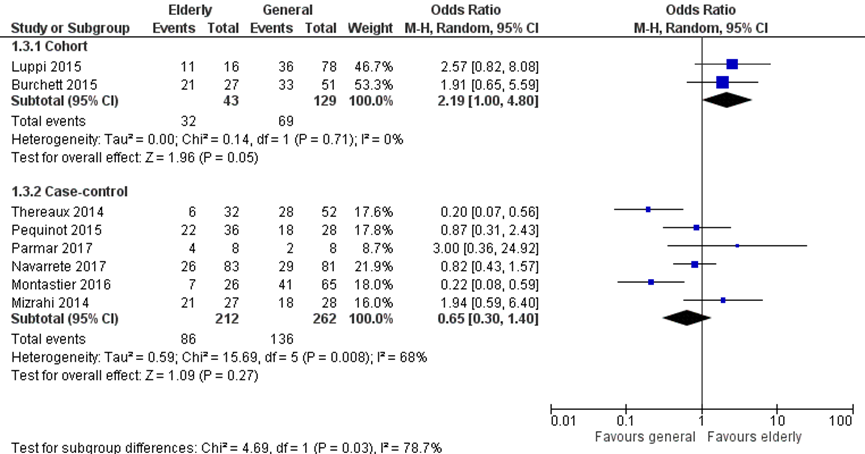
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
De remissie van dyslipidemie werd gerapporteerd in zes studies, waarvan twee cohort studies met 29 patiënten ≥ 60 jaar met preoperatieve dyslipidemie en 118 patiënten < 60 jaar en vier case-control studies met 149 patiënten ≥ 60 jaar en 137 patiënten < 60 jaar. Totaal hadden 80 patiënten (54%) in de ≥ 60 jaar groep versus 138 in de < 60 jaar groep (54%) remissie van dyslipidemie. De odds ratio in de cohort studies was is het voordeel van de ≥ 60 jaar (OR 2,06 (95% BI 0,57 tot 7,47)), terwijl de odds ratio van de case-control studies een voordeel lieten zien voor de < 60 jaar groep (OR 0,43 (95% BI 0,23 tot 0,83) (figuur 2c).
Figuur 2c Uitkomstmaat remissie dyslipidemie vergelijking ≥ 60 jaar versus < 60 jaar
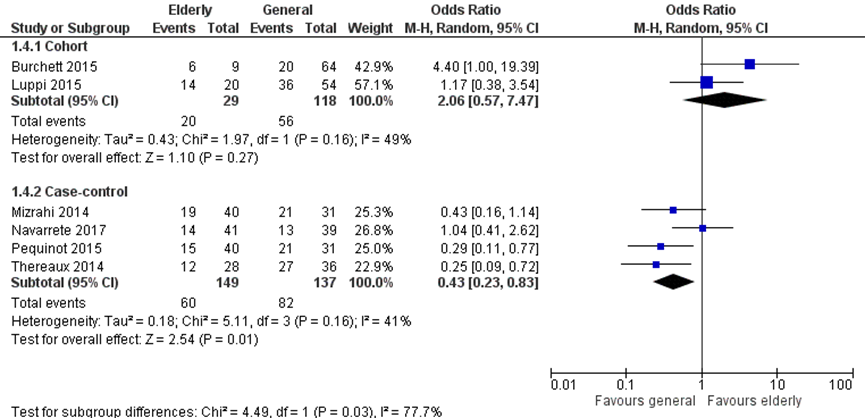
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
De remissie van OSAS werd gerapporteerd in zes studies, waarvan twee cohort studies met 27 patiënten ≥ 60 jaar met preoperatieve hypertensie en 105 patiënten < 60 jaar en vier case-control studies met 114 patiënten ≥ 60 jaar en 157 patiënten < 60 jaar. Totaal hadden 88 patiënten (62%) in de ≥60 jaar groep versus 182 in de < 60 jaar groep (69%) remissie van OSAS. De odds ratio in de cohort studies was is 0,56 (95% BI 0,22 tot 1,43) en odds ratio van de case-control studies was 0,40 (95% BI 0,22 tot 0,71), beiden in het voordeel van de < 60 jaar groep (figuur 2d).
Figuur 2d Uitkomstmaat remissie OSAS vergelijking ≥ 60 jaar versus < 60 jaar
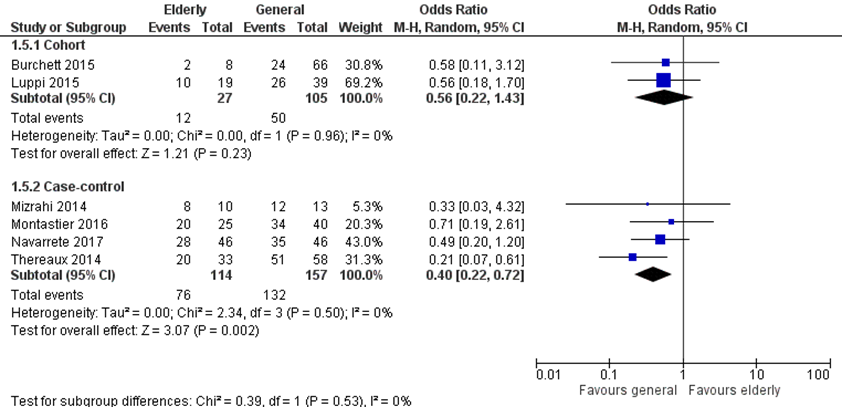
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat remissie van co-morbiditeiten is gebaseerd op niet-gerandomiseerd vergelijkend onderzoek en start derhalve laag. De bewijskracht is verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet zoals het niet corrigeren voor mogelijke confounding of overmatchen (risk of bias), zowel klinische (verschillende follow-up, verschillende leeftijdsgrenzen als afkapwaardes en verschillende chirurgische technieken) als statistische heterogeniteit tussen de studies (inconsistentie) en gering aantal events (imprecisie).
1.3. Uitkomstmaat Complicaties (cruciaal)
Het aantal complicaties werd gerapporteerd in 13 studies, waarvan 7 cohort studies met 4.538 patiënten ≥ 60 jaar en 95.001 patiënten < 60 jaar en 6 case-control studies met 292 patiënten ≥ 60 jaar en 523 patiënten < 60 jaar. Totaal hadden 372 patiënten (7,7%) in de ≥ 60 jaar groep versus 5796 in de < 60 jaar groep (6,1%) complicaties (OR cohort 1,34 (95% BI 1,04 tot 1,74) en OR case-control 1,37 (95% BI 0,55 tot 3,40)) (figuur 3).
Figuur 3 Uitkomstmaat complicaties vergelijking ≥ 60 jaar versus < 60 jaar
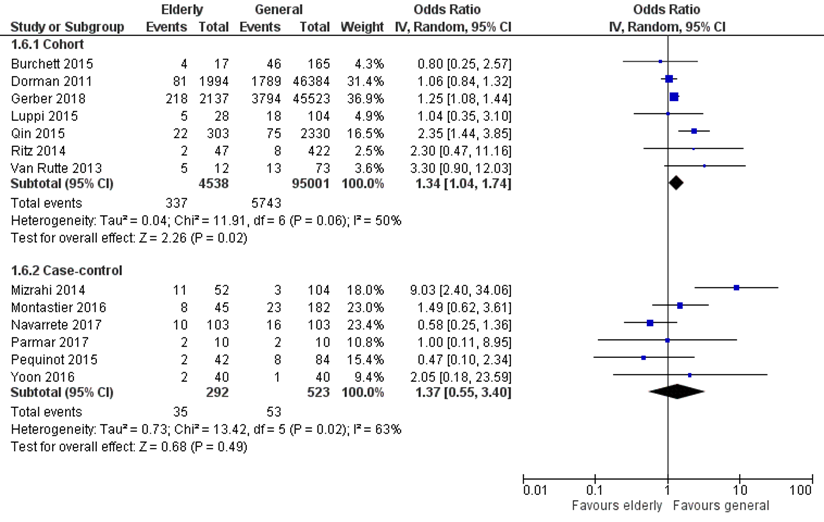
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties is gebaseerd op niet-gerandomiseerd vergelijkend onderzoek en start derhalve laag. De bewijskracht is verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet zoals het niet corrigeren voor mogelijke confounding of overmatchen (risk of bias) en zowel klinische (verschillende follow-up, verschillende leeftijdsgrenzen als afkapwaardes en verschillende chirurgische technieken) als statistische heterogeniteit tussen de studies (inconsistentie).
1.4. Uitkomstmaat Mortaliteit (cruciaal)
Mortaliteit werd gerapporteerd in 14 studies, waarvan 9 cohort studies met 5.069 patiënten ≥ 60 jaar en 105.909 patiënten < 60 jaar en 5 case-control studies met 255 patiënten ≥ 60 jaar en 385 patiënten < 60 jaar. Totaal overleden 41 patiënten (0,8%) in de ≥ 60 jaar groep versus 197 in de < 60 jaar groep (0,2%). Er was geen risicoverschil tussen beiden groepen (figuur 4).
Figuur 4 Uitkomstmaat mortaliteit vergelijking ≥ 60 jaar versus < 60 jaar
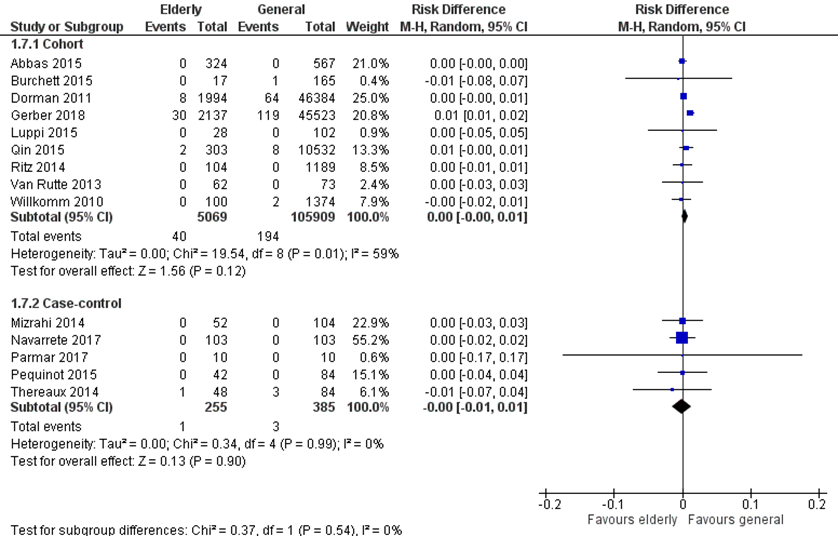
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op niet-gerandomiseerd vergelijkend onderzoek en start derhalve laag. De bewijskracht is verlaagd naar zeer laag gezien beperkingen in de onderzoeksopzet zoals het niet corrigeren voor mogelijke confounding of overmatchen (risk of bias), klinische heterogeniteit tussen de studies (verschillende follow-up, verschillende leeftijdsgrenzen als afkapwaardes en verschillende chirurgische technieken) (inconsistentie) en gering aantal events (imprecisie).
1.5. Uitkomstmaat Kwaliteit van leven (Belangrijk)
Geen van de geïncludeerde studies rapporteerden over kwaliteit van leven.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven kon niet worden beoordeeld, omdat er geen studies was die deze uitkomstmaat rapporteerden.
1.6. Uitkomstmaat Levensverwachting (Belangrijk)
Geen van de geïncludeerde studies rapporteerden over de levensverwachting.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat levensverwachting kon niet worden beoordeeld, omdat er geen studies was die deze uitkomstmaat rapporteerden.
PICO 2
Er zijn geen studies gevonden die deze PICO beschreven.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Wat zijn de (on)gunstige effecten van metabole chirurgie bij ouderen (≥60 jaar) ten opzichte van patiënten jonger dan 60?
PICO 1
P: patiënten met een indicatie voor metabole chirurgie ouder dan 60 jaar;
I: metabole chirurgie ≥ 60 jaar;
C: metabole chirurgie < 60 jaar;
O: gewichtsverlies (uitgedrukt in % Total Body Weightloss of % Excess Weight Loss), morbiditeit/ complicaties, mortaliteit, kwaliteit van leven, levensverwachting.
Wat zijn de (on)gunstige effecten van metabole chirurgie bij ouderen ten opzichte van reguliere zorg (conservatieve behandeling)?
PICO 2
P: patiënten met een indicatie voor metabole chirurgie ouder dan 60 jaar;
I: metabole chirurgie;
C: conservatieve behandeling/ standaard zorg;
O: gewichtsverlies (uitgedrukt in % Total Body Weightloss of % Excess Weight Loss), morbiditeit/ complicaties, mortaliteit, kwaliteit van leven, levensverwachting.
Relevante uitkomstmaten
De werkgroep achtte effectiviteit van de ingreep (gewichtsverlies en vermindering van co-morbiditeit) en veiligheid (complicatierisico en mortaliteit) voor de besluitvorming cruciale uitkomstmaten en kwaliteit van leven en levensverwachting voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor geen van de uitkomstmaten klinisch (patiënt) relevante verschillen. We hanteerden daarom, indien van toepassing, de onderstaande grenzen voor klinische relevantie en vergeleken de resultaten met deze grenzen: RR < 0,75 of > 1,25) (GRADE-recommendation) of Standardized mean difference (SMD=0,2 (klein); SMD=0,5 (matig); SMD=0,8 (groot). De interpretatie van continue uitkomstmaten is sterk context gebonden en hiervoor werden a priori geen grenzen voor klinische relevantie benoemd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 3 juni 2018 met relevante zoektermen gezocht naar vergelijkende studies gepubliceerd vanaf 1995 die metabole chirurgie vergeleken met conservatieve behandeling/ standaard zorg of metabole chirurgie bij patiënten ≥ 60 vergeleken met metabole chirurgie bij patiënten < 60. In Nederland wordt een zachte leeftijdsgrens van 65 jaar aangehouden. De uitgangsvraag richt zich op metabole chirurgie boven de 65 jaar. In de internationale richtlijnen wordt vaak een bovengrens van 60 jaar gehanteerd voor metabole chirurgie. Veel studies zijn op die grens gebaseerd. Er is dan ook weinig literatuur die een vergelijking maakt tussen chirurgie boven en onder de 65 jaar maar wel boven en onder de 60 jaar. In die studies worden ook patiënten ouder dan 65 jaar meegenomen. Om die reden is de zoekvraag naar 60 jaar verruimd, nadat er bleek dat er te weinig literatuur beschikbaar was bij een leeftijdsgrens van 65 jaar.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 451 systematische reviews, 789 RCT’s en 1239 observationele studies op. Eerst werden systematische reviews en RCT’s geselecteerd op grond van de volgende selectiecriteria:
- vergelijking metabole chirurgie versus conservatieve/ standaard zorg bij patiënten ≥ 60 jaar;
- vergelijking metabole chirurgie bij patiënten ≥ 60 jaar vergeleken met metabole chirurgie bij patiënten < 60 jaar;
- vanaf 2008 gepubliceerd.
Vanwege het gebrek aan RCT’s die voldeden aan de inclusiecriteria zijn vervolgens ook observationele studies geselecteerd. Bij deze eerste selectie werd een review gevonden (Giordano, 2015) die alle studies includeerde met resultaten van patiënten die een metabole operatieve ingreep hadden ondergaan en 60 jaar of ouder waren, ongeacht het studiedesign. De zoekdatum van het review was augustus 2015, daarom zijn de observationele studies vanaf 2015 geselecteerd door de werkgroep. Studies die >10% patiënten includeerde met revisie chirurgie, biliopancreatic diversion met duodenal switch of maagband zonder de resultaten afzonderlijk te rapporteren zijn geëxcludeerd.
Op basis van titel en abstract werden in eerste instantie 67 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 56 geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en twee systematische reviews en negen aanvullende studies definitief geselecteerd.
Resultaten
Twee systematische reviews en negen aanvullende studies zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Centraal Bureau voor de Statistiek (CBS). Levensverwachting; geslacht, leeftijd (per jaar en periode van vijf jaren). https://opendata.cbs.nl/statline/#/CBS/nl/dataset/37360ned/table?dl=10917
- Chouillard E, Alsabah S, Chahine E, Saikaly E, Debs T, Kassir R. Changing the quality of life in old age bariatric patients. Cross-sectional study for 79 old age patients. Int J Surg. 2018 Jun;54(Pt A):236-241..
- Consensus, N. I. H. (1992). Gastrointestinal surgery for severe obesity: National Institutes of Health Consensus Development Conference Statement. Am J Clin Nutr. 1992 Feb;55(2 Suppl):615S-619S.
- Dorman RB, Abraham AA, Al-Refaie WB, Parsons HM, Ikramuddin S, Habermann EB. Bariatric surgery outcomes in the elderly: an ACS NSQIP study. J Gastrointest Surg. 2012 Jan;16(1):35-44; discussion 44.
- Felix HC, West DS. Effectiveness of weight loss interventions for obese older adults. American Journal of Health Promotion. 2013. 27(3), 191-199.
- Gerber P, Anderin C, Szabo E, Näslund I, Thorell A. Impact of age on risk of complications after gastric bypass: A cohort study from the Scandinavian Obesity Surgery Registry (SOReg). Surg Obes Relat Dis. 2018 Apr;14(4):437-442.
- Montastier E, Becouarn G, Bérard E, Guyonnet S, Topart P, Ritz P. Gastric Bypass in Older Patients: Complications, Weight Loss, and Resolution of Comorbidities at 2 Years in a Matched Controlled Study. Obes Surg. 2016 Aug;26(8):1806-13.
- Navarrete A, Corcelles R, Del Gobbo GD, Perez S, Vidal J, Lacy A. Sleeve gastrectomy in the elderly: A case-control study with long-term follow-up of 3 years. Surg Obes Relat Dis. 2017 Apr;13(4):575-580.
- Parmar C, Mahawar KK, Carr WRJ, Schroeder N, Balupuri S, Small PK. Bariatric Surgery in Septuagenarians: a Comparison with <60 Year Olds. Obes Surg. 2017 Dec;27(12):3165-3169.
- Prasad J, Vogels E, Dove JT, Wood C, Petrick AT, Parker DM. Is age a real or perceived discriminator for bariatric surgery? A long-term analysis of bariatric surgery in the elderly. Surg Obes Relat Dis. 2018 Dec 22. pii: S1550-7289(18)30491-X
- Qin C, Luo B, Aggarwal A, De Oliveira G, Kim JY. Advanced age as an independent predictor of perioperative risk after laparoscopic sleeve gastrectomy (LSG). Obes Surg. 2015 Mar;25(3):406-12.
- Sjöström L. Review of the key results from the Swedish Obese Subjects (SOS) trial - a prospective controlled intervention study of bariatric surgery. J Intern Med. 2013 Mar;273(3):219-34.
- Stichting DICA. JAARRAPPORTAGE DICA 2017 – REGISTRATIES. 2018
- Thereaux J, Poitou C, Barsamian C, Oppert JM, Czernichow S, Bouillot JL. Midterm outcomes of gastric bypass for elderly (aged ≥ 60 yr) patients: a comparative study. Surg Obes Relat Dis. 2015 Jul-Aug;11(4):836-41.
- Wang Y, Yi X, Li Q, Zhang J, Wang Z. The Effectiveness and Safety of Sleeve Gastrectomy in the Obese Elderly Patients: a Systematic Review and Meta-Analysis. Obes Surg. 2016 Dec;26(12):3023-3030. Review.
- Willkomm CM, Fisher TL, Barnes GS, Kennedy CI, Kuhn JA. Surgical weight loss >65 years old: is it worth the risk? Surg Obes Relat Dis. 2010 Sep-Oct;6(5):491-6.
- Yoon J, Sherman J, Argiroff A, Chin E, Herron D, Inabnet W, Kini S, Nguyen S. Laparoscopic Sleeve Gastrectomy and Gastric Bypass for The Aging Population. Obes Surg. 2016 Nov;26(11):2611-2615.
Evidence tabellen
Evidence table for systematic review of RCTs and observational studies (intervention studies)
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Felix, 2013 |
SR and meta-analysis of RCTs
Literature search up to July 2010
Setting and Country: USA
Source of funding: Not reported
|
Inclusion criteria SR: Studies examining weight loss strategies were restricted to RCTs examining behavioral/ lifestyle and pharmaceutical weight loss strategies that had a follow-up period of at least 1 year and either targeted only older adults (aged ≥60 years), reported study results for older adults (aged 60–85 years) separately, or had a mean age of study population of ≥60 years.Because of ethical considerations in conducting weight loss surgery RCTs, the review of studies examining surgical weight loss strategies included those with quasi-experimental designs targeting older adults or including older adults in the study population. Only English-language studies were included.
Exclusion criteria SR: - 10 studies included in the SR, but the literature search for studies of bariatric surgery among older adults (≥60 years) did not identify any RCTs. |
N/A |
N/A |
N/A
|
N/A
|
- |
|
Wang, 2016
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of cohort/ case-control studies
Literature search up to June 2016
A: Pequinot 2015 B: Burchett 2015 C: Luppi 2015 D: Mizrahi 2014 E: Ritz 2014* F: van Rutte 2013 G: Abbas 2015*
Study design*: A: Case-control B: Cohort C: Cohort D: Case-control E: Cohort F: Cohort G: Cohort
Setting and Country: China
Source of funding: non-commercial |
Inclusion criteria SR: Cohort studies that reported the effectiveness and safety of SG in the obese elderly patients and compared with the young ones were included. Patients with morbid obesity, defined as a BMI >40 kg/m2 or a BMI between 35 and 40 kg/m2 with obesity-related comorbidities, were potential candidates.
Exclusion criteria SR: data were unavailable, overlapping population, animal experiment, reviews, or case reports.
11 studies included, of whom 7 studies fulfilled the inclusion criteria of the literature summary. Abbas, 2015 and Ritz, 2014 also included patients with RYGB. Results of these study are extracted from the individual study.
Important patient characteristics at baseline:
Number of patients (I/C) A: 42/ 84 B: 17/165 C: 28/ 102 D: 52/ 104 E: SG: 47/ 422 RYGB: 57/ 767 F: I1: 50/ I2: 12 /C: 73 G: 30 (LSG), 53 (LRYGB)/ 294 (LSG, 514 (LRYGB)
BMI A: 46.7/ 46.8 B: 45/ 46 C: 43.3/ 45.8 D: 42.6/ 42.6 E: >35/ >35 F: 44.2/ 43.8 G: >35/ >35
Groups comparable at baseline? Yes |
Describe intervention: Bariatric surgery (mean) age:
Sleeve gastrectomy A: 62 B: ≥62 C: 63.2 D: 62.9 F: I1: 60-64 I2: ≥65
Sleeve gastrectomy or RYGB* E: >60 G: 63.4I
|
Describe control: Bariatric surgery (mean) age:
Sleeve gastrectomy A: 41.3 B: <62 C: 45.2 D: 35.7 F: 57
Sleeve gastrectomy or RYGB* E: <59 G: 22-59
|
End-point of follow-up*:
A: 2 years B: mean 1 year C: 2 years D: 22±1.4 months E:1 year F: 14.6 months G: 1 year
For how many participants were no complete outcome data available?* (intervention/control) A: only patients with full follow-up were included B: 46%/ 20% at 1 year, 66%/ 36% at 2 years/ 77/ 55 at 3 years C: 18%/ 25% at 1 year D: 46%/ 46% at 2 years E: only patients with full follow-up were included F: not reported G: 40%/ 21%
|
Outcome measure-1 % Excess Weight Loss (mean) A: 51.8%/ 73.5%, p=<0.01(2y) B: 44% (SD 25)/ 44 (SD 21) (1y) C: 45%/ 60%, p=0.012 (2y) D: 62% (SD 3.06) (17m)/ 75% (SD 2.46) (22m) F: 52.2% (SD 14.4)/ 59.9% (SD 14.9)/ 55.2% (SD 17.8) (last FUP)
LSG+RYGB* E: NR G: 65.2% SD 25.6/ ?
Outcome measure-2 Complications % A: 2 of the 42/ 8 of the 84 B: 4 of the 17/ 46 of the 165 C: 5 of the 28/ 18 of the 104 D: 11 of the 52/ 3 of the 104 (<30d) F: 12 of the 50/ 5 of the 12/ 13 of the 73*
LSG+RYGB* E: LSG: 2 of the 47/ 8 of the 422 RYGB: 7 of the 57/ 37 of the 767 G: 8/ 44
Outcome measure-3 Resolution of co-morbidity
Defined as resolution of DM2 A: 21 of the 27/ 27 of the 38 B: 5 of the 6/ 20 of the 40 C: 9 of the 12/ 30 of the 40 D:26 of the 31/ 15 of the 19 E: NR F: NR G: NR for both groups
Defined as resolution of hypertension A: 21 of the 27/ 30 of the 39 B: 11 of the 16/ 36 of the 78 C: 21 of the 27/ 33 of the 51 D:22 of the 36/ 18 of the 28 E: NR F: NR G: NR for both groups
Defined as resolution of dyslipidaemia A: 15 of the 18/ 25 of the 34 B: 6 of the 9/ 20 of the 64 C: 14 of the 20/ 36 of the 54 D:19 of the 40/ 21 of the 31 E: NR F: NR G: NR for both groups
Defined as resolution of OSAS A: NR B: 2 of the 8/ 24 of the 66 C: 10 of the 19/ 26 of the 39 D: 8 of the 10/ 12 of the 13 E: NR F: NR G: NR for both groups
Outcome measure-4 Operative mortality in % A: 0/ 0 B: 0/ 0.61% (90 days mortality) C: 0/ 0 D: 0/ 0 E: 0/ 0/ 0 F: 0/ 0/ 0 G: 0/ 0
Outcome measure 5- Quality of life Not reported
Outcome measure 6- Life expectancy Not reported |
Author’s conclusion Bariatric surgery can be safe and effective for patients older than 60 years of age with a low morbidity and mortality; the weight loss and improvement in comorbidities in older patients were clinically significant. When compared to the general population, there was no statistically significant difference in the average %EWL at 12 months or the number of complications due to surgery. Long-term effects of such interventions will need further studies and investigations.
Level of evidence: GRADE not reported
*Results extracted from the original study |
Evidence table for intervention studies
Table of quality assessment for systematic reviews of RCTs and observational studies
|
Study
First author, year |
Appropriate and clearly focused question?
Yes/no/ unclear |
Comprehensive and systematic literature search?
Yes/no/ unclear |
Description of included and excluded studies?
Yes/no/unclear |
Description of relevant characteristics of included studies?
Yes/no/ unclear |
Appropriate adjustment for potential confounders in observational studies? Yes/no/ unclear/not applicable |
Assessment of scientific quality of included studies?
Yes/no/ unclear |
Enough similarities between studies to make combining them reasonable?
Yes/no/ unclear |
Potential risk of publication bias taken into account?
Yes/no/ unclear |
Potential conflicts of interest reported?
Yes/no/ unclear |
|
Felix, 2013 |
Yes |
Yes |
No |
Yes |
N/A |
No |
N/A |
N/A |
No |
|
Wang, 2016 |
Yes |
Yes |
Yes (supplemental file) |
Yes |
No |
Yes |
Yes |
Yes |
Yes |
Risk of bias table for intervention studies (observational: non-randomized clinical trials, cohort and case-control studies)
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Navarette, 2017 |
Likely* |
Unlikely |
Unlikely |
Likely |
|
Gerber, 2018 |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Montastier, 2016 |
Unlikely |
Unclear |
Unlikely |
Unlikely |
|
Thereaux, 2014 |
Likely* |
Unclear |
Unlikely |
Likely |
|
Willkomm, 2009 |
Likely |
Likely |
Unlikely |
Likely |
|
Parmar, 2017 |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Yoon, 2016 |
Likely* |
Unlikely |
Unlikely |
Likely |
|
Qin, 2015 |
Likely |
Unclear |
Unlikely |
Likely |
|
Dorman, 2011 |
Unlikely |
Unclear |
Unlikely |
Unlikely |
*Overmatching may have occurred due to matching on colliders
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gonzalez-Heredia 2015 |
55 als leeftijdsgrens |
|
Keren 2015 |
58 als leeftijdsgrens |
|
Leivonen 2011 |
58 als leeftijdsgrens |
|
Nagao 2014 |
55 als leeftijdsgrens |
|
Robert 2014 |
38% is re-do, resultaten niet uitgesplitst |
|
Marihart 2016 |
Self-reported vragenlijst |
|
Perez Quirante 2017 |
6,4% is re-do en 4,7% gastric band, resultaten niet uitgesplitst |
|
Giordano 2015 |
Geen vergelijking gemaakt, alleen resultaten van 60+ gerapporteerd search augustus 2015 |
|
Chow 2016 |
Geen vergelijking gemaakt, alleen resultaten van 65+ gerapporteerd |
|
Marihart 2014 |
Geen echt SR, geen zoekdatum, zoekstrategie of kwaliteitsbeoordeling |
|
Mathus-Vliegen 2012 |
Geen originele studie of SR |
|
Clough 2011 |
Geen vergelijkende studie, beschrijft alleen resultaten 60+ |
|
Hauser 2010 |
Geen vergelijkende studie, beschrijft alleen resultaten "ouderen" met gem. leeftijd 52 |
|
Eisenberg 2009 |
Geen originele studie of SR |
|
Miller 2008 |
Geen originele studie of SR |
|
Pajecki 2015 |
Geen vergelijkende studie, beschrijft alleen resultaten ouderen |
|
Perry 2016 |
Maagbanden |
|
Fischer 2015 |
Studie protocol |
|
Spanakis 2009 |
Geen originele studie of SR |
|
Gagner 2016 |
Geen originele studie of SR |
|
Ikramuddin 2015 |
Voldoet niet aan PICO: wordt niet specifiek bij ouderen gekeken (30-67 jaar) |
|
Khidir 2018 |
Geen controle groep |
|
Gray 2018 |
Voldoet niet aan PICO: LSG vergeleken met LRYGB |
|
Giodano 2018 |
Individuele studies uit review geïncludeerd vanwege ontbreken risk of bias assessment |
|
Batsis 2018 |
Geen SR of originele studie |
|
Cazzo 2017 |
Geen SR maar narrative review |
|
Moon 2016 |
Voldoet niet aan PICO: vergelijking verschillende technieken |
|
Rothberg 2015 |
Geen SR of originele studie |
|
Nassif 2015 |
Geen SR of originele studie |
|
Huang 2015 |
Voldoet niet aan PICO: vergelijking verschillende technieken |
|
Cacares 2014 |
Includeert ook niet-vergelijkende studies en maagbanden, referenties nagelopen |
|
Musella 2014 |
Voldoet niet aan PICO: vergelijking verschillende technieken |
|
Cetin 2014 |
Geen SR of originele studie |
|
Cacares 2014 |
Geen SR of originele studie |
|
Soto 2013 |
Geen vergelijkende studie |
|
Verdam 2012 |
Geen SR of originele studie |
|
Ramirez 2012 |
Voldoet niet aan PICO: geen controle groep |
|
Tucker 2008 |
Voldoet niet aan PICO: geen controle groep |
|
Ovdat 2017 |
Abstract conferentie |
|
Morgan 2017 |
55 als leeftijdsgrens |
|
Zaveri 2016 |
Voldoet niet aan PICO: vergelijking verschillende technieken |
|
Michaud 2016 |
Biliopancreatic Diversion met Duodenal Switch wordt niet meer gedaan in Nederland |
|
Davidson 2016 |
55 als leeftijdsgrens |
|
McGlone 2015 |
Voldoet niet aan PICO: BMI <50> vergeleken |
|
Leslie 2012 |
17,4% maagmand, resultaten niet uitgesplitst |
|
Mittermair 2008 |
Maagbanden |
|
Burgos 2008 |
Spaanstalig |
|
Kim 2014 |
Niet specifiek voor oudere populatie |
|
Ji 2014 |
Niet specifiek voor oudere populatie |
|
Nakamura 2016 |
Niet specifiek voor oudere populatie |
|
Gorgojo-Martinez 2016 |
Niet specifiek voor oudere populatie |
|
Reijntjes 2015 |
Bredere PICO, referenties nagelopen |
|
Lainas 2018 |
Geen vergelijkende studie |
|
Nor Hanipah 2018 |
Geen vergelijkende studie |
|
Haskins 2018 |
Oudste leeftijdsgroep 56+ |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 28-10-2020
Beoordeeld op geldigheid : 28-10-2020
Voor het beoordelen van de actualiteit van deze richtlijn is de werkgroep niet in stand gehouden. Uiterlijk in 2025 bepaalt het bestuur van de Nederlandse Vereniging voor Heelkunde of de modules van deze richtlijn nog actueel zijn. Op modulair niveau is een onderhoudsplan beschreven. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt over de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening (update). De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
|
Module1 |
Regiehouder(s)2 |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn3 |
Frequentie van beoordeling op actualiteit4 |
Wie houdt er toezicht op actualiteit5 |
Relevante factoren voor wijzigingen in aanbeveling6 |
|
Indicatiestelling ouderen |
NVvH |
2020 |
2025 |
1x per 5 jaar |
NVvH |
nvt |
|
[1] Naam van de module 2 Regiehouder van de module (deze kan verschillen per module en kan ook verdeeld zijn over meerdere regiehouders) 3 Maximaal na vijf jaar 4 (half)Jaarlijks, eens in twee jaar, eens in vijf jaar 5 Regievoerende vereniging, gedeelde regievoerende verenigingen, of (multidisciplinaire) werkgroep die in stand blijft 6 Lopend onderzoek, wijzigingen in vergoeding/organisatie, beschikbaarheid nieuwe middelen |
||||||
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
PubMed 3 jun 2018
#4 = SR’s (442)
#6 = RCT’s (715)
#8 = Epidemiologische studies (1631)
|
Search |
Query |
Items found |
|
#8 |
(#7 NOT (#5 OR #4)) |
1631 |
|
#7 |
(#3 AND (("Epidemiologic Studies"(Mesh) OR "Prognosis"(Mesh) OR cohort(tiab) OR (case(tiab) AND (control(tiab) OR controll*(tiab) OR comparison(tiab) OR referent(tiab))) OR risk(tiab) OR causation(tiab) OR causal(tiab) OR "odds ratio"(tiab) OR etiol*(tiab) OR aetiol*(tiab) OR "natural history"(tiab) OR predict*(tiab) OR prognos*(tiab) OR outcome(tiab) OR course(tiab) OR retrospect*(tiab) OR follow up(tiab) OR followup(tiab) OR prognos*(tiab)))) |
2639 |
|
#6 |
(#5 NOT #4) |
715 |
|
#5 |
(#3 AND (("Randomized Controlled Trial"(Publication Type) OR "Controlled Clinical Trial"(Publication Type) OR random*(tiab) OR placebo(tiab) OR "Drug Therapy"(Subheading) OR trial(tiab) OR groups(tiab)))) |
813 |
|
#4 |
(#3 AND (((review(tiab) OR "Review"(Publication Type) OR "Meta-Analysis as Topic"(Mesh) OR meta-analysis(tiab) OR "Meta-Analysis "(Publication Type)) NOT ("Letter"(Publication Type) OR "Editorial"(Publication Type) OR "Comment"(Publication Type))))) |
442 |
|
#3 |
(#1 AND #2 NOT ("Animals"(Mesh) NOT "Humans"(Mesh)) AND ("1995"(Date - Entrez) : "3000"(Date - Entrez)))) |
3205 |
|
#2 |
"Aged"(Mesh) OR "Aged, 80 and over"(Mesh) OR "Frail Elderly"(Mesh) OR "Geriatrics"(Mesh) OR "Geriatric Psychiatry"(Mesh) OR elder*(ti) OR eldest(ti) OR frail*(ti) OR geriatri*(ti) OR old age*(ti) OR oldest old*(ti) OR senior*(ti) OR senium(ti) OR very old*(ti) OR septuagenarian*(ti) OR octagenarian*(ti) OR octogenarian*(ti) OR nonagenarian*(ti) OR centarian*(ti) OR centenarian*(ti) OR supercentenarian*(ti) OR older people(ti) OR older subject*(ti) OR older patient*(ti) OR older age*(ti) OR older adult*(ti) OR older man(ti) OR older men(ti) OR older male*(ti) OR older woman(ti) OR older women(ti) OR older female*(ti) OR older population*(ti) OR older person*(ti) OR elder*(ot) OR eldest(ot) OR frail*(ot) OR geriatri*(ot) OR old age*(ot) OR oldest old*(ot) OR senior*(ot) OR senium(ot) OR very old*(ot) OR septuagenarian*(ot) OR octagenarian*(ot) OR octogenarian*(ot) OR nonagenarian*(ot) OR centarian*(ot) OR centenarian*(ot) OR supercentenarian*(ot) OR older people(ot) OR older subject*(ot) OR older patient*(ot) OR older age*(ot) OR older adult*(ot) OR older man(ot) OR older men(ot) OR older male*(ot) OR older woman(ot) OR older women(ot) OR older female*(ot) OR older population*(ot) OR older person*(ot) |
2868879 |
|
#1 |
("Bariatric Surgery"(Mesh) OR bariatric surg*(ti) OR metabolic surg*(ti) OR stomach stapl*(ti) OR gastric bypass*(ti) OR roux en y*(ti) OR gastroileal bypass*(ti) OR gastrojejunostom*(ti) OR gastroplast*(ti) OR jejunoileal bypass*(ti) OR jejuno ileal bypass*(ti) OR ileojejunal bypass*(ti) OR intestinal bypass*(ti) OR weight loss surg*(ti) OR gastric sleev*(ti) OR sleeve gastrectom*(ti) OR gastric band*(ti) OR bariatric surg*(ot) OR metabolic surg*(ot) OR stomach stapl*(ot) OR gastric bypass*(ot) OR roux en y*(ot) OR gastroileal bypass*(ot) OR gastrojejunostom*(ot) OR gastroplast*(ot) OR jejunoileal bypass*(ot) OR jejuno ileal bypass*(ot) OR ileojejunal bypass*(ot) OR intestinal bypass*(ot) OR weight loss surg*(ot) OR gastric sleev*(ot) OR sleeve gastrectom*(ot) OR gastric band*(ot)) |
28171 |
Embase.com 3 jun 2018
#6 = SR’s (42)
#8 = RCT’s (13)
#10 = Epidemiologische studies (56)
|
No. |
Query |
Results |
|
#10 |
#9 NOT (#7 OR #6) |
56 |
|
#9 |
#5 AND ((cohort:ti,ab,kw OR (case:ti,ab,kw AND (control:ti,ab,kw OR controll*:ti,ab,kw OR comparison:ti,ab,kw OR referent:ti,ab,kw)) OR risk:ti,ab,kw OR causation:ti,ab,kw OR causal:ti,ab,kw OR 'odds ratio':ti,ab,kw OR etiol*:ti,ab,kw OR aetiol*:ti,ab,kw OR 'natural history':ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw OR outcome:ti,ab,kw OR course:ti,ab,kw OR retrospect*:ti,ab,kw OR 'epidemiology'/de OR follow) AND up:ti,ab,kw OR followup:ti,ab,kw OR predict*:ti,ab,kw OR prognos*:ti,ab,kw) |
79 |
|
#8 |
#7 NOT #6 |
13 |
|
#7 |
#5 AND ('clinical':ti,ab,kw AND 'trial':ti,ab,kw OR 'clinical trial'/exp OR random*:ti,ab,kw) |
18 |
|
#6 |
#5 AND ('meta-analysis':ti,ab,kw OR 'meta analysis'/exp OR 'review'/exp OR review:ti,ab,kw) |
42 |
|
#5 |
#4 NOT ('conference abstract'/it OR 'conference paper'/it OR 'letter'/it OR 'note'/it) |
190 |
|
#4 |
#3 NOT ((animals)/lim NOT (humans)/lim) AND (1-1-1995)/sd |
294 |
|
#3 |
#1 AND #2 |
299 |
|
#2 |
'aged'/exp/mj OR 'geriatrics'/exp/mj OR 'elderly care'/exp/mj OR elder*:de,ti,kw OR eldest:de,ti,kw OR frail*:de,ti,kw OR geriatri*:de,ti,kw OR ((old NEXT/1 age*):de,ti,kw) OR ((oldest NEXT/1 old*):de,ti,kw) OR senior*:de,ti,kw OR senium:de,ti,kw OR ((very NEXT/1 old*):de,ti,kw) OR septuagenarian*:de,ti,kw OR octagenarian*:de,ti,kw OR octogenarian*:de,ti,kw OR nonagenarian*:de,ti,kw OR centarian*:de,ti,kw OR centenarian*:de,ti,kw OR supercentenarian*:de,ti,kw OR 'older people':de,ti,kw OR ((older NEXT/1 subject*):de,ti,kw) OR ((older NEXT/1 patient*):de,ti,kw) OR ((older NEXT/1 age*):de,ti,kw) OR ((older NEXT/1 adult*):de,ti,kw) OR 'older man':de,ti,kw OR 'older men':de,ti,kw OR 'older male*':de,ti,kw OR 'older woman':de,ti,kw OR 'older women':de,ti,kw OR 'older female*':de,ti,kw OR ((older NEXT/1 population*):de,ti,kw) OR ((olderNEXT/1 person*):de,ti,kw) |
485043 |
|
#1 |
'bariatric surgery'/exp/mj OR 'roux y anastomosis'/exp/mj OR 'gastrojejunostomy'/exp/mj OR 'gastroplasty'/exp/mj OR 'weight loss surgery'/exp/mj OR 'bariatric surg*':ti,kw OR 'metabolic surg*':ti,kw OR 'stomach stapl*':ti,kw OR 'gastric bypass*':ti,kw OR 'roux en y':ti,kw OR 'roux en ys':ti,kw OR 'gastroileal bypass*':ti,kw OR gastrojejunostom*:ti,kw OR gastroplast*:ti,kw OR 'jejunoileal bypass*':ti,kw OR 'jejuno ileal bypass*':ti,kw OR 'ileojejunal bypass*':ti,kw OR 'intestinal bypass*':ti,kw OR 'weight loss surg*':ti,kw OR 'gastric sleev*':ti,kw OR 'sleeve gastrectom*':ti,kw OR 'gastric band*':ti,kw |
38214 |
Wiley/Cochrane Library 3 jun 2018
|
ID |
Search |
Hits |
|
#1 |
("bariatric surg*" or "metabolic surg*" or "stomach stapl*" or "gastric bypass*" or "roux en y" or "roux en ys" or "gastroileal bypass*" or gastrojejunostom* or gastroplast* or "jejunoileal bypass*" or "jejuno ileal bypass*" or "ileojejunal bypass*" or "intestinal bypass*" or "weight loss surg*" or "gastric sleev*" or "sleeve gastrectom*" or "gastric band*"):ti,ab,kw |
3181 |
|
#2 |
(elder* or eldest or frail* or geriatri* or (old and age*) or (oldest and old*) or senior* or senium or (very and old*) or septuagenarian* or octagenarian* or octogenarian* or nonagenarian* or centarian* or centenarian* or supercentenarian* or "older people" or (older and subject*) or (older and patient*) or (older and age*) or (older and adult*) or "older man" or "older men" or "older male*" or "older woman" or "older women" or "older female*" or (older and population*) or (older and person*)):ti,ab,kw |
75713 |
|
#3 |
#1 and #2 Publication Year from 1995 |
78 |
CENTRAL: 78.
