Indicatiestelling patiënten met diabetes mellitus type 2
Uitgangsvraag
Welke patiënten met diabetes mellitus type 2 komen in aanmerking voor metabole chirurgie?
Aanbeveling
Overweeg te verwijzen voor metabole chirurgie bij patiënten een slecht gereguleerde diabetes mellitus ondanks maximale behandeling door een internist en een BMI tussen de 30 en 35 kg/m2.
Overweeg te verwijzen voor metabole chirurgie bij patiënten met een goed gereguleerde diabetes mellitus type 2 en een BMI tussen de 35 en 40 kg/m2.
Adviseer te verwijzen voor metabole chirurgie bij patiënten met een slecht gereguleerde diabetes mellitus type 2 en een BMI tussen de 35 en 40 kg/m2.
Adviseer nadrukkelijk te verwijzen voor metabole chirurgie bij patiënten met diabetes mellitus type 2 en een BMI > 40 kg/m2, ook als de diabetes goed gereguleerd is.
Overwegingen
De onderstaande overwegingen en aanbevelingen gelden voor het overgrote deel van de populatie waarop de uitgangsvraag betrekking heeft.
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In vijf verschillende kleine gerandomiseerde studies wordt het effect van metabole chirurgie beschreven in vergelijking met intensieve medicamenteuze therapie. Op het niveau van controle van de diabetes (HbA1c % en het aantal patiënten met een HbA1c < 7%) is er mogelijk een groot klinisch relevant effect in het voordeel van metabole chirurgie op zowel de korte als de lange termijn (5 jaar). Deze studies tonen tevens een mogelijk groot klinisch relevant effect op volledige en partiele remissie van diabetes (NNT 3,7) tot en met 5 jaar follow-up.
Tot 2 jaar follow-up is er ook mogelijk een klinisch relevant effect op kwaliteit van leven, maar in verband met ontbreken van bruikbare RCT’s met een langere follow-up blijft het onzeker of metabole chirurgie ook leidt tot een verbeterde kwaliteit van leven op langere termijn. In een uitgebreid review van de beschikbare literatuur inclusief observationeel onderzoek, zet Tsilingiris uiteen dat de kwaliteit van leven na metabole chirurgie in ieder geval niet slechter wordt in vergelijking met conservatieve therapie (Tsilingiris, 2019).
Op basis van de geïncludeerde RCT’s is het zeer onzeker of metabole chirurgie resulteert in meer behandelcomplicaties (direct operatie gerelateerd en langere termijn metabool, zoals nutriënt tekorten en vorming van galstenen) en in reductie van diabetes gerelateerde complicaties ten opzichte van optimale conservatieve behandeling. Het aantal complicaties in de studies, zowel diabetes-gerelateerd als chirurgisch-gerelateerd was zo gering dat de onderbouwing van die conclusie zwak is. Echter, studies waarin patiënten met BMI klassen breder dan 30-35 kg/m2 werden geïncludeerd laten een gunstig verband zien van metabole chirurgie op de afname van diabetes gerelateerde microvasculaire complicaties, zoals neuropathie, nefropathie en retinopathie (Arterburn, 2020). Zo rapporteerde een meta-analyse van 3 RCT’s en 7 observationele studies met een follow-up van minstens 1 jaar en 17.532 patiënten dat metabole chirurgie de incidentie van deze complicaties verlaagde (OR 0,26; 95% BI 0,16 tot 0,42) (Billeter, 2018). Een andere systematische review includeerde 7 observationele studies met minstens 5 jaar follow-up en 29.026 patiënten. De incidentie van macrovasculaire complicaties was lager in de metabole chirurgie groep vergeleken met de standaard behandeling (RR 0,52; 95% BI 0,44 tot 0,61), net als de mortaliteit (RR 0,21; 95% BI 0,20 tot 0,22) (Sheng, 2017). Het is aannemelijk dat deze positieve effecten ook gelden voor patiënten in de BMI <35 kg/m2.
De bewijskracht voor de meeste uitkomstmaten is laag vanwege het risico op bias in studies en het relatief geringe aantal patiënten in de studies. Daar tegenover staat dat de positieve effecten in alle studies worden bevestigd en in geen enkele studie worden verworpen. Met name de uitkomstmaat HbA1c % laat bovendien een dermate groot klinisch relevant verschil zien (ook op de lange termijn) dat een omgekeerd effect bij grotere groepen niet waarschijnlijk lijkt. Onafhankelijk van het al dan niet voortduren van de partiële of volledige remissie van diabetes, is in observationeel onderzoek naar lange termijn resultaten van metabole chirurgie bij herhaling de bevinding beschreven dat diabetes gerelateerde complicaties significant minder voorkomen na metabole chirurgie en dat de overleving van patiënten significant verbetert ten opzichte van conservatief behandelde patiënten. (Adams, 2007; Adams, 2012; Mingrone, 2015; Sjöström, 2014; Syn, 2021)
Afgezien van gezondheidswinst en winst in levensjaren, is dat ook gezondheid economisch voordelig.
Hoewel zoals gezegd er tekortkomingen in de bewijskracht zijn doordat het een gering aantal kleinere studies betreft en er bijv. geen intention-to-treat analyse heeft plaats gevonden komen de resultaten goed overeen in de BMI klassen > 35 kg/m2. Voor deze groepen is bekend dat metabole chirurgie leidt tot betere diabetesregulatie en gewichtsverlies dan conservatieve zorg. En dit geldt met name ook voor positieve effecten op kwaliteit van leven. Hoewel niet in RCT’s getest, laten ook observationele studies zien dat er in de BMI < 35 kg/m2 klassen (sterk) verbeterde uitkomsten zijn op de levensverwachting (Chen, 2016; Zhou, 2016).
Omdat de gepubliceerde studies met betrekking tot een BMI tussen 30 en 35 kg/ kg/m2 positieve resultaten laten zien is tijdens het Diabetes Surgery Summit (DSS-II) consensus conference opgenomen dat bariatrische chirurgie bij patiënten met een ongecontroleerde diabetes en een BMI van 30 kg/m2 of hoger (of 27,5 kg/m2 bij Aziatische personen) overwogen dient te worden. Deze nieuwe richtlijn is inmiddels overgenomen door de grootste overkoepelende en tevens de landelijke beroepsverenigingen van endocrinologen en metabool-bariatrische chirurgen wereldwijd (Rubino, 2017).
Op basis van de beschikbare uitkomsten is het voordeel van een metabole interventie ten aanzien van diabetesregulatie (HbA1c, diabetesremissie,) en gewichtsverlies aannemelijk gemaakt. De uitkomsten van de studies, hoewel met de besproken tekortkomingen in de bewijskracht, tonen hierin een hoge mate van interne consistentie op de relevante uitkomstmaten, ook op de langere termijn. Het is ook vermeldenswaard dat dezelfde overweging internationaal al gemaakt wordt; in het veld is op basis van alle beschikbare data een ruime consensus over de positie van metabole chirurgie bij diabetes patiënten met een BMI 30-35kg/m2 als zinvol, mits toegepast na goede weging van de overige therapeutische opties door de behandelend internist-endocrinoloog (Eisenberg, 2022; Fried, 2013).
Conservatieve zorg
De conservatieve zorg zoals in de geanalyseerde studies gehanteerd is sterk heterogeen, en bestaat vaak ook een combinatie van voedings- en beweegadvies.
Naar de toekomst toe stelt de werkgroep voor conservatieve zorg, mede met het oog op de per 2019 en 2022 beschikbaar gekomen therapieën, te definiëren als: ‘een gecombineerde leefstijlinterventie, waarbij begeleiding wordt geboden op het gebied van gezonde voeding, beweging en gedragsverandering door een geaccrediteerde leefstijlcoach en/ of (multidisciplinaire) inzet van paramedici, zoals fysio- of oefentherapeuten en diëtisten, eventueel in combinatie met medicamenteuze therapie’.
Inmiddels is er een lijst beschikbaar via de RIVM van interventies (https://www.loketgezondleven.nl/leefstijlinterventies/gecombineerde-leefstijlinterventie/erkende-gli-basisverzekering), opgesteld op basis van het rapport van Zorginstituut ’De gecombineerde leefstijlinterventie nader bekeken’ (ZINL, 2018).
Dat deze conservatieve stap wel degelijk zinvol kan zijn, bewijst de DIRECT-trial (Lean, 2018) met de follow up daarvan (Lean, 2019). Deze wordt in groepsverband gedurende twee jaar aangeboden. Indien een persoon reeds een volledig optimale leefstijl heeft, kan overwogen worden deze stap over te slaan. Onder een gezonde leefstijl verstaan we een gezond slaappatroon, voldoende mentale ontspanning en eet- en beweegpatronen conform richtlijn gezonde voeding en de beweegnorm (Gezondheidsraad, 2017).
Farmacotherapie
Onder conservatieve zorg kan in toenemende mate ook de behandeling met GLP-1 analogen worden gerekend. De klasse van middelen kent steeds meer middelen waarvan inmiddels niet alleen een (sterke) verbetering van glycemische regulatie uitgaat, maar waarvan ook in meer of mindere mate gewichtsreductie en cardiovasculaire protectie kan worden verwacht. Deze klasse van middelen geldt als veilig en kent relatief weinig bijwerkingen behoudens abdominale klachten die doorgaans passagère zijn. Hoewel deze middelen effectief zijn, is de mate van gewichtsreductie en glycemische verbetering niet van dezelfde orde als metabole chirurgie. Ook de resolutie van andere obesitas gerelateerde co-morbiditeit is minder groot, maar wel degelijk aanzienlijk. Ook op niveau van kwaliteit van leven bieden deze middelen een duidelijke verbetering (Billings, 2018). In contrast met het in opzet eenmalige karakter van metabole chirurgie dient men zich te realiseren dat GLP-1 analogen naar verwachting langdurig (levenslang) zullen moeten worden doorgegeven. Over effectiviteit en complicaties op lange termijn van deze middelen, is nog onvoldoende bekend.
Waarden en voorkeuren van patiënten
Het voordeel van de chirurgische interventie - ten opzichte van conservatieve behandeling - is dat het in een groter aantal gevallen leidt tot remissie van diabetes mellitus type 2 dan wel tot het beter reguleren van het glucose metabolisme en andere verwante risicofactoren zoals dyslipidemie en hypertensie. Hoe dit is ten opzichte van GLP-1 analogen is nog niet bekend, omdat direct vergelijkende studies ontbreken.
De metabole operatie is wel ingrijpend en kan op zichzelf nieuwe klachten met zich meebrengen, zoals voedingsdeficiënties, en lage bloedsuikers na de maaltijd. Daarin is belangrijk om te vermelden dat de andere puur obesitas gerelateerde klachten, zoals pijn in gewrichten bij patiënten met een BMI< 35 kg/m2 vaak minder uitgesproken zijn. Voor- en nadelen moeten dan ook goed tegen elkaar worden afgewogen.
Ten aanzien van de besluitvorming zijn er vele argumenten die tegelijkertijd moeten worden mee gewogen. Leeftijd en levensverwachting, operatie risico en co-morbiditeiten, de wens tot curatie versus ziektecontrole, en persoonlijke voorkeuren van patiënt en behandelaar. Weging hiervan wordt in een multidisciplinaire setting gedaan.
Kosten (middelenbeslag)
De totale kosten van een metabole operatieve ingreep in Nederland zijn ongeveer 10.000 euro per patiënt. Ook adequate follow up en suppletie van vitamines en mineralen brengen kosten met zich mee. Daarnaast zijn er ook kosten voor eventuele her- of vervolgoperaties of ziekenhuisopnames in verband met complicaties. De kosten van behandeling met een GLP-1 analoog zijn ongeveer 1200 euro per jaar. Het is evident dat het persisteren van ernstige obesitas (en de daarmee samenhangende co-morbiditeit) ook een forse kostenpost is. Een uitgebreidere uitwerking van de kosten van metabole chirurgie bij patiënten met BMI 30 tot 35 kg/m2 en type 2-diabetes is te vinden in de budget impact analyse (BIA) die in het kader van de richtlijn is uitgevoerd. De BIA is als aanverwant product bij de richtlijn opgenomen.
Aanvaardbaarheid voor de overige relevante stakeholders
Metabole chirurgie geldt als een invasieve behandeling. Ook moet deze operatie als (vrijwel) onomkeerbaar worden beschouwd. Daar staat tegenover dat het vaak leidt tot meer gezondheid, een langere levensverwachting en hogere kwaliteit van leven. Dat betekent dat er een wel overwogen beslissing door zowel arts als patiënt moet worden gemaakt. Hoewel de operatie als veilig te boek staat, kunnen ernstige complicaties ontstaan. Te denken hierbij zijn infecties, bloedingen, trombose/embolie en voedingsdeficiënties, dumping en problemen met resorptie van medicatie. Niet opereren betekent echter vaker het voortduren van de ziekte hetgeen ook complicaties met zich meebrengt.
Lange termijn follow up (> 5 jaar) ontbreekt, terwijl dit wel relevant is. De duur van ziekteremissie in de BMI klasse van 30 tot 35 kg/m2 is onbekend. In aantal grote studies (Aminian, 2019; Schauer, 2017) zijn er wel duidelijke aanwijzingen dat de voordelen op niveau van complicaties ook voor diabeten met een BMI < 35 kg/m2 gelden.
Een exacte plaatsbepaling van de metabole chirurgie kan dan ook alleen op individuele basis gegeven worden. In sommige observationele studies (Madsen, 2019) blijkt er een voordeel te bestaan om juist in een vroeger stadium van diabetes mellitus type 2 metabole chirurgie toe te passen, gezien de grotere kans op remissie van diabetes. Dit contrasteert met de huidige notie om dergelijke ingrepen als last-resort behandeling te zien. Het onnodig uitstellen van een chirurgische behandeling van obesitas en diabetes zou dus kunnen resulteren in een lagere kans op langdurige remissie van de diabetes. Die afname wordt al vastgesteld als de diabetes langer duurt dan een jaar. Het is dan ook belangrijk om bij uitblijvend of onvoldoende effect van medicamenteuze behandeling niet te lang te wachten om te kiezen voor metabole chirurgie.
De ontwikkeling van de laatste generatie van GLP-1 analogen (waarbij met name semaglutide genoemd moet worden), voegt een nieuwe dimensie aan de plaatsbepaling toe van metabole chirurgie. Door de vermindering van mortaliteit als gevolg van behandeling met GLP-1 analogen (liraglutide en semaglutide) van patiënten met diabetes mellitus type 2 is dit een belangrijk alternatief te noemen. De wetenschappelijke onderbouwing hiervan is sterk (meerdere studies van hoge kwaliteit (Marso, 2016a; Marso, 2016b; Hemmer, 2019)). Ook is het mogelijk om deze behandeling te mitigeren of zelfs te staken in geval van bijwerkingen, hetgeen vanwege het onomkeerbare karakter van metabole chirurgie niet mogelijk is. Hier tegen over kan worden ingebracht dat metabole chirurgie sterkere behandeleffecten heeft. Het zou om die reden maar kosteneffectief kunnen zijn, maar feitelijk is dat niet precies bekend.
Haalbaarheid en implementatie
Op basis van de BIA wordt er geen capaciteitsprobleem verwacht. Uit de BIA komt naar voren dat het om een beperkte groei van het aantal patiënten per jaar zal gaan. De meest beperkende factor zal zijn dat het overgrote deel van de patiënten die in aanmerking komen onder de indicatiestelling geen operatie willen. Geschat wordt dat het percentage patiënten dat ook daadwerkelijk de operatie zal ondergaan circa 4 tot 5% zal bedragen. Voor meer informatie zie ook de uitgevoerde BIA.
Rationale/ balans tussen de argumenten voor en tegen de interventie
Metabole chirurgie bij patiënten met diabetes mellitus type 2 en een BMI 30 tot 35 kg/m2 leidt tot sterke verbetering van glycemische regulatie en gewichtsreductie. Deze resultaten sluiten aan bij de resultaten in de BMI > 35 kg/m2 gewichtsklasse. Hoewel effecten op de levensverwachting en kwaliteit van leven voor de BMI 30 tot 35 kg/m2 zeer beperkt zijn onderzocht, is het de verwachting dat deze niet in essentie zullen afwijken van die in de BMI > 35 kg/m2 groep.
Metabole chirurgie kent potentieel ernstige complicaties, zoals revisie chirurgie vanwege (na)bloeding, naadlekkage, inwendige hernia of naadulcus. Het percentage hiervan is echter laag en de mortaliteit is zeer laag. Vanzelfsprekend zijn er aan leefstijlinterventies zelf geen vergelijkbare complicaties verbonden en ook van farmacotherapeutische interventies zijn dergelijke ernstige problemen niet bekend. Dit verschil in risico moet in de afweging voor therapie keuze worden afgezet tegen het omgekeerde verschil in optreden van diabetes gerelateerde complicaties.
Bij de afweging voor metabole chirurgie spelen diverse factoren mee. Er is uit diverse studies overtuigend bewijs dat het kan resulteren in ziekteremissie indien leefstijlinterventie hier niet in slaagt. De kans hierop lijkt groter te zijn bij minderlang bestaande diabetes mellitus type 2. Metabole chirurgie wordt daarmee niet (meer) als last-resort behandeling beschouwd maar ook als een therapeutisch alternatief in vroegere fasen van behandeling. Anderzijds kan de aanwezigheid van andere aan obesitas of diabetes mellitus type 2 gerelateerde co-morbiteiten en levensverwachting meespelen in de keuze tussen metabole chirurgie en standaard of conservatieve behandeling.
Farmacotherapie met GLP-1 analogen kan als alternatief worden gezien vanwege effecten op diabetesregulatie en gewicht, maar deze behandelresultaten zijn minder sterk, met bijvoorbeeld geringere dalingen in bijvoorbeeld het HbA1c en gewicht. Bovendien is niet bij alle patiënten behandeling met farmacotherapie effectief vanwege tegenvallende resultaten of vanwege bijwerkingen van de medicatie. In dat geval moet metabole chirurgie worden overwogen.
De inzet van metabole chirurgie of GLP-1 analogen zal dus in hoge mate afhangen van de individuele behandeldoelen. Gezien de sterkte en consistentie van het behandeleffect, in lijn met de effecten in hogere BMI klassen, wordt ondanks de lage bewijskracht in de literatuur de aanbeveling gegeven om metabole chirurgie te bespreken als goed alternatief bij diabetes mellitus type 2 en een BMI van 30 tot 35 kg/m2 en onvoldoende respons op reguliere therapie.
Direct nadat diabetes mellitus type 2 is gediagnosticeerd is een gecombineerde leefstijlinterventie de hoeksteen van de behandeling. Dat deze conservatieve stap wel degelijk zinvol kan zijn, bewijst de DIRECT-trial (Lean, 2018) met de follow up daarvan (Lean, 2019). Een vervolgstap kan farmacotherapie of metabole chirurgie zijn en dit is sterk afhankelijk van het behandeldoel en de noodzaak tot succesvol behandelresultaat op zowel kortere als langere termijn. Het gaat dus in de afweging om de meest passende therapie (matched care).
Bij een BMI 30 tot 35 kg/m2 en een slecht gereguleerde diabetes dienen patiënten verwezen te worden naar een internist (endocrinoloog). Alleen binnen 2de en 3de lijnszorg bestaat voldoende kennis ervaring en overzicht over het snel veranderende pallet van behandelingen, waaronder metabole chirurgie. De therapeutische afweging en de indicatiestelling voor metabole chirurgie geschiedt dan ook bij de internist (endocrinoloog), nadat is komen vast te staan dat dit de meest passende therapeutische optie is of dat andere behandelvormen onvoldoende effect (zullen) hebben. Diabetes mellitus type 2 kent een hoge ziektelast. Metabole chirurgie is een mogelijk zinvol tweedelijns alternatief om de diabetes onder controle te krijgen, de medicatielast te verlagen en diabetes gerelateerde complicaties te verminderen.
Bij een BMI > 35 kg/m2 en goed ingestelde diabetes kan zeker overwogen worden te verwijzen voor metabole chirurgie, gezien de kans op remissie van diabetes en de verlaging van de medicatielast. Gecombineerde leefstijlinterventie gecombineerd met farmacotherapie hebben een primair een belangrijke rol en dienen als mogelijke interventies hieraan voorafgaand. Bij een BMI > 35 kg/m2 met slecht gereguleerde diabetes is het advies te verwijzen voor metabole chirurgie.
Bij een BMI 40 kg/m2 of hoger moet met meer nadruk overwogen worden om te verwijzen voor metabole chirurgie, gezien de kans op remissie en de verlaging van de medicatielast ongeacht hoe de diabetes gereguleerd is. Uitstel van chirurgische behandeling verlaagt in deze groep de kans op resolutie van de diabetes op termijn en moet zo mogelijk worden vermeden.
Onderbouwing
Achtergrond
Diabetes Mellitus type 2 gaat gepaard met complexe metabole ontregeling en zorgt dientengevolge voor toegenomen morbiditeit, sterfte en kosten. Hoewel leefstijlinterventie essentieel is om obesitas en diabetes te voorkomen of behandelen, moet er bij mensen met diabetes zo breed mogelijk gekeken worden wat de behandelopties zijn. Steeds meer wordt duidelijk dat de tractus digestivus een klinisch en fysiologisch belangrijke rol speelt in de regulering van diabetes. Er is toenemend bewijs dat metabole chirurgie (gedefinieerd als: gastro-intestinale chirurgie met de intentie diabetes mellitus type 2 en obesitas te behandelen) moeilijk instelbare diabetes beter helpt te reguleren, wat ook een verbetering van cardiovasculaire risicofactoren tot gevolg heeft. Er is in dit kader in 2016 ook een statement verschenen van internationale diabetesorganisaties (Rubino, 2016). Belangrijk is dat er in dat statement geadviseerd wordt een metabole operatieve ingreep ook bij een BMI < 35 kg/m2 te overwegen. Deze ontwikkeling is een van de redenen waarom de richtlijn is herzien.
Conclusies / Summary of Findings
Uitkomstmaat 1. Controle diabetes mellitus type 2 (cruciaal)
HbA1c
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in een betere HbA1c % vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2, op korte en lange termijn (6 maanden, 1, 2, 3 en 5 jaar follow-up).
Bronnen: Azevedo, 2018; Horwitz, 2020; Ikramuddin, 2018; Liang, 2013; Lau, 2021; Parikh, 2015; Schauer, 2017 |
Volledige remissie
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in een betere volledige diabetes remissie vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2, op korte en lange termijn (6 maanden, 2, 3 en 5 jaar follow-up).
Bronnen: Horwitz, 2015 en 2020; Ikramuddin, 2018; Parikh, 2015 |
Partiële remissie
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in een betere partiële diabetes remissie vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2, op korte en lange termijn (1, 2, 3 en 5 jaar follow-up).
Bronnen: Ikramuddin, 2018; Lau, 2021 |
Nuchter glucose
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in lagere nuchter glucose waardes vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2, op korte en lange termijn (6 maanden, 1, 2 en 5 jaar follow-up).
Bronnen: Cohen, 2020; Ikramuddin, 2018; Lau, 2021; Parikh, 2015 |
Gebruik van diabetes medicatie
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in minder gebruik van diabetes medicatie bij metabole chirurgie vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2.
Bronnen: Azevedo, 2018; Cohen, 2020; Horwitz, 2015 en 2020; Ikramuddin, 2018 |
Uitkomstmaat 2. Complicaties (cruciaal)
|
Zeer laag GRADE |
Het is zeer onzeker wat het verschil is in complicaties vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2.
Bronnen: Cohen, 2020; Horwitz, 2020, Ikramuddin, 2020; Liang, 2013; Parikh, 2015 |
Uitkomstmaat 3. Kwaliteit van leven (cruciaal)
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in een betere kwaliteit van leven vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2.
Bron: Cohen, 2020 |
Uitkomstmaat 4. Gewichtsverlies (belangrijk)
|
Laag GRADE |
Metabole chirurgie resulteert mogelijk in meer gewichtsverlies vergeleken met standaard of conservatieve zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2.
Bronnen: Ikramuddin, 2018; Liang, 2013; Parikh, 2015; Schauer, 2017 |
Uitkomstmaat 5. Mortaliteit (belangrijk)
|
Zeer laag GRADE |
Het is zeer onzeker wat het verschil is in mortaliteit tussen patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2 die metabole chirurgie hebben ondergaan vergeleken met patiënten met intensieve medische zorg.
Bronnen: Ikramuddin, 2013; Parikh, 2015 |
Uitkomstmaat 6. Levensverwachting (belangrijk)
|
- GRADE |
Het is onbekend wat het verschil in levensverwachting is bij patiënten die metabole chirurgie hebben ondergaan vergeleken met conservatieve of standaard zorg bij patiënten met diabetes mellitus type 2 en een BMI tussen 30 en 35 kg/m2. Er werden geen studies gevonden die dit onderzochten. |
Samenvatting literatuur
Beschrijving studies
Cohen (2020) beschreef een RCT met 24 maanden follow-up, waarbij 51 patiënten met diabetes mellitus type 2 en obesitas (BMI tussen de 30 en 35 kg/m2) een Roux-en-Y gastric bypass kregen en 49 patiënten een medicamenteuze behandeling kregen. Alle patiënten hadden een beginstadium van chronisch nierfalen. Medicamenten met een gunstig effect op microvasculaire en macrovasculaire resultaten werden direct aan het begin van de studie toegediend, indien de patiënten deze medicamenten nog niet gebruikten. De gemiddelde baseline BMI in de interventiegroep was 32.5 (SD 1.9) en 32.6 (SD 2.1) in de medicamenteuze groep.
Lau (2021) beschreef een open-label RCT met één jaar follow-up, waarbij tien patiënten met klasse 1 obesitas (BMI van ≥30 en <35 kg/m2) en gediagnosticeerd met diabetes mellitus type 2 een Roux-en-Y gastric bypass kregen en tien patiënten een standaard medicamenteuze behandeling kregen. Deze werd gedefinieerd als het gebruik van leefstijl (voedings- en bewegingsadviezen) richtlijnen van de American Diabetes Association (ADA) om gewichtsverlies en glykemische controle te optimaliseren samen met het zelfstandig controleren van de bloedsuikerspiegel en medicamenteuze therapie voor hyperglykemie. De gemiddelde baseline BMI in de interventiegroep was 33.6 kg/m2 en 32.0 kg/m2 in de medicamenteuze groep.
Ikramuddin (2013) beschreef een RCT waarbij 60 Amerikaanse en Taiwanese patiënten met diabetes mellitus type 2 een Roux-en-Y gastric bypass kregen. In de controlegroep kregen 60 patiënten een intensieve medische interventie bestaande uit leefstijl aanpassingen en medicatie om de glucoseregulatie en risicofactoren voor hart- en vaatziekten te controleren. De gemiddelde baseline BMI in de interventiegroep was 34,9 kg/m2 (95% BI 34,2 tot 35,7) versus 34,3 kg/m2 (95% BI 33,5 tot 35,1). 60% van de patiënten in de interventiegroep hadden een BMI < 35 kg/m2 versus 58% in de controlegroep. In 2015, 2016 en 2018 publiceerde Ikramuddin de 2, 3 en 5-jaars resultaten van de RCT (Ikramuddin, 2015; Ikramuddin, 2016; Ikramuddin, 2018). Chong (2017) rapporteerde subgroepanalyses van Ikramuddin (2015) waarin Taiwanese patiënten werden vergeleken met Amerikaanse patiënten.
Liang (2013) beschreef resultaten van een RCT in China met 1 jaar follow-up, waarbij 31 patiënten met diabetes mellitus type 2 een Roux-en-Y gastric bypass kregen, 36 patiënten standaard zorg en 34 patiënten standaard zorg plus behandeling plus exenatide. Patiënten met een BMI> 28 kg/m2 werden geïncludeerd, waarbij de gemiddelde BMI 30,48 (SD 0,94) in de interventiegroep was, 30,34 (SD 1,96) in de standaard zorg groep en 30,28 (SD 1,44) in de exenatide-groep.
Parikh (2015) deed een pilot RCT in de VS met 6 maanden follow-up. 29 patiënten met diabetes mellitus type 2 werden gerandomiseerd voor een metabole interventie, waarvan 7 een bypass, 5 een maagband en 16 patiënten sleeve gastrectomie kregen. Eén patiënt kreeg uiteindelijk geen metabole chirurgie. De controlegroep van 28 patiënten kregen intensieve medische therapie. Alleen patiënten met een BMI tussen de 30 en 35 kg/m2 werden geïncludeerd. De gemiddelde BMI was 32,8 kg/m2 (SD 1,7) in de interventiegroep versus 32,4 (SD 1,8) in de controlegroep. Horwitz (2016) en Horwitz (2020) beschreven 3- jaars follow-up en 5-jaars follow-up van deze pilot RCT, waarbij er na drie jaar 10 patiënten die gerandomiseerd waren voor intensieve medische therapie alsnog geopereerd waren (cross-over). Horwitz (2016 en 2020) analyseerde deze patiënten per protocol, wat risico op bias oplevert.
Azevedo (2018) beschreef een RCT waarbij 10 Braziliaanse patiënten met diabetes mellitus type 2 een sleeve gastrectomie met transit bipartition werden vergeleken met 10 patiënten die standaard zorg kregen. Patiënten met een BMI tussen de 28 en 35 kg/m2 werden geïncludeerd. De gemiddelde BMI was 33,4 kg/m2 (SD 2,6) in de interventiegroep versus 30,3 (SD 2,1) in de controlegroep. De follow-up was 2 jaar.
Schauer (2012) beschreef een RCT waarbij 150 patiënten met diabetes mellitus type 2 werden gerandomiseerd tussen een gastric bypass, sleeve gastrectomie of intensieve medische therapie. Schauer (2014) en Schauer (2017) beschreven 3- jaars follow-up (Horwitz, 2016) en 5-jaars follow-up (Horwitz, 2020). Er werden subgroep analyses gedaan voor patiënten met een BMI lager dan 35 kg/m2 (n=14 gastric bypass, n=18 sleeve en n=19 controlegroep). Alleen de analyses van deze subgroep voldoen aan de PICO zijn meegenomen in de literatuursamenvatting. Baseline karakteristieken werden niet gerapporteerd voor de subgroep.
Resultaten
Uitkomstmaat 1. Controle diabetes mellitus type 2 (cruciaal)
HbA1c%
Alle studies rapporteerden het HbA1c %, waarbij de follow-up periodes verschilden. De patiënten in de metabole groep hadden gemiddeld een lager HbA1c vergeleken met de conservatieve therapie groep (figuur 1). Het (gepoolde) effect varieert van 1,60% HbA1c na 6 maanden jaar tot 1,54% na 5 jaar. Het verschil tussen behandelarmen is op alle follow-up momenten in het voordeel van metabole chirurgie en klinisch relevant.
Figuur 1 Uitkomstmaat HbA1c % vergelijking metabole chirurgie versus conservatieve/ standaard zorg
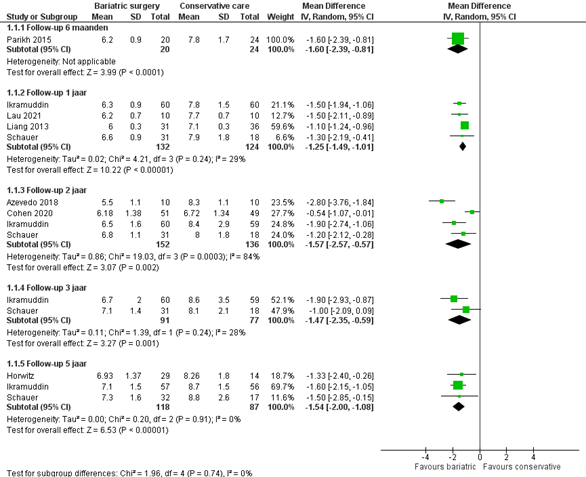
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat controle van diabetes mellitus type 2 uitgedrukt in HbA1c % is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is voor alle follow-up momenten verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias) en het geringe aantal patiënten (imprecisie).
%HbA1c < 7%
Twee studies rapporteerden het %HbA1c < 7% (Cohen, 2020; Ikramuddin). In de interventiegroep behaalden meer patiënten een %HbA1c < 7% vergeleken met de controlegroep op elk gemeten punt in de tijd (figuur 2). Na 5 jaar was er een risicoverschil van 40% (95% BI 24% tot 56%) in het voordeel van de interventiegroep. Alle gevonden verschillen zijn klinisch relevant.
Figuur 2 Uitkomstmaat %HbA1c vergelijking metabole chirurgie versus conservatieve/ standaard zorg
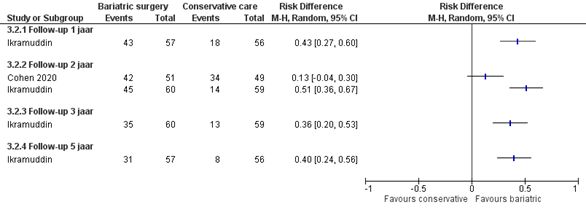
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat controle van diabetes mellitus type 2 uitgedrukt in het aantal patiënten met een HbA1c lager dan 7% is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is voor de 1, 3 en 5 jaar follow-up momenten verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), het geringe aantal events (imprecisie).
Volledige remissie
Twee studies rapporteerden de volledige remissie van diabetes: geen van de patiënten in de controle-arm bereikten volledige remissie, terwijl het % volledige remissie in de interventiearm varieert van 62% na 6 maanden (Horwitz, 2015) tot 7% na 5 jaar (Ikramuddin, 2018) (figuur 3). De verschillen zijn klinisch relevant in de follow-up periodes tot en met 3 jaar. Na 5 jaar is er geen klinisch relevant verschil meer in de studie van Ikramudding (2018). Het verschil is wel klinisch relevant in de studie van Horwitz (2020). Echter, dit betreft een per protocol analyse, waarbij er een cross-over plaatst heeft gevonden van 10 patiënten van de controle groep naar de metabole chirurgie groep.
Figuur 3 Uitkomstmaat volledige remissie vergelijking metabole chirurgie versus conservatieve/ standaard zorg
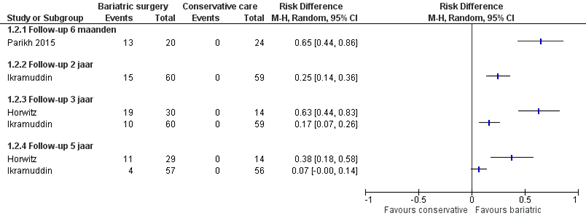
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat controle van diabetes mellitus type 2 uitgedrukt in aantal patiënten met volledige remissie is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), en het geringe aantal events (imprecisie).
Partiële remissie
Twee studies rapporteren over deze uitkomstmaat (Ikramuddin; Lau, 2021). Partiele remissie komt nauwelijks tot niet voor in de controlegroep. Partiele remissie lijkt in de interventiegroep af te nemen op de langere termijn: na 1 jaar is het verschil in partiele remissie tussen de behandelarmen 63% (95% BI 28% tot 97%), na 2 jaar gemiddeld 42% (95% BI van 29% tot 54%), na 3 jaar gemiddeld 20% (95% BI van 10% tot 30%) en na 5 jaar gemiddeld 10% (95% BI van -1% tot 22%) (figuur 4).
Figuur 4 Uitkomstmaat partiële remissie vergelijking metabole chirurgie versus conservatieve/ standaard zorg
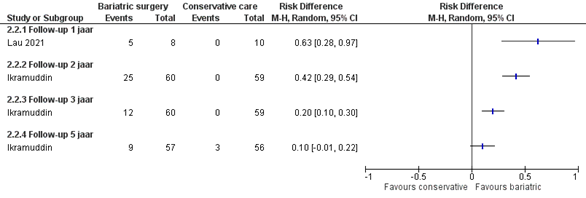
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat controle van diabetes mellitus type 2 uitgedrukt in het aantal patiënten met partiele remissie is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), het geringe aantal events (imprecisie).
Nuchter glucose
Vier studies rapporteerden nuchter glucose. De patiënten in de metabole groep hadden gepoold gemiddeld lagere nuchter glucose waardes vergeleken met intensieve medische therapie op elke gemeten follow-up (figuur 5).
Figuur 5 Uitkomstmaat nuchter glucose vergelijking metabole chirurgie versus conservatieve/ standaard zorg
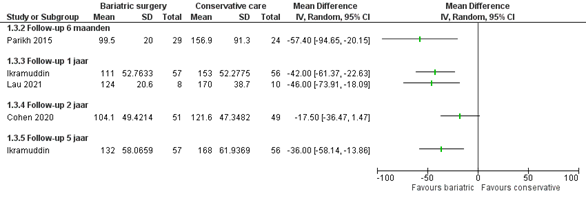
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat nuchter glucose is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), het geringe aantal patiënten (imprecisie).
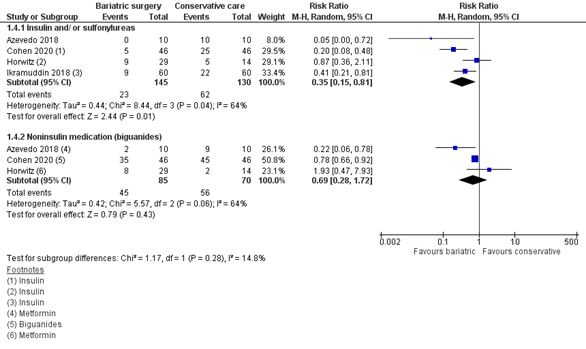
Gebruik van diabetes medicatie
Zes studies rapporteerden het gebruik van diabetes medicatie. Vier studies rapporteerden het gebruik van insuline en/of sulfonylureas (gepoolde RR 0,35; 95% BI 0,15 tot 0,81) en drie studies rapporteerden het gebruik van biguanides (gepoolde RR 0,69; 95% BI 0,28 tot 1,72) (figuur 6). Deze verschillen zijn klinisch relevant.
Cohen (2020) rapporteerde daarnaast nog het gebruik van andere typen diabetes medicatie, waaronder thiazolidinediones (interventie 9 (19,6%) patiënten versus controle 31 (67,4%) patiënten), incretin mimetics/enhancers (interventie 19 (41,3%) patiënten versus controle 46 (100%) patiënten), SGLT2 remmers (interventie 21 (45,7%) patiënten versus controle 46 (89,%) patiënten) en secretagogues (interventie 0 patiënten versus controle 2 (4,3%) patiënten).
Horwitz (2020) rapporteerde naast het gebruik van insuline en metformine ook het gebruik van “andere” diabetes medicatie. Tien patiënten (34,5%) in de interventie groep versus 5 (35,7%) patiënten in de controlegroep gebruikten andere medicatie.
Ikramuddin (2018) rapporteerde naast het gebruik van insuline ook het gebruik van diabetes medicatie anders dan insuline. Dit gebruikten 24 (42%) van de patiënten in de interventiegroep versus 38 (88%) in de controlegroep.
Parikh (2015) rapporteerde het gebruik van diabetes medicatie, maar maakte hierbij geen onderscheid tussen het type medicatie. Vier patiënten (13,7%) in de interventiegroep versus 21 patiënten (75%) in de controlegroep gebruikten diabetes medicatie (RR 0,69; 95% BI 0,28 tot 1,72)
Schauer (2014) rapporteerde in een subgroep analyse (BMI< 35 kg/m2) het gemiddelde aantal diabetes medicatie na 3 jaar. Dit was gemiddeld 1,2 in de metabole groep versus 2,75 in de intensieve medische therapie groep (afgelezen vanuit een figuur).
Figuur 6 Uitkomstmaat gebruik van diabetes medicatie vergelijking metabole chirurgie versus conservatieve/ standaard zorg
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat controle van diabetes mellitus type 2 uitgedrukt in het gebruik van diabetes medicatie is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias) en het 95% betrouwbaarheidsintervallen die de grenzen van klinische relevantie overschrijden (imprecisie).
Uitkomstmaat 2. Complicaties (cruciaal)
Diabetes gerelateerde complicaties
Twee studies rapporteerden de diabetes gerelateerde complicaties. In beide studies worden na metabole chirurgie minder diabetes gerelateerde complicaties gerapporteerd dan na conventionele behandeling studies, vooral na 5 jaar (43% minder neuropathie, 29% minder retinopathie en 14% minder cardiovasculaire complicaties, zie figuur 7). De betrouwbaarheidsintervallen rondom de verschilscores zijn echter breed vanwege het kleine aantal events.
Figuur 7 Uitkomstmaat gebruik van diabetes gerelateerde complicaties vergelijking metabole chirurgie versus conservatieve/ standaard zorg
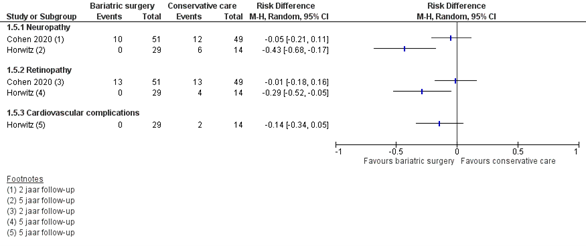
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
De bewijskracht voor de uitkomstmaat complicaties uitgedrukt in diabetes gerelateerde complicaties is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is voor alle complicaties verlaagd met 3 niveaus naar zeer laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), het geringe aantal events en 95% betrouwbaarheidsintervallen die de grenzen van klinische relevantie overschrijden (imprecisie).
Operatie gerelateerde complicaties
Vier studies rapporteerden de operatie gerelateerde complicaties. Het aantal complicaties varieerde van 0 (Liang, 2013) tot 18% (Ikramuddin, 2020) (figuur 8).
Figuur 8 Uitkomstmaat gebruik van chirurgische gerelateerde complicaties vergelijking metabole chirurgie versus conservatieve/ standaard zorg
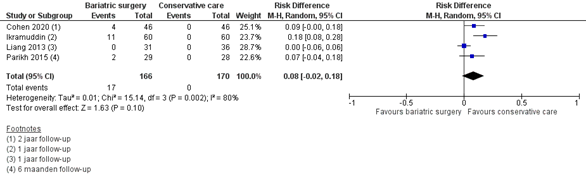
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat complicaties uitgedrukt in chirurgische gerelateerde complicaties is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 3 niveaus naar zeer laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias), het geringe aantal events en 95% betrouwbaarheidsintervallen die de grenzen van klinische relevantie overschrijden (imprecisie).
Uitkomstmaat 3. Kwaliteit van leven (cruciaal)
In twee studies is kwaliteit van leven gemeten (Cohen, 2020; Schauer, 2012). De studie van Cohen (2020) is de kwaliteit van leven gemeten d.m.v. de SF-36. Deze studie betreft patiënten die niet alleen T2DM en een BMI van 30-35 kg/m2 hebben, maar ook nierproblemen. In de studie van Schauer (2012) wordt de kwaliteit van leven alleen voor de totale studiepopulatie gerapporteerd en niet voor de subgroep met een BMI 30-35 kg/m2, waardoor de resultaten niet bruikbaar zijn voor deze literatuursamenvatting.
In de studie van Cohen (2020) lieten de patiënten in de metabole chirurgie arm na 24 maanden een grotere verbetering zien wat betreft algemene gezondheidsbeleving (gem. verschil 17.85, 95%BI 10.0 tot 25.7), mentale gezondheid (gem. verschil 8,9, 95%BI 0,7 tot 17,2), fysiek functioneren (gem. verschil 19,9, 95%BI 3,5 tot 36,4), rolbeperkingen door fysieke problemen (gem. verschil 14,2; 95%BI 5,1 tot 23,2) en vitaliteit/energie (gem. verschil 14,4, 95%BI 6,1 tot 22,7). 5-jaars data ontbreken. De grootte van het effect na 2 jaar is klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat kwaliteit van leven is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen blindering (risk of bias) en het geringe aantal patiënten (imprecisie). Bij patiënten met DM2 en een BMI 30-35 leidt bariatrische chirurgie na 2 jaar follow-up tot een verbeterde kwaliteit van leven (1 onderzoek, low GRADE). Bij patiënten met DM2 en een BMI 30-35 is het onduidelijk of bariatrische chirurgie leidt tot een verbeterde kwaliteit van leven na 5 jaar follow-up vanwege het ontbreken van studies die deze uitkomstmaat na 5 jaar follow-up rapporteerden.
Uitkomstmaat 4. Gewichtsverlies (belangrijk)
De uitkomstmaat gewichtsverlies, gedefinieerd als % Total Body Weight Loss of % Excess Weight Loss werd gerapporteerd in vier studies. De studies gebruikten verschillende manieren om dit te rapporteren. De data zijn daarom niet gepoold. Alle studies vonden een klinisch relevant verschil in het voor de metabole chirurgie groep.
Cohen (2020) rapporteerde een gemiddeld % verandering in lichaamsgewicht. Dit was -25,4% (95% BI -26,9 tot -23,8) in de interventiegroep versus -4,5 (95% BI -6,1 tot -3,1) in de controlegroep.
Ikramuddin (2018) rapporteerde een gewichtsverlies na 5 jaar van 21,8% in de metabole groep versus 9,6% in de leefstijl groep. Dit is een gemiddeld verschil van 12,20 (95% BI 8,94 tot 15,46).
Lau (2021) rapporteerde het % gewichtsverlies. Dit bedroeg 25,5% (SD 5,6) in de interventiegroep (n=8) versus 4,9% (SD 5,5) (n=10).
Parikh (2015) rapporteerde een % excess weight loss van 60% in de metabole groep en 7,4% (SD in de intensieve medische therapie groep. Dit is een gemiddeld verschil van 52,60 (95% BI 43,61 tot 61,59). Horwitz (2016) rapporteerde het % excess weight loss na 3 jaar. Dit was 26,6% in de interventiegroep versus 2,8% in de controlegroep. Daarnaast werd het % gewichtsverlies gerapporteerd. Dit was na 5 jaar 21,4% (SD 9,4) en 10,3% (SD 8,1) in de controlegroep.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat gewichtsverlies is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 2 niveaus naar laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment, geen blindering en geen intention-to-treat analyse (risk of bias) en het geringe aantal patiënten (imprecisie).
Uitkomstmaat 5. Mortaliteit (belangrijk)
Ikramuddin (2013) en Parikh (2015) rapporteerden dat geen van de geïncludeerde patiënten waren overleden.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op RCT’s en start derhalve hoog. De bewijskracht is verlaagd met 3 niveaus naar zeer laag gezien beperkingen in de onderzoeksopzet, zoals onduidelijke allocation concealment en geen intention-to-treat analyse (risk of bias) en het zeer gering aantal events (imprecisie).
Uitkomstmaat 6. Levensverwachting (belangrijk)
Geen van de geïncludeerde studies rapporteerde de levensverwachting.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat levensverwachting kon niet worden beoordeeld, omdat er geen studies was die deze uitkomstmaat rapporteerden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat zijn de (on)gunstige effecten van metabole chirurgie bij patiënten met een BMI tussen de 30 en 35 kg/m2 en met diabetes mellitus type 2 ten opzichte van conservatieve zorg?
P: Patiënten met een BMI tussen de 30 en 35 kg/m2 EN met diabetes mellitus type 2;
I: Metabole chirurgie;
C: Conservatieve behandeling / standaard zorg;
O: Gewichtsverlies (uitgedrukt in % Total Body Weight Loss of % Excess Weight Loss), complicaties, controle van diabetes mellitus type 2 (HbA1c beloop, remissie van diabetes, nuchter glucose, gebruik van diabetes medicatie), mortaliteit, kwaliteit van leven en levensverwachting.
Relevante uitkomstmaten
De werkgroep achtte controle van diabetes mellitus type 2, complicaties en kwaliteit van leven voor de besluitvorming cruciale uitkomstmaten; en gewichtsverlies, mortaliteit en levensverwachting voor de besluitvorming belangrijke uitkomstmaten.
Voor de definitie van ‘volledige remissie’ en ‘partiele remissie’ werden de definities gebruikt van het ADA (American Diabetes Association) consensus statement. Volledige remissie betreft een HbA1c < 6,0% (i.e. 42 mmol/mol) zonder gebruik van alle diabetes medicatie en partiele remissie een HbA1c < 6,5% (i.e. 48 mmol/mol) zonder gebruik van diabetes medicatie. De werkgroep definieerde niet a priori de overige genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
De werkgroep definieerde voor de uitkomstmaten de volgende klinisch (patiënt) relevante verschillen:
% Remissie: Risicoverschil (% patiënten met remissie, I minus C) ≥ 17% (Leslie, 2016)
HbA1c: Gemiddeld verschil (gem. HbA1c, C minus I) ≥ 0,4% (i.e. 4 mmol/mol) (Zorginstituut Nederland, 2019) risicoverschil (% patiënten met HbA1c% < 7% (i.e. 53 mmol/mol) (International Diabetes Federation, 2017; NHG, 2018), I minus C) ≥ 17%
Complicaties: Risicoverschil (% complicaties) – GRADE default evenals een (kwalitatieve) weging van operatie-gerelateerde complicaties versus diabetes-gerelateerde complicaties
Kwaliteit van leven: MID waarden gepubliceerd in de literatuur, afhankelijk van de afgenomen vragenlijst. Indien hier niet over gepubliceerd is, dan wordt een 0,5 SD als klinisch relevant verschil aangehouden.
Voor overige uitkomstmaten hanteerde de werkgroep, indien van toepassing, de onderstaande grenzen voor klinische relevantie en vergeleek de resultaten met deze grenzen: RR < 0,80 of > 1,25) voor dichotome uitkomstenmaten, een standaard deviatie van 0,5 voor continue uitkomstmaten of voor de Standardized mean difference (SMD=0,2-0,5 (klein); SMD=0,5-0,8 (matig); SMD≥0,8 (groot).
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) en de Cochrane Library (via Wiley) is op 7 december 2018 met relevante zoektermen gezocht naar vergelijkende studies gepubliceerd vanaf 1995 die metabole chirurgie met conservatieve of standaard zorg vergeleken. De literatuurzoekactie leverde 1863 treffers op, waarvan 529 systematische reviews, 445 RCT’s, 819 cohort studies en 70 case studies.
Op 8 februari 2022 is de search geüpdatet voor systematische reviews en RCT’s. De literatuurzoekactie leverde 125 systematische reviews en 136 RCT’s op.
De zoekverantwoording is weergegeven onder het tabblad Verantwoording.
Eerst werden systematische reviews en RCT’s geselecteerd op grond van de volgende selectiecriteria:
- vergelijking metabole chirurgie versus conservatieve/ standaard zorg;
- de gemiddelde BMI van de studiepopulatie lag tussen de 30 en 35 kg/m2;
- patiënten met diabetes mellitus type 2.
Studies met ≥10% patiënten met maagbanden zijn geëxcludeerd. Op basis van titel en abstract werden in eerste instantie 60 artikelen voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 50 artikelen geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en dertien artikelen die over zeven studies rapporteren definitief geselecteerd.
Resultaten
Tien artikelen die over vijf onderzoeken rapporteren zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Adams TD, Davidson LE, Litwin SE, Kolotkin RL, LaMonte MJ, Pendleton RC, Strong MB, Vinik R, Wanner NA, Hopkins PN, Gress RE, Walker JM, Cloward TV, Nuttall RT, Hammoud A, Greenwood JL, Crosby RD, McKinlay R, Simper SC, Smith SC, Hunt SC. Health benefits of gastric bypass surgery after 6 years. JAMA. 2012 Sep 19;308(11):1122-31. doi: 10.1001/2012.jama.11164. PMID: 22990271; PMCID: PMC3744888.
- Adams TD, Gress RE, Smith SC, Halverson RC, Simper SC, Rosamond WD, Lamonte MJ, Stroup AM, Hunt SC. Long-term mortality after gastric bypass surgery. N Engl J Med. 2007 Aug 23;357(8):753-61. doi: 10.1056/NEJMoa066603. PMID: 17715409.
- Aminian A, Zajichek A, Arterburn DE, Wolski KE, Brethauer SA, Schauer PR, Kattan MW, Nissen SE. Association of Metabolic Surgery With Major Adverse Cardiovascular Outcomes in Patients With Type 2 Diabetes and Obesity. JAMA. 2019 Sep 2. doi: 10.1001/jama.2019.14231. (Epub ahead of print) PubMed PMID: 31475297; PubMed Central PMCID: PMC6724187.
- Arterburn DE, Telem DA, Kushner RF, Courcoulas AP. Benefits and Risks of Bariatric Surgery in Adults: A Review. JAMA. 2020 Sep 1;324(9):879-887. doi: 10.1001/jama.2020.12567. PMID: 32870301.
- Azevedo FR, Santoro S, Correa-Giannella ML, Toyoshima MT, Giannella-Neto D, Calderaro D, Gualandro DM, Yu PC, Caramelli B. A Prospective Randomized Controlled Trial of the Metabolic Effects of Sleeve Gastrectomy with Transit Bipartition. Obes Surg. 2018 Oct;28(10):3012-3019. doi: 10.1007/s11695-018-3239-3. PubMed PMID: 29704228
- Billeter AT, Scheurlen KM, Probst P, Eichel S, Nickel F, Kopf S, Fischer L, Diener MK, Nawroth PP, Müller-Stich BP. Meta-analysis of metabolic surgery versus medical treatment for microvascular complications in patients with type 2 diabetes mellitus. Br J Surg. 2018 Feb;105(3):168-181. doi: 10.1002/bjs.10724. PMID: 29405276.
- Billings LK, Handelsman Y, Heile M, Schneider D, Wyne K. Health-Related Quality of Life Assessments with Once-Weekly Glucagon-Like Peptide-1 Receptor Agonists in Type 2 Diabetes Mellitus. J Manag Care Spec Pharm. 2018 Sep;24(9-a Suppl):S30-S41. doi: 10.18553/jmcp.2018.24.9-a.s30. Review. PubMed PMID: 30156447.
- Chen Y, Corsino L, Shantavasinkul PC, Grant J, Portenier D, Ding L, Torquati A. Gastric Bypass Surgery Leads to Long-term Remission or Improvement of Type 2 Diabetes and Significant Decrease of Microvascular and Macrovascular Complications. Ann Surg. 2016 Jun;263(6):1138-42. doi: 10.1097/SLA.0000000000001509. PMID: 26599565.
- Chong, K., Ikramuddin, S., Lee, W. J., Billington, C. J., Bantle, J. P., Wang, Q., Thomas, A. J., Connett, J. E., Leslie, D. B., Inabnet, W. B., 3rd, Jeffery, R. W., Sarr, M. G., Jensen, M. D., Vella, A., Ahmed, L., Belani, K., Schone, J. L., Olofson, A. E., Bainbridge, H. A., Laqua, P. S., Chuang, L. M. (2017). National Differences in Remission of Type 2 Diabetes Mellitus After Roux-en-Y Gastric Bypass Surgery-Subgroup Analysis of 2-Year Results of the Diabetes Surgery Study Comparing Taiwanese with Americans with Mild Obesity (BMI 30-35 kg/m2). Obesity surgery, 27(5), 11891195. https://doi-org.saz.idm.oclc.org/10.1007/s11695-016-2433-4
- Cohen RV, Pereira TV, Aboud CM, Petry TBZ, Lopes Correa JL, Schiavon CA, Pompílio CE, Pechy FNQ, da Costa Silva ACC, de Melo FLG, Cunha da Silveira LP, de Paris Caravatto PP, Halpern H, Monteiro FLJ, da Costa Martins B, Kuga R, Palumbo TMS, Docherty NG, le Roux CW. Effect of Gastric Bypass vs Best Medical Treatment on Early-Stage Chronic Kidney Disease in Patients With Type 2 Diabetes and Obesity: A Randomized Clinical Trial. JAMA Surg. 2020 Aug 1;155(8):e200420. doi: 10.1001/jamasurg.2020.0420. Epub 2020 Aug 19. PMID: 32492126; PMCID: PMC7270872.
- Eisenberg D, Shikora SA, Aarts E, Aminian A, Angrisani L, Cohen RV, De Luca M, Faria SL, Goodpaster KPS, Haddad A, Himpens JM, Kow L, Kurian M, Loi K, Mahawar K, Nimeri A, O'Kane M, Papasavas PK, Ponce J, Pratt JSA, Rogers AM, Steele KE, Suter M, Kothari SN. 2022 American Society for Metabolic and Bariatric Surgery (ASMBS) and International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO): Indications for Metabolic and Bariatric Surgery. Surg Obes Relat Dis. 2022 Dec;18(12):1345-1356. doi: 10.1016/j.soard.2022.08.013. Epub 2022 Oct 21. PMID: 36280539.
- Fried M, Yumuk V, Oppert JM, Scopinaro N, Torres AJ, Weiner R, Yashkov Y, Frühbeck G; European Association for the Study of Obesity; International Federation for the Surgery of Obesity - European Chapter. Interdisciplinary European Guidelines on metabolic and bariatric surgery. Obes Facts. 2013;6(5):449-68. doi: 10.1159/000355480. Epub 2013 Oct 11. PMID: 24135948; PMCID: PMC5644681.
- Gezondheidsraad. Beweegrichtijnen. 2017. URL: https://www.gezondheidsraad.nl/documenten/adviezen/2017/08/22/beweegrichtlijnen-2017. Bezocht op: 7-1-2020
- Hemmer A, Maiter D, Buysschaert M, Preumont V. Long-term effects of GLP-1 receptor agonists in type 2 diabetic patients: A retrospective real-life study in 131 patients. Diabetes Metab Syndr. 2019 Jan - Feb;13(1):332-336. doi: 10.1016/j.dsx.2018.09.007. Epub 2018 Sep 22. PubMed PMID: 30641721.
- Horwitz, D., Padron, C., Kelly, T., Saunders, J. K., Ude-Welcome, A., Schmidt, A. M., & Parikh, M. (2020). Long-term outcomes comparing metabolic surgery to no surgery in patients with type 2 diabetes and body mass index 30-35. Surgery for obesity and related diseases : official journal of the American Society for Bariatric Surgery, 16(4), 503508. https://doi-org.saz.idm.oclc.org/10.1016/j.soard.2020.01.016
- Horwitz, D., Saunders, J. K., Ude-Welcome, A., Marie Schmidt, A., Dunn, V., Leon Pachter, H., & Parikh, M. (2016). Three-year follow-up comparing metabolic surgery versus medical weight management in patients with type 2 diabetes and BMI 30-35. The role of sRAGE biomarker as predictor of satisfactory outcomes. Surgery for obesity and related diseases : official journal of the American Society for Bariatric Surgery, 12(7), 13371341. https://doi-org.saz.idm.oclc.org/10.1016/j.soard.2016.01.016
- Ikramuddin S, Billington CJ, Lee WJ, Bantle JP, Thomas AJ, Connett JE, Leslie DB, Inabnet WB 3rd, Jeffery RW, Chong K, Chuang LM, Sarr MG, Jensen MD, Vella A, Ahmed L, Belani K, Schone JL, Olofson AE, Bainbridge HA, Laqua PS, Wang Q, Korner J. Roux-en-Y gastric bypass for diabetes (the Diabetes Surgery Study): 2-year outcomes of a 5-year, randomised, controlled trial. Lancet Diabetes Endocrinol. 2015 Jun;3(6):413-422. doi: 10.1016/S2213-8587(15)00089-3. Epub 2015 May 12. Erratum in: Lancet Diabetes Endocrinol. 2015 Jul;3(7):e5. PubMed PMID: 25979364; PubMed Central PMCID: PMC4477840.
- Ikramuddin S, Korner J, Lee WJ, Bantle JP, Thomas AJ, Connett JE, Leslie DB, Inabnet WB 3rd, Wang Q, Jeffery RW, Chong K, Chuang LM, Jensen MD, Vella A, Ahmed L, Belani K, Olofson AE, Bainbridge HA, Billington CJ. Durability of Addition of Roux-en-Y Gastric Bypass to Lifestyle Intervention and Medical Management in Achieving Primary Treatment Goals for Uncontrolled Type 2 Diabetes in Mild to Moderate Obesity: A Randomized Control Trial. Diabetes Care. 2016 Sep;39(9):1510-8. doi: 10.2337/dc15-2481. Epub 2016 Jun 16. PubMed PMID: 27311493; PubMed Central PMCID: PMC5001141.
- Ikramuddin S, Korner J, Lee WJ, Connett JE, Inabnet WB, Billington CJ, Thomas AJ, Leslie DB, Chong K, Jeffery RW, Ahmed L, Vella A, Chuang LM, Bessler M, Sarr MG, Swain JM, Laqua P, Jensen MD, Bantle JP. Roux-en-Y gastric bypass versus intensive medical management for the control of type 2 diabetes, hypertension, and hyperlipidemia: the Diabetes Surgery Study randomized clinical trial. JAMA. 2013 Jun 5;309(21):2240-9. doi: 10.1001/jama.2013.5835. PubMed PMID: 23736733; PubMed Central PMCID: PMC3954742.
- Ikramuddin S, Korner J, Lee WJ, Thomas AJ, Connett JE, Bantle JP, Leslie DB, Wang Q, Inabnet WB 3rd, Jeffery RW, Chong K, Chuang LM, Jensen MD, Vella A, Ahmed L, Belani K, Billington CJ. Lifestyle Intervention and Medical Management With versus Without Roux-en-Y Gastric Bypass and Control of Hemoglobin A1c, LDL Cholesterol, and Systolic Blood Pressure at 5 Years in the Diabetes Surgery Study. JAMA. 2018 Jan 16;319(3):266-278. doi: 10.1001/jama.2017.20813. PubMed PMID: 29340678;PubMed Central PMCID: PMC5833547.
- International Diabetes Federation. IDF Clinical Practice Recommendations for managing Type 2 Diabetes in Primary Care. 2017.
- Lau, E., Belda, E., Picq, P., Carvalho, D., Ferreira-Magalhães, M., Silva, M. M., Barroso, I., Correia, F., Vaz, C. P., Miranda, I., Barbosa, A., Clément, K., Doré, J., Freitas, P., & Prifti, E. (2021). Gut microbiota changes after metabolic surgery in adult diabetic patients with mild obesity: a randomised controlled trial. Diabetology & metabolic syndrome, 13(1), 56. https://doi-org.saz.idm.oclc.org/10.1186/s13098-021-00672-1
- Lean ME, Leslie WS, Barnes AC, Brosnahan N, Thom G, McCombie L, Peters C, Zhyzhneuskaya S, Al-Mrabeh A, Hollingsworth KG, Rodrigues AM, Rehackova L, Adamson AJ, Sniehotta FF, Mathers JC, Ross HM, McIlvenna Y, Stefanetti R, Trenell M, Welsh P, Kean S, Ford I, McConnachie A, Sattar N, Taylor R. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet. 2018 Feb 10;391(10120):541-551. doi: 10.1016/S0140-6736(17)33102-1. Epub 2017 Dec 5. PubMed PMID: 29221645.
- Lean MEJ, Leslie WS, Barnes AC, Brosnahan N, Thom G, McCombie L, Peters C, Zhyzhneuskaya S, Al-Mrabeh A, Hollingsworth KG, Rodrigues AM, Rehackova L, Adamson AJ, Sniehotta FF, Mathers JC, Ross HM, McIlvenna Y, Welsh P, Kean S, Ford I, McConnachie A, Messow CM, Sattar N, Taylor R. Durability of a primary care-led weight-management intervention for remission of type 2 diabetes: 2-year results of the DiRECT open-label, cluster-randomised trial. Lancet Diabetes Endocrinol. 2019 May;7(5):344-355. doi: 10.1016/S2213-8587(19)30068-3. Epub 2019 Mar 6. PubMed PMID: 30852132.
- Liang Z, Wu Q, Chen B, Yu P, Zhao H, Ouyang X. Effect of laparoscopic Roux-en-Y gastric bypass surgery on type 2 diabetes mellitus with hypertension: a randomized controlled trial. Diabetes Res Clin Pract. 2013 Jul;101(1):50-6. doi: 10.1016/j.diabres.2013.04.005. Epub 2013 May 22. PubMed PMID: 23706413.
- Leslie, W. S., Ford, I., Sattar, N., Hollingsworth, K. G., Adamson, A., Sniehotta, F. F., McCombie, L., Brosnahan, N., Ross, H., Mathers, J. C., Peters, C., Thom, G., Barnes, A., Kean, S., McIlvenna, Y., Rodrigues, A., Rehackova, L., Zhyzhneuskaya, S., Taylor, R., & Lean, M. E. (2016). The Diabetes Remission Clinical Trial (DiRECT): protocol for a cluster randomised trial. BMC family practice, 17, 20. https://doi-org.saz.idm.oclc.org/10.1186/s12875-016-0406-2
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, Lingvay I, Rosenstock J, Seufert J, Warren ML, Woo V, Hansen O, Holst AG, Pettersson J, Vilsbøll T; SUSTAIN-6 Investigators. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2016a Nov 10;375(19):1834-1844. Epub 2016 Sep 15. PubMed PMID: 27633186.
- Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JF, Nauck MA, Nissen SE, Pocock S, Poulter NR, Ravn LS, Steinberg WM, Stockner M, Zinman B, Bergenstal RM, Buse JB; LEADER Steering Committee; LEADER Trial Investigators. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2016b Jul 28;375(4):311-22. doi: 10.1056/NEJMoa1603827. Epub 2016 Jun 13. PubMed PMID: 27295427; PubMed Central PMCID: PMC4985288.
- Madsen LR, Baggesen LM, Richelsen B, Thomsen RW. Effect of Roux-en-Y gastric bypass surgery on diabetes remission and complications in individuals with type 2 diabetes: a Danish population-based matched cohort study. Diabetologia. 2019 Apr;62(4):611-620. doi: 10.1007/s00125-019-4816-2. Epub 2019 Feb 6. PubMed PMID: 30734055.
- Mingrone G, Panunzi S, De Gaetano A, Guidone C, Iaconelli A, Nanni G, Castagneto M, Bornstein S, Rubino F. Bariatric-metabolic surgery versus conventional medical treatment in obese patients with type 2 diabetes: 5 year follow-up of an open-label, single-centre, randomised controlled trial. Lancet. 2015 Sep 5;386(9997):964-73. doi: 10.1016/S0140-6736(15)00075-6. PMID: 26369473.
- NHG-standaard Diabetes mellitus type 2. 2018.
- Parikh M, Chung M, Sheth S, McMacken M, Zahra T, Saunders JK, Ude-Welcome A, Dunn V, Ogedegbe G, Schmidt AM, Pachter HL. Randomized pilot trial of bariatric surgery versus intensive medical weight management on diabetes remission in type 2 diabetic patients who do NOT meet NIH criteria for surgery and the role of soluble RAGE as a novel biomarker of success. Ann Surg. 2014 Oct;260(4):617-22; discussion 622-4. doi: 10.1097/SLA.0000000000000919. PubMed PMID: 25203878; PubMed Central PMCID: PMC4691842.
- Rubino F, Nathan DM, Eckel RH, Schauer PR, Alberti KG, Zimmet PZ, Del Prato S, Ji L, Sadikot SM, Herman WH, Amiel SA, Kaplan LM, Taroncher-Oldenburg G, Cummings DE; Delegates of the 2nd Diabetes Surgery Summit. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: a Joint Statement by International Diabetes Organizations. Obes Surg. 2017 Jan;27(1):2-21. doi: 10.1007/s11695-016-2457-9. PubMed PMID: 27957699.
- Schauer PR, Bhatt DL, Kirwan JP, Wolski K, Aminian A, Brethauer SA, Navaneethan SD, Singh RP, Pothier CE, Nissen SE, Kashyap SR; STAMPEDE Investigators. Bariatric Surgery versus Intensive Medical Therapy for Diabetes - 5-Year Outcomes. N Engl J Med. 2017 Feb 16;376(7):641-651. doi: 10.1056/NEJMoa1600869. PubMed PMID: 28199805; PubMed Central PMCID: PMC5451258.
- Schauer PR, Bhatt DL, Kirwan JP, Wolski K, Brethauer SA, Navaneethan SD, Aminian A, Pothier CE, Kim ES, Nissen SE, Kashyap SR; STAMPEDE Investigators. Bariatric surgery versus intensive medical therapy for diabetes--3-year outcomes. N Engl J Med. 2014 May 22;370(21):2002-13. doi: 10.1056/NEJMoa1401329. Epub 2014 Mar 31. PubMed PMID: 24679060; PubMed Central PMCID: PMC5451259.
- Schauer PR, Kashyap SR, Wolski K, Brethauer SA, Kirwan JP, Pothier CE, Thomas S, Abood B, Nissen SE, Bhatt DL. Bariatric surgery versus intensive medical therapy in obese patients with diabetes. N Engl J Med. 2012 Apr 26;366(17):1567-76. doi: 10.1056/NEJMoa1200225. Epub 2012 Mar 26. PubMed PMID: 22449319; PubMed Central PMCID: PMC3372918.
- Sheng B, Truong K, Spitler H, Zhang L, Tong X, Chen L. The Long-Term Effects of Bariatric Surgery on Type 2 Diabetes Remission, Microvascular and Macrovascular Complications, and Mortality: a Systematic Review and Meta-Analysis. Obes Surg. 2017 Oct;27(10):2724-2732. doi: 10.1007/s11695-017-2866-4. PMID: 28801703.
- Sjöström L, Peltonen M, Jacobson P, Ahlin S, Andersson-Assarsson J, Anveden Å, Bouchard C, Carlsson B, Karason K, Lönroth H, Näslund I, Sjöström E, Taube M, Wedel H, Svensson PA, Sjöholm K, Carlsson LM. Association of bariatric surgery with long-term remission of type 2 diabetes and with microvascular and macrovascular complications. JAMA. 2014 Jun 11;311(22):2297-304. doi: 10.1001/jama.2014.5988. PMID: 24915261.
- Syn NL, Cummings DE, Wang LZ, Lin DJ, Zhao JJ, Loh M, Koh ZJ, Chew CA, Loo YE, Tai BC, Kim G, So JB, Kaplan LM, Dixon JB, Shabbir A. Association of metabolic-bariatric surgery with long-term survival in adults with and without diabetes: a one-stage meta-analysis of matched cohort and prospective controlled studies with 174?772 participants. Lancet. 2021 May 15;397(10287):1830-1841. doi: 10.1016/S0140-6736(21)00591-2. Epub 2021 May 6. PMID: 33965067.
- Tsilingiris D, Koliaki C, Kokkinos A. Remission of Type 2 Diabetes Mellitus after Bariatric Surgery: Fact or Fiction? Int J Environ Res Public Health. 2019 Aug 30;16(17):3171. doi: 10.3390/ijerph16173171. PMID: 31480306; PMCID: PMC6747427.
- Zhou X, Yu J, Li L, Gloy VL, Nordmann A, Tiboni M, Li Y, Sun X. Effects of Bariatric Surgery on Mortality, Cardiovascular Events, and Cancer Outcomes in Obese Patients: Systematic Review and Meta-analysis. Obes Surg. 2016 Nov;26(11):2590-2601. doi: 10.1007/s11695-016-2144-x. PMID: 26992897.
- Zorginstituut Nederland. Rapport De gecombineerde leefstijlinterventie nader bekeken. 2018 Zorginstituut Nederland. Standpunt Flash Glucose Monitoring (FGM) voor mensen met diabetes met een intensief insulineschema. 2019
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
2. Provide data per treatment group on the most important prognostic factors ((potential) confounders).
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias assessment
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/ unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/ unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/ unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/ unclear) |
|
Cohen (2020) |
Using a computer-generated, centrally concealed, and sex-stratified 1:1 randomization sequence, we assigned 100 eligible patients to best medical treatment or RYGB |
Unclear
No information regarding allocation concealment provided. |
Likely |
Likely
|
Unclear |
Unlikely |
Unlikely |
Unlikely |
|
Lau (2021) |
Consequently, we included 20 participants who were randomly assigned to one of the two study arms, with a 1:1 ratio, using a computer-generated randomisation procedure, to receive either RYGB or standard medical therapy |
Unlikely |
Likely
|
Likely |
Likely |
Unlikely |
Unlikely |
Likely |
|
Ikramuddin, 2013, 2015, 2016 and 2018 |
Participants were randomized with equal probability to control or intervention. The randomization schedule used permutated blocks of random length within each site, so that each site would have nearly equal proportions in each arm. |
Likely, randomization assignment was unblinded. |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Liang, 2013 |
Patients were randomized into three groups in a 1:1:1 ratio with the use of a computerized system for generating random numbers. |
Unlikely |
Likely |
Likely |
Unclear |
Unlikely |
Unlikely |
Likely |
|
Parikh, 2014 Horwitz (2016) / (2020) |
Patients were randomized by RAs calling a central phone number to receive allocation; the allocation sequence was generated in advance and stratified to ensure balance of patients with BMI 30–35 in each of the arms. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Likely |
Likely |
|
Azevedo, 2018 |
Not described |
Unclear |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
|
Schauer, 2012, 2014 and 2017 |
Using a block-randomization method with a 1:1:1 ratio, 150 patients were assigned to undergo intensive medical therapy alone or intensive medical therapy plus either Roux-en-Y gastric bypass or sleeve gastrectomy, with stratification according to the patients’ use of insulin at baseline. |
Unlikely |
Likely |
Likely |
Likely |
Unlikely |
Unlikely |
Unclear for the subgroup |
1. Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
2. Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
3. Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
4. Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
5. If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
6. Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Kenngott 2013 |
Studieprotocol |
|
Shukla 2012 |
Geen systematisch review of originele studie |
|
Maggard-Gibbons 2013 |
Recenter review beschikbaar |
|
Wu 2016 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Cummings 2016a |
Geen systematisch review of originele studie |
|
Cummings 2016b |
Voldoet niet aan PICO: BMI>35 |
|
Ding 2015 |
Voldoet niet aan PICO: alleen maagbanden |
|
Malin 2014 |
Voldoet niet aan PICO: uitkomst is acylated ghrelin |
|
Courcoulas 2014 |
Voldoet niet aan PICO: BMI>35 |
|
Halperin 2014 |
Voldoet niet aan PICO: BMI>35 |
|
Palikhe 2014 |
Niet gerandomiseerde studie |
|
Courcoulas 2015 |
Voldoet niet aan PICO: BMI>35 |
|
Giske 2014 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Picot 2009 |
Kosten-effectiviteitsanalyse |
|
Crawford 2018 |
Voldoet niet aan PICO: uitkomst is increased bone turnover |
|
Serrot 2011 |
Geen RCT |
|
Campos 2013 |
Artikel in Portugees |
|
Ribaric 2014 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Yan 2016 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Crawford 2017 |
Conference abstract |
|
Khorgami 2018 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Cummings 2018 |
Geen systematisch review of originele studie |
|
Cohen 2017 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Horwitz 2016 |
Geen RCT |
|
Rao 2015 |
Review met voornamelijk niet-vergelijkende studies |
|
Mullier-Stich 2015 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd, individuele studies die voldeden zijn meegenomen in de literatuuranalyse |
|
Ngiam 2014 |
Recenter review beschikbaar |
|
Gloy 2013 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Cohen 2013 |
Recenter review beschikbaar |
|
Shimizu 2012 |
Recenter review beschikbaar |
|
Reis 2012 |
Recenter review beschikbaar |
|
Li 2012 |
Recenter review beschikbaar |
|
O’Brien 2018 |
Geen RCT |
|
Tan 2017 |
Conference abstract |
|
Luque 2017 |
Conference abstract |
|
Banerjee 2017 |
Kosten-effectiviteitsanalyse |
|
Shah 2016 |
Conference abstract |
|
Thomas 2014 |
Beschrijving van recruitment van een RCT |
|
Abbatini 2012 |
Geen RCT |
|
Khorgami, 2019 |
Voldoet niet aan PICO: BMI>35 |
|
Cresci, 2020 |
Voldoet niet aan PICO: BMI>35 |
|
Ding, 2020 |
Individuele studies die voldoen aan PICO zijn meegenomen in de literatuuranalyse |
|
Carmona, 2021 |
Individuele studies die voldoen aan PICO zijn meegenomen in de literatuuranalyse |
|
Cui, 2021 |
Individuele studies die voldoen aan PICO zijn meegenomen in de literatuuranalyse |
|
Li, 2021 |
Design voldoet niet |
|
Constantin, 2019 |
Voldoet niet aan PICO: uitkomstmaat |
|
Iosif, 2019 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Katsogiannos, 2019 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Courcoulas, 2020 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
|
Lorkowski, 2020 |
Voldoet niet aan PICO: allerlei BMI’s geïncludeerd |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 10-05-2023
In 2023 is deze richtlijnmodule op modulair niveau aangepast. Hierbij heeft een update van de literatuur plaatsgevonden en zijn er tekstuele aanpassingen gedaan die door de werkgroep akkoord zijn bevonden. De inhoud van de module is niet veranderd. De oorspronkelijke autorisatiedatum is datum blijft daarom gehandhaafd.
De Nederlandse Vereniging voor Heelkunde is regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS) en/of andere bron. De financier heeft geen enkele invloed gehad op de inhoud van de richtlijn.
Doel en doelgroep
Doel
Doel van deze herziening is om tot een richtlijn te komen waarin de meest recente kennis omtrent de chirurgische zorg voor patiënten met obesitas is vastgelegd.
Doelgroep
Deze richtlijn is geschreven voor alle leden van de beroepsgroepen die betrokken zijn bij de zorg voor patiënten met obesitas.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met ernstige obesitas (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Dr. F.J. Berends, chirurg, Nederlandse Vereniging voor Heelkunde (voorzitter)
- Dr. I.F. Faneyte, chirurg, ZiekenhuisGroep Twente, Almelo/Hengelo, Nederlandse Vereniging voor Heelkunde
- Dr. R. Schouten, chirurg, Flevoziekenhuis, Almere, Nederlandse Vereniging voor Heelkunde
- Dr. F.M.H. van Dielen, chirurg, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Heelkunde
- Prof. dr. L.W.E. van Heurn, hoogleraar kinderchirurgie, chirurg, Amsterdam UMC locatie AMC, Amsterdam, plaats, Nederlandse Vereniging voor Heelkunde
- Dr. S. Bouma- de Jongh, kinderarts, De Kinderartsenpraktijk, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.C.E. Vreugdenhil, kinderarts, MUMC+, Maastricht, Nederlandse Vereniging voor Kindergeneeskunde
- Dr. A.P. van Beek, internist, UMCG, Groningen, Nederlandse Internisten Vereniging
- Dr. J.S. Burgerhart, internist i.o., Erasmus MC, Rotterdam tot 31 december 2019, vanaf 1 januari 2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk, Nederlandse Internisten Vereniging
- Dr. M.J.M. Groenen, MDL-arts, Rijnstate, Arnhem, Nederlandse Vereniging van Maag-Darm-Leverartsen
- Dr. S.V. Koenen, gynaecoloog, Elisabeth-TweeSteden-Ziekenhuis, Tilburg, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Drs. M.S.Q. Kortenhorst, gynaecoloog i.o. UMC Utrecht, Utrecht, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. R.C. Painter, gynaecoloog, Amsterdam UMC, locatie AMC, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- Dr. J.O.E.H. van Laar, gynaecoloog, Máxima Medisch Centrum, Veldhoven/Eindhoven, Nederlandse Vereniging voor Obstetrie en Gynaecologie
- N.G. Cnossen, patiëntvertegenwoordiger, Nederlandse Stichting Over Gewicht
- Dr. C. Hinnen, klinisch psycholoog, LUMC, Leiden, Nederlands Instituut van Psychologen
- E. Govers BSc., diëtist, Amstelring, Amsterdam, Nederlandse Vereniging van Diëtisten
Klankbordgroep
- Prof. dr. E.F.C. van Rossum, internist, Erasmus MC, Rotterdam, Nederlandse Internisten Vereniging
Met ondersteuning van
- Dr. A. Bijlsma, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. J. Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Dr. W.A. van Enst, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot oktober 2018)
- Dr. S.N. Hofstede, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- Drs. A.A. Lamberts, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf oktober 2018)
- J.C.F. Ket, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- I. van Dusseldorp, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
- E. Delvaux, medisch informatiespecialist, Van Dusseldorp, Delvaux & Ket
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in de onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten.
|
Achternaam WG-lid |
Hoofdfunctie |
Nevenwerkzaamheden |
Persoonlijke financiële belangen |
Persoonlijke relaties |
Extern gefinancierd onderzoek |
Intellectuele belangen en reputatie |
Overige belangen |
Getekend op |
Actie (voorstel) |
|
Berends (voorzitter) |
Freelance chirurg |
Consultant Johnson & Johnson tot september 2018 (betaald) |
De firma Johnson & Johnson heeft een "baratric and metabolic board" waarvan ik lid ben. (Betaald) |
geen |
geen |
|
geen |
24-11-2017 |
Geen. Er staan geen producten van Johnson in deze richtlijn. |
|
Hinnen |
Oncologisch centrum, LUMC, afdeling medische psychologie en ziekenhuis-psychiatrie, MC Slotervaart |
Bestuur Nederlandse Behavioral Medicine Federatie (onbetaald) |
geen |
geen |
geen |
geen |
geen |
31-10-2017 |
Geen |
|
Schouten |
Chirurg, Flevoziekenhuis te Almere |
geen |
geen |
geen |
geen |
geen |
geen |
8-11-2017 |
Geen |
|
Groenen |
Maag Darm Leverarts, werkzaam in Rijnstate Ziekenhuis te Arnhem |
Concilium Gastroenterolgicum, onbetaald |
geen |
geen |
Betrokken bij onderzoek betreffende Chronische darmontsteking (Crohn en Colitis Ulcerosa) waarbij ondersteuning door industrie. |
geen |
geen |
9-11-2017 |
Geen, gefinancierde onderzoeken/ training gaan niet over obesitas |
|
Faneyte |
Chirurg 75% ZiekenhuisgroepTwente |
geen |
geen persoonlijke financiële belangen behoudens eigen werk als vrijgevestigd bariatrisch chirurg |
geen |
geen |
geen |
geen |
9-11-2017 |
Geen |
|
Govers |
Diëtist, Stichting Amstelring (inmiddels niet meer werkzaam) |
Voorzitter Kenniscentrum Diëtisten Overgewicht en Obesitas, Amsterdam, |
geen |
geen |
geen |
geen |
- |
26-11-2017 |
Geen |
|
Van Laar |
gynaecoloog |
Assistant professor TU/e |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Koenen |
Gynaecoloog, UMC Utrecht (vanaf 1 januari 2018 ETZ, Tilburg) 1,0 FTE werkzaam |
Voorzitter Werkgroep Otterlo NVOG (werkgroep die verantwoordelijk is voor richtlijnen over de Verloskunde). Onbetaald |
geen |
geen |
geen |
geen |
nee |
12-12-2017 |
Geen |
|
Painter |
Gynaecoloog, Afdeling Verloskunde, AMC, Amsterdam 0,9 FTE |
• Affiliatie: Gynaecoloog Amsterdam UMC • lid van de werkgroep modulaire richtlijn Zwangerschap en Obesitas (NVOG). • vice voorzitter van de NVOG Pijler FMG Wetenschapscommissie • voorzitter SIG NVOG Diabetes, Obesitas en Zwangerschap • lid van de Koepel Wetenschap NVOG • lid van de RIVM Commissie Programma Nationale Hielprik Screening (namens de NVOG) • lid stuurgroep James Lind Alliance PSP 'Hyperemesis Gravidarum' |
geen |
geen |
CVON/ Nederlandse Hartstichting, WOMB project (hoofdaanvrager prof Roseboom) AMC-VuMc Alliantie OiO (mede aanvrager dr AE Budding) |
Lid Wetenschappelijke Advies Raad Stichting ZEHG (Hyperemesis Gravidarum patiënten vereniging) |
geen |
29-11-2017 |
Geen, de onderzoeken betreffen onderwerpen die buiten de afbakening van de richtlijn vallen. |
|
Kortenhorst |
Gynaecoloog-in-opleiding Wilhelmina Kinderziekenhuis |
geen |
geen |
geen |
geen |
geen |
geen |
1-12-2017 |
Geen |
|
Cnossen |
Ervaringsdeskundige werkgroep bariatrie van de Nederlandse stichting Over Gewicht -(Onbetaald) |
geen |
geen |
geen |
geen |
geen |
geen |
19-1-2018 |
Geen |
|
Burgerhart |
internist- vasculair geneeskundig i.o. in opleiding Erasmus MC Rotterdam t/m 31-12-2019. Vanaf 1-1-2020 internist-vasculair geneeskundige, Ziekenhuis St Jansdal, Harderwijk |
geen |
geen |
geen |
geen |
geen |
geen |
18-5-2018 |
Geen |
|
Heurn |
Kinderchirurg, hoogleraar kinderchirurgie AMC en VUMC |
geen |
geen |
geen |
geen |
Hoofdonderzoeker BASIC trial: onderzoek naar bariatrische |
geen |
28-2-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
|
Beek |
internist-endocrinoloog (100%) in het UMC Groningen. |
geen |
geen |
geen |
Select studie. Effecten op cardiovasculaire uitkomsten bij patiënten met overgewicht of obesitas (Novo Nordisk). Het betreft een multicenter trial waarbij in totaal 17500 patiënten worden geïncludeerd. Mijn centrum zal 25 patiënten includeren en NL in totaal 250. Ik ben National Leader in deze studie die is gestart 24-10-2018. Uitkomsten worden verwacht in 2023. Geen belangen verstrengeling zowel inhoudelijk (resultaten nog niet bekend) als financieel. |
geen |
geen |
13-7-2018 |
Geen
Uitkomsten van de studie worden verwacht in 2023. Redelijkerwijs zal deze studie dus geen belangenverstrengeling opleveren omdat er geen uitkomsten nog van de studie zijn. |
|
Dielen |
Bariatrisch chirurg |
0.0 fte aanstelling in het Mumc+ als gastoperateur voor de BASIC trial. Betaald |
geen |
geen |
geen |
Gastroperateur van de BASIC trial en derhalve hierbij actief betrokken. - Principal investigator van een internationale multicenter prospectief gerandomiseerde studie gastric sleeve versus. gastric bypass in adolescenten. (TEEN-Best). Voorlopige startdatum 1 september 2018 |
geen |
6-3-2018 |
Geen, onderzoek wordt op dit moment gefinancierd door het ziekenhuis zelf. Funding wordt nog wel gezocht. Resultaten nog niet bekend |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een afgevaardigde van de Stichting Over Gewicht (voorheen Nederlandse Obesitas Vereniging) plaats te laten nemen in de werkgroep. De volgende patiëntenorganisaties zijn uitgenodigd voor de Invitational conference: Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht. Een verslag van deze bijeenkomst is besproken in de werkgroep en de belangrijkste knelpunten zijn verwerkt in de richtlijn. Tijdens de oriënterende zoekactie (uitgevoerd op 18 december 2017) werd gezocht op literatuur naar patiëntenperspectief (zie Strategie voor zoeken en selecteren van literatuur). De conceptrichtlijn is tevens voor commentaar voorgelegd aan de Patiëntenfederatie Nederland, Hart en Vaatgroep, Diabetesvereniging en Stichting Over Gewicht.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stap-voor-stap beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door verschillende stakeholders tijdens een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd eerst oriënterend gezocht naar bestaande buitenlandse richtlijnen (GIN-database), systematische reviews, literatuur over patiëntvoorkeuren en patiëntrelevante uitkomstmaten (Medline, Comet-initiative en COSMIN database). Vervolgens werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens is aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiëntenperspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (risk of bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de Risk of Bias (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR - voor systematische reviews; Cochrane - voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottowa - voor observationeel onderzoek; QUADAS II - voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal studies en overeenkomstigheid (homogeniteit) tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk* |
|
|
Laag |
|
|
Zeer laag |
|
*in 2017 heeft het Dutch GRADE Network bepaalt dat de voorkeursformulering voor de op een na hoogste gradering ‘redelijk’ is in plaats van ‘matig’
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008), en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie (overall conclusie). Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De overall bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de cruciale uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overall conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje 'Overwegingen'.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals de expertise van de werkgroepleden, de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van Zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden. Een overzicht van de onderwerpen waarvoor (aanvullend) wetenschappelijk van belang wordt geacht, is als aanbeveling in het aanverwante product Kennislacunes beschreven.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Brouwers, M. C., Kho, M. E., Browman, G. P., Burgers, J. S., Cluzeau, F., Feder, G., ... & Littlejohns, P. (2010). AGREE II: advancing guideline development, reporting and evaluation in health care. Canadian Medical Association Journal, 182(18), E839-E842.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site/richtlijnontwikkeling.html
Kennisinstituut. Ontwikkeling van Medisch Specialistische Richtlijnen: stappenplan. Kennisinstituut van Medisch Specialisten. 2015
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Schünemann, H. J., Oxman, A. D., Brozek, J., Glasziou, P., Jaeschke, R., Vist, G. E., ... & Bossuyt, P. (2008). Rating Quality of Evidence and Strength of Recommendations: GRADE: Grading quality of evidence and strength of recommendations for diagnostic tests and strategies. BMJ: British Medical Journal, 336(7653), 1106.
Wessels, M., Hielkema, L., & van der Weijden, T. (2016). How to identify existing literature on patients' knowledge, views, and values: the development of a validated search filter. Journal of the Medical Library Association: JMLA, 104(4), 320.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
