Toediening van botulinetoxine bij spasticiteit
Uitgangsvraag
Welke methode van injecteren verdient de voorkeur bij het toedienen van botulinetoxine door middel van intramusculaire injecties bij patiënten met cerebrale en/of spinale spasticiteit?
Aanbeveling
Injecteer botulinetoxine onder echografische geleiding vanwege de accuratesse van het injecteren, en daarmee de positieve invloed op de spiertonus, verminderde kans op iatrogeen letsel, en inzicht in de morfologische veranderingen van de te behandelen spieren.
Als alternatief op echografische methoden kan overwogen worden om botulinetoxine onder geleiding van elektrostimulatie te injecteren.
Combineer beide methoden (echografische methoden en elektrostimulatie) voor maximale nauwkeurigheid met name bij diep gelegen spieren.
Injecteer botulinetoxine bij voorkeur niet onder EMG-geleiding gezien de lagere accuratesse ten opzichte van de eerstgenoemde injectietechnieken, ondanks dat er sprake is van een grotere nauwkeurigheid en betere effecten van behandeling ten opzichte van de palpatoire methode.
Injecteer botulinetoxine niet door slechts gebruik te maken van de landmark palpatoire methode, gezien de laagste accuratesse en minste effectiviteit van toediening van botulinetoxine.
Overwegingen
Naast de gegevens uit de geselecteerde literatuur zijn ook praktijkervaringen met de verschillende injectietechnieken van belang. Bij gebruik van elektrostimulatie kan het voorkomen dat de doelspier niet gestimuleerd kan worden, terwijl men toch in de goede spier zit. Een eenduidige verklaring hiervoor is er niet. Wel komt het in praktijk vaker voor indien er sprake is van zeer hoge spiertonus. Ook kan er sprake zijn van algemene of lokale morfologische verandering van de spier zoals atrofie, vervetting en/of verbindweefseling, welke gepaard gaan met verlies van spiercellen. Logischerwijze neemt de prikkelbaarheid van de spier hierdoor af. Ook kunnen arthrogene en/of capsulogene beperkingen ertoe leiden dat er geen gewenste beweging plaatsvindt in een gedeelte van de extremiteit. Vaak wordt deze selectieve beweging als controle van accuratesse van deze injectietechniek gebruikt.
Gebruik van echografie maakt het mogelijk om de te behandelen spier voor het injecteren over diens verloop te bekijken. Hierbij is het mogelijk om morfologische veranderingen van de gehele spier of van een gedeelte te herkennen, zoals vervetting en verbindweefseling. Het injecteren van botulinetoxine in de morfologisch geheel veranderde spieren is waarschijnlijk niet zinvol. Bij gedeeltelijk veranderde spieren kan een injectieplek gekozen worden zonder of met de minste morfologische veranderingen.
In een niet geïncludeerd artikel van (Picelli, 2014) wordt bij spastische spieren een directe relatie aangetoond tussen de mate van intensiteit van het echosignaal, de score op de Modified Ashworth Scale (MAS) en de actiepotentialen bij EMG registratie (CMAPS). In de conclusie geven de auteurs aan dat deze bevindingen van meerwaarde kunnen zijn bij de keuze en opstellen van een behandelplan. Kortom, morfologische verandering van de spier of van een gedeelte daarvan kan van invloed zijn op het effect van botulinetoxine. De schrijver van het artikel geeft aan dat verder onderzoek hiernaar van belang is.
Bij EMG-geleide injecties doet zich het fenomeen voor dat, als er sprake is van meerdere over elkaar gelegen spieren die alle een verhoogde tonus vertonen, hierdoor elke spier een gelijksoortig signaal kan geven. Hierdoor kan de selectiviteit van deze methode per situatie verschillen.
Eén van de bijwerkingen, tevens risico’s van toediening van botulinetoxine, is een algemene reactie buiten de behandelde spiergroepen. Het betreft bijvoorbeeld algemene spierzwakte, ademhalings- en slikproblematiek, incontinentie voor urine, en dubbelzien. Dit kan gepaard gaan met verslechtering van functionele mogelijkheden zoals verslechtering van sta-, loop- en hand-armvaardigheid. De kans op deze bijwerkingen is bij alle toedieningsvormen vergelijkbaar klein indien men handelt volgens de regels wat betreft de maximale dosis per behandeling, het voorkómen van intravasale toediening door voor het injecteren te aspireren, en voorzichtigheid betracht bij neurologische ziekten gepaard gaande met ademhalings-, slik- en continentieproblematiek. Daarnaast kan er sprake zijn van een lokale complicatie bij het injecteren van botulinetoxine. Aangezien alleen bij het gebruik van echogeleiding er sprake is van visuele controle bij het positioneren van de naald, is de kans op iatrogeen vaat- of zenuwletsel het kleinst bij gebruik van deze toedieningstechniek ten opzichte van andere methoden.
Patiëntenperspectief
De patiëntvriendelijkheid van de toedieningswijze wordt bepaald door de volgende factoren:
- snelheid en precisie van de behandeling;
- pijnlijkheid van de behandeling (naaldgebruik, gebruik lokale Emla pleisters);
- duur van het behandeleffect.
De snelheid van de behandeling wordt bij alle injectietechnieken bepaald door meerdere factoren. Om te beginnen speelt de ervaring van de behandelaar met de gebruikte injectietechniek en de accuratesse van het handelen een grote rol. Het snel kunnen vinden van de te behandelen spiergroepen is verschillend per injectietechniek. Met betrekking tot dit aspect is er geen literatuur beschikbaar. Het ligt echter wel voor de hand dat de injectietechniek waarbij gebruik wordt gemaakt van elektrostimulatie en/of echografie een doeltreffender lokalisatie van de doelspieren mogelijk maakt.
Van de vier genoemde injectietechnieken is de ervaring dat het injecteren onder elektrostimulatie pijnlijk kan zijn. Elektrostimulatie op zich kan pijnsensatie geven maar ook de spiercontracties die door de elektrostimulatie worden opgewekt. De ervaring is dat met name bij bepaalde patiëntgroepen zoals dwarslaesie-patiënten elektrostimulatie tijdens de behandeling tot plotselinge toename van tonus en clonus van de gestimuleerde spier kan leiden.
Het effect van de behandeling en de duur ervan is mogelijk afhankelijk van de accuratesse van de toediening en de juiste dosering van botulinetoxine. Van groot belang is het voorafgaand specialistisch onderzoek gericht op het herkennen van de bij een spastisch patroon betrokken spiergroepen en het opstellen van een behandelplan.
Gezien de aanwijzingen in de literatuur en op basis van praktische ervaring zijn er twee methoden van injecteren die voorafgaand informatie geven over verhoogde tonus en mogelijk ook mate van spasticiteit. Dit betreft de injectietechnieken onder geleiding van EMG en met name echografie (Picelli, 2014). Zodoende kunnen ze in tegenstelling tot palpatie en elektrostimulatie bijdragen aan het opstellen van een behandelplan. Immers het injecteren in een vervette, atrofische of verbindweefselde spier heeft geen zin. Bovendien is met behulp van echografie een hypertone spier herkenbaar door een specifieke, vaak ronde vorm welke door uitwendige druk niet goed te veranderen is. Ook is een rekclonus goed zichtbaar evenals spontane contracties (fasciculaties, myclonieën).
Professioneel perspectief
Ook hier zijn de al eerder genoemde punten van belang:
- een zo kort mogelijke duur van de behandeling;
- minste kans op complicatie;
- accuratesse van het injecteren en zo klein mogelijke verspilling van botulinetoxine.
Uit bedrijfstechnisch oogpunt spelen een rol de beschikbaarheid en/of aanschafkosten van de benodigde apparatuur. Dit geldt voor beschikbaarheid van een elektrostimulatie-, EMG- en/of echoapparaat. De aanschafkosten zijn zeer uiteenlopend waarbij elektrostimulatie een relatief goedkoop apparaat is. Lokale situatie waarbij een apparaat gedeeld wordt met andere vakgroepen kan tot goedkopere oplossingen leiden.
Onderbouwing
Achtergrond
Eén van de methode van lokale behandeling van verhoogde tonus of spasticiteit is intramusculaire toediening van botulinetoxine. Er wordt op dit moment gebruik gemaakt van een viertal injectietechnieken:
- Gebruikmakend van anatomische kennis waarbij zogenaamde landmarks een grote rol spelen bij de lokalisatie van de te behandelen spiergroepen;
- Elektromyogram (EMG) van hypertone spiergroepen om doelspieren te lokaliseren;
- Opzoeken van de te behandelen spiergroepen met behulp van elektrostimulatie waarbij respons in de vorm van een beweging van desbetreffende gedeelte van een extremiteit leidend is;
- Injecteren onder echogeleiding waarbij de echografische beelden gebruikt worden voor het lokaliseren van de te behandelen spieren, het ernaartoe leiden van de injectienaald en real time visuele controle op juistheid van de injectieplek door zichtbaarheid van botulinetoxine depot;
- Combinatie van echografie en elektrostimulatie.
De vraag is welke van deze methoden de voorkeur verdient op basis van:
- Nauwkeurigheid van het lokaliseren van de te behandelen doelspieren en van het injecteren;
- Patiëntvriendelijkheid en veiligheid.
Conclusies / Summary of Findings
|
Laag GRADE |
Er zijn aanwijzingen dat het geven van botulinetoxine injecties onder begeleiding van elektrostimulatie of echografie nauwkeuriger is dan op basis van palpatie.
Bronnen (Picelli, 2012a) |
|
Zeer laag GRADE |
Er zijn geringe aanwijzingen dat na het geven van botulinetoxine injecties onder begeleiding van elektrostimulatie of echografie spasticiteit minder is ten opzichte van spasticiteit na injecties op basis van palpatie.
Bronnen (Picelli, 2012a) |
|
Zeer laag GRADE |
Er zijn geringe aanwijzingen dat het geven van botulinetoxine injecties onder begeleiding van elektromyografie een positieve invloed heeft op functioneren ten opzichte van injecties op basis van palpatie.
Bronnen (Picelli, 2012a) |
Samenvatting literatuur
Beschrijving studies
Er zijn zes studies geïncludeerd met in totaal 264 patiënten. Dit waren vijf RCT’s (Picelli 2012A, Picelli 2012B, Picelli 2014, Ploumen 2014 en Santamato 2014) en één observationeel cohortonderzoek (Henzel, 2010). Vier studies onderzochten verschillende injectietechnieken bij patiënten met spasticiteit ten gevolgen van een CVA, één studie includeerde zowel patiënten met een CVA als met een traumatisch hersenletsel (Henzel 2010) en één studie includeerde patiënten met elke vorm van niet-aangeboren hersenletsel of cervicaal letsel (Ploumis 2014). In de studies werd de locatie voor de toediening van botulinetoxine injecties geïdentificeerd op basis van palpatie van landmarks (P) ten opzichte elektrostimulatie (ES) en/of ultrasonografie (US). In twee studies is het verschil in afstand tussen beide injectietechnieken of accuratesse onderzocht (Henzel, 2010; Picelli, 2012A), terwijl de overige studies klinische parameters onderzochten, namelijk de stijfheid van de behandelde spiergroep gemeten met de Modified Asworth Scale (MAS). Een overzicht van de geïncludeerde studies is weergegeven in tabel 1.
Tabel 1 Overzicht van de geïncludeerde studies
|
Studie |
Populatie |
Vergeleken technieken |
Uitkomsten |
|
Henzel 2010 |
CVA en traumatisch hersenletsel met spasticiteit in de onderarm |
Palpatie versus US |
Verschil in afstand tussen beide technieken |
|
Picelli 2012A |
CVA met spasticiteit in de gastrocnemius |
Palpatie, elektrostimulatie met US als referentiestandaard |
Accuratesse |
|
Picelli 2012B |
CVA met spasticiteit in de gastrocnemius |
Palpatie versus elektrostimulatie versus US |
Stijfheid (modified Ashworth scale) |
|
Picelli 2014 |
CVA met hand en vinger spasticiteit |
Palpatie versus elektrostimulatie versus US |
Stijfheid (modified Ashworth scale) |
|
Ploumis 2014 |
CVA, traumatisch hersenletsel, traumatisch cervicaal letsel |
Palpatie versus EMG |
Stijfheid (modified Ashworth scale) Functioneren (berthel index) |
|
Santamato 2014 |
CVA met hand en vinger spasticiteit |
Palpatie versus US |
Stijfheid (modified Ashworth scale) |
Resultaten
In drie van de geïncludeerde studies wordt er vergelijking gemaakt tussen drie verschillende injectietechnieken waarbij in één studie de accuratesse en in twee studies invloed op de tonus wordt beschreven. In de overige drie artikelen wordt de palpatietechniek vergeleken met EMG -en US-geleide injectietechniek waarvan één artikel betrekking heeft op accuratesse en twee op de mate van tonusvermindering.
De locatie van verhoogde tonus was per studie verschillend en de uitkomsten waren niet eenduidig gerapporteerd. Hierdoor was het niet mogelijk om een meta-analyse uit te voeren. De resultaten zijn zodoende kwalitatief beschreven. De studies gaven uitkomsten over de nauwkeurigheid van de injectietechniek. Ook rapporteerden ze de effectiviteit op het verminderen van de spiertonusen functioneren gemeten met de Barthel index na één maand en drie maanden, en de kans op complicaties binnen één maand. Snelheid van handelen, belasting voor de patiënt, patiëntveiligheid en/of kans op iatrogeen letsel werden niet beschreven.
Ook zijn er geen studies gevonden/geïncludeerd die de daadwerkelijke werkingsduur van botulinetoxine bij toepassing van verschillende injectietechnieken met elkaar vergelijken.
Accuratesse
Twee van de geïncludeerde studies hebben betrekking op de accuratesse van de toegepaste methode van het injecteren. In geen enkele studie is de EMG techniek in de vergelijking meegenomen.
De RCT van Picelli 2012A (N=81) onderzocht de accuratesse (overeenstemming tussen de geplaatste en daadwerkelijke locatie) van landmarks versus ES voor verschillende punten van de gastrocnemius (gastrocnemius lateralis – proximaal en distaal en gastrocnemius medialis – proximaal en distaal). Ultrasound (US) werd gebruikt als referentiestandaard.
De accuratesse ten opzichte van US was het hoogst bij gebruik van ES variërend van 87,17% tot 94,87%. Palpatie was in de gastrocnemius lateralis ongeveer gelijk aan ES, maar bij toepassing voor de gastrocnemius medialis was het beduidend minder accuraat (lateraal P: 64,28% versus ES: 87,17% en distaal P: 73,80% versus ES: 92,30%). Henzel et al. (2010) onderzochten in een observationele studie het verschil in afstand tussen injectieplekken gevonden op basis van de landmarktechniek versus US onder zeventien patiënten met spasticiteit in de bovenste extremiteiten. Hieruit kwam naar voren dat bij de proximo-distale coördinaten de pronator teres (PT) en de flexor pollicis longus (FPL) op significant verschillende afstand werden gelokaliseerd (PT: landmark= 4,7 ± 0,8 en US= 9,4 ± 3,0; FPL: landmark= 18,7 ± 2,6 en US= 17,9 ± 2,5). Bij de laterale coördinaten werden de flexor digitorum superficialis van dig 3 (FDS-3) en de flexor pollicis longus (FPL) op significante verschillende afstand gelokaliseerd (FDS-3: landmark= 17 ± 0 en US= 19,9 ± 4,1; FPL: landmark= 32,8 ± 13,7 en US= 21,9 ± 5,7).
Samenvattend kan geconcludeerd worden dat bij studies waarbij US als referentiekader wordt gebruikt elektrostimulatie met gemiddeld 90% de accuratesse van US benadert.
Bij de palpatietechniek is de accuratesse lager en veel sterker afhankelijk van de locatie van de spier. Vooral bij de dieper gelegen spieren, zowel in onderste als bovenste extremiteit, neemt de accuratesse van palpatietechniek af.
Er kon geen vergelijking plaatsvinden met de injectietechniek onder EMG geleiding.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat nauwkeurigheid van de injectietechniek is met drie niveaus verlaagd, omdat er beperkingen waren in de onderzoeksopzet (geen blindering van de outcome assessor) de resultaten voor een beperkt aantal spiergroepen gemeten zijn (indirectheid) en de RCT slechts 81 patiënten omvatte (imprecisie).
Invloed van injectietechniek op de mate van tonusvermindering
Van belang is te vermelden dat in de verschillende artikelen de begrippen tonusverhoging en spasticiteit niet eenduidig worden gebruikt.
Vier RCT’s vergeleken de mate van de tonus na toepassing van verschillende injectietechnieken binnen een maand. Spiertonus werd gemeten met de Modified Ashworth scale (MAS) en werd ook meegenomen als een proxy voor functioneren.
De resultaten werden gevonden voor spiertonus in de gastrocnemius en in de hand/vuist en vingers. Ploumis et al. beschreven de anatomische locatie van de waargenomen spiertonus niet. Botulinetoxine injecties verminderden de spiertonus na een maand significant wanneer deze waren toegediend onder geleiding van US ten opzichte van landmark positionering (Picelli, 2012b; Picelli, 2014; Santamato, 2014). Deze metingen zijn gedaan in de gastrocnemius (N=32), onderarm(N=40), pols, middenhand en vinger (N=30).
Santamato onderzocht de verschillen in MAS en ruststand van de vingers na het injecteren van de vingerflexoren met de landmarkmethode en US-geleiding. In beide groepen was er sprake van een verbetering op beide parameters, echter er was een significant verschil ten gunste van US in vergelijking met landmarkmethode.
Picelli (2014) onderzocht de invloed van de injectietechniek zowel op spiertonus door middel van MAS, als de mate van spasticiteit gemeten met Tardieuschaal (TS). Tevens werd de invloed op ROM gemeten van pols en vingers. Behandeld werden minimaal twee spieren uit de groep van flexor carpi radialis (FCR), flexor carpi ulnaris (FCU), flexor digitorum profundus (FDP) en superficialis (FDS). De MAS verbeterde meer bij ES dan bij palpatie - landmarktechniek (polsbuigers (PM) p= 0,008 en vingerbuigers p=0,0015). Ook was er sprake van meer verbetering van de mate van spasticiteit gemeten met TS (pols p= 0,001 en vingers p= 0,003).
Vergelijking van palpatietechniek met US bracht grotere verschillen naar voren (MAS pols p=0,001 vingers p=0,003; TS pols 0,010 vingers 0,001). Verschil in passieve ROM laat een p< 0,001 zien. Er is geen significant verschil gevonden tussen ES en injectietechniek met behulp van echografie.
Picelli et al. (2012b) onderzochten ook de invloed van de drie injectietechnieken op zowel MAS, TS en passieve ROM na het injecteren van de laterale en mediale m. gastrocnemius. Bij gebruik van US was er ten opzichte van landmarktechniek sprake van verbetering van MAS (p=0,008). De passieve ROM van het enkelgewricht verbeterde ten opzichte van ES (p=0,004) en ten opzichte van PM (p<0,001). Er zijn geen significante verschillen gevonden in de mate van spasticiteit gemeten met TS.
De mate van spasticiteit (TS) na toediening onder geleiding van US bleek ten opzichte van ES (N=33 en N=40) niet significant te verschillen voor toepassing in de m. gastrocnemius (gemiddeld verschil=0,20; p-waarde=0,265). In de onderarm werden geen significante verschillen gevonden tussen beide injectietechnieken zowel wat betreft de MAS (gemiddeld verschil=0,23; p-waarde= 0) als de TS. Ploumis vond dat botulinetoxine injecties de tonus van de spieren significant verminderden (p<0,05) na drie weken en na drie maanden wanneer deze waren toegediend onder geleiding van EMG ten opzichte van palpatie positionering (N=27). Er was sprake van verlaging met twee punten op de MAS.
Samenvattend is er sprake van significante verschillen in mate van spiertonus (MAS) en spasticiteit (TS) tussen de palpatoire landmarkmethode en de methoden onder geleide van ES en/of echografie, gemeten tot drie maanden na de injecties. Er zijn op beide parameters geen significante verschillen gevonden tussen echografie en ES bij injecties in bovenste extremiteit. In injecties van m. gastrocnemius zijn er geen verschillen gevonden in mate van spasticiteit (TS). Wel was er sprake van verbetering van passieve ROM van het enkelgewricht na injectie onder echografie ten opzichte van ES en significant ten opzichte van palpatoire landmarkmethode. Er was geen vergelijking gemaakt tussen ES en echografie ten opzichte van EMG-geleide injectie. Wel zijn significante verschillen aangetoond bij toepassing van EMG-geleide techniek ten opzichte van de palpatoire methode.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat werkingsduur is met twee niveaus verlaagd omdat er beperkingen waren in de onderzoeksopzet (geen blindering van de outcome assessor) en de RCT’s per vergelijking minder dan 50 patiënten omvatten (imprecisie).
Barthel index
Ploumis onderzocht het functioneren met behulp van de Barthel index na drie weken en na drie maanden (N=27). De Barthel index was zowel na drie weken als na drie maanden hoger in de groep waarbij injecties waren toegediend onder begeleiding van EMG (gemiddeld verschil na drie weken: EMG=11,66 (SD=11,08) palpatoir=5 (SD=3,01), gemiddeld verschil na drie maanden: EMG=11,0 (SD=3,38) palpatoir =4,17 (SD=1,95)), maar dit verschil was niet significant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functioneren is met drie niveaus verlaagd omdat er beperkingen waren in de onderzoeksopzet (geen blindering van de outcome assessor), het niet duidelijk was voor welke spiergroepen de resultaten golden (indirectheid), en de RCT slechts 27 patiënten omvatte (imprecisie).
Bijwerkingen en complicaties van de interventies (ongunstige effecten)
Alleen de RCT van Picelli (2012b) rapporteerde informatie over bijwerkingen, namelijk dat er geen bijwerkingen plaats vonden gedurende de follow-up periode van een maand. Welke bijwerkingen hier mogelijk meegenomen zijn, werd niet beschreven. Ploumis et al. beschreven dat er geen ernstige bijwerkingen binnen 24 uur na de injectie zijn opgetreden.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bijwerkingen en complicaties is niet te graderen met GRADE omdat de uitkomst niet is gemeten of zich niet heeft voorgaan in de studies (Picelli, 2012b; Ploumis, 2014).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Welke injectietechniek voor toediening van botulinetoxine is het meest nauwkeurig en geeft daardoor een verbetering van functioneren bij patiënten met verworven spasticiteit ten opzichte van toediening van botulinetoxine op basis van palpatie?
P: Patiënten met cerebrale en/of spinale spasticiteit
I: Intramusculaire injectie van botulinetoxine volgens verschillende methoden (EMG, elektrostimulatie, echografie, combinatie van echografie en elektrostimulatie)
C: Palpatie of een andere methode van intramusculaire injecties
O: Nauwkeurigheid van injectietechniek, functioneren, werkingsduur van botulinetoxine na de injectie, snelheid van handelen, belasting voor de patiënt, patiëntveiligheid en kans op complicaties en/of kans op iatrogeen letsel.
In de databases Medline (OVID) en Embase werd met relevante zoektermen gezocht naar systematische reviews en (gerandomiseerd) gecontroleerd onderzoek (RCT’s en CCT’s). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 178 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: studiepopulatie bestond uit volwassenen met cerebrale en/of spinale spasticiteit waarbij verschillende technieken voor het toedienen van botulinetoxine zijn vergeleken. Reviews zijn alleen geïncludeerd wanneer het selectieproces systematisch was uitgevoerd en transparant was weergegeven en wanneer de methodologische validiteit van de geïncludeerde studies werd beoordeeld.
Op basis van titel en abstract werden in eerste instantie twaalf studies geselecteerd uit de zoekresultaten en twee dankzij het nalopen van referentielijsten en via communicatie met experts in het veld. Na raadpleging van de volledige tekst, werden vervolgens acht studies geëxcludeerd (zie exclusietabel), en zes studies definitief geselecteerd.
(Resultaten)
Zes onderzoeken zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Henzel MK, Munin MC, Niyonkuru C, et al. Comparison of surface and ultrasound localization to identify forearm flexor muscles for botulinum toxin injections. PM R. 2010;2(7):642-646. PMID: 20659720.
- Picelli A, Bonetti P, Fontana C, et al. Accuracy of botulinum toxin type A injection into the gastrocnemius muscle of adults with spastic equinus: manual needle placement and electrical stimulation guidance compared using ultrasonography. J Rehabil Med. 2012a;44(5):450-452. PMID: 22549655.
- Picelli A, Tamburin S, Bonetti P, et al. Botulinum toxin type A injection into the gastrocnemius muscle for spastic equinus in adults with stroke: a randomized controlled trial comparing manual needle placement, electrical stimulation and ultrasonography-guided injection techniques. Am J Phys Med Rehabil. 2012b;91(11):957-964. PMID: 23085706.
- Picelli A, Lobba D, Midiri A, et al. Botulinum toxin injection into the forearm muscles for wrist and fingers spastic overactivity in adults with chronic stroke: a randomized controlled trial comparing three injection techniques. Clin Rehabil. 2014;28(3):232-42. PMID: 23945164.
- Ploumis A, Varvarousis D, Konitsiotis S, et al. Effectiveness of botulinum toxin injection with and without needle electromyographic guidance for the treatment of spasticity in hemiplegic patients: a randomized controlled trial. Disabil Rehabil. 2014;36(4):313-8. PMID: 23672209
- Santamato A, Micello MF, Panza F, et al. Can botulinum toxin type A injection technique influence the clinical outcome of patients with post-stroke upper limb spasticity? A randomized controlled trial comparing manual needle placement and ultrasound-guided injection techniques. J Neurol Sci. 2014;347(1-2):39-43. PMID: 25263601.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Henzel, 2010 |
Type of study: Observational cohort (analysis contrast within subjects)
Setting: Outpatient in tertiary care
Country: United States (PA)
Source of funding: Not reported (some of the authors worked for Allergan)
|
Inclusion criteria: Participants with upper-extremity flexor spasticity that interfered with function
Exclusion criteria: Individuals with severe fixed contractures or traumatic injuries to the involved forearm.
N total at baseline: N=17
Important prognostic factors2: age ± SD: 46 ± 14 years
Sex: 39% M
Cause of spaticity, n: hemorrhagic stroke=1 traumatic brain injury=4 thrombotic stroke=10 other=3 Groups comparable at baseline? Not applicable |
Landmark technique: Surface identification of the FCR, PT, and FPL was performed by using fingerbreadth measurements per the method of Delagi. The 4 muscle bellies of FDS were marked by using a surface landmark technique by Bickerton. First, a landmark line (LL) was drawn from the medial epicondyle (starting point) to pisiform bone (distal point). Next, by measuring perpendicular to the LL, the FDS2 muscle belly was localized 14 mm lateral to the proximodistal point measured at 72% of the distance along the LL (%LL) from the medial epicondyle. Similarly, FDS3 was localized 17mmlateral to the 54 %LL point, FDS4 was localized 7 mm lateral to the 49 %LL point, and FDS5 was localized 6 mm lateral to the 76 %LL point.
|
Ultrasound: the transverse (axial) view, where the largest cross-sectional area of the target muscle was visualized with minimal intervening muscles to permit the most direct injection path that also avoided neurovascular structures. Gentle passive movements were incorporated to help identify the target muscle. Skin was then marked, and US measurements were recorded by using the same LL system. |
Length of follow-up: Not applicable
Loss-to-follow-up: Not applicable
Incomplete outcome data: Not applicable
|
Proximodistal coordinates average difference between landmark mapping and ultrasound coordinates in cm: FDS2 MNP:19.3 ±1.7 US: 19.1 ± 1.9
FDS3 MNP: 15.1 ± 1.3 US: 15.0 ± 1.5
FDS4 MNP: 13.8 ± 1.5 US: 13.7 ± 1.5
FDS5 MNP: 20.5 ± 1.7 US: 20.4 ± 1.5
FCR MNP: 8.4 ± 3.0 US: 9.3 ± 3.1
PT MNP: 4.7 ± 0.8 US: 9.4 ± 3.0 Significantly different (P<0.05)
FPL MNP: 18.7 ± 2.6 US: 17.9 ± 2.5 Significantly different (P<0.05)
Lateral coordinates average difference between landmark mapping and ultrasound coordinates in mm: FDS2 MNP:14 US: 15.4 ± 2.6
FDS3 MNP: 17 US: 19.9 ± 4.1 Significantly different (P<0.05)
FDS4 MNP: 7 US: 8.8 ± 4.0
FDS5 MNP: 6 US: 6.2 ± 2.9
FCR MNP: 32.8 ± 13.7 US: 21.9 ± 5.7 Significantly different (P<0.05)
PT MNP: 37.8 ± 8.6 US: 39.0 ± 7.4
FPL MNP: 39.2 ± 7.2 US: 39.4 ± 8.7 |
FDS: flexor digitorum superficialis; FCR: flexor carpi radialis; PT: pronator teres; FPL: flexor pollicis longus MNP: Manual Needle Placement US: Ultrasound
Conclusion by the authors: Our data suggest that US should be considered as an adjunct for localization in patients with upper-limb spasticity. In addition, use of US may help avoid injection into vascular and nerve structures, and minimize spread of toxin outside the targeted muscle belly. It remains unclear whether use of US guidance to deliver this medication makes a difference in decreasing spasticity or improving functional recovery. |
|
Picelli, 2012A
(J Rehabil Med. 2012;44(5):450-452) |
Type of study: RCT
Setting: Outpatient setting
Country: Italy
Source of funding: Not reported |
Inclusion criteria: Age >18 years, spastic equinus after ischaemic or hemorrhagic stroke, GM spasticity graded at least 1+ on the modified Ashworth scale, time from stroke at least 6 months and time from last BoNT-A injection at least 4 months
Exclusion criteria: Fixed contractures or bony deformities of the affected leg, any previous treatment of the affected leg spasticity with neurolytic or surgical procedures, other neurological or orthopaedic conditions involving the affected leg.
N total at baseline: MNP: 42 ES: 39
Important prognostic factors: age ± SD: Total: 59.2 years ± 2.8
Sex: Total: 44% male
Groups comparable at baseline? Unclear. Characteristics were not specified per group.
|
Injections with electrical stimulation guidance
OR
BoNT-A was injected into two sites of GMM and GML: a proximal site (near to the muscle origin) and a distal site (at the mid-belly of the muscle bulk). BoNT-A injections were performed by clinicians with more than 3 years of clinical experience in the treatment of spasticity. |
Injections with manual needle placement (anatomical landmarks and palpation)
Verified by US |
Length of follow-up: Not applicable
Loss-to-follow-up: No drop outs Incomplete outcome data: Intervention: Not described
|
Accuracy of needle placement into the proximal site of GMM: MNP: 88.09% ES: 92.30% p-value=0.793
Accuracy of needle placement into the distal site of GMM: MNP: 92.86% ES: 94.87% p-value= 0.932
Accuracy of needle placement into the proximal site of GML: MNP: 64.28% ES: 87.17% p-value= 0.033 (significant difference favouring ES)
Accuracy of needle placement into the distal site of GMM: MNP: 73.80% ES: 92.30% p-value= 0.057 (significant difference favouring ES) |
Abbreviations: BoNT-A: botulinum toxin type A ES: electrical stimulation guidance GM: gastrocnemius muscle GML: gastrocnemius lateralis GMM: gastrocnemius medialis MNP: Manual needle placement US: ultrasonography
Notes: The accuracy of needle positioning with MNP and ES was compared by measuring positioning by means of US. No results of the UW were reported.
Conclusion of the authors: ES appeared to be more accurate than MNP because of the exclusion of subcutaneous injections (i.e. non-contractile tissue). However, ES could not result in completely precise injections into the GM of adults, probably because it is “blind” (as well as MNP) to the muscle volume and, consequently, not able to completely exclude injections into the soleus.
Subgroup The effect of age (< 60 vs > 60 years), sex (male vs female), time from onset (< 2 vs > 2 years), and site (proximal vs distal) on the accuracy of needle placement (accurate vs inaccurate) and muscle thickness did not seem to matter significantly. |
|
Picelli, 2012B
(Am J Phys Med Rehabil. 2012;91(11):957-964) |
Type of study: RCT
Setting: Neurological Rehabilitation Unit
Country: Italy
Source of funding: Not reported |
Inclusion criteria: Age >18 years, spastic equinus foot as a consequence of ischemic or hemorrhagic stroke, gastrocnemius muscle spasticity graded at least 2 (range, 0-5) on the modified Ashworth scale (MAS) time from stroke onset at least 6 months, and time from last BoNT-A treatment at least 3 months.
Exclusion criteria: inclusion in other clinical trials, fixed contractures (MAS = 5) or bony deformities at the affected ankle, previous treatment of the affected leg spasticity with neurolytic or surgical procedures, and other neurologic or orthopedic conditions involving the lower limbs.
N total at baseline: MNP: 16 ES: 16 US: 17
Important prognostic factors: age ± SD: MNP: 63.1 (13.8) ES: 55.1 (17.3) US: 61.4 (11.8)
Sex: MNP: 60% male ES: 67% male US: 71% male
Groups comparable at baseline? The groups are quite small causing a low probability to identify significant difference if present. |
Injections with electrical stimulation guidance
OR
US needle positioning
Injections were performed at two sites in each head of the gastrocnemius muscle: a proximal site (near the muscle origin) and a distal site (at midbelly of themuscle bulk).
Participants did not perform any type of rehabilitation in the 3 months before the study, did not undergo any form of therapy aimed at increasing the effectiveness of BoNT-A (e.g., electrical stimulation, casting, taping, or physical therapy), or did not undergo home exercise program during the study. |
Injections with manual needle placement (anatomical landmarks and palpation: popliteal fossa, medial and lateral femoral epicondyles, and medial and lateral malleoli).
Injections were performed at two sites in each head of the gastrocnemius muscle: a proximal site (near the muscle origin) and a distal site (at midbelly of themuscle bulk).
Participants did not perform any type of rehabilitation in the 3 months before the study, did not undergo any form of therapy aimed at increasing the effectiveness of BoNT-A (e.g., electrical stimulation, casting, taping, or physical therapy), or did not undergo home exercise program during the study. |
Length of follow-up: 4 weeks
Loss-to-follow-up: MNP: 1 (moved to different city) ES: 1 (moved to different city) US: 0
Incomplete outcome data: Intervention: Not described
|
Modified Ashworth scale (0-5): Effect size (p-value) MNP-ES: 0.27 (0.133) MNP-US: 0.46 (0.008) ES-US: 0.20 (0.265) US was significant better than MNP
Adverse events: No adverse events occurred during the trial in any of the groups |
Abbreviations: BoNT-A: botulinum toxin type A ES: electrical stimulation guidance MNP: Manual needle placement US: ultrasonography
Conclusion of the authors: Ultrasonography-guided injection technique could improve the clinical outcome of botulinum toxin injections into the gastrocnemius of adults with spastic equinus.
|
|
Picelli 2014 |
Type of study: RCT
Setting: Neurological Rehabilitation Unit
Country: Italy
Source of funding: Not reported |
Inclusion criteria: Age >18, arm spasticity as a consequence of ischaemic or haemorrhagic stroke, wrist and finger flexors tone graded at least 1+ on the Modified Ashworth Scale, time from stroke onset at least six months and time from last botulinum toxin treatment at least five months.
Exclusion criteria: Inclusion in other clinical trials, fixed contractures (tone graded at 4 on the Modified Ashworth Scale) or bony deformities in the affected arm, previous treatment of the affected arm spasticity with neurolytic or surgical procedures, and other neurological or orthopaedic conditions involving the arms.
N total at baseline: MNP: 20 ES: 20 US: 20
Important prognostic factors:
Age ± SD: MNP: 64.9 (11.4) ES: 60.2 (15.5) US: 64.4 (12.1)
Sex: MNP: 60% male ES: 50% male US: 55% male
Groups comparable at baseline? The groups are quite small causing a low probability to identify significant difference if present. |
Injections with electrical stimulation guidance
OR
US needle positioning
BoNT-A injections into at least two of the following muscles: flexor carpi radialis, flexor carpi ulnaris, flexor digitorum superficialis and flexor digitorum profundus (no fascicles selection was attempted).
Participants did not perform any type of rehabilitation in the three months before the study (the family doctor certified this condition), nor undergo any form of therapy aimed at increasing the effectiveness of botulinum toxin after injection (such as casting, taping, electrical stimulation or physical therapy), nor did they do any home exercise.
|
MNP: needle placement (anatomical landmarks and palpation: wrist joint, medial elbow epicondyle, ulnar styloid process and ulnar border)
BoNT-A injections into at least two of the following muscles: flexor carpi radialis, flexor carpi ulnaris, flexor digitorum superficialis and flexor digitorum profundus (no fascicles selection was attempted).
Participants did not perform any type of rehabilitation in the three months before the study (the family doctor certified this condition), nor undergo any form of therapy aimed at increasing the effectiveness of botulinum toxin after injection (such as casting, taping, electrical stimulation or physical therapy), nor did they do any home exercise. |
Length of follow-up: 4 weeks
Loss-to-follow-up: Intervention: MNP: 0 ES: 0 US: 0
Incomplete outcome data: Not reported
|
Modified Ashworth scale (0-5) at wrist: Effect size (p-value) MNP-ES: 0.39 (0.014) MNP-US: 0.54 (0.001) ES-US: 0.21 (0.170) ES and US were significant better than MNP
Modified Ashworth scale (0-5) at fingers: Effect size (p-value) MNP-ES: 0.40 (0.011) MNP-US: 0.47 (0.003) ES-US: 0.23 (0.191) ES and US were significant better than MNP |
Abbreviations: BoNT-A: botulinum toxin type A ES: electrical stimulation guidance MNP: Manual needle placement US: ultrasonography
Conclusion of the authors: Instrumental guidance may improve the outcome of botulinum toxin injections into the spastic forearm muscles of stroke patients. |
|
Ploumis, 2014 |
Type of study: RCT
Setting: Outpatient in tertiary care
Country: Italy
Source of funding: injection needle electrode and electromyographic amplifier are provided freely by Allergan company to everyone (including the authors) who wishes to use its products, but that this had no influence upon the collection or analysis of data, or upon the article written. There was no commercial benefit from any company to any of the authors.
|
Inclusion criteria: hemiplegic patients for spasticity treatment due to brain or spinal cord damage [stroke, trauma brain injury (TBI), spinal cord injury (SCI), cerebral palsy (CP) and hypoxic encephalopathy. Patients had to previously fail to control undesired hypertonia with oral muscle relaxants.
Exclusion criteria: Any previous administration of botulinum toxin, age <16 or >70 years, spasticity less than 2 grades according to the modified Ashworth spasticity score, history of any infection within the preceding 1 month, or history of any operation in the same muscle, or spasticity lasting more than 3 years.
N total at baseline: Intervention: 15 Control: 12
Important prognostic factors2: age ± SD: I: 40.27 (15.82) C: 41.83 (17.8)73
Sex: I: 73.33% M C: 75% M
Modified Ashworth I: 2.6 (0.5) C: 2.58 (0.51)
Groups comparable at baseline? Groups seem to be comparable. |
Botulinum toxin was administered with electromyographic guidance.
Patients were administered the toxin with anatomic landmark localization (based on muscle mapping) and electromyographic guidance by an electromyographic signal amplifier (i.e. using auditory electromyographic guidance to verify that the needle tip is intramusclular).
|
Botulinum toxin was administered without electromyographic assistance.
Patients the toxin was administered without electromyographic assistance but with the use of anatomic landmarks only |
Length of follow-up: 3 months
Loss-to-follow-up: Intervention: 3 (20%)
Control: 0 (0%) 0
|
Mean reduction of spasticity Ashworth score (SD) after 3 weeks: I: 1.67 (0.5) C: 1.25 (0.46) p-value < 0.05
Mean reduction of spasticity Ashworth score (SD) after 3 months: I: 1.47 (0.52) C: 1.08 (0.29) p=0.03256
Barthel index (SD) improvement in 3 weeks: I: 11.66 (11.08) C: 5 (3.01) p-value > 0.05
Barthel index (SD) improvement in 3 months: I: 11 (3.38) C: 4.17 (1.95) p-value > 0.05
No serious adverse events took place within 24h after the injection of botulin toxin. |
Conclusion of the authors: “The effectiveness of intramuscular botulinum toxin injection for the treatment of spasticity in hemiplegic patients is superior when performed with needle electromyographic guidance than without electromyography.” |
|
Santamato 2014
|
Type of study: RCT
Setting: Outpatient in tertiary care
Country: Italy
Source of funding: The research was supported by Programmi di Ricerca Scientifica di Rilevante Interesse Nazionale (PRIN) 2009 Grant 2009E4RM4Z. |
Inclusion criteria: First-ever, unilateral, ischemic or hemorrhagic stroke. A clinical pattern with Modified Ashworth Score (MAS) ≥1 concerning wrist and fingers spasticity.
Exclusion criteria: <18 years of age, time from last BoNT-A treatment is less than 3 months, fixed contractures and/or deformities at the wrist and fingers (muscle contracture was considered as severe restriction of the joint range of motion on passive stretch), previous fractures of the paretic upper limb after stroke event, peripheral nervous system disorders/myopathies, and medications that could have had an impact on the study findings. Moreover, no patients with structural alterations in the soft tissue as fibrosis graded IV at Heckmatt scale were enrolled.
N total at baseline: US: 15 MNP: 15
Important prognostic factors:
Age range: US: 42–71 years MNP: 38–74 years
Sex: US: 53% male MNP: 66% male
Groups comparable at baseline? The groups are quite small causing a low probability to identify significant difference if present. |
BoNT-A injection using ultrasound guide
A physiatrist with more than 10 years of experience in the field of spasticity and BoNT-A therapy performed all injections.
Participants did not perform any type of therapy aimed at increasing the effectiveness of botulinum toxin after injection (such as stretching, casting, taping, or electrical stimulation) for thirty days. After the post injection evaluation the patients underwent in a necessary rehabilitation program. |
BoNT-A injected identifying target muscles by surface anatomical landmarks and palpation. Surface identification of the FCR, FCU, and FDP was performed by using fingerbreadth measurements for the method of Delagi and colleagues, and a single skin mark was placed for each muscle.
A physiatrist with more than 10 years of experience in the field of spasticity and BoNT-A therapy performed all injections.
Participants did not perform any type of therapy aimed at increasing the effectiveness of botulinum toxin after injection (such as stretching, casting, taping, or electrical stimulation) for thirty days. After the post injection evaluation the patients underwent in a necessary rehabilitation program. |
Length of follow-up: 4 weeks
Loss-to-follow-up: US: 0 MNP: 0
Incomplete outcome data: Not reported
|
Wrist MAS FCU or FCR Median (inter quartile range): US: 2 (1) MNP: 2 (1) p = 0.0211 Significant difference favouring US
Finger MAS FCU or FCR Median (inter quartile range): US: 1 (1) MNP: 2 (1) p = 0.0124 Significant difference favouring US |
Abbreviations: BoNT-A: botulinum toxin type A MAS–FPD: Modified Ashworth Scale–flexor profundis digitorum muscle. MAS–FSD: Modified Ashworth Scale–flexor superficialis digitorum muscle. MAS–FC: Modified Ashworth Scale–flexor carpi (ulnaris or radialis carpi muscles). FPR: Finger position at rest MNP: Manual needle placement US: ultrasonography |
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Picelli, 2012
(Am J Phys Med Rehabil. 2012;91(11):957-964) |
Patients were randomly assigned in a one-to-one ratio. |
Unclear, this was not described. |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Unclear, the trial was not prospectively registered. |
Unlikely, there were two drop outs. |
Unlikely, the treatment could not be changed (one time only) |
|
Picelli 2014 |
Patients were assigned using a restricted randomization scheme generated by software. One of the investigators checked correct patient allocation according to the randomization list. Unmasking took place at the end of the study. |
Unlikely. Sound randomization and blinding of the allocation. |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Unclear, the trial was not prospectively registered. |
Unlikely, there were no drop outs. |
Unlikely, the treatment could not be changed (one time only) |
|
Ploumis, 2014 |
Patients were randomly (by a closed envelope method with a numbered series of pre-filled envelopes specifying the group) allocated |
Unlikely |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Unclear, the trial was not prospectively registered. |
Unlikely, after 3 months 20% loss |
Unlikely, the treatment could not be changed (one time only) |
|
Santamato 2014
|
Participants were randomly assigned to 2 groups, with an automated technique detailed elsewhere. Individual, sequentially numbered index cards with the random assignments were prepared. The index cards were folded and placed in sealed opaque envelopes. |
Unlikely |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Likely, this was a non-blinded study |
Unclear, the trial was not prospectively registered. |
Unlikely, there were no drop outs. |
Unlikely, the treatment could not be changed (one time only) |
Risk of bias table for diagnostic studies
|
Study reference |
Patient selection |
Index test |
Reference standard |
Flow and timing |
Comments with respect to applicability |
|
Henzel, 2012 |
Was a consecutive or random sample of patients enrolled? Unclear, not described
Was a case-control design avoided? Yes, all patients received both diagnostic modalities
Did the study avoid inappropriate exclusions? Yes, all patients were analysed.
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes, the index test was used before the reference test.
If a threshold was used, was it pre-specified? No, the threshold was implicit. (imagine)
|
Is the reference standard likely to correctly classify the target condition? No, there is no gold standard
Were the reference standard results interpreted without knowledge of the results of the index test? Yes, after surface measurements were collected, the skin marks were removed.
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No, patients with traumatic brain injury.
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes, there is a wide variation in the use of palpation techniques.
Are there concerns that the target condition as defined by the reference standard does not match the review question? No.
|
|
CONCLUSION: Could the selection of patients have introduced bias? Yes, it is unclear were the patients come from
RISK: HIGH |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias? It is unclear how the implicit threshold may have affected the results.
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias? Yes, since there is no gold standard bias is possible.
RISK: LOW /HIGH/UNCLEAR |
CONCLUSION Could the patient flow have introduced bias? No.
RISK: LOW |
|
|
|
Picelli, 2012
(J Rehabil Med. 2012;44(5):450-452) |
Was a consecutive or random sample of patients enrolled? Yes, it was a random sample
Was a case-control design avoided? Yes, it was a RCT
Did the study avoid inappropriate exclusions? Yes
|
Were the index test results interpreted without knowledge of the results of the reference standard? Yes, the index test was used before the reference test.
If a threshold was used, was it pre-specified? No, the threshold was implicit. (imagine)
|
Is the reference standard likely to correctly classify the target condition? No, there is no gold standard
Were the reference standard results interpreted without knowledge of the results of the index test? Unclear, there is no procedure of blinding described.
|
Was there an appropriate interval between index test(s) and reference standard? Yes
Did all patients receive a reference standard? Yes
Did patients receive the same reference standard? Yes
Were all patients included in the analysis? Yes
|
Are there concerns that the included patients do not match the review question? No
Are there concerns that the index test, its conduct, or interpretation differ from the review question? Yes, there is a wide variation in the use of palpation techniques.
Are there concerns that the target condition as defined by the reference standard does not match the review question? No.
|
|
CONCLUSION: Could the selection of patients have introduced bias? No
RISK: LOW |
CONCLUSION: Could the conduct or interpretation of the index test have introduced bias? It is unclear how the implicit threshold may have affected the results.
RISK: UNCLEAR |
CONCLUSION: Could the reference standard, its conduct, or its interpretation have introduced bias? This might be possible when the results of the index test were not blinded.
RISK: UNCLEAR |
CONCLUSION Could the patient flow have introduced bias? No.
RISK: LOW |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Lim, 2006 |
Contrast is tussen lange en korte flexoren ipv tussen injectie technieken. |
|
Lim, 2006 |
Zelfde studie als nr 23. Contrast is tussen lange en korte flexoren ipv tussen injectie technieken. |
|
Mayer, 2008 |
Geen relevante vergelijking. Motor point toediening vergeleken met multi point toediening. |
|
Picelli A, 2014 |
Geen relevante uitkomsten. |
|
Wissel M, 2001 |
Narratieve beschrijving van het veld. |
|
Ding XD, 2015 |
Vergelijking tussen conservatieve therapie versus conservatief plus BonT-A injecties. |
|
Picelli A, 2014 |
Studie naar factoren die de precisie van de toediening kunnen beïnvloeden. |
|
Wissel J, 2014 |
Narratieve beschrijving van het veld. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2017
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
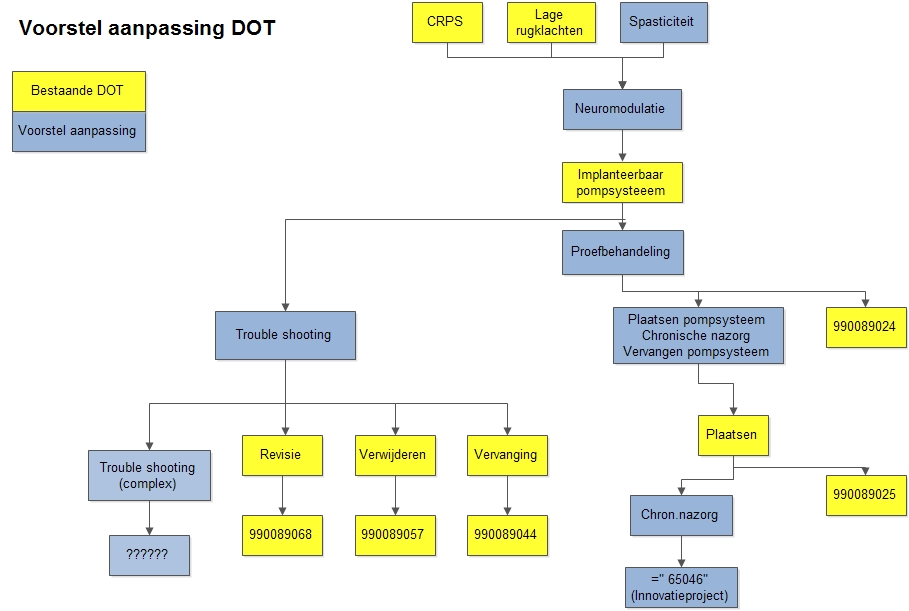
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
|
Uitgangsvraag: Wat is de meest effectieve methode om botulinetoxine injecties toe te dienen? |
|
|
Database(s): Embase |
Datum: 12-03-2015 |
|
Periode: > 2000 |
Talen: Engels, Nederlands en Duits |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 2000- maart 2015 Engels, Nederlands, Duits |
1 exp Spinal Injuries/ (17910) 2 exp Multiple Sclerosis/ (45906) 3 exp Brain Injuries/ (50990) 4 Head Injuries, Closed/ (2644) 5 exp Cerebrovascular Disorders/ (286287) 6 1 or 2 or 3 or 4 or 5 (392709) 7 ((brain adj2 injur*) or (spinal adj2 injur*) or tbi or (head adj2 injur*) or stroke or (cerebrovascular adj2 (accident* or diseas*))).ab,ti. (254066) 8 6 or 7 (517004) 9 exp Paraparesis, Spastic/ (322) 10 exp Cerebral Palsy/ (16058) 11 exp Muscle Hypertonia/ (9289) 12 exp Dystonia/ (7898) 13 9 or 10 or 11 or 12 (31808) 14 (spastic* or cerebral palsy or hypertonia or dystonia).ab,ti. (42450) 15 13 or 14 (53591) 16 exp Botulinum Toxins/ (12318) 17 ((botulin* adj1 toxin*) or botox or btx or (bont adj1 a)).ab,ti. (11769) 18 16 or 17 (15745) 19 8 and 15 and 18 (465) 20 exp Palpation/ (7591) 21 exp Electric Stimulation Therapy/ (60344) 22 exp Electric Stimulation/ (117550) 23 exp Electromyography/ (67930) 24 (echograph* or palpation* or electrostimulat* or electromyograph* or emg or echograph* or (electric* adj1 stimulation) or ultraso* or (anatomic adj1 locali?ation)).ab,ti. (360414) 25 20 or 21 or 22 or 23 or 24 (537779) 26 19 and 25 (91) 27 limit 26 to (yr="2000 -Current" and (dutch or english or german)) (69) = 69 (68 uniek) |
178 |
|
Embase |
'spine injury'/de OR 'multiple sclerosis'/exp OR 'brain injury'/exp OR (brain NEAR/2 injur*):ab,ti OR (spinal NEAR/2 injur*):ab,ti OR 'head injury'/exp OR 'cerebrovascular disease'/exp OR tbi:ab,ti OR (head NEAR/2 injur*):ab,ti OR stroke:ab,ti OR (cerebrovascular NEAR/2 (accident* OR diseas*)):ab,ti AND ('spasticity'/exp OR 'spastic paresis'/exp OR spastic*:ab,ti OR 'cerebral palsy'/exp OR 'cerebral palsy':ab,ti OR hypertonia:ab,ti OR dystonia:ab,ti) AND ('botulinum toxin a'/exp OR (botulin* NEAR/1 toxin*):ab,ti OR botox:ab,ti OR btx*:ab,ti OR (bont NEXT/1 a):ab,ti OR 'botulinum toxin'/exp) AND ('palpation'/exp OR 'electrostimulation'/exp OR 'electromyography'/exp OR 'echography'/exp OR palpation*:ab,ti OR electrostimulation:ab,ti OR electromyograph*:ab,ti OR emg:ab,ti OR echograph*:ab,ti OR (electric* NEAR/1 stimulation):ab,ti OR ultraso*:ab,ti OR (anatomic NEAR/1 localization):ab,ti OR localisation:ab,ti) AND ([dutch]/lim OR [english]/lim OR [german]/lim) AND [embase]/lim AND [2000-2015] NOT 'conference abstract':it = 146 (110 uniek) |
