Organisatie van zorg bij spasticiteit
Uitgangsvraag
Hoe dient de zorg voor patiënten met cerebrale en/of spinale spasticiteit geoganiseerd te worden?
Aanbeveling
De werkgroep acht het niet meer wetenschappelijk verantwoord om bij elke patiënt eerst alle niet-invasieve opties te hebben uitgeprobeerd alvorens invasieve behandelmethoden te overwegen en bespreekbaar te maken. Dit geldt zeker voor het gebruik van botulinetoxine injecties, maar ook voor het aanbieden van fenol, intrathecale baclofenbehandeling of chirurgische behandelopties.
Onderbouwing
Achtergrond
Inhoudelijke besluitvorming
Wanneer een volwassen patient met een Upper Motor Neuron syndroom op basis van cerebraal of spinaal letsel zich presenteert met spasticiteit, heeft de behandelaar een arsenaal aan diagnostische methoden en behandelingen tot zijn beschikking.
Er is een aantal factoren van invloed op de diagnostische en therapeutische overwegingen:
1. Is de spasticiteit problematisch, d.w.z. wordt deze als hinderlijk ervaren of zijn er negatieve secundaire gevolgen? Deze vraag bepaalt of de aanwezige spasticiteit behandeld moet worden.
2. Wat is het niveau van functioneren van de patient en wat is zijn/haar doel? (low level versus high level functioning) Het niveau van functioneren bepaalt in belangrijke mate het doel van eventuele behandeling, variërend van vergemakkelijken van verzorgbaarheid tot optimaliseren van functionele mogelijkheden en zelfstandigheid.
3. Is de spasticiteit focaal, regionaal of gegeneraliseerd? De keuze tussen de verschillende behandelmethoden hangt af van de verdeling van spastische spieren over het lichaam.
4. Wat zijn de voorkeuren van de patiënt ten aanzien van de beschikbare behandelmethoden?
Ad 1. Indien er sprake is van problematische spasticiteit, waarvoor de patiënt behandeld wil worden, dan dient in alle gevallen gestart te worden met onderzoek naar en eventuele behandeling van uitlokkende factoren (zie de module ‘Voorkomen spasticiteit-verhogende factoren’). Indien dit onvoldoende effect heeft of niet mogelijk is, heeft het de voorkeur te starten met reversibele behandelmethoden, na grondige evaluatie van de spasticiteit en het functioneren zoals beschreven in de module ‘Evaluatie van spasticiteit’. Toch kunnen in een vroege fase ook andere, meer invasieve of niet-reversibele opties worden besproken met de patiënt, zeker bij ernstige spasticiteit.
Ad 2. Bij patiënten met een laag niveau van functioneren, met grote afhankelijkheid van zorg, zullen andere behandeldoelen geformuleerd worden dan bij patienten die (grotendeels) zelfstandig functioneren. In de eerste groep is de behandeling voornamelijk gericht op maximaal comfort en het kunnen omgaan met de spasticiteit. In de tweede groep zullen behoud van of vergroting van functionele mogelijkheden een veel grotere rol spelen. De keuze van het meetinstrument vooraf en na een eventuele behandeling moet hierop afgestemd worden (zie de module ‘Evaluatie van spasticiteit’).
Ad 3. De keuze van de behandelmethode hangt deels af van de verdeling van spastische spieren over het lichaam. Bij gegeneraliseerde spasticiteit zullen systemische behandeling met orale spasmolytica of intrathecale baclofen primair worden overwogen. Bij focale en regionale spasticiteit zijn intramusculaire botulinetoxine injecties of eventueel zenuwblokkade eerste keus. Deze laatste behandeling moet in beginsel samen gaan met passieve en zo mogelijk actieve oefentherapie, en eventueel orthesen, om het effect van de neuro(musculaire) blokkade te ondersteunen en te verlengen. Bij terugkeer van spasticiteit, na het uitwerken van de behandeling, kan deze herhaald worden, maar kan ook een operatieve ingreep worden overwogen (bijvoorbeeld spier-peesverlenging van de betrokken spieren, peestransfer, of selectieve neurotomie).
Ad 4. Het is van groot belang dat de patiënt uiteindelijk zelf de keuze maakt, nadat de medisch specialist de mogelijkheden heeft benoemd, passend bij het klinisch beeld van het individue (‘shared decision making’). Voor de patient kunnen heel andere overwegingen een rol spelen dan voor de professional, die dikwijls niet medisch-inhoudelijk van aard zijn. Te denken valt aan bedenkingen bij de toedieningsvorm van pharmaca of cosmetische overwegingen.
NB. De werkgroep acht het niet meer wetenschappelijk verantwoord om bij elke patiënt eerst alle niet-invasieve opties te hebben uitgeprobeerd alvorens invasieve behandelmethoden bespreekbaar te maken. Dit geldt zeker voor het gebruik van botulinetoxine injecties, maar ook voor het aanbieden van intrathecale baclofenbehandeling of chirurgische behandelopties. Er zijn goede voorbeelden te bedenken waarbij patiënten sneller voor invasieve of zelfs irreversibele opties in aanmerking zouden moeten komen dan voorheen dikwijls gepropageerd. Zo zal de CVA patient met ernstige teenflexiespasmen vaak onvoldoende reageren op orale medicatie of schoenaanpassingen en zeer gebaat zijn bij een snelle behandeling van de teenflexoren met botulinetoxine injecties, of primair chirurgie in de vorm van een release van de teenflexoren. Evenzo zal de verzorgingsbehoeftige MS patient met ernstige flexiespasmen van de benen snel in aanmerking moeten kunnen komen voor intrathecale baclofenbehandeling en een langdurig (en twijfelachtig) traject met orale medicatie bespaard moeten kunnen blijven. Om deze reden ziet de werkgroep geen plaats voor een rigide, hiërarchisch opgebouwde beslisboom van spasticiteitsbehandelingen, maar veeleer voor een ‘personalised approach’, rekening houdend met individuele doelen en voorkeuren, de medisch-technische mogelijkheden, de behandelsetting, en uiteraard met de psychosociale context van de individuele patiënt. Het is van belang dat met de patiënt wordt besproken dat de oude beslisboom niet langer leidend is, omdat patiënten hier mogelijk nog wel informatie over vinden.
Organisatie van zorg
Een deel van de voorgestelde diagnostische en behandelmethoden behoort tot de reguliere klinische praktijk en is voor vrijwel elke betrokken medisch specialist toegankelijk, zoals het voorschrijven van orale medicatie of oefentherapie. Voor sommige methoden dient men echter te beschikken over specifieke expertise. Voorbeelden daarvan zijn:
- op het gebied van diagnostiek: interdisciplinaire diagnostiek, gangbeeldanalyse, dynamische electromyografie;
- op het gebied van invasieve, reversibele behandeling: botulinetoxine injecties en perifere zenuwblokkade op geleide van echografie en/of elektrostimulatie;
- op het gebied van invasieve, (min of meer) irreversibele behandeling: intrathecale baclofenbehandeling, chirurgie.
Ad 1. Voor meer complexe problematiek is interdisciplinaire diagnostiek een voorwaarde voor het maken van een goed behandelplan, zeker als men denkt aan irreversibele invasieve behandeling (zie onder andere de modules ‘Evaluatie van spasticiteit’, ‘Orale spasmolytica bij spasticiteit’, ‘Intrathecale baclofen bij spasticiteit’ en ‘Chirurgische behandeling bij spasticiteit’). Spasticiteitsbehandeling van de onderste extremiteit bij patiënten met residuele loopvaardigheid, bijvoorbeeld middels botulinetoxine injecties, dient bij voorkeur te worden gebaseerd op instrumentele gangbeeldanalyse, inclusief meting van (oppervlakte-) elektromyografie en eveneens beschikbaarheid over 3D kinematica en meting van grondreactiekracht. Derhalve zou ieder behandelcentrum deze voorzieningen in huis moeten hebben dan wel een overeenkomst moeten hebben met een andere instelling waaraan deze diagnostische mogelijkheden kunnen worden uitbesteed.
Ad 2. Voor het juist verrichten van een neuromusculaire blokkade met botulinetoxine of een zenuwblokkade met fenol zijn goede lokalisatietechnieken een voorwaarde. De literatuur laat zien dat echografie hierbij optimaal is, op de voet gevolgd door elektrostimulatie. Niet alleen de beschikbaarheid maar ook scholing en ervaring met deze apparatuur is van belang. Indien deze behandelingen in een gewone spreek- of behandelkamer plaats vinden, dient in voldoende mate aseptisch en snel te kunnen worden gewerkt om de risico’s en de belasting voor de patiënt te minimaliseren. Bij multifocale behandeling en/of bij ernstige spasticiteit is verpleegkundige ondersteuning gewenst. Verder verdient het aanbeveling te kunnen beschikken over meer dan een type botulinetoxine, daar sprake kan zijn van specifieke intolerantie ten aanzien van een product.
Ad 3.
A. Intrathecale baclofenbehandeling (ITB)
ITB-behandeling is een laag volume, complexe behandeling met potentieel ernstige bijwerkingen, die interdisciplinair moet worden gedaan. In Nederland zijn bij de behandeling revalidatieartsen, neurologen, neurochirurgen, anesthesiologen, specialisten ouderengeneeskunde en artsen voor verstandelijk gehandicapten betrokken. Jaarlijks wordt in Nederland bij ca. 120 nieuwe volwassen patiënten een pomp geïmplanteerd. In verband met een beperkte levensduur van de batterij (7 jaar) vinden jaarlijks daarnaast ca. 80 vervangingen plaats. Omdat de indruk bestaat dat er in Nederland sprake is van onderbehandeling (Erwin 2011), zou minimaal het dubbele aantal nieuwe patiënten mogen verwacht. Deze implantaties vinden plaats in negen centra, waarvan slechts één centrum (Ersamus Medisch Centrum) de behandeling overtuigend als speerpunt beschouwt. Dit centrum verricht een derde van alle implantaties in Nederland en richt zich verder op ‘trouble shooting’. Dit betekent dat de overige implantaties over de andere acht centra worden verdeeld, wat bij een aantal centra leidt tot onvoldoende ervaring. En juist deze ervaring met de indicatiestelling, de chirurgische interventie en de nazorg is cruciaal voor het welslagen van de therapie. Daarnaast is het van belang is dat te allen tijde 24/7 zorg geborgd is door gekwalificeerde professionals met inbegrip van “dubbel check” van de sterk geconcentreerde medicatie en de programmering van het pompsysteem. De werkgroep acht het derhalve noodzaak de behandeling te concentreren in een beperkt aantal implantatiecentra met 24/7 gekwalificeerde ondersteuning, waardoor op al deze plaatsen voldoende expertise kan worden bereikt en geborgd. Met betrekking tot adequate ‘trouble shooting’ betreft dat de beschikbaarheid van een deskundige en specialistische 24/7 opvang, double check voor de toediening van intrathecale medicatie door deskundigen, IC voorziening voor trouble shooting, radiologische diagnostiek, expertise voor pompanalyse om problemen op te sporen zoals sidepoort onderzoek, spectraal CT, nucleair medisch onderzoek en 24/7 OK voorziening.
Gegevensverwerking, follow up
In Nederland bestaat de intentie de ITB-behandeling in het zogenoemde Promise-systeem te registreren (Delhaas, 2008). In de praktijk blijkt dit niet goed te functioneren, omdat niet ieder centrum meedoet, de nazorg door een ander dan het implantatiecentrum niet kan worden geregistreerd, en/of onvoldoende mogelijkheden aanwezig zijn om een registratiesysteem optimaal te faciliteren. Uit de beschikbare gegevens blijkt dat de incidentie van complicaties hoog is. Het ligt voor de hand dat deze zou kunnen worden gereduceerd indien een nader vast te stellen minimumaantal verrichtingen zou kunnen worden gerealiseerd.
B. Chirurgische behandeling
Ook voor chirurgische behandeling van spasticiteit geldt dat er sprake is van laag volume, hoog complexe zorg die interdisciplinair moet worden geïndiceerd en geëvalueerd. Extra zorgvuldigheid is geboden bij chirurgische behandeling omdat deze vorm van therapie in alle gevallen irreversibel is. Gezien het grote aantal functionele en technische aspecten dat bij chirurgische behandeling een rol speelt, kunnen gemakkelijk essentiële zaken over het hoofd worden gezien of bepaalde aspecten onjuist worden geïndiceerd of uitgevoerd. Voorbeelden hiervan zijn het uitvoeren van een tenotomie daar waar een peesverlenging beter was geweest voor het behouden van musculaire balans over een bepaald gewricht; het te rigoreus uitvoeren of onoordeelkundig indiceren van een Achillespeesverlenging, waardoor knie-instabiliteit wordt geïnduceerd; of het ‘vergeten’ van de voorvoet en de tenen bij een behandeling puur gericht op balansherstel rond de enkelgewrichten. Om deze redenen dient ook deze zorg in een beperkt aantal behandelcentra, specifiek voor de bovenste of onderste extremiteit, plaats te vinden. Alleen op deze wijze kan in deze centra voldoende expertise worden opgebouwd, wetenschappelijke studies worden verricht, en richtlijnen worden aangescherpt.
Communicatie met patiënt en naaste(n)
Behandelaars moeten zich realiseren dat de patiënt spasticiteit meestal als hinderlijk of ongewenst zal ervaren. De rol van de behandelaar is om, naast een goede anamnese en klinisch onderzoek, informatie te verstrekken aan de patiënt en zijn/haar naaste(n) dan wel wettelijk vertegenwoordiger over het verschijnsel spasticiteit, de eventueel te verwachten gevolgen, en de behandelmogelijkheden. Het stellen van gezamenlijke doelen is daarbij cruciaal. Hierbij kan gebruik worden gemaakt van formele instrumenten, zoals Goal Attainment Scaling en andere klinimetrie (zie module 'Orthesen bij spasticiteit'). Dit heeft als voordeel dat ook op lange termijn de doelen en resultaten voor alle partijen scherp op het netvlies blijven staan.
Vooral bij behandelingen die herhaald plaats vinden, zoals botulinetoxine injecties, kan de cyclus van doelen stellen, behandelen, evalueren, en bijstellen van doelen gemakkelijk worden verwaarloosd. Om die reden is het wenselijk dat deze informatie wordt bijgehouden in een monitoringsysteem. Om de patientgerichtheid van de zorg te verbeteren, zou het wenselijk zijn als de patient en/of naasten zelf een belangrijke rol zouden kunnen spelen bij deze monitoring. Dit zal ook de doelmatigheid van behandelen ten goede komen.
Vooral bij patienten met bijkomende cognitieve stoornissen moet men er rekening mee houden dat het stellen en evalueren van realistische doelen en verwachtingen moeilijk is. Ook het bepalen van de feitelijke hinder van de spasticiteit kan dan erg lastig zijn. In deze gevallen verdient het aanbeveling directe naasten/ wettelijk vertegenwoordigerbij de behandeling te betrekken of eventueel een neuropsycholoog te consulteren. In het geval van (gedeeltelijke) wilsonbekwaamheid moet bij invasieve en irreversibele behandeling extra zorgvuldig de mogelijke baat versus de belasting en risico’s worden afgewogen.
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2017
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
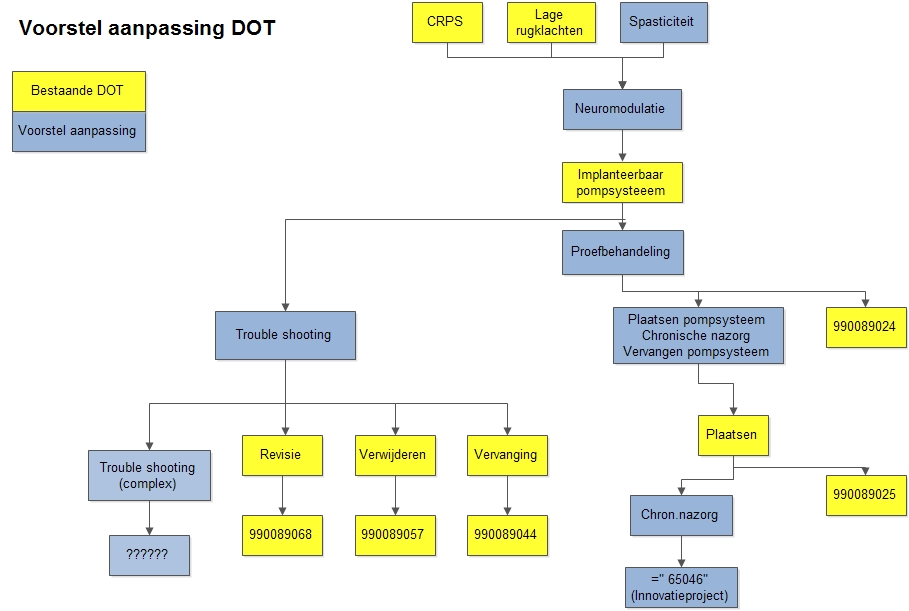
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
