Orale spasmolytica bij spasticiteit
Uitgangsvraag
Is er een plaats voor orale spasmolytica bij patiënten met cerebrale en/of spinale spasticiteit?
Aanbeveling
Overweeg orale spasmolytica bij gegeneraliseerde spasticiteit ter verlichting van klachten. Baclofen en tolperison hebben daarbij waarschijnlijk het gunstigste (bij)werkingenprofiel.
Wees terughoudend met het gebruik van (centraal aangrijpende) orale spasmolytica bij patiënten met cognitieve stoornissen.
Overweeg orale spasmolytica bij focale spasticiteit alleen onder bepaalde omstandigheden. Hierbij moet een afweging worden gemaakt tussen de mate van hinder als gevolg van spasticiteit enerzijds en de (neven)effecten van de medicatie anderzijds. Mogelijke omstandigheden zijn bijvoorbeeld hinderlijke focale spasticiteit die ten koste gaat van de slaap, verzorgingsproblemen door spasticiteit, of sensaties van pijnlijke stijfheid en/of kramp die niet anderszins effectief te behandelen zijn.
Wees terughoudend met het voorschrijven van combinaties van orale spasmolytica.
Evalueer de (bij)werkingen van orale spasmolytica in alle gevallen regelmatig.
Overwegingen
Er is nauwelijks goede literatuur beschikbaar over de werking en effectiviteit van orale spasmolytica bij spinale spasticiteit. Bewijs van de effectiviteit van orale middelen bij cerebrale spasticiteit is eveneens zwak. Voor vele van de farmacologische therapieën zijn de duur van het therapeutische effect, de lange termijn complicaties en de kosteneffectiviteit nog niet bepaald. Er is geen wetenschappelijk bewijs dat orale behandeling leidt tot functionele verbetering.
Binnen de expertgroep bestaat er consensus op basis van klinische ervaring dat orale spasmolytica effectief kunnen zijn ter verlichting van klachten bij gegeneraliseerde spasticiteit, in het bijzonder bij spinale spasticiteit, zoals bij patiënten met een dwarslaesie en - in lagere dosering - bij patiënten met MS. Bij spasticiteit als gevolg van een cerebraal letsel kunnen de bijwerkingen interfereren met mogelijk aanwezige cognitieve stoornissen, waardoor het gebruik ervan in dat geval een minder rationele keuze is. De meest bekende bijwerking is slaperigheid, wat onder andere vermindering van functioneren en verhoogd valrisico met zich meebrengt.
Bij focale spasticiteit ligt de keuze voor een oraal spasmolyticum niet voor de hand. Toch kunnen er omstandigheden zijn waarin gekozen wordt voor een oraal middel. Voorbeelden zijn symptoomreductie bij hinderlijke focale spasticiteit die ten koste gaat van de slaap, verzorgingsproblemen door spasticiteit, of een sensatie van pijnlijke stijfheid of kramp. In dergelijke gevallen kan gekozen worden voor een oraal spasmolyticum, waarbij de bijwerking (slaperigheid, sufheid) niet per sé een belemmering is, maar bij toediening voor de nacht ook een gewenst neveneffect kan zijn.
In alle gevallen is het noodzakelijk de werking van het voorgeschreven middel regelmatig te evalueren, afhankelijk van de reden van voorschrijven minimaal een keer per half jaar (in de vroege fase vaker). Op proef een periode afbouwen van de dosering kan zinvol zijn om te beoordelen of het gebruik nog effectief is. Voor een actueel overzicht van bekende en/of gemelde bijwerkingen bij medicatie kan de website van Bijwerkingencentrum Lareb worden geraadpleegd (www.lareb.nl). Via deze website kunnen ook eventuele bijwerkingen, ook bij off label gebruik, worden gemeld.
Op basis van het ontbreken van literatuurgegevens is het voorschrijven van een combinatie van middelen niet rationeel. De werkgroep is dan ook van mening dat terughoudendheid is geboden in het voorschrijven van combinaties van orale spasmolytica.
Op grond van literatuur is er geen voorkeur of een middel van eerste keuze. Wel is men van mening dat het perifeer aangrijpende dantroleen (sodium) de minste voorkeur verdient vanwege hepatotoxiciteit. Indien deze behandeling wordt toegepast dient de leverfunctie strikt te worden gecontroleerd. Baclofen en tolperison (beide centraal aangrijpend) lijken het gunstigste bijwerkingenprofiel te hebben. Ofschoon tolperison (50 en 150 mg) een nieuw middel is op de Nederlandse markt is het, gegeven het relatief gunstige bijwerkingenprofiel, een relevante aanvulling. Dit moet gezien worden in het licht van de vaak matige tolerantie en geringe therapeutische breedte van bestaande orale spasmolytica. Voor dosering van de verschillende middelen wordt verwezen naar het Farmacotherapeutisch Kompas (http://www.farmacotherapeutischkompas.nl/; Zorginstituut Nederland).
Er is zeer beperkt literatuur voor wat betreft de (neven)effecten van cannabinoiden. Voor sommige patiënten kunnen deze middelen mogelijk een ‘last resort’ functie vervullen (Whiting, 2015). Sinds 2003 kunnen medicinale Cannabisproducten in Nederland worden voorgeschreven voor een aantal indicaties, waaronder ‘pijn, spierkrampen en spiertrekkingen bij multiple sclerose (MS) of ruggenmergschade’ (bron: www.cannabisbureau.nl; website van Ministerie van Volksgezondheid, Welzijn en Sport). De middelen vallen onder de Opiumwet.
De legitimiteit van de conventionele benadering die het progressief gebruik voorstaat van eenvoudig (bijvoorbeeld orale spasmolytica) naar meer complexe behandelingen (bijvoorbeeld focale spasmolyse, of intrathecale baclofen) op geleide van gedocumenteerde mislukkingen van eerdere stappen is zwak en kan patiëntonvriendelijk zijn.
Vooralsnog is het gangbaar beleid om vóór toepassing van intrathecale baclofen eerst orale medicatie in maximale dosis en vaak in combinatie te hebben uitgeprobeerd. Dit beleid wordt niet ondersteund, noch door de literatuur, noch door de klinische praktijk. Deze benadering kan veeleisend, duur en belastend zijn, en zeker niet vrij van ongewenste neveneffecten, vooral bij patiënten met ernstige spasticiteit die intramuraal verblijven b.v. in verpleeghuizen (zie ook aanbevelingen bij de module ‘Orale spasmolytica bij spasticiteit’).
Onderbouwing
Achtergrond
Van oudsher nemen orale spasmolytica een prominente plaats in bij de behandeling van spasticiteit. De afgelopen decennia zijn er echter andere belangrijke behandelopties bijgekomen, waardoor de plaats van orale middelen moet worden heroverwogen. Bovendien wordt de rol van spasticiteit in de huidige tijd anders gewaardeerd. Spasticiteit als entiteit op zich behoeft niet altijd behandeling, de focus ligt meer op de mogelijke negatieve gevolgen.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Er zijn geringe aanwijzingen dat orale baclofen, tizanidine en tolperison effectiever zijn dan placebo en dat diazepam effectiever is dan tizanidine bij de behandeling van cerebrale spasticiteit.
Bronnen (Montane, 2004; Stamenova, 2005) |
|
Zeer laag GRADE |
Er zijn geringe aanwijzingen dat baclofen en tolperison relatief een gunstig bijwerkingenprofiel hebben in vergelijking met andere orale spasmolytica, vooral bij cerebrale spasticiteit.
Bronnen (Montane, 2004; Stamenova, 2005) |
|
Zeer laag GRADE |
Er is onvoldoende bewijs om aan te geven welke orale spasmolytica het gunstigste (bij)werkingenprofiel hebben bij de behandeling van spinale spasticiteit of de behandeling van MS patiënten.
Bronnen (Shakespeare, 2003; Taricco, 2009; Chu, 2014) |
Samenvatting literatuur
Spinale spasticiteit
Zeven trials beschreven de behandeling van spinale spasticiteit met orale spasmolytica. De volgende vergelijkingen werden gemaakt: clonidine versus placebo (Stewart, 1991), gabapentine versus placebo (Gruenthal, 1997), diazepam versus amobarbital en versus placebo (Corbett, 1972), tizanidine versus baclofen en versus placebo (Chu, 2014), tizanidine versus placebo (Nance, 1994), en twee trials onderzochten baclofen versus placebo (Jones, 1970; Burke, 1971). Deze studies beschreven dezelfde data en gelden daarom als één RCT.
Vijf van de zes RCT’s gebruikten een cross-over design. Eén trial (Nance, 1994) onderzocht de interventie in een parallel design. De RCT’s includeerden gezamenlijk 193 patiënten, waarvan er 118 afkomstig waren uit de studie van Nance. De patiënten zijn voornamelijk mannen (66% tot 100%) tussen de 15 en 69 jaar oud.
De validiteit van de studies was veelal onduidelijk vanwege de beperkte beschrijving van de gevolgde procedures. De randomisatieprocedure was slechts in één studie beschreven en voldoende. De studies waren allemaal dubbel-blind gecontroleerd. Eén cross-over trial had geen wash-out periode tussen de interventie en placebobehandeling, terwijl de overige studies daarvoor een periode van 24 uur en twee weken gebruikten.
De resultaten waren zeer summier beschreven in de primaire studies.
Resultaten
Voor de vergelijking tussen clonidine versus placebo zijn geen voor de richtlijn relevante uitkomsten kwantitatief beschreven. Pijn was alleengrafisch gepresenteerd en het resultaat wees op een afname van de pijn. Eén patiënt met parese ging vooruit in loopvaardigheid. Drie van de twaalf patiënten vielen uit de studie vanwege ziekte of konden zich niet houden aan het protocol.
Het effect van gabapentine versus placebo werd onderzocht onder 25 patiënten. De ernst van de spasticiteit gemeten met de gemodificeerde Ashworth schaal. Spasticiteit nam 11% af in de gabapentine- ten opzichte van de placebogroep (p<0,05). Er werd geen verschil gevonden op andere uitkomsten (niet beschreven welke andere uitkomsten).
Eén studie onderzocht het effect van diazepam en amobarbital ten opzichte van placebo onder 22 patiënten. Vanwege organisatorische problemen zijn slechts van elf patiënten alle resultaten bekend. Er is gekeken of de patiënten spasticiteit verminderde op een vier-puntschaal (geen gevalideerd instrument). De uitkomsten werden gemeten door zes waarnemers, waaronder de patiënt zelf. Diazepam gaf volgens alle observatoren betere resultaten dan amobarbital of placebo. Slaperigheid werd als bijwerking genoemd door zeven patiënten. Zes benoemden dit tijdens gebruik van diazepam, twee gedurende gebruik van amobarbital en drie bij gebruik van de placebobehandeling.
Twee trials onderzochten de effectiviteit van baclofen vergeleken met placebo. Dit werd gedaan onder zes patiënten die eerder zijn behandeld met diazepam. Deze resultaten werden niet statistisch geanalyseerd. De tweede studie includeerde tien patiënten maar presenteerde alleen de bijwerkingen als relevante uitkomstmaat. Eén patiënt uit de baclofengroep gaf aan last te hebben van slaperigheid. In de placebogroep werden vermoeidheid, misselijkheid en tweemaal sufheid genoemd.
Tizanidine versus placebo werd onderzocht in twee studies. In één studie (Nance 1994) was er sprake van ernstige studie uitval. Veertig patiënten staakten de behandeling vanwege bijwerkingen (19 patiënten), uitblijven van effect (11 patiënten) en om niet gerapporteerde redenen (10 patiënten). Daarnaast kregen zes patiënten de interventie of placebobehandeling niet. Bij de overige patiënten gaf tizanidine een significante afname van -4,41 (Standaardfout 0,57) in spasticiteit gemeten met de Ashworth schaal. Er werd geen significant verschil waargenomen in functioneren (algemene dagelijkse levensverrichtingen). In de tizanidinegroep rapporteerde 81% van de patiënten één of meer bijwerkingen ten opzichte van 53% in de placebogroep (p=0,002). De studie van Chu (n=10) beschreef de toedracht van de bijwerkingen. Patiënten ervoeren een combinatie van misselijkheid, vermoeidheid en slaperigheid, vermoeidheid en slaperigheid (tweemaal) en slaperigheid (tweemaal).

Bewijskracht van de literatuur
De bewijskracht voor de uitkomsten is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (niet omschreven randomisatieprocedure en blindering van de allocatie, hoge uitval van deelnemers), de indirecte vergelijking tussen de middelen (indirectheid) en het zeer geringe aantal patiënten per vergelijking (imprecisie).
Cerebrale spasticiteit (spasticiteit na traumatisch hersenletsel of cerebrovasculaire aandoening)
Zeven dubbel-blind gecontroleerde trials onderzochten orale spasmolytica bij spasticiteit na traumatisch hersenletsel of cerebrovasculaire aandoeningen. Drie trials gebruikten hiervoor een parallel design en vier gebruikten een cross-over design. Hierin werden de volgende vergelijkingen gemaakt: diazepam versus tizanidine (Bes 1988), baclofen versus tizanidine (Medici, 1989), baclofen versus placebo (Medear, 1991), dantroleen versus placebo (Ketel, 1984; Katrak, 1992), tizanidine versus placebo (Meythaler, 2001), en tolperison versus placebo (Stamenova, 2004). De gemiddelde leeftijd van de studiepopulatie lag tussen de 44 en 65 jaar. Het aandeel mannen varieerde tussen 35% en 82%.
De randomisatieprocedure was in geen van de geïncludeerde trials voldoende beschreven. Daarnaast was de methode voor het blinderen van de behandelaar of patiënt in drie trials onvoldoende beschreven. Het aantal studiedeelnemers dat uitviel varieerde tussen 12% en 25%.
De resultaten waren zeer summier beschreven in de primaire publicaties.
Resultaten
Een vergelijking tussen diazepam versus tizanidine onder 105 patiënten toonde aan dat de loopafstand significant verbeterde bij gebruik van diazepam (p<0,05). Ook gaf diazepam in 72% bijwerkingen terwijl dit in de tizanidinegroep 88% was.
Uit een vergelijking van baclofen versus tizanidine bij 30 patiënten bleek dat de ernst van de spasticiteit gemeten op de Ashworth schaal aan het eind van de follow-up periode niet van elkaar verschilde. Het aantal bijwerkingen was in de baclofen groep slechts 27% ten opzichte van 60% in de tizanidinegroep.
Uit een vergelijking tussen baclofen en placebo bij 20 patiënten bleek dat baclofen significant betere resultaten gaf op zowel de Ashworth schaal (2,9 versus 3,2 p<0,001) en de Oswestery disability index (3,8 versus 3,2; p<0,014) dan de placebobehandeling. Op de Incapacity Rating Scale werd geen verschil gevonden. Baclofen gaf in 50% bijwerkingen versus 15% in de placebogroep.
In een vergelijking tussen tizanidine en placebo onder 17 patiënten bleek dat spasticiteit afnam na gebruik van tizanidine in zowel de onderste als de bovenste extremiteit gemeten op de Ashworth schaal.
Twee trials met 18 en 38 patiënten onderzochten dantroleen ten opzichte van placebo. De ernst van de spasticiteit gemeten met de Spasticity Rating Scale nam af in de dantroleengroep, maar dit verschil was niet significant. Daarnaast nam het functioneren (ADL) toe in de dantroleengroep, maar ook dit was niet significant verschillend van de placebobehandeling. Bijwerkingen kwamen in beide trials voor bij 64% van de dantroleen gebruikers. Bijwerkingen kwamen onder 11% en 19% van de placebogroep voor.
Eén trial onderzocht tolperison versus placebo onder 120 patiënten. De ernst van de spasticiteit was na twaalf weken significant lager na behandeling met tolperison gemeten met de Ashworth schaal (1,10 ± 0,77 vs. 0,52 ± 0,57; P<0,0001). Bijwerkingen kwamen vaker voor in de placebogroep (n=26) dan in de tolperisongroep (n=19).

Bewijskracht van de literatuur
De bewijskracht voor de uitkomsten is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (niet omschreven randomisatieprocedure en blindering of allocatie van de behandeling), de indirecte vergelijking tussen de middelen (indirectheid) en het zeer geringe aantal patiënten (imprecisie).
Spasticiteit bij MS
De review van Shakespeare et al. includeerde 39 RCT’s waarvan 31 RCT’s een oraal farmacologische interventie onderzochten om spasticiteit bij patiënten met MS te behandelen. De trials waren dubbel-blind gecontroleerd en relatief oud. Eén trial werd gepubliceerd in de jaren ’60, tien in de jaren ’70, vijftien in de jaren ’80, drie in de jaren ’90 en twee in de jaren ’00. Hierin werden de volgende vergelijkingen gemaakt: baclofen versus placebo, dantroleen versus placebo, tizanidine versus placebo, vigabatrine versus placebo, cannabinoiden versus placebo, prazepam versus placebo, progabide versus placebo, baclofen versus tizanidine, en vergelijkingen met diazepam (baclofen versus diazepam, lage- en hoge dosering diazepam (8mg en 20 mg) versus dantroleen, twee benzodiazepines te weten ketazolam versus diazepam, en tizanidine versus diazepam). Twintig trials hadden een cross-over design, tien een parallel design en in één RCT was het niet duidelijk beschreven welk design gebruikt werd.
De trials hadden te maken met methodologische beperkingen. De randomisatieprocedure en de blindering van de allocatie was veelal niet beschreven en de uitval van studiedeelnemers was soms aanzienlijk en beperkte de validiteit. Daarbij was de studiepopulatie in een aantal RCT’s heterogeen waardoor de extrapoleerbaarheid van de resultaten wordt beperkt.
Resultaten
In zes trials werd baclofen met een placebo vergeleken. Echter, slechts twee trials rapporteerden een uitkomst relevant voor deze richtlijn. Brar (1991) vond dat patiënten die baclofen kregen in combinatie met oefentherapie een significant betere score op de Ashworth schaal hadden. Feldman (1978) vond dat pijnlijke spasticiteit en clonus afnam in patiënten behandeld met baclofen.
Vier trials onderzochten dantroleen versus placebo, maar geen van de trials rapporteerde een voor deze richtlijn relevante uitkomst.
Drie trials vergeleken tizanidine met een placebobehandeling. Twee van deze trials rapporteerden aanzienlijke studie-uitval vanwege niet beschreven redenen (uitval in Smith, 1994: tizanidine n=35/111 en placebo n=26/109; uitval United Kingdom Tizanidine Trial Group (UKTTG), 1994: totaal 32/187 en daarnaast hielden n=117 patiënten zich niet aan het protocol). De RCT van Smith vond geen verschil op de Ashworth schaal tussen tizanidine en placebo terwijl de trial van UKTTG dit wel vond (tizanidine groep=14,6 (SD: 10,1); placebogroep=15,3 (SD: 10,0); p=0,004). Echter, de UKTT-groep vond geen verschil tussen beide groepen in spasticiteit score, pijn, acht-minuten loopafstand of op de Expanded Disability Status Scale (EDSS). Lapierre et al. (1987) rapporteerden ook geen verschil in de EDSS.
Bijwerkingen werden genoemd door 91% in de tizanidinegroep en door 61% in de placebogroep in de publicatie van Smith et al. Voor veertien patiënten, waaronder zes met een placebobehandeling, waren de bijwerkingen aanleiding om de behandeling te staken. In de RCT van UKTTG waren bijwerkingen voor 29 deelnemers aanleiding om de behandeling te staken. Bijwerkingen waren voornamelijk: een droge mond, vermoeidheid en slaperigheid.
Een vergelijking tussen vigabatrine versus placebo werd gemaakt in twee trials. Hiervan rapporteerde slechts één trial (Joder-Ohlenbusch, 1984) relevante uitkomsten gemeten onder 25 patiënten. Uit de analyse bleek dat de vooruitgang op de Ashworth schaal in beide groepen gelijk was.
Twee RCT’s onderzochten de effectiviteit van cannabinoiden versus placebo onder n=16 en n=18 patiënten. Beide namen de Ashworth schaal mee als uitkomstmaat maar vonden geen significant verschil in de resultaten (data niet beschikbaar). Killestein (2002) vond echter wel een afname in MS-uitkomsten (MS functional composite score), en Wade (2003) vond een significante afname van pijn en de spasticiteitscore. Bijwerkingen werden niet beschreven.
Baclofen en tizanidine werd in zeven trials onder totaal 317 patiënten onderzocht. Echter, alleen de trial van Bass (1988) beschreef kwantitatieve uitkomsten. Hieruit bleek dat de behandeling geen significant verschillend effect had op EDSS. Overige RCT’s beschreven geen significante verschillen in ernst van de spasticiteit, spasticiteitscore of frequentie van clonus.
Daarnaast werden vergelijkingen gemaakt tussen baclofen en diazepam, lage- en hoge dosering diazepam (8mg en 20 mg) versus dantroleen, ketazolam versus diazepam, en tizanidine versus diazepam. Er werd geen verschil gevonden tussen baclofen en diazepam onder 16 patiënten op de Ashworth schaal, clonus- en spasticiteitscore, loopvaardigheid of bijwerkingen. In de vergelijking tussen diazepam en dantroleen werd eveneens geen verschil gevonden op de uitkomsten clonus, loopsnelheid of bijwerkingen. Patiënten gaven vaker de voorkeur aan het gebruik van dantroleen (n=22 versus n=13). In de vergelijking tussen ketazolam en diazepam werd er geen verschil gevonden in functioneren gemeten met de Ashworth schaal tussen tizanidine en diazepam (Rinne, 1980). Jellinger et al. (1983) vonden een verbetering in ernst van spasticiteit en clonus. In beide trials gaven patiënten aan vaker last te hebben van slaperigheid en slapheid bij gebruikt van diazepam.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomsten is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet (hoge uitval, en niet omschreven randomisatieprocedure) het zeer geringe aantal patiënten (imprecisie) vanwege het feit dat de populatie niet in alle trials geheel uit MS patiënten bestond (indirectheid) en de middelen niet in één trial direct met elkaar zijn vergeleken.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Wat zijn de (on)gunstige effecten van orale spasmolytica ten opzichte van elkaar of een placebo bij de behandeling van cerebrale en/of spinale spasticiteit?
P: Patiënten met spasticiteit met onvoldoende respons op niet-medicamenteuze therapie
I: Orale spasmolytica
C: Alternatieve therapie
O: Spiertonus, spierkracht, actief en passief bewegingsbereik, pijn; functionele metingen van balans, lopen, arm- en handvaardigheid, activiteiten van het dagelijks leven (ADL); sociale participatie bijwerkingen
Relevante uitkomstmaten
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase werd met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd primair onderzoek (RCT’s). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 235 treffers op. Systematische reviews werden geselecteerd op grond van de volgende selectiecriteria: literatuur is gezocht in tenminste twee databases met een objectieve en transparante selectiemethode, wijze van data extractie en methodologische beoordeling (risk of bias assessment). Systematische reviews of RCT’s zijn geselecteerd wanneer het ging om deelnemers met niet aangeboren spasticiteit (cerebrale spinale en/of cerebrale spinale spasticiteit) die werden behandeld met orale spasmolytica (ten opzichte van elke andere interventie) en het effect werdbeoordeeld op basis van één van de geselecteerde uitkomsten. Op basis van titel en abstract werden in eerste instantie 22 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens achttien studies geëxcludeerd (zie exclusietabel), en vier studies definitief geselecteerd.
(Resultaten)
Er is één Cochrane review opgenomen in de literatuuranalyse over patiënten met spinale spasticiteit (Taricco, 2009). Deze review is aangevuld met één RCT (Chu, 2014). De systematische review van Taricco includeerde negen publicaties van acht RCT’s, waarvan vijf (zes publicaties) een oraal middel onderzochten. Samen met de trial van Chu zijn er in totaal zes RCT’s meegenomen (zeven publicaties) in de literatuuranalyse naar orale spasmolytica bij spinale spasticiteit. De studies gebruikten alle een cross-over design en includeerden samen 193 patiënten (range 6 tot 118 patiënten per studie). De validiteit van de review werd onderzocht met de AMSTAR instrument. Hier waren geen noemenswaardige beperkingen gevonden. De validiteit van de additionele studie is onderzocht met de Cochrane risk of bias instrument.
Er is één systematische review opgenomen waarin patiënten met cerebrale spasticiteit zijn onderzocht (Montane, 2004). De review includeerde twaalf RCT’s waarvan er zes RCT’s patiënten met CVA of traumatisch hersenletsel onderzochten. Drie RCT’S hadden een cross-over design. De zoekactie om de review te updaten identificeerde één relevante trial met parallel design (Stamenova, 2005). De zeven trials includeerden samen 349 patiënten. De validiteit van de review werd onderzocht met de AMSTAR instrument. Er was in de review van Montane geen overzicht gegeven van de referenties die geëxcludeerd zijn. Verder waren er geen noemenswaardige beperkingen gevonden. De validiteit van de additionele studie is onderzocht met de Cochrane risk of bias tool.
Er is één systematische review opgenomen waarin patiënten met spasticiteit en MS zijn onderzocht (Shakespeare, 2003). De zoekactie leverde geen aanvullende RCT’s op die aan de inclusiecriteria voldeden. De review includeerde 39 RCT’s. Hiervan onderzochten vijf RCT’s een middel dat niet in Nederland is geregistreerd (L-threonine) of middelen die vanwege toxiciteit niet therapeutisch gebruikt worden (progabide en brolitene). Daarnaast onderzochten drie trials de effectiviteit van een niet-orale (intramusculaire) interventie (botulinetoxine). Zodoende waren er 31 RCT’s relevant voor de uitgangsvraag, waaronder twee dubbel-publicaties. De validiteit van de review werd onderzocht met de AMSTAR instrument. Hier waren geen noemenswaardige beperkingen gevonden.
De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Chu VW, Hornby TG, Schmit BD. Effect of antispastic drugs on motor reflexes and voluntary muscle contraction in incomplete spinal cord injury. Arch Phys Med Rehabil. 2014;95(4):622-32. doi: 10.1016/j.apmr.2013.11.001. Epub 2013 Nov 21. PubMed PMID: 24269485.
- Montané E, Vallano A, Laporte JR. Oral antispastic drugs in nonprogressive neurologic diseases: a systematic review. Neurology. 2004;63(8):1357-63. Review. PubMed PMID: 15505149.
- Shakespeare DT, Boggild M, Young C. Anti-spasticity agents for multiple sclerosis. Cochrane Database Syst Rev. 2003;(4):CD001332. Review. PubMed PMID:14583932.
- Stamenova P, Koytchev R, Kuhn K, et al. A randomized, double-blind, placebo-controlled study of the efficacy and safety of tolperisone in spasticity following cerebral stroke. Eur J Neurol. 2005;12(6):453-61. PubMed PMID: 15885050.
- Taricco M, Adone R, Pagliacci C, et al. Pharmacological interventions for spasticity following spinal cord injury. Cochrane Database Syst Rev. 2000;(2):CD001131. Review. PubMed PMID: 10796750.
Evidence tabellen
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
McIntyre A, 2012 |
Systematische review. Geen aanvullinde RCT’s meegenomen t.o.v. van de review van Montane, in totaal minder RCT’s vanwege beperkte PICO. |
|
Nance PW, 2011 |
RCT: arbaclofen placarbil in patients with spasticity due to spinal cord injury. Middel is niet beschikbaar in Nederland. |
|
Phillips K 2014 |
Protocol |
|
Lu 2012 |
Geen orale toediening. |
|
Chang E, 2013 |
Overview, narratief |
|
Olvey EL, 2010 |
Review voldoet niet aan de PICO. |
|
Cui 2009 |
Chinese publicatie. |
|
Kamen 2008 |
Narratieve review |
|
Tarrico 2006 |
Update uit 2009 beschikbaar |
|
Landau WM, 2005 |
Brief bij publicatie van Montané |
|
Cardoso 2005 |
Toedieningsvorm van BtX injecties: relevant voor vraag 6 |
|
Yelnik 2005 |
Franstalig |
|
Beard, 2003 |
Systematische review bij MS. Recentere versie beschikbaar in de vorm van de publicatie van Shakespeare 2009. |
|
Meythaler JM, 2001 |
RCT is opgenomen in review van Montane 2004 |
|
Orsnes GB, 2000 |
Geëxcludeerd in de review van Shakespeare vanwege geen RCT |
Research question: Spinal cord injury
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Taricco, 2009 |
SR and meta-analysis of RCT’s
Literature search up to July 2008 (additional search by knowledge centre on March 2015)
A: Chu 2014* B: Burke 1971; Jones 1970 C: Corbett 1972 D: Gruenthal 1997 E: Nance 1994 F: Stewart 1991
Study design: RCT
Source of funding: Not reported
|
Inclusion criteria SR: All parallel and cross-over randomised controlled trials (RCT’s) including spinal cord injury patients complaining of ’severe spasticity’.
Exclusion: Studies where less than 50% of patients had a spinal cord injury
7 studies included (6 RCT’s)
Important patient characteristics at baseline:
N, mean age A: 10 pts, 49 yrs B: 6 pts, 17-41 yrs C: 22 pts, age not reported D: 25 pts, 21 – 60 yrs E: 118 pts, 15 -69 yrs F: 12 pts, 19 – 57 years
Sex: A: 100% Male B: 66% Male C: Not reported D: 88% Male E: 88% Male F: Not reported
Groups comparable at baseline? Unclear |
A1: Baclofen 30 mg A2: Tiazidine 4 mg B: Baclofen 15 mg; daily increasing by 15 mg every three days until 60 mg (five pts) and to 75 mg (one pt) C: Amytal 30 mg and Valium 5 mg during 3 periods of 2 weeks. Gradual increasing of doses from 1 to 3 tablets a day D: gabapentin 400 mg x 3 daily for 48 hours, added to usual medications E: tizanidine, at dosage titrated from 4 to a maximum of 36 mg/d in 3 doses during the weeks 1 to 3 (titration phase). The individual maximum doses reached at the end of titration were maintained during weeks 4 to 7 (plateau phase) and tapered to stop medication during week 8 F: clonidine 3 times a day, for 2 periods of 4 weeks. Initial doses 0.05 mg/day, increasing every 3 days until the optimal dose (0.10 mg - 0.50 mg/day) at the end of second week |
A: placebo B: placebo C: placebo D: placebo E: placebo F: placebo
|
End-point of follow-up:
A: 7 days B: after 14 and 28 days C: after therapy (2 weeks) D: day 3, 15 and 17 E: week 5 and 7 F: 4 weeks
For how many participants were no complete outcome data available? (intervention/control) A: 0/0 B: 0/0 C: Complete observations reported in 11 pts due to organisational problems. D: 3 (unknown reasons) E: 40 patients interrupted the trial due to adverse events or insufficient therapeutic effect. Six pts, after randomisation, did not receive study medication and were not considered in the analysis F: 3 (illness or inability to comply with the protocol). |
Clonidine versus placebo No quantitative results
Gabatine versus placebo
Severity of spasticity Defined as Ashworth score I: reduction of 11% P=0.044
Valium versus Amytal and placebo Valium is superior to Amytal p<0.05 (in 11 to 19 patients)
Baclofen versus placebo Adverse effects: I: Somnolence C: Fatigued, dizziness, relaxed (2x), none (5x)
Tiazidine versus placebo
Severity of spasticity Defined as Ashworth score (mean difference, (SE)) -4,41 (0,57)
Adverse effects: I: Dizziness, fatigued, somnolence (1x), fatigued, somnolence (2x), somnolence (2x) C: Fatigued, dizziness, relaxed (2x), none (5x)
|
There is insufficient evidence to assist clinicians in a rational approach to antispastic treatment for SCI. Further research is urgently needed to improve the scientific basis of patient care.
*this studied was identified in the update search strategy |
Research question: Cerebrale spasticititeit
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Montané, 2004
|
SR and meta-analysis of RCT’s
Literature search up to January 2004 (additional search by knowledge centre on March 2015)
A: Bes, 1988 B: Medici, 1989 C: Ketel, 1984 D: Medear, 1991 E: Meythaler, 2001 F: Katrak, 1992 G: Stamenova, 2004*
Study design: RCT
Setting and Country: Not reported
Source of funding: Not reported
|
Inclusion criteria SR: Reports of clinical trials were considered if patients’ allocation was randomized, spasticity was due to nonprogressive neurologic diseases (spinal cord injury, cerebral palsy, and cerebrovascular disease), and the experimental drug was given by oral route.
Exclusion criteria SR: Data from case reports, abstracts, and letters were excluded. Reports were also excluded if the study was not double-blind, when sample size was less than 10 patients, when patients with spasticity had MS, and when the experimental agent was administered by intrathecal or other parenteral routes (mainly baclofen and botulinum toxin A).
7 studies included
Important patient characteristics at baseline:
N, mean age A: 105 pts, 52 yrs B: 30 pts, 49 yrs C: 18 pts, 61 yrs D: 20 pts, 65 yrs E: 17 pts, 44 yrs F: 38 pts, 61 yrs G: 120 pts, 63 yrs
Sex: A: 73% Male B: 80% Male C: 44% Male D: 35% Male E: 82% Male F: 74% Male G: 64% Male
Groups comparable at baseline? Unclear |
A: diazepam 30 mg/d B: baclofen 20-50 mg/d C: dantrolene 6 wk followed by dantrolene 25 mg/8-12 h D: baclofen 30 mg/d E: tizanidine 12-36 mg/d F: dantrolene 50-200 mg/d G: tolperisone 300 -900 mg/d
|
A: tizanidine 24 mg/d B: tizanidine 8-20 mg/d C: dantrolene 6 wk followed by placebo D: placebo E: placebo F: placebo G: placebo
|
End-point of follow-up:
A: 8 wks B: 12 mo C: 12 wks D: 19 wks E: 15 wks F: 14 wks G: 12 wks
For how many participants were no complete outcome data available? (intervention/control) A: 23 (22%) B: 5 (17%) C: 4 (22%) D: 5 (25%) E: 2 (12%) F: 7 (18%) G: 23 (19%) two patients dropped out in the tolperisone group (n=1 on own request, n=1 lost to follow-up). Seven patients withdrew from placebo (n=2 adverse events; n=2 lack of efficacy; n=2 lost to follow-up; n=1 on own request). Additionally, seven patients in each group were excluded from the PP analysis because of protocol violations.
|
Diazepam versus Tizanidine
Functioning (walking distance) Better in diazepam group (p < 0.05).
Severity of spasticity (clonus) No differences
Severity of spasticity Defined as Ashworth score
Adverse effects I: 72% C: 88%
Baclofen versus tizanidine
Severity of spasticity Defined as Ashworth score, muscle spasms or clonus, No differences
Adverse effects I: 27% C: 60%
Dantrolene versus placebo
Improvement of Spasticity Grading Scale in advantage of the dantrolene
Adverse effects I: 64% C: 11%
Baclofen versus placebo
Severity of spasticity Defined as Ashworth score I: 2.9 C: 3.7 P<0.001 in advantage of the intervention
Functioning (Oswestry) I: 3.8 C: 3.2 P<0.014 in advantage of the intervention
Adverse effects I: 50% C: 15%
Tizanidine versus placebo
Severity of spasticity Defined as Ashworth score Lower and upper limbs: p < 0.0001 in advantage of the intervention
Severity of spasticity Defined as Penn Spasm Frequency Scale (PSFS) Lower limps: p =0.046 in advantage of the intervention Upper limbs: No significant difference
Adverse events Not reported
Dantrolene versus placebo
Functioning (ADL) No difference
Adverse events I: 64% C: 19% |
The general methodologic quality was poor, which impedes performing a meta-analysis and reaching a firm conclusion regarding the clinical management of spasticity.
Antispastic drugs should be used with caution in the mobile spastic patient, because the decrease in muscle tone may seriously impair movement performance. Only when the patient is totally dependent because of severe spasticity may it be advisable to improve spasticity even at the cost of undesirable weakness or drowsiness.
There is a clear need for well-designed large RCT’s in patients with spasticity associated with nonprogressive neurologic diseases.
*this studied was identified in the update search strategy |
Research question: MS
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Shakespeare, 2003
|
SR and meta-analysis of RCT’s / cohort
Literature search up to June 2003 (additional search by knowledge centre on March 2015)
A: Basmajian 1974, Basmajian 1975 B: Basmajian 1984 Basmajian 1986 C: Bass 1988 D: Killestein 2002 E: Brar 1991 F: Chrzanowski 1981 G: Eyssette 1988 H: Feldman 1978 I: From 1975 J: Gelenberg 1973 K: Jellinger 1983 L: Joder- Ohlenbusch 1984 M: Lapierre 1987 N: Levine(1) 1969 O: Luisto 1982 P: Pellkofer 1989 Q: Rinne 1980 R: Sachais 1977 S: Sawa 1979 T: Schmidt 1975 V: Sheplan 1975 X: Smith 1994 Y: Smolenski 1981 Z: Stien 1987 A2: Tell 1981 B2: Tolosa 1975 C2: UKTTG 1994 D2: Wade 2003 E2: Wuthrich 1981
Study design: RCT A: Crossover B: Crossover C: Crossover D: Crossover E: Crossover F: Parallel G: Parallel H: Crossover I: Crossover J: Crossover K: Crossover L: Crossover M: Parallel N: Crossover O: Unclear P: Crossover Q: Crossover R: Parallel S: Crossover T: Crossover V: Crossover X: Parallel Y: Parallel Z: Parallel A2: Crossover B2: Parallel C2: Parallel D2: Crossover E2: Parallel
Setting and Country: Not reported
Source of funding: Not reported |
Inclusion criteria SR: Double-blind, RCT’s of at least seven days duration on patients with a clinically definite diagnosis of MS at any stage of their disease and with spasticity of any degree were included.
Exclusion criteria SR: Quasi-randomised, unrandomised and unblinded trials. Studies on patients within one month of a relapse were excluded. Studies including patients with other diagnoses were excluded unless individual data for the MS patients could be obtained.
39 studies included, of which 31 were relevant for the guideline
Important patient characteristics at baseline:
N, age A: 22 pts, ? yrs B: 30 pts, ? yrs C: 66 pts, ? yrs D: 16 pts, ? yrs E: 30 F: 23 pts, 24-69 yrs G: 100 pts, 18-70 yrs H: 23 pts, 38-53 yrs I: 16 pts, ? yrs J: 20 pts K: 32 pts, 18-70 yrs L: 25 pts, ? yrs M: 66 pts, 18-60 yrs N: 18 pts, ? yrs O: 3 pts, ? yrs P: 47 pts, ? yrs Q: 30 pts, ? yrs R: 106 pts, ? yrs S: 21 pts, ? yrs T: 46 pts, ? yrs V:8 pts, ? yrs X: 220 pts, 18-70 yrs Y: 21 pts, 42-73 yrs Z: 40 pts, ? yrs A2: 5 pts, ? yrs B2: 23 pts, ? yrs C2: 187 pts, 18-75 yrs D2: 18 pts, ? yrs E2: 20 pts, 19-71 yrs
Other characteristics not reported
Groups comparable at baseline? |
A: Baclofen (dose not reported) B: Ketazolam 30 - 60mg C: Baclofen up to 80mg D: 2.5-5mg THC v. C. sativa plant extract E: Baclofen 20mg, with and without an exercise programme F: Baclofen up to 90mg G: Baclofen up to 60mg H: Baclofen up to 80mg I: Baclofen up to 120mg J: Dantrolene up to 800mg K: Tizanidine up to 24mg, mean 14.8mg L: Vigabatrin 3 g daily M: Tizanidine up to 36mg N: Prazepam 5-25mg as tolerated O: Dantrolene up to 400mg daily P: Tetrazepam P2: Tizanidine Q: Tizanidine up to 18mg R: Baclofen 60-80mg S: Baclofen up to 60mg T: Diazepam 8mg and 20mg V: Dantrolene up to 400mg X: Tizanidine 2-36mg Y: Baclofen up to 80mg Z: Baclofen up to 90mg A2: Vigabatrin 2 g daily B2: Dantrolene up to 800mg C2: Tizanidine up to 36mg D2: THC v. CBD v. 1:1 mixture of THC:CBD E2: Baclofen 20-60mg |
A: placebo B: diazepam 15 - 30mg C: tizanidine up to 32mg D: placebo E: or placebo, with and without an exercise programme F: tizanidine up to 36mg G: tizanidine up to 24mg H: placebo I: diazepam up to 40mg J: placebo K: diazepam up to 30mg, mean 14.5mg L: placebo M: placebo N: placebo O: placebo P: baclofen Q: diazepam up to 22.5mg R: placebo S: placebo T: dantrolene 100mg and 300 mg V: placebo X: placebo Y: tizanidine up to 36mg Z: tizanidine up to 36 mg A2: placebo B2: placebo C2: placebo D2: placebo E2: tizanidine 8-24mg
|
End-point of follow-up: No data available
For how many participants were no complete outcome data available? C: 18/66 (four were excluded due to protocol violation, two due to relapse, 11 due to weakness (baclofen seven, tizanidine four), and five (on baclofen) due to nausea. T: 76/111 in the tizanidine group and 83/109 in the placebo group completed the study C2: 32 (reasons not reported) were loss to follow-up but only 70 (29 tizanidine, 41 placebo) complied with the study protocol completely.
|
Baclofen versus placebo No quantitative results
Dantrolene versus placebo No quantitative results
Tizanidine versus placebo
Severity of spasticity Defined as Ashworth score I: 14.6 (SD 10.1) C: 15.3 (SD 10.0) P=0.004
No significant difference was noted between the tizanidine- and placebo-treated groups in spasm score.
Pain No significant difference was noted in pain score
Functioning No significant difference was noted in eight metre walk time or expanded disability status scale.
Side effects I: 91% C: 61%
Quit treatment because of side effects: Smith I: 8 (dry mouth n=2, somnolence n=4, dizziness n=2, hepatitis and hallucinations n=1) C: 6 (dry mouth n=2, dizziness n=1, other reasons not reported) UKTTG I: 29 (12 due to adverse effects of tiredness, drowsiness or dry mouth; 12 due to inefficacy, three due to poor co-operation, one because of an unrelated illness and one because of withdrawal effects from previous anti-spasticity medication)
Vigabatrin versus placebo
Severity of spasticity Defined as Ashworth score
Improvement in Ashworth score in the same number of participants with vigabatrin and placebo.
Cannabinoids versus placebo
Severity of spasticity Defined as Ashworth score
Baclofen versus tizanidine No significant difference was noted in the EDSS or the unvalidated tonemeasures for either drug.
Baclofen versus diazepam No quantitative results
Dantrolene versus diazepam No quantitative results
Ketazolam versus diazepam No quantitative results
Tizanidine versus diazepam No quantitative results |
Authors’ conclusion The absolute and comparative efficacy and tolerability of anti-spasticity agents in multiple sclerosis is poorly documented and no recommendations can be made to guide prescribing. The rationale for treating features of the upper motor neurone syndrome must be better understood and sensitive, validated spasticity measures need to be developed.
|
Table of quality assessment for systematic reviews of RCT’s and observational studies
Based on AMSTAR checklist (Shea et al.; 2007, BMC Methodol 7: 10; doi:10.1186/1471-2288-7-10) and PRISMA checklist (Moher et al 2009, PLoS Med 6: e1000097; doi:10.1371/journal.pmed1000097)
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/not applicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Taricco, 2009 |
Yes, PICO format |
Yes, several database, using Mesh terms, reference list and contacting experts. |
Yes, both lists are provided in de publication. |
Yes, the patients, design and intervention were well described. |
n.a. |
Yes, objective risk of bias assessment. |
n.a. the results were not combined in a meta-analysis because of heterogeneity. |
No, no search in prospective trial register (funnel plot analysis not possible due to heterogeneity in data). |
No conflicts of interest. |
|
Montane, 2004 |
Yes, clearly specified aim |
Yes, several database, using Mesh terms, reference list |
No, there were no reference reported by the excluded studies. |
Yes, the patients, design and intervention were well described. |
n.a. |
Yes, risk of bias was scored using Jaded scoring tool reported per item. |
n.a. the results were not combined in a meta-analysis because of heterogeneity. |
Yes, although no search in prospective trial register was performed (funnel plot analysis not possible due to heterogeneity in data). |
Supported by Pfizer Spain. The conception, methods, analysis, and publication of the present study have been independent from the funding source. |
|
Shakespeare, 2009 |
Yes, PICO format |
Yes, several database, using Mesh terms, reference list, contacting experts and manufactures. |
Yes, both lists are provided in de publication. |
Yes, the patients, design and intervention were well described. |
n.a. |
Yes, objective risk of bias assessment. |
n.a. the results were not combined in a meta-analysis because of heterogeneity. |
No, no search in prospective trial register (funnel plot analysis not possible due to heterogeneity in data). |
No conflicts of interest. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2017
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
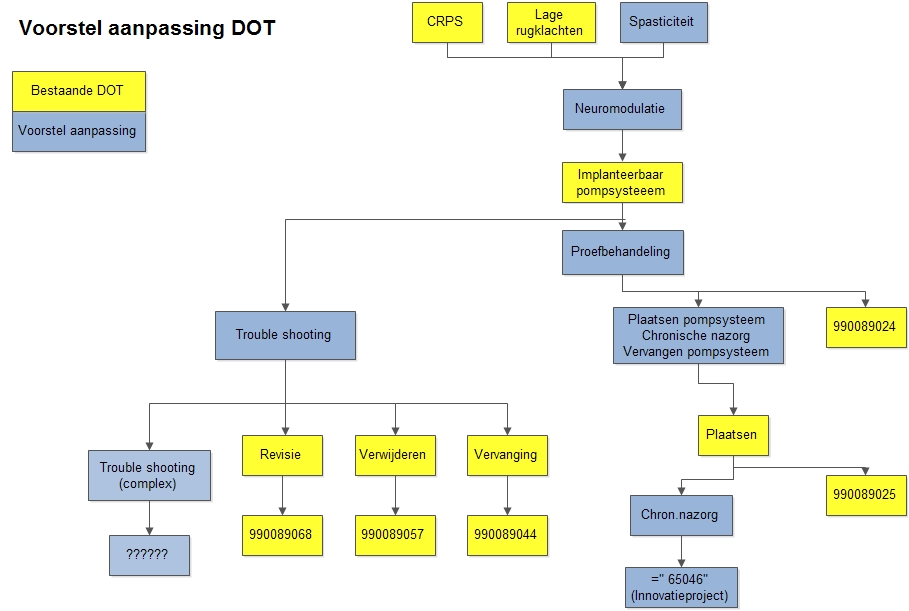
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
|
Database(s): Embase en Medline |
Datum: 25-02-2015 |
|
Periode: >2000 |
Talen: geen beperking |
|
Database |
Zoektermen |
Totaal |
|
Medline
2000-feb. 2015 |
1 exp Muscle Spasticity/ (6845) 2 exp Paraparesis, Spastic/ (318) 3 spastic*.ab,ti. (19157) 4 1 or 2 or 3 (21161) 5 exp Spinal Injuries/ (17870) 6 exp Multiple Sclerosis/ (45345) 7 exp Brain Injuries/ (50565) 8 (brain adj2 injur*).ab,ti. (41800) 9 (spinal adj2 injur*).ab,ti. (29378) 10 exp Craniocerebral Trauma/ (124784) 11 exp Cerebrovascular Disorders/ (283947) 12 tbi.mp. (13998) 13 ('acquired brain' adj2 injur*).ab,ti. (1138) 14 ('traumatic brain' adj2 injur*).ab,ti. (20110) 15 (head adj2 injur*).ab,ti. (20343) 16 stroke.ab,ti. (152438) 17 poststroke.ab,ti. (2995) 18 (cerebrovascular adj2 (accident* or diseas*)).ab,ti. (20171) 19 exp Spinal Cord Diseases/ (103281) 20 exp Neuromuscular Diseases/ or exp Motor Neuron Disease/ (243827) 21 exp Cerebral Palsy/ (15971) 22 exp Adult/ (5660331) 23 adult*.ti,ab. (843018) 24 22 or 23 (6092627) 25 21 and 24 (3434) 26 (('spinal cord' or neuromuscular) adj2 disease*).ab,ti. (5302) 27 'pyramidal system'.mp. (125) 28 ('upper motor neuron' adj2 (disease* or l?esion*)).ab,ti. (287) 29 (pyramidal adj2 insufficienc*).ab,ti. (14) 30 ('cerebral palsy' and adult*).ab,ti. (1127) 31 5 or 6 or 7 or 8 or 9 or 10 or 11 or 12 or 13 or 14 or 15 or 16 or 17 or 18 or 19 or 20 or 25 or 26 or 27 or 28 or 29 or 30 (849245) 32 tizanidine.mp. (458) 33 exp Dantrolene/ (1740) 34 exp Benzodiazepines/ (58682) 35 exp Clonazepam/ (2307) 36 exp Baclofen/ (4869) 37 lioresal.mp. or Baclofen/ (4912) 38 zanaflex.mp. (7) 39 'dantrolene sodium'.ab,ti. (511) 40 dantrium*.ab,ti. (38) 41 benzodiazepine*.ab,ti. (28526) 42 diazepam*.ab,ti. (17796) 43 clonazepam*.ab,ti. (3027) 44 rivotril*.ab,ti. (48) 45 baclofen*.ab,ti. (5834) 46 or/32-45 (82666) 47 (('oral pharmacological' or 'oral spasmolytic' or 'oral antispastic') adj3 (therap* or medication* or treat*)).ab,ti. (34) 48 (4 and 31 and 46) or (31 and 47) (689) 49 limit 48 to yr="2000 -Current" (396) 50 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (227308) 51 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1419681) 52 49 and 50 (27) 53 49 and 51 (98) 54 52 or 53 (106) – SR en RCT’s – 105 uniek 55 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Case control.tw,kw. or (cohort adj (study or studies)).tw,kw. or Cohort analy$.tw,kw. or (Follow up adj (study or studies)).tw,kw. or (observational adj (study or studies)).tw,kw. or Longitudinal.tw,kw. or Retrospective.tw,kw. or Prospective.tw,kw. or Cross sectional.tw,kw. or Cross-sectional studies/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2083916) 56 49 and 55 (95) 59 56 not 54 (59) – observationele studies |
309 |
|
|
('oral pharmacological' OR 'oral spasmolytic' OR 'oral antispastic') NEAR/3 (therap* OR medication* OR therap*)):ab,ti OR ('spasticity'/exp/mj OR 'spastic paresis'/exp/mj OR spastic*:ab,ti AND ('spine injury'/de OR 'multiple sclerosis'/exp/mj OR 'brain injury'/exp/mj OR (brain NEAR/2 injur*):ab,ti OR (spinal NEAR/2 injur*):ab,ti OR 'head injury'/exp/mj OR 'cerebrovascular disease'/exp/mj OR tbi:ab,ti OR ('acquired brain' NEAR/2 injur*):ab,ti OR ('traumatic brain' NEAR/2 injur*):ab,ti OR (head NEAR/2 injur*):ab,ti OR stroke:ab,ti OR poststroke:ab,ti OR (cerebrovascular NEAR/2 (accident* OR diseas*)):ab,ti) OR 'spinal cord disease'/exp OR 'neuromuscular disease'/exp/mj OR 'motor neuron disease'/exp/mj OR ('cerebral palsy'/exp/mj AND ('adulthood'/exp OR adult*:ab,ti)) OR (('spinal cord' OR neuromuscular) NEAR/2 disease*):ab,ti OR 'pyramidal system':ab,ti OR ('upper motor neuron' NEAR/2 (l?esion* OR disease*)):ab,ti OR (pyramidal NEAR/2 insufficienc*):ab,ti OR ('cerebral palsy':ab,ti AND adult*:ab,ti) AND ('tizanidine'/exp/mj OR 'dantrolene'/exp/mj OR 'benzodiazepine derivative'/exp/mj OR 'clonazepam'/exp/mj OR 'baclofen'/exp/mj OR lioresal*:ab,ti OR tizanidine*:ab,ti OR zanaflex*:ab,ti OR 'dantrolene sodium':ab,ti OR dantrium*:ab,ti OR benzodiazepine*:ab,ti OR diazepam*:ab,ti OR clonazepam*:ab,ti OR rivotril*:ab,ti OR baclofen*:ab,ti)) AND [embase]/lim AND [2000-2015]/py AND 'meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)), (46) AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blindprocedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti OR cohort:ab,ti OR 'follow up':ab,ti) NOT 'conference abstract':it (177) SR or RCT: 192 – 130 uniek clinical study'/exp NOT SR or RCT > 23 referenties – 15 uniek |
|
