Intrathecale baclofen bij spasticiteit
Uitgangsvraag
Wat is de plaats van intrathecale toediening van baclofen (ITB) bij patiënten met cerebrale en/of spinale spasticiteit?
Aanbeveling
Overweeg patiënten met gegeneraliseerde cerebrale en/of spinale spasticiteit in de onderste en/ of bovenste extremiteit die onvoldoende reageren op orale spasmolytica te behandelen met intrathecaal baclofen om een betere functionaliteit of betere verzorgbaarheid of comfort te bereiken.
Overweeg behandeling van potentiële kandidaten voor intrathecale baclofen verblijvend in een verpleeghuis op locatie ter voorkoming van belastende transporten, mits onder leiding van een medisch specialist met ITB-ervaring.
Verricht een proefbehandeling met intrathecale baclofen alleen middels bolusinjecties wanneer er geen sta- en/of loopvaardigheid meer is.
Verricht een proefbehandeling met intrathecale baclofen middels een tijdelijke katheter en een mini-infusor voor zorgvuldige titratie bij patiënten met residuele sta- en/of loopvaardigheid.
Stel pas de diagnose “tolerantie” nadat analyse van het toedieningssysteem of de patiënt heeft plaatsgevonden.
Vanwege het lage volume en de hoge complexiteit van de intrathecale baclofen (na)zorg, met de noodzaak tot continu beschikbare 24-uurszorg voor calamiteiten, verdient het aanbeveling deze zorg alleen na interdisciplinair overleg te indiceren en het aantal centra voor pompimplantaties, nazorg en trouble-shooting in Nederland sterk te beperken. Ook verdient het aanbeveling de behandeling in studieverband te laten plaatsvinden. Met studieverband bedoelt de werkgroep dat er sprake is van het systematisch registreren en rapporteren van patiënt-kenmerken, diagnostiek, behandeling en uitkomst (zie ook de module 'Organisatie van zorg’).
Overwegingen
De eerdergenoemde RCT’s geven afdoende antwoord op de vraag of intrathecale baclofen een effectieve behandelvorm is, echter zij geven nog onvoldoende antwoord op de uitgangsvraag naar de exacte plaats van intrathecale baclofentoediening. Ze geven namelijk onvoldoende inzicht in de bijwerkingen en de complicaties van chronisch (>3 maanden) toegediend intrathecaal baclofen. Hiervoor bestaan geen placebo gecontroleerde vergelijkende onderzoeken, echter deze onderzoeksmethodiek zou ook niet ethisch zijn bij patiënten bij wie de proefbehandeling een gunstig resultaat op de spasticiteit heeft uitgewezen. Hiervoor zou derhalve grootschalig longitudinaal cohortonderzoek beschikbaar dienen te zijn. Ook ontbreekt vergelijkend onderzoek van oraal versus intrathecaal toegediende baclofen. Voor deze beoordeling kan dan ook alleen gebruik worden gemaakt van observationele studies. Meerdere observationele studies concluderen dat intrathecale baclofen toediening een belangrijke behandeling is bij therapieresistente spasticiteit bij verschillende spinale en cerebrale aandoeningen (Ordia, 2002; Sampson, 2002; Beard, 2003; Zahavi, 2004; Guillaume, 2005; Krach, 2006; Saval, 2010; Schiess, 2010; Mathur, 2014; McIntyre, 2014; Natale, 2016). Zo wordt in een recente publicatie van de NHS Commissioning Board uit het Verenigd Koninkrijk (2013), ondanks beperkt bewijs, de ITB-therapie aanvaard als een effectievere behandeling voor therapieresistente spasticiteit, dan alleen de standaardtherapieën. Bij deze stellingname (NHS, 2013) is niet alleen de effectiviteit, maar ook onderzoek naar de kosteneffectiviteit meegenomen (Sampson, 2002; Hoving, 2008). Het Nederlandse onderzoek heeft een QALY van €32.737 berekend, bij een bereidheidsdrempel voor het betalen van een QALY van €80.000.
De indicatiestelling voor ITB-behandeling vindt in de regel pas plaats nadat orale medicamenteuze behandeling niet het gewenste resultaat oplevert of te veel bijwerkingen vertoont. Naar de opvatting van de werkgroep is er bij de ITB-behandeling sprake van onderbehandeling en een veelal laat ingestelde therapie. Bij een registratieonderzoek van de North American Research Committee naar MS (NARCOMS) werden 21.000 MS patiënten geregistreerd. Daaruit bleek dat 1% werd behandeld met ITB, terwijl er indicatie was voor 17% (Rizzo, 2004). Tot dusver wordt voornamelijk uitgegaan van klinisch relevante, functioneel belemmerende spasticiteit (Meythaler, 2001; Sampson, 2002; NHS, 2013). Hierbij is er onvoldoende aandacht voor spastische patiënten in een verpleeghuis (Meijer 2016), bij wie de doelstelling een betere verzorgbaarheid en comfort is. Op dit moment wordt een innovatieproject uitgevoerd, waarbij laatstgenoemde categorie zo veel mogelijk op locatie wordt behandeld, teneinde belastende transporten naar het ziekenhuis zoveel mogelijk te vermijden. In de Europese landen worden verschillende aantallen pompen per miljoen inwoners voor ITB-behandeling geïmplanteerd: Belgie: 16,3, Frankrijk: 1,72, Nederland: 3,1., Duitsland: 13,12, Engeland: 3,0 (Narendran, 2015). De voorkeuren van zowel de artsen als patiënten kunnen sterk variëren erg verschillen per land/cultuur, wat een mogelijke verklaring is voor deze verschillen. In deze studie wordt als oorzaak van de onderbehandeling aangegeven dat de complexiteit en de noodzakelijke interdisciplinaire benadering die mogelijk niet in alleziekenhuizen aanwezig is.
Het geschatte aantal ITB-patiënten in Nederland bedraagt circa 1000. Jaarlijks worden circa 200 pompen geïmplanteerd, waarvan 60% nieuwe patiënten en 40% pompvervangingen. In Nederland worden de implantaties in sterk variërende aantallen in negen centra gedaan. Deze versnippering is ongewenst. De werkgroep is dan ook van mening dat concentratie van de ITB-zorg noodzakelijk is en vanwege de schaarse informatie het gewenst is de behandeling in studieverband uit te voeren.
Bijwerkingen zijn vergelijkbaar met de orale toediening maar komen, vanwege de veel lagere systemische doseringen, minder vaak voor. Belangrijk is de in de literatuur genoemde bijwerking hypotonie. Deze spierzwakte bij actieve taken is naar het oordeel van de werkgroep geen bijwerking, maar een effect van ITB. De zorg dat ITB-behandeling niet selectief is en dus zou leiden tot spierzwakte aan de niet-aangedane zijde bij CVA-patiënten bleek ongegrond (Meythaler, 2001; Francisco, 2003; Ivanhoe, 2006). De beoordeling of spierzwakte ontstaat is cruciaal bij de beoordeling of de patiënt met sta- en loopvaardigheid gebaat is bij een ITB-behandeling. Bij een proefbehandeling kan met nauwkeurige titratie met een extern pompsysteem nagegaan worden of een dosis kan worden gevonden waarbij wél reductie van de spasticiteit, maar geen spierzwakte optreedt, waardoor nog aanwezige sta- en loopvaardigheid niet verloren gaat. Voor een actueel overzicht van bekende en/of gemelde bijwerkingen bij medicatie kan de website van Bijwerkingencentrum Lareb worden geraadpleegd (www.lareb.nl). Via deze website kunnen ook eventuele bijwerkingen worden gemeld.
De ITB-behandeling kent een wisselende incidentie van complicaties (Delhaas, 2008; Draulans, 2013; Borrini, 2014; Natale, 2016). Desondanks wordt een hoge patiënttevredenheid aangegeven. Een hoog percentage patiënten raadt de behandeling aan, ondanks mogelijke complicaties, aan lotgenoten (Plassat, 2004; Zahavi, 2004; Mathur 2014). Deze complicaties en ook mogelijke zwaarwegende risico’s moeten worden meegenomen bij de indicatiestelling en afgewogen tegen (voortzetting van) orale spasmolytica of toepassing van andere invasieve behandelmethoden (Motta, 2007; Stetakarova, 2010).
Van de complicaties lijken infecties, vanwege de slechte toestand van in verpleeghuis verblijvende patiënten en de aanwezigheid van voedingssondes, urinekatheters en stoma’s, vaak voor te komen. Verder zijn complicaties gerelateerd aan het toedieningssysteem zelf, aan de omgang ermee en/of aan de operatie. De daarbij optredende over- en onderdosering kan ernstig zijn en bij een onttrekking zelfs levensbedreigend. In een gering percentage zijn er pomp gerelateerde problemen (onvoldoende afgifte of geen afgifte door rotorproblematiek of plotselinge uitval van de batterij). In het verleden was de problematiek vooral katheter gerelateerd (obstructie, knikken, breuk, defecte pompconnector, disconnectie van beide katheterdelen en dislocatie) (Stetakarova, 2010; Draulans 2013). Door de aanpassing van de chirurgische techniek (Follett, 2003) en de verbeterde kathetermaterialen is empirisch gebleken dat de incidentie is gedaald. De werkgroep is van mening dat ervaring een belangrijke factor is in het reduceren van het aantal en de ernst van de complicaties, reden waarom gepleit wordt voor concentratie van zorg in een beperkt aantal expertisecentra.
Tolerantie treedt op bij chronische infusie ITB. Dit is zowel dierexperimenteel als klinisch gebleken. Dierexperimenteel is bij continue infusie reeds na twee tot drie weken tolerantie aangetoond (Wang, 2002), maar dit bleek niet het geval bij een bolusinjectie (Hefferan, 2006). Klinische ervaring laat zien dat bij de chronische ITB-behandeling in de eerste 12 maanden een geleidelijke ophoging van de dosering, mogelijk verklaard door het optreden van partiële tolerantie, noodzakelijk is om het effect te behouden. Een opvallende bevinding is dat bij niet-MS patiënten na 12 maanden een stabilisatie optreedt (Penn, 1987; Loubser, 1991; Akman, 1993; Nielsen, 2002). Dit in tegenstelling tot MS waarbij geleidelijke aanpassing van de dosering noodzakelijk bleek (Nielsen, 2002). Mogelijk heeft dit te maken met de progressie van de MS. In een pilotstudie bij baclofen tolerante patiënten kon met een lagere dosering worden volstaan indien 6x/dag een bolus werd gegeven in plaats van continue infusie, mogelijk veroorzaakt door een betere distributie (Heetla, 2010). Uitdrukkelijk moet worden vermeld dat, voordat het bestaan van tolerantie wordt vastgesteld, analyse van het toedieningssysteem en de patiënt dient plaats te vinden.
Ook bij post-CVA patiënten wordt de ITB-behandeling in toenemende mate toegepast. In een consensus wordt aanbevolen om ITB-behandeling binnen drie tot zes maanden, zodra er sprake is van bemoeilijkte progressie bij de revalidatie, toe te passen (Francisco, 2006).
Bij patiënten met multiple sclerose wordt het fenomeen van relatief late toepassing van ITB toegeschreven aan de relatief grote aandacht voor ziekte modificerende therapieën (Erwin, 2011). Dit blijkt ook uit registraties van de North American Research Committee on MS (NARCOMS) bij meer dan 21.000 registraties (Rizzo, 2004). Opvallende bevinding was dat 2/3 van de patiënten op de hoogte was van ITB-behandeling, maar minder dan een ¼ hierover door de arts werden geïnformeerd. Het fenomeen van late toepassing heeft ook te maken met het feit dat ITB nog steeds wordt gezien als een “last resort” therapie als uitputtende (niet-medicamenteuze behandelingen geen of onvoldoende resultaat opleveren, ondanks dat klinische ervaring laat zien dat ernstige vormen van spasticiteit niet of nauwelijks reageren op gangbare behandelingen.
In de literatuur is er geen eenduidigheid omtrent de relatie spasticiteit en contractuurvorming en of derhalve vroegtijdige optimale spasticiteitsbehandeling het ontstaan van contractuurvorming kan verminderen (Ada, 2006; Moriyama, 2007; Hägglund, 2011; Malhotra, 2011; Kwah, 2012). Los van een mogelijke reductie van contractuurvorming is in een recent dierexperimenteel onderzoek bij traumatisch hersenletsel gevonden dat ITB-behandeling in het initiële stadium het ontstaan van spasticiteit kan remmen (Bose, 2013).
Er is discussie over de optimale intrathecale kathetertippositie. Bij uitsluitend spasticiteit van de onderste extremiteiten is er weinig verschil van mening over de laag thoracale kathetertippositie. Dit ligt anders wanneer zowel onderste als bovenste extremiteiten zijn betrokken bij de spasticiteit. In aanmerking genomen dat bij dierexperimenteel onderzoek de hoogste concentraties worden gevonden rondom de tip van de katheter (Bernards, 2006) zou bij een gewenste invloed op de onderste extremiteiten de tip laag thoracaal moeten zijn gelegen en bij gewenste behandeling van de bovenste extremiteiten hoog thoracaal/cervicaal. Van oudsher is echter een rostrale verspreiding van de liquor, met een lumbo-cervicale gradiënt van 4:1, aangetoond (Kroin, 1992), zodat ook de hoger gelegen receptoren weliswaar met een lagere concentratie, kunnen worden bereikt. Wegens ontbreken van overtuigend klinisch onderzoek zijn er verschillende klinische benaderingen. Voorstander van een cervicale tippositie (Albright, 2006) is van mening dat een beter resultaat wordt bereikt bij een tetraparese, maar in andere publicaties wordt geen verschil in klinisch effect gevonden (McCall, 2006; Sivakumar, 2010). Bij tegenstanders heerst de opvatting dat bij een dergelijke hoge tippositie er geen of nauwelijks effect op de onderste extremiteiten is en een verhoogd risico zou bestaan op intoxicatie. In een drietal publicaties van een onderzoeksgroep (Meythaler, 1997; Grabb, 1999; Burns, 2001) is gezocht naar een middenweg door de tip op Th6 te plaatsen, maar hun resultaten zijn niet door anderen bevestigd. In Nederland wordt meestal de laag thoracale tippositie toegepast; in ieder geval bij een diplegie, maar ook bij een tetraplegie. Hierbij wordt uitgegaan dat ook klinisch effect op de bovenste extremiteiten op basis van de rostrale verspreiding in liquor kan worden verkregen. Gebaseerd op het feit dat de hoogste concentraties rondom de intrathecale kathetertip bij dierexperimenteel onderzoek (Bernards, 2006), is zelfs het inbrengen van een tweetal katheters, laag thoracaal en cervicaal gesuggereerd (Heetla, 2014), maar klinisch onderzoek hiernaar ontbreekt. Een andere benadering, op basis van dierexperimenteel onderzoek (Bernards, 2006), om een beter resultaat op de bovenste extremiteiten te verkrijgen zijn bolustoedieningen in plaats van continue infusie, maar er is onvoldoende bewijs of dit een beter resultaat oplevert. Ook is gezocht naar een grotere verspreiding, met daaraan gerelateerd een beter effect door een grotere infusiesnelheid met een groter volume, maar dit kon niet worden aangetoond (Van der Plas, 2011).
Onderbouwing
Achtergrond
Gamma-aminoboterzuur (GABA) is de belangrijkste inhiberende neurotransmitter in het centrale zenuwstelsel. De chemische structuur van het geneesmiddel baclofen is hieraan verwant en gebleken een sterke en selectieve GABAB-receptor agonist te zijn (Bowery, 2000; Bowery, 2002). De toediening leidt tot een stimulatie van de receptor, wat leidt tot een presynaptische suppressie van hyperreflexie en wordt daarom gebruikt bij de behandeling van spasticiteit. Vanwege de bloed-hersenbarrière worden na orale toediening in het ruggenmerg relatief lage liquorconcentraties bereikt, waardoor de behandeling bij matige tot ernstige spasticiteit veelal onvoldoende is (Erwin, 2011). In tegenstelling tot de orale toediening (12-96 μg/ml) worden bij de intrathecale applicatie hoge liquorspiegels (400 μg/ml) bereikt (Penn, 1989; Sallerin-Caute, 1991), resulterend in een hoge concentratie in het ruggenmerg (Natale, 2016). Hierdoor kan in vergelijking met de orale toediening, met een veel lagere dosering een betere reductie van de spasticiteit met minder bijwerkingen worden verkregen. Daarnaast is bij continue infusie met een geïmplanteerd pompsysteem aangetoond dat niet alleen de liquorconcentratie een rol speelt, maar ook significante veranderingen in de serotonerge en deopaminerge activiteit ontstaan (Albright, 2006; Margetis, 2014), die niet worden gevonden bij de orale toediening (Walinder, 1977). ITB geeft weliswaar vergelijkbare bijwerkingen, maar deze komen (samenhangend met de aanzienlijk lagere dosering (100 maal of meer), het voornamelijk spinale effect en de minimale systemische absorptie in de liquorruimte (Loubser, 1991) veel minder frequent voor. Intrathecale toediening van baclofen (ITB) bij patiënten met spasticiteit is in 1984 voor het eerst beschreven (Penn, 1984) en is sindsdien een belangrijke behandeloptie geworden bij therapieresistente spasticiteit.
Conclusies / Summary of Findings
|
Hoog GRADE |
Intrathecale baclofen (proef)behandeling is effectief in het verminderen van spasticiteit ten opzichte van placebo bij patiënten met cerebrale en/of spinale spasticiteit. Hierbij worden effecten zowel op de onderste als op de bovenste extremiteit gezien.
Bronnen (Penn, 1989; Loubser, 1991; Herman, 1992; Meythaler, 1996; Middel, 1997; Meythaler, 2001) |
Samenvatting literatuur
Beschrijving studies
De RCT’s hadden patiënten geïncludeerd met chronische invaliderende spasticiteit die onvoldoende reageerden op maximale doseringen orale spasmolytica, wat resulteerde in een bemoeilijkte persoonlijke verzorging, problematische transfers en zit- en lighoudingen, met daarbij gepaard gaande pijn en slaapstoornissen. De spasticiteit was veroorzaakt door cerebrovasculair accident (Meythaler, 2001), niet-aangeboren hersenletsel (Meythaler, 1996), dwarslaesie of multipele sclerose (Penn, 1989; Herman, 1992; Middel, 1997), of dwarslaesie (Loubser, 1991). Vier RCT’s (Loubser, 1991; Herman, 1992; Meythaler, 1996; Meythaler, 2001) hadden tijdens de proefbehandeling een cross-over design. Eén RCT (Penn, 1989) had, na een voorafgaande ongecontroleerde bolusinjectie intrathecaal baclofen voor de patiënten selectie, een cross-over design na implantatie van de pomp met een follow-up van drie dagen, terwijl één RCT (Middel, 1997) na een initiële, placebogecontroleerde, positieve reactie op een bolusinjectie baclofen een parallel design had waarbij in beide na de studieperiode de placebogroep alsnog met continue infusie van ITB werd behandeld. In alle RCT’s werd voor de placebo fysiologisch zout als controle interventie toegepast. In één RCT (Middel, 1997) werd de orale baclofenmedicatie in de placebogroep gehandhaafd. Twee RCT’s (Meythaler, 1996; Meythaler, 2001) hadden metingen tot zes uur na eenmalige intrathecale toediening van baclofen; twee RCT’s (Penn 1989; Middel, 1997) had metingen gedurende respectievelijk drie en dertien weken bij patiënten met een programmeerbare geïmplanteerde pomp. In drie RCT’s zijn tijdstippen van de metingen na eenmalige toediening van ITB niet gedefinieerd.
De ITB werd toegediend in doses van 50 µg ineens (Herman, 1992; Meythaler, 1996; Meythaler, 2001). In de overige drie RCT’s werd de dosering getitreerd, waarbij geen dose-response curve werd vermeld. In één RCT (Middel, 1997) werd tijdens de proefbehandelingsfase 50 tot 150 µg gegeven. Vervolgens werd voor de vervolgstudie met continue infusie na implantatie van de pomp voor de 24-uurs dosering een verdubbeling van de voorafgaande positieve testdosis genomen (Middel, 1997). Penn (1989) hanteerde anderhalf tot twee keer de proefbehandelingsdosering van 25 tot 75µg. Als uitkomstmaat werden de Ashworth score (Ashworth, 1964), spasm frequency score (Penn, 1992), reflexscore en enkele aanvullende maten gebruikt (tabel 1).
Tabel 1 Uitkomstmaten gebruikt in de studies
|
RCT |
Ashworth score |
Reflex score |
Spasm frequency score |
Overige maten |
|
Meythaler, 2001 |
1-5 (no increase in tone to rigid)* |
0-5 (absent to clonus)* |
0-4 (none to >10/h)* |
|
|
Middel, 1997 |
0-4 (no increase in tone to rigid)** |
|
0-4 (none to >10/h) |
Pain, sickness impact, Hopkins symptom check list |
|
Meythaler, 1996 |
1-5 (no increase in tone to rigid)* |
0-5 (absent to clonus)* |
0-4 (none to >10/h)* |
|
|
Herman, 1992 |
1-5 (no increase in tone to rigid) |
0-5 (absent to clonus) |
|
|
|
Loubser, 1991 |
1-5 (no increase in tone to rigid) |
0-6 (absent to sustained clonus) |
|
Evaluation of functional abilities; personal independence; global assessment scale |
|
Penn, 1989 |
1-5 (no increase in tone to rigid) |
|
0-4 (none to >10/h) |
|
|
* de scores zijn alleen in een figuur gerapporteerd, niet numeriek. Daardoor was het niet mogelijk om deze resultaten mee te nemen in de meta-analyses. ** omdat de scoremethodiek gelijk is aan de methodiek in de andere studies, alleen de schaal loopt van 0-4 in plaats van 1-5, is de score in de meta-analyse aangepast door één punt op te tellen bij de in het artikel vermelde scores. |
||||
Resultaten
In alle zes RCT’s werden significante verbeteringen gevonden voor de Ashworth score. Alle lumbaal puncties werden uitgevoerd op niveau L2 tot 3 of L3 tot 4 (Meythaler, 1996; Meythaler, 2001). Als een percutane intrathecale katheter werd gebruikt, was de kathetertip niet gespecificeerd (Herman, 1992; Middel, 1997) of 3 tot 5 cm boven insertie op niveau L3 tot 4 of L4 tot 5 geplaatst (Loubser, 1991). Hieruit kan worden geconcludeerd dat in alle studies baclofen lumbaal was toegediend. Alleen Meythaler (1996 en 2001) beschreef het effect op de bovenste en onderste extremiteiten, waarbij overigens een gelijk resultaat werd vastgesteld met dien verstande dat het effect van een lagere uitgangsscore in de bovenste extremiteiten ook resulteerde in minder reductie van de Ashworth score. Geen van RCT’s vermeldde effect op de rompmusculatuur. Een meta-analyse van vier RCT’s (“random effects model”) liet zien dat de gemiddelde Ashworth score bij ITB 2,00 punten lager was dan bij placebo (95%BI -2,82 tot -1,18) (figuur 1). Ook voor de reflexscore werd in de vier RCT’s een significante afname gevonden. Een meta-analyse was niet mogelijk vanwege het feit dat resultaten alleen in een figuur werden gerapporteerd (Meythaler, 1996; Meythaler, 2001) of vanwege een afwijkende scoremethodiek (Loubser, 1991). De resultaten op de spasmefrequentie score lieten in drie van de vier RCT’s een lagere frequentie van spasmen zien na toediening van ITB. In één RCT was het verschil tussen ITB en placebo niet significant. Wanneer echter werd gecorrigeerd voor baselineverschillen tussen de interventie- en controlegroep was dit wel het geval (Middel, 1997). Een meta-analyse van twee RCT’s (“random effects model”) liet zien dat de gemiddelde spasmefrequentie score niet significant lager was dan bij placebo (-1,54; 95%BI -4,00 tot 1,14). Echter, dit resultaat werd vertekend door de eerdergenoemde baselineverschillen tussen de interventie- en controlegroep in één studie. In de twee RCT’s met een follow-up van zes uur werden de grootste effecten gevonden vier of zes uur na toediening.
Bijwerkingen of ongunstige effecten werden niet gevonden (Meythaler, 1996), niet gerapporteerd (Penn, 1989; Herman, 1992; Middel, 1997) of waren mild (Penn, 1989; Meythaler, 2001) beide bij twee patiënten met hoofdpijn gedurende 24 tot 48 uur, één patiënt met spierzwakte; één patiënt met milde hypertensie; één patiënt met premature ventriculaire contracties (Loubser, 1991).
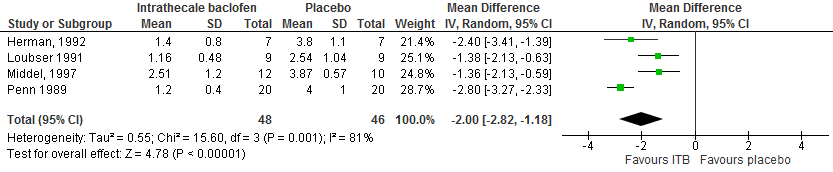
Figuur 1. De gecombineerde resultaten van vier RCT’s voor het effect van ITB op de Ashworth score. Bij deze analyse is niet gecorrigeerd voor gepaarde metingen in de studies met een cross-over design.
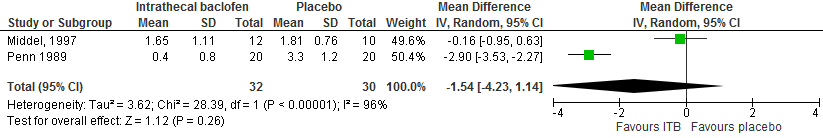
Figuur 2. De gecombineerde resultaten van twee RCT’s voor het effect van ITB op de spasme frequentie score. Bij deze analyse is niet gecorrigeerd voor gepaarde metingen in de studies met een cross-over design.
Bewijskracht van de literatuur
De bewijskracht voor intrathecale baclofen proefbehandeling op spasticiteit is vastgesteld op hoog. Er werd een klinisch relevant significant effect gevonden.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden werd er een systematische literatuuranalyse van RCT’s verricht naar de volgende wetenschappelijke vraagstelling:
Wat zijn de (on)gunstige effecten van intrathecale baclofentoediening ten opzichte van geen behandeling of orale spasmolytica bij patiënten met cerebrale en/of spinale spasticiteit?
P: Patiënten met cerebrale en/of spinale spasticiteit met onvoldoende respons op niet-medicamenteuze en orale spasmolytica en/of lokale therapie
I: Intrathecaal spasmolyticum (baclofen)
C: Geen spasmolytica of andere interventie (bijvoorbeeld orale spasmolytica of focale blokkade)
O: Spiertonus, spierkracht, actief en passief bewegingsbereik, pijn; functionele metingen van balans, lopen, arm- en handvaardigheid, activiteiten van het dagelijks leven (ADL); sociale participatie en complicaties
Relevante uitkomstmaten
De werkgroep heeft niet a priori de genoemde uitkomstmaten gedefinieerd, maar de in de studies gebruikte definities gehanteerd.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) werd met relevante zoektermen gezocht naar wetenschappelijke artikelen in de periode 1995 tot juni 2015 over spasticiteit en intrathecale baclofentoediening. De zoekverantwoording is weergegeven onder het tabblad “Verantwoording”. De literatuurzoekactie leverde 375 unieke treffers op. Studies werden geselecteerd op grond van de volgende criteria: 1) inclusie van patiënten met cerebrale en/of spinale spasticiteit; 2) vergelijkend gecontroleerd onderzoek tussen intrathecale baclofen en een andere interventie of placebo; en 3) tenminste één onder “Zoeken en Selecteren” gedefinieerde uitkomstmaten. Op basis van titel en abstract werden in eerste instantie 75 studies geselecteerd. Na raadpleging van de volledige tekst voldeden er nog 70 niet aan de inclusiecriteria (zie “Exclusietabel”). Aanvankelijk leken twee systematische reviews en drie RCT’s bruikbaar voor inclusie. Echter, één review had geen vergelijkende studies geïncludeerd (McIntyre, 2014). Deze werd alsnog geëxcludeerd. Van de resterende systematische review zijn de primaire studies getoetst op bovenstaande selectiecriteria, waarbij drie studies aan alle criteria voldeden. Uiteindelijk werden zes RCT’s definitief geselecteerd voor de vaststelling van de wetenschappelijke conclusies. De benodigde vergelijkingen zijn als volgt te verdelen:
1. vergelijking orale versus intrathecale baclofen toediening
2. vergelijking intrathecale baclofentoediening versus placebo (kortdurend)
3. vergelijking continue intrathecale baclofentoediening versus placebo (langer durend)
Ad.1 Vergelijkend onderzoek van orale en intrathecale baclofentoediening werd niet gevonden.
Ad.2. Vijf RCT’s, die de intrathecale toediening bacofen en placebo met elkaar hebben vergeleken hadden betrekking op de proefbehandeling met een follow-up variërende van één tot 12 uur. In één RCT werd, na een positieve ongecontroleerde proefbehandeling, een pomp geïmplanteerd en werden de patiënten daarna kortdurend in een gecontroleerde opzet (drie dagen) gevolgd waarna alle patiënten, ook de placebogroep, definitief met intrathecaal baclofen werden behandeld.
Ad.3. In één RCT werd, na een positieve placebogecontroleerde proefbehandeling, een pomp geïmplanteerd en werden de patiënten daarna in een gecontroleerde opzet voor een langere periode (13 weken) gevolgd. Ook bij deze studie werden alle patiënten daarna definitief behandeld.
De belangrijkste studiekarakteristieken en resultaten werden opgenomen in de evidence-tabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit werden opgenomen onder het tabblad “Onderbouwing”.
Resultaten
Er werden zes RCT’s opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten werden opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit werden opgenomen onder het tabblad “Onderbouwing”.
Referenties
- Ada L, O'Dwyer N, O'Neill E. Relation between spasticity, weakness and contracture of the elbow flexors and upper limb activity after stroke: an observational study. Disabil Rehabil. 2006;28(13-14):891-7.
- Akman MN, Loubser PG, Donovan WH, et al. Intrathecal baclofen: does tolerance occur? Paraplegia. 1993;31(8):516-20.
- Albright AL, Turner M, Pattisapu JV. Best-practice surgical techniques for intrathecal baclofen therapy. Journal of neurosurgery. 2006;104(4 Suppl):233-9.
- Ansari NN, Naghdi S, Moammeri H, et al. Ashworth Scales are unreliable for the assessment of muscle spasticity. Physiotherapy theory and practice. 2006;22(3):119-25.
- Ashworth B. PRELIMINARY TRIAL OF CARISOPRODOL IN MULTIPLE SCLEROSIS. The Practitioner. 1964;192:540-2.
- Azouvi P, Mane M, Thiebaut JB, et al. Intrathecal baclofen administration for control of severe spinal spasticity: functional improvement and long-term follow-up. Archives of physical medicine and rehabilitation. 1996;77(1):35-9.
- Beard S, Hunn A, Wight J. Treatments for spasticity and pain in multiple sclerosis: a systematic review. Health technology assessment (Winchester, England). 2003;7(40):iii, ix-x, 1-111.
- Bernards CM. Cerebrospinal fluid and spinal cord distribution of baclofen and bupivacaine during slow intrathecal infusion in pigs. Anesthesiology. 2006;105(1):169-78.
- Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Physical therapy. 1987;67(2):206-7.
- Borrini L, Bensmail D, Thiebaut JB, Hugeron C, Rech C, Jourdan C. Occurrence of adverse events in long-term intrathecal baclofen infusion: a 1-year follow-up study of 158 adults. Arch Phys Med Rehabil. 2014;95(6):1032-8.
- Bose P, Hou J, Nelson R, et al. Effects of acute intrathecal baclofen in an animal model of TBI-induced spasticity, cognitive, and balance disabilities. Journal of neurotrauma. 2013;30(13):1177-91.
- Bowery NG, Bettler B, Froestl W, et al. International Union of Pharmacology. XXXIII. Mammalian gamma-aminobutyric acid(B) receptors: structure and function. Pharmacological reviews. 2002;54(2):247-64.
- Bowery NG, Enna SJ. gamma-aminobutyric acid(B) receptors: first of the functional metabotropic heterodimers. The Journal of pharmacology and experimental therapeutics. 2000;292(1):2-7.
- Burns AS, Meythaler JM. Intrathecal baclofen in tetraplegia of spinal origin: efficacy for upper extremity hypertonia. Spinal cord. 2001;39(8):413-9.
- Delhaas EM, Beersen N, Redekop WK, et al. Long-term outcomes of continuous intrathecal baclofen infusion for treatment of spasticity: a prospective multicenter follow-up study. Neuromodulation : journal of the International Neuromodulation Society. 2008;11(3):227-36.
- Erwin A, Gudesblatt M, Bethoux F, et al. Intrathecal baclofen in multiple sclerosis: too little, too late? Multiple sclerosis (Houndmills, Basingstoke, England). 2011;17(5):623-9.
- Draulans N, Vermeersch K, Degraeuwe B, Meurrens T, Peers K, Nuttin B, et al. Intrathecal baclofen in multiple sclerosis and spinal cord injury: complications and long-term dosage evolution. Clin Rehabil. 2013;27(12):1137-43.
- Farmer SE, James M. Contractures in orthopaedic and neurological conditions: a review of causes and treatment. Disability and rehabilitation. 2001;23(13):549-58.
- Fleuren JF, Voerman GE, Erren-Wolters CV, et al. Stop using the Ashworth Scale for the assessment of spasticity. Journal of neurology, neurosurgery, and psychiatry. 2010;81(1):46-52.
- Follett KA, Burchiel K, Deer T, et al. Prevention of intrathecal drug delivery catheter-related complications. Neuromodulation : journal of the International Neuromodulation Society. 2003;6(1):32-41.
- Francisco GE, Boake C. Improvement in walking speed in poststroke spastic hemiplegia after intrathecal baclofen therapy: a preliminary study. Archives of physical medicine and rehabilitation. 2003;84(8):1194-9.
- Francisco GE, Yablon SA, Schiess MC, et al. Consensus panel guidelines for the use of intrathecal baclofen therapy in poststroke spastic hypertonia. Topics in stroke rehabilitation. 2006;13(4):74-85.
- Grabb PA, Guin-Renfroe S, Meythaler JM. Midthoracic catheter tip placement for intrathecal baclofen administration in children with quadriparetic spasticity. Neurosurgery. 1999;45(4):833-6; discussion 6-7.
- Guillaume D, Van Havenbergh A, Vloeberghs M, Vidal J, Roeste G. A clinical study of intrathecal baclofen using a programmable pump for intractable spasticity. Arch Phys Med Rehabil. 2005;86(11):2165-71.
- Haas BM, Bergstrom E, Jamous A, et al. The inter rater reliability of the original and of the modified Ashworth scale for the assessment of spasticity in patients with spinal cord injury. Spinal cord. 1996;34(9):560-4.
- Hagglund G, Wagner P. Spasticity of the gastrosoleus muscle is related to the development of reduced passive dorsiflexion of the ankle in children with cerebral palsy: a registry analysis of 2,796 examinations in 355 children. Acta orthopaedica. 2011;82(6):744-8.
- Heetla HW, Staal MJ, Proost JH, et al. Clinical relevance of pharmacological and physiological data in intrathecal baclofen therapy. Archives of physical medicine and rehabilitation. 2014;95(11):2199-206.
- Heetla HW, Staal MJ, van Laar T. Tolerance to continuous intrathecal baclofen infusion can be reversed by pulsatile bolus infusion. Spinal cord. 2010;48(6):483-6.
- Hefferan MP, Fuchigami T, Marsala M. Development of baclofen tolerance in a rat model of chronic spasticity and rigidity. Neuroscience letters. 2006;403(1-2):195-200.
- Herman RM, D'Luzansky SC, Ippolito R. Intrathecal baclofen suppresses central pain in patients with spinal lesions. A pilot study. The Clinical journal of pain. 1992;8(4):338-45.
- Hoving MA, Evers SM, Ament AJ, van Raak EP, Vles JS. Intrathecal baclofen therapy in children with intractable spastic cerebral palsy: a cost-effectiveness analysis. Dev Med Child Neurol. 2008;50(6):450-5.
- Ivanhoe CB, Francisco GE, McGuire JR, et al. Intrathecal baclofen management of poststroke spastic hypertonia: implications for function and quality of life. Archives of physical medicine and rehabilitation. 2006;87(11):1509-15.
- Kakinohana O, Hefferan MP, Nakamura S, et al. Development of GABA-sensitive spasticity and rigidity in rats after transient spinal cord ischemia: a qualitative and quantitative electrophysiological and histopathological study. Neuroscience. 2006;141(3):1569-83.
- Krach LE, Nettleton A, Klempka B. Satisfaction of individuals treated long-term with continuous infusion of intrathecal baclofen by implanted programmable pump. Pediatric rehabilitation. 2006;9(3):210-8.
- Kroin JS. Intrathecal drug administration. Present use and future trends. Clinical pharmacokinetics. 1992;22(5):319-26.
- Kuroiwa M, Kitano Y, Takasuna K, et al. Muscle relaxant and neurotoxic activities of intrathecal baclofen in rats. Pharmacological research. 2009;60(5):392-6.
- Kwah LK, Harvey LA, Diong JH, et al. Half of the adults who present to hospital with stroke develop at least one contracture within six months: an observational study. Journal of physiotherapy. 2012;58(1):41-7.
- Loubser PG, Narayan RK, Sandin KJ, et al. Continuous infusion of intrathecal baclofen: long-term effects on spasticity in spinal cord injury. Paraplegia. 1991;29(1):48-64.
- Malhotra S, Pandyan AD, Rosewilliam S, et al. Spasticity and contractures at the wrist after stroke: time course of development and their association with functional recovery of the upper limb. Clinical rehabilitation. 2011;25(2):184-91.
- Mathur SN, Chu SK, McCormick Z, et al. Long-term intrathecal baclofen: outcomes after more than 10 years of treatment. PM & R : the journal of injury, function, and rehabilitation. 2014;6(6):506-13.e1.
- McCall TD, MacDonald JD. Cervical catheter tip placement for intrathecal baclofen administration. Neurosurgery. 2006;59(3):634-40; discussion -40.
- McIntyre A, Mays R, Mehta S, et al. Examining the effectiveness of intrathecal baclofen on spasticity in individuals with chronic spinal cord injury: a systematic review. The journal of spinal cord medicine. 2014;37(1):11-8.
- Meijer R, Wolswijk A, Eijsden HV. Prevalence, impact and treatment of spasticity in nursing home patients with central nervous system disorders: a cross-sectional study. Disabil Rehabil. 2016:1-9.
- Meythaler JM, DeVivo MJ, Hadley M. Prospective study on the use of bolus intrathecal baclofen for spastic hypertonia due to acquired brain injury. Archives of physical medicine and rehabilitation. 1996;77(5):461-6.
- Meythaler JM, Guin-Renfroe S, Brunner RC, et al. Intrathecal baclofen for spastic hypertonia from stroke. Stroke; a journal of cerebral circulation. 2001;32(9):2099-109.
- Meythaler JM, McCary A, Hadley MN. Prospective assessment of continuous intrathecal infusion of baclofen for spasticity caused by acquired brain injury: a preliminary report. Journal of neurosurgery. 1997;87(3):415-9.
- Middel B, Kuipers-Upmeijer H, Bouma J, et al. Effect of intrathecal baclofen delivered by an implanted programmable pump on health related quality of life in patients with severe spasticity. Journal of neurology, neurosurgery, and psychiatry. 1997;63(2):204-9.
- Moriyama H, Yoshimura O, Kawamata S, et al. Alteration of knee joint connective tissues during contracture formation in spastic rats after an experimentally induced spinal cord injury. Connective tissue research. 2007;48(4):180-7.
- Motta F, Buonaguro V, Stignani C. The use of intrathecal baclofen pump implants in children and adolescents: safety and complications in 200 consecutive cases. Journal of neurosurgery. 2007;107(1 Suppl):32-5.
- Narendran RC, Duarte RV, Valyi A, Eldabe S. The need for and provision of intrathecal baclofen therapy for the management of spasticity in England: an assessment of the Hospital Episode Statistics database. BMJ Open. 2015;5(6):e007517.
- Natale M, D'Oria S, Nero VV, Squillante E, Gentile M, Rotondo M. Long-term effects of intrathecal baclofen in multiple sclerosis. Clin Neurol Neurosurg. 2016;143:121-5.
- Nielsen JF, Hansen HJ, Sunde N, et al. Evidence of tolerance to baclofen in treatment of severe spasticity with intrathecal baclofen. Clinical neurology and neurosurgery. 2002;104(2):142-5.
- Ordia JI, Fischer E, Adamski E, Chagnon KG, Spatz EL. Continuous intrathecal baclofen infusion by a programmable pump in 131 consecutive patients with severe spasticity of spinal origin. Neuromodulation. 2002;5(1):16-24.
- Pandyan AD, Johnson GR, Price CI, et al. A review of the properties and limitations of the Ashworth and modified Ashworth Scales as measures of spasticity. Clinical rehabilitation. 1999;13(5):373-83.
- Parke B, Penn RD, Savoy SM, et al. Functional outcome after delivery of intrathecal baclofen. Archives of physical medicine and rehabilitation. 1989;70(1):30-2.
- Penn RD, Savoy SM, Corcos D, et al. Intrathecal baclofen for severe spinal spasticity. The New England journal of medicine. 1989;320(23):1517-21.
- Penn RD, Kroin JS. Long-term intrathecal baclofen infusion for treatment of spasticity. J Neurosurg. 1987;66(2):181-5.
- Penn RD, Kroin JS. Intrathecal baclofen alleviates spinal cord spasticity. Lancet. 1984;1(8385):1078.
- Plassat R, Perrouin Verbe B, Menei P, et al. Treatment of spasticity with intrathecal Baclofen administration: long-term follow-up, review of 40 patients. Spinal cord. 2004;42(12):686-93.
- Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Mult Scler. 2004;10(5):589-95.
- Sampson FC, Hayward A, Evans G, Morton R, Collett B. Functional benefits and cost/benefit analysis of continuous intrathecal baclofen infusion for the management of severe spasticity. J Neurosurg. 2002;96(6):1052-7.
- Saval A, Chiodo AE. Intrathecal baclofen for spasticity management: a comparative analysis of spasticity of spinal vs cortical origin. J Spinal Cord Med. 2010;33(1):16-21.
- Schiess MC, Oh IJ, Stimming EF, et al. Prospective 12-month study of intrathecal baclofen therapy for poststroke spastic upper and lower extremity motor control and functional improvement. Neuromodulation : journal of the International Neuromodulation Society. 2011;14(1):38-45; discussion
- Sivakumar G, Yap Y, Tsegaye M, et al. Intrathecal baclofen therapy for spasticity of cerebral origin--does the position of the intrathecal catheter matter? Child's nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2010;26(8):1097-102.
- Stetkarova I, Yablon SA, Kofler M, et al. Procedure- and device-related complications of intrathecal baclofen administration for management of adult muscle hypertonia: a review. Neurorehabilitation and neural repair. 2010;24(7):609-19.
- van der Plas AA, Marinus J, Eldabe S, et al. The lack of efficacy of different infusion rates of intrathecal baclofen in complex regional pain syndrome: a randomized, double-blind, crossover study. Pain medicine (Malden, Mass). 2011;12(3):459-65.
- Wang DC, Bose P, Parmer R, et al. Chronic intrathecal baclofen treatment and withdrawal: I. Changes in ankle torque and hind limb posture in normal rats. Journal of neurotrauma. 2002;19(7):875-86.
- Ward A, Hayden S, Dexter M, et al. Continuous intrathecal baclofen for children with spasticity and/or dystonia: Goal attainment and complications associated with treatment. Journal of paediatrics and child health. 2009;45(12):720-6.
- Wunderlich CA, Krach LE. Gram-negative meningitis and infections in individuals treated with intrathecal baclofen for spasticity: a retrospective study. Developmental medicine and child neurology. 2006;48(6):450-5.
- Zahavi A, Geertzen JH, Middel B, et al. Long term effect (more than five years) of intrathecal baclofen on impairment, disability, and quality of life in patients with severe spasticity of spinal origin. Journal of neurology, neurosurgery, and psychiatry. 2004;75(11):1553-7.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Meythaler, 2001 |
Type of study: Randomised, double-blind placebo-controlled crossover trial
Setting: Outpatient rehabilitation clinic setting, part of a single, tertiary-care university medical center Follow-up clinical visits in the same outpatient clinic for dose adjustments and pump refills
Country: US
Source of funding: Medtronic Inc. |
Inclusion criteria: 1) > 16 years 2) post-cerebrovascular accident 3) severe chronic spastic hypertonia lower extremities (≥ 6 months ) (Ashworth score ≥2); 4) failure maximum doses oral antispastic medications or unacceptable side effects. Exclusion criteria: Not reported. N total at baseline: 22 Important prognostic factors2: Age: 53 years (range: 16-86) No further baseline characteristics reported for all patients Due to the cross-over design, groups were comparable at baseline- |
Intrathecal bolus 50 µg baclofen
|
Intrathecal bolus 50 µg preservative-free normal saline
|
Duration follow-up: 1, 2, 4, and 6 hours after injection.
Loss-to-follow-up: 1 (4.5%) Reason: refusal second bolus after experience active drug first bolus
|
Ashworth score (lower extremities): Decrease from 3.3 (±1.2) before to 1.4 (±0.7) 6 hrs after treatment (p<0.0001 No significant trend over time (control group) Significant differences intervention and control group 4 hrs (p<0.0001) and 6 hrs (p<0.0001) Spasm score (lower extremities): Decrease from 1.2 (±1.2) before to 0.1 (±0.3) 6 hrs after treatment (p=0.02) No significant trend over time (control group) Significant differences intervention and control group 4 hrs (p=0.0077) and 6 hrs (p=0.0077) Reflex score (lower extremities): Decrease from 2.1 (±1.2) before to 0.1 (±0.5) 6 hrs after treatment (p<0.0001) No significant trend over time in the control group, Significant differences intervention and control group 4 hrs (p<0.0001) and 6 hrs (p<0.0001) Adverse effects: Headache (24-48 hrs): 2 (9.0%) |
Only results lower extremities (study focus)
Only reporting results crossover RCT No follow up results after 6 months (n=4) and 1 year (n=14) after programmable pump implantation
Mean differences not calculated since original not numerical values reported numerical, only a figure |
|
Middel, 1997 |
Type of study: Double-blind, randomised multicentre trial
Setting: Nine Dutch hospitals
Country: The Netherlands
Source of funding: Dutch Sick Fund Council |
Inclusion criteria: 1) ≥ 18 years 2) chronic disabling spasticity spinal origin inhibiting personal care, sitting, lying, and transfers, accompanied by pain and stiffness, or disturbed sleeping 2) insufficient response maximum oral baclofen, dantrolene and tizanidine 3) sufficient understanding consequences treatment Exclusion criteria: 1) pregnancy 2) supraspinal neurological symptoms 3) baclofen allergy. N total at baseline: I: 12 C: 10 Important prognostic factors2: Age: I: 45.8 , C: 46.3 years No measure for spread reported. Female:I: I: 7 (58.3%) C: 5 (50%) Male: I: 6 (50%) C: 6 (50%) SCI: I: 6 (50%) C: 3 (30%) MS: I: 6 (50%) C: 7 (70%)
Groups comparable at baseline for the reported characteristics and baseline measures.
|
Implantation programmable pump
Aftercare: 13 weeks intrathecal baclofen (150-180 µg)
Initial 24 hrs dose = 2x bolus test
If needed additional 10% increase dose |
Implantation programmable pump
Aftercare: 13 weeks intrathecal placebo in combination with oral medication.
After 13 weeks Intrathecal baclofen |
Duration follow-up: Baseline, 4 weeks, 13 weeks.
Loss-to-follow-up: 0 (0%) |
Modified Ashworth score Baseline, mean (SD): I: 2.51 (0.70) C: 3.07 (0.41) 3 months, mean (SD): I: 1.51 (1.20) C: 2.87 (0.57) Mean difference at 3 months: -1.36 (95% CI: -2.13, -0.59) p=0.0005 Spasm score: Baseline, mean (SD): I: 2.23 (0.54) C: 1.83 (0.66) 3 months, mean (SD): I: 1.65 (1.11) C: 1.81 (0.76) Mean difference at 3 months: -0.16 (95% CI: -0.95, 0.63)** p=0.69 Pain (10 point self-assessment scale): Baseline, mean (SD): I: 4.20 (2.98) C: 6.00 (3.07) 3 months, mean (SD): I: 2.75 (3.22) C: 5.94 (3.57) Mean difference at 3 months: -3.19 (95% CI: -6.06, -0.32) p=0.03 Modified sickness impact profile overall score: Baseline, mean (SD): I: 31.72 (9.8)C: 30.12 (10.64) 3 months, mean (SD): I: 27.79 (5.32)C: 28.98 (8.83) Mean difference at 3 months: -1.19 (95% CI: -7.44, 5.06) p=0.71v Hopkins symptom check list overall score: Baseline, mean (SD): I: 30.0 (12.54) C: 31.0 (21.62) 3 months, mean (SD): I: 20.67 (11.78)C: 28.22 (18.43) Mean difference at 3 months: -7.55 (95% CI: -20.78, 5.68) p=0.26 ** Significant effect if analysis is corrected for baseline difference between groups |
Only the results double-blind randomised controlled trial, thus leaving out results of longitudinal follow-up of one year without control group |
|
Meythaler, 1996 |
Type of study: Randomised double-blind, placebo-controlled crossover trial
Setting: University tertiary care outpatient rehabilitation clinic
Country: US
Source of funding: United States Department of Health and Human Services; Centers for Disease Control and Prevention; National Center for Injury Prevention and Control to the University of Alabama; Birmingham Injury Control Research Center |
Inclusion criteria: 1) age 18-65 years 2) Acquired brain injury 3) Severe chronic spastic hypertonia lower extremities (≥ 1 year) (average Ashworth score ≥3 or an average spasm score ≥2); 3) failure maximum doses oral antispastic medications or unacceptable side effects Exclusion criteria: 1) Pregnancy or insufficient birth control 2) Hypersensitivity baclofen 3) Severely impaired renal function, severe hepatic or gastrointestinal disease N total at baseline: 11 Important prognostic factors2: Age, range: 25 (20-37) years Female: 2 (18%) Brain injury cause: Motor vehicle crash: 9 (82%) Gunshot wound: 1 (9%) Anoxic: 1 (9%) Due to the cross-over design, groups were comparable at baseline |
50 µg intrathecal baclofen administration
|
Preservative-free normal saline |
Duration follow-up: 1, 2, 4 and 6 hours after injection
Loss-to-follow-up: 0 (0%) |
Ashworth score (lower extremities): Decrease from 4.2 (±0.8) before treatment to 2.2 (±0.6) 4 hours after treatment (p=0.0033) No significant trend over time in the control group, with significant differences between intervention and control at 4h (p=0.0084) and 6h (p=0.0163)
Spasm score (lower extremities): Decrease from 3.1 (±1.0) before treatment to 1.0 (±0.7) 4 hours after treatment (p=0.0032) No significant trend over time in the control group, with significant differences between intervention and control at 4h (p=0.0073) and 6h (p=0.0049) Reflex score (lower extremities): Decrease from 3.3 (±0.5) before treatment to 1.0 (±1.3) 4 hours after treatment (p=0.0033) No significant trend over time in the control group, with significant differences between intervention and control at 4h (p=0.0086) and 6h (p=0.0085) Adverse effects: None |
Only the results for lower extremities (focus study)
Mean differences not calculated since original not numerical values reported numerical, only a figure |
|
Herman, 1992 |
Type of study: Randomised double-blind, placebo-controlled crossover trial
Setting: Not reported
Country: Not reported
Source of funding: Not reported |
Inclusion criteria: Spinal cord lesions. No further inclusion criteria described. Exclusion criteria: No exclusion criteria described. N total at baseline: 7 Important prognostic factors2: Age, mean (SD): 48.4 (9.8) Female: 5 (71%) Duration, mean (SD) year: 8.7 (4.7) Cause: MS:4 (57.1%) Transverse Myelitis: 2 (28.6%) Spinal cord lesion (epidural abscess: 1(14.3%)) Due to the cross-over design, groups were comparable at baseline |
50 µg Intrathecal baclofen |
Placebo (vehicle) |
Duration follow-up: Not reported, only pre-post intervention measurements but no time point specified.
Loss-to-follow-up: Double-blind protocol was discontinued for 2/9 (22%) patients. Reasons: not reported |
Ashworth score, mean (SD): I: 1.4 (0.8) C: 3.8 (1.1) Mean difference: -2.40 (95% CI: -3.41, -1.39) p<0.05
Reflex score, mean, (SD): I: 0.3 (0.3) C: 3.1 (1.4) Mean difference: -2.80 (95% CI: -3.86, -1.74) p<0.05
Adverse effects: Not reported |
Only results patients with positive effect from double-blind controlled part study (7/9) |
|
Loubser, 1991 |
Type of study: Randomised double-blind, placebo-controlled crossover trial
Setting: Regional spinal cord injury center
Country: US
Source of funding: Department of Education; National Institute on Disability and Rehabilitation Research |
Inclusion criteria: Traumatic spinal cord injury Intractable spasticity not responding to other therapies Exclusion criteria: Obstruction spinal canal (myleography) No further criteria reported. N total at baseline: 9 Important prognostic factors2: Age, mean (SD): 45.6 (12.4) Female: 0 (0%) No further prognostic factors were reported Due to the cross-over design, groups were comparable at baseline |
Stage I: 5 days of 12 hrs continuous infusion intrathecal baclofen percutaneous catheter external pump (daily dose titration)
Stage II: Implantation programmable pump Intrathecal baclofen infusion |
Stage I: Randomised selected 1x placebo of 12 hrs continuous infusion (preservative-free normal saline).
No comparison |
Duration follow-up: Not reported, only pre-post intervention measurements but no time point specified.
Loss-to-follow-up: 0 (0%) |
Ashworth score, mean (SD): I: 1.16 (0.48) C: 2.54 (1.04) Mean difference: -1.38 (95% CI: -2.13, -0.63) p<0.05 Reflex score, mean, (SD): I: 0.64 (0.87) C: 2.56 (1.14) Mean difference: -1.92 (95% CI: -2.86, -0.98) p<0.05
Adverse effects: Muscle weakness (n=1) Mild hypertension (n=1) Unifocal premature ventricular contractions (n=1)
|
Only results double-blind controlled part study |
|
Penn, 1989 |
Type of study: Randomised double-blind, placebo-controlled crossover trial
Setting: Not reported
Country: Not reported
Source of funding: National Institutes of Health and the Food and Drug Administration (Orphan Drug Division) |
Inclusion criteria: Severe disabling spasms causes by multiple sclerosis or spinal cord injury; Not controlled by oral doses of antispastic medications Exclusion criteria: Not mentioned N total at baseline: 20 Important prognostic factors2: Age, mean (SD): 41.5 (10.3) Female: 9 (45%) Max oral Baclofen, mean (SD) µg/day: 96.8 (40.7) Diagnosis: Spinal cord injury: 10 (50%) Multiple sclerosis: 10 (50%) |
Stage I: (pat.selection) 3x bolus injection intrathecal baclofen (25,50,75 µg ) Stage II: Implantation programmable pump 3 days intrathecal infusion baclofen (1½-2x) effective testdose Stage III: Continuation open trial intrathecal baclofen |
Stage I: same
Stage II: Implantation programmable pump 3 days intrathecal infusion normal saline Stage III: Continuation open trial intrathecal baclofen |
Duration follow-up: Not reported, only pre-post intervention measurements but no time point specified.
Loss-to-follow-up: 0 (0%) |
Ashworth score, mean (SD): I: 1.2 (0.4) C: 4.0 (1.0) Mean difference: -2.80 (95% CI: -3.27, -2.33) p<0.05 Spasm score, mean (SD): I: 0.4 (0.8) C: 3.3 (1.2) Mean difference: -2.90 (95% CI: -3.53, -2.27) p<0.05 Adverse effects: Not reported
Due to the cross-over design, groups were comparable at baseline |
Only results double-blind controlled part study |
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Meythaler, 2001 |
Coin toss |
Unlikely |
Unlikely. Patients blinded for receiving baclofen or preservative-free normal saline. |
Unlikely. Although blinding care providers is not mentioned, unlikely effect on outcome. |
Unlikely. Raters blinded for allocation. |
Unlikely. Results reported all described measures in “Methods” |
Unlikely. One of 22 patients did not receive the second bolus (normal saline) after requesting unblinding. |
Unclear. Analysis data patient lost to follow-up not reported |
|
Middel, 1997 |
Not reported |
Unclear |
Unlikely. Patients blinded for receiving baclofen or placebo. |
Unlikely. Care providers blinded for allocation providing placebo or control. |
Unclear/unlikely. Physicians blinded, unclear they also performed tests |
Unlikely. Results reported all described measures in “Methods” |
Unlikely. No patients were lost to follow-up. |
Unlikely. No other treatment switch or lost to follow-up |
|
Meythaler, 1996 |
Not reported |
Unclear |
Unlikely. Patients blinded for receiving baclofen or preservative-free normal saline. |
Unlikely. Although blinding care providers is not mentioned, unlikely effect on outcome. |
Unlikely. Rater blinded for allocation. |
Unlikely. Results reported all described measures in “Methods” |
Unlikely. No patients were lost to follow-up. |
Unlikely. No other treatment switch or lost to follow-up |
|
Herman, 1992 |
Not reported |
Unclear |
Unlikely. Patients blinded for receiving baclofen or preservative-free normal saline. |
Unlikely. Care providers blinded for allocation providing placebo or control. |
Unlikely. Raters blinded for allocation. |
Unlikely. Results reported all described measures in “Methods” |
Unclear. Double-blind protocol discontinued for two patients for unknown reasons. |
Unclear. After discontinuation double blinded protocol in 2 patients exclusion analysis follow-up |
|
Loubser, 1991 |
Not reported |
Unclear |
Unlikely. Patients blinded for receiving baclofen or preservative-free normal saline. |
Unlikely. Care providers blinded for allocation providing placebo or control. |
Unlikely. Raters blinded for allocation. |
Unlikely. Results reported all described measures in “Methods” |
Unlikely. No patients were lost to follow-up. |
Unlikely. No other treatment switch or lost to follow-up |
|
Penn, 1989 |
Not reported |
Unclear |
Unlikely. Patients blinded for receiving baclofen or preservative-free normal saline. |
Unlikely. Care providers blinded for allocation providing placebo or control. |
Unlikely. Raters blinded for allocation. |
Unlikely. Results reported all described measures in “Methods” |
Unlikely. No patients were lost to follow-up. |
Unlikely. No other treatment switch or lost to follow-up |
1. Randomization: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
2. Allocation concealment: refers to the protection (blinding) of the randomization process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomization (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomization procedures or open allocation schedules.
3. Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
4. Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
5. If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear
6. Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur, jaartal |
Reden van exclusie |
|
McIntyre, 2014 |
Geen relevante (alleen observationele) studies geïncludeerd |
|
Chang, 2013 |
Dit blijkt een narratieve review te zijn. |
|
Belfrund, 2010 |
Narratieve review/beschrijving |
|
Fransisco, 2009 |
Narratieve overview (niet beschikbaar) |
|
Guillaume, 2005 |
Cohortstudie (n=129) zonder controle (FU 12 maanden) |
|
Zahavi, 2004 |
Cohortstudie (n=21) met 5 jaar follow-up, zonder controle |
|
Albright, 2003 |
Cohortstudie (n=68) met gem. 70 maanden follow-up; geen controlegroep |
|
Albright, 2003 |
Zelfde als hierboven |
|
Van Schaeybroeck, 2000 |
Onduidelijk studie design; cerebrale parese patiënten |
|
Meythaler, 1999 |
Cohortstudie van patiënten die goed reageerden op bolus en vervolgens een pomp kregen (n=17); geen controle |
|
Ordia, 1996 |
Onduidelijk design; wel gerandomiseerd en interventie/ controle, maar geen vergelijking in de resultaten. |
|
Bensmail, 2009 |
Kosten-effectiviteit beoordeeld, maar onduidelijk hoe effectiviteit is gemeten |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2017
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
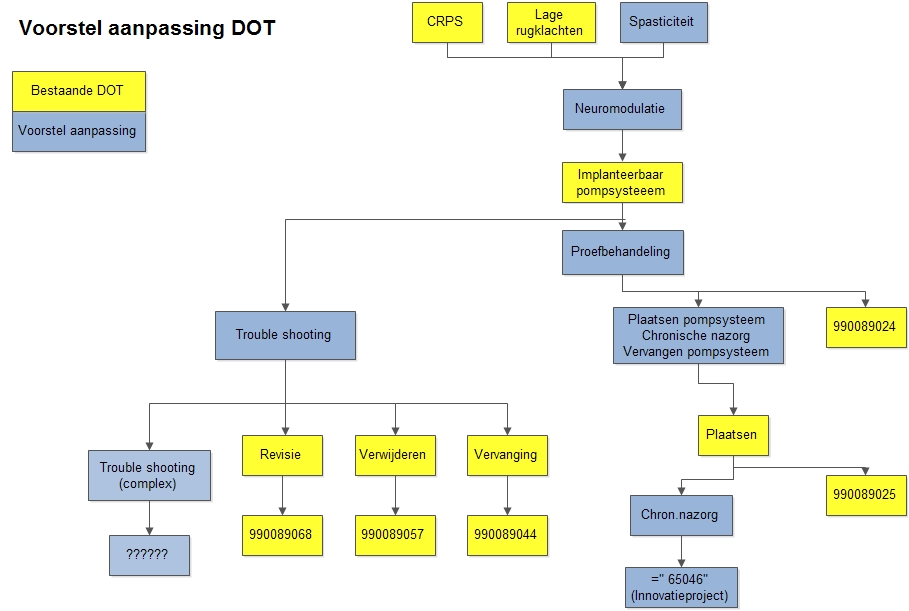
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
|
Database(s): Embase en Medline |
Datum: 17-06-2015 |
|
Periode: > 1995 |
Talen: Engels |
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1995 – juni 2015 |
1 exp Muscle Spasticity/ or spastic*.ab,ti. or exp Paraparesis, Spastic/ or exp Cerebral Palsy/ or cerebral palsy.ab,ti. or exp Muscle Hypertonia/ or hypertonia.ab,ti. or exp Dystonia/ or dystonia.ab,ti. (54450) 2 ((exp Baclofen/ or baclofen.ab,ti.) and intrathecal.ab,ti.) or itb.ab,ti. (1300) 3 1 and 2 (817) 4 limit 3 to (yr="1995 -Current" and english) (643) 5 (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (240352) 6 4 and 5 (31) 7 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) (1472155) 8 4 and 7 (112) 9 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective.tw. or prospective.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (2161794) 10 4 and 9 (191) 11 6 or 8 or 10 (265)
= 265 (260 uniek) |
375 |
|
Embase |
'spasticity'/exp OR 'spastic paresis'/exp OR spastic*:ab,ti OR 'cerebral palsy'/exp OR 'cerebral palsy':ab,ti OR hypertonia:ab,ti OR dystonia:ab,ti
AND ('baclofen'/exp OR baclofen:ab,ti AND intrathecal:ab,ti OR itb:ab,ti)
AND [english]/lim AND [1995-2015]/py
AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it OR ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp)) OR 'major clinical study'/exp)
= 238 ( 115 uniek) |
