Fenolisatie bij spasticiteit
Uitgangsvraag
Is er een plaats voor chemische neurolyse met fenol van de perifere zenuwen bij patiënten cerebrale en/of spinale spasticiteit?
Aanbeveling
Behandel patiënten met cerebrale en/of spinale spasticiteit op indicatie met chemische neurolyse met fenol:
- N. obturatorius: patiënten met spasticiteit van de onderste extremiteiten en hinderlijke schaarspasme vanuit de heup(en) ter voorkoming dat de maximaal toegestane dosering botulinetoxine wordt overschreden.
- N. tibialis: patiënten met functioneel hinderlijke clonus van de triceps surae. Cave neuropathische klachten, vooral bij herhaalde behandeling.
Overwegingen
Fenol is een goedkoop middel waarmee de gevolgen van spasticiteit kunnen worden verminderd. Het zenuwsignaal wordt door de toxische werking van de fenol op de zenuw onderbroken. Het effect is binnen 15 minuten te merken en kan tijdens de behandeling worden geëvalueerd. Hierdoor is het mogelijk om het effect af te wachten en te stoppen bij voldoende effect.
Veiligheid
Neuropathische klachten zijn bekende bijwerkingen van chemische neurolyse met fenol. Deze bijwerkingen kunnen invaliderend zijn en lang aanhouden. Klinische ervaring leert dat de kans op bijwerkingen toeneemt bij herhaalde behandeling. Er moet nogal eens, vanwege de ontstane neuropathische klachten, een medicamenteuze behandeling met gabapentine dan wel pregabaline worden gestart die op zichzelf weer bijwerkingen geeft, zoals hoofdpijn, slaperigheid en duizeligheid. Logischerwijs kan dit een vermindering geven van de kwaliteit van leven. Verder is fenol toxisch en kan het weefselnecrose veroorzaken. Bij welke concentratie en volume dit optreedt, is nooit onderzocht.
Aangezien de kans op neuropathische klachten samenhangt met de beïnvloeding van afferente zenuwvezels, verdient een zo selectief mogelijke blokkade, b.v. van de motorische takken naar de m. soleus en de m. tibialis posterior, de voorkeur. Waarschijnlijk is de kans op neuropathische klachten hierbij aanzienlijk kleiner.
Verder kan een proefblok (b.v. met bupivacaine 0,25%) nuttig zijn om zowel het effect van fenolisatie als de kans op bijwerkingen in te schatten.
De zenuwen waarbij volgens de literatuur gedacht kan worden aan chemische neurolyse zijn de n. suprascapularis, n. musculocutaneus, n. obturatorius en de n. tibialis.
|
Zenuw |
Innervatie |
Sensibel |
|
n. suprascapularis |
m. infraspinatus m. supraspinatus |
delen van het schouderkapsel |
|
n. musculocutaneus |
m. biceps brachii, m. coracobrachialis m. brachialis |
n. antebrachii lateralis welke de radiaire zijde van de onderarm innerveert |
|
n. obturatorius |
adductoren m. pectineus m. gracilis (gedeeltelijk) |
een in doorsnede 4cm groot gebied aan de mediale zijde van het bovenbeen |
|
n. tibialis |
m. gastrocnemeis m. soleus m. plantaris m. popliteus m. tibialis posterior teenflexoren |
Gebied rond de hiel en groot deel van de voetzool |
Vanwege de ligging van de n. musculocutaneus in de oksel in de buurt van een aantal vitale structuren is fenolisatie van deze zenuw uit oogpunt van veiligheid (relatief) gecontraïndiceerd.
De indicatie voor het prikken van de n. suprascapularis is zeer klein, de zenuw is echografisch slecht te onderscheiden en ligt pal naast de a. suprascapularis. Derhalve is ook een behandeling van de n. suprascapularis niet aan te bevelen.
De n. obturatorius innerveert sensibel slechts een klein gebied aan mediale zijde van het bovenbeen. Het kan derhalve worden overwogen om de n. obturatorius, vanwege hinderlijk schaarspasme, met fenol te behandelen. Soms is bij een botulinetoxine behandeling van de onderste extremiteiten de maximaal toegestane hoeveelheid te gering voor voldoende effect in de heup adductoren en kan chemische neurolyse van de n. obturatorius derhalve een goede aanvulling zijn. Houd wel rekening met het feit dat de adductoren een rol spelen bij de stabiliteit van de heupen tijdens het lopen en tevens kunnen worden gebruikt als adjuvante heupflexoren bij mensen met heupflexiezwakte. Overwogen kan worden om alleen de anterior tak te behandelen (m. adductor longus en brevis), zodat de m. adductor magnus ongemoeid wordt gelaten. Deze tak ligt meer ventraal en is makkelijk te onderscheiden van de andere takken. Patiënten met hinderlijk schaarspasme hebben over het algemeen een matige loopvaardigheid. De winst van ontspanning van de adductoren bij deze patiëntengroep, op het gebied van kwaliteit van leven, kan aanzienlijk zijn.
Manca (2010) en Kirazli (1998) zagen voordelen van fenol boven botulinetoxine voor het behandelen van enkelclonus, waarschijnlijk omdat fenol de snelheid van de reflexkring zowel afferent als efferent ondermijnt. Voordeel van fenol is dat tijdens de behandeling de dosering kan worden bepaald door op het moment dat de clonus verdwenen is te stoppen met fenol toediening. De bijwerking neuropathische klachten van de hiel/ voetzool komt frequent voor, vooral na herhaalde behandeling. Er kan dan ook geen goede onderbouwing worden gevonden voor neurolyse met fenol om een verlenging van de kuitmusculatuur te bewerkstelligen dan wel spasticiteitsvermindering voor andere doeleinden. Hiervoor wordt primair botulinetoxine geadviseerd.
Fenol wordt door apotheken in 5-6% geleverd. Er wordt aangeraden om niet meer dan 2 tot 2,5 ml per keer te geven, dit vanwege het gevaar op weefselnecrose dan wel neuropathische klachten. Een lagere concentratie, bijvoorbeeld 3%, kan ook werkzaam zijn. Hiervoor kan worden verdund met gedestilleerd water. Ook als fenol in een hogere concentratie dan 6% wordt aangeleverd, kan worden verdund met gedestilleerd water.
Tot slot lijkt de structuur van de perifere zenuwen bij herhaaldelijk gebruik te veranderen. Het is niet goed bekend wat herhaalde chemische neurolyse doet met de zenuwen. Derhalve zal bij langdurige indicatie voor een alternatief moeten worden gekozen, bijvoorbeeld een operatieve interventie.
Patiëntenperspectief
De verbetering van functioneren op basis van spiertonusvermindering lijkt langer aan te houden bij behandeling met fenol dan bij botulinetoxine injecties. Echter, de behandeling met fenol op zich kost meer tijd dan een behandeling met botulinetoxine en kan meer belastend zijn voor de patiënt. Daarnaast zijn potentiële bijwerkingen vooral bij de behandeling van de n. tibialis ernstig en relatief frequent, vooral na herhaalde behandeling. Dit vraagt om een goede voorlichting van de patiënt. Zeker bij patiënten die niet handelingsbekwaam zijn is voorzichtigheid geboden.
Behandelkosten
Chemische neurolyse met fenol is een goedkoop alternatief vergeleken met andere behandelingen van spasticiteit.
Professioneel perspectief
Vanwege de mogelijke bijwerkingen vraagt de chemische neurolyse met fenol veel uitleg over de werking en mogelijke bijwerkingen. Het gebruik van foldermateriaal wordt dan ook geadviseerd.
Daarnaast moet een eventuele behandeling gebeuren door ervaren professionals. Verder moet er een mogelijkheid bestaan om te kiezen voor een alternatieve behandeling met bijvoorbeeld botulinetoxine dan wel andere medicamenteuze behandeling in het instituut waar de behandeling wordt voorgesteld. Tot slot moet de behandelaar ervaring hebben met het gebruik van de medicatie die mogelijke bijwerkingen kan bestrijden.
Onderbouwing
Achtergrond
Chemische neurolyse middels fenol is één van de mogelijke behandelingen voor spasticiteit. Hoewel het een gangbare behandeling is, wordt het niet door alle behandelaren gebruikt vanwege de mogelijke bijwerkingen en de ernst van de bijwerkingen. Soms is het ook vanwege onbekendheid. Redenen om gebruik te maken van chemisch neurolyse met fenol zijn:
- Het heeft een langduriger effect heeft op spasticiteit dan bijvoorbeeld botulinetoxine injecties.
- Als er sprake is van gegeneraliseerde spasticiteit kan chemische neurolyse met fenol in aanvulling op botulinetoxine gebruikt worden indien reeds de maximaal toegestane dosering botulinetoxine wordt ingezet.
- Chemische neurolyse met fenol is goedkoper dan behandeling met botulinetoxine.
Conclusies / Summary of Findings
|
Zeer laag GRADE |
Spiertonus Er zijn geringe aanwijzingen dat bij patiënten met spasticiteit in de onderste ledematen behandeling met botulinetoxine injecties tot sterkere vermindering van spiertonus leidt dan chemische neurolyse met fenol.
Bronnen (Kirazli, 1998) |
|
Zeer laag GRADE |
Actief en passief bewegingsbereik Er is waarschijnlijk geen verschil in behandeleffect tussen chemische neurolyse met fenol en botulinetoxine injecties wat betreft verbetering van actief en passief bewegingsbereik bij patiënten met spasticiteit in de onderste ledematen.
Bronnen (Manca, 2010; Kirazli, 1998) |
|
Zeer laag GRADE |
Enkelclonus Er zijn geringe aanwijzingen dat chemische neurolyse met fenol de enkelclonus sterker vermindert dan botulinetoxine injecties bij patiënten met spasticiteit in de onderste ledematen.
Bronnen (Manca, 2010; Kirazli, 1998) |
|
Zeer laag GRADE |
H:M ratio Er is waarschijnlijk geen verschil in behandeleffect tussen chemische neurolyse met fenol en botulinetoxine injecties wat betreft afname van de H:M ratio bij patiënten met spasticiteit in de onderste ledematen.
Bronnen (Manca, 2010; Kirazli, 1998) |
|
Zeer laag GRADE |
Loopsnelheid Er is waarschijnlijk geen verschil in behandelingeffect tussen chemische neurolyse met fenol en botulinetoxine injecties wat betreft verbetering van loopsnelheid bij patiënten met spasticiteit in de onderste ledematen.
Bronnen (Kirazli, 1998) |
Samenvatting literatuur
Beschrijving studies
Spasticiteit in de onderste ledematen
Manca (2010) onderzocht de effectiviteit over een perioden van zes maanden van chemische neurolyse met fenol en botulinetoxine injecties (Botox) gericht op de remming van enkelclonus. Tweeëntwintig patiënten met spastische parese met enkelclonus als gevolg van een beroerte (n=17), traumatische hersenletsel (n=1) of degeneratieve myelopathie (n=4) werden geïncludeerd. 11 patiënten ontvingen een chemische neurolyse met fenol (6% oplossing; totaal volume: 4,5 tot 8 ml) van de n. tibialis tot het snel handmatig strekken van de triceps surea niet meer tot een clonus leidde. Elf patiënten werden met botulinetoxine in het caput mediale en laterale van de m. gastrocnemius en m. soleus geïnjecteerd. Elke spier ontving een dosis van 100 units verdeeld over twee plaatsen met een totale dosering van 300 units. Beoordelaar van de uitkomstmaten was niet geblindeerd. Loss to follow-up was in beide armen 45% (n=5).
Kirazli (1998) en On (1999) bestudeerden of botulinetoxine en chemische neurolyse met fenol de symptomen van spasticiteit in de enkel als gevolg van een beroerte verlichtten en wat de voor- en nadelen waren van de ene behandeling boven de andere behandeling. Twintig patiënten werden geïncludeerd en gerandomiseerd naar chemische neurolyse met fenol (5% oplossing; 3 ml) in de n. tibialis of naar 400 units botulinetoxine (Botox) injecties met 100 units verdeeld over twee plaatsen in de volgende drie spieren: m. soleus, m. tibialis posterior, en caput mediale en laterale van de m. gastrocnemius. Uit een tabel is af te leiden dat tien patiënten naar chemische neurolyse met fenol gerandomiseerd waren en tien patiënten naar botulinetoxine injecties. Patiënten werden gedurende 12 weken gevolgd. Er werd niets gerapporteerd over loss to follow-up.
Resultaten
Spasticiteit in de onderste ledematen
Effectiviteit van de interventies (gunstige effecten)
1. Actief en passief bewegingsbereik in het enkelgewricht, gemeten met een goniometer
Manca (2010) heeft het bereik, uitgedrukt in de mediaan, op dag vijftien, na één maand, na drie maanden en na zes maanden gemeten en vond een verschil tussen behandelarmen fenol en botulinetoxine op alle tijdsmomenten (p>0,05). Kirazli (1998) heeft het aantal patiënten dat verbetering liet zien gerapporteerd. Het is onduidelijk op welke tijdsmoment de metingen zijn gedaan. Voor actief bewegingsbereik zagen vijf patiënten (50%) in de fenolgroep een verbetering en zes patiënten (60%) in de botulinetoxine groep (p>0,05). Voor passief bewegingsbereik werd verbetering geobserveerd bij respectievelijk zes (75%) en vijf patiënten (63%) (p>0,05).
2. Enkelclonus
Beide studies hebben de enkelclonus na behandeling beoordeeld. Manca (2010) gebruikten een vijf-puntsschaal om aan te geven welke respons er was na het strekken van de triceps surae (0= geen reactie tot 4= onuitputtelijke clonus veroorzaakt door een langzame strekking). Alleen op de tijdsmomenten dag 15 en een maand was er een statistisch significant verschil in score in het voordeel van chemische neurolyse met fenol (p<0,05). Kirazli (1998) heeft de gemiddelde verandering in duur van clonus (in seconden) ten opzichte van baseline gemeten. In week twee was de afname in duur van clonus het sterkst in de botulinetoxinegroep (-50,3 sec (SE 17,0) en fenol: -16,1 sec (SE 5,1); p<0,05). In week vier, acht en twaalf was de afname in duur van clonus het grootste in de fenolgroep, maar niet statistisch significant verschillend van de botulinetoxinegroep (p>0,05).
3. H:M ratio
Beide trials hebben op dezelfde wijze de H:M ratio gemeten en berekend. Manca (2010) rapporteerde de mediaan in beide behandelarmen en observeerden een verschil tussen behandeling op dag 15 en na 6 maanden (p<0,05) met een sterkere afname in ratio ten gunste van fenol. On et al. 1999 zagen geen verschil in gemiddelde verschil ten opzichte van baseline tussen beide behandelingen gedurende de gehele follow-up (p>0,05).
4. Spiertonus
Kirazli (2010) heeft spiertonus door middel van de Ashworth Scale voor dorsiflexie en eversie gemeten. In week 2 en week 4 was het verschil in gemiddelde afname ten opzichte van baseline significant verschillend tussen de fenolgroep en de botulinetoxine groep (p<0,05) ten gunste van de botulinetoxine groep. In de tweede week was de afname voor de fenolgroep -0,7 (SE 0,2) en voor de botulinetoxine groep -1,5 (SE 0,2) en in de vierde week respectievelijk -0,7 (SE 0,2) en -1,4 (SE 0,2).
5. Lopen
Patiënten werd gevraagd om een afstand van 25 feet (ongeveer 7,6 meter) te lopen waarbij de tijd in seconden werd gemeten (Kirazli, 1998). Alleen in de tweede week was er een significant verschil in afname ten opzichte van baseline. Patiënten uit de botulinetoxine groep deden er gemiddeld 4,9 sec korter over dan op baseline en de patiënten uit de fenolgroep gemiddeld 1,9 sec korter ten opzichte van baseline. In week 4, 8 en 12 was de afname in duur van lopen het grootst in de fenolgroep, maar niet statistisch significant verschillend van de botulinetoxine groep (p>0,05).
Bijwerkingen en complicaties van de interventies (ongunstige effecten)
Geen van de RCT’s rapporteerde mogelijke bijwerkingen gerelateerd aan de behandeling.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten actief en passief bewegingsbereik, enkelclonus, H:M ratio, spiertonus en lopen is met drie niveaus verlaagd gezien beperkingen in de onderzoeksopzet, extrapoleerbaarheid (bias ten gevolge van indirectheid) en het geringe aantal patiënten (imprecisie).
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende wetenschappelijke vraagstelling:
Wat zijn de (on)gunstige effecten van chemische neurolyse met fenol ten opzichte van placebo injecties of een alternatieve therapie bij patiënten met cerebrale en/of spinale spasticiteit?
P: Volwassen patiënten met spinale of cerebrale spasticiteit
I: Chemische neurolyse met fenol van perifere zenuwen, met name de nervus tibialis, nervus obturatorius en nervus musculocutaneus
C: Placebo injecties, alternatieve therapie (bijvoorbeeld fysiotherapie)
O: Spiertonus, spierkracht, actief en passief bewegingsbereik, pijn; functionele metingen van balans, lopen, arm- en handvaardigheid, activiteiten van het dagelijks leven (ADL); sociale participatie
Relevante uitkomstmaten
De werkgroep achtte de uitkomstmaten spiertonus, spierkracht, actief en passief bewegingsbereik en pijn voor de besluitvorming kritieke uitkomstmaten; en functionele metingen van balans, lopen, arm- en handvaardigheid en activiteiten van het dagelijks leven (ADL) voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities.
Zoeken en selecteren (Methode)
In de databases Medline (OVID) en Embase werd met relevante zoektermen gezocht naar systematische reviews en gerandomiseerde trials (RCT’s). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 33 treffers op. Studies werden geselecteerd op grond van de volgende criteria: systematische review (gezocht in tenminste twee databases met een objectieve en transparante zoekstrategie, data extractie en methodologische beoordeling) of gerandomiseerde trials bij mensen met cerebrale en/of spinale spasticiteit onder behandeling van chemische neurolyse met fenol vergeleken met placebo injecties of alternatieve therapieën. Op basis van titel en abstract werden in eerste instantie 18 studies geselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 15 studies geëxcludeerd (zie exclusietabel), en drie studies definitief geselecteerd, waarvan twee dezelfde populatie beschreven maar met andere uitkomstmaten. Alle studies hebben chemische neurolyse met fenol vergeleken met botulinetoxine injecties.
Vanwege heterogeniteit in uitkomstmaten, patiëntenpopulatie en dosering van fenol en botulinetoxine was het niet mogelijk om de resultaten te poolen. De geïncludeerde studies worden derhalve afzonderlijk besproken.
(Resultaten)
Geen enkele systematische review voldeed aan de selectiecriteria. Alleen RCT’s werden geïncludeerd. Twee RCT’s zijn opgenomen in de literatuuranalyse. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De evidencetabellen en beoordeling van individuele studiekwaliteit zijn opgenomen onder het tabblad Onderbouwing.
Referenties
- Kirazli Y, On AY, Kismali B, et al. Comparison of phenol block and botulinus toxin type A in the treatment of spastic foot after stroke: a randomized, double-blind trial. Am J Phys Med Rehabil. 1998;77(6):510-5. PubMed PMID: 9862538.
- Manca M, Merlo A, Ferraresi G, et al. Botulinum toxin type A versus phenol. A clinical and neurophysiological study in the treatment of ankle clonus. Eur J Phys Rehabil Med. 2010;46(1):11-8. PubMed PMID: 20332721.
- On AY, Kirazli Y, Kismali B, et al. Mechanisms of action of phenol block and botulinus toxin Type A in relieving spasticity: electrophysiologic investigation and follow-up. Am J Phys Med Rehabil. 1999;78(4):344-9. PubMed PMID: 10418840.
Evidence tabellen
Research question: Wat zijn de (on)gunstige effecten van chemische neurolyse met fenol van de perifere zenuwen vergeleken met placebo of alternatieve therapieën in patiënten met spinale of cerebrale spasticiteit?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Manca, 2010 |
Type of study: Randomized trial
Setting: Patients with spastic paresis and ankle clonus referred to the rehabilitation unit of one national hospital
Country: Italy
Source of funding: Unknown |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 11 Control: 11
Important prognostic factors2: Median age (range): I: 59 (25-78) C: 52 (17-78)
Sex: I: 82% M C: 73% M
Groups comparable at baseline? Yes
|
Injection with phenol in a 6% aqueous solution into the tibialis posterior nerve
A Teflon needle electrode was used to deliver the stimuli and inject the phenol. Each patient received phenol until the manual rapid stretching of triceps surae ceased to trigger clonus.
|
Intramuscular injection with botulinum toxin type A (Botox) with a total dose of 300 IU
Each muscle (Gastrocnemius medialis, Gastrocnemius lateralis and Soleus) received 100 units divided at two sites per muscle. |
Length of follow-up: Six months
Loss-to-follow-up: Intervention: 5 (45%) Reasons: Evaluation in other hospitals or left out due to appearance of exclusion criteria
Control: 5 (45%) Reasons: a new stroke; continued evaluations in other hospitals; refused to return to hospital or left out due to appearance of exclusion criteria
Incomplete outcome data: Intervention: 5 (45%) Reasons: Evaluation in other hospitals or left out due to appearance of exclusion criteria
Control: 5 (45%) Reasons: a new stroke; continued evaluations in other hospitals; refused to return to hospital or left out due to appearance of exclusion criteria
|
Passive dorsiflexion of the ankle joint: Measured with a hand goniometer, median (range) * Significantly different from baseline (p<0.05)
Baseline I: 0 (0 to 20) C: 5 (-5 to 15) Day 15* I: 15 (5-25) C: 10 (0-20) p>0.05 One month* I: 10 (5-15) C: 13 (10-20) p>0.05 Three months* I: 10 (5-15) C: 10 (10-20) p>0.05 Six months* (only for the control group) I: 10 (0-15) C: 10 (10-20) p>0.05
Clonus in the ankle: Measured by manually stretching of the sural triceps on a five-point scale: 0 no response; 1 jerking response; 2 exhaustible clonus; 3 inexhaustible clonus; 4 inexhaustible clonus triggered by a slow stretch, median (range) * Significantly different from baseline (p<0.05)
Baseline I: 3 (2-4) C: 3 (3-4) Day 15* I: 0 (0-1) C: 2 (0-3) p<0.05 One month* I: 0 (0-1) C: 1 (0-2) p<0.05 Three months* I: 0 (0-2) C: 1 (0-3) p>0.05 Six months* I: 1 (0-3) C: 2 (0-3) p>0.05
M/H ratio: Measured as recording of M and H reflex responses on the surface of soleus muscle, median (range) * Significantly different from baseline (p<0.05)
Baseline I: 0.7 (0.4-1.0) C: 0.6 (0.3-0.9) Day 15*(intervention only) I: 0.4 (0.1-0.8) C: 0.6 (0.4-1.0) p<0.05 One month*(intervention only) I: 0.2 (0.1-0.7) C: 0.5 (0.4-0.9) p>0.05 Three months I: 0.3 (0.1-0.8) C: 0.6 (0.3-0.8) p>0.05 Six months*(intervention only) I: 0.3 (0.1-0.7) C: 0.6 (0.5-1.0) p<0.05 |
Authors’ conclusions: While both treatments led to reduction in ankle clonus, phenol showed greater clinical efficacy. The difference in neurophysiological results suggest that the two drugs have different action mechanisms with a more prevalent reduction of alpha motoneuron excitability in phenol-treated patients.
Comment: Causes of spasticity were as follows stroke (n=17), traumatic brain injury (n=1), degenerative myelopathy (n=4) |
|
Kirazli, 1998
Additional data (H:M ratio) from On, 1999 |
Type of study: Randomized trial
Setting: Patients with lower limb spasticity after stroke
Country: Unknown
Source of funding: Unknown |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Total: 20 Intervention: 10 Control: 10
Important prognostic factors2: Median age (SD): Total: 50 (18)
Sex: Total: 14 (70%) M
Groups comparable at baseline? Unknown
|
Injection with 5% phenol (3 ml)
Because of spasticity in invertors and plantar flexors, a tibial nerve block was indicated, with the primary target being fibers to the gastrocnemius and soleus muscles and the secondary target, the tibialis posterior.
A Teflon needle electrode was used to deliver the stimuli and inject the phenol.
|
Intramuscular injection with botulinum toxin type A (Botox) with a total dose of 400 IU under EMG guidance
Each muscle (Gastrocnemius medialis, Gastrocnemius lateralis, the Tibialis posterior and Soleus) received 100 units divided at two sites per muscle. |
Length of follow-up: 12 weeks
Loss-to-follow-up: Unknown
Incomplete outcome data: Unknown |
Range of Motion: Measured with a goniometer, n (%) improvement
Active I: 5 (50%) C: 6 (60%) RR 1.20 (95%CI: 0.54-2.67) Passive I: 6 (75%) C: 5 (63%) RR 1.20 (95%CI: 0.61-2.34)
Muscle tone: Measured with Ashworth Scale and tested for dorsiflexion and eversion, mean change (SE) from baseline
Dorsiflexion Week 2 I: -0.7 (0.2) C: -1.5 (0.2) P<0.05 Week 4 I: -0.7 (0.2) C: -1.4 (0.2) P<0.05 Week 8 I: -0.7 (0.2) C: -1.0 (0.1) P>0.05 Week 12 I: -0.6 (0.2) C: -0.5 (0.2) P>0.05
Eversion Week 2 I: -0.4 (0.2) C: -1.2 (0.1) P<0.05 Week 4 I: -0.5 (0.2) C: -1.2 (0.1) P<0.05 Week 8 I: -0.3 (0.2) C: -0.5 (0.2) P>0.05 Week 12 I: -0.2 (0.2) C: -0.1 (0.1) P>0.05
Walking: Time (sec) to walk 25 feet, mean change from baseline
Week 2 I: -1.9 (2.5) C: -4.9 (0.5) P<0.05 Week 4 I: -5.2 (3.1) C: -4.6 (0.4) P>0.05 Week 8 I: -6.7 (2.9) C: -3.7 (0.6) P>0.05 Week 12 I: -6.3 (2.8) C: -3.6 (0.5) P>0.05
Global assessment of spasticity: Score from -4 (severe worsening) to 4 (complete abolishment of symptoms), mean change (SE) from baseline
Not reported because the direction of change was unclear
Clonus duration: Recorded with EMG (sec), mean change (SE) from baseline
Week 2 I: -16.1 (5.1) C: -50.3 (17.0) P<0.05 Week 4 I: -67.8 (22.6) C: -35.3 (21.1) P>0.05 Week 8 I: -66.9 (21.9) C: -34.9 (7.1) P>0.05 Week 12 I: -72.0 (23.2) C: -31.2 (7.2) P>0.05
H:M ratio: Mean change (SE) from baseline
Week 2 I: 0.1 (0.2) C: 0.0 (0.2) P>0.05 Week 4 I: 0.1 (0.2) C: 0.0 (0.2) P>0.05 Week 12 I: 0.1 (0.2) C: 0.1 (0.2) P>0.05 |
Authors’ conclusions: Both phenol neurolysis and botulinum toxin injections reduce lower limb spasticity in post stroke patients. How and to what extent this affects patients’ functioning in daily life and their quality of life remain to be determined.
Comment: In the phenol group, three patients had dysesthesia and two obese patients developed common peroneal nerve paralysis which could have influenced the results the walking test. |
Notes:
1. Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
2. Provide data per treatment group on the most important prognostic factors [(potential) confounders]
3. For case-control studies, provide sufficient detail on the procedure used to match cases and controls
4. For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
Research question: Wat zijn de (on)gunstige effecten van chemische neurolyse met fenol van de perifere zenuwen vergeleken met placebo of alternatieve therapieën in patiënten met spinale of cerebrale spasticiteit?
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Manca, 2010 |
Permuted block design with a treatment allocation ratio of 1:1 |
Unclear |
Unclear |
Unclear |
Likely |
Unlikely |
Likely |
Unlikely |
|
Kirazli, 1998 |
Unclear |
Unclear |
Unclear |
Unlikely |
Unlikely |
Unlikely |
Unclear |
Unclear |
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Author, year |
Reden |
|
Yelnik, 2004 |
Gezocht in april 2004; Geen gedetailleerde zoekstrategie; 2 geïncludeerde trials die phenol gebruikten -> één observationele studie van patiënten geïnjecteerd in m. sub scapularis en één studie geïnjecteerd in n. ulnaire met een chirurgische techniek |
|
Van Kuijk, 2002 |
Gezocht in oktober 2000; 1 artikel geïncludeerd met phenol behandeling, Hecht 1992 (case series) |
|
Lam, 2015 |
Cerebrale parese patiënten zijn geïncludeerd, geen data over het aantal. |
|
Strommen, 2013 |
Expert opinion |
|
Ghai, 2013 |
Alle patiënten ontvingen de behandeling |
|
Esquenazi, 2012 |
Patiënten zijn niet gerandomiseerd |
|
Kocabas, 2010 |
Alcohol vergeleken met phenol |
|
Uchikawa, 2009 |
Alle patiënten ontvingen de behandeling |
|
Elovic, 2009 |
Narratieve review |
|
Zafonte, 2004 |
Narratieve review |
|
Gallichio, 2004 |
Narratieve review |
|
Sung, 2008 |
Geen controle groep |
|
Beckerman, 1996 |
Systematische review gezocht in maar 1 database; inclusie van observationele studies |
|
Iwatsubo, 1994 |
Case series; alle patiënten ontvingen de behandeling van phenol geïnjecteerd tussen wervels T12/L1 |
|
Wassef, 1993 |
Vergelijking tussen twee injectietechnieken; alle patiënten ontvingen behandeling met phenol |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 01-04-2017
Beoordeeld op geldigheid : 01-01-2016
Uiterlijk in 2021 bepaalt het bestuur van de Nederlandse Vereniging van Revalidatieartsen of deze richtlijn nog actueel is. Zo nodig wordt een nieuwe werkgroep geïnstalleerd om de richtlijn te herzien. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
De Nederlandse Vereniging van Revalidatieartsen is als houder van deze richtlijn de eerstverantwoordelijke voor de actualiteit van deze richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijk verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Kennisinstituut van Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Momenteel ontbreekt er een gestandaardiseerde behandelwijze voor volwassen patiënten met cerebrale en/of spinale spasticiteitsklachten. Er zijn veel verschillende (para)medisch specialismen (revalidatiearts, neuroloog, neurochirurg, handchirurg, anesthesioloog, orthopeed, fysiotherapeut, ergotherapeut, arts verstandelijk gehandicapten en specialist oudergeneeskunde) betrokken bij de behandeling van deze patiëntengroep. Een goede afstemming en consensus over wat optimale zorgverlening is voor deze groep patiënten is dan ook gewenst. Een landelijke evidence-based richtlijn is nodig om zorgprofessionals te ondersteunen in hun klinische besluitvorming en transparantie te bieden aan patiënten en derden.
Doelgroep
De patiëntengroep is divers; zo zijn er patiënten die weinig tot geen behandeling van hun spasticiteit nodig hebben of patiënten die in hun dagelijkse activiteiten (ADL) juist gebruik maken van hun spasticiteit (staan, lopen, aankleden). De spiertonus kan echter in de loop der tijd wijzigen, waardoor behandeling noodzakelijk wordt. Spasticiteit kan in dat geval leiden tot pijnklachten, fysiek ongemak, beperkte mobiliteit en zelfzorg, complicaties als contracturen, een laag zelfbeeld en decubitus, smetplekken vanwege moeilijkheden om een adequate hygiëne te realiseren (in gedeformeerde handen wordt dit probleem vaak gezien).
Beroerte, traumatisch hersenletsel en multiple sclerose kennen een hoge incidentie. Een belangrijk percentage van deze patiënten ontwikkelt spasticiteit. De incidentie/prevalentie van spasticiteit is niet exact bekend. Geschat wordt dat een derde van de CVA patiënten (van Kuijk et al., 2007; Watkins et al., 2002), 80% van patienten met Multiple Sclerose (MS) en 75% van de patiënten met lichamelijk beperkingen na traumatisch hersenletsel (THL) uiteindelijk spasticiteit ontwikkelt en in aanmerking komt voor behandeling. Gelet op de hoge incidentie van CVA, traumatisch hersenletsel en MS in Nederland is het aantal mensen met spasticiteit zeer omvangrijk.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijn is in 2014 een multidisciplinaire werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cerebrale en/of spinale spasticiteit te maken hebben.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep werkte gedurende twee jaar aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Kerngroep
- prof. dr. A.C.H. Geurts, revalidatiearts, werkzaam in het Radboudumc, Nijmegen (voorzitter per 01-07-2015), VRA
- drs. J.D. Martina, revalidatiearts, werkzaam in Medisch Spectrum Twente, Enschede (voorzitter tot 01-07-2015), VRA
- drs. E.M. Delhaas, anesthesioloog, werkzaam in het Erasmus Medisch Centrum, Rotterdam, NVA
- drs. A.M.V. Dommisse, revalidatiearts, werkzaam in het Isala Klinieken, Zwolle
- dr. J. Fermont, neuroloog, werkzaam in het Amphia ziekenhuis, Breda, VRA
- dr. J.F.M. Fleuren, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- dr. H.J.L. van der Heide, orthopedisch chirurg, werkzaam in het Leids Universitair Medisch Centrum, Leiden, NOV
- drs. E. Kurt, neurochirurg, Radboudumc, Nijmegen, NVNN
- dr. M. Kreulen, plastisch chirurg, werkzaam in het Rode Kruis ziekenhuis, Beverwijk, NVPC
- prof. Dr. G. Kwakkel, Hoogleraar Neurorevalidatie, werkzaam in het VU Medisch Centrum, Amsterdam, KNGF
- dr. C.G.M. Meskers, revalidatiearts, werkzaam in het VU Medisch Centrum, Amsterdam, VRA
- dr. A.V. Nene, revalidatiearts, werkzaam in het Roessingh, Enschede, VRA
- drs. W.P. Polomski, revalidatiearts, werkzaam in het Spaarne Gasthuis, Hoofddorp, VRA
- drs. M.N. Ruissen-Eversdijk, ergotherapeut, bewegingswetenschapper werkzaam in het Reade, centrum voor revalidatiegeneeskunde en reumatologie, Amsterdam, EN
- dr. I.T.H.J. Verhagen, neurochirurg, werkzaam in het Neurochirurgisch Science Centrum, Tilburg, NVNN
Klankbordgroep
- drs. W.G.M. Bakx, revalidatiearts, werkzaam in de Adelante zorggroep, Hoensbroek, VRA
- prof. Dr. J. Becher, kinderrevalidatiearts, werkzaam in het Vrije Universiteit Medisch Centrum, Amsterdam, NVK
- A. Cremers, patiëntvertegenwoordiger, werkzaam bij Hersenletsel.nl, Velp
- drs. E. de Klerk, revalidatiearts, werkzaam in het Bravis ziekenhuis, Bergen op Zoom, VRA
- drs. W.J. Lubbers, huisarts, werkzaam bij de Zorggroep Almere, Almere, NHG
- drs. C.J. Meijer, specialist ouderengeneeskunde, werkzaam in de Zonnehuisgroep Vlaardingen, Vlaardingen, Verenso
- drs. P.A.A. Struyf, revalidatiearts, werkzaam bij Zuyderland medisch centrum, Sittard, VRA
- drs. B. Tinselboer, arts voor verstandelijk gehandicapten, 's Heeren Loo, Apeldoorn, NVAVG
Met ondersteuning van:
- dr. W.A. van Enst, senior adviseur, Kennisinstituut van Medisch Specialisten
- dr. B.H. Stegeman, adviseur, Kennisinstituut van Medisch Specialisten
Belangenverklaringen
De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van Medisch Specialisten, een overzicht vindt u hieronder:
|
Naam werkgroeplid |
Belangen |
Consequenties |
|
Delhaas |
Consultant Medtronic, directeur van Care4home |
Geen consequenties |
|
Dommisse |
|
|
|
Fermont |
Geen |
|
|
Fleuren |
Geen |
|
|
Geurts |
Doceren bij cursussen en congresbijdragen gefinancierd door Ipsen en Medtronic en onderzoeksgelden ontvangen van Ipsen en Merz. |
Geen consequenties |
|
Kreulen |
Geen |
|
|
Kurt |
Geen |
|
|
Kwakkel |
Geen |
|
|
Martina |
Doceren bij cursussen gefinancierd door Ipsen, Medtronic en Allergan |
Geen consequenties |
|
Meskers |
STW project gehonoreerd waaraan Ipsen bijdraagt |
Geen consequenties |
|
Nene |
Geen |
|
|
Polomski |
Geen |
|
|
Ruissen-Eversdijk |
Geen |
|
|
Van der Heide |
Geen |
|
|
Verhagen |
Geen |
|
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door vroegtijdig af te stemmen met de Patiëntenfederatie Nederland en de patiëntenvereniging Cerebraal. Door een fusie tussen Cerebraal, CVA vereniging Samen Verder, en Afasievereniging tot Hersenletsel.nl kon er pas vanaf de ontwikkelfase worden samengewerkt. In de ontwikkelfase is een interview met een vertegenwoordiger van de patiëntenvereniging Hersenletsel.nl gehouden. De verkregen input is verwerkt bij het opstellen van de richtlijntekst. Deze is nadien nog gecontroleerd door de vertegenwoordiger van Hersenletsel.nl en een patiënt die de problematiek beschreven in de richtlijn zelf ervaart. De uitkomsten zijn verwerkt in de tekst over communicatie met de patiënt (module 'Organisatie van zorg bij spasticiteit'). Tevens is de gehele richtlijn ter commentaar voorgelegd aan Hersenletsel.nl, Dwarslaesie Organisatie Nederland en de MS vereniging. Dit commentaar is verwerkt in de definitieve richtlijn.
Methode ontwikkeling
Evidence based
Implementatie
Dit implementatieplan is opgesteld ter bevordering van de implementatie van de richtlijn ‘Behandeling van cerebrale en/of spinale spasticiteit’. Voor het opstellen van dit plan is een inventarisatie gedaan van de mogelijk bevorderende en belemmerende factoren voor het naleven van de aanbevelingen. Daarbij heeft de werkgroep een advies uitgebracht over het tijdpad voor implementatie, de daarvoor benodigde randvoorwaarden en de acties die door verschillende partijen ondernomen dienen te worden.
Werkwijze
De werkgroep heeft per aanbeveling geïnventariseerd:
- per wanneer de aanbeveling overal geïmplementeerd moet kunnen zijn;
- de verwachte impact van implementatie van de aanbeveling op de zorgkosten;
- randvoorwaarden om de aanbeveling te kunnen implementeren;
- mogelijk barrières om de aanbeveling te kunnen implementeren;
- mogelijke acties om de implementatie van de aanbeveling te bevorderen;
- verantwoordelijke partij voor de te ondernemen acties.
Voor iedere aanbeveling is nagedacht over de hierboven genoemde punten. Echter niet voor iedere aanbeveling kon ieder punt worden beantwoord (“Overweeg om …”) en wordt dus meer ruimte gelaten voor alternatieve opties. Voor “sterk geformuleerde aanbevelingen” zijn bovengenoemde punten in principe verder uitgewerkt dan voor de “zwak geformuleerde aanbevelingen”.
Implementatietermijnen
Voor de volgende aanbevelingen geldt dat zij zo spoedig mogelijk geïmplementeerd dienen te worden. Uiterlijk per november 2017 dient iedereen aan deze aanbevelingen te voldoen. Veel andere aanbevelingen zijn al onderdeel van de huidige praktijk en brengen daarom weinig of geen implementatieproblemen met zich mee.
- Interdisciplinaire diagnostiek met inbreng van relevante disciplines bij de indicering en evaluatie van invasieve en niet-reversibele behandelopties.
- Gebruik van gangbeeldanalyse ten behoeve van het indiceren en evalueren van invasieve, niet-reversibele therapie voor de onderste extremiteiten bij patiënten met residuele sta- en loopvaardigheid.
- Gebruik van echografie en/of elektrostimulatie ter geleiding van intramusculaire injecties met botulinetoxine.
- Gebruik van mini-infusor voor de proefbehandeling van intrathecale baclofen bij mensen met residuele sta- of loopvaardigheid.
Daarnaast wordt aanbevolen om uiterlijk november 2019 te komen tot de erkenning van een beperkt aantal behandelcentra in Nederland voor 1. Weke-delen en enkel-voetchirurgie bij patiënten met cerebrale en/of spinale spasticiteit, 2. Neurochirurgische ingrepen bij patiënten met cerebrale en/of spinale spasticiteit, en 3. Intrathecale baclofenbehandeling (inclusief ‘trouble shooting’). Deze centra dienen te beschikken over goede mogelijkheden voor geavanceerde gangbeeldanalyse indien het gaat om patiënten met residuele sta- en loopvaardigheid.
Impact op zorgkosten
Veel aanbevelingen brengen geen of nauwelijks gevolgen met zich mee voor de zorgkosten, omdat het gaat om reeds geïmplementeerde behandeling. Doordat deze richtlijn een aanzet doet om niet altijd een seriële behandelstrategie op te volgen (zie de module 'Organisatie van zorg bij spasticiteit’) kunnen mogelijk kosten bespaard worden. Indien onnodige behandelingen niet worden toegepast, kan sneller de meeste effectieve therapie voor de individuele patiënt worden gevonden. Een aantal aanbevelingen zal extra kosten met zich meebrengen, omdat hiervoor extra apparatuur of scholing nodig is of omdat de behandeling nu nog weinig wordt toegepast. Deze kostenverhoging wordt echter als relatief gering ingeschat. Scholing kan bovendien leiden tot doelmatiger behandelen, waarmee uiteindelijk kosten gereduceerd kunnen worden. De verwachte impact op kosten is gebaseerd op een inschatting door experts, niet op een kostenanalyse.
Vergoeding
De vergoedingen voor ITB-behandelingen zijn problematisch, wat goede zorg in de weg staat. De problematiek kan als volgt worden samengevat:
- de bestaande DOT’s voor ITB zijn niet specialisme-overstijgend;
- nieuwe DOT’s zijn noodzakelijk;
- aanpassing van nomenclatuur is noodzakelijk;
- vergoeding is veelal onvoldoende of zelfs niet aanwezig (vooral voor de betrokkenheid van de revalidatiearts bij de instelling en nazorg).
Weliswaar is er over deze problematiek reeds overleg geweest met de NZa, maar de oplossing lijkt nog ver weg. Afgeleid van de Zorgboom Anesthesiologie Pijnbestrijding is onderstaand model (figuur 1) in de plenaire vergadering van de Vereniging voor Neuromodulatie Nederland geaccordeerd en bij de NZa ter discussie aangeboden. De NZa zal hiertoe vertegenwoordigers van de verschillende medische specialismen uitnodigen om tot een consensus te komen.
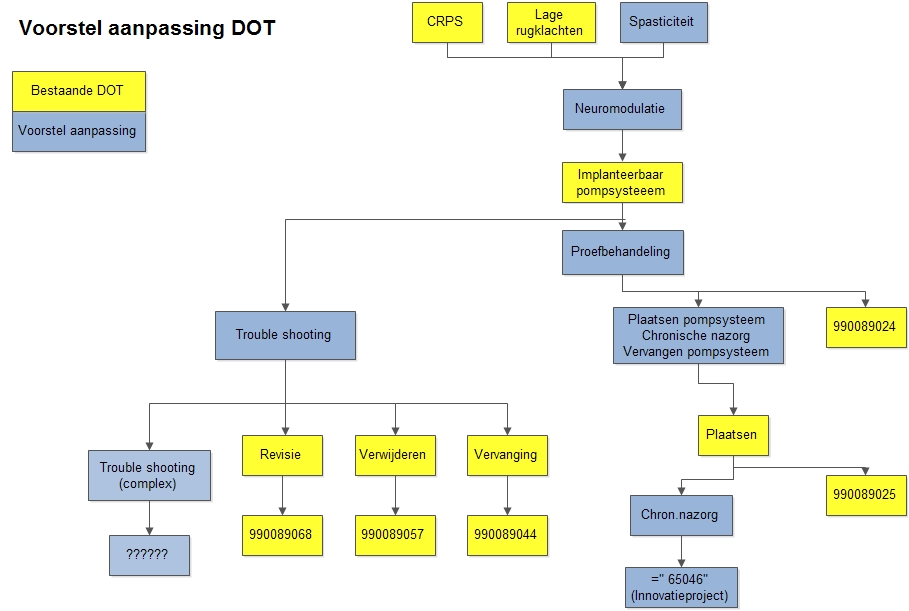
Figuur 1. Voorstel voor aanpassing van de DOT voor ITB-behandelingen
Te ondernemen acties per partij
Hieronder wordt per partij toegelicht welke acties zij kunnen ondernemen om de implementatie van de richtlijn te bevorderen.
Alle direct betrokken wetenschappelijk verenigingen/beroepsorganisaties (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, EN, Verenso, NVAVG en het NHG):
- Bekend maken van de richtlijn onder de leden.
- Publiciteit voor de richtlijn maken door over de richtlijn te publiceren in tijdschriften en te vertellen op congressen.
- Bespreken van vergoedingsproblematiek rondom de aanbevolen zorg uit de richtlijn met ZN en het Zorginstituut.
- Ontwikkelen van gerichte bijscholing/trainingen, onder andere gericht op pathofysiologie, diagnostiek, toediening van botulinetoxine injecties, chemische neurolyse met fenol, en op intrathecale baclofenbehandeling.
- Oprichten van interdisciplinaire kennisplatformen (VRA, NVA, NOV, NVPC, NVN, NVvN, KNGF, en EN, Verenso, NVAVG en het NHG)
- Ontwikkelen en aanpassen van patiënteninformatie.
- Controleren van de toepassing van de aanbevelingen middels audits en de kwaliteitsvisitatie.
- Gezamenlijk afspraken maken over en opstarten van continu modulair onderhoud van de richtlijn.
De lokale vakgroepen/individuele medisch professionals:
- Het bespreken van de aanbevelingen in de vakgroepsvergadering en lokale werkgroepen.
- Het volgen van bijscholing die bij gebruik maakt van deze richtlijn.
- Aanpassen van lokale patiënteninformatie op grond van de materialen die door de verenigingen beschikbaar gesteld zullen worden.
- Afstemmen en afspraken maken met andere betrokken disciplines om de toepassing van de aanbevelingen in de praktijk te borgen.
De systeemstakeholders (onder andere zorgverzekeraars, (koepelorganisaties van) ziekenhuisbestuurders, IGZ):
Ten aanzien van de financiering van de zorg voor patiënten met cerebrale en/of spinale spasticiteit wordt van het bestuur van de revalidatiecentra en ziekenhuizen verwacht dat zij bereid zijn om de nodige investeringen te doen (zie hierboven bij impact op zorgkosten) om de aanbevelingen in deze richtlijn te kunnen implementeren. Daarnaast wordt van de bestuurders verwacht dat zij bij de betrokken medisch professionals nagaan op welke wijze zij kennis hebben genomen van de nieuwe richtlijn cerebrale en/of spinale spasticiteit en deze toepassen in de praktijk.
Wanneer de zorg beschreven in de richtlijn niet kan worden aangeboden (b.v. geen mogelijkheid tot het uitvoeren van een gangbeeldanalyse, afwezigheid van echografie of elektrostimulatie, of onvoldoende expertise) dienen er afspraken te worden gemaakt tussen zorginstellingen over het doorverwijzen van patiënten, waarbij de kwaliteit van zorg kan worden gegarandeerd. Het verzorgen van een goed ingericht ziekenhuisinformatiesysteem kan bijdragen aan de implementatie van de aanbevelingen die betrekking hebben op de verslaglegging van lichamelijk en aanvullend onderzoek en de terugkoppeling aan (para)medici in eerste en tweede lijn. Van zorgverzekeraars wordt verwacht dat zij de zorg die in deze richtlijn wordt aanbevolen zullen vergoeden. De geformuleerde aanbevelingen in deze richtlijn kunnen, na verloop van de aangegeven implementatietermijnen, door zorgverzekeraars worden gebruikt voor de inkoop van zorg. Voorwaarde voor zorginkoop op kwaliteitsbeleid is dat de aanbevolen zorg vergoed wordt.
Het Kennisinstituut van Medisch Specialisten:
- Toevoegen van richtlijn aan richtlijnendatabase.
- Opnemen van het implementatieplan in ‘aanverwante producten’, zodat het voor alle partijen goed te vinden is.
- Opnemen van kennislacunes in ‘aanverwante producten’.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwalitieit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (http://www.agreetrust.org/agree-ii/), dat een internationaal breed geaccepteerd instrument is, en op de ‘richtlijnen voor richtlijn’ voor de beoordeling van de kwaliteit.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Tevens zijn er knelpunten aangedragen door Allergan, Inspectie voor de Gezondheidszorg, Ipsen, Medtronic en Zorginstituut Nederland via een invitational conference. Een verslag hiervan kunt u hier vinden.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de voorzitter en de adviseur concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang als cruciaal, belangrijk of onbelangrijk. Tevens definieerde de werkgroep, voor zover mogelijk, wat zij voor een bepaalde uitkomstmaat een klinisch relevant verschil vond, dat wil zeggen wanneer de verbetering in uitkomst een verbetering voor de patiënt was.
Strategie voor zoeken en selecteren van literatuur
Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar studies aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar studies met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De specifieke zoekstrategieën en de gehanteerde selectiecriteria zijn te vinden in de module van de desbetreffende uitgangsvraag.
Kwaliteitsbeoordeling individuele studies
Individuele studies werden systematisch beoordeeld op basis van op voorhand opgestelde methodologische kwaliteitscriteria om zo het risico op vertekende studieresultaten (bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de risk of bias tabellen.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij voldoende overeenkomsten tussen de studies werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/) (Atkins et al, 2004).
B) Voor vragen over waarde diagnostische tests, schade of bijwerkingen, etiologie en prognose
Bij dit type vraagstelling kan GRADE (nog) niet gebruikt worden. De bewijskracht van de conclusie is bepaald volgens de gebruikelijke EBRO-methode (van Everdingen et al, 2004).
Formuleren van de conclusies
Voor vragen over de waarde van diagnostische tests, schade of bijwerkingen, etiologie en prognose is het wetenschappelijke bewijs samengevat in een of meerdere conclusie, waarbij het niveau van het meest relevante bewijs is weergegeven.
Bij interventievragen verwijst de conclusie niet naar één of meer artikelen, maar wordt getrokken op basis van alle studies samen (body of evidence). Hierbij maakten de werkgroepleden de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen.
Overwegingen
Voor een aanbeveling zijn naast het wetenschappelijke bewijs ook andere aspecten belangrijk, zoals de expertise van de werkgroepleden, patiëntenvoorkeuren, kosten, beschikbaarheid van voorzieningen of organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld onder het kopje ‘Overwegingen’.
Formuleren van aanbevelingen
De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (Organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden in de module 'Organisatie van zorg bij spasticiteit' behandeld.
Indicatorontwikkeling
Gelijktijdig met het ontwikkelen van de conceptrichtlijn is overwogen om interne kwaliteitsindicatoren te ontwikkelen. Echter, de werkgroep heeft afgezien van de ontwikkeling omdat er geen harde aanbevelingen worden gedaan waarvan het meten van uitkomsten kan bijdragen aan de kwaliteitscyclus. Meer informatie over de methode van indicatorontwikkeling is op te vragen bij het Kennisinstituut van Medisch Specialisten (secretariaat@kennisinstituut.nl).
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat bij aanverwante producten (Onderzoek/ Kennislacunes).
Commentaar- en autorisatiefase
De conceptrichtlijn wordt aan de betrokken (wetenschappelijke) verenigingen voorgelegd voor commentaar. De commentaren worden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren wordt de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn zal nadien aan de betrokken (wetenschappelijke) verenigingen worden voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1990 – mei 2015 |
exp Spinal Injuries/ or exp Multiple Sclerosis/ or exp Brain Injuries/ or Head Injuries, Closed/ or exp Cerebrovascular Disorders/ or ((brain adj2 injur*) or (spinal adj2 injur*) or tbi.ab,ti. or (head adj2 injur*).ab,ti. or exp Stroke/ or stroke.ab,ti. or (cerebrovascular adj2 (accident* or diseas*))).ab,ti. AND exp Muscle Spasticity/ or spastic*.ab,ti or exp Paraparesis, Spastic/ or exp Cerebral Palsy/ or cerebral palsy.ab,ti. or exp Muscle Hypertonia/ or hypertonia.ab,ti. OR exp Dystonia/ or dystonia.ab,ti.
AND exp Phenol/ or phenol.ab,ti. or fenol.ab,ti.
AND exp Nerve Block/ or nerve block*.ab,ti. or neuroly*.ab,ti.
limit to (yr="1990 -Current" and (dutch or english or french or german))
AND (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) OR (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) limit to (yr="1990 -Current" and (dutch or english or french or german))
= 18 (18 uniek) |
33 |
|
Embase |
'spine injury'/de OR 'multiple sclerosis'/exp OR 'brain injury'/exp OR (brain NEAR/2 injur*):ab,ti OR (spinal NEAR/2 injur*):ab,ti OR 'head injury'/exp OR 'cerebrovascular disease'/exp OR tbi:ab,ti OR (head NEAR/2 injur*):ab,ti OR stroke:ab,ti OR (cerebrovascular NEAR/2 (accident* OR diseas*)):ab,ti AND ('spasticity'/exp OR 'spastic paresis'/exp OR spastic*:ab,ti OR 'cerebral palsy'/exp OR 'cerebral palsy':ab,ti OR hypertonia:ab,ti OR dystonia:ab,ti)
AND ('phenol'/exp OR phenol:ab,ti OR fenol:ab,ti OR ethanol:ab,ti)
AND ('neurolysis'/exp OR neuroly*:ab,ti OR 'nerve block':ab,ti OR 'nerve blocks':ab,ti)
AND ([dutch]/lim OR [english]/lim OR [french]/lim OR [german]/lim) AND [1990-2015]/py
AND (('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) OR ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it),11,9 Jun 2015AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psychlit:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp))
= 23 (15 uniek) |
