Ontstekingsprofylaxe bij cataract
Uitgangsvraag
Welke profylaxe dient bij een cataractoperatie gebruikt te worden om de kans op postoperatieve ontsteking tot een minimum te beperken?
De uitgangsvraag omvat de volgende deelvragen:
- Wat is de meest effectieve behandeling om postoperatieve ontsteking na cataractchirurgie te verminderen en de kans op cystoïd macula oedeem (CMO) te verkleinen? Kan worden volstaan met alleen steroïden of non-steroïde anti-inflammatoire drugs (NSAIDs), of is de combinatie noodzakelijk?
- Is het even effectief om de ontstekingsprofylaxe peroperatief te geven (‘dropless cataract surgery’) zodat patiënten thuis niet hoeven te druppelen?
Aanbeveling
Aanbeveling-1
Geef preventief NSAIDs én corticosteroïden oogdruppels na een staaroperatie ter preventie van cystoïd macula oedeem.
Aanbeveling-2
Geef niet standaard een peroperatieve injectie met corticosteroïden in plaats van postoperatieve ontstekingsremmende oogdruppels bij cataractchirurgie. Dit vanwege het feit dat het op dit moment nog onduidelijk is of een peroperatieve injectie met corticosteroïden even effectief is ter preventie van postoperatief cystoïd macula oedeem en ontsteking.
Overweeg alleen een peroperatieve injectie met corticosteroïden te geven in aanvulling op postoperatieve ontstekingsremmende oogdruppels indien er een lage compliance van druppelen wordt verwacht of wanneer er een andere indicatie is (zoals bijvoorbeeld verhoogd risico op uveitis).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
In Nederland worden jaarlijks 180.000 cataractoperaties verricht. De incidentie van CMO is met de huidige operatietechnieken een stuk lager dan vroeger. Echter, CMO is nog steeds de belangrijkste oorzaak van een suboptimale visus na cataract chirurgie. Gezien de grote aantallen cataractoperaties en het belang voor de patiënt is het klinisch relevant om te evalueren met welke ontstekingsprofylaxe de kans op CMO zo klein mogelijk is.
Deelvraag 1
In deelvraag 1 werd onderzocht welke ontstekingsremmende oogdruppels na een cataractoperatie de kans op CMO en postoperatieve ontsteking tot een minimum beperken. Kan worden volstaan met alleen corticosteroïden of NSAIDs druppels, of is de combinatie noodzakelijk?
Korte samenvatting belangrijkste resultaten, klinische relevantie en kwaliteit van het bewijs
Er werden drie verschillende PICO’s onderzocht om de verschillende druppelstrategieën na cataractchirurgie te vergelijken: alleen corticosteroïden, alleen NSAIDs of de combinatie van steroïden met NSAIDs.
De cruciale uitkomstmaat is het optreden van CMO na 1 maand (4 tot 6 weken). Uit de gepoolde resultaten van PICO 1.1 (corticosteroïden versus NSAIDs) blijkt dat CMO voorkwam bij respectievelijk 15,2% en 5,0% van de patiënten. Dit is een klinisch relevant verschil. De gepoolde resultaten van PICO 1.2 (corticosteroïden versus combinatie) laten zien dat CMO in de corticosteroïden groep bij 5,0% van de patiënten voorkwam en in de combinatiegroep bij 0,95% van de patiënten. Dit lijkt ook een klinisch relevant verschil. In PICO 1.3 (combinatie versus NSAIDs) bleek CME voor te komen bij 0,57% van de patiënten in de combinatiegroep en 2,84% in de NSAID-groep. Dit verschil is in het voordeel van de combinatie corticosteroïden + NSAIDs. Concluderend treedt CMO 4 tot 6 weken na een staaroperatie waarschijnlijk minder vaak op bij gebruik van NSAIDs dan bij gebruik van corticosteroïden oogdruppels (bewijskracht redelijk). Combinatiebehandeling met NSAIDS en corticosteroïden oogdruppels is waarschijnlijk effectiever dan monotherapie met alleen NSAIDs of alleen corticosteroïden (bewijskracht laag tot redelijk).
Een belangrijke uitkomstmaat is het optreden van ontsteking (cellen en tyndall) in de voorste oogkamer (VOK) 1 week postoperatief. Er lijkt geen verschil in cellen in de VOK te zijn bij gebruik van alleen corticosteroïden versus alleen NSAIDs (PICO 1.1). Het optreden van cellen in de VOK is niet gerapporteerd in studies die corticosteroïden of NSAIDs vergeleken hebben met de combinatie-behandeling (PICO 1.2 en PICO 1.3). Er lijkt ook geen verschil (PICO 1.2 corticosteroïden versus combinatie) ofwel een niet klinisch relevant verschil (PICO 1.1 corticosteroïden versus NSAIDs) in tyndall 1 week postoperatief. De bewijskracht voor deze uitkomstmaten is laag. Concluderend lijkt er dus geen klinisch relevant verschil te zijn in ontsteking in de VOK 1 week postoperatief bij het gebruik van topicale corticosteroïden, NSAIDs of de combinatie (bewijskracht laag tot geen).
Overwegingen bij interpretatie resultaten
De geïncludeerde studies zijn erg heterogeen qua gebruikte medicatie en behandelschema. Er werden bijvoorbeeld zowel laag- als hoog-potente corticosteroïden gebruikt. Ook varieerde de duur van de behandeling van 2 tot 8 weken. Het doel van het literatuuronderzoek was niet om de optimale duur of afbouwschema van de postoperatieve behandeling te onderzoeken. Ook is niet onderzocht wat het optimale moment is om te starten met topicale ontstekingsprofylaxe.
De belangrijkste uitkomstmaat is het optreden van CMO. De definitie van CMO verschilt per studie en werd gemeten met ofwel OCT of met fluorescentieangiografie (FAG). Vooral in oudere studies (van voor 2012) werd als detectiemethode FAG gebruikt. OCT heeft een hogere sensitiviteit en specificiteit bij het opsporen van CMO. Ook is met deze techniek mogelijk om retinadikte objectief te meten en CMO te kwantificeren. FAG toont lekkage van de bloed-retina barrière aan. Bij lekkage is het waarschijnlijk dat de retina hier verdikt is, maar dit is subjectief en niet te kwantificeren.
De aanwezigheid van CMO hoeft niet te resulteren in een verminderde visus. Klinisch significant CMO (CMO en een visusdaling) zou een klinisch relevantere uitkomstmaat zijn. Dit is echter in te weinig studies goed gedefinieerd om hier een uitspraak over te kunnen doen. Wielders (2018) rapporteerde een incidentie in klinisch significant CMO (CMO en minder dan twee regels visusverbetering ten opzichte van pre-op) zes weken postoperatief in 3,6% van patiënten die NSAIDs gebruikten, 5,1% van patiënten die corticosteroïden gebruikten en 0,7% van patiënten die de combinatie gebruikten.
Het risico op een visusdaling door CMO is waarschijnlijk gerelateerd aan de mate van postoperatieve ontsteking. In dit literatuuronderzoek is de mate van ontsteking in de voorste oogkamer (cellen en Tyndall) een week postoperatief meegenomen als uitkomstmaat. Klinisch is dit niet het meest relevante moment om deze uitkomstmaat te bepalen. Als er na een week nog cellen en/of Tyndall aanwezig is dan heeft dit meestal geen consequenties voor de behandeling of beleid. Echter, de aanwezigheid van cellen en/of Tyndall 4 weken postoperatief komt zo weinig voor dat dit niet in een literatuuronderzoek te vergelijken is. Een ander issue bij deze uitkomstmaat is dat de beoordeling van cellen en Tyndall subjectief is. Bij spleetlamponderzoek wordt voor de aanwezigheid van cellen en Tyndall de Standardized Uveitis Nomenclature (SUN) aangehouden. Echter, vergeleken met uveïtis zijn er over het algemeen weinig tekenen van ontsteking in de VOK na cataractchirurgie. Dit maakt het klinisch lastiger om de SUN gradering te gebruiken na cataractchirurgie.
Bovenstaande resultaten gelden voor patiënten met cataract die geen verhoogd risico hebben op het ontstaan van CMO. Patiënten met bepaalde systemische aandoeningen (bijvoorbeeld DM), met bepaalde oogheelkundige aandoeningen (veneuze vaatocclusie, uveïtis, epiretinaal membraan, of eerdere netvlieschirurgie), of waarbij intra-operatief een complicatie is opgetreden (achterste kapselruptuur, iristrauma) hebben een verhoogd risico op het ontstaan van CMO na cataract chirurgie. Bij deze patiënten zijn er mogelijk aanvullende maatregelen nodig om de kans op CMO te verkleinen. In de module comorbiditeit wordt ingegaan op aanvullende maatregelen bij patiënten met DM/DRP.
Voor- en nadelen van de interventie
Zowel corticosteroïden als NSAIDs oogdruppels worden al lange tijd gebruikt om ontsteking na cataractchirurgie en inflammatoire aandoeningen aan het oog te behandelen. De belangrijkste bijwerking van corticosteroïden oogdruppels is een verhoogde oogdruk, welke binnen dagen tot weken optreedt. Patiënten met DM type 1, hoge myopie, openkamerhoekglaucoom of glaucoom bij eerste graads-familieleden hebben een hogere kans op het ontwikkelen van een steroïd-geïnduceerde hoge oogdruk. Andere bijwerkingen van topicale corticosteroïden zijn: vertraagde wondgenezing, activering of verergering van infecties (bv herpes keratitis) en irritatie door het conserveringsmiddel. Mogelijke bijwerkingen van topicale NSAIDs zijn vertraagde wondgenezing, cornea melting en irritatie door het conserveringsmiddel.
Ongeveer 1 op de 10 patiënten heeft na een staaroperatie thuiszorg nodig voor toediening van corticosteroïde en NSAID-oogdruppels (Simons, 2019). Meestal worden NSAID-oogdruppels tweemaal daags gedurende twee weken voorgeschreven. Monotherapie met NSAIDs zou daarom de minste contactmomenten voor thuiszorg opleveren, en de druk op thuiszorgorganisaties en mantelzorgers kunnen verminderen.
Aanvaardbaarheid, haalbaarheid en implementatie
Aangezien corticosteroïden en NSAIDs oogdruppels al lang gebruikt worden zijn er geen problemen te verwachten met de aanvaardbaarheid, haalbaarheid of implementatie.
Kosten (middelenbeslag)
Zoals boven beschreven zou monotherapie met alleen NSAID druppels door minder contactmomenten met de thuiszorg lagere kosten met zich meebrengen. Echter, in een recente kosten-effectiviteitsanalyse op basis van de PREMED-studie werden de totale kosten voor de Nederlandse gezondheidszorg (inclusief kosten gerelateerd aan oogdruppels, thuiszorg, polibezoeken en eventuele complicaties) van behandeling met ofwel topicale bromfenac, ofwel topicale dexamethason, of de combinatie vergeleken (Simons, 2020). Deze resultaten laten zien dat de combinatie behandeling kosteneffectiever was dan monotherapie met alleen dexamethason of bromfenac.
Deelvraag 2
In deelvraag 2 werd onderzocht of peroperatief gebruik van ontstekingsprofylaxe even effectief is als postoperatief gebruik van oogdruppels om de kans op CMO en postoperatieve ontsteking tot een minimum te beperken.
Korte samenvatting belangrijkste resultaten, klinische relevantie en kwaliteit van het bewijs
De cruciale uitkomstmaat is het optreden van CMO na 1 maand (4 tot 6 weken) postoperatief. Voor deze uitkomstmaat zijn aanvullend observationele studies geïncludeerd vanwege de lage incidentie van CMO. De bewijskracht start daarmee automatisch op laag. Klinisch significant CMO werd onderzocht in 1 RCT (Dieleman, 2011) en 3 retrospectieve studies (Shorstein, 2015, Singhal, 2019; Tyson, 2017). In deze studies werd subconjunctivale (Dieleman, 2011 en Shorstein, 2015) of transzonulaire (Singhal, 2019 en Tyson, 2017) corticosteroïd injectie vergeleken met postoperatieve behandeling met corticosteroïde oogdruppels. Deze studies rapporteerden geen statistisch significant verschil na peroperatieve steroïde injectie en postoperatieve corticosteroïden oogdruppels (bewijskracht zeer laag). De centrale retina dikte werd in twee RCT’s onderzocht. In beide studies werd subconjunctivale steroïde injectie vergeleken met postoperatieve corticosteroïde oogdruppels. Er lijkt geen verschil te zijn in postoperatieve centrale retina dikte na gebruik van peroperatieve steroïde injectie vergeleken met postoperatieve oogdruppels (bewijskracht zeer laag).
Een belangrijke uitkomstmaat is het optreden van ontsteking (cellen en tyndall) in de voorste oogkamer na 1 tot 2 weken en na 4 tot 6 weken. Er lijkt vroeg en laat postoperatief geen verschil in cellen of flare te zijn na een peroperatieve corticosteroïd injectie in vergelijking met postoperatieve oogdruppels (bewijskracht laag tot redelijk).
Overwegingen bij interpretatie resultaten
De geïncludeerde studies zijn erg heterogeen qua gebruikte medicatie, dosering en toedieningsweg. Betamethasone heeft bijvoorbeeld een kortere werkingsduur dan triamcinolone: 1 tot 10 dagen versus drie tot zes weken. Er zijn tevens meerdere studies die subconjunctivaal triamcinolon acetonide hebben onderzocht. De dosering varieerde echter van 2 mg (Shorstein, 2015)) tot 20 mg (Lindholm, 2019). Dit maakt het onmogelijk om de resultaten van deze studies te vergelijken en om de meest optimale medicatie en dosering te bepalen.
Intra- of perioculaire corticosteroïd injecties worden al langer reeds gebruikt bij de behandeling van bijvoorbeeld uveïtis, diabetisch macula oedeem en afstoting na hoornvliestransplantatie. Mogelijke toedieningswegen voor peroperatieve toediening van corticosteroïden tijdens de cataractoperatie zijn: subconjunctivaal, sub-Tenonaal, transzonulair en intravitreaal. In de studies in dit literatuuronderzoek werd met name de subconjunctivale toedieningsweg onderzocht. Een voordeel van subconjunctivale toediening is dat dit een makkelijke handeling is en het mogelijk is om het depot te verwijderen als patiënten een hoge oogdruk ontwikkelen.
Het literatuuronderzoek bij deelvraag 1 toont aan dat de combinatie van corticosteroïden en NSAIDs het meest effectief was in het voorkomen van CMO. Nagenoeg alle studies in dit literatuuronderzoek hebben echter als controlegroep postoperatieve behandeling met corticosteroïde oogdruppels. In een grote retrospectieve studie (16.070 patiënten) heeft Shorstein (2015) wel subconjunctivale injectie met 2 mg Triamcinolone vergeleken met postoperatieve corticosteroïde oogdruppels en gecombineerde corticosteroïde + NSAID oogdruppels. De odds ratio voor het ontwikkelen van klinisch significant CMO was respectievelijk 1,21, 1,00 en 0,45.
Peroperatieve NSAID injectie is niet tot nauwelijks onderzocht in mensen. Er is recent wel een intracamerale NSAID goedgekeurd door de European Medicines Agency. Omidria is een combinatiepreparaat met phenylephrine en ketorolac, welke toegediend wordt aan de irrigatie vloeistof die gebruikt wordt tijdens de cataractoperatie. Omidria is geregistreerd voor pijnreductie en ter voorkoming van miosis tijdens de cataractoperatie. Of intracamerale toediening tijdens de operatie postoperatief ook CMO zou kunnen voorkomen is nog niet onderzocht.
Voor- en nadelen van de interventie
Het belangrijkste voordeel van deze interventie is dat patiënten postoperatief geen oogdruppels zouden hoeven te gebruiken. Optimale effectiviteit van behandeling vergt goede therapietrouw door de patiënt. Vooral in de oudere cataract populatie kan de therapietrouw suboptimaal zijn door vergeetachtigheid, geen toegang tot oogdruppels, of een verkeerde druppeltechniek. Omdat veel patiënten moeite hebben om zelf te druppelen wordt vaak mantelzorg of thuiszorg ingeschakeld wat leidt tot extra maatschappelijke kosten. Door de ontstekingsremmende medicatie tijdens de operatie toe te dienen door middel van een injectie rondom en/of in het oog, hoeven patiënten na de operatie geen oogdruppels meer te gebruiken. Dit kan het comfort voor patiënten en de effectiviteit van de behandeling verbeteren. Daarnaast kunnen hiermee kosten aan thuiszorg worden bespaard: uit een eerdere studie is gebleken dat ongeveer 1 op de 10 patiënten na een staaroperatie thuiszorg nodig heeft. Tevens kan hiermee de druk op thuiszorgorganisaties en mantelzorgers verminderd worden.
Een bekend risico van corticosteroïden is een verhoogde oogdruk. Door peroperatief steroïden toe te dienen in of rondom het oog kan de oogdruk stijgen. De kans op een verhoogde oogdruk hangt af van de toedieningsweg, dosering en potentie van het steroïd en van patiënt-gerelateerde factoren. Patiënten met DM type 1, hoge myopie, openkamerhoekglaucoom of glaucoom bij eerste graads-familieleden hebben een hogere kans op het ontwikkelen van een steroïd-geïnduceerde hoge oogdruk. In de literatuur is beschreven dat de werkingsduur van een triamcinolon depot subconjunctivaal drie tot zes weken is, en mogelijk langer. Een drukpiek na subconjunctivale triamcinolon injectie is in de literatuur gerapporteerd na één week tot 10 maanden (Athanasiadis, 2013). De meeste studies in dit literatuuronderzoek rapporteren alleen een gemiddelde oogdruk. Er zijn een paar studies die het aantal patiënten met een oogdruk van 25 mmHg of 30 mmHg of hoger rapporteren (Dieleman, 2011; Lindholm, 2019 en Khan, 2016) na peri-oculaire steroïde injectie. In de praktijk is het belangrijk om de oogdruk na 1 week en bij de eindcontrole na 4 tot 6 weken te meten. Indien deze verhoogd is dan zal de oogdruk, gezien de mogelijk werkingsduur van corticosteroïden, voor een langere periode in de gaten gehouden moeten worden. Een voordeel van een subconjunctivale toedieningsweg is dat het mogelijk is om het depot chirurgisch te verwijderen als de oogdruk met medicatie niet onder controle te krijgen is.
Aanvaardbaarheid, haalbaarheid en implementatie
Het toedienen van medicatie in of rond het oog is technisch niet lastig en wordt bij andere oogheelkundige aandoeningen al toegepast. Hier zijn geen implementatieproblemen te verwachten.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
De patiënten hebben over het algemeen de voorkeur voor een dropless cataractchirurgie of een minder intensief druppelschema. Gezien het gebrek aan bewijs dat dropless cataractchirurgie even veilig is als het postoperatief druppelen kan op dit moment het postoperatieve druppelschema niet worden gereduceerd. Het postoperatief druppelen zal goed met de patiënt en zijn/haar mantelzorgers moeten worden besproken en indien nodig geoefend moeten worden.
Kosten (middelenbeslag)
Een mogelijke barrière voor implementatie is de vergoeding. Dropless cataractchirurgie leidt tot een toename in operatiekosten doordat extra medicatie, extra materialen en extra tijd om de medicatie toe te dienen nodig is. Als dropless cataractchirurgie wordt geïmplementeerd in Nederland dan zal dit tot een besparing leiden in kosten voor oogdruppels en thuiszorg. Hier tegenover zal een vergoeding moeten komen voor de toename in operatiekosten.
Daarentegen moet er ook rekening worden gehouden dat er extra controle op de polikliniek moet plaatsvinden om de verhoogde kans op oogdrukstijging te controleren.
Aanbeveling-1
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
In deelvraag 1 werd onderzocht welke ontstekingsremmende oogdruppels na een cataractoperatie de kans op CMO en postoperatieve ontsteking bij niet-diabeten tot een minimum beperken.
Na een staaroperatie treedt CMO minder vaak op bij gebruik van NSAIDs dan bij corticosteroïden oogdruppels. Combinatiebehandeling met NSAIDs is waarschijnlijk effectiever dan monotherapie met alleen NSAIDs.
Aanbeveling-2
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
In deelvraag 2 werd onderzocht of peroperatief gebruik van ontstekingsprofylaxe even effectief is als postoperatief gebruik van oogdruppels om de kans op CMO en postoperatieve ontsteking bij niet-diabeten tot een minimum te beperken.
De bewijskracht in de literatuur voor de cruciale uitkomstmaat (CMO) is zeer laag. De geïncludeerde studies zijn tevens erg heterogeen qua gebruikte medicatie, dosering en toedieningsweg. Hierdoor is het niet goed mogelijk om de resultaten van deze studies te vergelijken en om de meest optimale medicatie en dosering te bepalen.
Nagenoeg alle studies in dit literatuuronderzoek hebben als controlegroep postoperatieve behandeling met corticosteroïde oogdruppels. Uit het literatuuronderzoek bij deelvraag 1 is gebleken dat deze behandeling waarschijnlijk minder effectief is dan combinatiebehandeling met corticosteroïden en NSAIDs.
Het belangrijkste risico van peri- of intraoculaire steroïd injectie is een verhoogde oogdruk. Dit kan vanwege het steroïde depot langer aanhouden dan bij topicale corticosteroïden. Indien de oogdruk bij de eindcontrole na 4 tot 6 weken verhoogd is, dan zal de oogdruk, gezien de werkingsduur van corticosteroïden, voor een langere periode in de gaten gehouden worden.
Onderbouwing
Achtergrond
Jaarlijks worden er in Nederland 180.000 cataractoperaties verricht. Na een cataractoperatie worden corticosteroïden en/of NSAIDs oogdruppels gebruikt om postoperatieve ontsteking te verminderen en het risico op cystoïd macula oedeem (CMO) te verkleinen. CMO ontstaat door verhoogde vaatpermeabiliteit in de retina als gevolg van de postoperatieve ontstekingsreactie en is de belangrijkste oorzaak van suboptimale visus na een cataractoperatie. Kan ter preventie van postoperatieve ontsteking en CMO worden volstaan met steroïden, of zijn NSAIDs noodzakelijk? Topicale behandeling met steroïden en/of NSAIDs is alleen effectief mits er een goede therapietrouw is door de patiënt. In de praktijk is dit vaak suboptimaal door bijvoorbeeld vergeetachtigheid of een onjuiste druppeltechniek, met name bij een oudere populatie. Door de ontstekingsremmende medicatie tijdens de operatie toe te dienen door middel van een injectie rond en/of in het oog, hoeven patiënten na de operatie geen oogdruppels meer te gebruiken. Dit wordt ‘dropless cataract chirurgie’ genoemd.
Conclusies / Summary of Findings
Deelvraag 1: Welke profylaxe dient bij een cataractoperatie gebruikt te worden om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken? (Kan worden volstaan met alleen steroïden of NSAIDs druppels, of is de combinatie noodzakelijk?)
PICO 1.1 NSAIDs versus corticosteroïden
Cystoïd macula oedeem na 4 tot 6 weken
Cellen na 1 week
|
Laag GRADE |
Er lijkt geen verschil in cellen in de VOK 1 week postoperatief bij het gebruik van NSAIDs vergeleken met corticosteroïden druppels na cataractchirurgie.
Bronnen: (Bucci, 2001; Holzer, 2002 en Roberts, 1995) |
Flare na 1 week
|
Laag GRADE |
Er lijkt een statistisch significant, maar niet klinisch relevant verschil in FLARE 1 week postoperatief bij het gebruik van NSAIDs vergeleken met corticosteroïden druppels na cataractchirurgie.
Bronnen: (Asano, 2008; Bucci, 2001; Coassin, 2019; Miyake, 2007; Miyake, 2011; Roberts, 1995 en Ylinen, 2018) |
PICO 1.2 NSAIDs + corticosteroïden versus corticosteroïden
Cystoïd macula oedeem na 4 tot 6 weken
|
Redelijk GRADE |
Cystoïd macula oedeem treedt waarschijnlijk minder vaak op 1 maand postoperatief bij het gebruik van de combinatie van NSAIDs en corticosteroïden druppels dan bij corticosteroïden druppels alleen na cataract chirurgie.
Bronnen: (Campa, 2018; Giannicare, 2018; Jung, 2015; Li, 2011; Miyanaga, 2009; Moschos, 2012; Ticly, 2014; Wielders, 2018; Wittpenn, 2008; Ylinen, 2018 en Zaczek, 2014) |
Cellen na 1 week
|
- GRADE |
Vanwege het ontbreken van studies die deze uitkomstmaat rapporteren kan er geen conclusie worden geformuleerd. |
FLARE na 1 week
|
Laag GRADE |
Er lijkt geen verschil in FLARE 1 week postoperatief bij het gebruik van de combinatie van NSAIDs en corticosteroïden druppels dan bij corticosteroïden druppels alleen na cataract chirurgie.
Bronnen: (Giannaccare, 2018 en Ylinen, 2018) |
PICO 1.3 NSAIDs + corticosteroïden versus NSAIDs
Cystoïd macula oedeem na 4 tot 6 weken
|
Laag GRADE |
Cystoïd macula oedeem lijkt minder vaak op te treden na 4 tot 6 weken postoperatief bij het gebruik van de combinatie van NSAIDs en corticosteroïden druppels dan bij NSAID-druppels alleen na cataractchirurgie.
Bronnen: (Wielders, 2018; Ylinen, 2018) |
Cellen na 1 week
|
- GRADE |
Vanwege het ontbreken van studies die deze uitkomstmaat rapporteren kan er geen conclusie worden geformuleerd. |
FLARE na 1 week
|
- GRADE |
Vanwege het ontbreken van studies die deze uitkomstmaat rapporteren kan er geen conclusie worden geformuleerd. |
Deelvraag 2: Is peroperatief gebruik van ontstekingsprofylaxe even effectief als postoperatief gebruik om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken na een cataract extractie?
Cystoïd macula oedeem na één maand
Centrale retinale dikte na één maand
|
Zeer laag GRADE |
Het is onduidelijk of een eenmalige peroperatieve corticosteroïde injectie even effectief is in vergelijking met postoperatieve corticosteroïde oogdruppels op de postoperatieve centrale retinale dikte.
Bronnen: (Dieleman, 2011; Lindholm, 2019) |
Cellen in de voorste oogkamer na één tot twee weken
|
Redelijk GRADE |
Een eenmalige peroperatieve corticosteroïde injectie is waarschijnlijk even effectief voor het aantal cellen in de voorste oogkamer na één tot twee weken postoperatief in vergelijking met postoperatieve corticosteroïde oogdruppels.
Bronnen: (Paganelli, 2004; Karalezli, 2008; Paganelli, 2009; Simaroj, 2001; Merkoudis, 2014; Khan, 2016) |
Cellen in de voorste oogkamer na vier tot zes weken
|
Laag GRADE |
Een eenmalige peroperatieve corticosteroïde injectie lijkt even effectief voor postoperatief aantal cellen in de voorste oogkamer na vier tot zes weken in vergelijking met postoperatieve corticosteroïde oogdruppels.
Bronnen: (Paganelli, 2004; Paganelli, 2009; Simaroj, 2001; Merkoudis, 2014; Khan, 2016) |
FLARE na één tot twee weken
|
Laag GRADE |
Een eenmalige peroperatieve corticosteroïde injectie lijkt even effectief voor postoperatieve FLARE na één tot twee weken in vergelijking met postoperatieve corticosteroïde oogdruppels.
Bronnen: (Paganelli, 2004; Negi, 2006; Karalezli, 2008; Paganelli, 2009; Merkoudis, 2014; Khan, 2016; Lindholm, 2019) |
FLARE na vier tot zes weken
|
Redelijk GRADE |
Een eenmalige peroperatieve corticosteroïde injectie is waarschijnlijk even effectief voor postoperatieve FLARE na vier tot zes weken in vergelijking met postoperatieve corticosteroïde oogdruppels.
Bronnen: (Paganelli, 2004; Negi, 2006; Dieleman, 2011; Paganelli, 2009; Merkoudis 2014; Khan, 2016; Lindholm, 2019) |
Samenvatting literatuur
Deelvraag 1: Welke profylaxe dient bij een cataractoperatie gebruikt te worden om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken? (Kan worden volstaan met alleen steroïden of NSAIDs druppels, of is de combinatie noodzakelijk?)
Beschrijving studies
Juthani (2017) is een systematische cochrane review met meta-analyse die twee vergelijkingen onderzocht: 1) het effect van NSAID’s versus corticosteroïden en 2) het effect van NSAID’s + corticosteroïden versus corticosteroïden. Inclusiecriteria waren RCT’s waarin patiënten een ongecompliceerde phaco-emulsificatie ondergingen en waarbij één van bovenstaande vergelijkingen werd onderzocht met als uitkomstmaat ontstekingsactiviteit of visus. Er werd gezocht tot december 2016. Er werden 14 studies (Bucci, 2001; Holzer, 2002; Robert, 1995; Asano, 2008; Laurell, 2002; Miyanaga, 2009; Chen, 2015; Donnenfeld, 2006; Jung, 2015; Li, 2011; Moschos, 2012; Ticly, 2014; Wittpenn, 2008 en Zaczek, 2014) geïncludeerd die aan de inclusiecriteria voldeden en waarvan de uitkomstmaten konden worden gepoold. Van twee studies (Miyanaga, 2009 en Laurell, 2002) werden de resultaten nog uit de individuele studies gehaald om mee te kunnen poolen. Voor ontstekingsactiviteit werd het aantal cellen/ mm3 en voor FLARE het aantal fotonen/miliseconde (ph/ms) na 1 week gerapporteerd en voor macula oedeem het aantal personen met klinisch macula oedeem na 1 maand. Hierbij werd het aantal patiënten met cystoïd macula oedeem, gemeten met OCT of FAG, bepaald. De definitie van de individuele studies werd hierbij aangehouden, bijvoorbeeld enige lekkage of ophoping van fluoresceïne die met FAG werd gedetecteerd. Voor alle uitkomstmaten werd een GRADE-beoordeling gedaan.
Campa (2018) is een niet-geblindeerde RCT die het effect onderzocht van 1) nepafenac + dexamethason (n=48); 2) bromfenac + dexamethason (N=48) en 3) dexamethason (n=48) bij patiënten die een cataractoperatie ondergingen. Patiënten in de nepafenac groep druppelden 3 dagen pre-op, en de combinatie van nepafenac en dexamethasone tot 4 weken postop. Patiënten in de bromfenac groep druppelden 3 dagen pre-op en 15 dagen post-op bromfenac 2 maal daags en 4 weken post-op dexamethason 4 maal daags. Patiënten in de dexamethason groep druppelden post-op gedurende 4 weken met dexamethason. Central subfield macular thickness (in µm) werd gemeten op baseline, na 1 week en na 5 weken en het aantal patiënten dat cystoïd macula oedeem ontwikkelde na 5 weken werd gerapporteerd. Cystoïd macula oedeem werd gedefinieerd als de aanwezigheid van cystoïde afwijkingen binnen de macula die werden gedetecteerd met een OCT in combinatie met een centrale subfield thickness van minstens 310 µm en een minimale verdikking van 5% ten opzichte van baseline.
Coassin (2019) is een RCT die het effect onderzocht van 1) bromfenac (n=39) vergeleken met 2) dexamethason (n=37). Patiënten in de bromfenacgroep druppelden 2 keer per dag gedurende 2 weken en patiënten in de dexamethason groep druppelden 4 keer per dag gedurende de eerste week en twee keer per dag gedurende de tweede week. Flare (ph/ms) werd na 7 dagen en na 30 dagen gemeten en foveale dikte na 30 dagen (in µm en het aantal patiënten met een dikte van > 300 µm). Alleen de assessor was geblindeerd in de studie. Het aantal patiënten met subklinisch (≥ 8/10 best gecorrigeerde visus) cystoïd macula oedeem (aanwezigheid van cystes op de OCT) werd gerapporteerd.
Giannaccare (2018) is een RCT die het effect onderzocht van 1) diclofenac + betamethason (n=50); 2) bromfenac + betamethason (n=50) en 3) betamethason (n=30). Patiënten in de diclofenac groep druppelden 4 maal daags gedurende 28 dagen. Patiënten in de bromfenac groep druppelden 2 maal daags gedurende 28 dagen. Betamethason werd 4 maal daags gedruppeld gedurende de eerste week en daarna werd per week 1 druppel minder per dag gebruikt. Een beperking aan de studie is dat de diclofenac groep en de bromfenac groep werden gerandomiseerd terwijl de betamethason groep patiënten waren die aan de inclusiecriteria voldeden en fungeerden als controlegroep maar niet mee werden gerandomiseerd. Flare (ps/ms) werd na 7, 14 en 28 dagen gemeten. Centrale foveale dikte werd na 7 en 28 dagen gemeten en het aantal patiënten dat subklinische CME (aanwezigheid van cystes op OCT) ontwikkelde werd gerapporteerd. Voor foveale dikte werd geen maat van spreiding gerapporteerd.
Wielders (2018) is een multicenter RCT (de PREMED 1 studie) die het effect onderzocht van 1) bromfenac (n=307) en 2) bromfenac + dexamethason (n=303) en 3) dexamethason (n=304) bij patiënten die phaco-emulsificatie ondergingen. Bromfenac werd 2 maal daags gedruppeld 2 dagen pre-operatief en 2 weken postoperatief. Dexamethason werd 4 maal daags gedruppeld 2 dagen pre-operatief en 1 week postoperatief en werd daarna iedere week met 1 druppel afgebouwd. Oogheelkundig onderzoek werd na 6 en na 12 weken uitgevoerd. Cellen en flare werden geclassificeerd aan de hand van de SUN grading scale. Het optreden van cystoïd macula oedeem en central subfield macular thickness werd gemeten met OCT. Klinisch significant macula oedeem werd gemeten en was gedefinieerd als CME in combinatie met minder dan 0,2 logMAR toename in best gecorrigeerde visus ten opzichte van pre-operatieve baseline.
Ylinen (2018) is een RCT waarin het effect werd onderzocht van 1) diclofenac (n=78); 2) diclofenac + dexamethason (n=78) en 3) dexamethason (n=68). Diclofenac werd driemaal daags gedurende 3 weken gedruppeld. Dexamethason werd 3 maal daags gedurende 3 weken gedruppeld. Na 28 dagen werd flare (ph/ms), centrale retinale dikte (µm) en CME bepaald. CME werd gedefinieerd als klinische verschijnselen (‘clinical appearance’) in combinatie met typische OCT bevindingen. Er was een hoge mate van dropout binnen deze studie (10-20%).
Resultaten
PICO 1.1 NSAIDs versus corticosteroïden
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
In totaal werd de uitkomstmaat het optreden van klinisch significant cystoïd macula oedeem na één maand postoperatief in vijf studies onderzocht (Asano, 2008; Coassin, 2019; Miyanaga, 2009; Wielders, 2018 en Ylinen, 2018). Het gepoolde effect laat zien dat klinisch significant cystoïd macula oedeem in de NSAID groep bij 5,0% (24/480) van de patiënten voorkwam en in de corticosteroïden groep bij 15,2% (71/467) van de patiënten (figuur 1). Dit leidde tot een risk ratio van 0,36; 95% BI = (0,24 tot 0,55, p<0,00001) met een random effect model en een lage heterogeniteit (I2 0%). Het verschil is in het voordeel van NSAIDs.
Figuur 1 Uitkomstmaat cystoïd macula oedeem
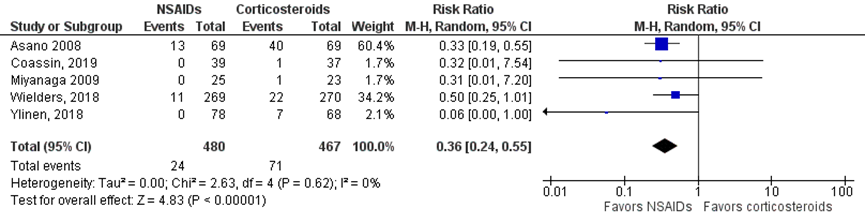
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
2. Uitkomstmaat cellen (1 week)
Juthani (2017) onderzocht in de systematische review het aantal cellen in de VOK één week postoperatief. In totaal werd de uitkomstmaat cellen (in cellen/ 0,075m3) in drie studies onderzocht (Bucci, 2001; Holzer, 2002 en Roberts, 1995). Het gepoolde effect laat een gemiddeld verschil in cellen tussen de interventiegroep en controlegroep zien van MD= -0,60; 95%BI= (-2,19; 0,99, p=0,46) met een random effect model en een lage heterogeniteit (I2 0%) (figuur 2). Hetgeen inhoudt dat er geen verschil is tussen de twee interventiegroepen.
Figuur 2 Uitkomstmaat cellen (cellen/0,075 mm3)
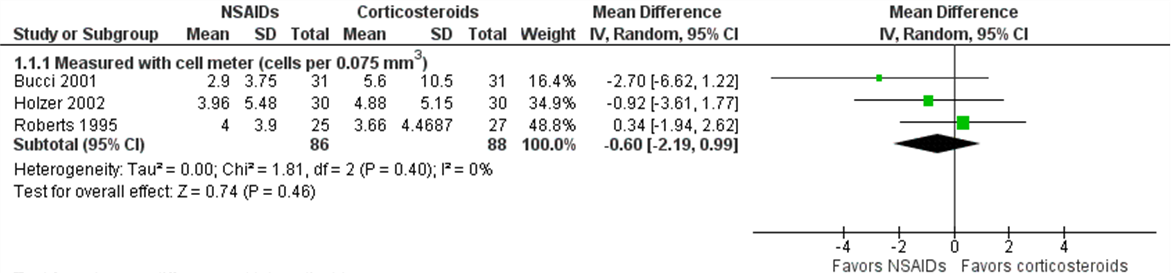
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
3. Uitkomstmaat FLARE/Tyndall (1 week)
In totaal werd de uitkomstmaat FLARE (in ph/ms) één week postoperatief in acht studies onderzocht (Asano, 2008; Bucci, 2001; Coassin, 2019; Miyake, 2007; Miyake, 2011; Miyanaga, 2009; Roberts, 1995 en Ylinen, 2018). Het gepoolde effect laat een gemiddeld verschil in FLARE/Tyndall tussen de interventiegroep en controlegroep zien van MD= -6,52; 95%BI= (-9,70; -3,34, p<0,00001) met een random effect model en een hoge heterogeniteit (I2 93%) (figuur 3). Het verschil is in het voordeel van NSAIDs.
Figuur 3 Uitkomstmaat FLARE (ph/ms)
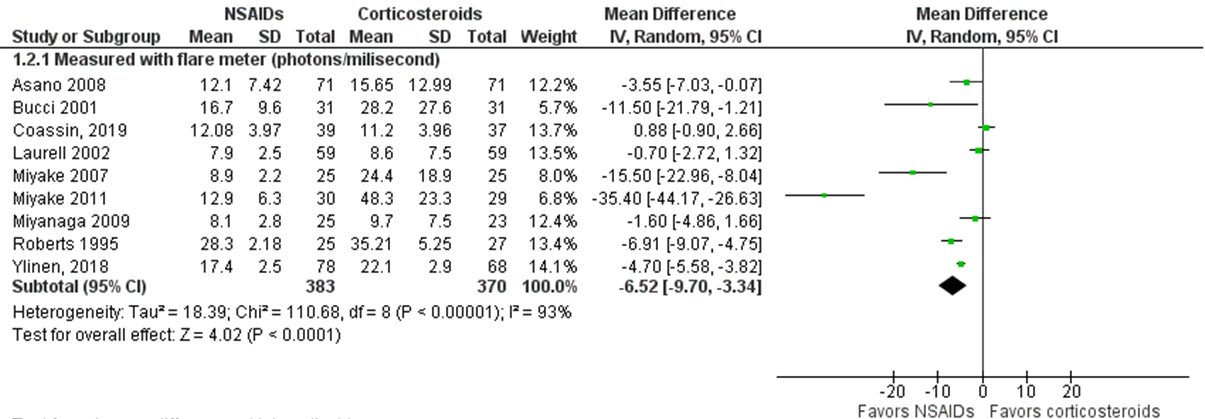
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
PICO 1.2 NSAIDs + corticosteroïden versus corticosteroïden
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
In totaal werd de uitkomstmaat het optreden van klinisch significant cystoïd macula oedeem na één maand postoperatief in twaalf studies onderzocht (Campa, 2018; Donnenfeld, 2006; Giannicare, 2018; Jung, 2015; Li, 2011; Miyanaga, 2009; Moschos, 2012; Ticly, 2014; Wielders, 2018; Wittpenn, 2008; Ylinen, 2018 en Zaczek, 2014). Het gepoolde effect laat zien dat klinisch significant cystoïd macula oedeem in de combinatiegroep NSAID’s + corticosteroïden bij 0,95% (11/1152) van de patiënten voorkwam en in de corticosteroïden groep bij 5,0% (53/1051) van de patiënten (figuur 4). Dit leidde tot een risk ratio van 0,26; 95% BI = (0,13 tot 0,53, p=0,0002) met een random effect model en een lage heterogeniteit (I2 12%). Het verschil is in het voordeel van de combinatiegroep NSAIDs + corticosteroïden.
Figuur 4 Uitkomstmaat cystoïd macula oedeem
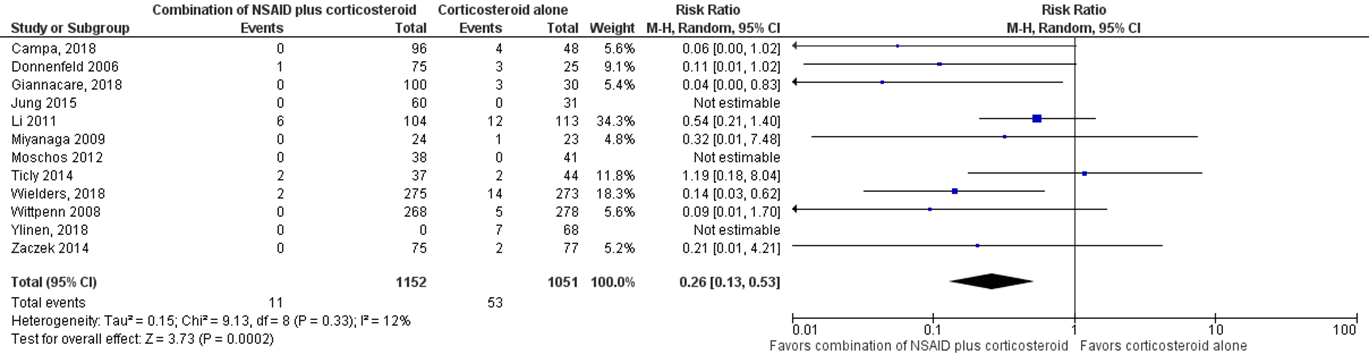
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval
2. Uitkomstmaat cellen in de VOK (1 week)
Geen van de geïncludeerde studies heeft cellen (in cellen / 0,075mm3) beschreven.
3. Uitkomstmaat FLARE/Tyndall (1 week)
In totaal werd de uitkomstmaat FLARE (in ph/ms) één week postoperatief in drie studies onderzocht (Miyanaga, 2009; Giannaccare, 2018 en Ylinen, 2018). Het gepoolde effect laat een gemiddeld verschil in ph/ms tussen de interventiegroep en controlegroep zien van MD= -4,72; 95%BI= (-9,93; -0,50, p=0,08) met een random effect model en een hoge heterogeniteit (I2 99%) (figuur 5). Het verschil is in het voordeel van de combinatie NSAIDs + corticosteroïden.
Figuur 5 Uitkomstmaat FLARE (ph/ms)
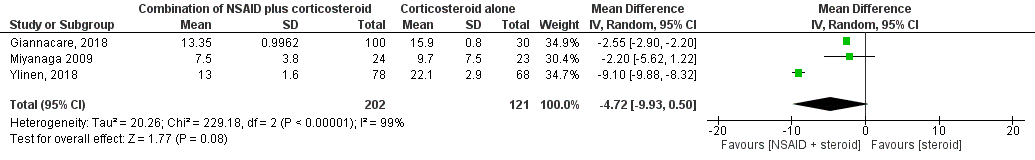
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
PICO 1.3 NSAIDs + corticosteroïden versus NSAIDs
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
De uitkomstmaat klinisch significant cystoïd macula oedeem werd in totaal door twee studies gerapporteerd (Wielders, 2018 en Ylinen, 2018). Het gepoolde effect laat zien dat klinisch significant cystoïd macula oedeem in de combinatiegroep bij 0,57% (2/353) van de patiënten voorkwam en in de NSAID-groep bij 2,84% (10/352) van de patiënten (figuur 6). Dit leidde tot een risk ratio van 0,90; 95% BI = (0,04 tot 0,90, p=0,04) met een random effect model. Het verschil is in het voordeel van de combinatie NSAIDs + corticosteroïden.
Figuur 6 Uitkomstmaat cystoïd macula oedeem
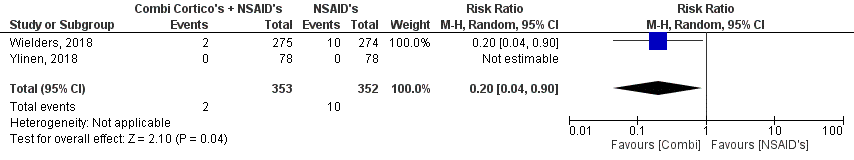
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
2. Uitkomstmaat cellen (1 week)
De uitkomstmaat cellen na 1 week werd niet gerapporteerd. Wel rapporteerde Wielders (2018) enige mate van cellen na 6 weken: in de combinatiegroep werden er cellen gezien bij 4,4% (12/271 patiënten) en in de diclofenacgroep bij 4% (11/272 patiënten).
3. Uitkomstmaat FLARE/Tyndall (1 week)
De uitkomstmaat FLARE na 1 week werd niet gerapporteerd. Wielders (2018) rapporteerde aanwezigheid van FLARE na 6 weken en vond FLARE in de combinatiegroep bij 1/ 303 patiënten en in de bromfenacgroep bij 0/307 patiënten. Ylinen (2018) rapporteerde na 28 dagen in de combinatiegroep 13 ± 1.6 ph/ms en in de dicofenacgroep 17.4±2.5 ph/ms, wat statistisch niet significant verschillend was.
Bewijskracht van de literatuur
PICO 1.1 NSAIDs versus corticosteroïden
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
De bewijskracht voor de uitkomstmaat cystoïd macula oedeem na 1 maand is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias, waaronder onduidelijkheid over blindering en uitval). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘redelijk’.
2. Uitkomstmaat cellen (1 week)
De bewijskracht voor de uitkomstmaat cellen na 1 week is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias, waaronder onduidelijkheid over blindering) en het geringe aantal patiënten (-1 imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
3. Uitkomstmaat FLARE/Tyndall (1 week)
De bewijskracht voor de uitkomstmaat FLARE na 1 week is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias, waaronder onduidelijkheid over blindering) en tegenstrijdige resultaten (-1, inconsistentie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
PICO 1.2 NSAIDs + corticosteroïden versus corticosteroïden
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
De bewijskracht voor de uitkomstmaat cystoïd macula oedeem na 1 maand is met 1 niveau verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias, waaronder onduidelijkheid over blindering en hoge uitval). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘redelijk’.
2. Uitkomstmaat cellen (1 week)
Vanwege het ontbreken van studies is er geen GRADE beoordeling voor de uitkomstmaat cellen.
3. Uitkomstmaat FLARE/Tyndall (1 week)
De bewijskracht voor de uitkomstmaat FLARE na 1 week is met 2 niveaus verlaagd gezien beperkingen in de onderzoeksopzet (-1, risk of bias, waaronder onduidelijkheid over blindering en hoge uitval) en brede betrouwbaarheidsintervallen (-1, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
PICO 1.3 NSAIDs + corticosteroïden versus NSAIDs
1. Uitkomstmaat cystoïd macula oedeem (4 tot 6 weken)
De bewijskracht voor de uitkomstmaat cystoïd macula oedeem na 1 maand is met 2 niveaus verlaagd gezien een beperkt aantal cases en overlap van het betrouwbaarheidsinterval met de grenzen voor klinische besluitvorming (-2, imprecisie). Vanwege het studiedesign is het startpunt GRADE ‘hoog’, de uiteindelijke bewijskracht komt uit op GRADE ‘laag’.
2. Uitkomstmaat cellen (1 week)
Vanwege het ontbreken van studies is er geen GRADE beoordeling voor de uitkomstmaat cellen na 1 week.
3. Uitkomstmaat FLARE/Tyndall (1 week)
Vanwege het ontbreken van studies is er geen GRADE beoordeling voor de uitkomstmaat FLARE na 1 week.
Deelvraag 2: Is peroperatief gebruik van ontstekingsprofylaxe even effectief als postoperatief gebruik om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken na een cataract extractie?
Beschrijving studies
Dieleman (2011) was een gerandomiseerd onderzoek waarin het effect van een enkele perioperatieve subconjunctivale injectie van betamethason-acetaat in de interventiegroep (n=200) werd vergeleken met oogdruppels dexamethason in de controlegroep (n=200) ter preventie van postoperatieve ontsteking en macula oedeem na cataractchirurgie. De studie werd uitgevoerd op de afdeling Oogheelkunde van het Rotterdams Oogheelkundig Instituut, het Universitair Ziekenhuis Maastricht en Het Oogziekenhuis Rotterdam in Nederland. Patiënten met diabetes werden geëxcludeerd uit de studie. De patiënten in de interventiegroep ontvingen een enkele injectie van 5,7 mg/ml betamethason-acetaat in het inferieure deel van de bulbaire conjunctiva aan het einde van de operatie. De patiënten in de controlegroep werden geïnstrueerd om vanaf dag één na de operatie driemaal daags voor een postoperatieve periode van 4 weken dexamethason 0,1% oogdruppels zelfstandig toe te dienen. De primaire uitkomstmaten waren flare, de proportie van het aantal patiënten met macula oedeem gezien op een OCT en klinisch significant macula oedeem en de “center point thickness” op een OCT. Klinisch significant macula oedeem was gedefinieerd als macula oedeem op OCT (> 30% verdikking ten opzichte van baseline) in combinatie met een afname in gecorrigeerde visus van 2 of meer regels op de ‘Early Treatment of Diabetic Retinopathy Study (ETDRS) chart’.
Khan (2016) was een gerandomiseerd onderzoek met een interventiegroep (n=54) en een controlegroep (n=54) waarin de veiligheid en het effect van een enkele subconjunctivale injectie van triamcinolon werd vergeleken met dexamethason oogdruppels ter vermindering van postoperatieve ontsteking en intraoculaire lens implantatie. De studie werd uitgevoerd in het Pakistaanse Khyber Teaching Hospital in Peshawar van September 2013 tot Februari 2014. Patiënten die phaco-emulsificatie met intraoculaire lensimplantatie ondergingen door dezelfde chirurg werden geïncludeerd in de studie. Patiënten met diabetes werden niet geëxcludeerd uit de studie. Patiënten in de interventiegroep ontvingen een sub-Tenon injectie van triamcinolon aan het einde van de operatie. De sub-Tenon injectie met een dosering van 40 mg (1,0 ml) werd geplaatst in het inferotemporale kwadrant. De patiënten in de controlegroep startten op de eerste postoperatieve dag met dexamethason oogdruppels volgens het volgende schema: viermaal druppelen per dag in week één, driemaal druppelen per dag in week twee, tweemaal druppelen per dag in week drie en eenmalig druppelen per dag in week vier. Beiden groepen gebruikten daarnaast twee weken lang, viermaal per dag tobramycin (0,3%) oogdruppels. Follow-up vond plaats na één dag, twee weken en zes weken postoperatief, waar postoperatieve ontsteking werd gemeten in termen als gradaties van cellen in de anterieure oogkamer en gradaties van flare beoordeeld met een spleetlamp. Er was geen sprake van blindering van de patiënten, waardoor patiënten op de hoogte waren van de toegewezen behandelinterventie.
Merkoudis (2014) was een prospectieve, gerandomiseerde studie met een interventie- en controlegroep (beide groepen n=25), waarbij de veiligheid en het effect van een subconjunctivale injectie van methylprednisolon (20 mg) werd vergeleken met een standaard postoperatieve behandeling van dexamethason (1mg/ml) oogdruppels. Patiënten met diabetes werden niet geëxcludeerd uit de studie. De patiënten met cataract graad 1-3 en tussen de 60 en 90 jaar oud werden willekeurig toegewezen aan één van de interventies. Alle patiënten werden een week en een maand postoperatief onderzocht op anterieure oogkamer ontstekingen. De studie was een open-label studie, waardoor patiënt en onderzoeker niet waren geblindeerd voor de toegewezen interventie.
Simaroj (2011) was een prospectieve, gerandomiseerde studie met een interventiegroep en controlegroep (beide groepen n=30), waarin een enkele intracamerale injectie van triamcinolon (2 mg in 0,1 ml) en gentamicine (0,2 mg in 0,1 ml) werd vergeleken met een postoperatieve combinatie van 0,1% dexamethason en 0,3% tobramycine oogdruppels (viermaal daags, totdat de ontsteking daalde). Alle patiënten werden een week en een maand postoperatief onderzocht. Patiënten met ongecompliceerde cataract die gepland stonden voor het ondergaan van phaco-emulsificatie en intraoculaire lens implantatie werden opgenomen in de studie. Patiënten met diabetes werden geëxcludeerd uit de studie. De primaire uitkomstmaat was de gradatie van intraoculaire ontsteking. Adverse events werden gerapporteerd om de veiligheid van de injectie te beoordelen. De belangrijkste beperking aan de studie is de kleine sample size en het gebrek aan blindering van de patiënt en onderzoeker.
Lindholm (2019) was een prospectieve, niet-gerandomiseerde klinische studie met een interventiegroep (n=52, door uitval n=50) en controlegroep (n=53, door uitval n=51). De studie vergeleek een perioperatieve subconjunctivale injectie van 20 mg triamcinolon-acetonide met postoperatieve behandeling van drie weken, driemaal per dag druppelen met 1 mg/ml dexamethason oogdruppels. Patiënten waren tussen de 60 en 90 jaar oud en kwamen in aanmerking voor cataractchirurgie volgens de huidige standaarden voor cataractchirurgie van de Finse gezondheidszorg. Patiënten met diabetes werden geëxcludeerd uit de studie. De primaire uitkomstmaten waren flare en centrale retinale dikte gemeten op 7, 28 en 90 dagen postoperatief. Bij een bilaterale operatie werd maar één oog willekeurig geselecteerd voor de analyse. De uitkomsten kunnen beïnvloed zijn, omdat de patiënt en onderzoeker niet waren geblindeerd voor de toegewezen behandeling. Daarnaast noemt de studie dat het gebruik van pupil verwijdingsmiddelen kan hebben gezorgd voor meer ontsteking en macula veranderingen.
Negi (2006) was een prospectieve gerandomiseerde studie met een interventiegroep en controlegroep (beide groepen n=27). Patiënten met ongecompliceerde, leeftijdgerelateerde cataract die in aanmerking kwamen voor phaco-emulsificatie werden opgenomen in de studie. Patiënten met diabetes werden geëxcludeerd uit de studie. De veiligheid en werkzaamheid van een enkele sub-Tenon injectie van 20 mg triamcinolone-acetonide voor de behandeling van postoperatieve intraoculaire ontsteking werd onderzocht en vergeleken met de standaard postoperatieve voorschrijving van betamethason natriumfosfaat 0,1% en neomycinesulfaat 0,5% (Betnesol-N) oogdruppels, welke viermaal per dag gedurende een periode van 30 dagen toegediend dienden te worden. Tijdens de studie werd de dosering van de sub-Tenon injectie aangepast van 20 naar 30 mg vanwege prikkeling in de voorste oogkamer bij enkele van de eerste tien patiënten. Randomisatie werd uitgevoerd aan het einde van de operatie op basis van een enveloppenmethode. Patiënten werden één, acht, 30 en 90 dagen postoperatief gezien door geblindeerde onderzoekers. Anterieure oogkamer ontsteking, oogdruk en klinische CME werd bij elk controlebezoek gemeten door geblindeerde optometristen. Anterieure oogkamer ontsteking werd overigens ook preoperatief gemeten. De grootste beperkingen van de studie zijn de kleine sample size en de randomisatiemethode.
Karalezli (2008) was een prospectieve gerandomiseerde studie met een interventie- en controlegroep (beide groepen n=30). Patiënten die ongecompliceerde phaco-emulsificatie en lens implantatie ondergingen werden opgenomen in de studie. Patiënten met diabetes werden geëxcludeerd uit de studie. Het effect, de veiligheid en tolereerbaarheid van het injecteren van 1 mg/0,1 ml intracamerale triamcinolon-acetonide in de anterieure oogkamer werd vergeleken met postoperatieve 1% prednisolon-acetaat oogdruppels. De oogdruppels dienden toegediend te worden middels het volgende schema: zeven dagen lang zesmaal per dag en de volgende 15 dagen vier maal per dag. Patiënten werden op de eerste, zevende en 30e dag postoperatief onderzocht. De belangrijkste effectiviteitsuitkomsten waren cellen en flare in de anterieure oogkamer. Eén van de beperkingen was het niet blinderen van de studie, omdat de operatie en observatie werden uitgevoerd door dezelfde persoon. Daarnaast was er geen mogelijkheid om gebruik te maken van een anterieure oogkamer cel meter, dus is gebruik gemaakt van een spleetlamp om anterieure oogkamer ontsteking te meten.
Paganelli (2004) was een gerandomiseerde, dubbel-gemaskeerde studie met een interventiegroep en een controlegroep (beide groepen n=50). Patiënten die phaco-emulsificatie en lens implantatie ondergingen werden opgenomen in de studie. Patiënten met diabetes werden geëxcludeerd uit de studie. De studie vergeleek een enkele intra-operatieve sub-Tenon-injectie van 40 mg triamcinolone-acetonide in de interventiegroep met postoperatieve 1% prednisolon-acetaat oogdruppels. De oogdruppels dienden toegediend te worden volgens het volgende schema: één druppel viermaal daags (week één), één druppel driemaal daags (week twee), één druppel tweemaal daags (week drie) en één druppel éénmaal per dag (week vier). Voor de blindering van de behandeling ontving de interventiegroep placebo oogdruppels en de controlegroep kreeg een sub-Tenon-injectie met een gelijke hoeveelheid zoutoplossing. Alle effectiviteitsvariabelen werden geëvalueerd met een spleetlamp. De primaire uitkomstmaten waren cellen in de anterieure oogkamer en flare. De uitkomstmaten werden tijdens alle follow-up bezoeken gerapporteerd.
Paganelli (2009) was een gerandomiseerde, dubbel-gemaskeerde studie met een interventiegroep (n=68) en controlegroep (n=67). De studie vergeleek een sub-Tenon injectie van 25 mg triamcinolon en 2 mg ciprofloxacin aan het einde van cataractchirurgie met 1% prednisolon en 3% ciproflxacin oogdruppels. De oogdruppels dienden toegediend te worden middels het volgende schema: één druppel, viermaal daags (week één), één druppel, driemaal daags (week twee), één druppel, tweemaal daags (week drie) en één druppel, eenmaal per dag (week vier). Patiënten met ongecompliceerde, leeftijd-gerelateerde cataract werden opgenomen in de studie. Voor de blindering van de behandeling ontving de interventiegroep placebo oogdruppels in flesjes volgens hetzelfde schema als de controlegroep. De controlegroep kreeg daarentegen een sub-Tenon injectie zonder werkzaam middel. De klinische beoordeling van postoperatieve uitkomsten werd gedaan door een geblindeerde onderzoeker die niet op de hoogte was van de groepsstatus van de patiënt. Patiënten werden daarnaast gevraagd geen informatie te verschaffen over de oogdruppels. Follow-up vond op één, drie, zeven, 14 en 28 dagen postoperatief plaats. De primaire effectiviteitsvariabele was het aantal cellen in de anterieure oogkamer en flare. Beperkingen in de studie waren dat de studie een kleine, gelimiteerde fase II studie was, er een korte follow-up was en dat er geen echte conclusie kon worden getrokken over de effectiviteit en veiligheid op de lange termijn.
Shorstein (2015) was een retrospectieve cohortstudie waarin data van 22.916 patiënten werd onderzocht die phaco-emulsificatie ondergingen in het Kaiser Permanente, Diablo Service Area, Northern California tussen 2007 en 2013 en tenminste 12 maanden gepland stonden voor de daadwerkelijke procedure. Er werden uiteindelijk 16.070 ogen geïncludeerd, waarvan er in 118 ogen macula oedeem werd gevonden volgens de definitieve van macula oedeem. De behandelregimes bestonden uit de referentietest, namelijk postoperatieve prednisolon-acetaat oogdruppels welke werd vergeleken met prednisolon-acetaat oogdruppels in combinatie met niet-steroïde ontstekingsremmend middel en met een intra-operatieve subconjunctivale injectie van 2 mg triamcinolone acetonide. De primaire uitkomstmaat was de incidentie van klinisch significant macula oedeem gedefinieerd als maculaire verdikking op OCT en een gecorrigeerde visus van 20/40 of minder.
Tyson (2017) was een retrospectieve analyse studie. De studiedata bestond uit dossiers van 922 patiënten (1541 ogen) die cataractchirurgie ondergingen tussen november 2013 en december 2014, waarin het effect van een intra-vitraele injectie van 0,2 ml met triamcinolone acetonide (0,3 mg), moxifloxacin (0,2 mg) en vancomycin (2,0 mg) na de intraoculaire lens implantatie, maar voor de visco-elastische verwijdering werd onderzocht. Direct na de operatie werd nog één druppel prednisolon 1% aan het geopereerde oog toegediend. Postoperatief werd centraal macula oedeem gemeten.
Singhal (2019) was een retrospectieve review, waarbij het effect van een transzonulaire injectie van 3 mg triamcinolone tijdens de cataractchirurgie in plaats van postoperatieve oogdruppels werd onderzocht. Patiënten kregen voorafgaand aan de operatie de keuze voor deze injectie of postoperatieve oogdruppels. Wanneer er niet werd gekozen voor een injectie werden ook geen preoperatieve oogdruppels toegewezen. In de periode waarin de injectie niet meer beschikbaar was kregen geïncludeerde patiënten twee dagen voor de operatie en een week postoperatief antibiotica in combinatie met prednisolon acetaat oogdruppels. De injectiegroep bestond uit 73 patiënten (99 ogen) en de oogdruppels groep uit 82 patiënten (99 ogen). Primaire uitkomstmaten waren significant centraal macula oedeem en visuele scherpte. Klinisch significant macula oedeem werd gedefinieerd als een gecorrigeerde visus van ≤ 20/40 bevestigd door de aanwezigheid van CME bij de fovea.
Resultaten
Cystoïd macula oedeem na 4 tot 6 weken
Klinisch significant macula oedeem na een injectie in vergelijking met oogdruppels na één maand werd onderzocht in vier studies (Dieleman, 2011; Tyson, 2017; Shorstein, 2015 en Singhal, 2019). In al deze vier studies werden patiënten in de controlegroep behandeld met corticosteroïd oogdruppels. De resultaten van de studies van Dieleman (2011), Singhal (2019) en Shorstein (2015) konden worden gepoold. De gepoolde resultaten (Dieleman, 2011; Shorstein, 2015 en Singhal, 2019) lieten een odds ratio zien van 0,98 (95% BI van 0,47 tot 2,02, p=0, 95) (figuur 7). De studies rapporteerden allemaal geen statistisch significant verschil tussen de interventie- en controlegroep. In de studie van Dieleman (2011) werd in de interventiegroep bij 2% (4/200) van de patiënten na één maand cystoïd macula oedeem met cystes gevonden. In de controlegroep werd dit bij 3,5% (7/200) patiënten geconstateerd. Er was geen sprake van een statistisch significant verschil tussen de interventie- en controlegroep (p=0,386). In de studie van Shorstein (2015) werd de associatie onderzocht tussen cystoïd macula oedeem bij een behandeling met alleen prednisolon-acetaat oogdruppels, prednisolon-acetaat oogdruppels in combinatie met een NSAID of een intra-operatieve subconjunctivale injectie van 2 mg triamcinolone acetonide. De odds-ratio voor de intra-operatieve subconjunctivale injectie ten opzichte van prednisolon-acetaat oogdruppels was 1,21 ((95% CI: 0,48; 3,06). Dit was geen statistisch significant verschil (p>0,05). Singhal (2019) vond een incidentie van visueel significant macula oedeem van 1/99 (1%) in de injectiegroep en 0/99 (0%) in de controlegroep. Er was geen sprake van een statistisch significant verschil (p=1,00). De resultaten van de studie van Tyson (2017) rapporteerden bij 28/1429 (2,0%) cases macula oedeem (niet gespecificeerd per groep), waarbij geen statistisch significant verschil werd gevonden.
Figuur 7 Uitkomstmaat klinisch significant CME
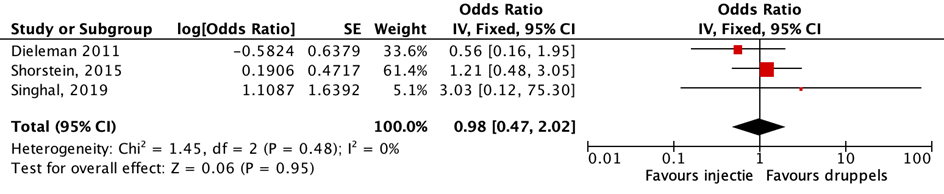
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
Centrale retinale dikte (µm) na 4 tot 6 weken
De uitkomstmaat central subfield macular thickness (µm) werd in twee studies onderzocht (Dieleman, 2011; Lindholm, 2019). De resultaten van de studies konden worden gepoold. Dieleman (2011) onderzocht het verschil in centrale retinale dikte tussen baseline en na vier weken postoperatief en vond tussen de interventie- en controlegroep een niet statistisch significante gemiddelde verschilscore van 23,7 ± 59,2 in de interventie groep en 20,3 ± 47,6 in de controlegroep (p=0,530). Lindholm (2019) vond wel een gemiddelde statistisch significante verschilscore van 27,1 µm ((95%BI=45,99 tot -8,21); p=0,005) tussen de interventie- en controlegroep na één maand. Het gepoolde gemiddelde verschil was -3,83 (95% BI van -13,03 tot 5,37, p=0,41) (figuur 8).
Figuur 8 Uitkomstmaat centrale retinale dikte (µm)
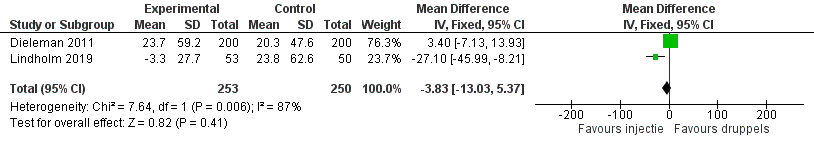
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn # patiënten
Cellen in de voorste oogkamer na één tot twee weken
Het verschil in het aantal cellen in de voorste oogkamer na een injectie in vergelijking met oogdruppels na één tot twee weken postoperatief is onderzocht in zes RCT’s (Paganelli, 2004; Karalezli, 2008; Paganelli, 2009; Simaroj, 2001; Merkoudis, 2014; Khan, 2016). Geen van de studies die toediening middels een injectie vergeleek met oogdruppels vond een significant verschil tussen de twee groepen. De resultaten van twee studies (Paganelli, 2009; Khan, 2016) konden worden gepoold (figuur 9). De andere vier studies konden niet worden gepoold vanwege heterogeniteit in de uitkomstmaten, maar lieten wel hetzelfde resultaat zien. Geen van de studies vond een statistisch significant verschil in het aantal cellen in de voorste oogkamer tussen de interventiegroep en de controlegroep. De beoordeling van het aantal cellen gebeurde met behulp van een spleetlamp op een oppervlakte van 1x1 mm2. De studie van Khan (2016) gebruikte een oppervlakte van 2x1 mm2. Het gemiddelde relatieve risico (RR) van de gepoolde studies voor aanwezigheid van ≥ 6 cellen in de voorste oogkamer was RR: 0,99 (95%BI= (0,90, 1,09); p= 0,84; ntotaal = 240), geen statistisch significant verschil tussen beide groepen.
Figuur 9 Uitkomstmaat cellen (# ogen >5 cellen in de VOK)
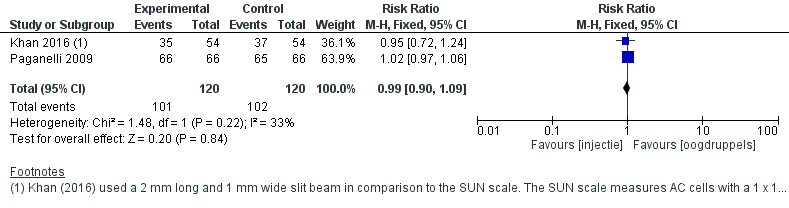
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn het aantal ogen
De studies die niet gepoold konden worden maar wel hetzelfde resultaat lieten zien rapporteerden cellen in de voorste oogkamer middels de SUN grading scale. Paganelli (2004) beoordeelde het aantal cellen vergelijkbaar met de SUN grading scale, maar presenteerde alleen een gemiddelde en beschreef geen standaarddeviatie. In vergelijking met de controlegroep was er geen significant verschil in gemiddelde scores tussen de interventiegroep en controlegroep na één week voor het aantal cellen in de voorste oogkamer (p= 0,989). Karalezli (2008) presenteerde de mediaan van de gradering van het aantal cellen samen met een range en vond geen statistisch significant verschil tussen de interventiegroep (1 (0 tot 2)) en controlegroep (1 (0 tot 2)) (p=0,71). Simaroj (2011) beoordeelde het aantal cellen in de voorste oogkamer met behulp van een indeling vergelijkbaar met de SUN grading scale. In de interventiegroep bevatten 83,3% (25/30) van de ogen (gradering ≥ 1+) cellen in de voorste oogkamer. In de controlegroep bevatten 90% (27/30) van de ogen (gradering ≥ 1+) cellen in de voorste oogkamer na een week. Het verschil tussen beide groepen was niet statistisch significant (p=0,33). Merkoudis (2014) maakte wel gebruik van de SUN grading scale, maar de resultaten werden beschreven als gemiddelde score en bijbehorende standaarddeviatie ten opzichte van baseline. Zowel de interventie- (0,6 ± 0,7) als de controlegroep (0,4 ± 0,6) lieten een lichte verbetering zien na één week ten opzichte van baseline, maar het verschil was niet statistisch significant (p= 0,49). Het verschil tussen de groepen werd statistisch niet getoetst.
Cellen in de voorste oogkamer na vier tot zes weken
Het verschil in het aantal cellen in de voorste oogkamer na een injectie in vergelijking met oogdruppels na één tot twee weken postoperatief is onderzocht in vijf RCT’s (Paganelli, 2004; Paganelli, 2009; Simaroj, 2001; Merkoudis, 2014; Khan, 2016). De resultaten konden niet worden gepoold. De studies van Simaroj (2011) en Merkoudis (2014) vonden een statistisch significant verschil in het aantal cellen in de voorste oogkamer tussen de interventie- en controlegroep, terwijl geen van de overige studies een statistisch significant verschil vond tussen de twee groepen na vier tot zes weken. De gemiddelde score op de SUN grading scale met bijbehorende range in de studie van Paganelli (2004) was 0,1 (0 tot 1) in beide groepen, geen statistisch significant verschil (p=1,000). De studie van Paganelli (2009) liet zien dat in de interventiegroep na één maand postoperatief 100% (66/66) van de ogen geen cellen meer bevatten in de voorste oogkamer. In de controlegroep bevatten 95,5% (63/66) van de ogen geen cellen in de voorste oogkamer en 4,5% (3/63) van de ogen bevatten 5 tot 9 cellen één maand postoperatief, wat statistisch niet significant verschillend was tussen de groepen (p=0,24). Simaroj (2011) beschreef evenals de studie van Paganelli (2009) het aantal cellen postoperatief, maar gebruikte een andere cut-off waarde. In de interventiegroep bevatten 3,3% (1/30) van de ogen 1 tot 5 cellen in de voorste oogkamer, terwijl in de controlegroep 30% (9/30) 1 tot 5 cellen in de voorste oogkamer bevatten na één maand postoperatief. Dit resulteerde in een statistisch significant verschil tussen de groepen (p=0,006). Merkoudis (2014) beschreef een gemiddelde van 0,2 ± 0,2 en 0,4 ± 0,5 voor de gemiddelde score op de SUN grading scale en vond een statistisch significant verschil tussen beide groepen van p=0,01. In de studie van Khan (2016) werden na zes weken postoperatief in zowel de interventie- (n=0) als controlegroep (n=0) geen cellen gevonden in de voorste oogkamer.
Flare (photons/ms) na één tot twee weken
De uitkomstmaat FLARE (photons/ms) na de interventie met een injectie in vergelijking met oogdruppels na één tot twee weken is onderzocht in twee RCT’s (Negi, 2006; Lindholm, 2019). De resultaten konden worden gepoold (figuur 10). Het gemiddelde verschil in flare (photons/ms) na één tot twee weken tussen beide groepen was -2,83 (photons/ms) (95%BI= (-8,40; 2,74); p=0,32), geen statistische significantie in het voordeel van de interventiegroep (injectie).
Figuur 10 Uitkomstmaat Flare (ph/ms) na één tot twee weken
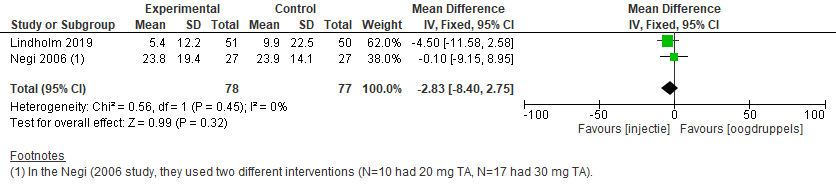
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn het aantal ogen
Flare (SUN grading scale) na één tot twee weken
De uitkomstmaat Flare (gemeten met de SUN grading scale) na de interventie met een injectie in vergelijking met oogdruppels na één tot twee weken is onderzocht in vijf RCT’s (Paganelli, 2004; Karalezli, 2008; Paganelli, 2009; Merkoudis, 2014; Khan, 2016), waarbij de resultaten van twee studies konden worden gepoold (Paganelli, 2009; Khan, 2016) (figuur 11). Geen van de studies vond een statistisch significant verschil in flare tussen de interventie- en controlegroep na één tot twee weken postoperatief. Het gemiddelde relatieve risico (RR) van de gepoolde studies voor een SUN grading scale score van ≥ 2+ was RR: 0,76 (95%BI= (0,39, 1,51); p= 0,44; ntotaal = 240).
Figuur 11 Uitkomstmaat Flare (SUN grading scale)
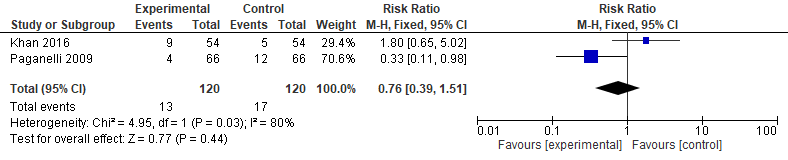
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn het aantal ogen
Paganelli (2004) beoordeelde flare na één week met een gemiddelde score (plus een range) op de SUN grading scale. De studie liet een gemiddelde zien van 0,3 (0 tot 1) in de interventiegroep en 0,2 (0 tot 1) in de controlegroep, geen statistisch significant verschil (p=0,863). De data uit de studie van Karalezli (2008) gaf een mediaanscore met bijbehorende range van 0 (0 tot 1) voor de interventiegroep en eenzelfde waarde voor de controlegroep en vond geen statistisch significant verschil na één week (p=0,45). De studie van Merkoudis (2014) beoordeelde flare op basis van de gemiddelde score en standaarddeviatie op de SUN grading scale. De gemiddelde toename op de SUN grading scale score en standaarddeviatie voor flare na één week ten opzichte van baseline bedroeg 0,4 ± 0,6 voor de interventiegroep en 0,3 ± 0,4 voor de controlegroep, geen statistisch significant verschil tussen beide groepen (p=0,57).
Flare (photons/ms) na vier tot zes weken
De uitkomstmaat flare (photons/ms) na een injectie in vergelijking met oogdruppels na vier tot zes weken werd onderzocht in drie studies (Negi, 2006; Dieleman, 2011; Lindholm, 2019). De resultaten van de drie studies konden worden gepoold (figuur 12). Het gemiddelde verschil in flare (photons/ms) na vier tot zes weken tussen beide groepen was -0,57 (photons/ms) (95%BI= (-0,98; 2,13); p=0,47), geen statistische significantie in het voordeel van de interventiegroep (injectie).
Figuur 12 Uitkomstmaat Flare (ph/ms) na vier tot zes weken
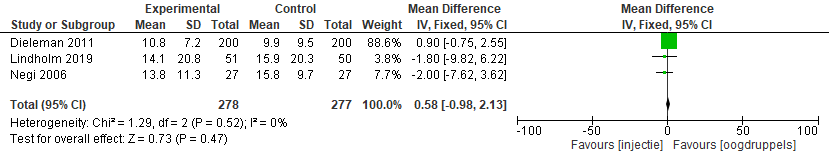
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; Totalen zijn het aantal ogen
Flare (SUN Grade) na vier tot zes weken
De uitkomstmaat flare (SUN grading scale) na de interventie met een injectie in vergelijking met oogdruppels na vier tot zes weken werd onderzocht in vier RCT’s (Paganelli, 2004; Paganelli, 2009; Merkoudis, 2014; Khan, 2016). De resultaten van de studies konden niet worden gepoold vanwege heterogeniteit in de uitkomstmaten. De gemiddelde score op de SUN grading scale met bijbehorende range na vier weken in de studie van Paganelli (2004) was 0,0 (0 tot 0) in beide groepen, geen statistisch significant verschil (p=1,000). De studie van Paganelli (2009) rapporteerde bij 98,5% (65/66) van de patiënten een gradering van 0 (complete absence) en bij 1,5% (1/66) van de patiënten een gradering van 1+ (faint flaire) in de interventiegroep. In de controlegroep werd bij (63/66) van de patiënten een gradering van 0 gevonden en bij (3/66) een gradering van flare van 1+. Er werd geen statistisch significant verschil gevonden tussen beide groepen (p=0,62). De gemiddelde score en range op de SUN grading scale in de studie van Merkoudis (2014) was 0,04 ± 0,2 in de interventiegroep en 0,1 ± 0,3 in de controlegroep, wat niet resulteerde in een statistisch significant verschil tussen de beiden groepen. Khan (2016) rapporteerde dat zowel in de interventiegroep als in de controlegroep er geen sprake was van postoperatieve flare na zes weken.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat cystoïd macula oedeem is niet verlaagd voor risk of bias omdat dit al gedisconteerd zit in het starten op een laag niveau bij observationeel onderzoek. Er wordt ook niet afgetrokken voor inconsistentie, publicatiebias, of indirectheid. Wel wordt er afgetrokken voor imprecisie (overlap van het 95% betrouwbaarheidsinterval met de grenzen voor klinische relevantie.) Vanwege het studiedesign is het startpunt GRADE ‘LAAG’, de uiteindelijke bewijskracht komt uit op GRADE ‘ZEER LAAG’.
De bewijskracht voor de uitkomstmaat cellen in de voorste oogkamer na één tot twee weken startte op ‘HOOG’ vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (blindering van beoordelend onderzoeker is niet in alle studies beschreven). Vanwege het grote aantal cases in de analyse (> 200 totaal) wordt voor imprecisie niet afgewaardeerd. Er is geen sprake van inconsistentie. Hiervoor wordt dus ook niet voor afgewaardeerd. De bewijskracht is REDELIJK.
De bewijskracht voor de uitkomstmaat cellen in de voorste oogkamer na vier tot zes weken startte op ‘HOOG” vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is vervolgens met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (blindering van de beoordelend onderzoeker is niet in alle studies beschreven); en één niveau verlaagd vanwege inconsistentie van de resultaten. De bewijskracht is LAAG.
De bewijskracht voor de uitkomstmaat flare na één tot twee weken startte op ‘HOOG” vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is vervolgens met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (blindering van beoordelend onderzoeker is niet beschreven in alle studies); één niveau verlaagd vanwege imprecisie (gering aantal patiënten). Er is geen sprake van inconsistentie van de resultaten, waardoor hier niet voor wordt afgewaardeerd. De bewijskracht is LAAG.
De bewijskracht voor de uitkomstmaat FLARE na vier tot zes weken startte op ‘HOOG” vanwege het gerandomiseerde onderzoeksdesign van de geïncludeerde studies; is vervolgens met één niveau verlaagd gezien beperkingen in de onderzoeksopzet (blindering van beoordelend onderzoeker niet in alle studies beschreven); Er is geen sprake van imprecisie vanwege het grote aantal patiënten in de analyse (> 200) en de smalle betrouwbaarheidsintervallen. Er is geen sprake van inconsistentie van de onderzoeksresultaten, waardoor hier niet voor wordt afgewaardeerd. De bewijskracht is REDELIJK.
Zoeken en selecteren
Deelvraag 1: Welke profylaxe dient bij een cataractoperatie gebruikt te worden om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken? (Kan worden volstaan met alleen steroïden of NSAIDs druppels, of is de combinatie noodzakelijk?)
PICO 1.1
P: patiënten > 18 jaar zonder diabetes mellitus die cataractchirurgie ondergaan;
I: NSAIDs oogdruppels;
C: corticosteroïden oogdruppels;
O: postoperatieve ontsteking (cellen in de voorste oogkamer en tyndall/flare), cystoïd macula oedeem.
PICO 1.2
P: patiënten > 18 jaar zonder diabetes mellitus die cataractchirurgie ondergaan;
I: combinatie corticosteroïden en NSAIDs oogdruppels;
C: corticosteroïden oogdruppels;
O: postoperatieve ontsteking (cellen in de voorste oogkamer en tyndall/flare), cystoïd macula oedeem.
PICO 1.3
P: patiënten > 18 jaar zonder diabetes mellitus die cataractchirurgie ondergaan;
I: combinatie corticosteroïden en NSAIDs oogdruppels;
C: NSAIDs oogdruppels;
O: postoperatieve ontsteking (cellen in de voorste oogkamer en tyndall/flare), cystoïd macula oedeem.
Deelvraag 2: Is peroperatief gebruik van ontstekingsprofylaxe even effectief als postoperatief gebruik om de kans op postoperatieve ontsteking/ CMO tot een minimum te beperken na een cataract extractie?
PICO 2:
P: patiënten > 18 jaar zonder diabetes mellitus die cataractchirurgie ondergaan;
I: corticosteroïden en/of NSAID injectie peroperatief;
C: corticosteroïden en/of NSAIDs oogdruppels;
O: postoperatieve ontsteking (cellen in de voorste oogkamer en tyndall/flare), cystoïd macula oedeem.
Relevante uitkomstmaten
Voor beide deelvragen achtte de werkgroep cystoïd macula oedeem na 1 maand (4 tot-6 weken) een cruciale uitkomstmaat en cellen/flare na 1 week voor de besluitvorming belangrijke uitkomstmaten. Voor deelvraag 2 achtte de werkgroep cystoïd macula oedeem na 1 maand (4 tot 6 weken) een cruciale uitkomstmaat en cellen/flare na 1 week en na 4 tot 6 weken voor de besluitvorming belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- Macula oedeem op basis van 1) central subfield thickness (µm); 2) wel/geen CME of 3) wel/ geen clinically significant macular edema (CME plus visusdaling).
- Cellen in de voorste oogkamer (VOK): het aantal cellen/0,075 mm3 of het aantal cellen gegradeerd volgens de SUNscale: 0 (< 1 cel); 0,5+ (1 tot 5 cellen); 1+ (6 tot 15 cellen); 2+ (16 tot 25 cellen); 3+ (26 tot 50 cellen); 4+ (> 50 cellen) (Standardization of Uveïtis Nomenclature scale (SUN) (Hornbeak, 2014)).
- Flare in de VOK: in fotonen/ms of gegradeerd volgens de SUN scale: 0: geen/trace; 1+ Faint; 2+: moderate (iris en lens details clear); 3+: marked (iris and lens details hazy); Intense (fibrin or plastic aqueous). Standardization of Uveïtis Nomenclature scale (SUN) (Hornbeak, 2014)
De werkgroep definieerde voor ontstekingsactiviteit het volgende als een klinisch relevant verschil: het optreden van cystoïd macula oedeem en een verschil van 10 µm in centrale retinale dikte, een verandering van één stap op de SUN scale (SUN, 2005), een verschil van 10 photonen/ miliseconde, een verschil van 6 cellen / 0,075mm3, een risk ratio van < 0,80 of > 1,25 voor aanwezigheid of afwezigheid van cellen.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID), Embase (via Embase.com) is op 17 oktober 2019 met relevante zoektermen gezocht naar systematische reviews en gerandomiseerd gecontroleerd onderzoek (RCT’s) gepubliceerd na 2011 (de vorige richtlijn). De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 362 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in ten minste twee relevante databases, risk of bias beoordeling aanwezig en de resultaten van individuele studies voldoende gepresenteerd) of RCT of observationeel onderzoek waarin een vergelijking is gemaakt 1) tussen corticosteroïden of NSAIDs oogdruppels en combinatie corticosteroïden en NSAIDs oogdruppels of 2) corticosteroïden en/of NSAID injectie peroperatief en corticosteroïden en NSAIDs oogdruppels bij > 20 (10 per arm) patiënten met een vergelijkbaar antibiotica beleid in beide groepen. Daarnaast moest tenminste één van de bovengenoemde uitkomstmaten zijn gerapporteerd. Aanvullend werd voor deelvraag 2 een extra search gedaan voor observationeel onderzoek beperkend op de uitkomstmaat cystoïd macula oedeem. Deze aanvullende literatuurzoekactie leverde 303 treffers op.
Op basis van titel en abstract werden in eerste instantie 62 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 44 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 18 studies definitief geselecteerd.
Resultaten
Twintig onderzoeken zijn opgenomen in de literatuuranalyse; zes voor deelvraag 1 en 12 voor deelvraag 2. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Athanasiadis, Y., Tsatsos, M., Sharma, A., & Hossain, P. (2013). Subconjunctival triamcinolone acetonide in the management of ocular inflammatory disease. Journal of ocular pharmacology and therapeutics, 29(6), 516-522.
- Campa, C., Salsini, G., & Perri, P. (2018). Comparison of the efficacy of dexamethasone, nepafenac, and bromfenac for preventing pseudophakic cystoïd macular edema: an open-label, prospective, randomized controlled trial. Current eye research, 43(3), 362-367.
- Coassin, M., De Maria, M., Mastrofilippo, V., Braglia, L., Cimino, L., Sartori, A., & Fontana, L. (2019). Anterior Chamber Inflammation After Cataract Surgery: A Randomized Clinical Trial Comparing Bromfenac 0.09% to Dexamethasone 0.1%. Advances in therapy, 36(10), 2712-2722.
- Dieleman, M., Wubbels, R. J., van Kooten-Noordzij, M., & de Waard, P. W. (2011). Single perioperative subconjunctival steroïd depot versus postoperative steroïd eyedrops to prevent intraocular inflammation and macular edema after cataract surgery. Journal of Cataract & Refractive Surgery, 37(9), 1589-1597.
- Giannaccare, G., Finzi, A., Sebastiani, S., Greco, F., Versura, P., & Campos, E. C. (2018). The comparative efficacy and tolerability of diclofenac 0.1% and bromfenac 0.09% ophthalmic solutions after cataract surgery. Current eye research, 43(12), 1445-1453.
- Juthani, V. V., Clearfield, E., & Chuck, R. S. (2017). Non‐steroïdal anti‐inflammatory drugs versus corticosteroïds for controlling inflammation after uncomplicated cataract surgery. Cochrane Database of Systematic Reviews, (7).
- Karalezli, A., Borazan, M., & Akova, Y. A. (2008). Intracameral triamcinolone acetonide to control postoperative inflammation following cataract surgery with phacoemulsification. Acta ophthalmologica, 86(2), 183-187.
- Khan, H., Alam, M., & Khan, A. (2016). Comparison of the safety and efficacy of single injection of subtenon triamcinolone and topical dexamethasone in reducing postoperative inflammation after phacoemulsification and intraocular lens implantation. Group, 1(1), 2.
- Lindholm, J. M., Taipale, C., Ylinen, P., & Tuuminen, R. (2019). Perioperative subconjunctival triamcinolone acetonide injection for prevention of inflammation and macular oedema after cataract surgery. Acta Ophthalmologica.
- Merkoudis, N., Wikberg Matsson, A., & Granstam, E. (2014). Comparison of peroperative subconjunctival injection of methylprednisolone and standard postoperative steroïd drops after uneventful cataract surgery. Acta ophthalmologica, 92(7), 623-628.
- Negi, A. K., Browning, A. C., & Vernon, S. A. (2006). Single perioperative triamcinolone injection versus standard postoperative steroïd drops after uneventful phacoemulsification surgery: Randomized controlled trial. Journal of Cataract & Refractive Surgery, 32(3), 468-474.
- Paganelli, F., Cardillo, J. A., Melo Jr, L. A., Oliveira, A. G., Skaf, M., Costa, R. A., & Pharmaceutical Technology Research Group. (2004). A single intraoperative sub–Tenon's capsule triamcinolone acetonide injection for the treatment of post–cataract surgery inflammation. Ophthalmology, 111(11), 2102-2108.
- Paganelli, F., Cardillo, J. A., Melo, L. A., Lucena, D. R., Silva, A. A., Oliveira, A. G.,... & Belfort, R. (2009). A single intraoperative sub-Tenon’s capsule injection of triamcinolone and ciprofloxacin in a controlled-release system for cataract surgery. Investigative ophthalmology & visual science, 50(7), 3041-3047.
- Shorstein, N. H., Liu, L., Waxman, M. D., & Herrinton, L. J. (2015). Comparative effectiveness of three prophylactic strategies to prevent clinical macular edema after phacoemulsification surgery. Ophthalmology, 122(12), 2450-2456.Simaroj, P., Sinsawad, P., & Lekhanont, K. (2011). Effects of intracameral triamcinolone and gentamicin injections following cataract surgery. Journal of the Medical Association of Thailand, 94(7), 819.
- Simaroj, P., Sinsawad, P., & Lekhanont, K. (2011). Effects of intracameral triamcinolone and gentamicin injections following cataract surgery. Journal of the Medical Association of Thailand, 94(7), 819.
- Simons et al. Economic evaluation of prevention of cystoïd macular edema after cataract surgery in nondiabetic patients: ESCRS PREMED study report 4. Submitted 2020.
- Simons, R. W., Visser, N., van den Biggelaar, F. J., Nuijts, R. M., Webers, C. A., Bauer, N. J.,... & Dirksen, C. D. (2019). Trial-based cost-effectiveness analysis of toric versus monofocal intraocular lenses in cataract patients with bilateral corneal astigmatism in the Netherlands. Journal of Cataract & Refractive Surgery, 45(2), 146-152.
- Singhal, R., Luo, A., O'Rourke, T., Scott, I. U., & Pantanelli, S. M. (2019). Transzonular Triamcinolone–Moxifloxacin Versus Topical Drops for the Prophylaxis of Postoperative Inflammation After Cataract Surgery. Journal of Ocular Pharmacology and Therapeutics, 35(10), 565-570.
- Tyson, S. L., Bailey, R., Roman, J. S., Zhan, T., Hark, L. A., & Haller, J. A. (2017). Clinical outcomes after injection of a compounded pharmaceutical for prophylaxis after cataract surgery: a large-scale review. Current opinion in ophthalmology, 28(1), 73.
- Wielders, L. H., Schouten, J. S., Winkens, B., Van Den Biggelaar, F. J., Veldhuizen, C. A., Findl, O.,... & Henry, Y. P. (2018). European multicenter trial of the prevention of cystoïd macular edema after cataract surgery in nondiabetics: ESCRS PREMED study report 1. Journal of Cataract & Refractive Surgery, 44(4), 429-439.
- Ylinen, P., Holmström, E., Laine, I., Lindholm, J. M., & Tuuminen, R. (2018). Anti‐inflammatory medication following cataract surgery: a randomized trial between preservative‐free dexamethasone, diclofenac and their combination. Acta ophthalmologica, 96(5), 486-493.
Evidence tabellen
PICO 1
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
Comments |
|
Juthani, 2017
[individual study characteristics deduced from [1st author, year of publication ]]
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of [RCTs / cohort / case-control studies]
Literature search up to [December/2016]
Pico 1.1 A: Bucci, 2001 B: Holzer, 2002 C: Roberts, 1995 D: Asano, 2008 E: Miyake, 2007 F: Miyake, 2011 Z: Laurell, 2002
PICO 1.1 and 1.2 G: Miyanaga, 2009
Pico 1.2 H: Chen, 2015 I: Donnenfeld, 2006 J: Jung, 2015 K: Li, 2011 L: Moschos, 2012 M: Ticly, 2014 N: Wittpenn, 2008 O: Zaczek, 2014
Mixed population: (non-diabetes + diabetes): E, F, N
Study design: RCT ‘s A: abstract?
Setting and Country: A: NR B: USA C: NR D: Japan E: Japan F: Japan G: Japan H: China I: NR J: South Korea K: China L: Greece M: Brazil N: USA O: Sweden Z: Sweden
Source of funding and conflicts of interest: [commercial / non-commercial / industrial co-authorship] A: NR B: unrestricted grant from Allergan Inc.. No interests stated. C: grants non commercial, no interests or conflicts stated D: funding NR, no conflicts stated E: funding NR, no disclosures F: funding NR, disclosures: consultants to Alcon G: NR H: funding NR, co disclosures I: funding not reported. Disclosures: authors are consultants Allergan J: non-commercial funding. No financial conflicts of interest K: NR L: funding not reported. No disclosures M: funding NR, no financial disclosures N: unrestricted educational grant Allergan. State no financial disclosure. Autors are consultants Allergan O: commercial (allergan) and non-commercial grant. Stated no financial interest Z: Alcon and Leiras provided drug, the pharmacy at St Göran’s Hospital, Stockholm provided masked bottles. “The authors have no proprietary interest in any of the products or equipment mentioned in this article” |
Inclusion criteria SR: RCTs in which participants were undergoing phacoemulsification for uncomplicated cataract extraction. We included both trials in which topical NSAIDs were compared with topical corticosteroids and trials in which combination therapy (topical NSAIDs and corticosteroids) was compared with topical corticosteroids alone. The primary outcomes for this review were inflammation and best-corrected visual acuity (BCVA).
17 studies included
Important patient characteristics at baseline: Number of patients; characteristics important to the research question and/or for statistical adjustment (confounding in cohort studies); for example, age, sex, bmi,...
N, mean age A: 62 eyes, age NR B: 30 (67.3 yrs) / 30 (68.5 yrs C: 25/27 eyes pts, age NR D: 75/75 eyes 66.07±5.51 / 66.23±5.55 yrs E: 31/31 (65.4±7.0 / 65.8±7.1 F: N=30/30; 53.3% 18-64y, 46.7% ≥65y / 41.4% 18-64y, 58.6% ≥65y G: I1: 25; I2: 24 C: 23; I1: 73.6 (48-86) I2: 71.4 (46-86), C: 69.7 (41-83) H: 50pts, 60 eyes / 50 pts, 60 eyes. 72.08±9.68 / 75.12 ±9.42 I: 25/25/25/25. 72.8±8.5 J: 28/32/31. 66.9 ± 8.5years K: 104/113; 72.2±10.8 / 71.6 ± 8.5 y L: 38/41; 76.68 ±10.72 / 76.71 ±8.82 M: 37/44; 67.1 ± 10.8 / 66.1 ±8.7 N: 268/278; 70 yrs O: 75/77; 70.4 ± 7.4 / 68.3± 7.5 Z: 64-85 y
Sex: A: NR B: 35% male C: NR D: I: 43.6 % / 45% male E: 52% / 40% male F: 53.5% / 55.2% male G: I1: 32% male C: 26% male, I2: 29% male H: 50% / 53% male I: 45% male J: 45.1% male K: 66.3% / 59.3% male L: 31.6% / 36.6% male M: 56.8% / 50% male N: 46.7% male O: 36% / 35.1% male Z: 67% / 63% male
Groups comparable at baseline? A: NR B: yes C: NR D: yes E: yes F: yes G: yes H: yes I: yes J: yes K: yes L: yes M: yes N: yes O: yes Z: yes |
Describe intervention: PICO 1.1: NSAID’s
A: Ketorolac, 4x /day B: ketorolac tromethamine 0.5% ophthalmic solution 4 drops / day for 1 week, 2 2 drops/day for the remainder of the study C: diclofenac sodium 0.1% 4 x/ day D: diclofenac 0.1% 3 hours, 2 hours, 1 hour, and 30 minutes before surgery and 3 times a day for 8 weeks after surgery
E: topical diclofenac 0.1% 4 times before surgery and 3 times daily for 5 weeks after surgery F: nepafenac 0.1% 1 drop 3 times a day from 1 day before surgery until 5 weeks after surgery Z: diclofenac sodium 0.1% 4 times daily for 1 week and then 2 times daily for 3 weeks
G I1: 0.1% bromfenac 2 times daily for 2 months
PICO 1.2 NSAID’s + corticosteroids
G I2: combined 0.1% bromfenac 2 times daily for 2 months plus 0.1% betamethasone 4 times daily for 1 month and then fluorometholone 4 times daily for 1 month
H: bromfenac sodium 0.1% twice daily for 1 to 3 days preoperatively and 2 weeks postoperatively plus dexamethasone 4 times daily for 1 week postoperation and 3 times daily for another week all participants also received the antibiotics tobramycin 4 or 6 times daily for 1 week postoperation and 3 or 4 times daily for another week and levofloxacin
I: ketorolac tromethamine 0.4% 4 times daily (I1 &I2) OR every 15 min (I3) for 1 day (I1) OR 3 days (I2) preoperatively and 3 times (I1) OR 1 time (I2) every 15 minutes OR in the hour before surgery and 4 times daily for 3 weeks after surgery plus topical prednisolone acetate 1% 4 times a day for 2 weeks after surgery then twice a day for 1 additional week
J: I1: 1 drop of bromfenac sodium hydrate ophthalmic solution 0.1% twice daily beginning 3 days before surgery and 2 drops at 20-minute intervals 2 hours before surgery plus prednisolone acetate 1% applied 4 times daily for 4 weeks I2: 1 drop of ketorolac 0.45% ophthalmic solution twice-daily beginning 1 day prior to cataract surgery and 2 drops at 20-minute intervals 2 hours before surgery, with continued application twice-daily throughout the first 2 postoperative weeks plus prednisolone acetate 1% applied 4 times daily for 4 weeks K: diclofenac 1%for 4 weeks postoperatively and dexamethasone 4 times daily for 1 day preoperatively and 4 weeks postoperatively L: diclofenac 0.1% 1 drop 3 times a day plus dexamethasone 0.1% 1 drop 4 times a day M: ketorolac tromethamine 0.4% 4 times daily for 3 days before surgery and 5 weeks postoperatively and prednisolone acetate 1% 4 times daily N: ketorolac 0.4% plus prednisolone 1% O: nepafenac ophthalmic suspension 0.1% starting 2 days before surgery and given 30 minutes before surgery 3 times 5 minutes apart and dexamethasone 0.1% 3 times a day for 3 weeks after surgery
|
Describe control: PICO 1.1 vs corticosteroids
A: Rimexolone 4x/day B: loteprednol etabonate 0.5% ophthalmic suspension 4 drops/ day for 1 week, 2 drops/day for the remainder of the study C: prednisolone acetate 1% x/ day D: topical betamethasone 0.1% 3 hours, 2 hours, 1 hour, and 30 minutes before surgery and 3 times a day for 8 weeks after surgery E: fluorometholone 0.1% 4 times before surgery and 3 times daily for 5 weeks after surgery F: fluorometholone 0.1% 1 drop 3 times a day from 1 day before surgery until 5 weeks after surgery Z: postoperative treatment with dexamethasone phosphate 0.1% 4 times daily for 1 week and then 2 times daily for 3 weeks
G: C 0.1% betamethasone 4 times daily for 1 month and then fluorometholone 4 times daily for 1 month
PICO 1.2 vs corticosteroids
H: dexamethasone 6 times daily for 1 week postoperation and 4 times daily for another week. all participants also received the antibiotics tobramycin 4 or 6 times daily for 1 week postoperation and 3 or 4 times daily for another week and levofloxacin
I: vehicle every 15 minutes in the hour before surgery and topical prednisolone acetate 1% 4 times a day for 2 weeks after surgery then twice a day for 1 additional week
J: prednisolone acetate 1% eye drops applied 4 times daily for 4 weeks
K: dexamethasone 4 times daily for 4 weeks postoperatively
L: dexamethasone 0.1% 1 drop 4 times a day
M: hypromellose/dextran 70 as a placebo 4 times daily for 3 days before surgery plus prednisolone acetate 1% 4 times daily
N: prednisolone acetate 1% O: dexamethasone 0.1% 3 times a day for 3 weeks after surgery and a placebo (dextran 70-hypromellose (Tears Naturale II Polyquad)) starting 2 days before surgery and given 30 minutes before surgery 3 times 5 minutes apart
|
End-point of follow-up:
A: 1d, 1 w, 2 weeks B: 1, 4, 7, 30 days C: 1d, 1w, 1 mo D: 1, 3 d, 1,2,5,8 weeks E: 2d, 1,2,5 weeks F: 1d, 1,2,5 weeks Z:1,3,8d, 2,4w, 2,6 mo, 1,2,4 y G: 1,2,3 d, 1,2 w, 1,2 mo H: 1,7,14 d I: 1d, 2w, 3 mo J: 1, 7, 28 days K: 1d, 1, 4 weeks L: 1,14,28 days M: 1d, 5 w N: 1d, 1, 4 w O: 1d, 3,6 weeks
For how many participants were no complete outcome data available? (intervention/control) A: NR B: 59 (1 excluded, pre-existing preoperative epithelial defect). N=3 intervention and N=1 control missed the 3-day follow-up, and 1 participant in each group missed the 7-day follow-up C: 52 (no loss) D: 71/71, NSAID: total 4: 1 due to “complications”, 3 due to “discontinuation proposal (there were patients who withdrew their consent during the course of this study)”; corticosteroid: total 4: 1 due to “complications”, 2 due to “discontinuation proposal”, 1 who “did not return to the hospital 2 weeks after surgery” E: 25/25 (losses NR) F: 30/29 (1 drop out macula degeneration) Z: 9 excl after ran G: 1 participant in the corticosteroid group developed CME at 1 month after cataract surgery in the left eye and was withdrawn from the study H: 120 eyes (no loss to FU) I: 100 eyes of 100 pts(no loss to FU) J: NR K: NR L: NR M: No loss to FU N: 5 were lost to follow-up prior to surgery, 11 were discontinued due to adverse events O: 1 in control
|
PICO 1.1
Outcome measure-1 Defined as Cells VOK (one week) # cells /0.075 mm3
Effect measure: mean difference [95% CI]: A: -2.70 [-6.62, 1.22] B: -0.92 [-3.61, 1.77] C: 0.34 [-1.94, 2.62]
Pooled effect (random effects model): -0.60 [95% CI -2.19 to 0.99] favoring NSAIDS (I) Heterogeneity (I2): 0% GRADE moderate (-1 RoB)
Outcome measure-2 Mean flare values (one week), photons/milisecond D: -3.55 [-7.03, -0.07] A: -11.50 [ -21.79, -1.21] E: -15.5 [-22.96, -8.04] F: -35.40 [ -44.17, -26.63] C: -6.91 [-9.07; -4.75]
Pooled effect (random effects model): -13.74 [95% CI -21.45 to -6.04] favoring NSAIDS (I) Heterogeneity (I2): 92% GRADE: low, -1 RoB, -1 inconsistency Deduced from individual study: G:I:8.1 (2.8) n=25; C: 9.7 (7.5) n=23; Z: 7.9 (2.5), n=59; 8.6 (7.5), n=59)
Outcome measure-3 Macula oedema (one month), Effect measure: RR [95% CI]: D: 0.33 [0.19, 0.55] E: 0.08 [0.01, 0.59] F: 0.18 [0.07, 0.44] G: 0.31 [0.01, 7.20]
Defined as: The proportion of participants with CME, as measured by ocular coherence tomography or fluorescein angiography, at oneweek after surgery. (Cystoid macular edema is frequently used as a surrogate for active intraocular inflammation.) We used definitions of CME as defined by the study authors, for example, any dye leakage or dye accumulation captured by fluorescein angiography
Pooled effect (random effects model): 0.26 [95% CI 0.17 to 0.41] favoring NSAIDS (I) Heterogeneity (I2): 0%
GRADE: low, -1 RoB,, 1- indirectness (the time point at which the study data were reported was one month rather than one week, and two of the studies, which made up 30%of the weight, used a weak corticosteroid in theircomparison.)
PICO 1.2
Outcome measure-1 Defined as Cells VOK (one week) Not described in review
Outcome measure-2 Mean flare values (one week) Not described in review.
G: I: 7.5 (3.8); C: 9.7 (7.5); Deduced from individual study:
Outcome measure-3 Macular edema (one week) Effect measure: RR [95% CI]: H: 0.33 [0.01, 8.02] I: 0.11 [0.01, 1.02]
Pooled effect (fixed effects model): 0.17 [95% CI 0.03 to 0.97] favoring combination Heterogeneity (I2): 0% GRADE: low, -1 inconsistency, -1 imprecisie (small number of events)
Macular edema (one month) Effect measure: RR [95% CI]: J: not est K: 0.54 [ 0.21, 1.40] G: 0.32 [ 0.01, 7.48] L: not est M: 1.19 [0.18, 8.04] N: 0.09 [0.01, 1.70] N:0.21 [0.01, 4.21]
Pooled effect (fixed effects model): 0.50 [95% CI 0.23 to 1.06] favoring combination Heterogeneity (I2): 0% No grade?
I: 1/75; C: 3/25
|
Facultative:
Brief description of author’s conclusion: “we could not conclude the equivalence or superiority of NSAIDs with or without corticosteroids versus corticosteroids alone. There may be some risk reduction of CME in the NSAID-alone group and the combination of NSAID plus corticosteroid group’
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question
Level of evidence: GRADE (per comparison and outcome measure) including reasons for down/upgrading PICO 1.1 Cells Flare Macular edema
PICO 1.2 Cells Flare Macular edema
Z. Unclear (masking outcome assessment), high (incomplete outcome data, selective reporting), other low risk
Sensitivity analyses (excluding small studies; excluding studies with short follow-up; excluding low quality studies; relevant subgroup-analyses); mention only analyses which are of potential importance to the research question. Yes, Miyake 2011 was removed because of funding bias (did not change conclusion)
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis). Yes in types, doses and regimens of NSAIDs and corticosteroids |
Risk of bias tabel
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Juthani, 2017 |
Yes |
Yes |
Yes |
Yes |
NA |
Yes |
Yes |
Yes |
yes |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Campa, 2018 |
using the method of randomly permuted blocks |
Unclear |
Likely, Not blinded |
Likely, Not blinded |
Likely, Not blinded |
Unlikely |
Unlikely |
Unlikely |
|
Coassin, 2019 |
randomized (1:1 ratio) using computer-generated randomization codes. |
Unlikely |
Lilkely, not blinded |
Lilkely, not blinded |
Unlikely, assessor blinded |
Unlikely |
Unlikely |
Unlikely |
|
Giannaccare, 2018 |
sequentially assigned to diclofenac or bromfenac in a 1:1 ratio according to a computer-generated randomization list. Group dexamethasone was not randomized! |
Unlikely |
Lilkely, not blinded |
Unlikely, surgeon was masked to randomization |
Unclear |
Likely, no measure of variation presented for foveal thickness |
Unlikely |
Unlikely |
|
Mc Cafferty, 2017 |
Subject’s eyes individually were randomly assigned by the compounding pharmacy using random number generator in groups of 10 to receive a placebo of sterile saline drops or nepafenac 0.3% |
Unlikely |
Unlikely, double-blind study |
Unlikely, double-blind study |
Unlikely |
Likely, pt characteristics not reported, values of intervention and control group not reported |
Unlikely |
Unlikely, intention to treat and safety analysis |
|
Wielders, 2018 |
Patients were randomly allocated to 1 of 3 treatment groups in a 1:1:1 ratio. Stratified block randomization was performed per study center by a local investigator using concealed online softwareB (ALEA, version 3.0, Formsvision BV) and a block size of 15 patients |
Unlikely, concealed |
Likely, patient were not blinded |
Unclear |
Unlikely, assessor was masked |
Unlikely |
Unlikely (<10% and comparable between groups) |
ITT analysis & per-protocol analysis compared.
Data were excluded from the per-protocol analyses if deviations from the allocated treatment intervention occurred |
|
Ylinen, 2018 |
After the cataract operation the research technician randomized the operated patient into a study group and distributed the marked envelopes accordingly |
The drug pipettes were covered with tape by hospital pharmacy and put into marked envelopes. |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
Likely, dropout 10-20% |
ITT and per-protocol analysis |
PICO 2
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Dieleman, 2011 |
Type of study: RCT
Setting and country: Eye hospital, Netherlands
Funding and conflicts of interest: Supported by the Research Foundation SWOO Flieringa, Rotterdam, The Netherlands. No author has a financial or proprietary interest in any material or method mentioned. |
Inclusion criteria: white patients scheduled for routine phacoemulsification
Exclusion criteria: mature, brunescent, or subcapsular posterior cataract; diabetes; age-related macular disease; corneal disease; glaucoma; presence of anterior synechiae; and a history of uveitis, chemotherapy, reaction to steroidal agents, or herpes simplex keratitis. Intraoperative exclusion criteria were posterior capsule rupture and iris manipulation.
N total at baseline: Intervention: 200 Control:200
Important prognostic factors2: age ± SD: I:72.3 (48-91) C:69.3 (41-87)
Sex: I: 63.5% F C: 57.5% F
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
a single subconjunctival injection of betamethasone acetate 5.7 mg/mL (Celestone Chronodose) in the inferior part of the bulbar conjunctiva at the end of surgery
|
Describe control (treatment/procedure/test):
dexamethasone 0.1% eyedrops 3 times daily for a postoperative period of 4 weeks starting the first day after surgery
|
Length of follow-up:baseline (pre-operative), 1d, 4w
Loss-to-follow-up: Intervention: N=19 (9.5%) Reasons: not meeting postsurgical inclusion criteria, refusal to have cataract surgery, withdrew consent, or lost to follow-up
Control: N=19 (9.5%) Reasons: not meeting postsurgical inclusion criteria, refusal to have cataract surgery, withdrew consent, or lost to follow-up
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1 Baseline – 4 weeks I: 8.7 ± 12.6 - 10.8 ± 7.2 C: 9.1 ±19.0 - 9.9 ± 9.5 P=0.003 (4 weeks))
Outcome measure2 Foveal center point thickness (µm) Not of interest?
Outcome measure 3 Incidence of macula edema On OCT (4 weeks) I: 14 (7%) C: 12 (6%) P=0.685
Outcome measure 4 Incidence of clinically significant macular edema I: 4/200 (2.1%) C: 7/200 (3.5%) P= 0.386
Outcome measure 5 Macular edema on OCT with cysts I: 10 (5%) C: 7 (3.5%) P=0.451
Adverse events: There were no serious adverse events, including endophthalmitis. However, subconjunctival hemorrhages occurred in both groups (16 in Group 1 and 17 in Group 2) on the first day of follow-up.
Outcome measure 6 Intraocular pressure Visit 1: Baseline – preoperative I: 16.1 ± 3.1 C: 16.0 ± 3.3 P=0.362
Visit 2: 1 day I: 15.9 ± 4.6 C: 15.1 ± 4.5 P=0.080
Visit 3: 4 weeks I: 14.2 ± 2.9 C: 14.0 ± 2.9 P=0.695 |
Aqueous flare values were measured with the laser flare meter for objective assessment of inflammatory activity in the anterior chamber. Seven consecutive aqueous flare measurements (photon counts per millisecond [photons / ms] were performed; the highest and lowest values were discarded an the remaining 5 measurements averaged. |
|
Khan, 2016 |
Type of study: RCT
Setting and country: Khyber Teaching Hospital, Peshawar, Pakistan
Funding and conflicts of interest: not reported. |
Inclusion criteria: Patients who had undergone uneventful phacoemulsification with IOL implantation by the same surgeon.
Exclusion criteria: Complicated cataracts, including cataracts with uveitis, pigment diesperson syndrome (PDS), pseudoexfoliation, lens-related glaucoma i.e. phacolytic and phacomorphic glaucoma, and patients less than 25 years of age were excluded.
N total at baseline: Intervention: 54 Control: 54
Important prognostic factors2: For example age ± SD: I: 57.77 ± 8.93 (range: 30 to 78 years) C: 58.87 ± 9.69 (range: 33 to 84 years)
Sex: I: 64.81 % M (n=35) C: 68.52 % M (n=37)
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
Patients of the intervention group received sub-tenon injection of triamcinolone at the end of surgery. Sub-tenon injection was performed at the inferotemporal quadrant in a single 40 mg (1.0 ml) dose.
* Both groups were also give tobramycin (0.3%) eye drops four times per day for 2 weeks.
|
Describe control (treatment/procedure/test):
Patients in the control group were started on dexamethasone (0.1%) eye drops on the 1st post-operative day, according to the following schedule: 4 times/day (week 1), 3 times/day (week 2), 2 times/day (week 3) and once daily (week 4).
* Both groups were also give tobramycin (0.3%) eye drops four times per day for 2 weeks.
|
Length of follow-up: baseline (pre-operative), 1st day, 14th day and 6 weeks post-operatively.
Loss-to-follow-up: Intervention: N=0 (0%) Reasons: none.
Control: N=0 (0%) Reasons: none.
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Flare (≥+2;) 1st day I: N=54 (100%) C: N=54 (100%)
14th day I: N=9 (16.66%)
6 weeks I: N=0
Outcome measure 2: I: AC cells were present in the eyes of 35 (64.81%) participants. C: AC cells were present in the eyes of 37 (68.52%). P=0.838
14th day I: AC were present in 3 (5.55%) eyes. C: AC were present in 4 (7.4%) eyes. p>0.999
6th week Six weeks after operation, no AC cells or aqueous flare was seen in any eye in either group.
Outcome measure 3: Baseline I: 14.52 ± 2.33) (range 11-20) C: 14.94 ± 2.24 (range 10-20) p=0.361.
1st day I: 14.28 ± 2.01 (range 10-19) C: 13.82 ± 1.95 (range 09-21) p=0.249.
14th day I: 14.74 ± 1.87 (range 11-20) p=0.132
6th week I: 15.00 ± 1.95 (range 12-21) C: 14.42 ± 2.15 (range 11-19) p=0.163.
Adverse events: none. |
Post-operative inflammation was measured in terms of grades of anterior chamber (AC) cells and grades of aqueous flare seen on slit lamp examination with a 2 mm long and 1 mm wide slit beam.
The following grading scale was used for AC cells:
Grade 0: <1 cells in field Cutt-off point Grade 2+: 16-25 cells Grade 3+: 26-50 cells Grade 4+ >50 cells
The following grading scale was used for aqueous flare description:
Grade +1: faint Cut-off point Grade 3+: marked (iris and lens detail hazy) |
|
Donnenfield, 2018 |
Type of study: Prospective randomized open-label multicentre trial
Setting and country: Eleven centers in the United States
Funding and conflicts of interest: not reported |
Inclusion criteria:
Verwijzen naar artikel. Heel veel criteria.
Exclusion criteria:
Verwijzen naar artikel. Heel veel criteria.
N total at baseline: Intervention: 130 Control: 64
Important prognostic factors2: For example age ± SD: I: 67.7 ± 8.95 C: 68.6 ± 10.24
Sex: I:46.8% M C: 43.6% M
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Patients received a single intraocular 5 mL injection of IBI10090 (dexamethasone suspension for intraocular injection, lot 504-001-003) at a concentration of 103.4 mg/mL dexamethasone for an equivalent dexamethasone dose of 517 mg immediately after surgery.
|
Describe control (treatment/procedure/test):
Patients-administered prednisolone acetate 1.0% ophthalmic suspension eyedrops (1 drop 4 times daily) for 3 weeks. |
Length of follow-up: 90 days postoperative
Loss-to-follow-up: Intervention: N=4 (3.2%) Reasons: Lost-to-follow -up: 1 Protocol deviation: 1 Withdrawal by patient: 1
Control: N 3(5.5%) Reasons: Lost-to-follow-up: 2 Adverse event: 1
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Anterior chamber cell grade (n; %)
1 day: Grade 0: n=18 (14.5%) Grade 2: n=38 (30.6%) Grade 3: n=18 (14.5%)
Controls: Grade 2: n=12 (21.8%) Grade 3: n=5 (9.1%)
1 week: Intervention group: Grade 0: n=65 (51.6%) Grade 2: n=7 (5.6%) Grade 3: n=1 (0.8%)
Controls: Grade 0: n=28 (51.9%) Grade 2: n=2 (3.7%) Grade 3: n=0
Outcome measure 2:
*Intraocular pressure in the study eye and the change from it from baseline is summarized descriptively by treatment group and timepoint
Overall, the IOP increase recovered/resolved in 13 patients; 1 patient required additional treatment with resolution by 8 days postoperatively. In all patients with increased pressure, the IOP measured 1 day postoperatively was less than 21 mm/Hg. |
Anterior chamber cell grade: Grade 1: 1 to 5 cells. Grade 3: 16 to 30+ cells. Grade 4: hypopyon.
|
|
Merkoudis, 2014 |
Type of study: prospective, randomized controlled study
Setting and country: Uppsala University Hospital, Sweden
Funding and conflicts of interest: not reported. |
Inclusion criteria:
Cataract (grad 1 to grade 3) according to the method stated in the Lens Opacities Classification System version III and age between 60 and 90 years.
Exclusion criteria:
Previous vitrectomy or other intraocular surgery; history of uveitis or evident intraocular inflammation; established glaucoma; corneal diseases; known steroid responder; preoperative IOP above 21 mmHg; known hypersensitivity to dexamethasone or methylprednisolone or any of their components; and ongoing local or systemic infection. Patients who were being treated with any of the following drugs were also excluded: cyclosporine, erythromycin, phenobarbital, itraconazole, ketoconazole, rifampicin, acetylsalicylate, oral anticoagulants, corticosteroids and non-steroidal anti-inflammatory drugs due to their potential interaction with medrol.
Intraoperative exclusion criteria were anterior chamber haemorrhage, posterior capsule rupture with or without vitreous prolapse, zonulolysis and iris manipulation.
N total at baseline: Intervention: 25 Control: 25
Important prognostic factors2: For example age ± SD: I: 74 (range 61-88) C: 75 (range 65-86)
Sex: I: 12/13 M/F C: 8/17 M/F
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Patients in the intervention group received 20 mg of methylprednisolone acetate [0.5 ml Depo-Medrol (40 mg/ml); Pfizer AB, Sollentuna, Sweden] by a single subconjunctival injection at the inferior part of the bulbar conjunctiva at the end of surgery.
|
Describe control (treatment/procedure/test):
Patients in the control group were instructed to administer dexamethasone 1 mg/ml eye drops (Isopto-maxidex; Alcon-Couvreur N.V., Puurs, Belgium) three times a day for a postoperative period of 2 weeks, starting on the first day after surgery, according to the Hospital’s standard clinical practice
|
Length of follow-up: 1 week (7 ± 2 days) and 1 month (30 ± 5 days) after cataract surgery
Loss-to-follow-up: Intervention: None N=0 (0%) Reasons: -
Control: None N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure: Intraocular inflammation and pressure
Outcome 1: Chamber cells 1-week visit
1 month visit
Pressure Baseline: I: 15.4 ± 2.2 mmHg C: 16.1 ± 2.7 mmHg P=0.32 (between groups)
1-week visit I: 14.1 ± 3.2 mmHg (range 9-21 mmHg), which was a statistically significant reduction of 1.3 ± 2.9 mmHg compared to baseline (p=0.03). C: 16.3 ± 2.6 mmHg (range 14-22 mmHg), which was not significantly different from the preoperative values (p=0.74). The intragroup difference in change was not statistically significant (p=0.09) at the 1-week visit.
1-month visit I: The mean IOP in the injection group remained unchanged (14.3 ± 2.6 mmHg (range 8–19 mmHg) compared to the 1-week visit (IOP change 0.2 ± 2.3 mmHg; p = 0.72) and was statistically significantly lower than at baseline (1.1 ± 2.5 mmHg; p = 0.03) C: The mean IOP was 15.6 ± 2.3 (range 11-19 mmHg), which was not statistically significantly different from baseline or at the 1-week visit (p=0.74).
At the end of the follow-up period, both groups showed lower IOP values than at baseline, although the intragroup changes were not statistically significant (p=0.36).
|
The anterior chamber inflammation (aqueous cells and flare) was evaluated in the biomicroscope according to the Standardization of Uveitis Nomenclature for reporting clinical data (Jabs et al. 2005). Inflammatory cells (aqueous cells) and the optical density of protein (aqueous flare) in the anterior chamber were reported independently on a scale from 0 to +4, using a field size of 1 mm x 1 mm slit beam.
|
|
Simaroj, 2011 |
Type of study: randomized, prospective study
Setting and country: Department of Ophtalmology, Ramathibodi Hospital, Bangkok, Thailand.
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Patients with uncomplicated senile cataract, scheduled to undergo phacoemulsification and foldable intraocular lens implantation.
Exclusion criteria:
Patients with glaucoma; family history with glaucoma; history of elevated intraocular pressure in response to topical ophthalmic steroid treatment; history of uveitis; previous eye trauma; previous intraocular surgery; diabetes mellitus; corneal endothelium disease, other anterior or posterior segment abnormalities, or cognitive impairment.
Patients were also excluded if they were monocular, experienced complications during cataract surgery, or were using oral or topical anti-inflammatory agents.
N total at baseline: Intervention: 30 Control: 30
Important prognostic factors2: For example age ± SD: I: 66.77 ± 8.29 C: 65.37 ± 7.97
Sex: I: 40% M (N=12) C:40% M (N=12)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Patients in the intervention group received single intracameral injections of TA (2 mag in 0.1 ml) and gentamicin (0.2 mg in 0.1 ml). In addition, they were also treated with topical tobramycin for one week.
|
Describe control (treatment/procedure/test):
Patients were instructed to administer postoperative topical 0.1% dexamethasone-0.3% tobramycin combination eye drops four times daily until the inflammation subsided. |
Length of follow-up: 1 day, 1 week and 1 month postoperatively
Loss-to-follow-up: Intervention: None N=0 (0%) Reasons: -
Control: None N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: intraocular pressure (IOP)
Baseline: I: 13.92 ± 2.25
1 day: I: 13.20 ± 1.88 P=0.63
1 week: C: 12.90 ± 2.16 P=0.27
1 month: I: 12.43 ± 1.87 C: 12.77 ± 2.05 P=0.51
Outcome measure 2: anterior chamber cell grade (N)
1 day: I: 30/30 eyes had trace of anterior chamber cells C: 30/30 eyes had trace of anterior chamber cells
1 week: I: 25/30 eyes had trace anterior chamber cells, 5/25 eyes had no cells. C: 27/30 eyes had trace anterior chamber cells, 3 eyes had no cells.
1 month: I: 1/30 eyes had trace of anterior chamber cells. C: 9/30 eyes had trace of anterior chamber cells P=0.006
|
The following grading scale was used: grade 0 = no cells. grade trace= 1-5 cells. grade 1+ = 6-10 cells. grade 2+ = 11-20 cells. grade 3+ = 21-50 cells. grade 4+ > 50 cells. |
|
Lindholm, 2019 |
Type of study: prospective, non-randomized controlled clinical trial
Setting and country: Kymenlaakso Central Hospital, Kotka, Finland
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Subjects were aged 60-90 years and were eligible for cataract surgery under the Current Care Guidelines of Cataract Surgery of the Finnish Medical Society, Duodecim (updated in year 2013).
Exclusion criteria:
Prior or active wet age-related macular degeneration; retinal vein/artery occlusion; retinal detachment; retinal necrosis; uveitis; endophthalimitis; vitreous haemorrhage; retinal phlebitis or optic neuritis; myopia above 6 dioptres; previous intraocular procedures; diabetes mellitus; a history of elevated intracranial pressure; alcohol abuse; thyroid disease with abnormal thyroid-stimulating hormone levels; continuous use of anti-inflammatory or immunomodulatory drugs; known or suspected sensitivity to any of the medications used in the operation or postoperatively; inability to use topical steroid drops as prescribed.
N total at baseline: Intervention: 53 (57 eyes) Control: 50 (52 eyes)
Important prognostic factors2: For example age ± SD: I: 74.7 ± 6.7 C: 74.5 ± 6.5
Sex: I: 47% M (N=16) C: 50% M (N=17)
Groups comparable at baseline? Yes
|
Describe intervention (treatment/procedure/test):
Patients received a single subconjunctival 0.5 ml injection of TA suspension (40 mg/ml.
|
Describe control (treatment/procedure/test):
Patients received the conventional treatment with topical DEX (1 mg/ml. |
Length of follow-up: 7 days, 28 days and 90 days postoperatively
Loss-to-follow-up: Intervention: N=2 (3.9%) Reasons: Failure to attend control visits; withdrawn at patient’s own request.
Control: N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Flare (photons/ms)
Baseline: P=0.829
7 days:
28 days: P=0.090
90 days: I: -0.2 ± 6.6 P=0.021
Outcome measure 2: Central retinal thickness
Baseline:
7 days: I: -9.2 ± 24.8
28 days:
90 days: I: -5.5 ± 33.4 C: 8.5 ± 24.4 P=0.026
Outcome measure 3: Intraocular pressure
Baseline: I: 15.4 ± 2.9 C: 14.0 ± 3.4 P=0.046
7 days: I: -3.5 ± 3.3 C: -2.7 ± 3.8 P=0.334
28 days: I: -3.1 ± 3.5 C: -3.0 ± 3.5 P=0.883
90 days: I: -2.6 ± 4.5 C: -3.3 ± 3.5 P=0.444 |
Aqueous flare was measured in photons/ms with a laser flare meter. The mean of five reliable measurements was used in the analysis.
Data are given as mean ± SD. Follow-up values are reported as mean change from baseline. |
|
Negi, 2006 |
Type of study: RCT
Setting and country: The Ophthalmology Department of the Queen’s Medical Centre, Nottingham, United Kingdom
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Patients with umcomplicated phacoemulsification and foldable IOL implantation at the Queen’s Medical Centre, Nottingham.
Exclusion criteria:
Known diabetes; patients receiving oral or topical anti-inflammatory agents (steroidal or nonsteroidal); family history of glaucoma; history of steroid responsiveness; eyes with uveitis, glaucoma, age-related macular degeneration, or corneal disease; a history of CME (in second eye)
N total at baseline: Intervention: 27 Control: 27
Important prognostic factors2: For example age ± SD: I: 73.3 ± 8.0 C:70.4 ± 8.4 P=0.21
Sex: I: 48,1%% M (N=13) C: 44.0% M (N=12)
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
27 patients were given a perioperative sub-Tenon’s injection of triamcinolone (injection group); 10 of these received 20 mg (I1), and the remaining 17 eyes had 30 mg (I2) triamcinolone.
|
Describe control (treatment/procedure/test):
Patients were prescribed a standard postoperative regimen of Betnesol-N drops 4 times a day for 30 days + a single dose of 250 mg acetazolamide orally. |
Length of follow-up: Preoperatively and 1 day, 8 days, 30 days and 90 days postoperatively.
Loss-to-follow-up: Intervention: N=0 (0%) Reasons: -
Control: N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1:
Baseline: I2: 8.5 ± 3.7 I1: 8.1 ± 3.7 C: 8.9 ± 3.2 P=0.59
1 day: I2: 16.4 ± 7.8 C: 19.6 ± 23.4 P=0.75
8 days: I2: 17.9 ± 7.9 I1: 33.8 ± 28.2 C: 23.9 ± 14.1 P=0.28
30 days: I2: 14.0 ± 13.4 C: 15.8 ± 9.7 P=0.37
90 days: I2: 9.7 ± 3.4 I1: 8.9 ± 2.9 P=0.46
Outcome measure 2:
Baseline: Injection group: 0.44 ± 0.26 Drops group: 0.38 ± 0.14 P=0.55
90 days:
Outcome measure 3: Injection group: 14.8 ± 2.9 P=0.85
90 days: Injection group: 15.9 ± 2.4 Drops group: 14.5 ± 3.0 |
Anterior chamber flare measurements were performed by measuring AC flare in photons/ms on the laser flare meter. Five readings were taken at each visit, and the mean was used to determine the AC flare. |
|
Paganelli, 2009 |
Type of study: randomized, double-masked, controlled trial
Setting and country: Centro Avancado de Retina c Catarata, Fortaleza, Brazil
Funding and conflicts of interest: not reported |
Inclusion criteria:
Patients with umcomplicated, age-related cataract and patients had to have best-corrected visual acuity (BCVA) of 20/100 or better in the fellow eye and be considered likely to follow instructions and complete the study.
Exclusion criteria:
Patients were excluded if they were taking oral or topical anti-inflammatory agents or if they had a history of steroid-induced ocular hypertension, hypermature cataracts, a previous ocular surgery, preexisting uveitis, diabetic retinopathy, glaucoma, or corneal disease.
If both eyes of a patient were eligible, the eye undergoing cataract extraction first was included.
N total at baseline: Intervention: 68 Control: 67
Important prognostic factors2: For example age ± SD: I: 68.2 (8.0) C: 70.2 (8.0)
Sex: I: 44.1% M (n=30) C: 35.8% M (n=24)
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
In the triamcinolone group, patients received a sub-Tenon’s capsule injection of DuoCat at the end of surgery. |
Describe control (treatment/procedure/test):
Patients instilled 1% prednisolone acetate and 0.3% ciprofloxacin hydrochloride eye drops in the treated eye. The prednisolone eye drop was instilled after surgery according to the following schedule: 1 drop four times daily (week 1), three times daily (week 2), twice daily (week 3), and once daily (week 4). The ciprofloxacin eye drop was instilled four times daily during the first two postoperative weeks. |
Length of follow-up: 1, 3, 7, 14 and 28 days postoperatively.
Loss-to-follow-up: Intervention: 2 N=2 (2.9%) Reasons: Lack of response to the treatment (introduced additional prednisolone drops at day 14)
Control: N=1 (1.5%) Reasons: Lack of response to the treatment (introduced additional prednisolone drops at day 14)
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1:
1 day Intervention group Grade 0: n=0 Grade 2+: n=43 Grade 3+: n=20 Grade 6+: n=0
Controls: Grade 2+: n=36 Grade 3+: n=22 Grade 6+: n=0
1 week Intervention group Grade 2+: n=6 Grade 3+: n=0 Grade 6+: n=0
Controls: Grade 2+: n=13 Grade 3+: n=0 Grade 6+: n=0
1 month Intervention group Grade 1+: n=0 Grade 2+: n=0 Grade 3+: n=0 Grade 6+: n=0
Controls Grade 0: n=63 Grade 2+: n=0 Grade 3+: n=0 Grade 6+: n=0
P=0.24
Outcome measure 2: Flare
1 day: Intervention group:
1 week:
Controls: Grade 0: n=1 1 month: Grade 0: n=65
Controls:
Outcome measure 3: Intraocular pressure
1 day: I: 14.2 (4.1) C: 13.8 (3.6) Mean difference (95%CI): -0.4 (-2.1; 1.3) P=0.56
1 week: I: 13.2 (3.1) C: 13.2 (3.0) Mean difference (95%CI): 0.0 (-1.4; 1.3) P=0.95
1 month: I: 12.3 (2.2) C: 12.2 (2.0) Mean difference (95%CI): -0.1 (-1.1; 0.9) P=0.76 |
Anterior chamber cells were graded based on a modification of the grading scal of Hogan et al. The anterior chamber cell was graded on a scale of 0 to 6+.
Grade 0: 0-4 cells. Grade 2+: 10-19 cells. Grade 3+: 20-29 cells. Grade 6+: 50 or more cells.
Anterior chamber flare was also graded on a scale of 0 to 4+.
Grade 0: complete absence. Grade 1+: faint flare (barely detectable). Grade 4+: intense flare (fixed, coagulated aqueous humor with considerable fibrin) |
|
Paganelli, 2004 |
Type of study: Randomized double-masked controlled trial
Setting and country: Hospital de Olhos de Araraquara, Sao Paulo, Brazil
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Patients with uncomplicated, senile cataract were scheduled for phacoemulsification and foldable lens surgery using topical anesthesia. Patients also had to have a best-corrected visual acuity of 20/100 or better in the unoperated eye and had to be deemed likely to follow instructions and complete the entire course of the study.
Exclusion criteria:
Patients were excluded if they took oral or topical anti-inflammatory agents, or if they had diabetes mellitus; a history of steroid-induced ocular hypertension, hypermature cataracts, or previous ocular surgery; preexisting uveitis; glaucoma; or corneal disease.
N total at baseline: Intervention: 50 Control: 50
Important prognostic factors2: For example age ± SD: I: 65.0 ± 7.9 C: 65.3 ± 7.9 P=0.885
Sex: I: 52% M (n=26) C: 44% M (n=22) P=0.423
Groups comparable at baseline? yes
|
Describe intervention (treatment/procedure/test):
patients received a single intraoperative preservative-free 40-mg triamcinolone acetonide sub–Tenon’s capsule injection, and normal saline placebo eyedrops were prescribed following the same schedule as the control group. Ofloxacin, 0.3% topical drops were instilled 4 times daily (week 1 and 2) for both groups. |
Describe control (treatment/procedure/test):
patients received conventional 1% prednisolone acetate eyedrops selfinstilled in the treated eye, according to the following schedule: 1 drop 4 times daily (week 1), 3 times daily (week 2), 2 times daily (week 3), once daily (week 4). A sub–Tenon’s capsule injection of an equal volume of balanced salt solution was used. |
Length of follow-up: 1, 3, 7, 14, 28 and 56 days postoperatively.
Loss-to-follow-up: Intervention: none N=0 (0%) Reasons: -
Control: none N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Flare
1 day (mean and range):
3 days (mean and range) I: 0.9 (0-2) P=0.852
7 days (mean and range) I: 0.3 (0-1) C: 0.2 (0-1)
14, 28 and 56 days have the same outcomes (mean and range) I: 0.0 (0-0)
Outcome measure 2: AC cell
1 day (mean and range): I: 2.2 (1-3) P=0.842
3 days (mean and range) P=0.491
7 days (mean and range) P=0.989
14 days (mean and range) I: 0.3 (0-1)
28 days (mean and range) P= 1.000
56 days (mean and range) I: 0.0 (0-0) P=1.000
Outcome measure 3: Intraocular pressure (data are the mean plus range mmHg)
Baseline: I: 14.2 (10-18) C; 14.1 (10-19) P=0.979
1 day: I: 17.1 (12-24) C: 17.5 (14-20) P=0.440
7 days: I: 13.4 (10-18) C: 16.1 (12-20) P<0.001
28 days: I: 13.2 (10-18) C: 14.3 (12-18) P=0.054 |
All efficacy variables were evaluated at baseline and during all follow-up visits by slit-lamp biomicroscopy without pupil dilation according to a grade system.
Anterior chamber flare was graded on the following scale:
Grade 4: very severe (vere severely intense Tyndall beam with a white and milky appearance of the aqueous.).
Anterior chamber cells were graded on the following scale:
Grade 0: none (no cells) Grade 1: mild (1-5 cells) Grade 2: moderate (6-15 cells) Grade 3: severe (16-30 cells) Grade 4: very severe (>30 cells)
|
|
Karalezli, 2008 |
Type of study: prospective randomized controlled trial
Setting and country: Baskent University School of Medicine, Ankara, Turkey
Funding and conflicts of interest: Not reported. |
Inclusion criteria:
Only one eye of each patient was included in the study. If the patient had bilateral cataract, one eye was selected randomly and included in the study.
Exclusion criteria:
Diabetes; current use of oral or topicalanti-inflammatory agents (steroidalor non-steroidal); family history ofglaucoma; history of steroid respon-siveness; uveitis, glaucoma, age-relatedmacular degeneration or corneal dis-ease (including in the second eye), anda history of cystoid macular oedema(CMO) (including in the second eye).
N total at baseline: Intervention: 30 Control: 30
Important prognostic factors2: For example age ± SD: I: 65.7 ± 7.6 C: 66.2 ± 6.6
Sex: I: 43.3% M (n=13) C: 46.7% M (n=14)
Groups comparable at baseline? Yes, for age and sex.
|
Describe intervention (treatment/procedure/test):
At the end of the cataract surgery, TA 1 mg (0.025 cc Kenacort-A; Bristol-Myers Squibb; diluted with BSS) was injected into the anterior chamber through a paracentesis using a27-gauge cannula in 30 eyes of 30patients |
Describe control (treatment/procedure/test):
Patients who did not receive the injection used topical prednisolone ace-tate 1% eyedrops, which were administered six times per day for 7 days, then four times per day for 15 days. Group A patients did not use topical prednisolone acetate 1%during the postoperative period. All patients received postoperative topical antibiotic prophylaxis with ofloxacin0.3%, one drop administered four times per day 15 mins after the topical steroid for 15 days. No other treatments were allowed. |
Length of follow-up: 1, 7 and 30 days postoperatively.
Loss-to-follow-up: Intervention: none N=0 (0%) Reasons: -
Control: none N=0 (0%) Reasons: -
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Flare (mean and range presented)
1 day:
7 days:
30 days:
Outcome measure 2: Anterior chamber cells (median and range) 1 day I: 1 (0-2) C: 1 (0-2) P=0.70
7 days C: 0 (0-1) P=0.31
30 days C: 0 (0-0) P=1.00
Outcome measure 2:
Baseline: P=0.26
1 day: P=0.98
7 days: P=0.83
30 days: I: 14.90 ± 1.70 P=0.54 |
Aqueous flare scale was scored as: Grade 2: moderate (iris details clear) Grade 3: marked (iris details hazy) Grade 4: severe (heavy with fibrin depositis and clots.
Anterior chamber cells were graded as: Grade 3: marked, 21-50 cells. Grade 4: severe, > 50 cells. |
|
Shorstein, 2015 |
Type of study: Retrospective cohort study
Setting and country: Diablo Service Area, Dublin, CA
Funding and conflicts of interest: None |
Inclusion criteria:
The study included health plan members who underwent a phacoemulsification surgery (Current Procedural Terminology) from 2007 through 2013 at the Diablo Service Area and had at least 12 months of enrolment in Kaiser Permanente preceding the surgery.
Only the eyes that underwent phacoemusification after the dat of installation of an OCT machine were included.
Exclusion criteria:
Patients who, in the 12 months before phacoemulsification, were diagnosed with cystoid macular edema, retinal edema, or diabetic macular edema. The study also excluded patients with a history of retinal detachment or defect, a history of retinal surgery, or a history of trabeculectomy preceding their first phacoemulsification date and patients with a diagnosis of macular edema in either eye recorded during the 6 months preceding their first phacoemulsification procedure.
N total at baseline: 118
Important prognostic factors2: For example age ± SD: I: C:
Sex: I: % M C: % M
Groups comparable at baseline? |
Describe intervention (treatment/procedure/test):
Intraoperative subconjunctival injection of triamcinolone acetonide (TA) |
Describe control (treatment/procedure/test):
Topical prednisolone acetate (PA) alone or with a nonsteroidal anti-inflammatory drug (NSAID). |
Length of follow-up: Day 1 through 3, 4 through 15 and 16 through 45.
Loss-to-follow-up: Intervention: none N=0 (0%) Reasons:
Control: none N=0 (0%) Reasons:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Association of macular edema TA compared with PA + NSAID OR=1.21 (95% CI: 0.48; 3.06)
Association of macular edema PA + NSAID compared with PA alone OR=0.45 (95% CI: 0.21; 0.95)
Subgroup analysis restricted to patients without diabetic retinopathy, epiretinal membrane, iritis or uveitis, or PCR:
Association of macular edema PA compared with PA + NSAID OR=0.35 (95% CI: 0.13; 0.97)
|
|
|
Singhal, 2019 |
Type of study: retrospective chart review
Setting and country: Penn State Eye Center
Funding and conflicts of interest: none |
Inclusion criteria:
patients who underwent phacoemulsification cataract surgery performed or supervised by a single surgeon at Penn State Eye Center between January 2017 and July 2018. For the purposes of inclusion in this retrospective chart review, only patients who did not meet any of the exclusion criteria listed above for transzonular injection were included in the topical drop group. Surgical cases were performed with stand
Exclusion criteria:
Criteria that precluded patients from being offered the injection included prior cataract surgery complications in the contralateral eye, uveitis, glaucoma, glaucoma suspect, ocular hypertension, or a previous IOP response to topical steroids
N total at baseline: 198 patients (198 eyes)
Important prognostic factors2: For example age ± SD: I: 68.7 (26-85) C: 65.6 (24-92)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
Transzonular injection triamcinolone-moxifloxacin in lieu to topical drops
Or
Topical drops in case of refused injection postoperatively
|
Describe control (treatment/procedure/test):
- |
Length of follow-up:
1 day, 1 week, 6-9 weeks
Loss-to-follow-up: none Intervention: N=0 (0%) Reasons:
Control: N=0 (0%) Reasons:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1:
Visually significant cystoid macular edema incidence (N; %)
Injection group: 1/99 (1%) Topical group: 0/99 (0%) P=1.000
Outcome measure 2: Intraocular pressure elevation (N; %)
Injection group: 0/99 (0%) Topical group: 0/99 (0%) P=1.000
|
|
|
Tyson, 2017 |
Type of study: retrospective analysis
Setting and country:
Funding and conflicts of interest: Dr Tyson is a consultant for Imprimis Pharmaceuticals. Dr Halleris currently receiving a grant from ThromboGenics,is a consultant for Merck Co. and Janssen Pharmaceutica, is a board member for Celgene, and has stock with Celgene. For the remaining authors none were declared.
|
Inclusion criteria:
Prospective cases for inclusion in the review had cataract surgery with implantation of an intraocular lens (IOL) and at least one intravitreal injection of TMV.
Exclusion criteria:
use of topical ophthalmic antibiotics, corticosteroids, or NSAIDs up to 1-week before the scheduled day of surgery; known allergy or hypersensitivity to any of the components of the compounded TMV formulation; history of corticosteroid-responsive glaucoma; history of uncontrolled IOP; and concomitant advanced glaucoma with risk of optic nerve damage in the case of elevated IOP.
N total at baseline: 922 (1541 eyes)
Important prognostic factors2: For example age ± SD: I: C:
Sex: 554 F (60.1%) 368 M (39.9%)
Groups comparable at baseline? Yes |
Describe intervention (treatment/procedure/test):
A transzonular injection of 0.2 ml TMV (3.0 mg triamcinolone acetonide, 0.2 mg moxifloxacin, and 2.0 mg vancomycin) was administered into the anterior vitreous after IOL implantation but before viscoelastic removal. One drop each of PRED FORTE (prednisolone acetate) 1% (Allergan, Inc., Irvine, California, USA), a fluoroquinolone, and a topical ophthalmic antihypertensive were instilled into the operative eye immediately after surgery. |
Describe control (treatment/procedure/test):
- |
Length of follow-up:
Days 1, 14-21 and 90
Loss-to-follow-up: none Intervention: N=0 (0%) Reasons:
Control: none N=0 (0%) Reasons:
|
Outcome measures and effect size (include 95%CI and p-value if available):
Outcome measure 1: Postoperative CME
Cases with CME at days 14-21 or 90 (N and %): 28 (2%)
Outcome measure 2: Mean intraocular pressure
Before surgery: Cases: 1517 mmHg (SD): 15.4 (3.6)
Day 1 after surgery Cases: 1514 mmHg (SD): 14.3 (4.3)
Days 14–21 after surgery Cases: 1301 mmHg (SD): 14.2 (3.7)
Day 90 after surgery Cases: 1067 mmHg (SD): 13.7 (3.3)
|
|
Risk of bias tabel
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome accessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Dieleman, 2011 |
Randomization was performed in 5 blocks of 80 sealed envelopes with uniform distribution of 40 envelopes per group |
Unlikely |
Likely, double-blind placebocontrolled study was not considered ethically acceptable because it would have required a placebo subconjunctival injection in Group 2 |
Likely, double-blind placebocontrolled study was not considered ethically acceptable because it would have required a placebo subconjunctival injection in Group 2 |
Unclear |
Unlikely |
Unlikely,
9.5% (but equally between groups) |
Unlikely
Per protocol analysis. Loss to FU not in analysis |
|
Khan, 2016 |
Patients were randomly divided through lottery method in dexamethasone group A and triamcinolone group B |
Unlikely |
Likely, double-blind placebo-controlled study was not considered ethically acceptable because it would have required a placebo subconjunctival injection in Group 2 |
Likely, double-blind placebo-controlled study was not considered ethically acceptable because it would have required a placebo subconjunctival injection in Group 2 |
Unclear |
Unlikely |
Unlikely, there was no loss to follow-up in both of the groups |
Unlikely |
|
Merkoudis, 2014 |
Randomization was performed in 50 sealed envelopes with uniform distribution of 25 envelopes per group. Five envelopes in each group were assigned to eyes with PEX. |
Unlikely |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Unlikely
“we consider that blinding would not have been feasible because of the presence of visible subconjunctival deposits after the steroid injection” |
Unlikely
|
Unlikely
There was no loss to follow-up in both of the groups. |
Unlikely |
|
Simaroj, 2011 |
All patients were randomized, using a block randomization |
Unlikely |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Unclear |
Unlikely |
Unlikely
There was no loss to follow-up in both of the groups. |
Unlikely
Per protocol analysis |
|
Lindholm, 2019 |
The study reports that patients enrolled for the study were assigned with equal allocation ratio to one of the two groups. However, no randomization technique was used.
|
Likely |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely
“Although this was a prospective study, the treatment used was not masked from the patient or the investigator and this could have affected the measured outcomes. However, the main outcome and safety aspects were designed to be measured with objective quantitative methods” |
Unlikely |
Likely
Two patients dropped out of the intervention group due to failure to attend control visits and one patient left the study at the patient’s own request. |
Unlikely. |
|
Negi, 2006 |
At the end of the procedure, the operating theater nurse opened the study envelope to ascertain the randomization for patients. |
Unlikely |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Unclear |
Unlikely |
Unlikely
There was no loss to follow-up in both of the groups. |
Unlikely |
|
Paganelli, 2009 |
The assignment was performed by block randomization based on a table of computer-generated random numbers. The allocation concealment was accomplished with sequentially numbered, opaque, sealed envelopes. |
Unlikely |
Unlikely
To mask the study, the patients in the prednisolone group underwent a similar sub-Tenon’s capsule injection of the polymer containing no drug, whereas the patients in the triamcinolone group received vehicle drops in bottles and schedules similar to those given to the prednisolone group |
Unclear |
Unlikely
Clinical assessment of postoperative outcomes was performed by a masked investigator (FP) who was unaware of the patient group status. To ensure the masked nature of this study, the patients were asked not to provide any information regarding eye drop instillation to the masked investigator because of the milky appearance of the prednisolone |
Unlikely |
Unlikely
1 patient from the control group and 2 in the intervention group were lost to follow-up after the day-1 postoperative visit. Their clinical outcome measures did not differ from the other patients. |
Unlikely |
|
Paganelli 2004 |
Qualified patients were assigned to 1 of 2 masked postoperative treatments using a table of computer-generated random numbers. |
Unlikely |
Unlikely
A sub–Tenon’s capsule injection of an equal volume of balanced salt solution was used in the control group to mask the allocated intervention |
Unclear |
Unlikely
Clinical assessment of intraocular inflammation was performed by a masked investigator who was unaware of patient group status, and a masked statistician analyzed the data. Unfortunately, because of the milky appearance of the prednisolone, we faced some barriers to guarantee the masked fashion of this study. To overcome this potential problem, the observer was unaware of any detail of the patient treatment and the patients were asked not to provide any information regarding eyedrop instillation. |
Unlikely |
Unlikely
No patients from either treatment group were dropped from the study for lack of response. |
Unlikely |
|
Karalezli, 2008 |
Randomization was accomplished using a list created by a random number generator. Only one eye of each patient was included in the study. If the patient had bilateral cataract, one eye was selected randomly and included in the study. |
Unlikely |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely, a double-blind placebo-controlled study would have required a placebo subconjunctival injection in Group 2 |
Likely
All postoperative examinations were performed by the same author (AK)in order to obtain consistent inflammation grading scores and all scores were recorded for each visit and com-pared between the two treatment groups. |
Unlikely |
Unlikely
There was no loss to follow-up in both of the groups. |
Unlikely |
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
Shorstein, 2015 |
Unlikely |
Unclear |
Likely
(Soft outcome measure, not blinded) |
Likely
No correction for prognostic factors. |
|
Singhal, 2019 |
Unlikely |
Unlikely |
Likely
(Soft outcome measure, not blinded) |
Likely
No correction for prognostic factors. |
|
Tyson, 2016 |
Unlikely |
Unlikely
|
Likely
(Soft outcome measure, not blinded) |
Likely
No correction for prognostic factors. |
Tabel Exclusie na het lezen van het volledige artikel
|
|
Auteur en jaartal |
Redenen van exclusie |
|
1 |
Bodaghi, 2005 |
(Oude RL): andere interventie, NSAID versus NSAID |
|
2 |
Chatziralli, 2011 |
(Oude RL): Andere uitkomstmaat |
|
3 |
Dayanir, 2005 |
(Oude RL): andere interventie, oogdrukverlagende middelen |
|
4 |
Donnenfeld, 2018 |
Comparison voldoet niet aan de PICO: placebo injectie, geen druppels |
|
5 |
El Hazari, 1998 |
(Uit Kessel, 2014): Loteprednol is in NL niet verkrijgbaar |
|
6 |
Endo, 2010 |
Patiënten met diabetes (zie module comorbiditeit) |
|
7 |
Freitas, 2007 |
(Oude RL): andere PICO, gecombineerd versus apart toedienen van dexamethason en moxifloxacin |
|
8 |
Gayton, 2005 |
(Oude RL): andere PICO, prednison versus prednison |
|
9 |
Kir, 2008 |
(Oude RL): andere interventie, oogdrukverlagende middelen |
|
10 |
Maca, 2010 |
(Oude RL): andere interventie, NSAID versus NSAID |
|
11 |
Mathys, 2010 |
(Oude RL): andere uitkomstmaat |
|
12 |
Miyake, 1999 |
(Uit Wielders 2015):Alleen patiënten met oculaire hypertensie, normale druk glaucoom en primaire open-hoek VOK glaucoom. |
|
13 |
Miyake, 2000 |
(Uit Wielders 2015):Alleen patiënten met oculaire hypertensie, normale druk glaucoom en primaire open-hoek VOK glaucoom. |
|
14 |
Miyake, 2007 |
Includeert ook patiënten met diabetische retinopathie |
|
15 |
Miyake, 2011 |
Includeert ook patiënten met diabetische retinopathie |
|
16 |
Novitol, 2004 |
(Oude RL): andere interventie, corticosteroïd versus corticosteroïd |
|
17 |
Russo, 2005 |
(Oude RL): andere interventie, NSAID versus NSAID |
|
18 |
Yayali, 2004 |
(Oude RL): andere interventie, corticosteroïd versus corticosteroïd |
|
19 |
McCafferty, 2017 |
Mist essentiële data: geen aantallen beschreven voor interventie en controlegroep, alleen statistische significantie |
|
20 |
Chatziralli, 2011 |
Data alleen in figuur op andere tijdspunten |
|
21 |
Chatziralli, 2017 |
Andere uitkomstmaten |
|
22 |
Tzelikis, 2018 |
Inadequate randomisatie (2 ogen binnen 1 patiënt) |
|
23 |
Kessel, 2014 |
SR: overlap in studies in Juthani. Of reden van exclusie in Juthani: Miyake 2000, niet gerandomiseerd of niet duidelijk of was gerandomiseerd |
|
24 |
Lim, 2016 |
SR: overlap in studies in Juthani of populatie voldoet niet (diabetische retinopathie) of geen phaco. |
|
25 |
Reddy, 2019 |
Interventie voldoet niet aan de PICO (injectie + druppelen) |
|
26 |
Tyson, 2019 |
Comparison voldoet niet aan de PICO (gel in traanbuis in plaats van steroïd druppels) |
|
27 |
Walters, 2015 |
Comparison voldoet niet aan de PICO (gel in traanbuis in plaats van steroïd druppels) |
|
28 |
Wielders, 2015 |
SR: voldoet aan PICO maar geïncludeerde studies overlap met Juthani, 2017 of uitkomstmaat niet op 1 maand. |
|
29 |
Yavas, 2007 |
(Uit Wielders 2015) Uitkomstmaat CME niet op 1 maand |
|
30 |
Zielinska, 2016 |
Loteprednol is in NL niet verkrijgbaar |
PICO 2
|
|
Auteur en jaartal |
Redenen van exclusie |
|
1 |
Agarwal, 2013 |
Includeerde ook patiënten met diabetische retinopathie |
|
2 |
Bodaghi, 2005 |
(Oude RL): andere interventie, NSAID versus NSAID |
|
3 |
Calvo, 2018 |
Geen controlegroep |
|
4 |
Donnenfeld, 2018 |
PICO voldoet niet, geen vergelijking met druppels maar met placebo injectie |
|
5 |
Donnenfeld, 2018 |
Includeerde ook patiënten met diabetische retinopathie |
|
6 |
Elsawy, 2013 |
PICO voldoet niet, geen injecties |
|
7 |
Kim, 2017 |
PICO voldoet niet, geen injecties |
|
8 |
Modjtahedi, 2017 |
PICO voldoet niet, geen injecties |
|
9 |
Reddy, 2019 |
PICO voldoet niet, geen dropless vergelijking met druppels |
|
10 |
Song, 2019 |
PICO voldoet niet, geen injecties |
|
11 |
Suleesathira, 2017 |
Patiënten voldoen niet (uveitis) en geen controlegroep |
|
12 |
Tyson, 2019 |
PICO voldoet niet, wordt niet vergeleken met steroïd druppels post-op |
|
13 |
Walters, 2015 |
PICO voldoet niet, controlegroep krijgt geen steroïd/ NSAIDs druppels krijgt. |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-12-2021
Beoordeeld op geldigheid : 09-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Een richtlijn is in wezen de beschrijving van de actuele stand van de kennis, technieken en gerelateerde zaken rond het onderwerp van de richtlijn. Daarnaast heeft een richtlijn tot doel de beroepsbeoefenaars aanbevelingen te geven die de kwaliteit van hun werk mede op het gewenste niveau kunnen houden. Er is dus ook sprake van een beschrijving van kwalitatieve normen voor de beroepsgroep. Iedere arts is gehouden om primair te handelen in het belang van de patiënten daarbij zorg te dragen voor diens veiligheid in relatie tot het medische handelen. De Richtlijn Cataract stelt dan ook normen vast voor goede praktijkvoering, stelt standaarden voor patiëntenzorg en veiligheid en biedt een referentiepunt voor de beoordeling van de resultaten waaraan cataractchirurgie van hoge kwaliteit moet voldoen. De aanbevelingen, normen en standaarden zijn getoetst aan de resultaten van gedegen wetenschappelijk onderzoek, gepubliceerd in de wetenschappelijke literatuur. Indien zekere vraagstellingen niet goed beantwoord konden worden op basis van literatuuronderzoek, werden de meningen van erkende experts gehoord door de richtlijnwerkgroep en bij consensus verwerkt in de aanbevelingen.
Doelgroep
Deze richtlijn is geschreven voor met name oogartsen maar ook andere leden van de beroepsgroepen die direct betrokken zijn bij de zorg met cataract.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cataract.
Werkgroep
- Drs. B.A.E. (Bert) van der Pol, oogarts niet praktiserend, (voorzitter) NOG
- Dr. M.C. (Marjolijn) Bartels, oogarts, Deventer Ziekenhuis, NOG
- Drs. M.M.M.J. (Margot) Dellaert, oogarts, Treant Zorggroep, NOG
- Drs. Y.P. (Ype) Henry, oogarts, VU medisch centrum, NOG
- Dr. L.V. (Long) Ly, oogarts, Bergman Clinics, NOG
- Drs. R.C.M. (Marit) Maatman, oogarts, Alrijne Ziekenhuis, NOG
- Dr. N.J. (Nic) Reus, oogarts, Amphia Ziekenhuis, NOG
- Dr. N. (Nienke) Visser, oogarts, Maastricht Universitair Medisch Centrum, NOG
- Prof. Dr. R.M.M.A. (Rudy) Nuijts, oogarts, Maastricht Universitair Medisch Centrum, NOG
Met ondersteuning van
- Dr. A.C.J. (Astrid) Balemans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Josefien) Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Klankbordgroep
- H.J. (Anneke) Jansen Molenaar, Adviseur Oogzorg bij de Oogvereniging
- D. (Dana) Kamsteeg-Koerts, Optometrist, Oogziekenhuis Rotterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Van der Pol |
Niet praktiserend |
Geen |
Geen |
Geen actie |
|
Dellaert |
Oogarts |
Medisch manager, onkostenvergoeding |
Geen |
Geen actie |
|
Bartels |
Zelfstandig ondernemer, via B.V. verbonden aan Verenigde Specialisten Deventer en zo aan Deventer Ziekenhuis |
Voorzitter subcommissie Richtlijnen NOG |
Deelname aan ZonMw studie IBSCS / DBSCS via UMC Maastricht (site - investigator)
Contactpersoon namens cornea werkgroep bij hoornvliespatiënten vereniging.
|
Geen trekker van de modules over ontstekings- en infectieprofylaxe bij reguliere cataractchirurgie. |
|
Henry |
Oogarts; staflid
|
Lid van de steering group van EUREQUO (ESCRS); Secretaris van NIOIC (NOG); Voorzitter van WTO (NOG) |
Geen |
Geen actie |
|
Ly |
Oogarts bij Bergman Clinics |
Geen |
Geen |
Geen actie |
|
Maatman |
Oogarts, Alrijne Ziekenhuis
|
NOG bestuur (secretaris), betaald. Tot 2016/2017 advies Bayer / Eylea, betaald
|
Geen |
Geen trekker module ontstekingsprofylaxe reguliere cataractchirurgie. |
|
Reus |
Oogarts in het Amphia Ziekenhuis, Breda/Oosterhout
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald) Bestuurslid European Society of Cataract and Refractive Surgeons (ESCRS) (onbetaald)
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald)
1.Principal Investigator van Investigator-Initiated Trial waarvoor subsidie van Alcon (unresticted grant). Het onderwerp is de helderheid van ogen na een staaroperatie. Er wordt onderzoek gedaan naar de hoeveelheid lichtverstrooiing in de ogen na een cataractoperatie en redenen waarom er meer strooilicht in het oog overblijft na een cataractoperatie dan wordt verwacht. 2.Site-Investigator van studie naar bilaterale cataractchirurgie geïnitieerd door prof. R. Nuijts, oogarts (Universiteitskliniek voor Oogheelkunde Maastricht) waarvoor subsidie van ZonMW (unresticted grant). |
Geen trekker van modules met betrekking tot infectieprofylaxe bij reguliere cataractchirurgie en IOLs. |
|
Visser |
Oogarts, aandachtsgebieden cornea- en cataract chirurgie. Werkgever: University Eye Clinic Maastricht, MUMC+
|
Young ophthalmology committee ESCRS (onbetaald)
|
EPICAT study: Effectiveness of Periocular drug Injection in CATaract surgery (gefinancierd door ESCRS, het gaat hierbij om een restricted grant, de ESCRS heeft op voorhand akkoord gegeven voor de specifieke opzet, uitvoering, en terugkoppeling van de EPICAT studie) |
Geen actie |
|
Nuijts |
Prof.dr. RMMA Nuijts, hoogleraar Corneatransplantatie en Refractiechirurgie; MUMC Maastricht
|
- Voorzitter Nederlandse IntraOculaire Implant Club, NIOIC (onbetaald) |
Abbott: NL 56878.068.16/METC162029 A randomised, subject-masked evaluation of visual function after bilateral implantation of two types of presbyopia-correcting IOLs: the Symfony-study. Period: 01-12-2016 - 01-12-2018
Alcon: VERION versus conventional, manual ink-marking in toric IOL implantation. Period: 2015 - 2016
Alcon: ILJ466-P003 Post-Market Investigation of the Clareon IOL. Period: 2018 - 2028
Alcon: The ACRYSOF IQ PanOptix Presbyopia Correcting intraocular lens (IOL) Model TFNT00. Period: 01-12-2015 - 01-12-2017
CHIESI: NL 54419.000.15/CCMO15.0538 Multinational, multicentre, prospective, open-label, uncontrolled clinical trial to assess the efficacy and safety of Autologous Cultivated Limbal Stem Cells Transplantation (ACLSCT) for restoration of corneal epithelium in patients with limbal stem cell deficiency due to ocular burns. Period: 01-12-2016 - 01-12-2018
ESCRS: European Cornea and Cell Transplantation Registry (ECCTR), European Union Third Health Programme 2014-2020 and the European Society of Cataract and Refractive Surgeons. Period: 01-04-2016 - 2019
ESCRS: The ESCRS PREMED study: PREvention of Macular EDema after cataract surgery. Period: 2012 - 2016
InSciTE: EyeScite: smart biomedical solutions for better eyesight. |
Geen trekker van de modules met betrekking tot infectie- en onstekingsprofylaxe en IOLs bij reguliere cataractchirurgie. |
|
Kamsteeg-Koerts (klankbordgroep) |
Optometrist, Oogziekenhuis Rotterdam |
- Per 25 november 2019 lid OVN ledenraad met een aanstelling voor 3 jaar - Lid OVN commissie Beroepsbelangen |
Geen
|
Geen actie |
|
Jansen-Molenaar |
Adviseur Oogzorg bij de Oogvereniging |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Een afgevaardigde van de Oogvereniging nam zitting in de klankbordgroep. Daarnaast werden de Oogvereniging en de Patiëntenfederatie uitgenodigd om deel te nemen aan de schriftelijke knelpuntenanalyse. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de betrokken patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met cataract. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule cataract (2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door het Nederlands Oogheelkundig Gezelschap (NOG), de Nederlandse Vereniging voor Klinische Geriatrie (NVKG), het Nederlands Huisartsen Genootschap (NHG), de Oogvereniging, Verenso en de Landelijke Vereniging van Operatieassistenten (LVO) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen in de bijlagen.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) en belangrijk (maar niet cruciaal). Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimale klinisch relevante verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden die meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
PICO 1
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
Engels 2011-okt. 2019 |
1 exp Cataract/ or exp Cataract Extraction/ or (Cataract* or (Lens* adj2 Opacit*) or Pseudoaphakia* or Capsulorhexis or Phacoemulsification).ti,ab,kf. (71385) 7 exp Adrenal Cortex Hormones/ or ("adrenal cortex hormone*" or corticoid* or corticosteroid*).ti,ab,kf. or (prednisolone or rimexolone or betamethasone or triamcinolone).ti,ab,kf. or Dexamethasone.ti,ab,kf. (461438) 8 exp Anti-Inflammatory Agents, Non-Steroidal/ or (nepafenac or ketorolac or thromethamine or diclofenac or naproxen or bromfenac).ti,ab,kf. (210678) 9 "Macular Edema"/pc or (("Macular Edema" or CME) and (prophylax* or prevent*)).ti,ab,kf. (1115) 10 7 or 8 or 9 (654848) 11 1 and 10 (3804) 12 7 or 8 or 9 (654848) 13 1 and 12 (3804) 14 limit 13 to (english language and yr="2011 -Current") (1220) 15 limit 13 to ed=20110501-20191014 (1142) 16 14 or 15 (1344) 17 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy*).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*)).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (338810) 18 16 and 17 (66) > 62 uniek 19 (exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) (1143171) 20 16 and 19 (288) 22 20 not 18 (241) 23 limit 18 to english language (64) >62 uniek 24 limit 22 to english language (237).> 231 uniek |
362 |
|
Embase (Elsevier) |
((('cataract'/exp/mj OR 'cataract extraction'/exp/mj OR cataract:ti,ab OR pseudoaphakia:ti,ab OR capsulorhexis:ti,ab OR phacoemulsification:ti,ab OR ((lens* NEAR/2 opacit*):ti,ab))
AND 'corticosteroid'/exp/mj OR 'adrenal cortex hormone*':ti,ab OR corticoid*:ti,ab OR corticosteroid*:ti,ab OR prednisolone:ti,ab OR rimexolone:ti,ab OR betamethasone:ti,ab OR triamcinolone:ti,ab OR 'nonsteroid antiinflammatory agent'/exp/mj OR nepafenac:ti,ab OR ketorolac:ti,ab OR thromethamine:ti,ab OR diclofenac:ti,ab OR naproxen:ti,ab OR bromfenac:ti,ab OR 'macular edema'/exp/mj/dm_pc OR (('macular edema':ti,ab OR cme:ti,ab) AND (prophylax*:ti,ab OR prevent*:ti,ab))
NOT 'conference abstract':it AND [2011-2019]/py AND [english]/lim AND ([embase]/lim OR [pubmed-not-medline]/lim))
AND (('meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review):ti) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it) (59) > 16 uniek
(('randomized controlled trial'/exp OR 'randomized controlled trial (topic)'/exp OR random*:ti,ab OR rct*:ti,ab OR ((((pragmatic OR practical) NEAR/1 clinical):ti,ab) AND trial*:ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab)) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) NOT 'conference abstract':it) (222). 53 uniek |
|
Aanvullende search deelvraag 2- observationele studies
Algemene informatie
|
Richtlijn: Cataract |
|
|
Uitgangsvraag:
|
|
|
Database(s): Medline, Embase |
Datum: 9-3-2020 |
|
Periode: 2011 – maart 2020 |
Talen: Engels |
|
Literatuurspecialist: Miriam van der Maten |
|
|
Toelichting en opmerkingen: Dit is een update van de eerder uitgevoerde search op 17-10-2019. Het verzoek was om ook observationele studies mee te nemen naast de SRs en RCTs. Voor de observationele studies kan specifiek op de uitkomstmaat 'cystoid macula oedeem' gezocht worden. Het sleutel artikel van Shorstein (2015) worden gevonden met de zoekopdracht. |
|
Zoekopbrengst
|
|
EMBASE |
OVID/MEDLINE |
Ontdubbeld |
|
SRs (17-10-2019) |
59 |
64 |
362 |
|
RCTs (17-10-2019) |
222 |
237 |
|
|
Observationele studies |
219 |
242 |
303 |
PICO 2
|
Database |
Zoektermen |
||||||||||||||||||||||||||
|
Embase
|
|
||||||||||||||||||||||||||
|
Medline (OVID)
|
1 exp Cataract/ or exp Cataract Extraction/ or (Cataract* or (Lens* adj2 Opacit*) or Pseudoaphakia* or Capsulorhexis or Phacoemulsification).ti,ab,kf. (71385) 7 exp Adrenal Cortex Hormones/ or ("adrenal cortex hormone*" or corticoid* or corticosteroid*).ti,ab,kf. or (prednisolone or rimexolone or betamethasone or triamcinolone).ti,ab,kf. or Dexamethasone.ti,ab,kf. (461438) 8 exp Anti-Inflammatory Agents, Non-Steroidal/ or (nepafenac or ketorolac or thromethamine or diclofenac or naproxen or bromfenac).ti,ab,kf. (210678) 9 "Macular Edema"/pc or (("Macular Edema" or CME) and (prophylax* or prevent*)).ti,ab,kf. (1115) 10 7 or 8 or 9 (654848) 11 1 and 10 (3804) 12 7 or 8 or 9 (654848) 13 1 and 12 (3804) 14 limit 13 to (english language and yr="2011 -Current") (1220) 15 limit 13 to ed=20110501-20191014 (1142) 16 14 or 15 (1344) 17 (meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy*).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*)).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (338810) 18 16 and 17 (66) 19 (exp randomized controlled trial/ or randomized controlled trials as topic/ or random*.ti,ab. or rct?.ti,ab. or ((pragmatic or practical) adj "clinical trial*").ti,ab,kf. or ((non-inferiority or noninferiority or superiority or equivalence) adj3 trial*).ti,ab,kf.) not (animals/ not humans/) (1143171) 20 16 and 19 (288) 22 20 not 18 (241) 23 limit 18 to english language (64) 24 limit 22 to english language (237) 25 exp Macular Edema/ or (macula* adj3 (edema or oedema)).ti,ab,kf. or cme.ti,ab,kf. (18481) 26 1 and (7 or 8) and 25 (929) 27 Limit 26 to (english language and yr="2011 -Current") (480) 28 Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ [Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies] (3380465) 29 27 and 28 (242) |
