Per- en postoperatieve antibiotica profylaxe bij cataract
Uitgangsvraag
Aanbeveling
Geef cefuroxim 1 mg in 0,1 ml intracameraal, aan het einde van een cataractoperatie om het risico op een postoperatieve endoftalmitis (POE) te verlagen.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Er is redelijke robuuste bewijskracht dat intracamerale toediening van cefuroxim het risico op endoftalmitis aanzienlijk verlaagt vergeleken met niet-intracamerale antibiotica. Er is lage bewijskracht gevonden dat moxifloxacine het risico op endoftalmitis aanzienlijk doet afnemen. Voor de behandeling met intracamerale vancomycine zonder postoperatief antibiotica druppelen is de bewijskracht beoordeeld als ‘zeer laag’ en kan daar geen conclusie uit worden getrokken. Voor de behandeling met intracamerale vancomycine met postoperatief antibiotica druppelen is er lage bewijskracht gevonden dat intracamerale vancomycine met postoperatief antibiotica het risico op endoftalmitis flink verlaagt vergeleken met niet-intracamerale antibiotica toediening.
Er is geen literatuuranalyse uitgevoerd naar de directe vergelijking intracamerale injectie ten opzichte van intracamerale antibiotica injectie + postoperatief druppelen. De gepoolde prevalentie van endoftalmitis in de studiepopulatie die alleen intracamerale antibiotica injectie kreeg is 0,00035% (143/412.886). De gepoolde prevalentie van de studiepopulatie die intracamerale antibiotica injectie kreeg + postoperatieve druppels is 0,00027 (69/252.663). Er zijn voorzichtige aanwijzingen, gebaseerd op indirect bewijs, dat het toedienen van postoperatieve antibiotica druppels naast intracamerale antibiotica injecties de incidentie van endoftalmitis mogelijk niet verder laat afnemen.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Het toedienen van intracameraal cefuroxim aan het einde van de ingreep heeft, mits de patiënt niet bekend is met een allergie voor dit middel, geen extra belasting voor de patiënt.
Kosten (middelenbeslag)
De kosten van het antibioticum cefuroxim zijn laag, minder dan €8,- voor één injectieflacon. Echter, hier zijn de logistieke kosten nog niet in berekend die nodig zijn om het middel over kleine spuitjes te verdelen om het steriel toe te kunnen dienen. Het number needed to treat is relatief hoog gezien de lage incidentie op een endoftalmitis.
De prijs van één enkele endoftalmitis is hoog, het gaat hierbij niet alleen om de materiële kosten van de extra operatie(s), maar vooral ook om de immateriële kosten van het verlies van visus en soms zelfs het hele oog.
Aanvaardbaarheid, haalbaarheid en implementatie
In Nederland is cefuroxim ruim voorhanden en direct beschikbaar voor intracameraal gebruik. Het toedienen van de cefuroxim is bovendien een korte, relatief eenvoudige en pijnloze handeling.
Een goed alternatief is er momenteel niet, dus bij risico op een bijwerking (anafylactische shock) dan moet overwogen worden om niets te geven.
Moxifloxacine als antibioticum is niet direct beschikbaar in Nederland voor intracameraal gebruik. Dit wordt in Nederland gezien als 'reserve' antimicrobiële middelen. Om resistentieontwikkeling te voorkomen, dient de toepassing ervan te worden gereserveerd voor situaties waarin met andere antimicrobiële middelen onvoldoende resultaat wordt verkregen of in geval van allergie voor cefuroxim. (Bron FK)
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Gezien de bewezen effectiviteit van intracamerale antibiotica in het verlagen van het risico op endoftalmitis, het ontbreken van nadelige effecten voor de patiënt en de relatief simpele uitvoering van de interventie, is de werkgroep van mening dat intracamerale antibiotica gegeven dient te worden aan het einde van een cataractoperatie.
Onderbouwing
Achtergrond
Endoftalmitis is een weinig voorkomende, maar potentieel ernstige visusbedreigende complicatie van een cataractoperatie. De incidentie in Nederland was in 2010 ongeveer 0,05% en deze is nu dalende. In 2015 was dit nog maar rond de 0,03% en in 2019 is het risico verder gezakt naar ongeveer 0,01 % (Bron: kwaliteitsregistratie van het NOG).
De vraag is hoe we dit risico op postoperatieve endoftalmitis tot een minimum kunnen blijven beperken. Al moeten we hierbij wel opmerken dat een risico van 0,01% al zeer laag is. Uiteraard moet ook worden nagegaan of er nadelige effecten zijn van het beperken van dit risico. Wat zijn de bijwerkingen en kosten van bijvoorbeeld de toediening van antibiotica intacameraal of van een oogdruppel met antibiotica.
Conclusies / Summary of Findings
PICO 1: Intracamerale antibiotica-injectie zonder postoperatief druppelen versus niet-intracamerale antibiotica
Endoftalmitis: cefuroxim
|
Redelijk GRADE |
Toediening van intracamerale cefuroxim zonder postoperatief antibiotica druppelen geeft waarschijnlijk een aanzienlijk lager risico op endoftalmitis vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (Bowen, 2018, meta-analyse met zes studies) |
Endoftalmitis: moxifloxacine
|
Laag GRADE |
Toediening van intracamerale moxifloxacine zonder postoperatief antibiotica druppelen lijkt gepaard te gaan met een aanzienlijk lager risico op endoftalmitis vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (Bowen, 2018, meta-analyse met twee studies) |
Endoftalmitis: vancomycine
|
Zeer laag GRADE |
Het is onduidelijk of toediening van intracamerale vancomycine zonder postoperatief antibiotica druppelen leidt tot een lager risico op endoftalmitis vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (Bowen, 2018, één studie) |
PICO 2: Intracamerale antibiotica-injectie met postoperatief druppelen versus niet-intracamerale antibiotica
Endoftalmitis: cefuroxim
|
Redelijk GRADE |
Toediening van intracamerale cefuroxim met postoperatief antibiotica druppelen geeft waarschijnlijk een aanzienlijk lager risico op endoftalmitis vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (Bowen, 2018, meta-analyse met zes studies; ESCRS, 2007) |
Endoftalmitis: moxifloxacine/ vancomycin
|
Laag GRADE |
Toediening van intracamerale moxifloxacine of vancomycine met postoperatief antibiotica druppelen lijkt gepaard te gaan met een aanzienlijk lager risico op endoftalmitis vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (Bowen, 2018, meta-analyse met twee studies) |
TASS
|
Laag GRADE |
Er zijn enige aanwijzingen dat toediening van intracamerale antibiotica niet gepaard gaat met meer of minder gevallen van TASS vergeleken met niet-intracamerale antibiotica bij cataractoperaties.
Bronnen: (ESCRS, 2007; García-Sáenz, 2009; Haripriya, 2017; Matsuura, 2013; Rush 2015) |
Samenvatting literatuur
Beschrijving studies
Bowen (2018) voerde een systematische review uit naar de intracamerale antibiotica-injecties cefuroxim moxifloxacine en vancomycine na afloop van de cataractoperatie welke werden vergeleken met niet-intracamerale antibiotica (topicaal, subconjunctivaal of niet-gespecificeerd). Er werd tot aan januari 2017 gezocht naar observationele studies en RCT’s en studies werden enkel geïncludeerd indien er ten minste 500 cataractoperaties waren uitgevoerd. In totaal werden acht studies geïncludeerd die overeenkomen met PICO 1: vier studies naar cefuroxim; twee studies naar moxifloxacine en één studie naar vancomycine. Er werden 13 studies geïncludeerd die overeenkomen met PICO 2: vijf studies naar cefuroxim; vijf studies naar moxifloxacine en vier studies naar vancomycine (studies konden meerdere intracamerale antibiotica onderzoeken). Van de 19 studies was er één RCT, de rest betrof observationele studies. Het merendeel van de observationele studies (vijf van de 18) betrof voor- nastudies, wat wil zeggen dat de incidentie van endoftalmitis na introductie van intracamerale antibiotica-injecties werd vergeleken met de voorgaande periode waar intracamerale antibiotica-injecties nog niet werden toegepast. Vier studies rapporteerden over de incidentie van TASS. Tabel 1 geeft een overzicht van de geïncludeerde studies en bijbehorende vergelijking in de studie van Bowen (2018).
Tabel 1 Overzicht geïncludeerde studies met bijbehorende vergelijkingen in systematische review van Bowen (2018)
|
PICO 1 |
||
|
|
Interventie |
Controle |
|
Arshinoff (2011) |
Intracameraal cefuroxim 1,0mg in 0,1cc zoutoplossing
Postoperatief beleid: niet gespecificeerd |
Postoperatief beleid: niet gespecificeerd
|
|
Myneni (2013) |
Intracameraal cefuroxim: dosis niet gespecificeerd
Postoperatief beleid: steroïde druppels eens per 4 uur voor een periode van 4 weken. |
Subconjunctivaal injectie 50 mg cefuroxim in 0,5 mL
Postoperatief beleid: steroïde druppels eens per 4 uur voor een periode van 4 weken. |
|
Yu-Wai-Man (2008) |
Intracameraal cefuroxim, 1 mg in 0,1 mL normal saline)
Postoperatief beleid: prednisolone acetaat 1,0% 3x daags tot eerstvolgende polikliniekbezoek, daarna 2x daags voor 2-3 weken. |
Subconjunctivale injectie cefuroxim (50 mg in 0,5 mL normal saline)
Postoperatief beleid: prednisolone acetaat 1,0% 3x daags tot eerstvolgende polikliniekbezoek, daarna 2x daags voor 2-3 weken.
|
|
Arshinoff (2011) |
Intracameraal moxifloxacine 100 tot 500 mg in 0,1-0,2 cc zoutoplossing
Postoperatief beleid: niet gespecificeerd |
Postoperatief beleid: niet gespecificeerd
|
|
Matsuura (2013) |
Intracameraal moxifloxacine. In 3 centra: 50-100 mg/mL moxifloxacin; 9 centra: 100-300 mg/mL moxifloxacin; 7 centra: 500 mg/mL moxifloxacine
Postoperatief beleid: niet gespecificeerd |
Postoperatief beleid: niet gespecificeerd
|
|
Arshinoff (2011) |
Intracameraal vancomycine, 1 mg in 0,1 cc zoutoplossing |
Postoperatief beleid: niet gespecificeerd
|
|
PICO 2 |
||
|
Barreau (2012) |
Intracameraal cefuroxim, 0,1 mL
Postoperatief beleid: dexamethason, tobramycine, diclofenac en tropicamide 3x daags gedurende 1 maand |
Postoperatief beleid: dexamethason, tobramycine, diclofenac en tropicamide 3x daags gedurende 1 maand |
|
Beselga (2014) |
Intracameraal cefuroxim, 1 mg cefuroxim (10 mg/mL)
Postoperatief beleid: levofloxacin 0,5% eyedrops (Oftaquix®) direct na operatie |
Postoperatief beleid: levofloxacin 0,5% eyedrops (Oftaquix®) direct na operatie |
|
ESCRS (2007) |
Intracameraal cefuroxim, 1 mg in 0,1ml zoutoplossing
50% van de studiepopulatie: Peri/postoperatief beleid: levofloxacin 0, 5%: 1 druppel 1 uur voor operatie; 1 druppel 30 minuten voor operatie; 3 druppels met 5-minuten interval na operatie (twee factorieel design)
Postoperatief beleid: levofloxacin 0,5% oogdruppels (Oftaquix) 4x daags gedurende 6 dagen na operatie |
50% van de studiepopulatie: Peri/postoperatief beleid: levofloxacin 0,5% oogdruppels (Oftaquix) 4x daags gedurende 6 dagen na operatie (twee factorieel design) |
|
Herrinton (2016) |
Intracameraal cefuroxim, dosis niet gespecificeerd |
Topicaal antibiotica, niet nader gespecificeerd |
|
Rahman (2014)
|
Intracameraal cefuroxim, dosis niet gespecificeerd
Postoperatief beleid: topicale antibiotica (veelal chloramphenicol of ofloxacine) |
Subconjunctivaal gentamicin
Postoperatief beleid: topicale antibiotica (veelal chloramphenicol of ofloxacine) |
|
Röck (2014) |
Intracameraal cefuroxim, 1mg cefuroxim in 0,1ml
Postoperatief beleid: 4x daags moxifloxacine druppels gedurende twee weken |
Subconjunctivaal Mezlocillin, 50mg en 4x daags gentamycine druppels gedurende twee weken
|
|
Sharma (2015) |
Intracameraal cefuroxim, 1,0 mg in 0,1 mL zoutoplossing
Postoperatief beleid: ofloxacin 0,3% 4x daags gedurende 1 week en topicale prednisolon acetaat 1,0% 4x daags gedurende 1 week en daarna afbouwend |
Postoperatief beleid: ofloxacin 0,3% 4x daags gedurende 1 week en topicale prednisolon acetaat 1,0% 4x daags gedurende 1 week en daarna afbouwend
|
|
Galvis (2014) |
Intracameraal moxifloxacine, 0,05 mL moxifloxacine 0,5%
Postoperatief beleid: gatifloxacin of moxifloxacine 4x daags vanaf de dag voor operatie tot 8-10 dagen na de operatie |
Postoperatief beleid: gatifloxacin of moxifloxacine 4x daags vanaf de dag voor operatie tot 8-10 dagen na de operatie |
|
Haripriya (2017) |
Intracameraal moxifloxacine, 0,1 ml moxifloxacine 0.5%
Postoperatief beleid: topicale ofloxacin |
Postoperatief beleid: topicale ofloxacin |
|
Herrinton (2016) |
Intracameraal moxifloxacine, dosis niet gespecificeerd |
Topicaal antibiotica, niet nader gespecificeerd |
|
Rudnisky (2014) |
Intracameraal moxifloxacine, dosis niet gespecificeerd
Postoperatief beleid: 35,1% ontving moxifloxacin; 9,5% ontving ofloxacin; 8,2% ontving ciprofloxacin; 4,3% ontving gatifloxacin; 4.0% ontving moxifloxacine + tobramycin; 1,0% ontving polymyxin B, en 0,5% ontving moxifloxacine + neomycin + polymyxin B (Maxitrol) |
Postoperatief beleid: 35,1% ontving moxifloxacin; 9,5% ontving ofloxacin; 8,2% ontving ciprofloxacin; 4,3% ontving gatifloxacin; 4.0% ontving moxifloxacine + tobramycin; 1,0% ontving polymyxin B, en 0,5% ontving moxifloxacine + neomycin + polymyxin B (Maxitrol) |
|
Anijeet (2010) |
Intracameraal vancomycine, 1 mg in 0,1 mL zoutoplossing
Postoperatief beleid: prednisolon acetaat 1% eens per 2 uur gedurende 2 weken, daarna afgebouwd in de aansluitende 4 weken. Daarnaast topicale fusidinezuur gedurende 10 dagen |
Postoperatief beleid: prednisolon acetaat 1% eens per 2 uur gedurende 2 weken, daarna afgebouwd in de aansluitende 4 weken. Daarnaast topicale fusidinezuur gedurende 10 dagen |
|
Au (2016) |
Intracameraal vancomycine, 1 mg/0,1 ml
Postoperatief beleid: topicaal dexamethason druppels (1mg/ml) 4x daags en topicale chloramphenical (0,5%) gedurende 4 weken |
Postoperatief beleid: topicaal dexamethason druppels (1mg/ml) 4x daags en topicale chloramphenical (0,5%) gedurende 4 weken postoperatief. |
|
Rudnisky (2014) |
Intracameraal vancomycine, dosis niet gespecificeerd
Postoperatief beleid: 35,1% ontving moxifloxacin; 9,5% ontving ofloxacin; 8,2% ontving ciprofloxacin; 4,3% ontving gatifloxacin; 4.0% ontving moxifloxacine + tobramycin; 1,0% ontving polymyxin B, en 0,5% ontving moxifloxacine + neomycin + polymyxin B (Maxitrol) |
Postoperatief beleid: 35,1% ontving moxifloxacin; 9,5% ontving ofloxacin; 8,2% ontving ciprofloxacin; 4,3% ontving gatifloxacin; 4.0% ontving moxifloxacine + tobramycin; 1,0% ontving polymyxin B, en 0,5% ontving moxifloxacine + neomycin + polymyxin B (Maxitrol) |
|
Rush (2015) |
Intracameraal vancomycine, 0,2 ml 1% oplossing
Postoperatief beleid: Besivance 3x daags gedurende twee weken met daarnaast topicale corticosteroïde - en topicale non-steroide ontstekingsremmende medicatie |
Postoperatief beleid: Besivance 3x daags gedurende twee weken met daarnaast topicale corticosteroïdes en topicale non-steroïde ontstekingsremmende medicatie
|
García-Sáenz (2009) betreft een voor- nastudie waarbij de incidentie van endoftalmitis na introductie van intracamerale antibiotica-injecties (oktober 2005 tot 2008: 7.057 patiënten) werd vergeleken met de voorgaande periode waar intracamerale antibiotica-injecties nog niet werden toegepast (1999 tot oktober 2005: 6.595 patiënten). Intracamerale cefuroxim werd toegediend in 1,0 mg in 0,1 mL zoutoplossing aan het einde van de operatie. In de voorgaande periode kregen patiënten ofloxacine 0,3% 4x daags gedurende 1 week. Gedurende de gehele studieperiode kregen de patiënten dezelfde postoperatieve steroïde en ontstekingsremmende medicatie. De studie rapporteerde tevens over de incidentie van TASS gedurende de verschillende tijdsperiodes.
Morgan (2002) betreft eveneens een voor- nastudie waarbij de incidentie van endoftalmitis na introductie van intracamerale antibiotica-injecties (1996 tot 2000: 32.180 cataractoperaties) werd vergeleken met de voorgaande periode waar intracamerale antibiotica-injecties nog niet werden toegepast (1990 tot 2005: 34.102 cataractoperaties). Intracamerale cefuroxim werd toegediend in 1,0 mg in 0,1 mL zoutoplossing 0,9% aan het einde van de operatie. Er werd in de periode van 1996 tot 2000 geen postoperatief antibiotica druppelen voorgeschreven. Tussen 1990 en 1993 werd er postoperatief een subconjunctivale injectie 20mg gentamicine toegediend (21.296 cataractoperaties) en in de periode 1993 tot 1995 werd de conjunctivaalzak gespoeld met een chloorhexidine 0,05% oplossing (12.806 cataractoperaties).
Lundström (2006) is een prospectieve multicenter cohort studie met data van 225.471 cataractoperaties die tussen 2002 en 2004 waren uitgevoerd. Daarvan werden bij 223.156 cataractoperaties aan het einde van de procedure 1mg intracamerale cefuroxim toegediend. Bij 2.315 cataract werd geen intracamerale cefuroxim gegeven, voornamelijk uit angst voor het veroorzaken van allergische reacties.
Melega (2018) evalueerde de incidentie van endoftalmitis in een RCT waarin intracameraal 0,5% moxifloxacine (1.818 cataractoperaties, gelijke aantal patiënten) werd vergeleken met een groep die geen intracamerale antibiotica-injectie ontving (1.822 cataractoperaties, gelijke aantal patiënten). Postoperatief beleid was in beide groepen hetzelfde: 0,5% moxifloxacine en 0,1% dexamethason oogdruppels direct na de operatie en elke drie uur 0,5% moxifloxacine met 0,1% dexamethason oogdruppels gedurende zeven dagen. Na zeven dagen werd er gedurende drie weken alleen nog met 0,1% dexamethason gedruppeld.
Resultaten
Endoftalmitis
PICO-1: De resultaten van de incidentie van endofthalmitis zijn gepoold naar type antibiotica (zie figuur 1). In alle studies was er een lagere incidentie van endoftalmitis wanneer er een intracamerale antibiotica-injectie was toegediend vergeleken met de groep cataractoperaties waar geen intracamerale antibiotica-injectie was toegediend. De gepoolde odds van alle studies, ongeacht intracamerale antibioticatype is 0,16 (95% BI 0,10 tot 0,25).
Cefuroxim
Montan (2002), Myneni (2013) en Yu-Wai-Man (2008) toonden een iets minder groot verschil tussen beide groepen vergeleken met de andere drie studies (Arshinoff, Carcía-Sáenz, 2009 en Lundstrom, 2011). Mogelijk heeft dit te maken met het feit dat deze studies intracamerale antibiotica-injecties vergelijken met subconjuctivale injecties. De gepoolde odds ratio van alle zes studies naar cefuroxim is 0,17 (95% BI 0,10 tot 0,27).
Moxifloxacine
De gepoolde odds ratio van twee studies naar moxifloxacine is 0,15 (95% BI 0,02 tot 0,92).
Vancomycine
Slechts één studie (Arshinoff, 2011) onderzocht de incidentie van endoftalmitis bij intracamerale injecties met vancomycine. De bijbehorende odds ratio is 0,04 (95% BI 0,00 tot 0,69).
Figuur 1 Gepoolde resultaten van de studies Intracamerale antibiotica injectie zonder post-op druppelen (PICO 1)
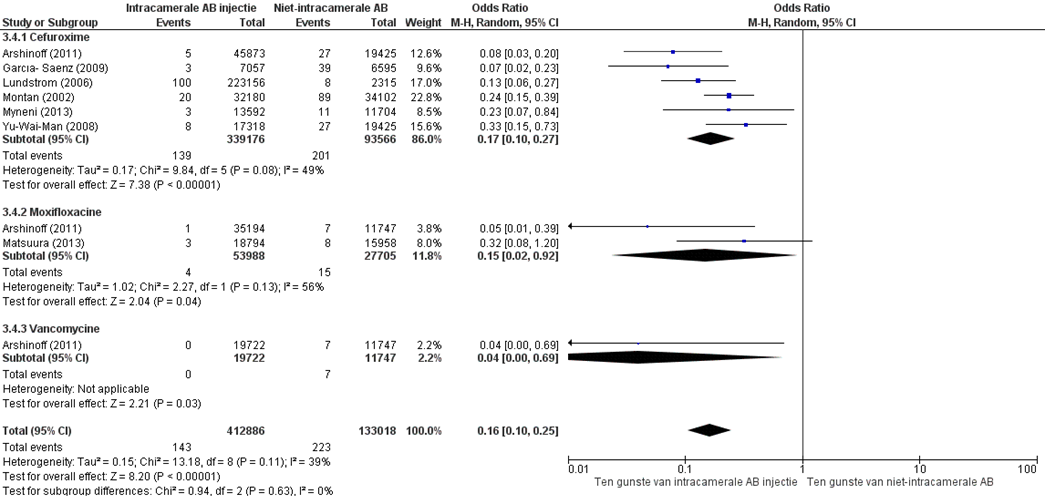
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; AB=antibiotica, IC=intracameraal
Toxic anterior segment syndroom (TASS)
Twee studies onderzochten het optreden van TASS (García-Sáenz, 2009; Matsuura, 2013). García-Sáenz (2009) rapporteerde geen gevallen van TASS in een studie waarin intracamerale cefuroxim werd vergeleken met postoperatief druppelen met ofloxacine. Ook Matsuura (2013) rapporteerde geen gevallen van TASS in een studie waarin intracamerale moxifloxacine werd vergeleken met niet-intracamerale antibiotica toediening.
PICO-2: In alle studies was er een lagere incidentie van endoftalmitis wanneer intracamerale antibiotica-injectie plus postoperatief antibiotica druppelen was toegediend vergeleken met de groep cataractoperaties waar geen intracamerale antibiotica-injectie was toegediend (zie figuur 4.3). De gepoolde odds van alle observationele studies, ongeacht intracamerale antibioticatype is 0,23 (95% BI 0,13 tot 0,42) (zie figuur 2).
Cefuroxim
De gepoolde odds ratio van zes observationele studies naar cefuroxim is 0,24 (95% BI 0,10 tot 0,56). Het relatief risico van de RCT van ESCRC (2007) is 0,21 (95% BI 0,08 tot 0,55).
Moxifloxacine
De gepoolde odds ratio van vier studies naar moxifloxacine is 0,38 (95% BI 0,14 tot 1,04). Het relatief risico van de RCT van Melega (2018) is 0,14 (95% BI 0,02 tot 1,16).
Vancomycine
De gepoolde odds ratio van vier studies naar vancomycine is 0,10 (95% BI 0,02 tot 0.59).
Figuur 2 Gepoolde resultaten van de studies naar intracamerale antibiotica-injectie met postoperatief druppelen vergeleken met niet-intracamerale antibiotica-injectie (PICO 2)
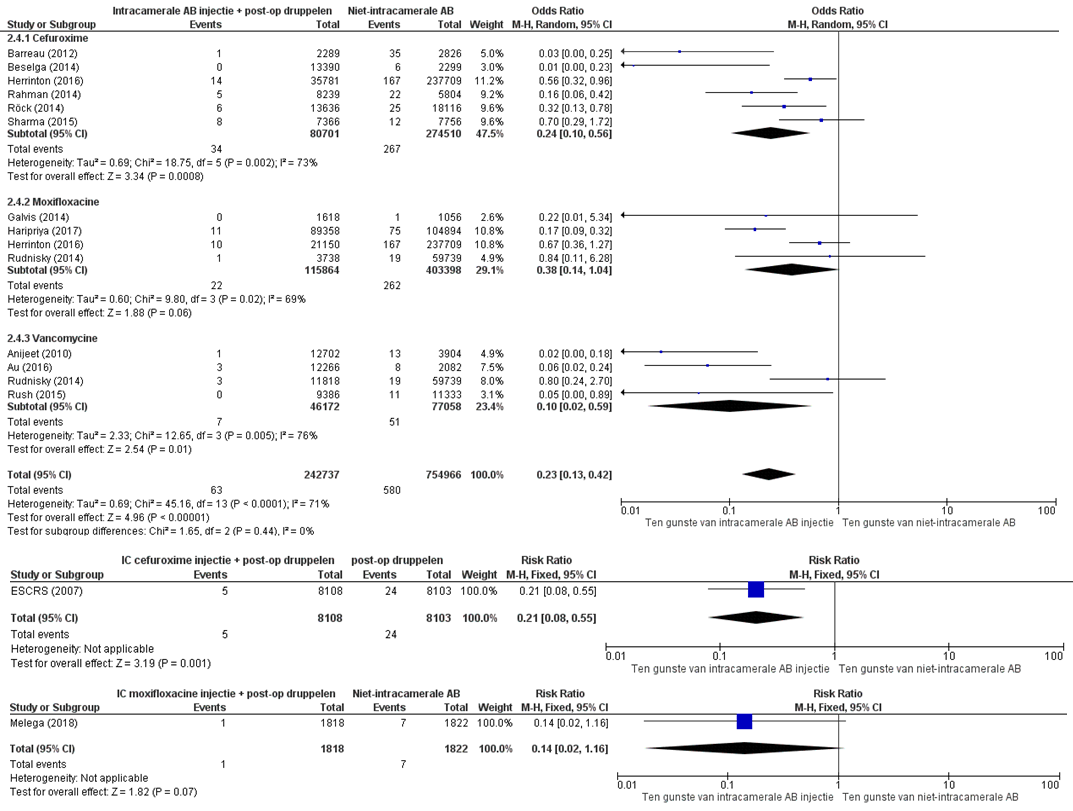
Z: p-waarde van het gepoolde effect; df: degrees of freedom (vrijheidsgraden); I2: statistische heterogeniteit; CI: betrouwbaarheidsinterval; A=gepoolde resultaten van de observationele studies; B=RCT cefuroxim en C= RCT moxifloxacine AB=antibiotica; IC= intracameraal
Toxic anterior segment syndroom (TASS)
Drie studies rapporteerden over de incidentie TASS (ESCRS, 2007; Haripriya, 2017; Rush 2015). Twee daarvan (Haripriya, 2017; Rush 2015) rapporteerden geen gevallen van TASS.
ESCRS (2017) rapporteerde één geval van TASS in de gehele studiepopulatie (n=16.211), maar er werd niet nader gespecificeerd in welke studie-arm.
Bewijskracht van de literatuur
Endofthalmitis: PICO 1
De bewijskracht van meta-analyses met observationele studies start ‘laag’. Voor cefuroxim is de bewijskracht opgewaardeerd naar ‘redelijk’ gezien de grote studiepopulatie en het robuuste resultaat. De bewijskracht voor moxifloxacine is niet opgewaardeerd gezien de heterogeniteit van het resultaat (inconsistentie). De bewijskracht voor vancomycine is gewaardeerd op ‘zeer laag’ aangezien er slechts één studie voor deze vergelijking kon worden geïncludeerd (imprecisie).
Endoftalmitis: PICO 2
De bewijskracht van meta-analyses met observationele studies starten ‘laag’. De bewijskracht van RCT’s starten ‘hoog’. De bewijskracht uit de meta-analyse is opgewaardeerd van ‘laag’ naar ‘redelijk’ gezien de grote studiepopulatie en het robuuste resultaat. De bewijskracht van de RCT is verlaagd van ‘hoog’ naar ‘redelijk’ gezien beperkingen in de studieopzet (risk of bias: gebrek aan blindering). De bewijskracht van cefuroxim is gewaardeerd op ‘redelijk’.
De bewijskracht van moxifloxacine is gewaardeerd op ‘laag’. De bewijskracht van het gepoolde resultaat voor moxifloxacine is niet opgewaardeerd gezien de heterogeniteit van de geïncludeerde studies (inconsistentie). De bewijskracht van de RCT is verlaagd van ‘hoog’ naar ‘laag’ gezien beperkingen in de studieopzet (risk of bias: gebrek aan blindering) en de overlap met de grens voor klinische relevantie (imprecisie).
De bewijskracht van vancomycine is gewaardeerd op ‘laag’. De bewijskracht uit de meta-analyse is niet opgewaardeerd gezien de heterogeniteit van de geïncludeerde studies (inconsistentie).
TASS
De bewijskracht van observationele studies starten ‘laag’. Gezien het lage aantal cases (imprecisie) is er voor gekozen de bewijskracht niet op te waarderen. De bewijskracht is daarom gewaardeerd als ‘laag’.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
PICO 1: Wat is de effectiviteit van intracamerale antibiotica injectie zonder postoperatief antibiotica druppelen voor de preventie van endoftalmitis bij volwassen die cataractoperatie ondergaan?
PICO 2: Wat is de effectiviteit van intracamerale antibiotica injectie met postoperatief antibiotica druppelen voor de preventie van endoftalmitis bij volwassen die cataractoperatie ondergaan?
PICO 1
P: volwassenen die cataractoperatie ondergaan;
I: intracamerale antibiotica injectie (cefuroxim, vancomycin, gentamycin of moxifoxacin) zonder post-op druppelen;
C: antibiotica, anders dan intracameraal;
O: endoftalmitis, toxic anterior segment syndroom (TASS).
PICO 2
P: volwassenen die cataractoperatie ondergaan;
I: intracamerale antibiotica (cefuroxim, vancomycin, gentamycin of moxifoxacin) injectie met post-op druppelen;
C: antibiotica, anders dan intracameraal;
O: endoftalmitis, toxic anterior segment syndroom (TASS).
Relevante uitkomstmaten
De werkgroep achtte endoftalmitis en TASS (naar aanleiding van antibioticagebruik) voor de besluitvorming cruciale uitkomstmaten. De werkgroep definieerde niet a priori de genoemde uitkomstmaten, maar hanteerde de in de studies gebruikte definities. Voor endoftalmitis en TASS werd een absoluut risico verschil van > 0 of een risk ratio > 1 als een klinisch (patiënt) relevant verschil gezien evenals voor TASS.
Zoeken en selecteren (Methode)
In de databases Medline en Embase is met relevante zoektermen in eerste instantie gezocht naar systematische reviews (gezocht in ten minste twee relevante databases, risk of bias beoordeling aanwezig en de resultaten van individuele studies voldoende gepresenteerd) en RCT’s. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 90 treffers op.
Op basis van titel en abstract werden in eerste instantie 12 studies voorgeselecteerd. De studies dienden in ieder geval de uitkomstmaat endoftalmitis te beschrijven. In deze selectie zat de systematische review van Bowen (2018). Bowen (2018) includeerde observationele studies en een RCT tot aan januari 2017. Voor PICO 1 includeerde Bowen (2018) vier studies en voor PICO 2 werden 15 studies geïncludeerd. Gezien de relatief robuuste resultaten van deze systematische review over de preventie van endoftalmitis werd besloten niet een aanvullende search uit te voeren naar observationele studies over de preventie van endoftalmitis na januari 2017.
Resultaten
Voor het beantwoorden van de uitgangsvraag werd de systematische review van Bowen (2018) geselecteerd. Deze resultaten werden aangevuld met de RCT van Melega (2018). Via het bestuderen van de referenties van de geselecteerde literatuur kwamen nog eens drie observationele studies naar voren. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Bowen, R. C., Zhou, A. X., Bondalapati, S., Lawyer, T. W., Snow, K. B., Evans, P. R.,... & Mamalis, C. A. (2018). Comparative analysis of the safety and efficacy of intracameral cefuroxim, moxifloxacine and vancomycin at the end of cataract surgery: a meta-analysis. British Journal of Ophthalmology, 102(9), 1268-1276.
- ESCRS Endophthalmitis Study Group. (2007). Prophylaxis of postoperative endophthalmitis following cataract surgery: results of the ESCRS multicenter study and identification of risk factors. Journal of Cataract & Refractive Surgery, 33(6), 978-988.
- García-Sáenz, M. C., Arias-Puente, A., Rodríguez-Caravaca, G., & Bañuelos, J. B. (2010). Effectiveness of intracameral cefuroxim in preventing endophthalmitis after cataract surgery: ten-year comparative study. Journal of Cataract & Refractive Surgery, 36(2), 203-207.
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., & Montan, P. (2007). Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology, 114(5), 866-870.
- Melega, M. V., Alves, M., Lira, R. P. C., da Silva, I. C., Ferreira, B. G., Assis Filho, H. L.,... & Arieta, C. E. L. (2019). Safety and efficacy of intracameral moxifloxacine for prevention of post-cataract endophthalmitis: Randomized controlled clinical trial. Journal of Cataract & Refractive Surgery, 45(3), 343-350.
- Montan, P. G., Wejde, G., Koranyi, G., & Rylander, M. (2002). Prophylactic intracameral cefuroxim: efficacy in preventing endophthalmitis after cataract surgery. Journal of Cataract & Refractive Surgery, 28(6), 977-981.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Bowen, 2018
study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of retrospective cohort studies + 1 RCT
Literature search up to Jan 2017
PICO 1: A: Arshinoff (2011) C: Yu-Wai-Man (2008) D: Arshinoff (2011) E: Matsuura (2013) F: Arshinoff (2011)
PICO 2: G: Barreau (2012) H: Beselga (2014) I: ESCRS (2007) J: Herrinton (2016) K: Rahman (2014) M: Sharma (2015) N: Galvis (2014) O: Haripriya (2017) P: Herrinton (2016) Q: Rudnisky (2014) R: Anijeet (2010) S: Au (2016) T: Rudnisky (2014) U: Rush (2015)
Study design: mainly retrospective cohort studies
Setting and Country: USA
Source of funding: non commercial “None declared.”
|
Inclusion criteria SR: RCTs and observational studies that evaluated patients undergoing phacoemulsification cataract surgery with a minimum sample size of 500 eyes
Exclusion criteria SR: Studies were excluded if they included extracapsular cataract extraction (ECCE) surgeries that could not be separated from phacoemulsification surgery data.
17 studies included
Important patient characteristics at baseline:
N:
Mean age A: Not specified B: Not specifief C: Not specified D: Not specified E: Not specified F: Not specified G: Not specified H: Not specified I: Not specifed J: No mean age reported, only in groups L: M: N: O: P: Q: R: S: T: U:
Sex: A: Not specified B: Not specifief C: Not specified D: Not specified E: Not specified F: Not specified K: Not specified
Groups comparable at baseline? Studies comparing to a ‘historical cohort’. More current procedures may had smaller incisions, shorter duration and better phaco machines. |
Describe intervention:
See Table 1
|
Describe control:
See Table 1
|
End-point of follow-up: Most studies compared the prevalence in a period before and after introduction of intracameral injection. Endpoint is not based on a certain state (e.g. mortality).
For how many participants were no complete outcome data available? Not applicable
|
Outcome measure-1: POE PICO-1: cefuroxime: Pooled effect (random effects model): 0.17 [95% CI: 0.10 to 0.27] favoring intervention. Heterogeneity (I2): 49%
PICO-1: moxifloxacine: Pooled effect (random effects model): 0.15 [95% CI: 0.02 to 0.92] favoring intervention. Heterogeneity (I2): 56% PICO-1: vancomycine: Pooled effect (random effects model): 0.04 [95% CI: 0.00 to 0.69] favoring intervention. Heterogeneity (I2): not applicable (one study)
PICO-2: cefuroxime: Pooled effect (random effects model): 0.24 [95% CI: 0.10 to 0.56] favoring intervention. Heterogeneity (I2): 73%
PICO-1: moxifloxacine: Pooled effect (random effects model): 0.38 [95% CI: 0.14 to 1.04] favoring intervention. Heterogeneity (I2): 69% PICO-1: vancomycine: Pooled effect (random effects model): 0.10 [95% CI: 0.02 to 0.59] favoring intervention. Heterogeneity (I2): 76%
Outcome measure-2: TASS
PICO-1: Two studies reported about the prevalence of TASS (only Matsuura form SR). Both studies reported no cases.
PICO-2:
|
Heterogeneity: clinical and statistical heterogeneity; explained versus unexplained (subgroupanalysis) |
Risk of bias tabel
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Bowen (2018) |
Yes |
Yes |
Yes |
Yes |
No |
Yes |
Yes |
Yes |
Yes, “none declared” |
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
García-Sáenz (2009) |
Unlikely |
Unlikely |
Unclear |
Likely |
|
Montan (2002) |
Unlikely |
Unlikely |
Unlikely |
Likely |
|
Lundström (2006) |
Unlikely |
Unlikely |
Unlikely |
Unlikely |
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Melega (2018) |
random allocation sequence |
Unlikely |
Unlikely |
Likely |
Likely |
Unlikely |
Unlikely |
Unlikely |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Gower (2017) |
Review welke alleen RCT's meeneemt. ESCRS (2007) enige relevant RCT. |
|
Huang (2016) |
Review van Bowen (2018) is recenter |
|
Kessel (2015) |
Review van Bowen (2018) is recenter |
|
Brundett (2018) |
Narratief review |
|
Grzybowski (2017) |
Expert opinie |
|
Schwartz (2016) |
Expert opinie |
|
Li (2015) |
Pre-operatief profylaxe |
|
Bucci (2015) |
Pre-operatief profylaxe |
|
Hsu (2013) |
in vitro |
|
Vazirani (2013) |
Narratief review |
Verantwoording
Beoordelingsdatum en geldigheid
Publicatiedatum : 15-12-2021
Beoordeeld op geldigheid : 09-11-2021
|
Module |
Regiehouder(s) |
Jaar van autorisatie |
Eerstvolgende beoordeling actualiteit richtlijn |
Frequentie van beoordeling op actualiteit |
Wie houdt er toezicht op actualiteit |
Relevante factoren voor wijzigingen in aanbeveling |
|
4. Infectieprofylaxe |
NOG |
2021 |
2026 |
5 jaar |
NOG |
N.v.t. |
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Een richtlijn is in wezen de beschrijving van de actuele stand van de kennis, technieken en gerelateerde zaken rond het onderwerp van de richtlijn. Daarnaast heeft een richtlijn tot doel de beroepsbeoefenaars aanbevelingen te geven die de kwaliteit van hun werk mede op het gewenste niveau kunnen houden. Er is dus ook sprake van een beschrijving van kwalitatieve normen voor de beroepsgroep. Iedere arts is gehouden om primair te handelen in het belang van de patiënten daarbij zorg te dragen voor diens veiligheid in relatie tot het medische handelen. De Richtlijn Cataract stelt dan ook normen vast voor goede praktijkvoering, stelt standaarden voor patiëntenzorg en veiligheid en biedt een referentiepunt voor de beoordeling van de resultaten waaraan cataractchirurgie van hoge kwaliteit moet voldoen. De aanbevelingen, normen en standaarden zijn getoetst aan de resultaten van gedegen wetenschappelijk onderzoek, gepubliceerd in de wetenschappelijke literatuur. Indien zekere vraagstellingen niet goed beantwoord konden worden op basis van literatuuronderzoek, werden de meningen van erkende experts gehoord door de richtlijnwerkgroep en bij consensus verwerkt in de aanbevelingen.
Doelgroep
Deze richtlijn is geschreven voor met name oogartsen maar ook andere leden van de beroepsgroepen die direct betrokken zijn bij de zorg met cataract.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cataract.
Werkgroep
- Drs. B.A.E. (Bert) van der Pol, oogarts niet praktiserend, (voorzitter) NOG
- Dr. M.C. (Marjolijn) Bartels, oogarts, Deventer Ziekenhuis, NOG
- Drs. M.M.M.J. (Margot) Dellaert, oogarts, Treant Zorggroep, NOG
- Drs. Y.P. (Ype) Henry, oogarts, VU medisch centrum, NOG
- Dr. L.V. (Long) Ly, oogarts, Bergman Clinics, NOG
- Drs. R.C.M. (Marit) Maatman, oogarts, Alrijne Ziekenhuis, NOG
- Dr. N.J. (Nic) Reus, oogarts, Amphia Ziekenhuis, NOG
- Dr. N. (Nienke) Visser, oogarts, Maastricht Universitair Medisch Centrum, NOG
- Prof. Dr. R.M.M.A. (Rudy) Nuijts, oogarts, Maastricht Universitair Medisch Centrum, NOG
Met ondersteuning van
- Dr. A.C.J. (Astrid) Balemans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Josefien) Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Klankbordgroep
- H.J. (Anneke) Jansen Molenaar, Adviseur Oogzorg bij de Oogvereniging
- D. (Dana) Kamsteeg-Koerts, Optometrist, Oogziekenhuis Rotterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Van der Pol |
Niet praktiserend |
Geen |
Geen |
Geen actie |
|
Dellaert |
Oogarts |
Medisch manager, onkostenvergoeding |
Geen |
Geen actie |
|
Bartels |
Zelfstandig ondernemer, via B.V. verbonden aan Verenigde Specialisten Deventer en zo aan Deventer Ziekenhuis |
Voorzitter subcommissie Richtlijnen NOG |
Deelname aan ZonMw studie IBSCS / DBSCS via UMC Maastricht (site - investigator)
Contactpersoon namens cornea werkgroep bij hoornvliespatiënten vereniging.
|
Geen trekker van de modules over ontstekings- en infectieprofylaxe bij reguliere cataractchirurgie. |
|
Henry |
Oogarts; staflid
|
Lid van de steering group van EUREQUO (ESCRS); Secretaris van NIOIC (NOG); Voorzitter van WTO (NOG) |
Geen |
Geen actie |
|
Ly |
Oogarts bij Bergman Clinics |
Geen |
Geen |
Geen actie |
|
Maatman |
Oogarts, Alrijne Ziekenhuis
|
NOG bestuur (secretaris), betaald. Tot 2016/2017 advies Bayer / Eylea, betaald
|
Geen |
Geen trekker module ontstekingsprofylaxe reguliere cataractchirurgie. |
|
Reus |
Oogarts in het Amphia Ziekenhuis, Breda/Oosterhout
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald) Bestuurslid European Society of Cataract and Refractive Surgeons (ESCRS) (onbetaald)
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald)
1.Principal Investigator van Investigator-Initiated Trial waarvoor subsidie van Alcon (unresticted grant). Het onderwerp is de helderheid van ogen na een staaroperatie. Er wordt onderzoek gedaan naar de hoeveelheid lichtverstrooiing in de ogen na een cataractoperatie en redenen waarom er meer strooilicht in het oog overblijft na een cataractoperatie dan wordt verwacht. 2.Site-Investigator van studie naar bilaterale cataractchirurgie geïnitieerd door prof. R. Nuijts, oogarts (Universiteitskliniek voor Oogheelkunde Maastricht) waarvoor subsidie van ZonMW (unresticted grant). |
Geen trekker van modules met betrekking tot infectieprofylaxe bij reguliere cataractchirurgie en IOLs. |
|
Visser |
Oogarts, aandachtsgebieden cornea- en cataract chirurgie. Werkgever: University Eye Clinic Maastricht, MUMC+
|
Young ophthalmology committee ESCRS (onbetaald)
|
EPICAT study: Effectiveness of Periocular drug Injection in CATaract surgery (gefinancierd door ESCRS, het gaat hierbij om een restricted grant, de ESCRS heeft op voorhand akkoord gegeven voor de specifieke opzet, uitvoering, en terugkoppeling van de EPICAT studie) |
Geen actie |
|
Nuijts |
Prof.dr. RMMA Nuijts, hoogleraar Corneatransplantatie en Refractiechirurgie; MUMC Maastricht
|
- Voorzitter Nederlandse IntraOculaire Implant Club, NIOIC (onbetaald) |
Abbott: NL 56878.068.16/METC162029 A randomised, subject-masked evaluation of visual function after bilateral implantation of two types of presbyopia-correcting IOLs: the Symfony-study. Period: 01-12-2016 - 01-12-2018
Alcon: VERION versus conventional, manual ink-marking in toric IOL implantation. Period: 2015 - 2016
Alcon: ILJ466-P003 Post-Market Investigation of the Clareon IOL. Period: 2018 - 2028
Alcon: The ACRYSOF IQ PanOptix Presbyopia Correcting intraocular lens (IOL) Model TFNT00. Period: 01-12-2015 - 01-12-2017
CHIESI: NL 54419.000.15/CCMO15.0538 Multinational, multicentre, prospective, open-label, uncontrolled clinical trial to assess the efficacy and safety of Autologous Cultivated Limbal Stem Cells Transplantation (ACLSCT) for restoration of corneal epithelium in patients with limbal stem cell deficiency due to ocular burns. Period: 01-12-2016 - 01-12-2018
ESCRS: European Cornea and Cell Transplantation Registry (ECCTR), European Union Third Health Programme 2014-2020 and the European Society of Cataract and Refractive Surgeons. Period: 01-04-2016 - 2019
ESCRS: The ESCRS PREMED study: PREvention of Macular EDema after cataract surgery. Period: 2012 - 2016
InSciTE: EyeScite: smart biomedical solutions for better eyesight. |
Geen trekker van de modules met betrekking tot infectie- en onstekingsprofylaxe en IOLs bij reguliere cataractchirurgie. |
|
Kamsteeg-Koerts (klankbordgroep) |
Optometrist, Oogziekenhuis Rotterdam |
- Per 25 november 2019 lid OVN ledenraad met een aanstelling voor 3 jaar - Lid OVN commissie Beroepsbelangen |
Geen
|
Geen actie |
|
Jansen-Molenaar |
Adviseur Oogzorg bij de Oogvereniging |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Een afgevaardigde van de Oogvereniging nam zitting in de klankbordgroep. Daarnaast werden de Oogvereniging en de Patiëntenfederatie uitgenodigd om deel te nemen aan de schriftelijke knelpuntenanalyse. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de betrokken patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met cataract. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule cataract (2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door het Nederlands Oogheelkundig Gezelschap (NOG), de Nederlandse Vereniging voor Klinische Geriatrie (NVKG), het Nederlands Huisartsen Genootschap (NHG), de Oogvereniging, Verenso en de Landelijke Vereniging van Operatieassistenten (LVO) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen in de bijlagen.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) en belangrijk (maar niet cruciaal). Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimale klinisch relevante verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden die meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID)
2011-heden
Engels |
1 exp Cataract/ or exp Cataract Extraction/ or (Cataract* or (Lens* adj2 Opacit*) or Pseudoaphakia* or Capsulorhexis or Phacoemulsification).ti,ab,kf. (70854) 2 exp *Anti-Bacterial Agents/ad, tu or cefuroxim/ or chloramphenicol/ or gentamicins/ or ofloxacin/ or vancomycin/ or (cefuroxim* or vancomycin* or gentamycin* or ofloxacin* or chloramphenicol* or antibiotic*).ti,ab,kf. (472237) 3 1 and 2 (1629) 4 Endophthalmitis.ti,ab,kf. or exp Endophthalmitis/ (9699) 5 1 and 4 (2799) 6 3 or 5 (3440) 7 prevention & control.fs. or (prophyla* or prevent*).ti,ab,kf. (2286690) 8 Antibiotic Prophylaxis/ (13184) 9 7 or 8 (2288187) 10 6 and 9 (1013) 11 limit 10 to english language (873) 12 limit 11 to ed=20110501-20190831 (338) 13 limit 11 to yr="2011 -Current" (361) 14 12 or 13 (370) 15 ((meta-analysis/ or meta-analysis as topic/ or (metaanaly* or metanaly* or meta-analy* or meta synthes* or metasynthes* or (pooled adj3 analysis)).ti,ab,kf. or ((systematic* or scoping or evidence based) adj3 (review* or overview*)).ti,ab,kf. or ((evidence or research) adj3 synthesis).ti,kf. or systematic review.pt. or (prisma or (("structured literature" or comprehensive or "quantitative literature" or evidence-based) adj2 (search or review)) or "systematic search" or ((systemic or systematized) adj3 review) or "systematic research synthesis" or (review* adj3 independent*))).ti,ab,kf. or (((quantitative or rapid or short or critical* or structured or comparative or comparitive or evidence or comprehensive) adj3 (review* or overview*)).ti. and search.ab.) or "Review Literature as Topic"/ or cochrane.jw. or (cochrane or embase or medline or cinahl or cinhal or cancerlit).ab. or (("selection criteria" or "data extraction").ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) (340108) 16 14 and 15 (11) > 10 uniek 17 (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or clinic$ trial$1.tw. or (clinic$ adj trial$1).tw. or ((singl$ or doubl$ or treb$ or tripl$) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo$.tw. or randomly allocated.tw. or (allocated adj2 random$).tw.) not (animals/ not humans/) (1463702) 18 14 and 17 (61) 19 18 not 16 (55) |
90 |
|
|
(('cataract'/exp/mj OR 'cataract extraction'/exp/mj OR cataract:ti,ab OR pseudoaphakia:ti,ab OR capsulorhexis:ti,ab OR phacoemulsification:ti,ab OR ((lens* NEAR/2 opacit*):ti,ab)) AND ('antibiotic agent'/exp/mj/dd_do,dd_dt,dd_cr,dd_ad OR cefuroxim*:ti,ab,kw OR vancomycin*:ti,ab,kw OR gentamycin*:ti,ab,kw OR ofloxacin*:ti,ab,kw OR chloramphenicol*:ti,ab,kw OR antibiotic*:ti,ab,kw) OR (('cataract'/exp/mj OR 'cataract extraction'/exp/mj OR cataract:ti,ab OR pseudoaphakia:ti,ab OR capsulorhexis:ti,ab OR phacoemulsification:ti,ab OR ((lens* NEAR/2 opacit*):ti,ab)) AND ('endophthalmitis'/exp/dm_pc OR endophthalmitis:ab,ti))) AND ('antibiotic prophylaxis'/exp OR prophylaxis:ab,ti OR preventi*:ab,ti OR prevention:lnk) AND [english]/lim AND [embase]/lim NOT 'conference abstract':it AND [2011-2019]/py AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR ((systematic NEAR/1 (review OR overview)):ab,ti) OR ((meta NEAR/1 analy*):ab,ti) OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT (('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) (10) > 1 uniek ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it" (40) > 24 uniek |
|
