Formule lenssterkte berekening bij cataractchirurgie na voorafgaande refractiechirurgie
Uitgangsvraag
Welke formule(s) voor het berekenen van de lenssterkte in patiënten die refractiechirurgie ondergaan hebben heeft/hebben de voorkeur door de komst van nieuwe lensformules?
Aanbeveling
Gebruik één van de gangbare lensformules voor de post-refractiechirurgie patiënten die cataractchirurgie moeten ondergaan.
Overweeg voor de IOL-berekening na refractiechirurgie gebruik te maken van een combinatie van meerdere methoden / lensformules om het voorspelde postoperatieve sferische equivalent te vergelijken. De post refractive IOL calculator van de American Society of Cataract and Refractive Surgery (ASCRS) maakt gebruik van meerdere analysemethoden (zie: https://iolcalc.ascrs.org/).
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Op basis van de beschikbare literatuur is er geen duidelijke voorkeur voor welke lenssterkteformule de beste berekening van de gemiddelde prediction error voor myope ogen, hyperope ogen en ogen met radiaire keratotomie geeft.
Uit de analyse van de myope ogen blijkt er een klinisch relevant verschil te zijn tussen de Haigis-L en de Shammas-K (MD= 0,41 (95% BI= -0,61 tot -0.21) en de SRK/T en de Holladay I (MD= 0,25 (95% BI= -0,07 tot 0,56). Het verschil valt binnen de waarde van 0,25 dioptrie die als klinisch (voor de patiënt) relevant verschil wordt beschouwd. De bewijskracht hiervoor is echter laag. Daarnaast dient in aanmerking genomen te worden dat het klinisch relevante verschil van de Haigis-L en de Shammas-K is gebaseerd op de resultaten van één enkele studie. Voor de vergelijkingen Haigis-L versus Shammas-PL, Haigis-L versus Shammas, Haigis-L versus SRK/T, Haigis-L versus Holladay I, SRK/T versus Hoffer Q en Holladay I versus Hoffer Q werden geen verschillen gevonden. De bewijskracht hiervoor is laag. Ook voor de vergelijkingen van de Haigis-L versus Hoffer Q, Haigis-L versus Barrett True-K en Haigis-L versus Barrett True-K no history method werden geen verschillen gevonden. De bewijskracht hiervoor is zeer laag.
Voor de hyperope ogen is het op basis van de beschikbare literatuur onduidelijk welke lenssterkteformule de voorkeur heeft bij het berekenen van de gemiddelde prediction error voor hyperope ogen. Uit de analyse van de resultaten voor hyperope ogen blijkt er geen verschil te zijn tussen de Haigis-L en Shammas en tussen de Haigis-L en de Barrett True-K no history method lenssterkteformules. De bewijskracht hiervoor is laag. Voor de overige vergelijkingen (Haigis-L versus Shammas-PL, Haigis-L versus Shammas-K, Haigis-L versus SRK/T, Haigis-L versus Hoffer Q, Haigis-L versus Holladay 1, SRK/T versus Holladay I, SRK/T versus Hoffer Q, Holladay I versus Hoffer Q en Haigis-L versus Barrett True-K) zijn geen studies gevonden van voldoende methodologische kwaliteit om te kunnen gebruiken voor klinische besluitvorming.
Er is literatuuronderzoek uitgevoerd naar lenssterkteformules die de voorkeur hebben bij het berekenen van de gemiddelde prediction error voor ogen met radiaire keratotomie. Er zijn geen studies gevonden die van voldoende methodologische kwaliteit waren om te kunnen gebruiken voor klinische besluitvorming.
Voor de IOL-berekening na refractiechirurgie kan ter vergelijking van voorspeld postoperatief spherisch equivalent gebruik gemaakt worden van een combinatie van meerdere methoden / lensformules. De lens calculator van de American Society of Cataract and Refractive Surgery (ASCRS) postrefractive IOL calculator incorporeert meerdere vaak gebruikte methoden (zie: https://iolcalc.ascrs.org/)).
Er is sprake van een kennislacune aangaande het onderwerp wat de beste lenssterkteformule is voor de berekening post-refractiechirurgie. De studies zijn vooral uitgevoerd in een klein aantal patiënten met relatief een lage grade aan evidence.
Tevens zijn de studies niet altijd methodologisch goed uitgevoerd, waarbij er niet goed onderscheid werd gemaakt in de toegepaste techniek qua refractiechirurgie. Ook is het niet in alle studies duidelijk of er goede subanalyses uitgevoerd zijn en of patiënten vooraf aan de refractiechirurgie hyperoop of myoop waren. Dit heeft invloed op de nauwkeurigheid van de berekening.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers)
Patiënten die eerder refractiechirurgie hebben ondergaan, hebben vaak hoge verwachtingen en wensen over de brilonafhankelijkheid. De lensformules lijken in de praktijk over het algemeen redelijk goed uit te komen, maar uit de literatuur is onvoldoende bewijs te halen dat bepaalde lensformules superieur zijn ten opzichte van andere. De eventuele onvoorspelbaarheden qua prediction error dienen met de patiënt besproken te worden zodat te hoge verwachtingen bijgesteld worden.
Kosten (middelenbeslag)
Niet alle commercieel verkrijgbare biometrie-apparatuur beschikt over alle moderne lensformules. Wel kan handmatig de lenssterkte berekend worden met de postrefractive IOL calculator van de American Society of Cataract and Refractive Surgery (ASCRS) calculator. Er dient dan wel extra te worden gelet op overschrijffouten. Indien één lensformule er beter uit zou springen, zou er geadviseerd kunnen worden een bepaalde biometer aan te schaffen.
Een andere optie is het gebruik van intra-operatieve aberrometrie. Intra-operatieve aberrometrie vergt een investering die mogelijk doorberekend zou worden naar de patiënt onder co-payment omstandigheden. De waarde van intra-operatieve aberrometrie is echter nog niet voldoende vastgesteld qua geringere prediction error in vergelijking met de conventionele biometrie / lenssterkte berekening.
Aanvaardbaarheid, haalbaarheid en implementatie
Omdat uit de analyse naar voren komt dat er geen verschillen zijn in de Mean Prediction Error tussen de verschillende lensformules, verwachten wij geen problemen bij de implementatie van de huidige aanbevelingen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Voor de myope ogen verschillen de gangbare lensformules Haigis-L, Shammas-PL, Shammas-K, Shammas, SRK/T, Hoffer Q, Holladay I, Barrett True-K en Barrett True-K no history method weinig van elkaar. Vanwege het gebrek aan literatuur over Shammas-PL, Shammas-k, SRK/T, Hoffer Q, Holladay 1 en Barrett True-K voor hyperope en ogen met radiaire keratotomie is niet duidelijk welke formule beter voorspelt dan de gangbare formules die langer in gebruik zijn.
Onderbouwing
Achtergrond
De benodigde sterkte van de kunstlens om een voorgenomen postoperatieve refractieve uitkomst te behalen met de cataractoperatie wordt berekend met behulp van verschillende formules. Het nauwkeurig voorspellen van de postoperatieve refractie is belangrijk voor de patiënt, zeker met het gebruik van torische en/of multifocale en Extended Depth Of Focus (EDOF) kunstlenzen. Daarnaast is het percentage patiënten dat eindigt binnen 1 dioptrie van de beoogde refractie één van de uitkomstindicatoren voor cataractchirurgie. De prediction error wordt gedefinieerd als de postoperatieve refractie (sferisch equivalent) minus de beoogde refractie (i.e., sferisch equivalent van doelrefractie). In deze module wordt de prediction error vergeleken tussen verschillende lenssterkteformules.
Conclusies / Summary of Findings
1. Myope ogen
|
Laag GRADE |
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Shammas-PL bij patiënten met myope ogen.
De Haigis-L geeft een klinisch relevant kleinere gemiddelde absolute prediction error dan de Shammas-K bij patiënten met myope ogen. Echter, de bewijskracht is laag.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Shammas bij patiënten met myope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de SRK/T bij patiënten met myope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Hoffer Q bij patiënten met myope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Holladay 1 bij patiënten met myope ogen.
De SRK/T geeft een klinisch relevant kleinere gemiddelde absolute prediction error dan de Holladay I bij patiënten met myope ogen. Echter, de bewijskracht is laag.
De gemiddelde absolute prediction error van de Holladay I lijkt niet te verschillen van de Hoffer Q bij patiënten met myope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet klinisch relevant te verschillen van de Barrett True-K bij patiënten met myope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Barrett True-K no history method bij patiënten met myope ogen.
Bronnen: (Abulafia, 2018; Arce, 2009; Cho, 2018; De Mill, 2011; Helaly, 2016; Jin 2010; Savini, 2010; Shammas, 2007; Wang, 2004; Wang, 2010) |
|
Zeer laag GRADE |
Het is onzeker of de gemiddelde absolute prediction error van de Haigis-L verschilt van de Hoffer Q bij patiënten met myope ogen.
Het onzeker of de gemiddelde absolute prediction error van de Holladay I verschilt van de Hoffer Q bij patiënten met myope ogen.
Het is onzeker of de gemiddelde absolute prediction error van de Haigis-L verschilt van de Barrett True-K no history method bij patiënten met myope ogen.
Bronnen: (Abulafia, 2016; Arce, 2009; Cho, 2018; Jin, 2010; Shammas, 2007; Wang, 2004) |
2. Hyperope ogen
|
Laag GRADE |
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Shammas bij patiënten met hyperope ogen.
De gemiddelde absolute prediction error van de Haigis-L lijkt niet te verschillen van de Barrett True-K no history method bij patiënten met hyperope ogen.
Bronnen: (Francone, 2019; Vrijman, 2019) |
|
- GRADE |
Het is niet mogelijk om conclusies te trekken of de bewijskracht te graderen middels de GRADE-methodiek voor de volgende vergelijkingen:
|
3. Radiaire keratotomie
|
- GRADE |
Het is niet mogelijk om conclusies te trekken of de bewijskracht te graderen middels de GRADE-methodiek voor de volgende vergelijkingen:
|
Samenvatting literatuur
Beschrijving studies
Chen (2020) beschrijft een systematische review. Chen (2020) includeerde studies waarin patiënten met een geschiedenis van refractieve chirurgie werden onderzocht met een publicatiedatum tot en met maart 2019. Chen (2020) vergeleek verschillende formules om de intraoculaire lenssterkte te berekenen. De studies die voldeden aan de volgende criteria werden geïncludeerd: 1) studies gericht op patiënten met een voorgeschiedenis van corneale refractieve chirurgie; 2) ogen die ongecompliceerde cataractchirurgie hebben ondergaan met ‘in-de-kapsel’ gefixeerde intraoculaire lensimplantatie; 3) studies die tenminste twee geselecteerde formules voor de berekening van de intraoculaire lenssterkte hebben onderzocht (Haigis-L, Shammas-post LASIK (PL) (laser-in-situ keratomileusis), SRK/T, Holladay 1, Hoffer Q). De volgende studies werden geëxcludeerd: 1) studies die ogen met andere aandoeningen onderzochten, zoals glaucoom, uveïtis of maculadegeneratie; 2) studies die torische of multifocale of piggyback intraoculaire lensimplantatie onderzochten; 3) review-artikelen, discussiestukken, samenvattingen van conferenties, retrospectieve studies of studies waarin dieren werden onderzocht. Zes studies van de tien uit de studie van Chen (2020) voldeden aan de overige inclusiecriteria voor de richtlijnmodule (Arce, 2009; Helaly, 2016; Jin, 2010; Savini, 2010; Shammas, 2007; Wang, 2004) en werden geïncludeerd in de literatuursynthese. Vijf van de tien studies hadden het design van een prospectieve cohortstudie (Arce, 2009; Helaly, 2016; Jin, 2010; Savini, 2010; Shammas, 2007; Wang, 2004). Eén van de tien studies had het design van een prospectieve case serie (Wang, 2004). In totaal analyseerden de studies 159 ogen. De gemiddelde leeftijd van de studies varieerde van 28 tot 67 jaar. De geïncludeerde studies uit de studie van Chen (2020) rapporteerden de gemiddelde absolute prediction error als relevante uitkomstmaat.
Francone (2019) beschrijft een retrospectieve observationele studie. Francone (2019) includeerde patiënten met hyperope ogen die eerder corneale refractieve chirurgie hebben gehad en vervolgens cataractchirurgie ondergingen. De studie vergeleek de nauwkeurigheid van de Haigis-L, Shammas, Barret True-K no history method en Holladay 2 lenssterkteformules. De studie includeerde in totaal 39 ogen van 24 patiënten. Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent was -0,6 (0,8) dioptrie (range -2,3 tot 0,8). De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
Vrijman (2019) beschrijft een retrospectieve case serie. Vrijman (2019) includeerde patiënten met hyperope ogen die eerder corneale refractieve chirurgie hebben gehad en vervolgens cataractchirurgie ondergingen. Vrijman (2019) vergeleek de nauwkeurigheid van de Haigis-L, Shammas, Barret True-K no history method, Masket en Modified Masket lenssterkteformules. De studie includeerde in totaal 64 ogen van 38 patiënten. Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent was 0,02 (0,97) dioptrie (range -3,00 tot 2,75). De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
Cho (2018) beschrijft een retrospectieve review. Cho (2018) includeerde patiënten met myope ogen die eerder LASIK of PRK hebben gehad en vervolgens cataract chirurgie ondergingen. Cho (2018) vergeleek de nauwkeurigheid van de Hagis-L, Shammas-K, Barret True-K en Wang/Koch/Maloney lenssterkteformules. De studie includeerde in totaal 69 ogen van 69 patiënten. Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent was -1,32 (1,32) dioptrie. De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
Abulafia (2016) beschrijft een retrospectieve case serie. Abulafia (2016) includeerde patiënten met myope ogen die eerder LASIK of PRK (photorefractieve keratotomie) hebben gehad en vervolgens cataract chirurgie ondergingen. Abulafia (2016) vergeleek de nauwkeurigheid van de Barrett True-K lensformule met de Adjusted Atlas, Masket, Modified Masket, Wang/Koch/Maloney, Shammas en Haigis-L lenssterkteformules. De studie includeerde in totaal 88 ogen van 66 patiënten. De patiënten werden onderverdeeld in ogen, waarvoor eerdere refractieve informatie beschikbaar is (groep A, 58 ogen van 40 patiënten) en ogen waarvoor geen eerdere refractieve informatie beschikbaar is (groep B, 30 ogen van 26 patiënten). Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent voor groep A was -0,45 (0,85) dioptrie (range -3,00 tot 1,25). Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent voor groep B was -0,83 (0,90) dioptrie (range -2,88 tot 0,75). De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
De Mill (2011) beschrijft een retrospectieve studie. De Mill (2011) includeerde patiënten met myope ogen die eerder LASIK of PRK hebben gehad en vervolgens cataract chirurgie ondergingen. De Mill (2011) vergeleek de nauwkeurigheid van de oculaire Haigis-L en oculaire SRK/T. De studie includeerde in totaal 21 ogen van 17 patiënten. Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent was -0,56 (0,77) dioptrie (range -2,50 tot 0,63). De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
Wang (2010) beschrijft een retrospectieve case serie. Wang (2010) includeerde patiënten met myope ogen die eerder LASIK of PRK hebben gehad en vervolgens cataract chirurgie ondergingen. Wang (2010) vergeleek de nauwkeurigheid van de Adjusted Atlas 0-3, Masket en Modified Masket lensformules voor patiënten met verandering in manifeste refractie. Wang (2010) vergeleek de nauwkeurigheid van de Haigis-L, Shammas en Wang/Koch/Maloney lenssterkteformules voor patiënten zonder beschikbare pre-refractieve chirurgische biometrische informatie. De studie includeerde in totaal 72 ogen van 57 patiënten. Het gemiddeld (SD) post-cataract manifest sferisch refractief equivalent -0,58 (0,63) dioptrie (range -2,50 tot 0,75). De studie rapporteerde de gemiddelde absolute prediction error als relevante uitkomstmaat.
Resultaten
1. Myope ogen
Haigis-L versus Shammas-PL
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Shammas-PL is onderzocht in drie studies (Helaly, 2016; Shammas, 2007; Wang, 2010). Het gepoolde gemiddelde verschil in absolute prediction error tussen de Haigis-L en Shammas-PL is MD= 0,06 (95% BI= -0,09 tot 0,21). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en Shammas-PL bij myope ogen (MD= 0,06; 95% BI= -0,09 tot 0,21) (zie figuur 1).
Haigis-L versus Shammas-K
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Shammas-K is onderzocht in één studie (Cho, 2018). De gemiddelde absolute prediction error van de Haigis-L was 0,51 (SD 0,44) versus 0,92 (SD 0,63) van de Shammas-K (MD= 0,41 (95% BI= -0,61 tot -0.21; p<0,0001). De Haigis-L geeft een klinisch relevant kleinere prediction error dan de Shammas-K bij myope ogen(MD= 0,41; 95% BI= -0,61 tot -0.21; p<0,0001) (zie figuur 1).
Haigis-L versus Shammas
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Shammas is onderzocht in één studie (Abulafia, 2018). De gemiddelde absolute prediction error van de Haigis-L voor groep A was 0,63 (SD 0,51) versus 0,60 (SD 0,51) van de Shammas (MD= 0,03 (95% BI= -0,16 tot 0,22; p=0,75). De gemiddelde absolute prediction error van de Haigis-L voor groep B was 0,68 (SD 0,45) versus 0,63 (SD 0,48) van de Shammas (MD= 0,05 (95% BI= -0,15 tot 0,25; p=0,63). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Shammas bij myope ogen.
Haigis-L versus SRK/T
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en SRK/T is onderzocht in drie studies (De Mill, 2011; Helaly, 2016; Shammas, 2007). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en SRK/T is MD= 0,08 (95% BI= -0,08 tot 0,24). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de SRK/T bij myope ogen (MD= 0,08; 95% BI= -0,08 tot 0,24) (zie figuur 1).
Haigis-L versus Hoffer Q
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Hoffer Q is onderzocht in drie studies (Arce, 2009; Jin, 2010; Shammas, 2007). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en Hoffer Q is MD= 0,01 (95% BI= -0,24 tot 0,27). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Hoffer Q bij myope ogen (MD= 0,01; 95% BI= -0,24 tot 0,27) (zie figuur 1).
Haigis-L versus Holladay I
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Holladay I is onderzocht in twee studies (Arce, 2009; Shammas, 2007). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en Holladay I is MD= 0,09 (95% BI= -0,18 tot 0,36). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Holladay I bij myope ogen (MD= 0,09; 95% BI= -0,18 tot 0,36) (zie figuur 1).
Figuur 1 gemiddelde absolute prediction error
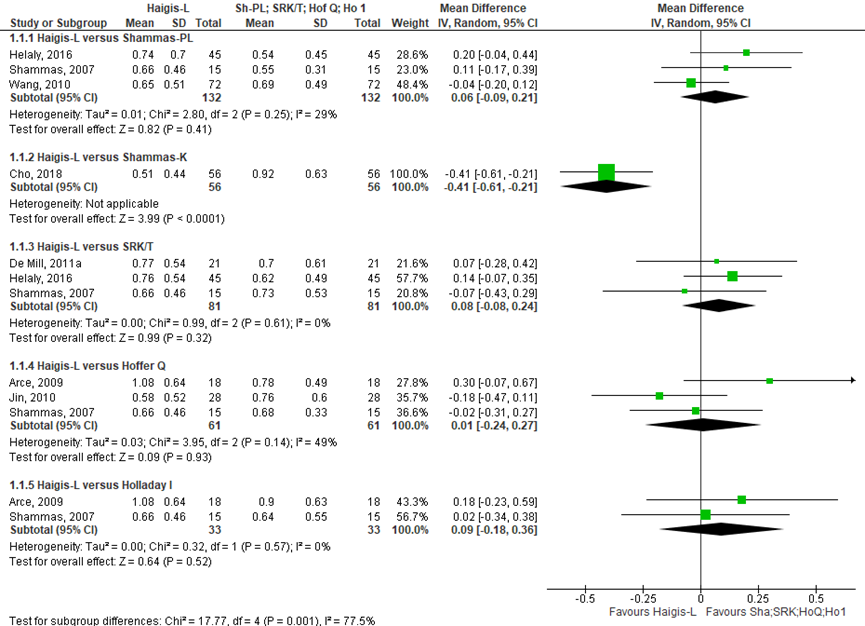
- Haigis-L versus Shammas-PL: Z=0.82 p=0.41; df: 2; I2: 29%; MD: 0.06 (CI: -0.09 tot 0.21);
- Haigis-L versus Shammas-K: Z=3.99; p<0.0001; MD=-0.41 (95% CI= -0.61 tot -0.21)
- Haigis-L versus SRK/T: Z=0.99; p=0.32; df: 2; I2: 0%; MD: 0.08 (CI: -0.08 tot 0.24);
- Haigis-L versus Hoffer Q: Z=0.09; p=0.93; df: 2; I2: 49%; MD: 0.01 (CI: -0.24 tot 0.27);
- Haigis-L versus Holladay I: Z=0.64; p=0.52; df: 1; I2: 0%; MD: 0.09 (CI: -0.18 tot 0.36).
SRK/T versus Holladay I
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de SRK/T en Holladay I is onderzocht in drie studies (Savini, 2010; Shammas, 2007; Wang, 2004). Het gepoolde gemiddeld verschil in absolute prediction error tussen de SRK/T en Holladay I is MD= 0,25 (95% BI= -0,07 tot 0,56). De SRK/T geeft een klinisch relevant kleinere prediction error dan de Holladay I bij myope ogen (MD= 0,25; 95% BI= -0,07 tot 0,56; p<0,13) (zie figuur 2).
SRK/T versus Hoffer Q
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de SRK/T en Hoffer Q is onderzocht in drie studies (Jin, 2010; Shammas, 2007; Wang, 2004). Het gepoolde gemiddeld verschil in absolute prediction error tussen de SRK/T en Hoffer Q is MD= -0,08 (95% BI= -0,29 tot 0,14). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de SRK/T en de Hoffer Q bij myope ogen (MD= -0,08; 95% BI= -0,29 tot 0,14) (zie figuur 2).
Figuur 2 gemiddelde absolute prediction error
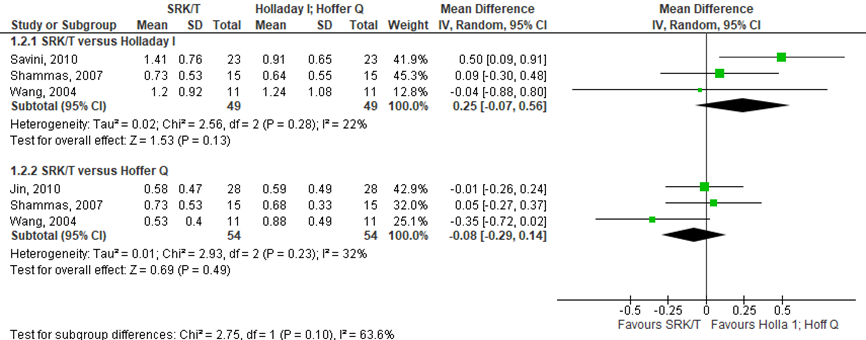
- SRK/T versus Holladay I: Z=1.53 p=0.13; df: 2; I2: 22%; MD: 0.25 (CI: -0.07 tot 0.56);
- SRK/T versus Hoffer Q: Z=0.69; p=0.49; df: 2; I2: 32%; MD: -0.08 (CI: -0.29 tot 0.14).
Holladay I versus Hoffer Q
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Holladay I en Hoffer Q is onderzocht in twee studies (Shammas, 2007; Wang, 2004). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Holladay I en Hoffer Q is MD= 0,02 (95% BI= -0,25 tot 0,29). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Holladay I en de Hoffer Q bij myope ogen (MD= 0,02; 95% BI= -0,25 tot 0,29) (zie figuur 3).
Figuur 3 gemiddelde absolute prediction error
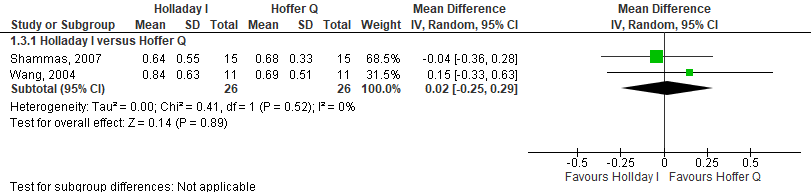
- Holladay I versus Hoffer Q: Z=0.14 p=0.89; df: 1; I2: 52%; MD: 0.02 (CI: -0.25 tot 0.29).
Haigis-L versus Barrett True-K
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Barrett True-K is onderzocht in één studie (Abulafia, 2016). De gemiddelde absolute prediction error van de Haigis-L was 0,63 (SD 0,51) versus 0,43 (SD 0,36) van de Barrett True-K (MD= 0,20 (95% BI= 0,04 tot 0,36; p=0,01). Hoewel de Barrett True-K een statisch significant kleinere prediction error geeft dan de Haigis-L bij myope ogen, werd dit verschil niet als klinisch relevant geacht (MD= 0,20; 95% BI= 0,04 tot 0,36; p=0,01).
Haigis-L versus Barrett True-K no history method
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Barrett True-K no history method is onderzocht in twee studies (Abulafia, 2016; Cho, 2018). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en Barrett True-K no history method is MD= 0,00 (95% BI= -0,30 tot 0,30). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Barrett True-K no history method (MD= 0,00; 95% BI= -0,30 tot 0,30) (zie figuur 4).
Figuur 4 gemiddelde absolute prediction error
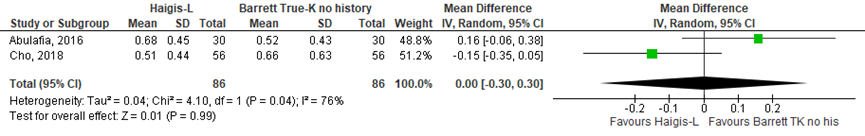
- Haigis-L versus Barrett True-K no history method: Z=0.01 p=0.99; df: 1; I2:76%; MD: 0.00 (CI: -0.30 tot 0.30).
2. Hyperope ogen
Haigis-L versus Shammas-K
Geen van de geïncludeerde studies vergeleek de Haigis-L lenssterkteformule met de Shammas-K lenssterkteformule bij patiënten met hyperope ogen.
Haigis-L versus Shammas
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Shammas is onderzocht in twee studies (Francone, 2019; Vrijman, 2019). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en Shammas is MD= -0,03 (95% BI= -0,17 tot 0,10). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Shammas bij hyperope ogen (MD= -0,03 (95% BI= -0,17 tot 0,10) (zie figuur 5).
Figuur 5 gemiddelde absolute prediction error
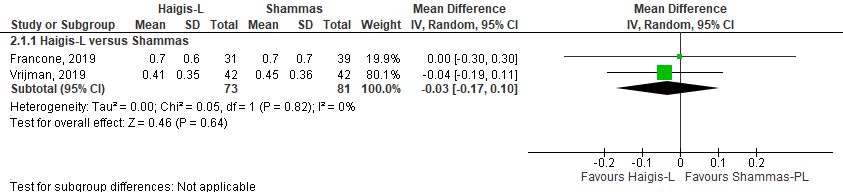
- Haigis-L versus Shammas: Z=0.46 p=0.64; df: 1; I2:0%; MD: -0.03 (CI: -0.17 tot 0.10).
Haigis-L versus Barrett True-K no history method
Het gemiddelde verschil (mean difference, MD) in gemiddelde absolute prediction error tussen de Haigis-L en Barrett True-K no history method is onderzocht in twee studies (Francone, 2019; Vrijman, 2019). Het gepoolde gemiddeld verschil in absolute prediction error tussen de Haigis-L en Barrett True-K no history method is MD= 0,02 (95% BI= -0,11 tot 0,16). Er werd geen klinisch relevant verschil in prediction error gevonden tussen de Haigis-L en de Barrett True-K no history method bij hyperope ogen (MD= 0,02 (95% BI= -0,11 tot 0,16) (zie figuur 6).
Figuur 6 gemiddelde absolute prediction error
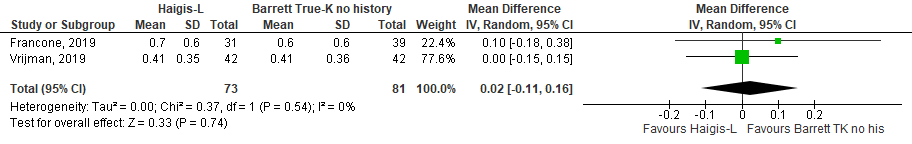
- Haigis-L versus Barrett True-K no history method: Z=0.33 p=0.74; df: 1; I2:0%; MD: 0.02 (CI: -0.11 tot 0.16).
Geen van de geïncludeerde studies rapporteerde de gemiddelde absolute prediction error bij patiënten met hyperope ogen voor de volgende lenssterkteformule vergelijkingen:
- Haigis-L versus Shammas-PL.
- Haigis-L versus Shammas-K.
- Haigis-L versus SRK/T.
- Haigis-L versus Hoffer Q.
- Haigis-L versus Holladay I.
- SRK/T versus Holladay I.
- SRK/T versus Hoffer Q.
- Holladay I versus Hoffer Q.
- Haigis-L versus Barrett True-K.
3. Radiaire keratotomie
Geen van de geïncludeerde studies rapporteerde de gemiddelde absolute prediction error bij patiënten met radiaire keratotomie voor de volgende lenssterkteformule vergelijkingen:
- Haigis-L versus Shammas-PL`.
- Haigis-L versus Shammas-K.
- Haigis-L versus Shammas.
- Haigis-L versus SRK/T.
- Haigis-L versus Hoffer Q:.
- Haigis-L versus Holladay I.
- SRK/T versus Holladay I.
- SRK/T versus Hoffer Q.
- Holladay I versus Hoffer Q.
- Haigis-L versus Barrett True-K.
- Haigis-L versus Barrett True-K no history method.
Bewijskracht van de literatuur
1. Myope ogen
- De bewijskracht voor de uitkomstmaat gemiddelde absolute prediction error bij patiënten met myope ogen is afkomstig uit observationeel onderzoek. Omdat de formules zijn onderzocht binnen dezelfde patiënt, is selectiebias uitgesloten. De bewijskracht van de literatuur start daarom niet op laag maar op hoog. De bewijskracht van onderstaande lenssterkteformule vergelijkingen is met twee niveaus verlaagd vanwege heterogeniteit in de studieresultaten (inconsistentie) en het kleine aantal patiënten (imprecisie):
- Haigis-L versus Shammas-PL.
- Haigis-L versus SRK/T.
- SRK/T versus Holladay I.
- SRK/T versus Hoffer Q.
De bewijskracht is LAAG.
- De bewijskracht voor de uitkomstmaat gemiddelde absolute prediction error bij patiënten met myope ogen is afkomstig uit observationeel onderzoek. Omdat de formules zijn onderzocht binnen dezelfde patiënt, is selectiebias uitgesloten. De bewijskracht van de literatuur start daarom niet op laag maar op hoog. De bewijskracht van onderstaande lenssterkteformule vergelijkingen is met twee niveaus verlaagd vanwege het kleine aantal patiënten (imprecisie) en basering van de conclusie op één enkele studie (imprecisie):
- Haigis-L versus Shammas-K.
- Haigis-L versus Shammas.
- Haigis-L versus Barrett True-K.
De bewijskracht is LAAG.
- Haigis-L versus Holladay I - De bewijskracht voor de uitkomstmaat gemiddelde absolute prediction error bij patiënten met myope ogen is afkomstig uit observationeel onderzoek. Omdat de formules zijn onderzocht binnen dezelfde patiënt, is selectiebias uitgesloten. De bewijskracht van de literatuur start daarom niet op laag maar op hoog. De bewijskracht van onderstaande lenssterkteformule vergelijking is met twee niveaus verlaagd vanwege het kleine aantal patiënten (imprecisie) en het brede betrouwbaarheidsinterval (imprecisie).
- Haigis-L versus Holladay I.
De bewijskracht is LAAG.
- De bewijskracht voor de uitkomstmaat gemiddelde absolute prediction error bij patiënten met myope ogen is afkomstig uit observationeel onderzoek. Omdat de formules zijn onderzocht binnen dezelfde patiënt, is selectiebias uitgesloten. De bewijskracht van de literatuur start daarom niet op laag maar op hoog. De bewijskracht van onderstaande lenssterkteformule vergelijkingen is met drie niveaus verlaagd vanwege heterogeniteit in de studieresultaten (inconsistentie), het kleine aantal patiënten (imprecisie) en het brede betrouwbaarheidsinterval (imprecisie):
- Haigis-L versus Hoffer Q.
- Holladay I versus Hoffer Q.
- Haigis-L versus Barrett True-K no history method.
De bewijskracht is ZEER LAAG.
2. Hyperope ogen
- De bewijskracht voor de uitkomstmaat gemiddelde absolute prediction error bij patiënten met hyperope ogen is afkomstig uit observationeel onderzoek. Omdat de formules zijn onderzocht binnen dezelfde patiënt, is selectiebias uitgesloten. De bewijskracht van de literatuur start daarom niet op laag maar op hoog. De bewijskracht van onderstaande lenssterkteformule vergelijkingen is met twee niveaus verlaagd vanwege heterogeniteit in de studieresultaten (inconsistentie) en het kleine aantal patiënten (imprecisie):
- Haigis-L versus Shammas.
- Haigis-L versus Barrett True-K no history method.
De bewijskracht is LAAG.
- Wegens afwezigheid van relevante literatuur is het niet mogelijk een GRADE-beoordeling voor de bewijskracht uit te voeren voor de volgende vergelijkingen:
- Haigis-L versus Shammas-PL.
- Haigis-L versus Shammas-K.
- Haigis-L versus SRK/T.
- Haigis-L versus Hoffer Q.
- Haigis-L versus Holladay I.
- SRK/T versus Holladay I.
- SRK/T versus Hoffer Q.
- Holladay I versus Hoffer Q.
- Haigis-L versus Barrett True-K.
3. Radiaire keratotomie
- Wegens afwezigheid van relevante literatuur is het niet mogelijk een GRADE-beoordeling voor de bewijskracht uit te voeren voor de volgende vergelijkingen:
- Haigis-L versus Shammas-PL.
- Haigis-L versus Shammas-K.
- Haigis-L versus Shammas.
- Haigis-L versus SRK/T.
- Haigis-L versus Hoffer Q.
- Haigis-L versus Holladay I.
- SRK/T versus Holladay I.
- SRK/T versus Hoffer Q.
- Holladay I versus Hoffer Q.
- Haigis-L versus Barrett True-K.
- Haigis-L versus Barrett True-K no history method.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag (vragen):
P: patiënten (> 18 jaar) met een indicatie voor cataractchirurgie post-refractiechirurgie;
I: intraoculaire lensformules, zoals SRK/T, Barrett Universal II, Haigis, HofferQ, Holladay 1, Holladay 2, Hill-RBF, K with Haigis, TK with Haigis (Haigis-TK), Haigis-L, Barret True-K, Shammas, Masket;
C: de andere onder de interventie genoemde formules;
O: prediction error.
Relevante uitkomstmaten
De werkgroep achtte de prediction error een voor de besluitvorming cruciale uitkomstmaat. De werkgroep definieerde niet a priori de genoemde uitkomstmaat, maar hanteerde de in de studies gebruikte definities. De werkgroep definieerde 0,25 dioptrie (D) als een klinisch (voor de patiënt) relevant verschil.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is op 05-03-2020 met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerd onderzoek (RCT’s) en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 385 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische review (gezocht in ten minste twee relevante databases, risk of bias beoordeling aanwezig en de resultaten van individuele studies voldoende gepresenteerd) of RCT of observationeel onderzoek waarin een vergelijking is gemaakt tussen minstens twee lensformules. Op basis van titel en abstract werden in eerste instantie 21 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 14 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en 7 studies definitief geselecteerd.
Resultaten
Zeven onderzoeken zijn opgenomen in de literatuuranalyse (één systematiche review (Chen, 2020) en zes observationele studies (Francone, 2019; Vrijman, 2019; Cho, 2018; Abulafia, 2016; De Mill, 2011; Wang, 2010)). De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk-of-biastabellen.
Referenties
- Abulafia, A., Hill, W. E., Koch, D. D., Wang, L., & Barrett, G. D. (2016). Accuracy of the Barrett True-K formula for intraocular lens power prediction after laser in situ keratomileusis or photorefractive keratectomy for myopia. Journal of Cataract & Refractive Surgery, 42(3), 363-369.
- Chen, H., Chen, X., Wang, H., Fang, Z., & Yao, K. (2020). Intraocular Lens power calculation after laser refractive surgery: A Meta-Analysis. Scientific reports, 10(1), 1-8.
- Cho, K., Lim, D. H., Yang, C. M., Chung, E. S., & Chung, T. Y. (2018). Comparison of intraocular lens power calculation methods following myopic laser refractive surgery: new options using a rotating scheimpflug camera. Korean Journal of Ophthalmology, 32(6), 497-505.
- DeMill, D. L., Moshirfar, M., Neuffer, M. C., Hsu, M., & Sikder, S. (2011). A comparison of the American Society of Cataract and Refractive Surgery post-myopic LASI K/PRK intraocular lens (IOL) calculator and the Ocular MD IOL calculator. Clinical ophthalmology (Auckland, NZ), 5, 1409.
- Francone, A., Lemanski, N., Charles, M., Borboli-Gerogiannis, S., Chen, S., Robert, M. C., & Pineda, R. (2019). Retrospective comparative analysis of intraocular lens calculation formulas after hyperopic refractive surgery. PloS one, 14(11), e0224981.
- Vrijman, V., Abulafia, A., van der Linden, J. W., van der Meulen, I. J., Mourits, M. P., & Lapid-Gortzak, R. (2019). ASCRS calculator formula accuracy in multifocal intraocular lens implantation in hyperopic corneal refractive laser surgery eyes. Journal of Cataract & Refractive Surgery, 45(5), 582-586.
- Wang, L., Hill, W. E., & Koch, D. D. (2010). Evaluation of intraocular lens power prediction methods using the American Society of Cataract and Refractive Surgeons post-keratorefractive intraocular lens power calculator. Journal of Cataract & Refractive Surgery, 36(9), 1466-1473.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C)
|
Follow-up |
Outcome measures and effect size |
|
Chen, 2020
(myopic eyes)
|
SR and meta-analysis of 7 prospective cohort studies and 3 prospective case series
Literature search up to March 2019
A: Arce, 2009 B: Helaly, 2016 C: Huang, 2013 D: Jin, 2010 E: Savini, 2010 F: Savini, 2015 G: Savini, 2018 H: Shammas, 2007 I: Wang, 2004 J: Wu, 2017
Setting and Country:
Source of funding and conflicts of interest: The authors declare no competing interests.
|
Inclusion criteria SR: - Focused on individuals with corneal refractive surgery history;
- Eyes undergone uncomplicated cataract surgery with in-the-bag fixated IOL implantation;
- Used at least two of the selected IOL power calculation formulas (Haigis-L, Shammas-post LASIK, SRK/T, Holladay 1, Hoffer Q).
Exclusion criteria SR: - Eyes with other disorders e.g., glaucoma, uveitis, or macular degeneration;
- Using toric, multifocal or piggyback IOL;
- Were review articles or discussion papers, conference abstracts, retrospective studies or studies done on animals.
10 studies included
Important patient characteristics at baseline:
N, mean (SD) age A: 32 eyes, NA B: 45 eyes, 28.66 (2.78) yrs C: 46 eyes, NA D: 28 eyes, 24.94 (1.08) yrs E: 28 eyes, 27.84 (1.90) yrs F: 30 eyes, 27.06 (2.05) yrs G: 22 eyes, 26.7 (1.7) yrs H: 15 eyes, 27.19 (2.52) yrs I: 11 eyes, 25.99 (n.r.) yrs J: 10 eyes, 50.3 (9.0) yrs
|
Describe intervention:
A: Haigis-L B: Haigis-L C: Haigis-L D: Haigis-L E: Holladay I (double-K) F: Holladay I (double-K) G: Holladay I (double-K) H: Haigis-L I: Holladay I J: Haigis-L
|
Describe control:
A: Holladay 1; SRK/T; Hoffer Q B: Shammas-PL; SRK/T (double-K) C: Shammas-PL D: SRK/T; Hoffer Q E: SRK/T (double-K) F: SRK/T (double-K); Hoffer Q (double-K) G: SRK/T (double-K) H: Shammas-PL; Holladay I (double-K); SRK/T (double-K); Hoffer Q (double-K) I: SRK/T; Hoffer Q; Holladay 2 J: Shammas-PL
|
End-point of follow-up:
A: 2 years B: 4 months C: 1 month D: 1 year E: 1 month F: NA G: NA H: 12 weeks I: 1 year J: 3 months
|
MYOPIC
Haigis-L versus Shammas-PL
Mean difference (MD) (95% CI)
B: MD= 0.20 (95% CI= -0.04 to 0.44) H: MD= 0.11 (95% CI= -0.17 to 0.39)
Pooled effect (random effects model) (95% CI)
MD= 0.16 (95% CI= -0.02 to 0.35), favoring Shammas-PL Heterogeneity (I2): 0%
Haigis-L versus SRK/T
Mean difference (MD) (95% CI)
B: MD= 0.14 (95% CI= -0.07 to 0.35) H: MD= -0.07 (95% CI= -0.43 to 0.29)
Pooled effect (random effects model) (95% CI)
MD= 0.08 (95% CI= -0.10 to 0.27), favoring SRK/T Heterogeneity (I2): 0%
Haigis-L versus Hoffer Q
Mean difference (MD) (95% CI)
A: MD= 0.30 (95% CI= -0.07 to 0.67) D: MD= -0.18 (95% CI= -0.47 to 0.11) H: MD= -0.02 (95% CI= -0.31 to 0.27)
Pooled effect (random effects model) (95% CI)
MD= -0.11 (95% CI= -0.41 to 0.20), favoring Haigis-L Heterogeneity (I2): 0%
Haigis-L versus Holladay I
Mean difference (MD) (95% CI)
A: MD= 0.18 (95% CI= -0.23 to 0.59) H: MD= 0.02 (95% CI= -0.34 to 0.38)
Pooled effect (random effects model) (95% CI)
MD= 0.09 (95% CI= -0.18 to 0.36), favoring Holladay I Heterogeneity (I2): 0%
SRK/T versus Holladay I
Mean difference (MD) (95% CI)
E: MD= 0.50 (95% CI= 0.09 to 0.91) H: MD= 0.09 (95% CI= -0.30 to 0.48) I: MD= -0.04 (95% CI= -0.88 to 0.80)
Pooled effect (random effects model) (95% CI)
MD= 0.25 (95% CI= -0.07 to 0.56), favoring Holladay I Heterogeneity (I2): 22%
SRK/T versus Hoffer Q
Mean difference (MD) (95% CI)
D: MD= -0.01 (95% CI= -0.26 to 0.24) H: MD= 0.05 (95% CI= -0.27 to 0.37) I: MD= -0.35 (95% CI= -0.72 to 0.02)
Pooled effect (random effects model) (95% CI)
MD= -0.08 (95% CI= -0.29 to 0.14), favoring SRK/T Heterogeneity (I2): 32%
Holladay I versus Hoffer Q
Mean difference (MD) (95% CI)
H: MD= -0.04 (95% CI= -0.36 to 0.28) I: MD= 0.15 (95% CI= -0.33 to 0.63)
Pooled effect (random effects model) (95% CI)
MD= 0.02 (95% CI= -0.25 to 0.29), favoring Hoffer Q Heterogeneity (I2): 0% |
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
|
Francone, 2019
Hyperopic eyes) |
Type of study: Retrospective chart review
Setting and country: Cornea Division at the Massachusetts Eye and Ear Infirmary (MEEI),of the Harvard Medical School
Funding and conflicts of interest: The authors report no conflicts of interest. The authors alone are responsible for the content and writing of this article.
|
Inclusion criteria: - History of phacoemulsification cataract surgery and primary in-the-bag implantation of posterior chamber intraocular lens;
- Previous hyperopic corneal refractive surgery (LASIK and/or PRK);
- Manifest refractive spherical equivalent (MRSE) performed > 4 weeks after cataract surgery;
- Post-operative best-corrected visual acuity (BCVA) of 20/32 or better.
Exclusion criteria: - Complications from previous refractive surgery;
- Inability to achieve secure ’in-the-bag’ placement of the IOL (i.e. due to posterior capsule rupture, radial tear in capsulorhexis, vitreous loss, zonular rupture);
- Use of corneal sutures;
- Haptic not in the capsular bag;
- Decentration of the IOL of more than 1.0 mm
- Presence of other ophthalmic pathology causing visual impairment: amblyopia, glaucoma, optic neuropathy, age related macular degeneration, macular edema, retinal detachment, proliferative diabetic retinopathy, ocular inflammation;
- Corneal opacities or irregularities: previous scarring, dystrophy, ectasia;
- Corneal astigmatism greater than 1.5 diopters;
- Other ocular surgery at time of cataract extraction History of YAG, laser capsulotomy, Uncontrolled diabetes;
- History of ocular trauma;
- Any neurological condition which may interfere with performance of required tests.
N total at baseline: N= 39 eyes (24 patients)
N, mean (SD) age 67 (7.0) yrs (range 55 to 78)
Mean (SD) Post-cataract manifest refraction spherical equivalent (D) -0.6 (0.8) (range -2.3 to 0.8). |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
Shammas Barrett True-K no history method Holladay II |
Length of follow-up: -
|
HYPEROPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis-L MAE (SD) = 0.7 (0.6) (range 0 to 2.3)
Barrett True-K no history method MAE (SD)= 0.6 (0.6) (range 0.01 t0 27)
Shammas MAE (SD)= 0.7 (0.7) (range 0.03 to 2.6)
Holladay II MAE (SD)= 0.7 (0.7) (range 0 to 2.5)
|
|
Vrijman, 2019
(Hyperopic eyes) |
Type of study: Retrospective case series
Setting and country: Amsterdam University Medical Center, University of Amsterdam, and Retina Total Eye Care, Driebergen, the Netherlands.
Funding and conflicts of interest: None of the other authors has a financial or proprietary interest in any material or method mentioned.
|
Inclusion criteria: - Uneventful phacoemulsification with implantation of a ReSTOR SN6AD1 IOL.
- Full keratorefractive data from before and after the refractive laser surgery and before and after phacoemulsification.
Exclusion criteria: -
N total at baseline: N= 64 eyes (38 patients)
N, mean (SD) age Not reported
Mean (SD) Pre-laser manifest refraction spherical equivalent: 1.65 (1.11) (range 4.63 to -1.50)
Mean (SD) Post-laser manifest refraction spherical equivalent: -0.52 (0.90) (range 1.38 to -2.38)
Mean (SD) Post-cataract manifest refraction spherical equivalent: 0.02 (0.97) (range -3.00 to 2.75) |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
Shammas (geen hyperopic mean prediction error) Barrett True-K no history method |
Length of follow-up: Not reported
|
HYPEROPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis-L MAE (SD)= 0.41 (0.35) (range 0.01 to 1.55)
Shammas MAE (SD)= 0.45 (0.36) (range 0.01 to 2.14)
Barrett True-K no history method MAE (SD)= 0.41 (0.36) (range 0.00 to 1.57) |
|
Cho, 2018
(Myopic eyes) |
Type of study: Retrospective review
Setting and country: Samsung Medical Center in Seoul, South Korea.
Funding and conflicts of interest: No potential conflict of interest relevant to this article was reported.
|
Inclusion criteria: - Patients who underwent myopic laser refractive surgery and subsequent cataract surgery
Exclusion criteria: -
N total at baseline: N= 56 eyes (56 patients)
N, mean (SD) age 54.64 (9.37) (range 38 to 76)
Mean (SD) Pre-cataract manifest refraction spherical equivalent: -2.83 (3.52) (range -5.25 to 0.75) |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
Shammas-K Barrett True-K |
Length of follow-up: Not reported
|
MYOPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis-L MAE (SD)= 0.51 (0.44)
Shammas-K MAE (SD)= 0.92 (0.74)
Barrett True-K MAE (SD) 0.66 (0.63) |
|
Abulafia, 2016
(Myopic eyes) |
Type of study: Retrospective case series
Setting and country: Cullen Eye Institute, Baylor College of Medicine, Houston, Texas, and private practice, Mesa, Arizona, USA.
Funding and conflicts of interest: None of the other authors has a financial or proprietary interest in any material or method mentioned. |
Inclusion criteria: - No complications during or after cataract surgery;
- Corrected distance visual acuity of 20/32 or better measured at least 3 weeks after surgery;
- Availability of manifest refraction values before and after LASIK or PRK.
Exclusion criteria: - Patients who had a Crystalens IOL (Bausch & Lomb) implanted.
N total at baseline: Group A: N= 58 eyes (40 patients) Group B: N= 30 eyes (25 patients)
*Group A = all eyes with inclusion of previous refractive data) *Group B = all eyes for which previous refractive data were not available
N, mean (SD) age Group A: not reported Group B: 58 (7.0) yrs (range 34-73)
Mean (SD) Pre-LASIK/PRK Spherical Equivalent (D) Group A: -5.49 (2.89) (range-13.38 to -0.63) Group B: NA
Mean (SD) Post-LASIK/PRK Spherical Equivalent (D) Group A: -0.43 (0.84) (range -2.00 to 2.50) Group B: NA |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
Shammas Barrett True-K Barrett True-K no history method |
Length of follow-up: At least 3 weeks after surgery.
Loss-to-follow-up: None.
|
MYOPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis-L Group A: MAE (SD)= 0.63 (0.51) (range 0.00 to 2.86) Group B: MAE (SD)= 0.68 (0.45) (range 0.14 to 1.94)
Shammas Group A: MAE (SD)= 0.60 (0.51) (range 0.00 to 2.87) Group B: MAE (SD)= 0.63 (0.48) (range 0.01 to 1.75)
Barrett True-K Group A: MAE (SD)= 0.43 (0.36) (range 0.00 to 1.53)
Barrett True-K no history Group B: MAE (SD)= 0.52 (0.43) (range 0.00 to 1.55) |
|
De Mill 2011
(Myopic eyes) |
Type of study: Retrospective study
Setting and country: Eye Center, University of Utah, Salt Lake City, UT, USA; Wilmer Eye Institute, Johns Hopkins University, Baltimore, MD, USA
Funding and conflicts of interest: The authors have no financial interests in any materials or products discussed in the work.
|
Inclusion criteria: - Consecutive patients with previous LASIK or photorefractive keratectomy for myopia and subsequent cataract surgery.
Exclusion criteria: - Major complications during or after cataract surgery;
- Missing data for the calculators;
- Best corrected distance visual acuity <20/30 after surgery.
N total at baseline: N= 21 eyes (17 patients)
N, mean (SD) age
Mean (SD) Pre-LASIK/PRK Spherical Equivalent (D) -5.55 (2.50) (range-10.00 to -2.00)
Mean (SD) Post-LASIK/PRK Spherical Equivalent (D) -0.38 (0.72) (range -2.00 to 0.63)
Mean (SD Pre-cataract surgery Spherical Equivalent (D) -2.42 (1.77) (range -6.50 to -0.13) |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
SRK/T |
Length of follow-up: Postoperative data was obtained at an average of 5.24 (3.39) months after LASIK/photorefractive kerectomy.
|
MYOPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis MAE (SD) = 0.77 (0.54) (range 0 to 2.28)
SRK/T MAE (SD)= 0.70 (0.61) (range 0.01 to 2.29) |
|
Wang, 2010
(Myopic eyes) |
Type of study: Retrospective study Setting and country: Cullen Eye Institute, Baylor College of Medicine, Houston, Texas, and private practice, Mesa, Arizona, USA.
Funding and conflicts of interest: No author has a financial or proprietary interest in any material or method mentioned. |
Inclusion criteria: - Implantation of an AcrySof SN60WF aspheric IOL (Alcon, Inc.);
- No complications during or after cataract surgery;
- Manifest refraction performed 3 weeks or more after cataract surgery;
- Corrected distance visual acuity of 20/32 or better after cataract surgery.
Exclusion criteria: -
N total at baseline: N= 72 eyes (57 patients)
N, mean (SD) age 58 (8.0) yrs (range 42 to 77)
Mean (SD) Pre-LASIK/PRK MRSE -6.04 (3.04) (range -13.50 to -1.25)
Mean (SD) Post-LASIK/PRK MRSE -0.44 (0.94) (range -3.25 to 3.00) |
Describe intervention (treatment/procedure/test):
Haigis-L
|
Describe control (treatment/procedure/test):
Shammas |
Length of follow-up: 3 weeks to 1 year
|
MYOPIC
Mean absolute prediction error (MAE) (SD) (range)
Haigis MAE (SD)= 0.65 (0.51) (range0.01 to 2.70)
Shammas MAE (SD)= 0.69 (0.49) (range 0.01 to 2.30) |
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Chen, 2016 |
Geen relevante formulevergelijkingen |
|
De Bernardo, 2014 |
Geen relevant artikel |
|
De Mill, 2011 |
Geen relevante formulevergelijkingen |
|
Hamil, 2017 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Ianchulev, 2014 |
Geen relevante formulevergelijkingen |
|
Kang, 2017 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
McCarthy, 2011 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Rosen, 2019 |
Geen uitsplitsing in myope ogen, hyperope ogen en patiënten die radiaire keratotomie ondergingen. |
|
Saiki, 2014 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Shammas, 2013 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Wang, 2015 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Wang, 2019 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Yagi-Yaguchi, 2019 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
|
Yaguchi, 2016 |
Rapporteert irrelevante uitkomstmaat (mediaan) |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 09-11-2021
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Doel en doelgroep
Doel
Een richtlijn is in wezen de beschrijving van de actuele stand van de kennis, technieken en gerelateerde zaken rond het onderwerp van de richtlijn. Daarnaast heeft een richtlijn tot doel de beroepsbeoefenaars aanbevelingen te geven die de kwaliteit van hun werk mede op het gewenste niveau kunnen houden. Er is dus ook sprake van een beschrijving van kwalitatieve normen voor de beroepsgroep. Iedere arts is gehouden om primair te handelen in het belang van de patiënten daarbij zorg te dragen voor diens veiligheid in relatie tot het medische handelen. De Richtlijn Cataract stelt dan ook normen vast voor goede praktijkvoering, stelt standaarden voor patiëntenzorg en veiligheid en biedt een referentiepunt voor de beoordeling van de resultaten waaraan cataractchirurgie van hoge kwaliteit moet voldoen. De aanbevelingen, normen en standaarden zijn getoetst aan de resultaten van gedegen wetenschappelijk onderzoek, gepubliceerd in de wetenschappelijke literatuur. Indien zekere vraagstellingen niet goed beantwoord konden worden op basis van literatuuronderzoek, werden de meningen van erkende experts gehoord door de richtlijnwerkgroep en bij consensus verwerkt in de aanbevelingen.
Doelgroep
Deze richtlijn is geschreven voor met name oogartsen maar ook andere leden van de beroepsgroepen die direct betrokken zijn bij de zorg met cataract.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2018 een werkgroep ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de zorg voor patiënten met cataract.
Werkgroep
- Drs. B.A.E. (Bert) van der Pol, oogarts niet praktiserend, (voorzitter) NOG
- Dr. M.C. (Marjolijn) Bartels, oogarts, Deventer Ziekenhuis, NOG
- Drs. M.M.M.J. (Margot) Dellaert, oogarts, Treant Zorggroep, NOG
- Drs. Y.P. (Ype) Henry, oogarts, VU medisch centrum, NOG
- Dr. L.V. (Long) Ly, oogarts, Bergman Clinics, NOG
- Drs. R.C.M. (Marit) Maatman, oogarts, Alrijne Ziekenhuis, NOG
- Dr. N.J. (Nic) Reus, oogarts, Amphia Ziekenhuis, NOG
- Dr. N. (Nienke) Visser, oogarts, Maastricht Universitair Medisch Centrum, NOG
- Prof. Dr. R.M.M.A. (Rudy) Nuijts, oogarts, Maastricht Universitair Medisch Centrum, NOG
Met ondersteuning van
- Dr. A.C.J. (Astrid) Balemans, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. J. (Josefien) Buddeke, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- M. (Mitchel) Griekspoor MSc, junior adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Klankbordgroep
- H.J. (Anneke) Jansen Molenaar, Adviseur Oogzorg bij de Oogvereniging
- D. (Dana) Kamsteeg-Koerts, Optometrist, Oogziekenhuis Rotterdam
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenwerkzaamheden |
Gemelde belangen |
Actie |
|
Van der Pol |
Niet praktiserend |
Geen |
Geen |
Geen actie |
|
Dellaert |
Oogarts |
Medisch manager, onkostenvergoeding |
Geen |
Geen actie |
|
Bartels |
Zelfstandig ondernemer, via B.V. verbonden aan Verenigde Specialisten Deventer en zo aan Deventer Ziekenhuis |
Voorzitter subcommissie Richtlijnen NOG |
Deelname aan ZonMw studie IBSCS / DBSCS via UMC Maastricht (site - investigator)
Contactpersoon namens cornea werkgroep bij hoornvliespatiënten vereniging.
|
Geen trekker van de modules over ontstekings- en infectieprofylaxe bij reguliere cataractchirurgie. |
|
Henry |
Oogarts; staflid
|
Lid van de steering group van EUREQUO (ESCRS); Secretaris van NIOIC (NOG); Voorzitter van WTO (NOG) |
Geen |
Geen actie |
|
Ly |
Oogarts bij Bergman Clinics |
Geen |
Geen |
Geen actie |
|
Maatman |
Oogarts, Alrijne Ziekenhuis
|
NOG bestuur (secretaris), betaald. Tot 2016/2017 advies Bayer / Eylea, betaald
|
Geen |
Geen trekker module ontstekingsprofylaxe reguliere cataractchirurgie. |
|
Reus |
Oogarts in het Amphia Ziekenhuis, Breda/Oosterhout
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald) Bestuurslid European Society of Cataract and Refractive Surgeons (ESCRS) (onbetaald)
|
Bestuurslid Nederlandse Intraoculaire Implant Club (NIOIC) (onbetaald)
1.Principal Investigator van Investigator-Initiated Trial waarvoor subsidie van Alcon (unresticted grant). Het onderwerp is de helderheid van ogen na een staaroperatie. Er wordt onderzoek gedaan naar de hoeveelheid lichtverstrooiing in de ogen na een cataractoperatie en redenen waarom er meer strooilicht in het oog overblijft na een cataractoperatie dan wordt verwacht. 2.Site-Investigator van studie naar bilaterale cataractchirurgie geïnitieerd door prof. R. Nuijts, oogarts (Universiteitskliniek voor Oogheelkunde Maastricht) waarvoor subsidie van ZonMW (unresticted grant). |
Geen trekker van modules met betrekking tot infectieprofylaxe bij reguliere cataractchirurgie en IOLs. |
|
Visser |
Oogarts, aandachtsgebieden cornea- en cataract chirurgie. Werkgever: University Eye Clinic Maastricht, MUMC+
|
Young ophthalmology committee ESCRS (onbetaald)
|
EPICAT study: Effectiveness of Periocular drug Injection in CATaract surgery (gefinancierd door ESCRS, het gaat hierbij om een restricted grant, de ESCRS heeft op voorhand akkoord gegeven voor de specifieke opzet, uitvoering, en terugkoppeling van de EPICAT studie) |
Geen actie |
|
Nuijts |
Prof.dr. RMMA Nuijts, hoogleraar Corneatransplantatie en Refractiechirurgie; MUMC Maastricht
|
- Voorzitter Nederlandse IntraOculaire Implant Club, NIOIC (onbetaald) |
Abbott: NL 56878.068.16/METC162029 A randomised, subject-masked evaluation of visual function after bilateral implantation of two types of presbyopia-correcting IOLs: the Symfony-study. Period: 01-12-2016 - 01-12-2018
Alcon: VERION versus conventional, manual ink-marking in toric IOL implantation. Period: 2015 - 2016
Alcon: ILJ466-P003 Post-Market Investigation of the Clareon IOL. Period: 2018 - 2028
Alcon: The ACRYSOF IQ PanOptix Presbyopia Correcting intraocular lens (IOL) Model TFNT00. Period: 01-12-2015 - 01-12-2017
CHIESI: NL 54419.000.15/CCMO15.0538 Multinational, multicentre, prospective, open-label, uncontrolled clinical trial to assess the efficacy and safety of Autologous Cultivated Limbal Stem Cells Transplantation (ACLSCT) for restoration of corneal epithelium in patients with limbal stem cell deficiency due to ocular burns. Period: 01-12-2016 - 01-12-2018
ESCRS: European Cornea and Cell Transplantation Registry (ECCTR), European Union Third Health Programme 2014-2020 and the European Society of Cataract and Refractive Surgeons. Period: 01-04-2016 - 2019
ESCRS: The ESCRS PREMED study: PREvention of Macular EDema after cataract surgery. Period: 2012 - 2016
InSciTE: EyeScite: smart biomedical solutions for better eyesight. |
Geen trekker van de modules met betrekking tot infectie- en onstekingsprofylaxe en IOLs bij reguliere cataractchirurgie. |
|
Kamsteeg-Koerts (klankbordgroep) |
Optometrist, Oogziekenhuis Rotterdam |
- Per 25 november 2019 lid OVN ledenraad met een aanstelling voor 3 jaar - Lid OVN commissie Beroepsbelangen |
Geen
|
Geen actie |
|
Jansen-Molenaar |
Adviseur Oogzorg bij de Oogvereniging |
Geen |
Geen |
Geen actie |
Inbreng patiëntenperspectief
Een afgevaardigde van de Oogvereniging nam zitting in de klankbordgroep. Daarnaast werden de Oogvereniging en de Patiëntenfederatie uitgenodigd om deel te nemen aan de schriftelijke knelpuntenanalyse. De conceptrichtlijn is tevens voor commentaar voorgelegd aan de betrokken patiëntenverenigingen en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met cataract. De werkgroep beoordeelde de aanbeveling(en) uit de eerdere richtlijnmodule cataract (2013) op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen door het Nederlands Oogheelkundig Gezelschap (NOG), de Nederlandse Vereniging voor Klinische Geriatrie (NVKG), het Nederlands Huisartsen Genootschap (NHG), de Oogvereniging, Verenso en de Landelijke Vereniging van Operatieassistenten (LVO) via een schriftelijke knelpuntenanalyse. Een verslag hiervan is opgenomen in de bijlagen.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming) en belangrijk (maar niet cruciaal). Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet een-op-een vergelijkbaar met het minimale klinisch relevante verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden die meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs, de belangrijkste overwegingen en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. https://richtlijnendatabase.nl/over_deze_site.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
