Jicht bij CVRM
Uitgangsvraag
Wat is de rol van jicht bij het schatten van het risico op hart- en vaatziekten bij personen zonder hart- en vaatziekten?
Aanbeveling
Overweeg bij personen met jicht een cardiovasculair risicoprofiel op te stellen.
Overweeg bij twijfel over de behandelindicatie (eerder) over te gaan tot behandeling van het risico op hart- en vaatziekten indien iemand jicht heeft.
Overwegingen
Alhoewel er dus aanwijzingen zijn dat het cardiovasculaire risico verhoogd is bij patiënten met jicht, blijft het onduidelijk in welke mate dit verhoogde risico verklaard wordt door (al dan niet subtiele) verschillen in het profiel van de meer bekende risicofactoren. Bovendien is er risico op bias van de bestaande literatuur. Deze richtlijn wil terughoudendheid propageren als het gaat om het laten meewegen van additionele risicofactoren/aandoeningen bij de cardiovasculaire risicoschattingen. Veel patiënten met jicht zullen om andere redenen (leeftijd, bekende risicofactoren; zie de module ‘Hoe het risico te schatten’) in aanmerking komen voor een zorgvuldige risico-inventarisatie.
Onderbouwing
Achtergrond
Onder de vele klinische variabelen die genoemd worden als mogelijk bijdragend aan verbeterde voorspelling van het risico op hart- en vaatziekten bevindt zich het urinezuurgehalte in het bloed, alsmede het hebben van een voorgeschiedenis van jicht. De rol van het urinezuurgehalte wordt elders besproken (zie de module ‘Etniciteit’).
Conclusies / Summary of Findings
Hart- en vaatziekten
|
Redelijk GRADE |
Het hebben van jicht is waarschijnlijk geassocieerd met een verhoogd risico op hart- en vaatziekten, onafhankelijk van klassieke cardiovasculaire risicofactoren.
Bronnen (Janssens, 2017; Clarson, 2015a) |
Mortaliteit ten gevolge van hart- en vaatziekten
|
Laag GRADE |
Het hebben van jicht is mogelijk geassocieerd met een verhoogd risico om te overlijden aan hart- en vaatziekten, onafhankelijk van klassieke risicofactoren.
Bronnen (Clarson, 2015b; Kok, 2012) |
Samenvatting literatuur
Beschrijving studies
Janssens (2017) onderzocht het risico op een eerste hart- en vaatziekten event onder huisartspatiënten met een diagnose van jicht. De studie maakte gebruik van een General Practitioner Database (GP-database). Deze database bevat algemene gegevens over de patiënt als ook diagnoses van de huisarts en managementinformatie van elektronische dossiers van het oosten van Nederland. Gemiddeld genomen waren de deelnemers 58 jaar en het merendeel was man. Deelnemers met jicht hadden ook vaker hypertensie, diabetes mellitus of hyperlipidemie dan deelnemers zonder jicht. In totaal werden 1859 deelnemers met jicht geïncludeerd en 6334 gematchte controles.
Clarson (2015a) onderzocht de associatie tussen jicht en incident coronaire hartziekte, hart- en vaatziekten en perifeer vaatlijden. Alleen personen ouder dan 50 jaar kwamen in aanmerking als ook personen zonder een geschiedenis van hart- en vaatziekten. In totaal werden 8386 patiënten met jicht geïncludeerd met 39766 controles. De deelnemers waren gemiddeld 66 jaar oud (SD 10,8) en 69% was man. Patiënten met jicht had een hogere prevalentie van alle risicofactoren voor hart- en vaatziekten, met uitzondering van diabetes mellitus, dan de controles.
Clarson (2015b) heeft een systematische review en meta-analyse uitgevoerd naar studies die de relatie tussen jicht en mortaliteit ten gevolge van hart- en vaatziekten onderzochten. Medline, EMBASE, CINAHL en The Cochrane Library zijn tot november 2012 doorzocht. Case-controlestudies werden vanwege sampling en recall bias geëxcludeerd. In totaal voldeden zes studies aan de selectiecriteria. Van deze zes studies rapporteerden vier studies de uitkomst mortaliteit ten gevolge van hart- en vaatziekten. Alleen deze studies werden verder meegenomen. Na de datum van de zoekactie werd nog een relevante cohortstudies gepubliceerd (Kok, 2012). Ook deze studie werd geïncludeerd en beschreven.
Kok (2012) bestudeerde de associatie tussen jicht en mortaliteit ten gevolge van hart- en vaatziekten in niet-diabetes personen in de leeftijd van 50 jaar en ouder met of zonder chronische nierziekte. De Taiwan National Health Insurance database werd voor deze studies gebruikt. Gedurende follow-up hadden totaal 164463 personen jicht en 3694377 personen geen jicht. Ook in deze studie was de prevalentie van risicofactoren hoger onder personen met jicht vergeleken met controles.
Resultaten
1. Hart- en vaatziekten morbiditeit
Janssens (2017) observeerde dat onder deelnemers met jicht 154 (8%) hart- en vaatziekte kregen vergeleken met 318 (3%) zonder jicht. Het risico om hart- en vaatziekten te krijgen onder deelnemers met jicht gedurende follow-up was 44% hoger vergeleken met deelnemers zonder jicht (HR 1,44 95%BI: 1,18 tot 1,76). Deze hazard ratio was voor de volgende confounders gecorrigeerd: leeftijd, geslacht en de aanwezigheid van comorbiditeiten (hypertensie, diabetes mellitus, hypercholesterolemie).
Clarson (2015a) rapporteerde de resultaten gestratificeerd voor geslacht vanwege een statistisch significante interactie tussen jicht en geslacht. In totaal werden 11266 vasculaire events tijdens follow-up geobserveerd. In tabel 1 worden de absolute risico per geslacht weergegeven.
Tabel 8 Absolute risico’s op hart- en vaatziekten per geslacht
|
|
Absolute risico per 1000 persoonsjaren (95%BI) |
|||
|
|
Man |
Vrouw |
||
|
Uitkomst |
Case (jicht) |
Controle |
Case (jicht) |
Controle |
|
Hart- en vaatziekten |
43,63 (41,55 tot 45,77) |
33,70 (32,86 tot 34,55) |
51,89 (48,32 tot 55,64) |
33,41 (32,15 tot 34,71) |
Het risico op een hart- en vaatziekte event gedurende follow-up is 6% en 25% verhoogd voor mannen en vrouwen, respectievelijk. De corresponderende hazard ratio’s waren 1,06 (95%BI: 1,01 tot 1,12) en 1,25 (95%BI: 1,15 tot 1,35). Deze effectschatters waren voor de volgende variabelen gecorrigeerd: geslacht, interactie tussen jicht en geslacht, leeftijd, BMI >25 kg/m2, roken, alcoholconsumptie, Charlson Comorbidity Score, hypertensie, hyperlipidemie en chronische nierziekte, en statine- en aspirine-gebruik.
Aangezien resultaten van Clarson (2015a) per geslacht zijn weergegeven, is het lastig deze resultaten met die van Janssens (2017) te combineren. Echter, de resultaten wijzen in dezelfde richting. Het risico op hart- en vaatziekten is verhoogd bij het hebben van jicht. Het is echter niet duidelijk hoe sterk het risico verhoogd is en in hoeverre dit verklaard kan worden door (subtiele) verschillen in overige risicofactoren.
2. Hart- en vaatziekten mortaliteit
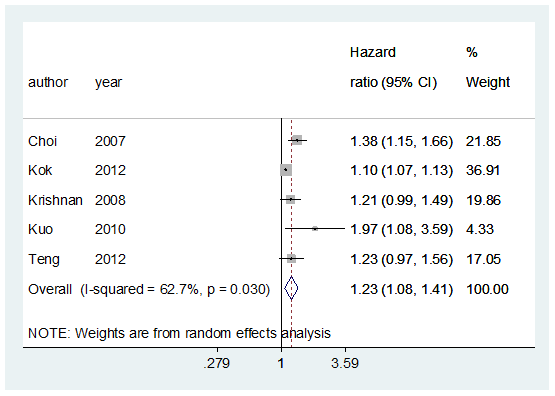
Het individuele studieresultaat van Kok (2012) is aan de meta-analyse van Clarson (2015b) toegevoegd. Het risico om te overlijden ten gevolge van hart- en vaatziekten bij het hebben van jicht was 23% hoger gedurende follow-up vergeleken met geen jicht hebben (HR 1,23 95%BI: 1,08 tot 1,41; figuur 1). Alle effectschattingen waren voor bekende risicofactoren gecorrigeerd.
Figuur 1 Meta-analyse jicht en mortaliteit ten gevolge van hart- en vaatziekten
Bewijskracht van de literatuur
Vanwege het domein etiologie van de zoekvraag start de bewijskracht op hoog:
Morbiditeit hart- en vaatziekten: De bewijskracht voor de uitkomstmaat hart- en vaatziekten is met een niveau verlaagd gezien publicatiebias.
Mortaliteit ten gevolge van hart- en vaatziekten: De bewijskracht voor de uitkomstmaat mortaliteit ten gevolge van hart- en vaatziekten is met twee niveaus verlaagd gezien tegenstrijdige resultaten (inconsistentie) en publicatiebias.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Is het hebben van jicht een onafhankelijke voorspeller voor het risico op hart- en vaatziekten?
P: algemene populatie zonder hart- en vaatziekten;
I: jicht;
C: geen jicht;
O: morbiditeit en mortaliteit van hart- en vaatziekten.
Relevante uitkomstmaten
De werkgroep achtte morbiditeit en mortaliteit van hart- en vaatziekten voor de besluitvorming kritieke uitkomstmaten.
Zoeken en selecteren (Methode)
In de database Medline (via OVID) is tot februari 2017 met relevante zoektermen gezocht naar systematische reviews of observationele studies. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 153 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gedetailleerde zoekstrategie, Risk of Bias beoordeling, evidence tabel);
- observationele studies (op basis van de bovengenoemde PICO).
Op basis van titel en abstract werden in eerste instantie 96 studies voorgeselecteerd. Na raadpleging van de volledige tekst werden vervolgens 92 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en 4 studies definitief geselecteerd.
Vier onderzoeken zijn opgenomen in de literatuuranalyse, waarvan 1 systematische review over mortaliteit ten gevolge van hart- en vaatziekten, 1 cohortstudie waarmee de systematische review geüpdatet kon worden (gepubliceerd na de literatuurzoekactie) en twee cohortstudies over hart- en vaatziekten morbiditeit. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- Clarson LE, Hider SL, Belcher J, et al. Increased risk of vascular disease associated with gout: a retrospective, matched cohort study in the UK clinical practice research datalink. Ann Rheum Dis. 2015a;74(4):642-7. doi: 10.1136/annrheumdis-2014-205252. Epub 2014 Aug 27. PubMed PMID: 25165032; PubMed Central PMCID: PMC4392302.
- Clarson LE, Chandratre P, Hider SL, et al. Increased cardiovascular mortality associated with gout: a systematic review and meta-analysis. Eur J Prev Cardiol. 2015b;22(3):335-43. doi: 10.1177/2047487313514895. Epub 2013 Nov 26. Review. PubMed PMID: 24281251; PubMed Central PMCID: PMC4361356.
- Janssens HJ, Arts PG, Schalk BW, et al. Gout and rheumatoid arthritis, both to keep in mind in cardiovascular risk management: A primary care retrospective cohort study. Joint Bone Spine. 2017;84(1):59-64. doi: 10.1016/j.jbspin.2015.12.003. Epub 2016 May 25. PubMed PMID: 27236260.
- Kok VC, Horng JT, Lin HL, et al. Gout and subsequent increased risk of cardiovascular mortality in non-diabetics aged 50 and above: a population-based cohort study in Taiwan. BMC Cardiovasc Disord. 2012;12:108. doi: 10.1186/1471-2261-12-108. PubMed PMID: 23170782; PubMed Central PMCID: PMC3556493.
- Liu SC, Xia L, Zhang J, et al. Gout and Risk of Myocardial Infarction: A Systematic Review and Meta-Analysis of Cohort Studies. PLoS One. 2015;10(7):e0134088. doi: 10.1371/journal.pone.0134088. eCollection 2015. Review. PubMed PMID: 26230580; PubMed Central PMCID: PMC4521845.
Evidence tabellen
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison / control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Clarson, 2015b
(individual study characteristics deduced from Clarson, 2015)
PS., study characteristics and results are extracted from the SR (unless stated otherwise) |
SR and meta-analysis of cohort studies
Literature search up to November 2012
A: Choi, 2007 B: Krishnan, 2008 C: Kuo, 2010 D: Teng, 2012
Study design: Not reported
Setting and Country: Not reported
Source of funding: Non-commercial (this review); not reported per included study
|
Inclusion criteria SR:
Exclusion criteria SR:
Six studies included of which four studies reported outcomes on mortality due to CVD
Important patient characteristics at baseline:
N, mean age (SD) A: 47,258 patients; I: 59, C: 54 yrs B: 9105 patients; I: 52.9 (5.8), C: 52.1 (5.9) yrs C: 49,332 patients; I: 52 (11), C: 50 (11) yrs D: 47,035 patients; I: 61.5 (7.7), C: 61.6 (8.0) yrs
Sex: A: 100% Male B: 100% Male C: 53% Male D: 41% Male |
Gout definition:
A: Self report of physician diagnosis B: Self report or physician diagnosis + documented Sustained hyperuricaemia OR use of gout medication in the preceding 5y OR self report of gout without urate level C: Physican recorded (either crystals present in joint aspirate or ICD-9 gout code) OR self-report D: Self-report of physician diagnosis + self-report of elevated serum urate self-report of dietary advice for gout
|
Without gout
|
End-point of follow-up:
A: 12 years B: 17 years C: 4.7 years D: 8.1 years
For how many participants were no complete outcome data available? Not reported
|
Outcome measure-1 Defined as mortality due to CVD
Definitions per study (N deaths) (ICD-9 codes 390 to 459; ICD-10 codes I00 to I99) : A: All cardiovascular deaths (2132) B: Death from any cardiovascular end-point (1241) C: Cardiovascular mortality (198) D: All cardiovascular deaths (1526)
Effect measure, adjusted for vascular risk factors: HR (95% CI): A: 1.38 (1.15 to 1.66) B: 1.21 (0.99 to 1.49) C: 1.97 (1.08 to 3.59) D: 1.23 (0.97 to 1.56)
Pooled effect (random effects model): 1.29 (95% CI 1.13 to 1.44) Heterogeneity (I2): 0.0% (p=0.541)
Outcome measure-2 Defined as morbidity due to CVD
Not reported
|
Facultative:
Author’s conclusion: “Whilst observational studies cannot demonstrate causation, this meta-analysis of large, high-quality cohort studies strongly supports gout as an independent risk factor for mortality from CVD. The clinical implications of this review are the need to promote identification and management of cardiovascular risk factors in patients with gout, but also to identify and optimally manage gout in patients at risk of CVD.”
Personal remarks on study quality, conclusions, and other issues (potentially) relevant to the research question:
Level of evidence: As this review could be updated with one study, the level of evidence was graded with addition of this RCT.
|
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Clarson, 2015b |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
Yes |
No, only for the review |
- Research question (PICO) and inclusion criteria should be appropriate and predefined.
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched.
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons.
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported.
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs).
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table et cetera).
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (for example Chi-square, I2)?.
- An assessment of publication bias should include a combination of graphical aids (for example funnel plot, other available tests) and/or statistical tests (for example Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
CVD mortality |
|||||||
|
Kok, 2012 |
Type of study: cohort study
Setting: Taiwan National Health Insurance Research Database
Country: Taiwan
Source of funding: Non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 164,463 Control: 3,694,377
Important prognostic factors2: Age (I/C): 50 to 59: 33%/46% 60 to 69: 31%/28% 70 to 79: 27%/19% ≥80: 9%/7%
Sex: I: 76% M C: 47% M
Comorbidities (I/C) Hypertension: 28%/10% Hyperlipidemia: 6%/1% |
Gout-related diagnoses
The following codes under ICD-9-CM were included:
Validation of these physician-diagnosed gout was ensured by verification that there were at least three separate outpatient visits by the same individual.
|
Without a gout-related diagnosis
Same validation process as with gout-related diagnoses |
Length of follow-up: >90% follow-up for 4 years
Incomplete outcome data: Complete data was a selection criteria. 5.6% of enrolees had not complete data.
|
Outcome measure-1 Defined as mortality due to CVD
Number of CVD deaths (%) I: 5650 (3) C: 74367 (2) Adjusted HR: 1.10 (1.07 to 1.13)
Outcome measure-2 Defined as morbidity due to CVD
Not reported
|
The National Death Registry was used to confirm survival of included participants.
Covariates in Cox regression models: gender, age, smoking-related diagnosis as a surrogate for cigarette smoking history and alcoholism-related diagnoses as a surrogate for chronic alcoholism history, hypertension, hyperlipidemia, atrial fibrillation and Charlson’s co-morbidity index (CCI) score. |
|
CVD morbidity |
|||||||
|
Janssens, 2017 |
Type of study: Cohort study
Setting: Primary care patients
Country: The Netherlands
Source of funding: None received |
Inclusion criteria:
N total at baseline: Intervention: 1859 Control: 6334
Important prognostic factors2: Age ± SD: I: 58 (14) C: 58 (14)
Sex: I: 72% M C: 65% M
Comorbidities (I/C) Hypertension: 39%/22% Diabetes mellitus: 15%/9% Hyperlipidemia: 10%/7% |
Gout (based on ICPC code T92)
|
Non-gout
|
Length of follow-up: Gout: Mean 29.8 months (SD 20.2) Non-gout: mean 26.8 months (SD 19.9)
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measure-1 Defined as mortality due to CVD
Not reported
Outcome measure-2 Defined as morbidity due to CVD
Number of CVD (%) I: 154 (8) C: 318 (3) Adjusted HR: 1.44 (1.18 to 1.76)
|
Adjusted for age, sex and comorbidities (hypertension, diabetes mellitus, hypercholesterolemia). |
|
Clarson, 2015a |
Type of study: Cohort study
Setting: Primary care patients
Country: UK
Source of funding: non-commercial |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 8386 Control: 39766
Important prognostic factors2: Age ± SD: I: 66 (11) C: 66 (11)
Sex: I: 69% M C: 69% M
Comorbidities (I/C) Hypertension: 36%/17% Hyperlipidemia: 6%/3% Diabetes: 4%/4% |
Gout (based on diagnostic code for gout in CPRD)
|
Non-gout
|
Length of follow-up: Not reported
Loss-to-follow-up: Not reported
Incomplete outcome data: Not reported
|
Outcome measure-1 Defined as mortality due to CVD
Not reported
Outcome measure-2 Defined as morbidity due to CVD
Number of CVD (%) Not reported Men: Adjusted HR: 0.95 (0.83 to 1.09) Women: Adjusted HR: 1.17 (0.99 to 1.38)
|
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures.
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
|
Study reference
(first author, year of publication) |
Bias due to a non-representative or ill-defined sample of patients?1
(unlikely/likely/unclear) |
Bias due to insufficiently long, or incomplete follow-up, or differences in follow-up between treatment groups?2
(unlikely/likely/unclear) |
Bias due to ill-defined or inadequately measured outcome ?3
(unlikely/likely/unclear) |
Bias due to inadequate adjustment for all important prognostic factors?4
(unlikely/likely/unclear) |
|
CVD mortality |
||||
|
Kok, 2012 |
Unlikely |
Unlikely |
Unlikely |
Likely; risk factor-related diagnosis was used instead of adjustment for the risk factor |
|
CVD morbidity |
||||
|
Janssens, 2017 |
Unlikely |
Unclear |
Unlikely |
Likely, analyses not adjusted for smoking or alcohol use or kidney function |
|
Clarson, 2015a |
Unlikely |
Unclear |
Unlikely |
Unlikely |
- Failure to develop and apply appropriate eligibility criteria: a) case-control study: under- or over-matching in case-control studies; b) cohort study: selection of exposed and unexposed from different populations.
- 2 Bias is likely if: the percentage of patients lost to follow-up is large; or differs between treatment groups; or the reasons for loss to follow-up differ between treatment groups; or length of follow-up differs between treatment groups or is too short. The Risk of Bias is unclear if: the number of patients lost to follow-up; or the reasons why, are not reported.
- Flawed measurement, or differences in measurement of outcome in treatment and control group; bias may also result from a lack of blinding of those assessing outcomes (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Failure to adequately measure all known prognostic factors and/or failure to adequately adjust for these factors in multivariate statistical analysis.
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-06-2021
Uiterlijk in 2020 bepalen het bestuur van het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie zijn regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Nederlands Huisartsen Genootschape en het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd door het Nederlands Huisartsen Genootschap en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze multidisciplinaire richtlijn is het optimaliseren van de preventie van hart- en vaatziekten met specifieke focus op individuen met een verhoogd risico op hart- en vaatziekten.
Doelgroep
Deze multidisciplinaire richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij cardiovasculair risicomanagement
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hoes (voorzitter) |
|
|
- |
Geen |
|
Konings |
Kaderhuisarts hart- en vaatziekten |
- |
- |
Geen |
|
Tjin-A-Ton |
Kaderhuisarts hart- en vaatziekten |
|
- |
Geen |
|
Visseren |
|
|
Deelname aan fase II en II multicenter trials oer PSCK9-antilichamen. Betrokken bij patiënteninclusie, geen data-analyse |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Liem |
|
|
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Martens |
Cardioloog |
Bestuurslid Werkgroep Cardiologische centra Nederland (WCN) |
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Den Hertog |
Neuroloog |
|
- |
Geen |
|
Henstra |
Verpleegkundig Specialist Vasculaire geneeskunde |
- |
Advies aan industrie lancering nieuwe medicatie bij FH |
Geen; valt buiten het bestek van de richtlijn |
|
Strijbis |
Relatiemanager Hartenraad |
Werkgroeplid Hypertensie in de tweede en derde lijn |
- |
Geen |
|
Van Laarhoven |
|
Werkgroeplid (erfelijke) dyslipidemie in de tweede en derde lijn |
- |
Geen |
|
Van Dis |
|
Lid van de werkgroep Voeding van de European Heart Network |
Hartstichting heeft een samenwerkingscontract met Unilever |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardiging van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hartenraad en Hartstichting.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. CVRM-indicatoren zijn separaat aan de herziening van deze richtlijn ontwikkeld en te vinden op https://www.nhg.org/themas/publicaties/download-indicatoren-archief.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stapsgewijze beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Voor het herzien van de Nederlandse multidisciplinaire richtlijn CVRM heeft de werkgroep besloten uit te gaan van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Deze richtlijn was op het moment van starten de meest recente richtlijn met de meest recente evidence. De werkgroep beoordeelde de aanbevelingen uit de eerder genoemde richtlijn op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een Invitational conference door Diabetesvereniging Nederland, IGZ, FMCC, Hartenraad (voorheen De Hart&Vaatgroep), KNGF, KNMP, NHG, NVAB, NVALT, NVR, NVVC, Verenso en InEen. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, en (3) de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de ondersteuners concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming over aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep in ieder geval voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar onderzoeken aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar onderzoeken met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Deze geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënte perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele onderzoeken
Individuele onderzoeken werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende onderzoeksresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de ‘Risk of Bias’ (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal onderzoeken en overeenkomstigheid (homogeniteit) tussen de onderzoeken werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De uiteindelijke bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en heeft de werkgroep de richtlijn definitief vastgesteld. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
