Lipidenverlagende behandeling en LDLc-streefwaarde bij (kwetsbare) ouderen >70 jaar
Uitgangsvraag
Wat is de meerwaarde van de behandeling met lipidenverlagende middelen bij (kwetsbare) ouderen (>70 jaar)?
Aanbeveling
Vitale ouderen
Starten van lipidenverlagende medicatie
Overweeg het aanbieden van lipidenverlagende medicatie aan vitale ouderen zonder hart- en vaatziekten alleen met een voldoende hoog geschat resterende levensverwachting en een hoog geschat risico op een vasculair event*.
Streef naar een LDL-C < 2,6 mmol/L.
*Bijvoorbeeld: geschat met SCORE2-OP óf door de aanwezigheid van ernstige risicofactoren (zoals diabetes, een zeer hoog cholesterol (TC > 8 mmol/L) of een zeer hoge bloeddruk (≥ 180/110 mmHg)).
Starten van lipidenverlagende medicatie
Bied lipidenverlagende medicatie aan vitale ouderen met hart- en vaatziekten aan.
Streef naar een LDL-C < 2,6 mmol/L. Overweeg een lagere streefwaarde als medicatie goed wordt verdragen en hart- en vaatziekte herhaald optreedt ondanks een LDL-C van <2,6 mmol/L.
Evalueer de eventuele bijwerkingen nauwgezet. Switch naar een andere statine of verlaag de statinedosering en overweeg ezetimib toe te voegen bij het vermoeden van het ontstaan van bijwerkingen.
Stoppen van lipidenverlagende medicatie
Stop alleen met lipidenverlagende medicatie bij onoverkomelijke bijwerkingen bij vitale ouderen met hart- en vaatziekten.
Kwetsbare ouderen
Starten van lipidenverlagende medicatie
Start niet met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Starten van lipidenverlagende medicatie
Overweeg het geven van lipidenverlagende medicatie aan kwetsbare ouderen na een (recent) vasculair event en met een voldoende hoog geschat resterende levensverwachting.
Overweeg te starten met een standaarddosis statine.
Evalueer het optreden van bijwerkingen nauwgezet en let op myopathie, behoud van functie en kwaliteit van leven.
Stoppen van lipidenverlagende medicatie
Stop met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Stoppen van lipidenverlagende medicatie
Overweeg te stoppen met lipidenverlagende medicatie bij kwetsbare ouderen met hart- en vaatziekten, met name bij het optreden van een mogelijke bijwerking of bij een geringe geschatte resterende levensverwachting.
Overwegingen
Voor patiënten onder de 70 jaar zijn de aanbevelingen omtrent lipidenverlagende medicatie beschreven in de module Streefwaarden van LDL-C bij behandeling met lipidenverlagende medicatie tot en met een leeftijd van 70 jaar.
Het gebruik van statines lijkt het risico op een cardiovasculair event te verlagen bij ouderen zonder hart- en vaatziekten vergeleken met een placebo, maar de bewijskracht is laag. (Inter)Nationaal is er discussie over de LDL-streefwaarden bij ouderen mét een doorgemaakte hart- en vaatziekte, waarbij sommige (inter)nationale richtlijnen adviseren om ook voor ouderen > 70 jaar met een hart- of vaatziekte een streefwaarde van < 1,8 aan te houden. Uit de literatuur die hierboven is beschreven, lijkt een LDL-streefwaarde <1,8 mmol/L bij ouderen (>75 jaar) mogelijk het risico op majeure cardiovasculaire events te verminderen, vergeleken met een streefwaarde van 2,3-2,8 mmol/L (Amarenco, 2020a). Het betreffen echter subgroepanalyses met te weinig statistische power om precieze schattingen van het effect te kunnen doen en de bewijskracht is dan ook laag. We beschrijven hier punten die de richtlijnwerkgroep mee heeft genomen om tot de aanbevelingen te komen.
NB. Voor de definitie van vitale ouderen, verwijzen we naar de richtlijnen van de NVKG.
Veiligheid
Bij het gebruik van een lipidenverlagend medicament door zowel ouderen met als zonder hart- en vaatziekten geldt dat de omvang van het risico op bijwerkingen in de dagelijkse klinisch praktijk niet is in te schatten. Het ontbreken van relevante myopathie in de hiervoor besproken en andere studies met statines is niet te extrapoleren naar de dagelijkse praktijk: in studies zijn veelal deelnemers opgenomen die vitaler zijn en minder comorbiditeit en comedicatie hebben dan de oudere patiënten die inmiddels in groten getale met statines behandeld worden. Post-marketing surveillance geeft evenmin een betrouwbare indicatie van de incidentie van myopathie omdat deze vaak mild is en deels oude patiënten treft die al mobiliteitsstoornissen ervaren. Milde myopathie kan daarentegen wel degelijk leiden tot een relevante reductie van mobiliteit die daarmee theoretisch zelfs het nagestreefde preventieve effect teniet kan doen. Lareb meldt dat er regelmatig meldingen van ernstige spierklachten bij zowel ouderen als jongeren worden gedaan. Over de uiterste consequenties van mogelijk mobiliteitsverlies door statinegebruik, vallen en functionele achteruitgang, is niets bekend.
Tenslotte geeft het voorschrijven van een lipidenverlagend medicament aan ouderen met polyfarmacie een verhoogd risico op het ontstaan van interacties. Met name simvastatine en atorvastatine zijn door hun afhankelijkheid van het cytochroom P450 3A4 (CYP3A4) metabolisme gevoelig voor interacties met CYP3A4-remmers zoals een aantal calciumantagonisten, “azolen” en macroliden. Op theoretische gronden lijken pravastatine en rosuvastatine een gunstiger interactieprofiel te hebben dan simvastatine en atorvastatine.
Patiëntenperspectief
In de media wordt al jaren aandacht besteed aan het belang van een laag cholesterol. Daarnaast worden cholesterolmetingen gevraagd door levensverzekeraars en ook gratis op (ouderen)beurzen als gezondheidsbevorderend middel aangeboden. Al deze aandacht leidt ertoe dat ook oudere patiënten hun artsen vragen om meting van hun cholesterol en belang hechten aan het bereiken van lage waarden. Media noch verzekeraars schenken aandacht aan de onzekerheden die verbonden zijn aan de behandeling van ouderen met lipidenverlagend medicatie.
Tenslotte blijkt bij gebruikers van lipidenverlagende medicatie van middelbare leeftijd dat de lange termijn therapietrouw zeer laag is. Het is onbekend of dit samenhangt met bijwerkingen of met andere factoren. Ook is onbekend of dit voor ouderen ook geldt; dit is echter wel waarschijnlijk.
Professioneel perspectief
In de huidige richtlijnen voor cardiovasculair risicomanagement vormt hoge leeftijd een van de belangrijke risicofactoren voor cardiovasculaire ziekten. Het hieruit voorkomend advies om laagdrempelig bij ouderen met en zonder hart- en vaatziekten met lipidenverlagend medicatie toe te passen komt met name voort uit geëxtrapoleerde onderzoeksresultaten. In deze onderzoeken waren ouderen slecht vertegenwoordigd, de geïncludeerde ouderen waren zeer vitaal en kwetsbare ouderen waren vrijwel volledig uitgesloten van deelname. Bovendien zijn de voor ouderen relevante uitkomstmaten (I)ADL-functioneren en kwaliteit van leven in geen van de beschreven onderzoeken meegenomen.
Hoewel het bewijs waarop de richtlijnaanbevelingen met betrekking tot het behandelen van kwetsbare ouderen met lipidenverlagende medicatie gebaseerd zijn beperkingen kent, hebben de zorgverzekeraars het voorschrijven van lipidenverlagende medicatie aan iedereen die aan de richtlijn-karakteristieken voldoet tot norm en kwaliteitsindicator verheven. Een klein deel van de eerstelijns praktijkfinanciering kan zelfs afhankelijk zijn van het percentage patiënten dat statines krijgt voorgeschreven. Deze vorm van financiering stimuleert vanwege de hoge prevalentie van cardiovasculaire risicofactoren bij kwetsbare ouderen het voorschrijven van lipidenverlagende medicatie in de doelgroep waar de onderbouwing van de meerwaarde bij kwetsbare ouderen zonder hart- en vaatziekten afwezig is en bij kwetsbare ouderen met hart- en vaatziekten zwak is.
Indien bij ouderen met hart- en vaatziekten de keuze wordt gemaakt om een lipidenverlagend medicament voor te schrijven, moet daarbij in overweging worden genomen of de zogenaamde time-to-benefit binnen de levensverwachting van de patiënt valt. In de PROSPER-studie werd gemiddeld na ruim drie jaar statine-gebruik een significant cardiovasculair morbiditeits- en mortaliteitsvoordeel gezien met een NNT van 25. In diverse andere studies met jongere deelnemers werd een kortere time-to-benefit gevonden. Een gemiddelde 85-jarige man had in 2012 volgens het CBS een resterende levensverwachting van 5,6 jaar. De 85-jarige met hart- en vaatziekten waarbij lipidenverlagende behandeling overwogen wordt, voldoet waarschijnlijk niet aan deze levensverwachting; deze zal vooral bepaald worden door de ernst van de comorbiditeit en het actuele niveau van functioneren. Derhalve is individuele inschatting van het absoluut risico op hart- en vaatziekte bij een (kwetsbare) oudere van groot belang, evenals een individuele inschatting van het te verwachten behandeleffect van lipiden-verlaging. Bij risicocommunicatie en shared decision making met de patiënt kan het gebruik van een algoritme waarmee het 5- of 10-jaarsrisico op hart- en vaatziekten bij ouderen kan worden geschat, toegevoegde waarde hebben (Stam-Slob, 2016). Binnen deze doelgroep is het NNH (number needed to harm) onbekend.
In geen van de genoemde studies werden verschillende streefwaarden voor LDL vergeleken bij kwetsbare ouderen. Dosiswijziging of toevoeging van een lipidenverlagend medicament bij kwetsbare ouderen zal vooral gedreven zijn door de aan- of afwezigheid van bijwerkingen.
Een buiten de zoekcriteria vallend onderzoek toonde dat bij personen >75 jaar het toevoegen van ezetimib aan simvastatine het risico op hart- en vaatziekten met 20% verlaagt (HR 0,80; 95%BI 0,70 tot 0,90). Bij personen <75 jaar was er geen effect (HR 0,97; 95%BI 0,92 tot 1,03) (Canon, 2015).
De veiligheid van het stoppen van lipidenverlagende medicatie is in de hierboven beschreven doelgroepen nog niet goed onderzocht.
Kosten
De kosten van behandeling met statines zijn door het verlopen van de meeste patenten inmiddels zeer laag: de goedkoopste vorm van simvastatine kost €0,025 per dag, pravastatine kost €0,035 per dag. De kosten voor ezetimib (zonder statine) zijn €0,11 per dag en in combinatie met een statine tussen €0,30 en €1,56 per dag, afhankelijk van het type en dosering statine.
Kosteneffectiviteit
Er is geen kosten-effectiviteitsonderzoek met kwetsbare ouderen beschikbaar. Los van dit feit kan ook bij een lage medicijnprijs de kosteneffectiviteit van een behandeling niet aangetoond worden als de effectiviteit niet onomstotelijk is vastgesteld.
Rationale
Cruciaal is de betekenis die aan streefwaarden moet worden gehecht. Deze waarden geven richting aan het te kiezen beleid, maar dicteren deze niet. Indien intensivering van medicamenteuze therapie om welke reden dan ook ongewenst is, dan kan in overleg met de patiënt met een hogere waarde genoegen genomen worden.
De werkgroep is van mening dat de TST-trial (Amarenco, 2020a) een streefwaarde van LDL-C < 1,8 mmol/L bij vitale patiënten boven 70 jaar met hart- en vaatziekten in enige mate ondersteunt (ook al was de subgroepanalyse van die trial die werd gepubliceerd beperkt tot 75 plussers), aangezien er geen significante heterogeniteit van het effect van een lage streefwaarde was tussen de verschillende leeftijdsgroepen. Er zijn echter ook argumenten die tegen deze lage streefwaarde pleiten. In de eerste plaats is de totale hoeveelheid literatuurgegevens over LDLc en cardiovasculair risico grotendeels gebaseerd op personen onder de 70 jaar. In de tweede plaats toont de subgroep van personen ouder dan 75 jaar in de TST-trial (Amarenco, 2020a), indien geheel geïsoleerd van de overige leeftijdsgroepen beschouwd, geen statistisch significant resultaat. De werkgroep is zich tenslotte bewust dat deze streefwaarde in de praktijk vaak moeilijk te behalen is. Alles overwegende beveelt de werkgroep daarom voor ouderen met hart- en vaatziekten sowieso een streefwaarde van 2,6 mmol/L aan. Een lagere streefwaarde kan overwogen worden, afhankelijk van hoe de medicatie verdragen wordt en of er extra risicoverhogende omstandigheden zijn, zoals het herhaald optreden van hart- en vaatziekten.
Bij kwetsbare ouderen blijft terughoudendheid ten aanzien van lage streefwaarden sowieso gerechtvaardigd.
De inhoudelijke basis, nodig voor het samen beslissen om al dan niet met een statine te starten, kan worden geleverd door een risicoscore tabel zoals die besproken wordt in module ‘Schatten van het risico op hart- en vaatziekten.
Onderbouwing
Achtergrond
Lipidenverlagende medicijnen zijn zowel bij patiënten met als bij patiënten zonder hart- en vaatziekten zeer effectief gebleken. Het bij een populatie van vooral middelbare leeftijd verkregen bewijs wordt breeduit, tot op richtlijnniveau geëxtrapoleerd naar ouderen. Bij ouderen is het bewijs voor de effectiviteit van lipidenverlagende medicijnen beperkt tot de jongsten en vitaalsten onder hen. Belangrijker dan morbiditeit en mortaliteit zijn voor kwetsbare ouderen de uitkomstmaten als behoud van functioneren, kwaliteit van leven, ziektevrij leven, cognitie en bijwerkingen van medicatie. Als deze uitkomstmaten niet beschikbaar zijn dan is prospectief onderzoek naar deze vragen bij kwetsbare en multimorbide ouderen dringend gewenst.
Conclusies / Summary of Findings
PICO1
Ouderen zonder hart- en vaatziekten
Hart- en vaatziekten
|
Zeer laag GRADE |
Het gebruik van statines lijkt het risico op een cardiovasculair event te verlagen bij ouderen zonder hart- en vaatziekten vergeleken met een placebo, maar de evidence is zeer onzeker.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Vergeleken met een placebo lijkt het gebruik van statines het risico op een hartinfarct te verlagen bij ouderen zonder hart- en vaatziekten, maar de evidence is zeer onzeker.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Het gebruik van statines lijkt niet of nauwelijks effect te hebben op het risico op een beroerte vergeleken met placebo bij ouderen zonder hart- en vaatziekten, maar de evidence is zeer onzeker.
Bronnen (Teng, 2015) |
Kwaliteit van leven & (cognitief) functioneren
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van statine ten opzichte van placebo op kwaliteit van leven en (cognitief) functioneren bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Bijwerkingen
|
Zeer laag GRADE |
Vergeleken met een placebo lijkt het gebruik van statines niet of nauwelijks effect te hebben op het risico op myalgie bij ouderen zonder hart- en vaatziekten, maar de evidence is zeer onzeker.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Vergeleken met een placebo lijkt het gebruik van statines niet of nauwelijks effect te hebben op het risico op het ontstaan van diabetes bij ouderen zonder hart- en vaatziekten, maar de evidence is zeer onzeker.
Bronnen (Teng, 2015) |
|
Redelijk GRADE |
Vergeleken met een placebo geeft het gebruik van statines waarschijnlijk geen hoger risico op het ontstaan van ernstige bijwerkingen bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Mortaliteit
|
Redelijk GRADE |
Vergeleken met een placebo heeft het gebruik van statines waarschijnlijk geen effect op all-cause mortaliteit bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Ouderen met hart- en vaatziekten
Hart- en vaatziekten
|
Hoog GRADE |
Vergeleken met een placebo verlaagt dagelijks 40 mg pravastatine het risico op overlijden als gevolg van coronaire hartziekten, een niet-fatale myocardiaal infarct en fatale of niet-fatale beroerte bij ouderen met hart- en vaatziekten.
Bronnen (Shepherd, 2002) |
Cognitief functioneren
|
Hoog GRADE |
Vergeleken met een placebo heeft dagelijks 40 mg pravastatine geen effect op cognitief functioneren bij ouderen met hart- en vaatziekten.
Bronnen (Trompet, 2010) |
Kwaliteit van leven, bijwerkingen & totale mortaliteit
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van dagelijks 40mg pravastatine vergeleken met placebo op kwaliteit van leven, bijwerkingen en totale mortaliteit bij ouderen met hart- en vaatziekten.
Bronnen (Shepherd, 2002; Trompet, 2010) |
PICO2
|
Laag GRADE |
Een LDL-C-streefwaarde van < 1,8 mmol/L bij ouderen (> 75 jaar) met een herseninfarct lijkt mogelijk het risico op majeure cardiovasculaire events te verminderen vergeleken met een streefwaarde van 2,3 – 2,8 mmol/L.
Bronnen: Amarenco, 2020 |
|
- GRADE |
Vanwege het ontbreken van gegevens over myocardinfarct of urgente coronaire revascularisatie is niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct ouder dan 75 jaar.
Bronnen: - |
|
- GRADE |
Vanwege het ontbreken van gegevens over mogelijke bijwerkingen is niet mogelijk een conclusie te trekken over het risico op bijwerkingen bij verschillende streefwaarden van LDL-C bij patiënten met een herseninfarct ouder dan 75 jaar.
Bronnen: - |
Samenvatting literatuur
Beschrijving studies – PICO1
Ouderen zonder hart- en vaatziekten
In de systematische review van Teng (2015) werd de effectiviteit en veiligheid van statines vergeleken met standaardzorg of placebobehandeling. De auteurs van de review beschreven echter niet wat standaardzorg in de geïncludeerde trials betrof. De literatuur werd doorzocht tot augustus 2014, en de vijf gerandomiseerde gecontroleerde trials die ook voldeden aan het leeftijdscriterium (>70 jaar) van deze literatuursamenvatting werden hier geïncludeerd. De onderzochte interventies bestonden uit dagelijks 40 milligram pravastatine (twee studies), 10 milligram atorvastatine (één studie), 80 milligram fluvastatine XL (één studie) en 20 milligram rosuvastatine (één studie). Uitkomsten van de review waren hart- en vaatziekten, bijwerkingen, cognitief functioneren en mortaliteit. Aan de geïncludeerde studies deden 20.147 ouderen zonder hart- en vaatziekten mee, en de gemiddelde follow-up tijd van de studies varieerde tussen de 1 en 4,8 jaar. In een van de geïncludeerde studies namen alleen patiënten met diabetes deel (Colliers, 2014) en één studie (ALLHAT, 2002) was niet geblindeerd.
Resultaten
1. Hart- en vaatziekten
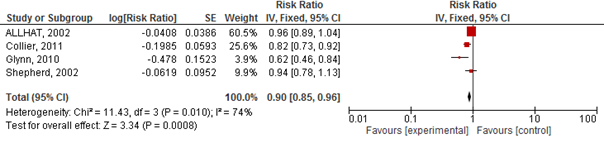
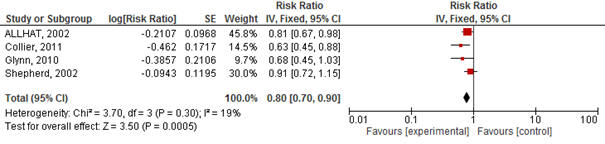
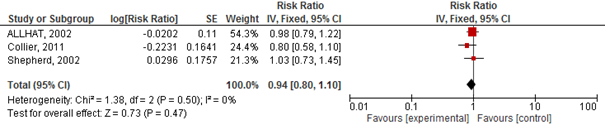
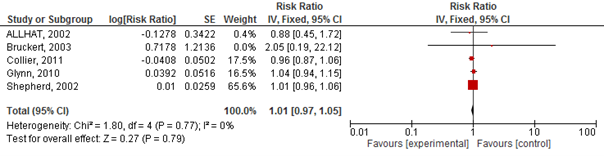
Vier studies geïncludeerd in Teng (2015) rapporteerden het risico op een cardiovasculair event. Het gebruik van statines verlaagde het risico op een cardiovasculair event met 10% (RR 0,90 95%BI 0,85 tot 0,96; figuur 2.20) en NNT van 133 over gemiddeld 3,5 jaar en specifiek op een hartinfarct (totaal) met 20% (RR 0,80 95%BI: 0,70 tot 0,90; figuur 2.21) en NNT van 25 over gemiddeld 3,5 jaar. Er werd echter geen risicoreductie van statines op beroertes gevonden (drie studies; RR 0,94 95%BI 0,80 tot 1,10; figuur 2.22).
Figuur 2.20 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een cardiovasculair event hebben geëvalueerd
Figuur 2.21 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een hartinfarct hebben geëvalueerd
Figuur 2.22 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een beroerte hebben geëvalueerd
2. Kwaliteit van leven
Teng (2015) rapporteerde geen data over kwaliteit van leven.
3. Functioneren, waaronder cognitie
Teng (2015) rapporteerde geen data over functioneren.
4. Bijwerkingen, waaronder spierklachten
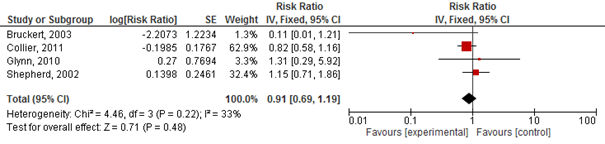
Teng (2015) rapporteerde het risico op myalgie (vier studies), ontstaan van diabetes (twee studies), en ernstige bijwerkingen (vijf studies). De auteurs beschrijven niet welke bijwerkingen vallen onder ernstige bijwerkingen. De gepoolde resultaten op de uitkomsten myalgie en ernstige bijwerkingen zijn weergegeven in figuren 2.23 en 2.24. Het risico op myalgie en op ernstige bijwerkingen was niet significant verhoogd bij gebruik van statines (myalgie RR 0,91 95%BI: 0,69 tot 1,19; ernstige bijwerkingen RR 1,01 95%BI: 0,97 tot 1,05). In twee door Teng (2015) geïncludeerde studies was ook het risico op het ontstaan van diabetes onderzocht; beide studies vonden geen significant effect van statines (RR 0,9 95%BI: 0,64 tot 1,26 en RR 1,25, 95%BI: 0,91 tot 1,73).
Figuur 2.23 Meta-analyse van studies die bij ouderen het effect van statines op het risico op myalgie hebben geëvalueerd (‘favours experimental’: ten faveure van statine)
Figuur 2.24 Meta-analyse van studies die bij ouderen het effect van statines op het risico op het serious adverse events hebben geëvalueerd (‘favours experimental’: ten faveure van statine)
Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat cardiovasculair event is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial) en aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat hartinfarct is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial), de inconsistentie en de imprecisie met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat beroerte is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial) en de imprecisie met drie niveaus verlaagd.
Kwaliteit van leven & (cognitief) functioneren: De bewijskracht voor de uitkomstmaten kwaliteit van leven en (cognitief) functioneren kan niet worden gegradeerd vanwege het ontbreken van data.
Bijwerkingen: De bewijskracht voor de uitkomstmaat myalgie is, gezien beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ontstaan van diabetes is, gezien de beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse), de inconsistentie en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ernstige bijwerkingen is, gezien de beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) met een niveau verlaagd.
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit is, gezien beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) met een niveau verlaagd.
Ten aanzien van de generaliseerbaarheid is alleen in de PROSPER-studie (Shepherd, 2002) bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. De overige studies gaven hierover geen gedetailleerde gegevens. Het is zeer aannemelijk dat een selectie van de vitaalste ouderen aan de geïncludeerde studies heeft deelgenomen; er is daarmee sprake van een lage externe validiteit.
Ouderen met hart- en vaatziekten
Beschrijving van studies
Shepherd (2002) en Trompet (2010) beschrijven dezelfde gerandomiseerde gecontroleerde studie. Van alle deelnemers (n=5804) hadden 2565 ouderen (70 tot 82 jaar) een vasculaire aandoening in de anamnese. Deelnemers aan de studie kregen of 40 milligram pravastatine per dag of een placebo, en werden gemiddeld ongeveer 3,5 jaar gevolgd. Uitkomstmaten in deze studie waren cognitief functioneren met behulp van de Mini Mental State Examination bepaald en de uitkomsten gedefinieerd als het totaal van het aantal overlijden door coronaire hartziekten, niet fatale hartinfarcten en fatale en niet-fatale beroerten.
Resultaten
1. Hart- en vaatziekten
Shepherd (2002) rapporteerde dat dagelijks 40 milligram pravastatine het risico op overlijden als het gevolg van coronaire hartziekten, een niet-fatale myocardiaal infarct en fatale of niet-fatale beroerte met 22% verlaagd is (HR 0,78 95%BI: 0,66 tot 0,93 en NNT van 24 over 3,2 jaar).
2. Kwaliteit van leven
Shepherd (2002) en Trompet (2010) rapporteerden geen data over kwaliteit van leven.
3. Functioneren, waaronder cognitie
Er werd in één studie verslag gedaan van het effect van statinegebruik op cognitief functioneren. Trompet (2010) rapporteerde dat de dagelijkse 40 milligram pravastatine geen significant effect had op cognitief functioneren (gemeten werd: attention, gemiddeld verschil=0,36 95%BI: -0,02 tot 0,74; processing speed, gemiddeld verschil=-0,02 95%BI: -0,08 tot 0,09; immediate recall en gemiddeld verschil=0,002 95%BI: -0,03 tot 0,04; delayed recall gemiddeld verschil=0,04 95%BI: -0,01 tot 0,09).
4. Bijwerkingen, waaronder spierklachten
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van de bijwerkingen geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over de bijwerkingen van dagelijks 40 milligram pravastatine.
5. Totale mortaliteit
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van mortaliteit geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over het effect van dagelijks 40 milligram pravastatine op totale mortaliteit.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten kwaliteit van leven, bijwerkingen en all-cause mortaliteit kan niet worden gegradeerd vanwege het ontbreken van data.
Hart- en vaatziekten & (cognitief) functioneren: De bewijskracht voor de uitkomstmaten functioneren, met name cognitief functioneren, en hart- en vaatziekten wordt niet verlaagd.
Ten aanzien van de generaliseerbaarheid is in de PROSPER-studie (Shepherd, 2002; Trompet, 2010) bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. Er werd hierbij geen onderscheid gemaakt tussen deelnemers met en zonder cardiovasculaire ziekten in de voorgeschiedenis. De gemiddelde uitkomsten van de (I)ADL tests lagen echter zo dicht bij het maximum dat aannemelijk is dat beide groepen vrijwel volledig bestonden uit volledig zelfstandig functionerende ouderen. Er is daarmee sprake van een lage externe validiteit.
Beschrijving studies – PICO2
Amarenco (2020; TST-trial) onderzocht de waarde van een streefwaarde van LDL-C van <1,8 mmol/L om het risico op hart- en vaatziekten te verlagen bij patiënten met een herseninfarct. In totaal werden 2148 patiënten geïncludeerd met een gemiddelde leeftijd van 67 (SD 11, bereik: 45 tot 89) jaar. 1073 patiënten, van wie 259 ouder dan 75 jaar, werden aan een streefwaarde van <1,8 mmol/L toegewezen en 1075 patiënten, van wie 268 ouder dan 75 jaar, aan een streefwaarde van 2,3 – 2,8 mmol/L. Op baseline was het gemiddelde niveau van LDL-C 3,5 mmol/L in beide groepen. De keuze voor type statine en dosering was aan de onderzoekers. Drie weken en elke zes maanden na randomisatie werd het LDL-C gemeten en afhankelijk van de uitslag werd de dosering van de statine aangepast of ezetimib toegevoegd. De follow-upduur was 5,3 jaar (mediaan). Over deze periode bereikte de interventiegroep (streefwaarde < 1,8) gemiddeld een LDL-C van 1,7 mmol/L vergeleken met 2,5 mmol/L in de controlegroep (streefwaarde 2,3 – 2,8).
Resultaten
De resultaten uit de subgroepanalyse bij ouderen (> 75 jaar) werden alleen beschreven.
4. Majeure cardiovasculaire events
De uitkomstmaat ‘majeur cardiovasculair event’ was een samengesteld eindpunt, bestaande uit niet-fataal herseninfarct of beroerte van onbekende oorzaak, niet-fataal myocardinfarct, ziekenhuisopname voor onstabiele angina, gevolgd door urgente revascularisatie van de kransslagader, TIA die dringende revascularisatie van de halsslagader vereist, of cardiovasculaire dood inclusief onverklaarde plotselinge dood. 30 (12%) deelnemers kregen een majeur cardiovasculair event bij een streefwaarde van < 1,8 mmol/L vergeleken met 38 (14%) deelnemers bij een streefwaarde van 2,3 – 2,8 mmol/L. Het relatieve risico op een majeur cardiovasculair event was 22% verlaagd bij een streefwaarde van < 1,8 vergeleken met 2,3 – 2,8 mmol/L (HR 0,78 95%BI: 0,48 tot 1,26, geadjusteerd en geanalyseerd met competing risk). Het absolute risicoverschil is -3% (95%BI -8% tot 3%).
5. Myocardinfarct of urgente coronaire revascularisatie of mortaliteit
Er werden geen gegevens over myocardinfarct of urgente coronaire revascularisatie of mortaliteit bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2,8 mmol/L onder ouderen (> 75 jaar) gerapporteerd.
6. Bijwerkingen, kwaliteit van leven, functioneren,
Er werden geen gegevens over mogelijke bijwerkingen bij een streefwaarde van < 1,8 mmol/L versus 2,3 – 2,8 mmol/L onder ouderen (> 75 jaar) gerapporteerd.
Bewijskracht van de literatuur
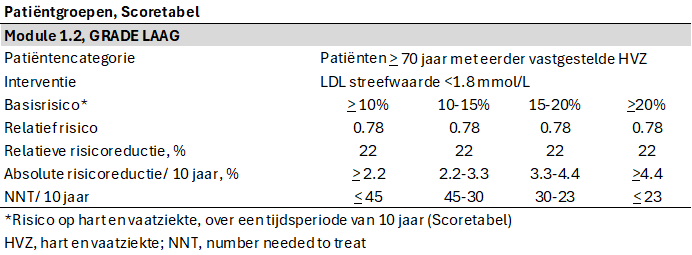
Onderstaande tabel combineert de uit de literatuursamenvatting gevonden relatieve risicoreductie op hart en vaatziekten met het basisrisico van de Scoretabellen, met daarbij de NNTs over een tijdsperiode van 10 jaar.
De bewijskracht start op een hoog niveau vanwege het therapeutische domein van de zoekvraag.
Majeure cardiovasculaire events: De bewijskracht voor de uitkomstmaat is met twee niveaus verlaagd gezien imprecisie (één niveau) en risk of bias (één niveau want het betreft een subgroepanalyse).
Myocardinfarct of urgente coronaire revascularisatie: De bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Bijwerkingen: De bewijskracht voor de uitkomstmaat is niet beoordeeld vanwege het ontbreken van gegevens.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van lipidenverlagende medicijnen bij ouderen (ouder dan 70 jaar) met of zonder hart- en vaatziekten vergeleken met een placebo of geen behandeling?
P1: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I1: lipidenverlagende therapie;
C1: placebo of geen behandeling;
O1: hart- en vaatziekte, kwaliteit van leven, functioneren, bijwerkingen, totale mortaliteit.
Welke streefwaarde van LDL-C dient te worden gehanteerd bij lipidenverlagende behandeling van ouderen met een verhoogd risico op hart- en vaatziekten?
P2: ouderen (ouder dan 70 jaar) met een verhoogd risico op hart- en vaatziekten;
I2: behandeling onder streefwaarde 1 van LDL-C;
C2: behandeling onder streefwaarde 2 van LDL-C;
O2: hart- en vaatziekte, kwaliteit van leven, functioneren, bijwerkingen, totale mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Klinische relevantie
De duiding van klinische relevantie wordt in Module Schatten van het risico op hart- en vaatziekten besproken (paragraaf van risico naar behandeladviezen).
Zoeken en selecteren (Methode)
Zoekactie PICO1 – maart 2016
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerde trials en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 618 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en Risk of Bias beoordeling);
- gerandomiseerde trials van patiënten ouder dan 70 jaar, of patiënten met een gemiddelde leeftijd van 70 jaar of ouder of een subgroep-analyse van patiënten 70 jaar of ouder die een statine of een ander lipidenverlagend medicijn kregen vergeleken met een placebo of geen behandeling.
Op basis van titel en abstract werden in eerste instantie 40 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 37 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en drie studies definitief geselecteerd.
Resultaten
Er is één systematische review geïncludeerd die zich focuste op de effectiviteit van een statine bij ouderen zonder hart- en vaatziekten. In deze review waren acht gerandomiseerde gecontroleerde trials opgenomen, waarvan vijf trials voldeden aan de gestelde PICO. Naast deze review werd er één gerandomiseerde trial (beschreven in twee artikelen) gevonden waarin patiënten met hart- en vaatziekten een statine ter secundaire preventie werd gegeven. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Zoekactie PICO2 – december 2021
De zoekactie voor de module Streefwaarden van LDL-C bij behandeling met lipidenverlagende medicatie is op 16-12-2021 herhaald met een paar wijzigingen (zie zoekverantwoording voor meer detail). Met deze zoekactie worden ook potentiële studies gevonden voor deze uitgangsvraag.
Op basis van titel en abstract werden in eerste instantie 38 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 37 studies geëxcludeerd (zie exclusietabel Update 2021 onder het tabblad Verantwoording) en een studie definitief geselecteerd. Een trial vergeleek twee streefwaarden met elkaar (TST-trial) met een subgroepanalyse van patiënten ouder dan 75 jaar (Amarenco, 2020).
Referenties
- ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial. Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT-LLT). JAMA. 2002;288(23):2998-3007. PubMed PMID: 12479764.
- Cannon CP, Blazing MA, Giugliano RP, et al; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-97. doi: 10.1056/NEJMoa1410489.
- Collier DJ, Poulter NR, Dahlöf B, et al. Impact of atorvastatin among older and younger patients in the Anglo-Scandinavian Cardiac Outcomes Trial Lipid-Lowering Arm. J Hypertens. 2011;29(3):592-9. doi: 0.1097/HJH.0b013e328342c8f7. PubMed PMID: 21297502.
- Trompet S, van Vliet P, de Craen AJ, et al. Pravastatin and cognitive function in the elderly. Results of the PROSPER study. J Neurol. 2010;257(1):85-90. doi:10.1007/s00415-009-5271-7. PubMed PMID: 19653027.
- Shepherd J, Blauw GJ, Murphy MB, et al. PROspective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial.Lancet. 2002;360(9346):1623-30. PubMed PMID: 12457784.
- Stam-Slob MC, Visseren FL, Wouter Jukema J, et al. Personalized absolute benefit of statin treatment for primary or secondary prevention of vascular disease in individual elderly patients. Clin Res Cardiol. 2016. (Epub ahead of print) PMID: 27554244
- Teng M, Lin L, Zhao YJ, et al. Statins for Primary Prevention of Cardiovascular Disease in Elderly Patients: Systematic Review and Meta-Analysis. Drugs Aging. 2015;32(8):649-61. doi: 10.1007/s40266-015-0290-9. Review. PubMed PMID: 26245770.
Evidence tabellen
Ouderen zonder hart- en vaatziekten
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/ control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Elderly without cardiovascular diseases |
|||||||
|
Teng, 2015 |
SR and meta-analyses of RCT’s and subgroups of RCTs
Literature search up to August 2014
A: ALLHAT, 2002 B: Collier, 2011 C: Bruckert, 2003 D: Glynn, 2010 E: Stephard, 2002
Study design: RCT
Setting and Country: A: US, Puerto Rico, US Virgin Islands and Canada B: UK, Sweden, Norway, Denmark, Finland, Ireland C: France, Italy, Spain, Belgium and Israel D: North America, South America, Europe and Africa E: Scotland, Ireland and The Netherlands
Source of funding: Systematic review: Not sponsored
A: not sponsored by industry B: Sponsored by industry C: Sponsored by industry D: Sponsored by industry E: Sponsored by industry
|
Inclusion criteria SR:
Exclusion criteria SR:
8 studies included, of which 5 had a study sample with a age >70 years
Important patient characteristics at baseline:
N, mean age A: 5809 patients, 72 yrs B: 4445 patients, 71 yrs C: 1229 patients, 75.5 yrs D: 5695 patients, 74 yrs E: 3239 patients, 75 yrs
Sex: A: 52.2% Male B: 81.4% Male C: 25.1% Male D: 48.4% Male E: 41.5% Male
Diabetes: A: 38.3% B: 100% C: 7% D: 0% E: 12.2%
Hypertension A: 100% B: 26.7% C: 55.9% D: 65.6% E: 71.6%
Groups comparable at baseline? Unclear |
A: Pravastatin, 40 mg/day B: Atorvastatin, 10mg/day C: Fluvastatin XL, 80 mg/day D: Rosuvastatin, 20 mg/day E: Pravastatin, 40 mg/day
|
A: placebo or usual care B: placebo or usual care C: placebo or usual care D: placebo or usual care E: placebo or usual care
|
End-point of follow-up: Mean follow-up: A: 4.8 years B: 3.3 years C: 1 years D: 1.9 years E: 3.2 years
For how many participants were no complete outcome data available? (intervention/control) A: Not reported (low Risk of Bias) B: Not reported (low Risk of Bias) C: Not reported (low Risk of Bias) D: Not reported (low Risk of Bias) E: Not reported (low Risk of Bias)
|
Not reported
Not reported
Defined as myalgia A: Not reported B: RR 0.82 (95%CI: 0.58;1.15) C: RR 0.11 (95%CI: 0.01;2.12) D: RR 1.31 (95%CI: 0.29;5.83) E: RR 1.15 (95%CI: 0.71;1.84)
Defined as new onset diabetes A: Not reported B: RR 0.9 (95%CI: 0.64;1.26) C: Not reported D: RR 1.25 (95%CI: 0.91;1.73) E: Not reported
Defined as serious adverse events A: RR 0.88 (95%CI: 0.45;1.73) B: RR 0.96 (95%CI: 0.87;1.06) C: RR 2.05 (95%CI: 0.19;22.54) D: RR 1.04 (95%CI: 0.94;1.15) E: RR 1.01 (95%CI: 0.96;1.06)
Defined as all-cause mortality A: RR 1.01 (95%CI: 0.91;1.13) B: RR 0.97 (95%CI: 0.77;1.22) C: RR 1.02 (95%CI: 0.06; 16.35) D: 0.79 (95%CI: 0.62;1.02) E: 0.98 (95%CI: 0.88;1.04)
Defined as major adverse cardiovascular events (myocardial infarction, stroke, coronary revascularization, cardiac sudden death, angina) A: RR 0.96 (95%CI: 0.89;1.05) B: RR 0.82 (95%CI: 0.73;0.93) C: Not reported D: 0.62 (95%CI: 0.46;0.82) E: 0.94 (95%CI: 0.78;1.14)
Defined as myocardial infarction A: RR 0.81 (95%CI: 0.67;0.99) B: RR 0.63 (95%CI: 0.45;0.89) C: Not reported D: 0.68 (95%CI: 0.45;1.02) E: 0.91 (95%CI: 0.72;1.14)
Defined as stroke A: RR 0.98 (95%CI: 0.79;1.20) B: RR 0.80 (95%CI: 0.58;1.11) C: Not reported D: Not reported E: 1.03 (95%CI: 0.73;1.45)
|
Neil, 2006, Collins, 2003, Nakaya, 2011 were excluded because the age of the study sample was <70 years.
Of the original 8 RCTs included, 2 focussed on elderly, six trials comprised subgroups.
Teng, 2015 judged the overall quality of evidence (8 RCTs) as moderate. A was open labelled, B, C, D and E were sponsored by the industry.
|
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Teng, 2015 |
Yes |
No |
No |
No, some of the data could not be retrieved |
Not appliciable |
Yes |
Yes |
No |
yes |
Ouderen met hart- en vaatziekten – PICO1
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/ control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Elderly with cardiovascular diseases |
|||||||
|
Shepherd, 2002 Trompet, 2010 |
Type of study: RCT
Setting: multicenter
Country: Scotland, Ireland and The Netherlands
Source of funding: Industry sponsored |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 1306 Control:1259
Important prognostic factors: Data only reported for the complete cohort (primary and secondary prevention combined)
Groups comparable at baseline? Unknown
|
Pravastatin 40mg/day
|
Placebo |
Length of follow-up: Shepherd, 2002: 3.2 years (range 2.8 to 4.0 years) Trompet, 2010: mean 42 months (range 36 to 48 months)
Loss-to-follow-up: Not specified for patients with previous vascular disease.
Incomplete outcome data: Likely all patients analysed.
|
Not reported
Determined using the Mini-Mental State Examination (MMSE). Analyses were adjusted for age, educational status, country and when appropriate for sex and version of the test. Four tests were included: 1. Attention (Executive functioning, Stroop-Colour-Word-test) Est 0.36 (95%CI=-0.02;0.74)
2. Processing Speed (Executive functioning, Letter-Digit Coding Test) Est -0.02 (95%CI=-0.08;0.09)
3. Immediate recal (Memory, 15-Picture Learning test) Est 0.002 (95%CI=-0.03;0.04)
4. Delayed recal (Memory, 15-Picture Learning test) Est 0.04 (95%CI=-0.01;0.09)
Not reported separately for subgroup of patients with previous vascular disease.
Not reported separately for subgroup of patients with previous vascular disease.
Defined as definite or suspect death from coronary heart disease, non-fatal myocardial infarction, and fatal or non-fatal stroke I: 227 (17,4%) C: 273 (21.7%) HR 0.78 (95%CI=0.66;0.93) |
408 patients of the entire cohort (primary and secondary prevention), 277 control patients and 131 patients from the intervention group used non-study statin therapy.
Here, we report only the results of the subgroup analyses that included patients with stable angina, intermittend claudication, stroke, transient ischeamic attack, myocardial infarction, arterial surgery or amputation for vascular disease more than 6 months before study entry.
|
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?
(unlikely/likely/unclear) |
Bias due to loss to follow-up?
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?
(unlikely/likely/unclear) |
|
Shepherd, 2002 Trompet, 2015 |
“Sequence was generated with a computerised pseudorandom number generator and consisted of balanced blocks of size four” |
Unlikely |
Unlikely |
unlikely |
unlikely |
Unlikely |
Unclear |
Unlikely |
Research question PICO2: Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison / control (C) 3
|
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
PICO 2 Cholesterol target |
|||||||
|
Amarenco, 2020 (TST trial), focus on subgroup aged > 75 years |
Type of study: RCT
Setting and country: France
Funding and conflicts of interest: Industry (unrestricted grants) |
Inclusion criteria:
N total at baseline: Intervention: 1081 (analysed 1073), 259 > 75 years Control: 1077 (analysed 1075), 268 > 75 years
Important prognostic factors2: Age ± SD: I: 67 (11) C: 67 (11)
Sex: I: 68% M C: 69% M
LDL-c at baseline (mean): I: 3.5 mmol/L C: 3.5 mmol/L
Groups comparable at baseline? Yes |
LDL cholesterol target of 1.8 mmol/L by use of any type and any dose of statin. 3 weeks after randomization, statin dose was adjusted or other lipid-lowering agents including ezetimibe were added to achieve the assigned LDL cholesterol target.
|
LDL cholesterol target of 2.4 mmol/L by use of any type and any dose of statin.
3 weeks after randomization, statin dose was adjusted or other lipid-lowering agents including ezetimibe were added to achieve the assigned LDL cholesterol target.
|
Length of follow-up: Median 5.3 years
Loss-to-follow-up: Intervention: N = 295 (27%) Reasons (lost to follow-up (62); no signed consent (8); withdrawn consent (121); serious adverse event (2); investigator’s decisions (102))
Control: N = 271 (25%) Reasons (lost to follow-up (49); no signed consent (2); withdrawn consent (108); serious adverse event (3); investigator’s decisions (109))
Incomplete outcome data: Intervention: N = 8 (0.7%) Reasons (no signed consent)
Control: N = 2 (0.2%) Reasons (no signed consent)
|
Outcome measure-1 Defined as major cardiovascular events* (primary outcome)
I: 103 (10%) C: 139 (13%) HR: 0.74 (0.57-0.95), adjusted for entry event (stroke or TIA), time since entry event, sex and age at baseline; HR based on Cox model with competing risk (Finn and Gray model)
Outcome measure-2 Defined as myocardial infarction or urgent coronary revascularisation or mortality
No data reported for the subgroup.
Outcome measure-3 Defined as adverse events, quality of life or daily living.
No data reported.
|
*The primary end point was a composite of adjudicated nonfatal cerebral infarction or stroke of undetermined source, nonfatal myocardial infarction, hospitalization for unstable angina followed by urgent coronary artery revascularization, TIA requiring urgent carotid revascularization, or cardiovascular death including unexplained sudden death. |
Research question: Welke streefwaarde van LDL-C dient te worden gehanteerd bij de behandeling van patiënten met een verhoogd risico op hart- en vaatziekten?
|
Study reference
(first author, publication year) |
Was the allocation sequence adequately generated?
Definitely yes Probably yes Probably no Definitely no |
Was the allocation adequately concealed?
Definitely yes Probably yes Probably no Definitely no |
Blinding: Was knowledge of the allocated interventions adequately prevented?
Were patients blinded?
Were healthcare providers blinded?
Were data collectors blinded?
Were outcome assessors blinded?
Were data analysts blinded?
Definitely yes Probably yes Probably no Definitely no |
Was loss to follow-up (missing outcome data) infrequent?
Definitely yes Probably yes Probably no Definitely no |
Are reports of the study free of selective outcome reporting?
Definitely yes Probably yes Probably no Definitely no |
Was the study apparently free of other problems that could put it at a risk of bias?
Definitely yes Probably yes Probably no Definitely no |
Overall risk of bias If applicable/necessary, per outcome measure
LOW Some concerns HIGH
|
|
|
|
|
|
|
|
|
|
|
Amarenco, 2020 (TST trial) |
Definitely yes
Reason: From study protocol: “Randomization list has been created by the biostatistician of the clinical research unit of the Bichat Stroke Center, using SAS software version 9.1.”
|
Definitely yes
Reason: Computerized system with login was used. |
Probably no
Reason: Outcome assessors were blinded. However, due to the nature of the intervention, health providers were not blinded. It was unclear if participants were blinded. |
Definitely no
Reason: 25% and 27% in the intervention and control group, respectively, were lost to follow-up. Reasons were similar between groups. Participants were censored at last available follow-up. |
Definitely yes
Reason: Protocol was published and the trial was registered as well. Outcomes were reported as described in protocol. |
Definitely yes
Reason: Industry provided an unrestricted grant and were not involved in the trial, data collection or analysis. |
LOW (major cardiovascular events)
Reason: Due to the nature of the intervention and control, not being blinded most likely did not result in bias. Because participants lost to follow-up were censored (non-informative censoring), and reasons for lost to follow-up were similar, this most likely did not result in bias. |
Exclusietabel - PICO1
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Review filter |
|
|
Thai, 2016 |
Focus op medicatie interacties |
|
Lowe, 2015 |
Geen kwaliteitsbeoordeling; alleen gezocht in Medline; studies al in bovenstaande reviews |
|
Iwere, 2015 |
Meerdere trials geïncludeerd met een populatie jonger dan 70 jaar. Trials met >70 zijn reeds geïncludeerd in Savarese, 2013 |
|
Zoungas, 2014 |
Narratieve review |
|
Savaraese, 2014 |
Erratum |
|
Savarese, 2013 |
Recentere systematische review beschikbaar |
|
Fulcher, 2013 |
Congres abstract |
|
Chen, 2012 |
Patiënten met diabetes |
|
Weatherley, 2011 |
Risicoschatting op basis van bestaande predictiemodellen |
|
Mills, 2011 |
Intensivering van statine dosering |
|
Kolovou, 2011 |
Narratieve review |
|
Biffi, 2011 |
Alleen beroerte als uitkomst, geen RCTs geïncludeerd |
|
Biffi, 2011 |
Merendeel observationele studies geïncludeerd |
|
Berthold, 2011 |
Narratieve review |
|
Lakhan, 2010 |
Merendeel observationele studies; onduidelijk leeftijd van patienten |
|
Brugts, 2009 |
Merendeel RCTs patiënten jonger dan 70 jaar |
|
Walker, 2008 |
Narratieve review |
|
Afilalo, 2008 |
Patiënten jonger dan 70 jaar |
|
Bonovas, 2007 |
Studie met 70-plussers reeds geincludeerd in Teng, 2015 |
|
Raffel, 2006 |
Narratieve review |
|
Law, 2006 |
Alleen gezocht in Medline |
|
Hey-Hadavi, 2006 |
Betreft de associatie tussen verschillende doseringen van atorvastatine |
|
Dornbrook-Lavender, 2003 |
Geen zoekstrategie weergegeven; geen in- en exclusie gegevens; gemiddelde leeftijd niet weergegeven, veel waarschijnlijk onder de 70 gemiddeld. Sommige studies wel al geïncludeerd in recentere SRs |
|
Birch, 2002 |
Alleen gezocht in Medline; Voldoet niet aan leeftijdscriterium |
|
Mellies, 1993 |
1 onderzochte statine: pravastatin en relatief oud |
|
RCT-filter |
|
|
Wu, 2015 |
Cohortstudie |
|
Wilmot, 2015 |
Narratieve review |
|
Schwartz, 2015 |
Narratieve review |
|
Pilotto, 2015 |
Patiënten met DM; associatie tussen effectiviteit van statine en voorspelde mortaliteit risico |
|
Pedro-botet, 2015 |
Narratieve review |
|
Hamilton-Craig, 2015 |
Narratieve review |
|
Sigurdsson, 2014 |
Editorial |
|
Savarese, 2014 |
Editorial |
|
Reiner, 2014 |
Narratieve review |
|
Fontana, 2014 |
Verdeling van medicatie disutility |
|
Drewes, 2014 |
PROSPER-trial analysis, gestratificeerd bij homocysteine niveaus |
|
Stender, 2013 |
Geen vergelijkende groep |
|
Stender, 2013 |
Vergelijking tussen twee statines in verschillende doseringen; geen placebo gegeven |
|
Rizzo, 2013 |
Narratieve review |
|
Lloyd, 2013 |
Studie (PROSPER) reeds geïncludeerd |
|
Bhardwaj, 2013 |
Narratieve review |
|
Sicras-Mainar, 2012 |
Cohortstudie |
|
Schiattarellla, 2012 |
Narratieve review |
|
Chokshi, 2012 |
Voorspellers voor het gebruik van een statine |
|
Shao, 2011 |
Narratieve review |
|
Szadkowska, 2010 |
Narratieve review |
|
Gransbo, 2010 |
Cohortstudie |
|
Fricker, 2009 |
Editorial |
|
Shepherd, 2004 |
Editorial; beschrijving van een andere studie |
|
Yaffe, 2002 |
Cohortstudie |
|
Jackevicius, 2002 |
Cohortstudie |
|
Houx, 2002 |
Baseline gegevens van reeds geïncludeerde studie (PROSPER) |
|
Benner, 2002 |
Cohort studie |
|
Ito, 2001 |
Vergelijking tussen verschillende doseringen |
|
Chikamori, 2000 |
Observationele studie |
|
Campeau, 1999 |
Geen relevante uitkomsten gerapporteerd |
|
Miettinen, 1997 |
Patiënten waren maximaal 70 jaar oud |
|
Lansberg, 1995 |
Geen vergelijking |
|
Santinga, 1994 |
Geen relevante uitkomsten gerapporteerd |
|
LaRosa, 1994 |
Geen relevante uitkomsten gerapporteerd |
Exclusietabel – PICO2
Tabel Exclusie na het lezen van het volledige artikel
Tabel update 2021
|
Referentie |
Reden |
|
Oyama K, Giugliano RP, Tang M, Bonaca MP, Saver JL, Murphy SA, et al. Effect of evolocumab on acute arterial events across all vascular territories : results from the FOURIER trial. European heart journal. 2021;42(47):4821-9. |
FOURIER-trial. Onderzoek naar intensieve behandeling versus minder intensieve behandeling |
|
Jin S, Nie X, Li Y, Yuan J, Cui Y, Zhao L. Effect of More Intensive LDL-C-Lowering Therapy on Long-term Cardiovascular Outcomes in Early-Phase Acute Coronary Syndrome: A Systematic Review and Meta-analysis. Clinical therapeutics. 2021;43(7):e217-e29. |
SR, geen van de geïncludeerde trials komt in aanmerking. |
|
Elgendy IY, Elshazly MB. LDL-C-lowering therapies reduce major vascular events in patients aged >=75 y. Annals of internal medicine. 2021;174(4):JC38. |
Commentaar op een trial |
|
Deedwania P, Murphy SA, Scheen A, Badariene J, Pineda A, Lira o, et al. Efficacy and Safety of PCSK9 Inhibition With Evolocumab in Reducing Cardiovascular Events in Patients With Metabolic Syndrome Receiving Statin Therapy: Secondary Analysis From the FOURIER Randomized Clinical Trial. JAMA cardiology. 2021;6(2):139-47. |
FOURIER-trial: analyse bij patiënten met het metabool syndroom |
|
Amarenco P, Kim JS, Labreuche J, Charles H, Giroud M, Lee B-C, et al. Impact of Lower Versus Higher LDL Cholesterol Targets on Cardiovascular Events After Ischemic Stroke in Patients With Diabetes. Diabetes. 2021;70(8):1807-15. |
TST-trial: Analyse naar subgroep diabetes. Echter, alle deelnemers hebben een beroerte gehad. |
|
Wiviott SD, Giugliano RP, Morrow DA, De Ferrari GM, Lewis BS, Huber K, et al. Effect of Evolocumab on Type and Size of Subsequent Myocardial Infarction: A Prespecified Analysis of the FOURIER Randomized Clinical Trial. JAMA cardiology. 2020;5(7):787-93. |
FOURIER-trial: analyse naar de uitkomst MI subtype |
|
Wang N, Fulcher J, Abeysuriya N, Park L, Kumar S, Di Tanna GL, et al. Intensive LDL cholesterol-lowering treatment beyond current recommendations for the prevention of major vascular events: a systematic review and meta-analysis of randomised trials including 327 037 participants. The Lancet Diabetes and Endocrinology. 2020;8(1):36-49. |
SR naar de daling in LDL |
|
Robinson JG, Jayanna MB, Bairey Merz CN, Stone NJ. Clinical implications of the log linear association between LDL-C lowering and cardiovascular risk reduction: Greatest benefits when LDL-C >100 mg/dl. PloS one. 2020;15(10):e0240166. |
Meta-analyse: daling in LDL |
|
Ödesjö H, Björck S, Franzén S, Hjerpe P, Manhem K, Rosengren A, et al. Adherence to lipid-lowering guidelines for secondary prevention and potential reduction in CVD events in Swedish primary care: A cross-sectional study. BMJ Open. 2020;10(10). |
Onderzoek naar adherentie en geen follow-up |
|
Gencer B, Mach F, Murphy SA, De Ferrari GM, Huber K, Lewis BS, et al. Efficacy of Evolocumab on Cardiovascular Outcomes in Patients With Recent Myocardial Infarction: A Prespecified Secondary Analysis From the FOURIER Trial. JAMA cardiology. 2020;5(8):952-7. |
FOURIER-trial: subgroepanalyse bij patiënten met MI |
|
Alkhalil M. Effects of intensive lipid-lowering therapy on mortality after coronary bypass surgery: A meta-analysis of 7 randomised trials. Atherosclerosis. 2020;293:75-8. |
SR bij patiënten die een CABG ondergingen |
|
Vallejo-Vaz AJ, Ray KK, Ginsberg HN, Davidson MH, Eckel RH, Lee LV, et al. Associations between lower levels of low-density lipoprotein cholesterol and cardiovascular events in very high-risk patients: Pooled analysis of nine ODYSSEY trials of alirocumab versus control. Atherosclerosis. 2019;288:85-93. |
Meta-analyse van ODYSSEY-trials en subgroepen comorbiditeiten (niet alleen vergelijking intensief versus minder-intensief of uitkomsten gerelateerd aan LDL-daling) |
|
Steg PG, Szarek M, Bhatt DL, Bittner VA, Bregeault M-F, Dalby AJ, et al. Effect of Alirocumab on Mortality After Acute Coronary Syndromes. Circulation. 2019;140(2):103-12. |
Duplicaat van publication ODESSEY-OUTCOMES-trial |
|
Rosenson RS, Hegele RA, Koenig W. Cholesterol-Lowering Agents. Circulation research. 2019;124(3):364-85. |
Narratieve review |
|
Ray KK, Colhoun HM, Szarek M, Baccara-Dinet M, Bhatt DL, Bittner VA, et al. Effects of alirocumab on cardiovascular and metabolic outcomes after acute coronary syndrome in patients with or without diabetes: a prespecified analysis of the ODYSSEY OUTCOMES randomised controlled trial. The lancet Diabetes & endocrinology. 2019;7(8):618-28. |
Subgroepanalyse: diabetes (alle patiënten hadden HVZ) |
|
Murphy SA, Pedersen TR, Gaciong ZA, Ceska R, Ezhov MV, Connolly DL, et al. Effect of the PCSK9 Inhibitor Evolocumab on Total Cardiovascular Events in Patients With Cardiovascular Disease: A Prespecified Analysis From the FOURIER Trial. JAMA cardiology. 2019;4(7):613-9. |
Analyse FOURIER-trial van totaal aantal events |
|
Lee J, Holbrook A. Pooled RCTs: Lowering LDL-C levels using statins reduces major vascular events in all age groups. Annals of internal medicine. 2019;170(12):JC65. |
Commentaar op een meta-analyse |
|
Jukema JW, Zijlstra LE, Bhatt DL, Bittner VA, Diaz R, Drexel H, et al. Effect of Alirocumab on Stroke in ODYSSEY OUTCOMES. Circulation. 2019;140(25):2054-62. |
Analyse ODESSEY OUTCOMES-trial naar effect op verschillende vormen van beroerte. |
|
Dicembrini I, Giannini S, Ragghianti B, Mannucci E, Monami M. Effects of PCSK9 inhibitors on LDL cholesterol, cardiovascular morbidity and all-cause mortality: a systematic review and meta-analysis of randomized controlled trials. Journal of Endocrinological Investigation. 2019;42(9):1029-39. |
SR: gezocht tot dec 2017 (recentere reviews beschikbaar) |
|
Soran H, Adam S, Durrington PN. Optimising treatment of hyperlipidaemia: Quantitative evaluation of UK, USA and European guidelines taking account of both LDL cholesterol levels and cardiovascular disease risk. Atherosclerosis. 2018;278:135-42. |
Onderzoek naar behandeling conform richtlijnen en het effect op LDL |
|
Schwartz GG, Steg PG, Szarek M, Bhatt DL, Bittner VA, Diaz R, Edelberg JM, Goodman SG, Hanotin C, Harrington RA, Jukema JW, Lecorps G, Mahaffey KW, Moryusef A, Pordy R, Quintero K, Roe MT, Sasiela WJ, Tamby JF, Tricoci P, White HD, Zeiher AM; ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med. 2018 Nov 29;379(22):2097-2107. doi: 10.1056/NEJMoa1801174. Epub 2018 Nov 7. PMID: 30403574. |
Onderzoek naar intensieve behandeling versus minder intensieve behandeling |
|
Sabatine MS, Wiviott SD, Im K, Murphy SA, Giugliano RP. Efficacy and safety of further lowering of low-density lipoprotein cholesterol in patients starting with very low levels: A meta-analysis. JAMA Cardiology. 2018;3(9):823-8. |
Onderzoek naar baseline LDL 1,8 en effect van verlaging |
|
Navarese EP, Robinson JG, Kowalewski M, Kolodziejczak M, Andreotti F, Bliden K, et al. Association Between Baseline LDL-C Level and Total and Cardiovascular Mortality After LDL-C Lowering: A Systematic Review and Meta-analysis. JAMA. 2018;319(15):1566-79. |
Meta-analyse: daling in LDL |
|
Koskinas KC, Siontis GCM, Piccolo R, Mavridis D, Räber L, Mach F, et al. Effect of statins and non-statin LDL-lowering medications on cardiovascular outcomes in secondary prevention: A meta-analysis of randomized trials. European Heart Journal. 2018;39(14):1172-80. |
SR: Trials hebben we reeds geïncludeerd in de module |
|
Kaasenbrood L, Ray KK, Boekholdt SM, Smulders YM, LaRosa JC, Kastelein JJP, et al. Estimated individual lifetime benefit from PCSK9 inhibition in statin-treated patients with coronary artery disease. Heart (British Cardiac Society). 2018;104(20):1699-705. |
Onderzoek naar het geschatte effect van PCSK9 |
|
Hong N, Lee YH, Tsujita K, Gonzalez JA, Kramer CM, Kovarnik T, et al. Comparison of the effects of ezetimibe-statin combination therapy on major adverse cardiovascular events in patients with and without diabetes: A meta-analysis. Endocrinology and Metabolism. 2018;33(2):219-27. |
SR: Effect bij diabetes. Geen van de geïncludeerde trials voldoet aan de huidige selectiecriteria (geen vergelijking tussen intensief versus minder intensief, patiënten met HVZ en diabetes of geen primaire uitkomstmaat HVZ). |
|
Soran H, Kwok S, Adam S, Ho JH, Durrington PN. Evidence for more intensive cholesterol lowering. Current Opinion in Lipidology. 2017;28(4):291-9. |
Recentere reviews beschikbaar |
|
He X, Liu T, Pan Y, Li X. Efficacy of LDL-C lowering therapy in patients with non-ST-segment elevation acute coronary syndrome: A meta-analysis. Chinese Journal of Evidence-Based Medicine. 2017;17(5):550-6. |
Effect van therapie bij NSTE-ACS |
|
Giugliano RP, Wiviott SD, Blazing MA, De Ferrari GM, Park J-G, Murphy SA, et al. Long-term Safety and Efficacy of Achieving Very Low Levels of Low-Density Lipoprotein Cholesterol : A Prespecified Analysis of the IMPROVE-IT Trial. JAMA cardiology. 2017;2(5):547-55. |
Effect van lage LDL-C-waarden na behandeling |
|
Giugliano RP, Keech A, Murphy SA, Huber K, Tokgozoglu SL, Lewis BS, et al. Clinical Efficacy and Safety of Evolocumab in High-Risk Patients Receiving a Statin: Secondary Analysis of Patients With Low LDL Cholesterol Levels and in Those Already Receiving a Maximal-Potency Statin in a Randomized Clinical Trial. JAMA cardiology. 2017;2(12):1385-91. |
Onderzoek of een lager LDL-niveau zinvol is. |
|
Ference BA, Ginsberg HN, Graham I, Ray KK, Packard CJ, Bruckert E, et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement fromthe European Atherosclerosis Society Consensus Panel. European Heart Journal. 2017;38(32):2459-72. |
Causaliteit van LDL op ACS |
|
Davies GM, Vyas A, Baxter CA. Economic evaluation of ezetimibe treatment in combination with statin therapy in the United States. Journal of Medical Economics. 2017;20(7):723-31. |
Kosteneffectiviteit van ezetimib en statine in Amerika |
|
Anonymous. Ezetimibe + statin: insufficient benefit. Prescrire international. 2016;25(175):245-6. |
Commentaar op een trial |
|
Fulcher J, O'Connell R, Voysey M, Emberson J, Blackwell L, Mihaylova B, et al. Efficacy and safety of LDL-lowering therapy among men and women: Meta-analysis of individual data from 174 000 participants in 27 randomised trials. The Lancet. 2015;385(9976):1397-405. |
Onderzoek naar man-vrouwverschil |
|
Cannon CP, Blazing MA, Giugliano RP, McCagg A, White JA, Theroux P, et al. Ezetimibe added to statin therapy after acute coronary syndromes. New England Journal of Medicine. 2015;372(25):2387-97. |
Reeds geïncludeerd in de eerdere literatuuranalyse |
|
Yan YL, Qiu B, Hu LJ, Jing XD, Liu YJ, Deng SB, et al. Efficacy and safety evaluation of intensive statin therapy in older patients with coronary heart disease: A systematic review and meta-analysis. European Journal of Clinical Pharmacology. 2013;69(12):2001-9. |
SR: recentere reviews beschikbaar |
|
Baigent C, Blackwell L, Emberson J, Holl, LE, Reith C, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: A meta-analysis of data from 170 000 participants in 26 randomised trials. The Lancet. 2010;376(9753):1670-81. |
SR: recentere reviews beschikbaar |
Verantwoording
Beoordelingsdatum en geldigheid
Laatst beoordeeld : 01-09-2024
Algemene gegevens
De ontwikkeling/herziening van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het herzien van de richtlijnmodule is in 2021 een multidisciplinaire cluster ingesteld, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van het cluster) die betrokken zijn bij de zorg voor patiënten met (een hoog risico op) hart-en vaatziekten.
Per geprioriteerde module wordt door het cluster bekeken welke expertise gewenst is bij de uitwerking en wordt gezamenlijk een verdeling gemaakt in mate van betrokkenheid van clusterleden. Alle clusterexpertiseleden die direct betrokken waren bij de modules, staan hieronder per module vermeld.
Stuurgroep
- Prof. dr. A.W. (Arno) Hoes (voorzitter), klinisch epidemioloog, werkzaam in het UMC Utrecht te Utrecht
- Prof. dr. Y.M. (Yvo) Smulders (vicevoorzitter), internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. N.J.P. (Klaas) Borst, internist ouderengeneeskunde, werkzaam in het Isala ziekenhuis te Zwolle, NIV
- Dr. F.A.L. (Frans) van der Horst, klinisch chemicus, werkzaam in het Reinier Medisch Diagnostisch Centrum te Delft, NVKC
- Dr. A.H. (AnHo) Liem, cardioloog niet praktiserend, NVVC
- Prof. dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Amsterdam UMC te Amsterdam, NVVC
- Prof. F. (Francesco) Mattace-Raso, klinisch geriater, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVKG
- Prof. E.P. (Eric) Moll van Charante, huisarts niet praktiserend, huisarts-onderzoeker, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NHG
- L.A.C. (Sanne) Ruigrok MSc, beleidsadviseur, werkzaam bij Harteraad te Den Haag, Harteraad
- Prof. dr. B.K. (Birgitta) Velthuis, radioloog, werkzaam in het UMC Utrecht te Utrecht, NVvR
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, werkzaam bij het Nederlands Huisartsen Genootschap te Utrecht, NHG
Betrokken expertisegroepleden bij cyclus 1
- Prof. Dr. B.J.H. (Bert-Jan) van den Born, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NIV
- Dr. J. (Jaap) Deinum, internist-vasculair geneeskundige, Radboud UMC, Nijmegen, NIV
- Dr. M.L. (Louis) Handoko, cardioloog, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NVVC
- Dr. O.W.H. (Olivier) van der Heijden, gynaecoloog-perinatoloog, werkzaam in het Radboud UMC te Nijmegen, NVOG
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- Drs. M. (Marco) Krukerink, huisarts, werkzaam in Huisartsenpraktijk Krukerink & De Wolde te Borne, NHG
- Dr. R.N. (Nils) Planken, radioloog, werkzaam in het Amsterdam UMC, locatie AMC te Amsterdam, NVvR
- Dr. C. (Calin) Popa, reumatoloog, werkzaam in de Sint Maartenskliniek te Nijmegen, NVR
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculair geneeskundige, werkzaam in het Erasmus MC te Rotterdam, NIV
- Dr. P. (Pernette) de Sauvage Nolting, cardioloog, werkzaam in Hartkliniek Rotterdam te Rotterdam, NVVC
- Drs. P. (Paul) Smits, kaderhuisarts hart- en vaatziekten, werkzaam bij De HOEDT-huisartsen te Zoetermeer, NHG
- Dr. M. (Melanie) Tan, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. S.E. (Sarah) Vermeer, neuroloog, werkzaam in het Rijnstate Ziekenhuis te Arnhem, NVN
- Prof. dr. R. (Rozemarijn) Vliegenthart, radioloog, werkzaam in het Universitair Medisch Centrum Groningen te Groningen, NVvR
- Dr. A.J. (Bart) Voogel, cardioloog, werkzaam in het Spaarne Gasthuis te Hoofddorp, NVVC
- Dr. M.E. (Janneke) Wittekoek, cardioloog, werkzaam bij Stichting Heartlife klinieken te Utrecht, NVVC
Betrokken clusterexpertiseleden
Module ‘Streefwaarden LDL-C bij behandeling met lipidenverlagende medicatie’ & Module Dyslipidemie bij (kwetsbare) ouderen
- Drs. M. (Marco) Krukerink, huisarts, werkzaam in Huisartsenpraktijk Krukerink & De Wolde te Borne, NHG
- Prof. F. (Francesco) Mattace-Raso, klinisch geriater, werkzaam in het Erasmus Medisch Centrum te Rotterdam, NVKG
- Dr. J.E. (Jeanine) Roeters van Lennep, internist-vasculair geneeskundige, werkzaam in het Erasmus MC te Rotterdam, NIV
- Dr. P. (Pernette) de Sauvage Nolting, cardioloog, werkzaam in Hartkliniek Rotterdam te Rotterdam, NVVC
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Dr. M.E. (Janneke) Wittekoek, cardioloog, werkzaam bij Stichting Heartlife klinieken te Utrecht, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
Met ondersteuning van:
- Dr. W.M. Lijfering, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf september 2023)
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (tot augustus 2023).
- Dr. N.L. van der Zwaluw, senior adviseur, Kennisinstituut van de Federatie Medisch Specialisten (vanaf april 2023)
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle clusterleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van de clusterleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Hoes (voorzitter) |
Vice-voorzitter raad van bestuur / decaan, UMC Utrecht |
|
- |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Visseren |
|
Voorzitter van de Task Force of the European Society of Cardiology for the 2021 European guidelines on cardiovascular disease prevention in clinical practice. |
Mede-initiatiefnemer van de U-Prevent website voor gebruik van risico algoritmes in de klinische praktijk. De website is eigendom van ORTEC. Betrokkenheid bestaat uit wetenschappelijk advies. |
Geen |
|
Borst |
Internist ouderengeneeskunde en vasculaire geneeskunde |
Lid Forum visitatorum (vacatievergoeding) |
- |
Geen |
|
Mattace-Raso |
|
2019-today: Aging Clinical and Experimental Research 2015-today: Clinical Interventions in Aging |
- |
Geen |
|
Liem |
Gepensioneerd cadioloog (eerder verbonden aan Franciscus gasthuis Rotterdam tot 31-12-2019)
|
- eerder lid richtlijnencommissie CVRM - eerder lid richtlijncommissie vetstofwisselingsstoornissen - lid Raad van Toezicht WCN (onbetaald) |
2018-2021: vergoeding op uurbasis voor presentaties en adviesraden op het gebied van CVRM Lipiden, antithrombotica, anti-diabetica) en Hartfalen. Deelname aan vele trials vanuit WCN. |
Geen, adviesraden zijn gestaakt gedurende het proces |
|
Martens |
Cardioloog Hoogleraar Preventieve Cardiologie |
Namens de NVVC voorzitter Werkgroep Geneesmiddelen Namens de DCVA voorzitter Commissie Preventie
|
Vergoeding voor presentaties op het gebied van CVRM (lipiden, antitrombotica en anti- diabetica), via bemiddeling bureau’s zoals Medcon, Sam Health, Health Investments, Springer Healthcare, Breau Prevents etc. |
Geen, adviesraden zijn gestaakt sinds lidmaatschap Stuurgroep CVRM |
|
Wiersma |
senior wetenschappelijk medewerker NHG |
- |
- |
Geen |
|
Moll van Charante |
Hoogleraar afdeling Huisartsgeneeskunde (0,5 fte) en afdeling Public & Occupational Health (0,5 fte) Amsterdam UMC. |
van VWS en het Deltaplan Dementie (ontwikkeld i.s.m Movisie, Nivel, Pharos, Trimbos-instituut en Vilans)
|
Betrokken bij de ontwikkeling van een app voor zelfmanagement van risicofactoren voor hartvaatziekten en dementie. Het aandeel van resp. Vital Health Software en Philips Vital Health in deze studie is gefinancierd vanuit een Europese grant. |
Geen |
|
Velthuis |
Radioloog |
|
Vergoedingen als spreker voor Nederlandse Vereniging voor Radiologie (NVvR). Philips research geld voor PhD onderzoeker vanaf 2023 |
Geen |
|
Van der Horst |
Laboratorium specialist klinische chemie en laboratoriumgeneeskunde
|
|
- |
Geen |
|
Ruigrok |
Beleidsadviseur |
Geen |
Geen |
Geen |
Expertisegroep
Module
|
Clusterlid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen restrictie |
|
Born, van den |
Internist-vasculair geneeskundige, |
|
|
Geen onderzoek betreft onderwerpen die niet in de herziene modules ter sprake komen.
|
|
De Sauvage Nolting |
Cardioloog |
- |
- |
Geen |
|
Deinum |
Internist Radboud UMC Nijmegen |
- |
- |
Geen |
|
Handoko |
Cardioloog |
Medical Lectures Handoko: |
Via Medical Lectures Handoko ontving/ontvang ik sprekersvergoeding / vergoeding voor advieswerk van Novartis, Boehringer Ingelheim, Daiichi Sankyo, Vifor Pharma, AstraZeneca, Bayer, MSD, Quin. |
Geen |
|
Heijden, van der |
Gynaecoloog-perinatoloog |
|
- |
Geen |
|
Konings |
|
Aspirant Directie-lid regionale zorggroep ZIO, betaald |
Schrijver van ECG-leerboek: ECG's beoordelen en begrijpen - De ECG 10+ methode – (royalties) |
Geen |
|
Krukerink |
Huisarts |
Podcastmaker, Huisartspodcast.nl gedeeltelijk betaald door vakblad H&W |
- |
Geen |
|
Planken |
Radioloog Amersterdam UMC, aandachtsgebied cardiovasculaire radiologie |
|
- Consultancy services: Bayer, Hemolens - Speakers fee: Bayer, Kalcio Healthcare |
Geen |
|
Popa |
Reumatoloog |
|
- |
Geen |
|
Roeters van Lennep |
Internist-vasculair geneeskundige |
|
Lokale PI bij verschillende internationale onderzoeken op het gebied van lipidenverlagende medicatie dat gefinancierd wordt door farmaceut. |
Geen |
|
Smits |
Huisarts |
|
- |
Geen |
|
Tan |
Internist-vasculair geneeskundige |
|
- |
Geen |
|
Tjin-A-Ton |
Huisarts - Huisartsenpraktijk Frakking & Tjin-A-Ton (40 uur) |
|
- |
Geen |
|
Vermeer |
Neuroloog Rijnstate |
- |
- |
Geen |
|
Vliegenthart |
Radioloog |
|
|
Geen |
|
Voogel |
Cardioloog Spaarne Gasthuis |
|
- |
Geen |
|
Wittekoek |
|
|
- |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afvaardiging van Harteraad in de clusterstuurgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptmodule is tevens voor commentaar voorgelegd aan Harteraad en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij de richtlijnmodule is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd om te beoordelen of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling is de richtlijnmodule op verschillende domeinen getoetst (zie het stroomschema op de Richtlijnendatabase).
Module |
Uitkomst raming |
Toelichting |
|
Module LDL-C bij ouderen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbeveling(en) breed toepasbaar zijn (>40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Need-for-update, prioritering en uitgangsvragen
Tijdens de need-for-update fase inventariseerde het cluster de geldigheid van de modules binnen het cluster. Naast de betrokken wetenschappelijke verenigingen en patiëntenorganisaties zijn hier ook andere stakeholders voor benaderd in juni 2021.
Per module is aangegeven of deze geldig is, kan worden samengevoegd met een andere module, obsoleet is en kan vervallen of niet meer geldig is en moet worden herzien. Ook was er de mogelijkheid om nieuwe onderwerpen voor modules aan te dragen die aansluiten bij één (of meerdere) richtlijn(en) behorend tot het cluster. De modules die door één of meerdere partijen werden aangekaart als ‘niet geldig’ zijn meegegaan in de prioriteringsfase. Deze module is geprioriteerd door het cluster.
Voor de geprioriteerde modules zijn door de het cluster concept-uitgangsvragen herzien of opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde het cluster welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. Het cluster waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde het cluster tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. Indien mogelijk werd de data uit verschillende studies gepoold in een random-effects model. R studio (versie 2023.06.0+421) werd gebruikt voor de statistische analyses. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie www.gradeworkinggroup.org. De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE methodiek.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door het cluster wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. Het cluster heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
Bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met het cluster. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door het cluster. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt)organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbook.html.
Zoekverantwoording
Zoekverantwoording – PICO1
|
Database |
Zoektermen |
Totaal |
|
Medline (OVID) 1946 – maart 2016
|
Dyslipidemias/ or Hydroxymethylglutaryl-CoA Reductase Inhibitors/ or exp Simvastatin/ or exp Pravastatin/ or exp Rosuvastatin Calcium/ or exp Lovastatin/ or exp Atorvastatin Calcium/ or statin*.ti OR simvastatin*.ab,ti OR pravastatin*.ab,ti OR rosuvastatin*.ab,ti OR lovastatin*.ab,ti OR fluvastatin*.ab,ti OR cerivastatin*.ab,ti OR pitavastatin*.ab,ti OR atorvastatin*.ab,ti AND exp *Aged/ or aged.ti. or exp *Frail Elderly/ or *"Aged, 80 and over"/ or exp *Aging/ or exp *Geriatric Assessment/ or (elderly or geriatric or 'community dwelling' or frail* or ag?ing or septuagenarian or octogenarian or nonagenarian or centenarian or 'old people' or eldest or oldest).ti limit to (dutch or english or german) Gebruikte filters: Systematische reviews: (meta-analysis/ or meta-analysis as topic/ or (meta adj analy$).tw. or ((systematic* or literature) adj2 review$1).tw. or (systematic adj overview$1).tw. or exp "Review Literature as Topic"/ or cochrane.ab. or cochrane.jw. or embase.ab. or medline.ab. or (psychlit or psyclit).ab. or (cinahl or cinhal).ab. or cancerlit.ab. or ((selection criteria or data extraction).ab. and "review"/)) not (Comment/ or Editorial/ or Letter/ or (animals/ not humans/)) RCTs: (exp clinical trial/ or randomized controlled trial/ or exp clinical trials as topic/ or randomized controlled trials as topic/ or Random Allocation/ or Double-Blind Method/ or Single-Blind Method/ or (clinical trial, phase i or clinical trial, phase ii or clinical trial, phase iii or clinical trial, phase iv or controlled clinical trial or randomized controlled trial or multicenter study or clinical trial).pt. or random*.ti,ab. or (clinic* adj trial*).tw. or ((singl* or doubl* or treb* or tripl*) adj (blind$3 or mask$3)).tw. or Placebos/ or placebo*.tw.) not (animals/ not humans/) Observationeel: Epidemiologic studies/ or case control studies/ or exp cohort studies/ or Controlled Before-After Studies/ or Case control.tw. or (cohort adj (study or studies)).tw. or Cohort analy$.tw. or (Follow up adj (study or studies)).tw. or (observational adj (study or studies)).tw. or Longitudinal.tw. or Retrospective*.tw. or prospective*.tw. or consecutive*.tw. or Cross sectional.tw. or Cross-sectional studies/ or historically controlled study/ or interrupted time series analysis/ (Onder exp cohort studies vallen ook longitudinale, prospectieve en retrospectieve studies)
= 412 |
618 |
|
Embase (Elsevier) |
'statin (protein)'/exp/mj OR statin*:ti OR simvastatin*:ab,ti OR pravastatin*:ab,ti OR rosuvastatin*:ab,ti OR lovastatin*:ab,ti OR fluvastatin*:ab,ti OR cerivastatin*:ab,ti OR pitavastatin*:ab,ti OR atorvastatin*:ab,ti OR 'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj AND ((dutch)/lim OR (english)/lim OR (german)/lim) AND (embase)/lim AND ('clinical trial'/exp OR 'randomization'/exp OR 'single blind procedure'/exp OR 'double blind procedure'/exp OR 'crossover procedure'/exp OR 'placebo'/exp OR 'prospective study'/exp OR rct:ab,ti OR random*:ab,ti OR 'single blind':ab,ti OR 'randomised controlled trial':ab,ti OR 'randomized controlled trial'/exp OR placebo*:ab,ti) NOT 'conference abstract':it AND ('aged'/exp/mj OR 'geriatric assessment'/exp/mj OR aged:ti OR elderly:ti OR geriatric:ti OR 'community dwelling':ti OR frail*:ti OR ageing:ti OR aging:ti OR septuagenarian:ti OR octogenarian:ti OR nonagenarian:ti OR centenarian:ti OR 'old people':ti OR eldest:ti OR oldest:ti) OR 'statin (protein)'/exp/mj OR statin*:ti OR simvastatin*:ab,ti OR pravastatin*:ab,ti OR rosuvastatin*:ab,ti OR lovastatin*:ab,ti OR fluvastatin*:ab,ti OR cerivastatin*:ab,ti OR pitavastatin*:ab,ti OR atorvastatin*:ab,ti OR 'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj AND ((dutch)/lim OR (english)/lim OR (german)/lim) AND (embase)/lim AND ('aged'/exp OR 'geriatric assessment'/exp OR aged:ti OR elderly:ab,ti OR geriatric:ab,ti OR 'community dwelling':ab,ti OR frail*:ab,ti OR ageing:ab,ti OR aging:ab,ti OR septuagenarian:ab,ti OR octogenarian:ab,ti OR nonagenarian:ab,ti OR centenarian:ab,ti OR 'old people':ab,ti OR eldest:ab,ti OR oldest:ab,ti) AND ((systematic NEAR/2 review*):ti OR 'meta analysis':ti OR cochrane:ta) OR 'statin (protein)'/exp/mj OR statin*:ti OR simvastatin*:ab,ti OR pravastatin*:ab,ti OR rosuvastatin*:ab,ti OR lovastatin*:ab,ti OR fluvastatin*:ab,ti OR cerivastatin*:ab,ti OR pitavastatin*:ab,ti OR atorvastatin*:ab,ti OR 'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj AND ((dutch)/lim OR (english)/lim OR (german)/lim) AND (embase)/lim AND ('clinical study'/de OR 'case control study'/de OR 'family study'/de OR 'longitudinal study'/de OR 'retrospective study'/de OR ('prospective study'/de NOT 'randomized controlled trial'/de) OR 'cohort analysis'/de OR (cohort NEAR/1 (study OR studies)):ab,ti OR (case:ab,ti AND (control NEAR/1 (study OR studies)):ab,ti) OR (follow:ab,ti AND (up NEAR/1 (study OR studies)):ab,ti) OR (observational NEAR/1 (study OR studies)):ab,ti OR (epidemiologic NEAR/1 (study OR studies)):ab,ti OR ('cross sectional' NEAR/1 (study OR studies)):ab,ti) AND ('aged'/exp/mj OR 'geriatric assessment'/exp/mj OR aged:ti OR elderly:ti OR geriatric:ti OR 'community dwelling':ti OR frail*:ti OR ageing:ti OR aging:ti OR septuagenarian:ti OR octogenarian:ti OR nonagenarian:ti OR centenarian:ti OR 'old people':ti OR eldest:ti OR oldest:ti)
= 403 |
Zoekverantwoording - PICO2
|
Uitgangsvraag: Welke streefwaarde van LDL dient te worden gehanteerd bij de behandeling van patiënten met een verschillende mate van verhoogd risico op het hart- en vaatziekten? |
|
|
Database(s): Medline, Embase |
Datum: 26-06-2017, 16-12-2021 |
|
Periode: 2005-juni 2017, 2017- |
Talen: E N , nvt. 16-12-2021 |
|
Toelichting:
16-12-2021 Er is een update uitgevoerd van de strategie van 2017. Daarbij is ervoor gekozen om de totale strategie specifieker op te zetten. Er is geen beperking toegepast op taal en tijd en er is gezocht vanaf 1-1-2017. |
|
Embase
16-12-2021
|
No. |
Query |
Results |
|
#16 |
#14 NOT #13 |
686 |
|
#15 |
#9 AND #14 |
1 |
|
#14 |
#11 AND #12 |
900 |
|
#13 |
#10 AND #12 |
362 |
|
#12 |
#4 AND [1-1-2017]/sd NOT ('conference abstract'/it OR 'editorial'/it OR 'letter'/it OR 'note'/it) NOT (('animal'/exp OR 'animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp) NOT 'human'/exp) |
3465 |
|
#11 |
'randomized controlled trial'/exp OR random*:ti,ab OR (((pragmatic OR practical) NEAR/1 'clinical trial*'):ti,ab) OR ((('non inferiority' OR noninferiority OR superiority OR equivalence) NEAR/3 trial*):ti,ab) OR rct:ti,ab,kw |
1852245 |
|
#10 |
'meta analysis'/exp OR 'meta analysis (topic)'/exp OR metaanaly*:ti,ab OR 'meta analy*':ti,ab OR metanaly*:ti,ab OR 'systematic review'/de OR 'cochrane database of systematic reviews'/jt OR prisma:ti,ab OR prospero:ti,ab OR (((systemati* OR scoping OR umbrella OR 'structured literature') NEAR/3 (review* OR overview*)):ti,ab) OR ((systemic* NEAR/1 review*):ti,ab) OR (((systemati* OR literature OR database* OR 'data base*') NEAR/10 search*):ti,ab) OR (((structured OR comprehensive* OR systemic*) NEAR/3 search*):ti,ab) OR (((literature NEAR/3 review*):ti,ab) AND (search*:ti,ab OR database*:ti,ab OR 'data base*':ti,ab)) OR (('data extraction':ti,ab OR 'data source*':ti,ab) AND 'study selection':ti,ab) OR ('search strategy':ti,ab AND 'selection criteria':ti,ab) OR ('data source*':ti,ab AND 'data synthesis':ti,ab) OR medline:ab OR pubmed:ab OR embase:ab OR cochrane:ab OR (((critical OR rapid) NEAR/2 (review* OR overview* OR synthes*)):ti) OR ((((critical* OR rapid*) NEAR/3 (review* OR overview* OR synthes*)):ab) AND (search*:ab OR database*:ab OR 'data base*':ab)) OR metasynthes*:ti,ab OR 'meta synthes*':ti,ab |
733409 |
|
#9 |
a AND comparison AND of AND two AND ldl AND cholesterol AND targets AND after AND ischemic AND stroke AND p. AND amarenco, AND j.s. AND kim, AND labreuche, AND h. AND charles, AND j. AND abtan, AND y. AND béjot, AND l. AND cabrejo |
1 |
|
#8 |
#4 AND #7 |
3 |
|
#7 |
#5 OR #6 |
3 |
|
#6 |
efficacy AND safety AND more AND intensive AND lowering AND ldl AND cholesterol AND a AND 'meta analysis' AND of AND data AND from AND 170 AND 000 AND participants AND 2010 AND baigent |
2 |
|
#5 |
between AND achieved AND 'low density' AND lipoprotein AND levels AND major AND adverse AND cardiac AND events AND in AND patients AND with AND stable AND ischemic AND heart AND disease AND taking AND statin AND treatment |
1 |
|
#4 |
#1 AND #2 AND #3 |
17720 |
|
#3 |
'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti,ab OR statin*:ti,ab OR atorvastatin*:ti,ab OR lovastatin*:ti,ab OR meglutol*:ti,ab OR pravastatin*:ti,ab OR rosuvastatin*:ti,ab OR simvastatin*:ti,ab OR 'lipid modifying':ti OR 'lipid level*':ti,ab OR 'reference value'/exp OR 'reference value*':ti,ab,kw OR target*:ti,ab,kw |
2613098 |
|
#2 |
'cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab |
3228633 |
|
#1 |
'low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR (((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab) |
101123 |
26-6-2021
|
Embase (Elsevier) |
'low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR ((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab
AND ('cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab)
AND (preventi*:ti,ab OR control:ti,ab OR therapy:ti,ab OR 'drug therapy':lnk OR prevention:lnk OR 'hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti,ab OR statin*:ti,ab OR atorvastatin*:ti,ab OR lovastatin*:ti,ab OR meglutol*:ti,ab OR pravastatin*:ti,ab OR rosuvastatin*:ti,ab OR simvastatin*:ti,ab OR target*:ti,ab OR risk:ti OR mortality:ti,ab OR incidence:ti OR relation*:ti OR association:ti OR 'lipid modifying':ti OR 'lipid level*':ti,ab OR reduction:ti,ab OR lowering:ti,ab OR 'reference value'/exp)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [2005-2017]/py NOT 'conference abstract':it
AND ('meta analysis'/de OR cochrane:ab OR embase:ab OR psycinfo:ab OR cinahl:ab OR medline:ab OR (systematic NEAR/1 (review OR overview)):ab,ti OR (meta NEAR/1 analy*):ab,ti OR metaanalys*:ab,ti OR 'data extraction':ab OR cochrane:jt OR 'systematic review'/de) NOT ('animal experiment'/exp OR 'animal model'/exp OR 'nonhuman'/exp NOT 'human'/exp) (622) – 190 uniek
Specifiekere search voor RCTs:
(('low density lipoprotein cholesterol'/exp/mj OR 'very low density lipoprotein cholesterol'/exp/mj OR (((ldl OR 'low-density lipoprotein*') NEAR/3 (c OR cholesterol)):ti,ab))
AND ('cardiovascular disease'/exp/mj OR 'cardiovascular disease*':ti,ab OR cvd:ti,ab OR 'vascular disease*':ti,ab OR 'vascular event*':ti,ab OR 'coronary heart disease':ti,ab OR chd:ti,ab)
AND ('hydroxymethylglutaryl coenzyme a reductase inhibitor'/exp/mj OR 'hmg coa reductase inhibitor*':ti OR statin*:ti OR atorvastatin*:ti OR lovastatin*:ti OR meglutol*:ti OR pravastatin*:ti OR rosuvastatin*:ti OR simvastatin*:ti OR target*:ti) OR 'lipid lowering therapy':ti,ab OR 'intensive lipid lowering':ti,ab)
AND ((random*:ti OR 'randomized controlled trial'/exp) NOT 'conference abstract':it)
AND ([dutch]/lim OR [english]/lim) AND [embase]/lim AND [2009-2017]/py (539) – 197 uniek |