Dyslipidemie bij ouderen bij CVRM
Uitgangsvraag
Wat is de meerwaarde van de behandeling met lipidenverlagende middelen bij (kwetsbare) ouderen (>70 jaar)?
Aanbeveling
Vitale ouderen
Starten van lipidenverlagende medicatie
Overweeg het geven van lipidenverlagende medicatie aan vitale ouderen zonder hart- en vaatziekten alleen bij een hoog geschat risico op een vasculair event, bijvoorbeeld door de aanwezigheid van ernstige risicofactoren (zoals diabetes of een zeer hoog cholesterol (TC >8 mmol/L), een zeer hoge bloeddruk (≥180/110 mmHg), en een voldoende hoog geschat resterende levensverwachting. Streef naar een LDL-c <2,6 mmol/l.
Geef lipidenverlagende medicatie aan vitale ouderen met hart- en vaatziekten en streef naar een LDL-c <2,6 mmol/l. Evalueer de eventuele bijwerkingen nauwgezet. Switch naar een andere statine of verlaag de statinedosering en overweeg ezetimib toe te voegen bij het vermoeden van het ontstaan van bijwerkingen.
Stoppen van lipidenverlagende medicatie
Stop alleen met lipidenverlagende medicatie bij onoverkomelijke bijwerkingen bij vitale ouderen met hart- en vaatziekten.
Kwetsbare ouderen
Starten van lipidenverlagende medicatie
Start niet met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Overweeg het geven van lipidenverlagende medicatie aan kwetsbare ouderen na een (recent) vasculair event en met een voldoende hoog geschat resterende levensverwachting. Evalueer het optreden van bijwerking nauwgezet en waak voor myopathie, behoud van functie en kwaliteit van leven.
Stoppen van lipidenverlagende medicatie
Stop met lipidenverlagende medicatie bij kwetsbare ouderen zonder hart- en vaatziekten.
Overweeg te stoppen met lipidenverlagende medicatie bij kwetsbare ouderen met hart- en vaatziekten, met name bij het optreden van een mogelijke bijwerking of bij een geringe geschatte resterende levensverwachting.
Overwegingen
Veiligheid
Bij het gebruik van een lipidenverlagend medicament door zowel ouderen met als zonder hart- en vaatziekten geldt dat de omvang van het risico op bijwerkingen in de dagelijkse klinisch praktijk niet is in te schatten. Het ontbreken van relevante myopathie in de hiervoor besproken en andere studies met statines is niet te extrapoleren naar de dagelijkse praktijk: in vooral door de farmaceutische industrie gesponsorde studies zijn veelal deelnemers opgenomen die vitaler zijn en minder comorbiditeit en comedicatie hebben dan de oudere patiënten die inmiddels in groten getale met statines behandeld worden. Post-marketing surveillance geeft evenmin een betrouwbare indicatie van de incidentie van myopathie omdat deze vaak mild is en deels oude patiënten treft die al mobiliteitsstoornissen ervaren. Milde myopathie kan daarentegen wel degelijk leiden tot een relevante reductie van mobiliteit die daarmee theoretisch zelfs het nagestreefde preventieve effect teniet kan doen. Lareb meldt dat er regelmatig meldingen van ernstige spierklachten bij zowel ouderen als jongeren worden gedaan. Over de uiterste consequenties van mogelijk mobiliteitsverlies door statinegebruik, vallen en functionele achteruitgang, is niets bekend.
Tenslotte geeft het voorschrijven van een lipidenverlagend medicament aan ouderen met polyfarmacie een verhoogd risico op het ontstaan van interacties. Met name simvastatine en atorvastatine zijn door hun afhankelijkheid van het cytochroom P450 3A4 (CYP3A4) metabolisme gevoelig voor interacties met CYP3A4-remmers zoals een aantal calciumantagonisten, “azolen” en macroliden. Op theoretische gronden lijkt pravastatine een gunstiger interactieprofiel te hebben dan simvastatine en atorvastatine.
Patiëntenperspectief
In de media wordt al jaren aandacht besteed aan het belang van een laag cholesterol. Daarnaast worden cholesterolmetingen gevraagd door levensverzekeraars en ook gratis op (ouderen)beurzen als gezondheidsbevorderend middel aangeboden. Al deze aandacht leidt ertoe dat ook oudere patiënten hun artsen vragen om meting van hun cholesterol en belang hechten aan het bereiken van lage waarden. Media noch verzekeraars schenken aandacht aan de onzekerheden die verbonden zijn aan de behandeling van ouderen met lipidenverlagend medicatie.
Tenslotte blijkt bij statinegebruikers van middelbare leeftijd dat de lange termijn therapietrouw zeer laag is. Het is onbekend of dit samenhangt met bijwerkingen of met andere factoren. Ook is onbekend of dit voor ouderen ook geldt; dit is, buiten ouderen afhankelijk van geïnstitutionaliseerde zorg echter wel waarschijnlijk.
Professioneel perspectief
In de huidige richtlijnen voor cardiovasculair risicomanagement vormt hoge leeftijd een van de belangrijke risicofactoren voor cardiovasculaire ziekten. Het hieruit voorkomend advies om laagdrempelig bij ouderen met en zonder hart- en vaatziekten met lipidenverlagend medicatie toe te passen komt met name voort uit geëxtrapoleerde onderzoeksresultaten. In deze onderzoeken waren ouderen slecht vertegenwoordigd, de geïncludeerde ouderen waren zeer vitaal en kwetsbare ouderen waren vrijwel volledig uitgesloten van deelname. Bovendien zijn de voor ouderen relevante uitkomstmaten (I)ADL-functioneren en kwaliteit van leven in geen van de beschreven onderzoeken meegenomen.
Hoewel het bewijs waarop de richtlijn-aanbevelingen met betrekking tot het behandelen van kwetsbare ouderen met lipidenverlagende medicatie gebaseerd zijn afwezig is, hebben de zorgverzekeraars het voorschrijven van lipidenverlagende medicatie aan iedereen die aan de richtlijn-karakteristieken voldoet tot norm en kwaliteitsindicator verheven. Een klein deel van de eerstelijns praktijkfinanciering kan zelfs afhankelijk zijn van het percentage patiënten dat statines krijgt voorgeschreven. Deze vorm van financiering stimuleert vanwege de hoge prevalentie van cardiovasculaire risicofactoren bij kwetsbare ouderen het voorschrijven van lipidenverlagende medicatie in de doelgroep waar de onderbouwing van de meerwaarde bij kwetsbare ouderen zonder hart- en vaatziekten afwezig is en bij kwetsbare ouderen met hart- en vaatziekten zwak is.
Indien bij ouderen met hart- en vaatziekten de keuze wordt gemaakt om een lipidenverlagend medicament voor te schrijven moet daarbij in overweging worden genomen of de zogenaamde time-to-benefit binnen de levensverwachting van de patiënt valt. In de PROSPER-studie werd gemiddeld na ruim drie jaar statine-gebruik een significant cardiovasculair morbiditeits- en mortaliteitsvoordeel gezien met een NNT van 25. In diverse andere studies met jongere deelnemers werd een kortere time-to-benefit gevonden. Een gemiddelde 85-jarige man had in 2012 volgens het CBS een resterende levensverwachting van 5,6 jaar. De 85-jarige met hart- en vaatziekten waarbij een statine overwogen wordt, voldoet waarschijnlijk niet aan deze levensverwachting; deze zal vooral bepaald worden door de ernst van de comorbiditeit en het actuele niveau van functioneren. Derhalve is individuele inschatting van het absoluut risico op hart- en vaatziekte bij een (kwetsbare) oudere van groot belang, evenals een individuele inschatting van het te verwachten behandeleffect van lipiden-verlaging. Bij risicocommunicatie en shared decision making met de patiënt kan het gebruik van een algoritme waarmee het 5- of 10-jaarsrisico op hart- en vaatziekten bij ouderen kan worden geschat, toegevoegde waarde hebben (Stam-Slob, 2016). Binnen deze doelgroep is het NNH onbekend.
Omdat in geen van de genoemde studies een biochemisch behandeldoel, bijvoorbeeld in de vorm van een streef-LDL, werd gehanteerd, ziet de werkgroep geen meerwaarde in het definiëren of nastreven van zo’n streefwaarde bij kwetsbare ouderen. Dosiswijziging of toevoeging van een lipidenverlagend medicament bij kwetsbare ouderen zal vooral gedreven zijn door de aan- of afwezigheid van bijwerkingen.
Een buiten de zoekcriteria vallend onderzoek toonde dat bij personen >75 jaar het toevoegen van ezetimib aan simvastatine het risico op hart- en vaatziekten met 20% verlaagt (HR 0,80; 95%BI 0,70 tot 0,90). Bij personen <75 jaar was er geen effect (HR 0,97; 95%BI 0,92 tot 1,03) (Canon, 2015).
De veiligheid van het stoppen van lipidenverlagende medicatie is nog niet in de hierboven beschreven doelgroepen onderzocht.
Kosten
De kosten van behandeling met statines zijn door het verlopen van de meeste patenten inmiddels zeer laag: de goedkoopste vorm van simvastatine kost €0,025 per dag, pravastatine kost €0,035 per dag.
Kosteneffectiviteit
Er is geen kosten-effectiviteitsonderzoek met kwetsbare ouderen beschikbaar. Los van dit feit kan ook bij een lage medicijnprijs de kosteneffectiviteit van een behandeling niet aangetoond worden als de effectiviteit niet onomstotelijk is vastgesteld.
Onderbouwing
Achtergrond
De tekst van deze module is intergraal overgenomen uit het in 2017 gepubliceerde addendum (kwetsbare) ouderen bij de multidisciplianire richtlijn CVRM. Het addendum is beschikbaar in de Richtlijnendatabase.
Lipidenverlagende medicijnen zijn zowel bij patiënten met als bij patiënten zonder hart- en vaatziekten zeer effectief gebleken. Het bij een populatie van vooral middelbare leeftijd verkregen bewijs wordt breeduit, tot op richtlijnniveau geëxtrapoleerd naar ouderen. Bij ouderen is het bewijs voor de effectiviteit van lipidenverlagende medicijnen beperkt tot de jongsten en vitaalsten onder hen. Belangrijker dan morbiditeit en mortaliteit zijn voor kwetsbare ouderen de uitkomstmaten als behoud van functioneren, kwaliteit van leven, ziektevrij leven, cognitie en bijwerkingen van medicatie. Als deze uitkomstmaten niet beschikbaar zijn dan is prospectief onderzoek naar deze vragen bij kwetsbare en multimorbide ouderen dringend gewenst.
Conclusies
Ouderen zonder hart- en vaatziekten
Hart- en vaatziekten
|
Zeer laag GRADE |
Het gebruik van statines verlaagt het risico op een cardiovasculair event bij ouderen zonder hart- en vaatziekten vergeleken met een placebo.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Vergeleken met een placebo zorgt het gebruik van statines voor een lager risico op een hartinfarct bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Het gebruik van statines heeft geen effect op het risico op een beroerte vergeleken met placebo bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Kwaliteit van leven & (cognitief) functioneren
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van statine ten opzichte van placebo op kwaliteit van leven en (cognitief) functioneren bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Bijwerkingen
|
Zeer laag GRADE |
Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op myalgie bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
|
Zeer laag GRADE |
Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op het ontstaan van diabetes bij ouderen zonder hart- en vaatziekten. Bronnen (Teng, 2015) |
|
Matig GRADE |
Vergeleken met een placebo geeft het gebruik van statines geen hoger risico op het ontstaan van ernstige bijwerkingen bij ouderen zonder hart- en vaatziekten. Bronnen (Teng, 2015) |
Mortaliteit
|
Matig GRADE |
Vergeleken met een placebo heeft het gebruik van statines geen effect op all-cause mortaliteit bij ouderen zonder hart- en vaatziekten.
Bronnen (Teng, 2015) |
Ouderen met hart- en vaatziekten
Hart- en vaatziekten
|
Hoog GRADE |
Vergeleken met een placebo verlaagt dagelijks 40 mg pravastatine het risico op overlijden als gevolg van coronaire hartziekten, een niet-fatale myocardiaal infarct en fatale of niet-fatale beroerte bij ouderen met hart- en vaatziekten.
Bronnen (Shepherd, 2002) |
Cognitief functioneren
|
Hoog GRADE |
Vergeleken met een placebo heeft dagelijks 40 mg pravastatine geen effect op cognitief functioneren bij ouderen met hart- en vaatziekten.
Bronnen (Trompet, 2010) |
Kwaliteit van leven, bijwerkingen & totale mortaliteit
|
- GRADE |
Vanwege het ontbreken van data is het niet mogelijk een conclusie te trekken over het effect van dagelijks 40mg pravastatine vergeleken met placebo op kwaliteit van leven, bijwerkingen en totale mortaliteit bij ouderen met hart- en vaatziekten.
Bronnen (Shepherd, 2002; Trompet, 2010) |
Samenvatting literatuur
Ouderen zonder hart- en vaatziekten
Beschrijving studies
In de systematische review van Teng (2015) werd de effectiviteit en veiligheid van statines vergeleken met standaardzorg of placebobehandeling. De auteurs van de review beschreven echter niet wat standaardzorg in de geïncludeerde trials betrof. De literatuur werd doorzocht tot augustus 2014, en de vijf gerandomiseerde gecontroleerde trials die ook voldeden aan het leeftijdscriterium (>70 jaar) van deze literatuursamenvatting werden hier geïncludeerd. De onderzochte interventies bestonden uit dagelijks 40 milligram pravastatine (twee studies), 10 milligram atorvastatine (één studie), 80 milligram fluvastatine XL (één studie) en 20 milligram rosuvastatine (één studie). Uitkomsten van de review waren hart- en vaatziekten, bijwerkingen, cognitief functioneren en mortaliteit. Aan de geïncludeerde studies deden 20.147 ouderen zonder hart- en vaatziekten mee, en de gemiddelde follow-up tijd van de studies varieerde tussen de 1 en 4,8 jaar. In een van de geïncludeerde studies namen alleen patiënten met diabetes deel (Colliers, 2014) en één studie (ALLHAT, 2002) was niet geblindeerd.
Resultaten
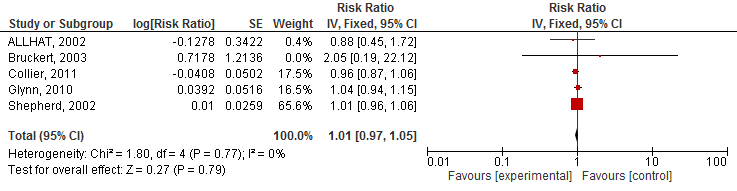
1. Hart- en vaatziekten
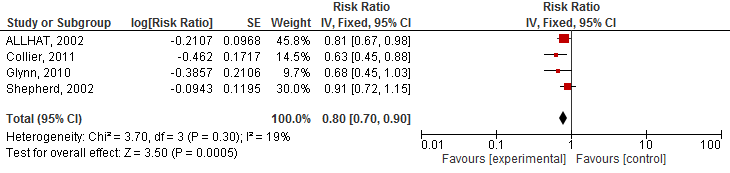
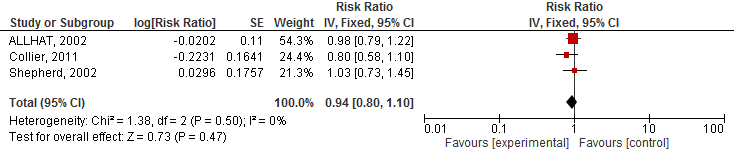
Vier studies geïncludeerd in Teng (2015) rapporteerden het risico op een cardiovasculair event. Het gebruik van statines verlaagde het risico op een cardiovasculair event met 10% (RR 0,90 95%BI 0,85 tot 0,96; figuur 1) en NNT van 133 over gemiddeld 3,5 jaar en specifiek op een hartinfarct (totaal) met 20% (RR 0,80 95%BI: 0,70 tot 0,90; figuur 2) en NNT van 25 over gemiddeld 3,5 jaar. Er werd echter geen risicoreductie van statines op beroertes gevonden (drie studies; RR 0,94 95%BI 0,80 tot 1,10; figuur 3).
Figuur 1 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een cardiovasculair event hebben geëvalueerd

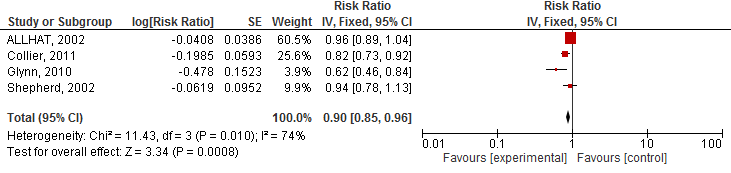
Figuur 2 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een hartinfarct hebben geëvalueerd

Figuur 3 Meta-analyse van studies die bij ouderen het effect van statines op het risico op een beroerte hebben geëvalueerd

1. Kwaliteit van leven
Teng (2015) rapporteerde geen data over kwaliteit van leven.
2. Functioneren, waaronder cognitie
Teng (2015) rapporteerde geen data over functioneren.
3. Bijwerkingen, waaronder spierklachten
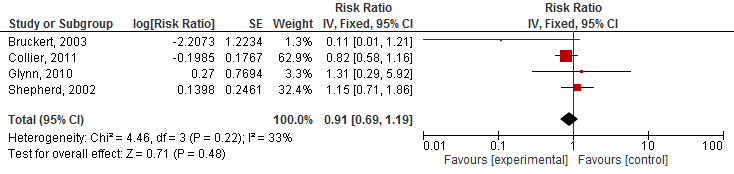
Teng (2015) rapporteerde het risico op myalgie (vier studies), ontstaan van diabetes (twee studies), en ernstige bijwerkingen (vijf studies). De auteurs beschrijven niet welke bijwerkingen vallen onder ernstige bijwerkingen. De gepoolde resultaten op de uitkomsten myalgie en ernstige bijwerkingen zijn weergegeven in figuren 2.23 en 2.24. Het risico op myalgie en op ernstige bijwerkingen was niet significant verhoogd bij gebruik van statines (myalgie RR 0,91 95%BI: 0,69 tot 1,19; ernstige bijwerkingen RR 1,01 95%BI: 0,97 tot 1,05). In twee door Teng (2015) geïncludeerde studies was ook het risico op het ontstaan van diabetes onderzocht; beide studies vonden geen significant effect van statines (RR 0,9 95%BI: 0,64 tot 1,26 en RR 1,25, 95%BI: 0,91 tot 1,73).
Figuur 4 Meta-analyse van studies die bij ouderen het effect van statines op het risico op myalgie hebben geëvalueerd

Figuur 5 Meta-analyse van studies die bij ouderen het effect van statines op het risico op het serious adverse events hebben geëvalueerd

Bewijskracht van de literatuur
Hart- en vaatziekten: De bewijskracht voor de uitkomstmaat cardiovasculair event is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial) en aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat hartinfarct is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial), de inconsistentie en de imprecisie met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat beroerte is, gezien de beperkingen in onderzoeksopzet (Risk of Bias; ontbreken van blindering in de grootste trial) en de imprecisie met drie niveaus verlaagd.
Kwaliteit van leven & (cognitief) functioneren: De bewijskracht voor de uitkomstmaten kwaliteit van leven en (cognitief) functioneren kan niet worden gegradeerd vanwege het ontbreken van data.
Bijwerkingen: De bewijskracht voor de uitkomstmaat myalgie is, gezien beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ontstaan van diabetes is, gezien de beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse), de inconsistentie en de aanwezige imprecisie, met drie niveaus verlaagd.
De bewijskracht voor de uitkomstmaat ernstige bijwerkingen is, gezien de beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) met een niveau verlaagd.
Mortaliteit: De bewijskracht voor de uitkomstmaat all-cause mortaliteit is, gezien beperkingen in de onderzoeksopzet (Risk of Bias; subgroep analyse) met een niveau verlaagd.
Ten aanzien van de generaliseerbaarheid is alleen in de PROSPER-studie (Shepherd, 2002) bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. De overige studies gaven hierover geen gedetailleerde gegevens. Het is zeer aannemelijk dat een selectie van de vitaalste ouderen aan de geïncludeerde studies heeft deelgenomen; er is daarmee sprake van een lage externe validiteit.
Ouderen met hart- en vaatziekten
Beschrijving van studies
Shepherd (2002) en Trompet (2010) beschrijven dezelfde gerandomiseerde gecontroleerde studie. Van alle deelnemers (n=5804) hadden 2565 ouderen (70 tot 82 jaar) een vasculaire aandoening in de anamnese. Deelnemers aan de studie kregen of 40 milligram pravastatine per dag of een placebo, en werden gemiddeld ongeveer 3,5 jaar gevolgd. Uitkomstmaten in deze studie waren cognitief functioneren met behulp van de Mini Mental State Examination bepaald en de uitkomsten gedefinieerd als het totaal van het aantal overlijden door coronaire hartziekten, niet fatale hartinfarcten en fatale en niet-fatale beroerten.
Resultaten
1. Hart- en vaatziekten
Shepherd (2002) rapporteerde dat dagelijks 40 milligram pravastatine het risico op overlijden als het gevolg van coronaire hartziekten, een niet-fatale myocardiaal infarct en fatale of niet-fatale beroerte met 22% verlaagd is (HR 0,78 95%BI: 0,66 tot 0,93 en NNT van 24 over 3,2 jaar).
2. Kwaliteit van leven
Shepherd (2002) en Trompet (2010) rapporteerden geen data over kwaliteit van leven.
3. Functioneren, waaronder cognitie
Er werd in één studie verslag gedaan van het effect van statinegebruik op cognitief functioneren. Trompet (2010) rapporteerde dat de dagelijkse 40 milligram pravastatine geen significant effect had op cognitief functioneren (gemeten werd: “attention, gemiddeld verschil=0,36 95%BI: -0,02 tot 0,74; processing speed, gemiddeld verschil=-0,02 95%BI: -0,08 tot 0,09; immediate recall en gemiddeld verschil=0,002 95%BI: -0,03 tot 0,04; delayed recall gemiddeld verschil=0,04 95%BI: -0,01 tot 0,09“).
4. Bijwerkingen, waaronder spierklachten
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van de bijwerkingen geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over de bijwerkingen van dagelijks 40 milligram pravastatine.
5. Totale mortaliteit
Shepherd (2002) en Trompet (2010) maakten bij de rapportage van mortaliteit geen onderscheid tussen ouderen zonder of met hart- en vaatziekten. Als gevolg hiervan kan er geen conclusie worden getrokken over het effect van dagelijks 40 milligram pravastatine op totale mortaliteit.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaten kwaliteit van leven, bijwerkingen en all-cause mortaliteit kan niet worden gegradeerd vanwege het ontbreken van data.
Hart- en vaatziekten & (cognitief) functioneren: De bewijskracht voor de uitkomstmaten functioneren, met name cognitief functioneren, en hart- en vaatziekten wordt niet verlaagd.
Ten aanzien van de generaliseerbaarheid is in de PROSPER-studie (Shepherd, 2002; Trompet, 2010) bij aanvang bepaald welk niveau van algemeen en cognitief functioneren de deelnemers hadden. Zij bleken in overgrote meerderheid zeer hoog te scoren op de ADL, IADL en cognitieve tests die werden uitgevoerd. Er werd hierbij geen onderscheid gemaakt tussen deelnemers met en zonder cardiovasculaire ziekten in de voorgeschiedenis. De gemiddelde uitkomsten van de (I)ADL tests lagen echter zo dicht bij het maximum dat aannemelijk is dat beide groepen vrijwel volledig bestonden uit volledig zelfstandig functionerende ouderen. Er is daarmee sprake van een lage externe validiteit.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvraag:
Wat is de effectiviteit van lipidenverlagende medicijnen bij ouderen (ouder dan 70 jaar) met of zonder hart- en vaatziekten vergeleken met een placebo of geen behandeling?
P: ouderen (ouder dan 70 jaar) met en zonder hart- en vaatziekten;
I: lipidenverlagende therapie;
C: placebo of geen behandeling;
O: hart- en vaatziekte, kwaliteit van leven, functioneren, bijwerkingen, totale mortaliteit.
Relevante uitkomstmaten
De werkgroep achtte hart- en vaatziekten, kwaliteit van leven en functioneren voor de besluitvorming kritieke uitkomstmaten; en bijwerkingen en totale mortaliteit voor de besluitvorming belangrijke uitkomstmaten.
Zoeken en selecteren (Methode)
In de databases Medline (via OVID) en Embase (via Embase.com) is met relevante zoektermen gezocht naar systematische reviews, gerandomiseerd gecontroleerde trials en observationeel onderzoek. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 618 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria:
- systematische reviews (gezocht in ten minste twee databases, gedetailleerde zoekstrategie beschikbaar en Risk of Bias beoordeling);
- gerandomiseerde trials van patiënten ouder dan 70 jaar, of patiënten met een gemiddelde leeftijd van 70 jaar of ouder of een subgroep-analyse van patiënten 70 jaar of ouder die een statine of een ander lipidenverlagend medicijn kregen vergeleken met een placebo of geen behandeling.
Op basis van titel en abstract werden in eerste instantie 40 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 37 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording) en drie studies definitief geselecteerd.
Resultaten
Er is één systematische review geïncludeerd die zich focuste op de effectiviteit van een statine bij ouderen zonder hart- en vaatziekten. In deze review waren acht gerandomiseerde gecontroleerde trials opgenomen, waarvan vijf trials voldeden aan de gestelde PICO. Naast deze review werd er één gerandomiseerde trial (beschreven in twee artikelen) gevonden waarin patiënten met hart- en vaatziekten een statine ter secundaire preventie werd gegeven. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidence-tabellen. De beoordeling van de individuele studieopzet (Risk of Bias) is opgenomen in de Risk of Bias tabellen.
Referenties
- ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group. The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial. Major outcomes in moderately hypercholesterolemic, hypertensive patients randomized to pravastatin vs usual care: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT-LLT). JAMA. 2002;288(23):2998-3007. PubMed PMID: 12479764.
- Cannon CP, Blazing MA, Giugliano RP, et al; IMPROVE-IT Investigators. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med. 2015;372(25):2387-97. doi: 10.1056/NEJMoa1410489.
- Collier DJ, Poulter NR, Dahlöf B, et al. Impact of atorvastatin among older and younger patients in the Anglo-Scandinavian Cardiac Outcomes Trial Lipid-Lowering Arm. J Hypertens. 2011;29(3):592-9. doi: 0.1097/HJH.0b013e328342c8f7. PubMed PMID: 21297502.
- Trompet S, van Vliet P, de Craen AJ, et al. Pravastatin and cognitive function in the elderly. Results of the PROSPER study. J Neurol. 2010;257(1):85-90. doi:10.1007/s00415-009-5271-7. PubMed PMID: 19653027.
- Shepherd J, Blauw GJ, Murphy MB, et al. PROspective Study of Pravastatin in the Elderly at Risk. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial.Lancet. 2002;360(9346):1623-30. PubMed PMID: 12457784.
- Stam-Slob MC, Visseren FL, Wouter Jukema J, et al. Personalized absolute benefit of statin treatment for primary or secondary prevention of vascular disease in individual elderly patients. Clin Res Cardiol. 2016. (Epub ahead of print) PMID: 27554244
- Teng M, Lin L, Zhao YJ, et al. Statins for Primary Prevention of Cardiovascular Disease in Elderly Patients: Systematic Review and Meta-Analysis. Drugs Aging. 2015;32(8):649-61. doi: 10.1007/s40266-015-0290-9. Review. PubMed PMID: 26245770.
Evidence tabellen
Ouderen zonder hart- en vaatziekten
|
Study reference |
Study characteristics |
Patient characteristics |
Intervention (I) |
Comparison/ control (C) |
Follow-up |
Outcome measures and effect size |
Comments |
|
Elderly without cardiovascular diseases |
|||||||
|
Teng, 2015 |
SR and meta-analyses of RCT’s and subgroups of RCTs
Literature search up to August 2014
A: ALLHAT, 2002 B: Collier, 2011 C: Bruckert, 2003 D: Glynn, 2010 E: Stephard, 2002
Study design: RCT
Setting and Country: A: US, Puerto Rico, US Virgin Islands and Canada B: UK, Sweden, Norway, Denmark, Finland, Ireland C: France, Italy, Spain, Belgium and Israel D: North America, South America, Europe and Africa E: Scotland, Ireland and The Netherlands
Source of funding: Systematic review: Not sponsored
A: not sponsored by industry B: Sponsored by industry C: Sponsored by industry D: Sponsored by industry E: Sponsored by industry
|
Inclusion criteria SR:
Exclusion criteria SR:
8 studies included, of which 5 had a study sample with a age >70 years
Important patient characteristics at baseline:
N, mean age A: 5809 patients, 72 yrs B: 4445 patients, 71 yrs C: 1229 patients, 75.5 yrs D: 5695 patients, 74 yrs E: 3239 patients, 75 yrs
Sex: A: 52.2% Male B: 81.4% Male C: 25.1% Male D: 48.4% Male E: 41.5% Male
Diabetes: A: 38.3% B: 100% C: 7% D: 0% E: 12.2%
Hypertension A: 100% B: 26.7% C: 55.9% D: 65.6% E: 71.6%
Groups comparable at baseline? Unclear |
A: Pravastatin, 40 mg/day B: Atorvastatin, 10mg/day C: Fluvastatin XL, 80 mg/day D: Rosuvastatin, 20 mg/day E: Pravastatin, 40 mg/day
|
A: placebo or usual care B: placebo or usual care C: placebo or usual care D: placebo or usual care E: placebo or usual care
|
End-point of follow-up: Mean follow-up: A: 4.8 years B: 3.3 years C: 1 years D: 1.9 years E: 3.2 years
For how many participants were no complete outcome data available? (intervention/control) A: Not reported (low Risk of Bias) B: Not reported (low Risk of Bias) C: Not reported (low Risk of Bias) D: Not reported (low Risk of Bias) E: Not reported (low Risk of Bias)
|
Not reported
Not reported
Defined as myalgia A: Not reported B: RR 0.82 (95%CI: 0.58;1.15) C: RR 0.11 (95%CI: 0.01;2.12) D: RR 1.31 (95%CI: 0.29;5.83) E: RR 1.15 (95%CI: 0.71;1.84)
Defined as new onset diabetes A: Not reported B: RR 0.9 (95%CI: 0.64;1.26) C: Not reported D: RR 1.25 (95%CI: 0.91;1.73) E: Not reported
Defined as serious adverse events A: RR 0.88 (95%CI: 0.45;1.73) B: RR 0.96 (95%CI: 0.87;1.06) C: RR 2.05 (95%CI: 0.19;22.54) D: RR 1.04 (95%CI: 0.94;1.15) E: RR 1.01 (95%CI: 0.96;1.06)
Defined as all-cause mortality A: RR 1.01 (95%CI: 0.91;1.13) B: RR 0.97 (95%CI: 0.77;1.22) C: RR 1.02 (95%CI: 0.06; 16.35) D: 0.79 (95%CI: 0.62;1.02) E: 0.98 (95%CI: 0.88;1.04)
Defined as major adverse cardiovascular events (myocardial infarction, stroke, coronary revascularization, cardiac sudden death, angina) A: RR 0.96 (95%CI: 0.89;1.05) B: RR 0.82 (95%CI: 0.73;0.93) C: Not reported D: 0.62 (95%CI: 0.46;0.82) E: 0.94 (95%CI: 0.78;1.14)
Defined as myocardial infarction A: RR 0.81 (95%CI: 0.67;0.99) B: RR 0.63 (95%CI: 0.45;0.89) C: Not reported D: 0.68 (95%CI: 0.45;1.02) E: 0.91 (95%CI: 0.72;1.14)
Defined as stroke A: RR 0.98 (95%CI: 0.79;1.20) B: RR 0.80 (95%CI: 0.58;1.11) C: Not reported D: Not reported E: 1.03 (95%CI: 0.73;1.45)
|
Neil, 2006, Collins, 2003, Nakaya, 2011 were excluded because the age of the study sample was <70 years.
Of the original 8 RCTs included, 2 focussed on elderly, six trials comprised subgroups.
Teng, 2015 judged the overall quality of evidence (8 RCTs) as moderate. A was open labelled, B, C, D and E were sponsored by the industry.
|
- Research question (PICO) and inclusion criteria should be appropriate and predefined
- Search period and strategy should be described; at least Medline searched; for pharmacological questions at least Medline + EMBASE searched
- Potentially relevant studies that are excluded at final selection (after reading the full text) should be referenced with reasons
- Characteristics of individual studies relevant to research question (PICO), including potential confounders, should be reported
- Results should be adequately controlled for potential confounders by multivariate analysis (not applicable for RCTs)
- Quality of individual studies should be assessed using a quality scoring tool or checklist (Jadad score, Newcastle-Ottawa scale, Risk of Bias table etc.)
- Clinical and statistical heterogeneity should be assessed; clinical: enough similarities in patient characteristics, intervention and definition of outcome measure to allow pooling? For pooled data: assessment of statistical heterogeneity using appropriate statistical tests (e.g. Chi-square, I2)?
- An assessment of publication bias should include a combination of graphical aids (e.g., funnel plot, other available tests) and/or statistical tests (e.g., Egger regression test, Hedges-Olken). Note: If no test values or funnel plot included, score “no”. Score “yes” if mentions that publication bias could not be assessed because there were fewer than 10 included studies.
- Sources of support (including commercial co-authorship) should be reported in both the systematic review and the included studies. Note: To get a “yes,” source of funding or support must be indicated for the systematic review AND for each of the included studies.
|
Study
First author, year |
Appropriate and clearly focused question?1
Yes/no/unclear |
Comprehensive and systematic literature search?2
Yes/no/unclear |
Description of included and excluded studies?3
Yes/no/unclear |
Description of relevant characteristics of included studies?4
Yes/no/unclear |
Appropriate adjustment for potential confounders in observational studies?5
Yes/no/unclear/notapplicable |
Assessment of scientific quality of included studies?6
Yes/no/unclear |
Enough similarities between studies to make combining them reasonable?7
Yes/no/unclear |
Potential risk of publication bias taken into account?8
Yes/no/unclear |
Potential conflicts of interest reported?9
Yes/no/unclear |
|
Teng, 2015 |
Yes |
No |
No |
No, some of the data could not be retrieved |
Not appliciable |
Yes |
Yes |
No |
yes |
Ouderen met hart- en vaatziekten
|
Study reference |
Study characteristics |
Patient characteristics 2 |
Intervention (I) |
Comparison/ control (C) 3 |
Follow-up |
Outcome measures and effect size 4 |
Comments |
|
Elderly with cardiovascular diseases |
|||||||
|
Shepherd, 2002 Trompet, 2010 |
Type of study: RCT
Setting: multicenter
Country: Scotland, Ireland and The Netherlands
Source of funding: Industry sponsored |
Inclusion criteria:
Exclusion criteria:
N total at baseline: Intervention: 1306 Control:1259
Important prognostic factors: Data only reported for the complete cohort (primary and secondary prevention combined)
Groups comparable at baseline? Unknown
|
Pravastatin 40mg/day
|
Placebo |
Length of follow-up: Shepherd, 2002: 3.2 years (range 2.8 to 4.0 years) Trompet, 2010: mean 42 months (range 36 to 48 months)
Loss-to-follow-up: Not specified for patients with previous vascular disease.
Incomplete outcome data: Likely all patients analysed.
|
Not reported
Determined using the Mini-Mental State Examination (MMSE). Analyses were adjusted for age, educational status, country and when appropriate for sex and version of the test. Four tests were included: 1. Attention (Executive functioning, Stroop-Colour-Word-test) Est 0.36 (95%CI=-0.02;0.74)
2. Processing Speed (Executive functioning, Letter-Digit Coding Test) Est -0.02 (95%CI=-0.08;0.09)
3. Immediate recal (Memory, 15-Picture Learning test) Est 0.002 (95%CI=-0.03;0.04)
4. Delayed recal (Memory, 15-Picture Learning test) Est 0.04 (95%CI=-0.01;0.09)
Not reported separately for subgroup of patients with previous vascular disease.
Not reported separately for subgroup of patients with previous vascular disease.
Defined as definite or suspect death from coronary heart disease, non-fatal myocardial infarction, and fatal or non-fatal stroke I: 227 (17,4%) C: 273 (21.7%) HR 0.78 (95%CI=0.66;0.93) |
408 patients of the entire cohort (primary and secondary prevention), 277 control patients and 131 patients from the intervention group used non-study statin therapy.
Here, we report only the results of the subgroup analyses that included patients with stable angina, intermittend claudication, stroke, transient ischeamic attack, myocardial infarction, arterial surgery or amputation for vascular disease more than 6 months before study entry.
|
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures
- Provide data per treatment group on the most important prognostic factors ((potential) confounders)
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Shepherd, 2002 Trompet, 2015 |
“Sequence was generated with a computerised pseudorandom number generator and consisted of balanced blocks of size four” |
Unlikely |
Unlikely |
unlikely |
unlikely |
Unlikely |
Unclear |
Unlikely |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignment influences the process of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the Risk of Bias is unclear
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the Risk of Bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-01-2017
Laatst geautoriseerd : 01-01-2017
Geplande herbeoordeling : 01-01-2021
Uiterlijk in 2020 bepalen het bestuur van het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie of de modules van deze richtlijn nog actueel zijn. Bij het opstellen van de richtlijn heeft de werkgroep per module een inschatting gemaakt van de maximale termijn waarop herbeoordeling moet plaatsvinden en eventuele aandachtspunten geformuleerd die van belang zijn bij een toekomstige herziening. De geldigheid van de richtlijn komt eerder te vervallen indien nieuwe ontwikkelingen aanleiding zijn een herzieningstraject te starten.
Het Nederlands Huisartsen Genootschap, de Nederlandse Internisten Vereniging en de Nederlandse Vereniging voor Cardiologie zijn regiehouder van deze richtlijn en eerstverantwoordelijke op het gebied van de actualiteitsbeoordeling van de richtlijn. De andere aan deze richtlijn deelnemende wetenschappelijke verenigingen of gebruikers van de richtlijn delen de verantwoordelijkheid en informeren de regiehouder over relevante ontwikkelingen binnen hun vakgebied.
Algemene gegevens
De richtlijnontwikkeling werd ondersteund door het Nederlands Huisartsen Genootschape en het Kennisinstituut van de Federatie Medisch Specialisten (www.kennisinstituut.nl) en werd gefinancierd door het Nederlands Huisartsen Genootschap en de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS).
Doel en doelgroep
Doel
Het doel van deze multidisciplinaire richtlijn is het optimaliseren van de preventie van hart- en vaatziekten met specifieke focus op individuen met een verhoogd risico op hart- en vaatziekten.
Doelgroep
Deze multidisciplinaire richtlijn is geschreven voor alle zorgverleners die betrokken zijn bij cardiovasculair risicomanagement
Samenstelling werkgroep
In 2016 is een multidisciplinaire werkgroep ingesteld, bestaand uit vertegenwoordigers van alle relevante specialismen die betrokken zijn bij de preventie van hart- en vaatziekten.
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
Werkgroep
- Prof. dr. A.W. (Arno) Hoes, klinisch epidemioloog, werkzaam in het Julius Centrum van het UMC Utrecht te Utrecht (voorzitter)
- Dr.ir. I. (Ineke) van Dis, epidemioloog en voedingswetenschapper, werkzaam bij de Hartstichting te Den Haag, Hartstichting
- Y.A. (Yvette) Henstra, verpleegkundig specialist vasculaire geneeskunde, werkzaam in het OVLG te Amsterdam, NVHVV
- Dr. H.M. (Heleen) den Hertog, neuroloog, werkzaam in het Isala Ziekenhuis te Zwolle, NVN
- Dr. K. (Karen) Konings, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk K. Konings te Maastricht, NHG
- H. (Hans) van Laarhoven, manager team collectieve belangenbehartiging, werkzaam bij Hartenraad te Den Haag, Harteraad
- Dr. A.H. (AnHo) Liem, cardioloog, werkzaam in het Franciscus Gasthuis & Vlietland te Rotterdam, NVVC
- Dr. F.M.A.C. (Fabrice) Martens, cardioloog, werkzaam in het Deventer Ziekenhuis te Deventer, NVVC
- Prof. dr. Y.M. (Yvo) Smulders, internist-vasculair geneeskundige, werkzaam in het Amsterdam UMC, locatie VUmc te Amsterdam, NIV
- Drs. A. (Anne-Margreet) Strijbis, relatiemanager zorg, werkzaam bij Harteraad te Den Haag, Harteraad
- Drs. J.J.S. (Judith) Tjin-A-Ton, kaderhuisarts hart- en vaatziekten, werkzaam in huisartsenpraktijk Frakking & Tjin-A-Ton te Amstelveen, NHG
- Prof. dr. F.L.J. (Frank) Visseren, internist-vasculair geneeskundige, werkzaam in het UMC Utrecht te Utrecht, NIV
Met ondersteuning van:
- G.M. (Maike) van Leeuwen, beleid- en projectondersteuner, NIV
- Dr. Tj. (Tjerk) Wiersma, senior-wetenschappelijk medewerker, NHG
- Dr. W. (Wouter) de Ruijter, wetenschappelijk medewerker, NHG tot augustus 2017
- Drs. M. (Martijn) Sijbom, wetenschappelijk medewerker, NHG vanaf augustus 2017
- Dr. I.M. (Iris) Wichers, wetenschappelijk medewerker, NHG
- Dr. B.H. (Bernardine) Stegeman, senior adviseur, Kennisinstituut van FMS
- Dr. J. (Janneke) Hoogervorst-Schilp, adviseur, Kennisinstituut van FMS tot april 2018
- Dr. A. (Aleid) Wirix, adviseur, Kennisinstituut van FMS vanaf april 2018
- N.F. (Natalia) Bullock, projectsecretaresse, Kennisinstituut van FMS tot januari 2018
- J. (Jill) Heij, junior projectsecretaresse, Kennisinstituut van FMS vanaf februari 2018
Belangenverklaringen
De KNMG-code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of ze in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoek financiering) of indirecte belangen (persoonlijke relaties, reputatiemanagement, kennisvalorisatie) hebben gehad. Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
Hoes (voorzitter) |
|
|
- |
Geen |
|
Konings |
Kaderhuisarts hart- en vaatziekten |
- |
- |
Geen |
|
Tjin-A-Ton |
Kaderhuisarts hart- en vaatziekten |
|
- |
Geen |
|
Visseren |
|
|
Deelname aan fase II en II multicenter trials oer PSCK9-antilichamen. Betrokken bij patiënteninclusie, geen data-analyse |
Geen |
|
Smulders |
|
|
- |
Geen |
|
Liem |
|
|
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Martens |
Cardioloog |
Bestuurslid Werkgroep Cardiologische centra Nederland (WCN) |
Advies aan universiteiten en industrie over dyslipidemie en lipidenverlaende middelen |
Geen actie; advies over alle middelen |
|
Den Hertog |
Neuroloog |
|
- |
Geen |
|
Henstra |
Verpleegkundig Specialist Vasculaire geneeskunde |
- |
Advies aan industrie lancering nieuwe medicatie bij FH |
Geen; valt buiten het bestek van de richtlijn |
|
Strijbis |
Relatiemanager Hartenraad |
Werkgroeplid Hypertensie in de tweede en derde lijn |
- |
Geen |
|
Van Laarhoven |
|
Werkgroeplid (erfelijke) dyslipidemie in de tweede en derde lijn |
- |
Geen |
|
Van Dis |
|
Lid van de werkgroep Voeding van de European Heart Network |
Hartstichting heeft een samenwerkingscontract met Unilever |
Geen |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door afgevaardiging van de patiëntenvereniging in de werkgroep. De conceptrichtlijn is tevens voor commentaar voorgelegd aan Hartenraad en Hartstichting.
Methode ontwikkeling
Evidence based
Implementatie
In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn (module) en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren. Het implementatieplan is te vinden bij de aanverwante producten. CVRM-indicatoren zijn separaat aan de herziening van deze richtlijn ontwikkeld en te vinden op https://www.nhg.org/themas/publicaties/download-indicatoren-archief.
Werkwijze
AGREE
Deze richtlijn is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010), dat een internationaal breed geaccepteerd instrument is. Voor een stapsgewijze beschrijving hoe een evidence-based richtlijn tot stand komt wordt verwezen naar het stappenplan Ontwikkeling van Medisch Specialistische Richtlijnen van het Kennisinstituut van de Federatie Medisch Specialisten.
Knelpuntenanalyse
Tijdens de voorbereidende fase inventariseerden de voorzitter van de werkgroep en de adviseur de knelpunten. Voor het herzien van de Nederlandse multidisciplinaire richtlijn CVRM heeft de werkgroep besloten uit te gaan van de Europese richtlijn Cardiovascular disease prevention in clinical practice uit 2016. Deze richtlijn was op het moment van starten de meest recente richtlijn met de meest recente evidence. De werkgroep beoordeelde de aanbevelingen uit de eerder genoemde richtlijn op noodzaak tot revisie. Tevens zijn er knelpunten aangedragen tijdens een Invitational conference door Diabetesvereniging Nederland, IGZ, FMCC, Hartenraad (voorheen De Hart&Vaatgroep), KNGF, KNMP, NHG, NVAB, NVALT, NVR, NVVC, Verenso en InEen. De werkgroep stelde vervolgens een lijst met knelpunten op en prioriteerde de knelpunten op basis van: (1) klinische relevantie, (2) de beschikbaarheid van (nieuwe) evidence van hoge kwaliteit, en (3) de te verwachten impact op de kwaliteit van zorg, patiëntveiligheid en (macro)kosten.
Uitgangsvragen en uitkomstmaten
Op basis van de uitkomsten van de knelpuntenanalyse hebben de voorzitter en de ondersteuners concept-uitgangsvragen opgesteld. Deze zijn met de werkgroep besproken waarna de werkgroep de definitieve uitgangsvragen heeft vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming over aanbevelingen, als kritiek, belangrijk (maar niet kritiek) en onbelangrijk. Tevens definieerde de werkgroep in ieder geval voor de kritieke uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Strategie voor zoeken en selecteren van literatuur
Er werd voor de afzonderlijke uitgangsvragen aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke onderzoeken in (verschillende) elektronische databases. Tevens werd aanvullend gezocht naar onderzoeken aan de hand van de literatuurlijsten van de geselecteerde artikelen. In eerste instantie werd gezocht naar onderzoeken met de hoogste mate van bewijs. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria. Deze geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekstrategie en de gehanteerde selectiecriteria zijn te vinden in de module met de desbetreffende uitgangsvraag. De zoekstrategie voor de oriënterende zoekactie en patiënte perspectief zijn opgenomen onder aanverwante producten.
Kwaliteitsbeoordeling individuele onderzoeken
Individuele onderzoeken werden systematisch beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende onderzoeksresultaten (Risk of Bias) te kunnen inschatten. Deze beoordelingen kunt u vinden in de ‘Risk of Bias’ (RoB) tabellen. De gebruikte RoB instrumenten zijn gevalideerde instrumenten die worden aanbevolen door de Cochrane Collaboration: AMSTAR – voor systematische reviews; Cochrane – voor gerandomiseerd gecontroleerd onderzoek; Newcastle-Ottawa – voor observationeel onderzoek; QUADAS II – voor diagnostisch onderzoek.
Samenvatten van de literatuur
De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidence-tabellen. De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur. Bij een voldoende aantal onderzoeken en overeenkomstigheid (homogeniteit) tussen de onderzoeken werden de gegevens ook kwantitatief samengevat (meta-analyse) met behulp van Review Manager 5.
Beoordelen van de kracht van het wetenschappelijke bewijs
A) Voor interventievragen (vragen over therapie of screening)
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor Grading Recommendations Assessment, Development and Evaluation (zie http://www.gradeworkinggroup.org/).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie (Schünemann, 2013).
|
GRADE |
Definitie |
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
B) Voor vragen over diagnostische tests, schade of bijwerkingen, etiologie en prognose
De kracht van het wetenschappelijke bewijs werd eveneens bepaald volgens de GRADE-methode: GRADE-diagnostiek voor diagnostische vragen (Schünemann, 2008) en een generieke GRADE-methode voor vragen over schade of bijwerkingen, etiologie en prognose. In de gehanteerde generieke GRADE-methode werden de basisprincipes van de GRADE-methodiek toegepast: het benoemen en prioriteren van de klinisch (patiënt)relevante uitkomstmaten, een systematische review per uitkomstmaat en een beoordeling van bewijskracht op basis van de vijf GRADE-criteria (startpunt hoog; downgraden voor Risk of Bias, inconsistentie, indirectheid, imprecisie, en publicatiebias).
Formuleren van de conclusies
Voor elke relevante uitkomstmaat werd het wetenschappelijk bewijs samengevat in een of meerdere literatuurconclusies waarbij het niveau van bewijs werd bepaald volgens de GRADE-methodiek. De werkgroepleden maakten de balans op van elke interventie. Bij het opmaken van de balans werden de gunstige en ongunstige effecten voor de patiënt afgewogen. De uiteindelijke bewijskracht wordt bepaald door de laagste bewijskracht gevonden bij een van de kritieke uitkomstmaten. Bij complexe besluitvorming waarin naast de conclusies uit de systematische literatuuranalyse vele aanvullende argumenten (overwegingen) een rol spelen, werd afgezien van een overkoepelende conclusie. In dat geval werden de gunstige en ongunstige effecten van de interventies samen met alle aanvullende argumenten gewogen onder het kopje Overwegingen.
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling worden naast (de kwaliteit van) het wetenschappelijke bewijs ook andere belangrijke aspecten meegewogen, zoals de waarden en voorkeuren van de patiënt (patient values and preferences), kosten, beschikbaarheid van voorzieningen en organisatorische zaken. Deze aspecten worden, voor zover geen onderdeel van de literatuursamenvatting, vermeld en beoordeeld (gewogen) onder het kopje Overwegingen.
Formuleren van aanbevelingen
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat de werkgroep toekent aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen.
Randvoorwaarden (organisatie van zorg)
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken deel uit van de overwegingen bij de bewuste uitgangsvraag. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Kennislacunes
Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is om de uitgangsvraag te kunnen beantwoorden.
Commentaar- en autorisatiefase
De conceptrichtlijn werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en heeft de werkgroep de richtlijn definitief vastgesteld. De definitieve richtlijn werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
